Projekt HARDROCK: parametrický sběr a analýza dat pacientů s nádory hlavy a krku na Klinice onkologické FN Ostrava – důraz na význam frakcionace a definice cílového objemu v radioterapii
HARDROCK Project: Parametric Data Collection and Analysis of Patients with Head and Neck Cancer in the Comprehensive Cancer Centre of Ostrava – Role of Fractionation and Target Volume Definition in Radiotherapy
Background:
The HARDROCK project has been designed as a retrospective data collection study in a locally run database system, which fulfils the requirements on the basic version of electronic medical records of cancer patients. The diagnostic category of head and neck tumors has been selected on purpose, as it presents a major problem in the Comprehensive Cancer Centre of Ostrava, and it is relevant given the high incidence and mortality in the Moravian-Silesian Region. The target parameters of the assessment include short-term as well as long-term treatment results in patients with head and neck tumors, evaluated with standard indicators of treatment response and survival. A special emphasis is put on major treatment modalities, i.e. surgery and radiation therapy, and on related complications.
Patients and Methods:
In this article, we present a sample of collected data. The data from patients has been separated into two groups based on the time of their acquisition: data from patients treated in 2004–2005 versus patients treated in 2006–2010. This division was given by the change of treatment protocols in 2006 introducing accelerated radiotherapy with concomitant boost and expanded lymph node irradiation field compared to normofractionation and hyperfractionation regimes used before 2006.
Results:
Introduction of new irradiation techniques did not increase the rate of acute toxicity but slightly increased late toxicity. Further, we found a decrease of number of relapse and improved overall survival in patients with stage IV disease treated in 2006–2010.
Conclusion:
The project results will contribute methodically to the exact evaluation of diagnostics and treatment of patients with head and neck cancer and will help to optimize their medical care.
Key words:
head and neck cancer – radiotherapy – population register
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
18. 1. 2012
Accepted:
10. 4. 2012
Authors:
M. Halámka 1; D. Feltl 1; J. Cvek 1; L. Dušek 2
Authors‘ workplace:
Klinika onkologická, FN Ostrava
1; Institut biostatistiky a analýz, Masarykova univerzita Brno
2
Published in:
Klin Onkol 2012; 25(4): 274-281
Category:
Original Articles
Overview
Východiska:
Projekt HARDROCK je koncipován jako retrospektivní sběr klinických dat v lokálně provozovaném databázovém systému, který splňuje požadavky na základní verzi elektronické zdravotnické dokumentace onkologického pacienta. Diagnostická skupina nádorů ORL byla vybrána cíleně, neboť představuje velkou zátěž pro Onkologické centrum v Ostravě a její sledování je také aktuální s ohledem na poměrně vysokou incidenci a mortalitu v Moravskoslezském kraji. Cílovými parametry hodnocení jsou krátkodobé i dlouhodobé výsledky léčby pacientů s nádory hlavy a krku hodnocené standardními ukazateli dosažené léčebné odpovědi a přežití. Zvláštní důraz je kladen na hlavní léčebné modality, tedy chirurgii a radioterapii, a na komplikace, které jsou s nimi spojeny.
Soubor pacientů a metody:
V tomto článku prezentujeme malou část výsledků získaných z dat z registru HARDROCK. Data byla rozdělena do dvou skupin podle doby léčby pacientů: data získána od pacientů léčených v letech 2004–2005 a data z let 2006–2010. Toto rozdělení bylo dáno změnou organizace pracoviště a protokolů léčby. V roce 2006 bylo do standardních postupů zavedeno ozáření v akcelerovaném režimu s využitím konkominantního boostu a dále byly do ozařovacího pole zahrnuty další oblasti lymfatických uzlin (zadní krční uzliny, nadklíčky). Oproti tomu před rokem 2006 byli pacienti ozařováni téměř výhradně v režimu normofrakcionace a hyperfrakcionace.
Výsledky:
Prezentujeme zde, že nové ozařovací techniky nezvyšují podíl časné toxicity, mírně zvyšují počet pacientů s pozdní toxicitou nízkého stupně. Důležitým zjištěním bylo, že u pacientů s onemocněním ve IV. stadiu léčených v letech 2006–2010 došlo ke snížení výskytu relapsů onemocnění a zlepšení celkového přežití.
Závěr:
Výsledky projektu metodicky přispějí k exaktnímu hodnocení diagnostiky a léčby pacientů s touto chorobou a napomohou optimalizaci léčebné péče.
Klíčová slova:
nádory hlavy a krku – radioterapie – populační registr
Úvod
Zhoubné nádory otorinolaryngologické a stomatologické oblasti zahrnují malignity dutiny nosní, nazofaryngu, rtů, dutiny ústní, slinných žláz, nádory hltanu a hrtanu. V radioterapeutické terminologii se označují jako tzv. HaN nádory („nádory hlavy a krku“).
Vznik dlaždicobuněčných nádorů HaN je tzv. multifaktoriální. V Evropě a Severní Americe je často nacházena souvislost s chronickým drážděním sliznic při abúzu alkoholu a s kouřením tabákových výrobků. Riziko se zvyšuje při současné kombinaci těchto dvou faktorů – předpokladem je snížená detoxikační schopnost jater a lepší vstřebávání kancerogenů tabákových derivátů v alkoholu [1,2].
Asi u 25–50 % tumorů HaN (nejčastěji těch, které zahrnují postižení tonzil, orofaryngu a dutiny ústní) se při vyšetření bioptických vzorků nacházejí onkogenní varianty HPV (human papiloma virus), které se integrují do buněčného genetického materiálu a spouštějí mutace v buněčném genomu. Jedná se o papilomaviry HPV 2, HPV 11 a nejvýznamněji HPV 16 [2–4]. Výskyt dlaždicobuněčných karcinomů v souvislosti s infekcí HPV je častější u mladších skupin pacientů (v průměru o 3–4 roky oproti pacientům bez pozitivity HPV), dále u bělošské populace – u této skupiny pacientů jsou pozorovány pokročilejší lokoregionální nálezy [5].
Dalšími faktory přispívajícími k výskytu tumorů jsou chronické mechanické dráždění v dutině ústní například špatně nasedajícími zubními náhradami, poškozenými zuby či iritace chronickými infekcemi [2]. Nespecificky se na vzniku nádorů podílí imunodeficience, avitaminózy a malnutrice, které jsou vzhledem ke stravovacím návykům a abúzu u této skupiny pacientů časté [1].
Data zaznamenávající výskyt nádorů v České republice jsou velmi dobře dokumentována díky Národnímu onkologickému registru a dále zveřejňována v publikacích Ústavu zdravotnických informací a statistiky [6]. Systematický sběr dat dovoluje mít přehled o incidenci a mortalitě nádorů. Incidence (výskyt) všech novotvarů v České republice meziročně mírně stoupá, naopak mortalita (úmrtnost) meziročně klesá. Příčiny stoupající incidence v ČR nejsou zcela objasněny. Jednou z příčin je genofond populace a neoptimální životní styl zahrnující nevhodné dietní, pohybové či jiné návyky, dále profesionální expozice rizikům. Dalším faktorem, který sice nezvyšuje incidenci nádorů sensu stricto, nicméně projevuje se takto statisticky, je výrazně zlepšená diagnostika, která detekuje větší množství nádorových onemocnění, která by v minulosti vůbec diagnostikována nebyla. Klesající mortalita je dána několika faktory. Jedním z hlavních faktorů je časná detekce nepokročilých stadií onemocnění (tzv. časných) především díky osvětě a screeningovým programům. Právě díky zlepšujícímu se odhalování nádorů je možné nasazení účinné onkologické terapie již v léčbě časných stadií onemocnění. Dalším faktorem příznivě ovlivňujícím mortalitu je výrazně se zlepšující onkologická terapie díky výraznému rozvoji všech jejích modalit a zlepšující se podpůrné léčbě.
Léčba nádorů hlavy a krku se odvíjí od stadia pokročilosti onemocnění v době stanovení diagnózy. Právě stadium onemocnění, resekabilita či neresekabilita tumoru, uzlinové postižení a celkový stav pacienta předurčují léčebnou strategii. Často se jedná o multimodální terapii, s individuálním načasováním jednotlivých léčebných modalit. Každého pacienta je nutno posuzovat individuálně v rámci mezioborové spolupráce a doporučit individuální postup, který vychází nejen z určení stadia onemocnění dle TNM (tumour-node-metastasis) klasifikace, z celkového stavu pacienta (KI, WHO PS), z národních či mezinárodních doporučených postupů, ale v neposlední řadě i z preference pacienta.
Onemocnění ve stadiu I a II jsou lokalizovaná a ohraničená daným orgánem či anatomickou oblastí (tzv. časná stadia). Velmi obecně lze říci, že terapií 1. volby v těchto případech bývá léčba chirurgická, která je u těchto stadií onemocnění řešením radikálním. V některých případech operace zajišťující dostatečnou radikalitu může působit zbytečnou mutilaci či ztrátu funkce orgánu/funkční oblasti. Často lze volit i radioterapii jakožto léčbu 1. volby a v těchto stadiích onemocnění mohou obě tyto modality terapie zajistit rovnocenné výsledky léčby [2,7].
U pokročilých stadií onemocnění, stadia III nebo IV, je situace složitější. Zde stomatochirurgové a otorinolaryngologové musejí rozhodnout, zda a za jakých okolností je u daného pacienta možná resekce tumoru, spádových lymfatik a bezpečnostních lemů okolních tkání. Kritéria resekability nejsou arbitrárně stanovena a jsou závislá nejen na rozsahu onemocnění u daného pacienta, jeho perioperativních zdravotních rizicích, ale také na zkušenostech daného centra, schopnostech operatérů a technickém zázemí pracovišť [7]. Koncept, kdy u resekabilních onemocnění byla vždy prováděna chirurgická resekce s následným pooperačním ozářením, je postupně opouštěn. Čím dále častěji je i u pokročilých stadií onemocnění zařazována předoperační radioterapie či primárně kurativní radioterapie s ponecháním operace jako záchranného výkonu při selhání léčby (tzv. salvage). V různých anatomických lokalizacích je zkoumán přínos toho či onoho přístupu a jsou identifikovány rizikové a prognostické faktory, které by mohly posloužit jako vodítko při rozhodování o strategii léčby [2]. Tam, kde je onemocnění primárně hodnoceno jako neresekabilní, je základem léčby radioterapie. Ke zlepšení výsledků terapie je při kurativním záměru léčby zařazována potenciační chemoterapie, recentně na základě studia nitro-buněčných drah také tzv. biologická terapie [8,9] nebo alternativní (optimalizovaná) schémata radioterapie – akcelerace, hyperfrakcionace [10–12].
Využití hyperfrakcionované radioterapie při ozařování nádorů HaN je založeno na radiobiologických propočtech dle lineárně kvadratického modelu (LQ). Hyperfrakcionace dovoluje ozáření cílového objemu vysokou dávkou záření bez navýšení pozdní toxicity okolních zdravých tkání. Např. 6týdenní režim konkomitantní radioterapie využívá faktoru navýšení dávky na den a časového faktoru akcelerace. Parametry výpočtu jsou: celková dávka 72 Gray v 6 týdnech, jednotlivé frakce 30 × 1,8 Gy a současně 12 × 1,5 Gy v posledních 2,5 týdnech radioterapie, tj. 54 Gy dopolední dávky, 18 Gy odpolední dávky, α/β poměr pro nádory hlavy a krku = 10, α/β poměr pro pozdní následky na podkoží = 2, faktor zkrácení radioterapie o 1 den ozařování = 0,8 Gy. Po výpočtu dle LQ modelu dojde oproti normofrakcionaci k navýšení dávky na ozařovaný tumor o 4,53 Gy, zatímco pokud se týče pozdních následků radioterapie na zdravé tkáně, je vypočítán pokles dávky o 2 Gy. Podrobné výpočty i tabulky parametrů k výpočtu jsou prezentovány v příručce radiobiologie [13]. Retrospektivní klinická srovnání prokázala, že hyperfrakcionovaná akcelerovaná radioterapie poskytuje zlepšení lokoregionální kontroly ve srovnání s normofrakcionací [10]. Obdobné výsledky přinesla i meta-analýza zaměřená na celkové přežití zahrnující různá hyperfrakcionační a akcelerační schémata [11].
Nádory HaN mají v Moravskoslezském kraji oproti jiným regionům ČR vysokou incidenci i mortalitu. Na Klinice onkologické Fakultní nemocnice Ostrava byl proto proveden parametrický sběr dat k identifikaci prognostických faktorů, rizik, léčebných postupů a léčebných výsledků (registr HARDROCK – HEAD AND NECK CANCER: ASSESMENT OF RISK FACTORS, STAGE DISTRIBUTION, RADIOTHERAPY OPTIMIZATION, CAUSES OF RELAPSE – KEYPOINTS). Cílovými parametry hodnocení byly krátkodobé i dlouhodobé výsledky léčby pacientů s nádory HaN hodnocené standardními ukazateli dosažené léčebné odpovědi a přežití. Zvláštní důraz v hodnocení sebraných dat byl kladen na hlavní léčebné modality, chirurgii a radioterapii, na techniky iradiace a dále na komplikace, které jsou s nimi spojeny. Prezentace projektu je veřejně přístupná na stránkách http://hardrock.registry.cz [14].
Soubor pacientů registru HARDROCK
Sběr dat byl proveden retrospektivně z období od 10/2004–06/2010, celkem bylo hodnoceno 774 pacientů. U 4 pacientů nebylo možno zpětně dohledat základní údaje, a tito 4 pacienti nebyli tedy do prezentovaných analýz zahrnuti. Ročně bylo ve spádovém regionu FN Ostrava 148 až 167 pacientů s nádory hlavy a krku. V roce 2006 došlo ke změně organizace pracoviště Kliniky onkologické Fakultní nemocnice v Ostravě, byly zavedeny nové metodiky léčby a sledování pacientů, a proto veškeré analýzy a srovnávání byly rozděleny do dvou skupin:
- a) období 10/2004–12/2005 (163 pa-cientů),
- b) období 01/2006–06/2010 (611 pa-cientů).
Výsledky analýz parametrických dat byly tedy prováděny v rámci těchto 2 skupin a následně byly výstupy srovnávány.
Demografie pacientů
Mezi pacienty je výrazně vyšší zastoupení mužů (80,6 %) než žen (19,4 %). Střední věk mužů při diagnóze je 58 let, žen 62 let.
Anatomická distribuce malignit
K nejčetnějším diagnózám patřily novotvary rtu a dutiny ústní – 30 % (z toho ústní spodiny – 10,9 %), hrtanu – 24,5 %, hltanu – 33,5 % (z toho tonzily 14,1 %). K minoritním nádorům patřily nádory slinných žláz – 4,7 %, nádory nosohltanu – 2,8 %, nádory dutiny nosní a paranazálních dutin – 2,1 %. U 2,5 % se jednalo o sekundární či neurčené zhoubné nádory (graf 1).

Zastoupení žen u nádorů rtu a dutiny ústní bylo 25 %, u nádorů hltanu 18 % a u nádorů hrtanu 8 %. Podíl žen u nádorů hrtanu je ve srovnání s oběma dalšími početnými skupinami statisticky významně nižší (Fisher exact test, p < 0,05).
TNM, stadium
V době zjištění malignity byla většina tumorů v lokálně pokročilém stadiu, 43 % tumorů bylo ve stadiu hodnoceném jako T4, 21 % jako T3, pouze 33 % nádorů bylo lokálně nepokročilých – T1 či T2 (graf 2) (u 4 % nálezů nebyl rozsah tumoru definován). Podíl pokročilých a nepokročilých stadií lokálního nálezu tumoru u jednotlivých anatomických lokalit se samozřejmě lišil, např. u nádorů dásní, spodiny ústní, orofaryngu či hypofaryngu přesáhl počet T4 onemocnění 60 %, u nádorů rtů většina onemocnění byla ve stadiu T1 či T2.

Analýza byla provedena i ve vztahu k postižení regionálních lymfatických uzlin (graf 3). U 33 % nádorů hlavy a krku nebyly zaznamenány lokální metastázy do mízních uzlin (N0). U některých diagnóz, jako karcinom hrtanu, paranazálních dutin či slinných žláz, byl podíl N0 až 50 i více procent. Celkově v našem souboru pacientů s nádory hlavy a krku 16 % pacientů mělo uzlinové postižení v rozsahu N1, 41 % pacientů v rozsahu N2 a 8 % v rozsahu N3.

Je obecně známo, že nádory hlavy a krku zakládají vzdálené metastázy pozdně. Analýza z registru HARDROCK ukázala, že v celém souboru pacientů je výskyt metastáz v době diagnózy kolem 5 %. Toto platí pro nádory rtů, hltanu, nosohltanu, hrtanu. U nádorů slinných žláz a dutiny nosní a paranazálních dutin bylo toto procento vyšší.
Ve stadiu IV je diagnostikována většina nádorů hlavy a krku (63 %). Podíl prognosticky výrazně příznivějších stadií I a II činil jen 17 %, lokálně pokročilých nádorů ve stadiu III bylo diagnostikováno také 17 %. Rozložení stadií onemocnění v populaci mužů či žen se neliší. Vzhledem k primárnímu účelu registru (srovnávání úspěšnosti různých léčebných postupů) nás zajímalo, zda skladba pacientů před rokem 2005 a po roce 2005 byla jiná. Ukázalo se, že co se týče stadií onemocnění, byly tyto soubory srovnatelné.
Klinický stav pacientů
Klinický stav pacientů a především jejich výživový status je jedním z faktorů ovlivňujících toleranci léčby a tímto i prognózu pacientů. Do parametrického sledování jsme zahrnuli parametr KI (Karnofsky performance status index), BMI (body mass index) a váhový pokles o více než 10 % v posledním půlroce před stanovením diagnózy. Zjistili jsme, že 35 % pacientů s nádorem hlavy a krku mělo před zahájením léčby KI 90 a více procent (jsou tedy samostatně aktivní), ve stavu vyžadujícím cizí pomoc (KI 60–50 %) bylo 8 % pacientů. 26 % pacientů s nádory hlavy a krku zaznamenalo před zahájením léčby významný váhový úbytek. Mezi ženami a muži nebyl v těchto kategoriích statisticky významný rozdíl. Zajímavým zjištěním však bylo, že mezi pacienty diagnostikovanými v letech 2004–2005 a pacienty z let 2006–2010 byl statisticky významný rozdíl v kategoriích KI i váhového úbytku. Podíl pacientů s hodnotami KI 90 a více procent v letech před 2005 a po tomto roce je 23 % oproti 39 %. Stejně tak podíl pacientů s váhovým úbytkem 10 a více procent při stejném časovém rozložení je 33 % u pacientů z let 2004–2005 oproti 24 % u pacientů z let 2006–2010. Z uvedeného vyplývá, že pacienti z let 2004–2005 byli před léčbou celkově v horším stavu než pacienti z let 2006–2010. Střední hodnota BMI pacientů s nádory hlavy a krku je 23,4 kg/m2. Mezi jednotlivými skupinami diagnóz je statisticky významný rozdíl, nejvyšší hodnoty byly zjištěny u pacientů s nádorem nosohltanu a slinných žláz, nejnižší pak u nádorů rtu a dutiny ústní. Mezi ženami a muži opět nebyl nalezen statisticky významný rozdíl. A stejně tak jako u KI je i u BMI významně vyšší statisticky významný rozdíl u pacientů z let 2006––2010 (Mann-Whitney test, p = 0,027).
Rizikové faktory
Samozřejmě že ve sběru dat a jejich analýze jsme se pokusili identifikovat rizikové faktory vzniku onemocnění. Většina pacientů s nádorem hlavy a krku byla aktivními nebo bývalými kuřáky, celkem 85 %. Zastoupení aktivních nebo bývalých kuřáků se statisticky nelišilo mezi obdobími stanovení diagnózy, nicméně podíl aktivních kuřáků byl v období 2006–2010 lehce nižší (64 % proti 67 %). U žen bylo oproti mužům statisticky významně nižší zastoupení aktivních nebo bývalých kuřáků, 66 % u žen oproti 89 % u mužů. U hlavních diagnostických skupin nádorů (nádory rtů, dutiny ústní, hltanu, hrtanu) bylo zastoupení aktivních a bývalých kuřáků 85–89 %. U méně četných diagnóz (nádory nosohltanu, nosních a paranazálních dutin a slinných žláz) byl podíl kuřáků výrazně nižší, 33–56 %.
V projektu HARDROCK byla konzumace alkoholu sledována v relaci na stav v době stanovení diagnózy (současný konzument, dřívější konzumace, abstinence), v případě konzumace alkoholu nyní nebo dříve byla dále sledována míra konzumace. Bylo zjištěno, že mezi pacienty s nádorem hlavy a krku bylo 37 % pravidelných nebo závislých konzumentů alkoholu. Zastoupení pravidelných nebo závislých konzumentů bylo významně vyšší u pacientů diagnostikovaných v letech 2004–2005 (52 %) ve srovnání s pacienty z let 2006–2010 (33 %). U mužů bylo zastoupení pravidelných nebo závislých konzumentů významně vyšší než u žen (42 % vs 15 %).
Terapie
Z celkového počtu 774 pacientů bylo indikováno k potenciálně kurativní léčbě 669 z nich (86,4 %), z toho 250 k operativní a 419 k neoperativní – radioterapii či radioterapii s další léčebnou modalitou. 95 pacientů (12,3 %) bylo léčeno paliativně a 10 (1,3 %) symptomaticky (graf 4).

Z pacientů indikovaných ke kurativní léčbě 3 % podstupují pouze operaci, 25 % je operováno s následnou adjuvantní radioterapií a 5 % operováno s další radioterapií s chemoterapií. Samostatnou radioterapii podstupuje 41 % pacientů, 11 % pacientů je léčeno radioterapií a chemoterapií.
Zastoupení klinických stadií onemocnění bylo rozdílné u jednotlivých typů použité léčby. U kurativně léčených pacientů byl zaznamenán největší podíl stadia IV mezi pacienty léčenými pouze radioterapií, radioterapií s chemoterapií či operací v kombinaci s radioterapií a chemoterapií (64–82 %). U pacientů s operací a radioterapií byl podíl IV. stadií 46 %, u pouze operovaných jen 8 %. Zajímavé je, že podíl jednotlivých modalit léčby byl rozdílný v různých časových obdobích. V období 2004–2005 bylo 39 % pacientů léčeno operativně, v období 2006–2010 to bylo jen 32 %. Pouze radioterapii s chemoterapií podstoupila v letech 2004–2005 2 % pacientů, v letech 2006–2010 pak 14 %.
Operační léčba
Operativní léčba byla uplatňována především u nádorů rtu a dutiny ústní (ve 43 %) a u nádorů slinných žláz (v 59 %). U nádorů hltanu, hrtanu a nosních a paranazálních dutin bylo operováno 23–50 % pacientů, u nádorů nosohltanu pouze 5 %. Celkově byla u stadií onemocnění I–III aplikována operativní léčba samozřejmě častěji než u stadia IV (47 % proti 25 %). Naopak u stadia IV byla pak ve srovnání se stadii I–III častěji používána nekurativní léčba a chemoterapie.
U nádorů hlavy a krku celkově byl podíl operací nejvyšší u stadia II, a to ve 49 %. Počet operací klesal s rostoucím stadiem onemocnění, u stadia III to bylo 47 %, u stadia IV jen 26 %. Výjimkou jsou nádory hrtanu, kde podíl operací naopak roste s rostoucím stadiem, stadium I – 2 %, stadium II – 5 %, stadium III – 14 % a 22 % u stadia IV.
Ze 774 pacientů v registru HARDROCK bylo 32,3 % primárně operováno. Z této skupiny pacientů u méně než 10 % z nich byla operace definitivním řešením, více než 90 % pacientů podstoupilo dále adjuvantní radioterapii či radioterapii a chemoterapii.
Radioterapie
Celkem je radioterapií léčeno 96 % pacientů, z toho 12 % paliativně (tab. 1).
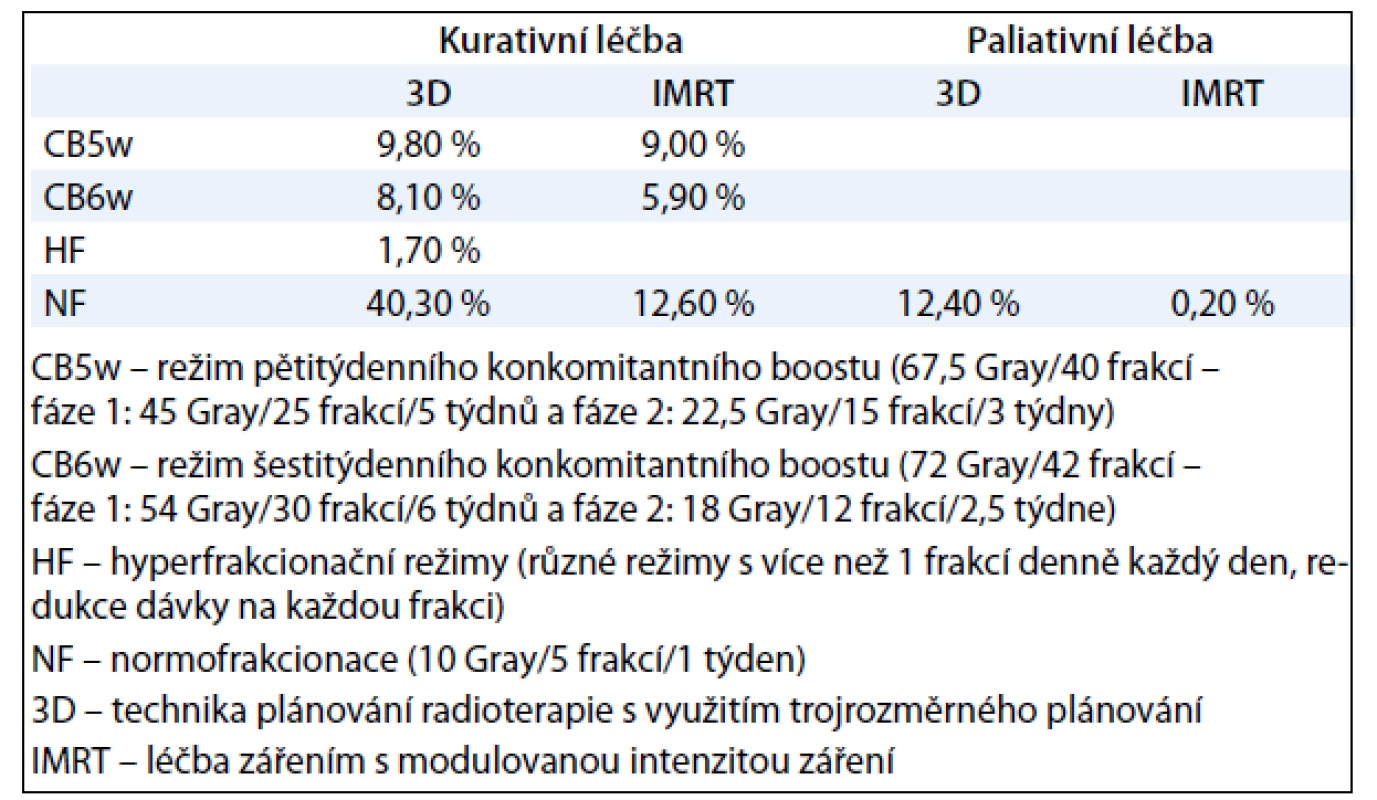
Režim frakcionace záření: V období 2004–2005 byla používána pouze 3D technika radioterapie. V období 2004––2005 byly u radioterapie využívány pouze strategie normofrakcionace (NF) a hyperfrakcionace (HF). Technika konkomitantního boostu v pěti týdnech (CB5w) a šesti týdnech (CB6w) byla používána až v letech 2006–2010. Technika IMRT byla zavedena až v letech 2006–2010.
Celkem bylo v registru HARDROCK zaznamenáno 559 pacientů léčených radioterapií s kurativním záměrem. V letech 2004–2005 bylo léčeno 138 pacientů a byli léčeni v normofrakcionačním či hyperfrakcionačním režimu. Od roku 2006 do 2010 bylo do registru vloženo 507 pacientů. Zde již 37,5 % pacientů bylo ozařováno v režimu 5 - či 6týdenního konkomitantního boostu.
Ozařovací objemy: V období 2004––2005 byly používány téměř výhradně objemy záření před míchu. Zadní krční lymfatické uzliny s ozářením nebo bez ozáření nadklíčkových jamek byly do ozařovacího pole zahrnuty až v letech 2006–2010, a to až v 75 % (NB: z toho v 9 % bez nadklíčků).
Dávka záření: U většiny kurativně léčených pacientů (62 %) byla aplikována celková střední dávka záření 66–75 Gy. Pacienti s nízkou dávkou záření do 65 Gy tvořili 25 % z kurativně léčených radioterapií a pacienti s vysokou dávkou nad 75 Gy pak 13 %. V období 2004–2005 bylo nejčastěji dosaženou celkovou dávkou záření 76–81 Gy, v období 2006–2010 pak dávka 66–75 Gy.
Dodržení léčebného plánu bylo srovnatelné u obou období (u 75–76 % zcela dodržen).
Výsledky terapie nádorů HaN
Toxicita léčby
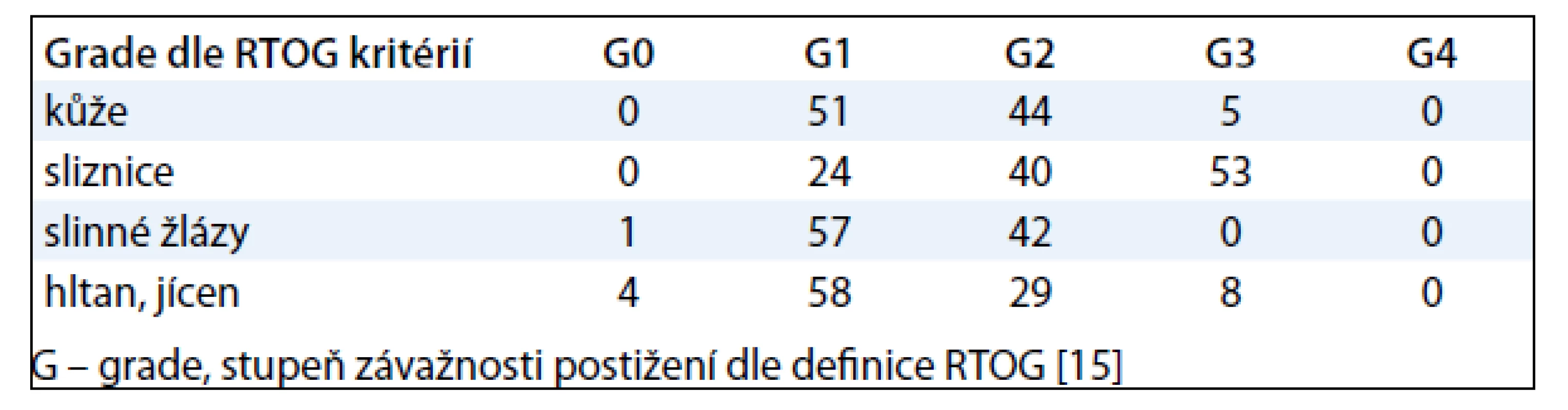
Toxicita byla a nadále je na Klinice onkologické Fakultní nemocnice Ostrava hodnocena dle RTOG (Radiation Therapy Oncology Group) kritérií [15]. Akutní toxicitou při léčbě nádorů hlavy a krku radioterapií jsou nejčastěji postiženy kůže, sliznice dutiny ústní a hltanu, slinné žlázy, hltan a jícen. Do registru HARDROCK byla zanesena nejvyšší toxicita bez ohledu na postiženou lokalizaci (tab. 2). Nejčastější byl výskyt akutní toxicity dle RTOG 1. stupně (42 %) či 2. stupně (37 %). Například co se týče dermatitidy a mukositidy, závažná akutní toxicita 3. či 4. stupně se vyskytla u 5 %, resp. 35 % pacientů. Výskyt toxicity 4. stupně byl velmi vzácný a jednalo se výhradně o přechodné neutropenie, které se vyskytovaly u pacientů léčených chemoterapií.
Pozdní toxicitou při léčbě nádorů hlavy a krku radioterapií byla nejčastěji postižena kůže, podkoží, sliznice, hrtan a slinné žlázy (tab. 3). Většina pacientů měla mírné potíže stupně 1 či 2. 6 % pacientů nemělo vůbec žádné projevy pozdní toxicity, naopak 1 % pacientů mělo známky pozdní toxicity 3. stupně, většinou se jednalo o postižení hrtanu.
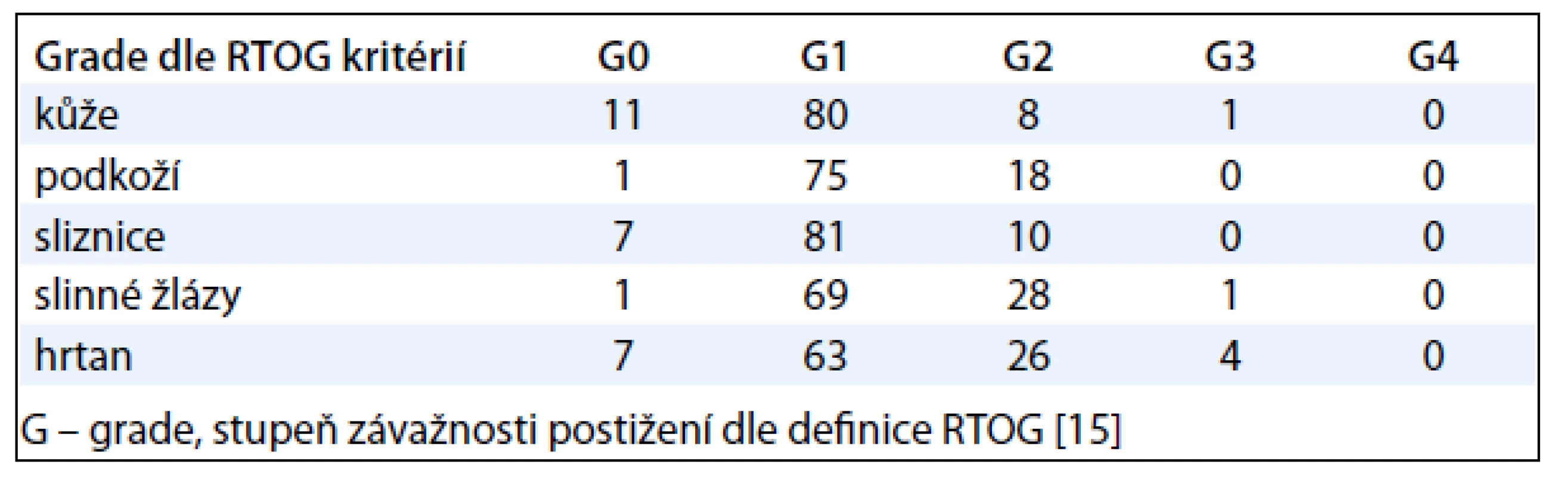
Při srovnání toxicity léčby v období 2004–2005 a 2006–2010 signifikantní rozdíl zjištěn nebyl. U pozdní toxicity je situace jiná. Pozdní toxicita léčby radioterapií byla v období 2004–2005 nižší než v období 2006–2010 (21 % vs 47 %).
Výsledky léčby
V celém souboru všech pacientů kompletní remise dosáhlo celkem 60 % pacientů, parciální remise dalších 23 %. Nejlepších výsledků dosáhli operovaní pacienti, u nichž byl podíl kompletních remisí 88–92 %. Pacienti léčení radioterapií (případně s konkomitantní nebo adjuvantní chemoterapií) dosáhli 52–57 % kompletních remisí a 32–35 % parciálních remisí.
Pacienti léčení primárně s kurativním záměrem dosáhli po léčbě kompletní remise v 68 % a parciální remise ve 21 %. Samozřejmě počet dosažených kompletních remisí po kurativně míněné léčbě byl závislý na stadiu onemocnění, v I. a II. stadiu onemocnění bylo dosaženo kompletní remise u více než 90 % pacientů, ve stadiu III již jen u 80 % pacientů a ve stadiu IV u 55 % pacientů.
Dosažené odpovědi na léčbu u kurativně léčených pacientů byly srovnatelné v obou sledovaných obdobích, tj. 2004–2005 a 2006–2010, mezi muži a ženami taktéž nebyl zjištěn statisticky významný rozdíl. Mohlo by se zdát, že zavedení nových postupů v terapii nepřineslo žádný léčebný benefit, nicméně podrobnější analýzy a delší sledování pacientů odhalily důležité informace.
Co se týče počtů relapsů a progresí onemocnění, ukázalo se, že v období 2004–2005 byl podíl progresí a relapsů vyšší o 11 % než v období 2006–2010 (38 % vs 27 %). Tento rozdíl se v terapeutickém efektu projevil především u pacientů léčených pouze radioterapií (54 % v letech 2004–2005 oproti 31 % v letech 2006–2010). Největší počet relapsů byl zaznamenán u nádorů ve stadiu IV – 26 % u nádorů hltanu, 42 % u nádorů hrtanu a 49 % u nádorů rtů a dutiny ústní. Jak bylo zmíněno výše, právě v období 2006–2010 došlo ke změně v plánování radioterapeutických objemů a technik, do ozařovacích objemů byly zahrnuty nadklíčkové a zadní krční lymfatické uzliny a množství pacientů bylo léčeno v akcelerovaných režimech s konkomitantním boostem.
Celkové přežití
Podíl zemřelých ve sledovaném souboru všech pacientů byl 42 %. Podíl úmrtí mezi pacienty diagnostikovanými v období 2004–2005 byl 59 %, mezi pacienty z let 2006–2010 pak 38 %. U kurativně léčených pacientů v obou sledovaných obdobích byl největší podíl zemřelých ve skupině pacientů léčených pouze radioterapií (76 % u pacientů léčených do roku 2006 a 44 % po roce 2006) a ve skupině léčené kombinací radioterapie a chemoterapie (75 % u pacientů léčených do roku 2006 a 33 % po roce 2006).
Celkové přežití (overall survival) definované jako interval mezi datem stanovení diagnózy a datem posledního známého stavu pacienta bylo provedeno Kaplanovou-Meierovou metodou. V celém netříděném souboru 774 pacientů je 58 % žijících a 42 % zemřelých, medián přežití je 26,5 měsíce.
V celkovém přežití všech pacientů diagnostikovaných v letech 2004–2005 a 2006–2010 nebyl statisticky významný rozdíl (log-rank test, p = 0,637). U pacientů z období 2004–2005 byl medián přežití 26,3 měsíce, u pacientů z let 2006–2010 byl medián přežití 27,2 mě-síce.
V celkovém přežití kurativně léčených pacientů byl zjištěn statisticky významný rozdíl mezi stadii onemocnění. Samozřejmě stadia I a II dosahují nejlepšího přežití (17 % zemřelých), nejhoršího přežití dosahují pacienti ve stadiu IV.
Je však zajímavé, že u kurativně léčených pacientů ve stadiu IV se rozdíl v přežití liší u pacientů léčených před rokem 2006 a po roce 2006. Co se týče léčby pacientů, operační postupy nezaznamenaly výraznou změnu, největší rozdíl spočíval v technice záření, jak již bylo zmíněno dříve (graf 5).

Toto bylo potvrzeno i při zhodnocení souborů pacientů, kteří v průběhu své léčby podstoupili radioterapii. U pacientů s onemocněním ve stadiu IV byl opět zjištěn signifikantní profit v celkovém přežití u léčených po roce 2006 oproti pacientům léčeným v letech 2004–2005 (graf 6).

Další zlepšení celkového přežití bylo zaznamenáno u pacientů pod 80 let a bez závislosti na alkoholu (graf 7).

Diskuze
Nádory HaN jsou významnou diagnostickou skupinou v radiační onkologii. Terapie těchto nádorů se v čase mění a upravuje a jsou hledány optimální postupy v jejich léčbě.
Projekt HARDROCK je založen na retrospektivně-prospektivním sběru dat, která mají za cíl vyhodnotit dopad změny léčebného protokolu na terapeutické výsledky. Hlavním výstupem projektu je tedy zpětná vazba v oblasti indikátorů kvality péče. V radiační onkologii můžeme definovat čtyři základní parametry, které definují jakost v nejširším smyslu slova. Pro management kvality potřebujeme znát:
- dostupnost (pacient se včas dostane k léčbě zářením),
- standardnost (léčba je provedena podle národních či mezinárodních standardů),
- bezpečnost (léčba je bezpečná, jsou monitorovány vedlejší účinky terapie),
- účinnost.
Projekt HARDROCK se při dobré dostupnosti radioterapie na naší klinice a po změně léčebných standardů zaměřil na parametry bezpečnosti a účinnosti. V první části prezentace dat uvádíme demografický přehled, rozložení tumorů dle anatomických lokalit i rozsah rizikových faktorů. Tato data nepřinášejí průlomové objevy, korespondují s velkými soubory pacientů [10], nicméně jsou důležitá k hodnocení charakteru pacientských souborů. Prezentace výsledků léčby by bez kontextu těchto popisných charakteristik neměla smysl.
Samotné výsledky léčby přinesly přehled o léčbě tumorů HaN za několik let, rozdělení do dvou skupin dle časových období dovoluje srovnání léčebných výsledků.
V léčbě radioterapií jsou mezi obdobími 2004–2005 a 2006–2010 zásadní rozdíly. Změnila se taktika provedení radioterapie, a to jak ve smyslu definice cílového objemu, tak i frakcionace. Hyperfrakcionace a v určitých případech i normofrakcionace byly v kurativní léčbě nahrazeny konkomitantním boostem, tj. akcelerovanou radioterapií.
RTOG akutní toxicita léčby byla srovnatelná u obou období. Pozdní toxicita byla v období 2004–2005 nižší než v období 2006–2010 z důvodu naprosto nedostatečného zaznamenávání pozdní toxicity ve follow-up v období 2004–2005.
Závěr
Vzhledem k tomu, že do databáze byli zahrnuti všichni pacienti, a data tudíž neprošla žádnou selekcí, můžeme konstatovat, že díky tomuto registru přesně víme, jak tuto konkrétní skupinu diagnóz léčíme, a to včetně vývoje v čase. Zjistili jsme, že změna objemu a frakcionace radioterapie vede ke snížení počtu relapsů a zlepšení celkového přežití u pacientů s onemocněním ve stadiu IV.
Výsledky projektu dále dokazují, že jednotlivé parametry kvality spolu velmi úzce souvisejí: změnou standardů se při nezměněné bezpečnosti zvyšuje účinnost terapie.
Podobné projekty doporučujeme jako ideální zdroj indikátorů kvality v onkologii.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Ing. MUDr. Jakub Cvek, Ph.D.
Klinika onkologická
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: jakub.cvek@fno.cz
Obdrženo: 18. 1. 2012
Přijato: 10. 4. 2012
Sources
1. Lingen MW. Head and neck. In: Kumar V, Abbas AK, Fausto N et al (eds). Robbins and Cotran Pathologic Basis of Disease. 8th ed. Philadelphia: Saunders Elsevier 2010 : 740–753.
2. Šlampa P, Petera J. Zhoubné nádory hlavy a krku. In: Vošmik M, Šlampa P, Kubeš J et al (eds). Radiační onkologie. Praha: Galén Karolinum 2007 : 67–104.
3. Kreimer AR, Clifford MG, Boyle P et al. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev 2005; 14(2): 467–475.
4. Termine N, Panzarella V, Falaschini S et al. HPV in oral squamous cell carcinoma vs head and neck squamous cell carcinoma biopsies: a meta-analysis (1988–2007). Ann Oncol 2008; 19(10): 1681–1690.
5. Chaturvedi AK, Engels EA, Anderson WF et al. Incidence trends for human papillomavirus-related and -unrelated oral squamous cell carcinomas in the United States. J Clin Oncol 2008; 26(4): 612–619.
6. Ústav zdravotnických informací a statistiky ČR. Novotvary 2005–2007 [online]. Praha: ÚZIS 2005–2007. Dostupné na: http://www.uzis.cz.
7. Licitra L, Felip E. ESMO Guidelines Working Group. Squamous cell carcinoma of the head and neck: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009; 20 (Suppl 4): 121–122.
8. Bonner JA, Harari PM, Giralt J et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006; 354(6): 567–578.
9. Harrington KJ, El-Hariry IA, Holford CS et al. Phase I study of lapatinib in combination with chemoradiation in patients with locally advanced squamous cell carcinoma of the head and neck. J Clin Oncol 2009; 27(7): 1100–1107.
10. Parsons JT, Mendenhall WM, Cassisi NJ et al. Hyperfractionation for head and neck cancer. Int J Radiat Oncol Biol Phys 1988; 14(4): 649–658.
11. Bourhis J, Overgaard J, Audry H et al. Hyperfractionated or acclerated radiotherapy in head and neck cancer: a meta-analysis. Lancet 2006; 368(9538): 843–854.
12. Terhaard CH, Kal HB, Hordijk GJ. Why to start the concomitant boost in accelerated radiotherapy for advanced laryngeal cancer in week 3. Int J Radiat Oncol Biol Phys 2005; 62(1): 62–69.
13. Feltl D, Cvek J. Klinická radiobiologie. 1st ed. Havlíčkův Brod: Tobiáš 2008 : 57–66.
14. HARDROCK, Head and neck cancer: Assessment of risk factors, stage distribution, radiotherapy optimalization, couses of relapse – keypoints [online]. Available from: http://hardrock.registry.cz.
15. Radiation Therapy Oncology Group, Cooperative Group Common Toxicity Criteria [online]. Available from: http://www.rtog.org/ResearchAssociates/AdverseEventReporting/AcuteRadiationMorbidityScoringCriteria.aspx.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2012 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Význam mikroprostředí kostní dřeně v patogenezi mnohočetného myelomu
- CT kolonografie – přehled vývoje metodiky a indikací
- Dlouhé nekódující RNA a jejich význam u nádorových onemocnění
- Léčba histiocytózy z Langerhansových buněk kladribinem dosáhla u 9 z 10 dospělých pacientů dlouhodobé kompletní remise
- Mutace genu EGFR u pacientů s pokročilým NSCLC
- Projekt HARDROCK: parametrický sběr a analýza dat pacientů s nádory hlavy a krku na Klinice onkologické FN Ostrava – důraz na význam frakcionace a definice cílového objemu v radioterapii
- Jaký je prognostický význam molekulárně genetických faktorů u karcinomu endometria?
- Hepatocelulární karcinom – dlouhodobě léčitelné onemocnění
- Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up-gradingu
- Porovnávanie histologických typov primárnych a korešpondujúcich recidivujúcich bazocelulárnych karcinómov kože
- Paratestikulárny mezotelióm v mladom veku. Kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hepatocelulární karcinom – dlouhodobě léčitelné onemocnění
- Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up-gradingu
- Mutace genu EGFR u pacientů s pokročilým NSCLC
- CT kolonografie – přehled vývoje metodiky a indikací
