Jaký je prognostický význam molekulárně genetických faktorů u karcinomu endometria?
What is the Prognostic Importance of Molecular Genetic Factors in Endometrial Carcinoma?
Background:
Evaluation of the importance of molecular genetic factors in endometrial carcinoma based on our review of available literature, and in the case of K - ras mutation based on our own data. The aim of the original part of our study was to compare the presence of K - ras mutation in early stages of endometroid carcinoma with normal endometrium and evaluate the role of the mutation in endometrial carcinogenesis.
Material and methods:
Molecular biological analysis was performed to detect K - ras mutation in samples of endometrial tissue obtained from women treated in the past at the Department of Obstetrics and Gynecology, University Hospital Hradec Kralove. The detection was made from DNA isolated from paraffin embedded sections using K - ras StripAssay™, ViennaLab Diagnostics GmbH.
Results:
K - ras mutation was found in 7 out of 30 specimens of endometroid carcinoma in stage I (23%) and in 3 of 20 specimens of normal endometrium in the control group (15%). K - ras mutations were more frequent in IA stage and grade 1 of endometroid carcinoma.
Conclusion:
The importance of molecular genetic factors in endometrial carcinoma differs depending on the type of carcinoma. In more common type 1 endometroid cancer, published data are not as clear as in type 2 carcinoma, in which prevalence of alteration of p53 reaches 90%. Results of our study performed on local population of women support the theory about the possible role of K - ras mutation as an early event in the process of endometrial carcinogenesis in type 1 tumors.
Key words:
endometrial carcinoma – K - ras gene – mutation
This study was supported by grant of Grant Agency of the Charles University No. 157310.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
12. 12. 2011
Accepted:
27. 6. 2012
Authors:
E. Křepinská 1; M. Chmelařová 2; J. Laco 3; V. Palička 2; J. Špaček 1
Authors‘ workplace:
Porodnická a gynekologická klinika, LF UK a FN v Hradci Králové
1; Ústav klinické biochemie a diagnostiky, LF UK a FN v Hradci Králové
2; Fingerlandův ústav patologie, LF UK a FN v Hradci Králové
3
Published in:
Klin Onkol 2012; 25(4): 282-286
Category:
Original Articles
Overview
Východiska:
Kritické zhodnocení významu vybraných molekulárně genetických ukazatelů u karcinomu endometria na základě analýzy dosud publikovaných prací a u K - ras mutace též prezentace vlastních výsledků. Cílem původní části práce bylo porovnat výskyt této mutace v tkáni karcinomu oproti zdravému endometriu u pacientek léčených na našem pracovišti a posléze i zhodnocení jejího podílu na vzniku tohoto onemocnění v rámci multivariační analýzy.
Materiál a metody:
Byla provedena molekulárně biologická analýza vzorků endometriální tkáně pacientek léčených na Porodnické a gynekologické klinice Fakultní nemocnice v Hradci Králové. Vyšetření mutací genu K - ras bylo provedeno z DNA získané z formalinem fixovaných a v parafinu zalitých vzorků. K detekci byla použita metoda K - ras StripAssay™, ViennaLab Diagnostics GmbH.
Výsledky:
Bylo vyšetřeno 30 vzorků endometroidního karcinomu ve stadiu I (dle FIGO), mutace genu K - ras byla prokázána v 7 případech (23 %). V kontrolní skupině 20 vzorků normálního endometria byla sledovaná mutace nalezena ve 3 případech (15 %). Mutace se častěji vyskytovala u stadia IA a ve skupině dobře diferencovaných nádorů.
Závěr:
Význam molekulárně genetických faktorů u karcinomu endometria se přelomově liší v závislosti na typu nádoru. U častějších endometroidních nádorů prvního typu nejsou dosud publikované výsledky zdaleka tak jasné jako u karcinomů druhého typu, kde je výskyt alterace p53 uváděn až v 90 %. Naše výsledky u představitelek místní populace podporují teorii o možném podílu K - ras mutace v procesu endometriální karcinogeneze u nádorů prvního typu ve smyslu časné události.
Klíčová slova:
karcinom endometria – gen K - ras – mutace
Úvod
Karcinom endometria je po karcinomu prsu nejčastější gynekologickou malignitou a jeho incidence neustále narůstá.
Ze zemí Evropské unie je jeho výskyt v České republice nejvyšší.
Od roku 1983 platí dualistická Bokhmanova teorie modelu karcinogeneze endometria, která vychází z klinického pozorování a histopatologických charakteristik [1]. Asi o deset let později byla tato dosud platná teorie podpořena studiemi na molekulární úrovni. Charakteristika obou základních subtypů souvisí i s odlišnou genetickou nestabilitou a molekulárními změnami [2].
U endometroidního karcinomu (typ I) jsou nejčastěji popisovány mutace PTEN tumor - supresorového genu [3], mikrosatelitální instabilita [4], mutace K - ras protoonkogenu [5] a β - cateninu [6]. Pro karcinomy typu II je charakteristická porucha funkce tumor - supresoru p53 a některé práce uvádějí, že gen p53 je alterován až v 90 % serózních karcinomů endometria [7]. Na rozdíl od typu I jsou u typu II vzácně popisované mutace K - ras , β - cateninu , dále mikrosatelitální instabilita a inaktivace p16 [2,8 – 11].
V původní části naší práce jsme se zaměřili na úlohu mutace K - ras genu v patogenezi endometroidního typu karcinomu endometria.
K - ras patří do rodiny onkogenů ras, které jsou nejčastěji spojovány se vznikem lidských maligních nádorů. Ras proteiny jsou součástí buněčné membrány a vykazují GTPázovou aktivitu. Podílejí se na spouštění růstu a diferenciaci buňky. Mutovaný K K - ras protein ztrácí schopnost spontánní inaktivace, což způsobí trvalou stimulaci buněčného růstu [12]. Z dostupných prací se mutace K - ras genu vyskytuje u 10 – 30 % případů endometroidního karcinomu [5,13], a to nejčastěji u nádorů středně a nízce diferencovaných [14]. To, že je mutace též přítomna asi v 16 % případů hyperplastického endometria, podporuje hypotézu o časné události v procesu karcinogeneze v této lokalizaci [15]. Jiné zdroje však naopak uvádějí možný vznik karcinomu endometria za přispění mutovaného K K - ras protoonkogenu bez stadia hyperplazie [16].
Materiál a metody
Byla provedena molekulárně biologická analýza 50 vzorků endometriální tkáně pacientek vyšetřených a léčených na Porodnické a gynekologické klinice LF UK a FN v Hradci Králové. Vzorky byly získány z archivu Fingerlandova ústavu patologie LF UK a FN v Hradci Králové, stáří vyšetřovaného materiálu nepřesáhlo 5 let. Vyšetřeno bylo 30 vzorků s endometroidním karcinomem ve stadiu I dle FIGO klasifikace. Dále byla vyšetřena kontrolní skupina 20 vzorků normálního endometria pacientek operovaných pro jinou, nezhoubnou diagnózu dělohy. Tyto vzorky byly histopatologem hodnoceny jako proliferační, sekreční či klidové endometrium. Do kontrolní skupiny nebyl zařazen žádný vzorek hyperplastického endometria. Vyšetření mutací genu K - ras bylo provedeno z DNA získané z formalinem fixovaných, v parafinu zalitých vzorků tkání. DNA z parafinového bločku byla izolována pomocí kitu firmy Qiagen. Vlastní vyšetření K - ras mutace bylo realizováno metodou K K - ras StripAssay™ (ViennaLab Diagnostics GmbH). Tento test zahrnuje vyšetření 10 mutací v K - ras genu (kodon 12 a 13). PCR amplifikace s využitím biotinylovaných primerů byla provedena dle protokolu výrobce, pro analýzu bylo použito 25 ng izolované DNA. Amplifikace byla uskutečněna v termocykléru Veriti (Applied Biosystems, CA). Amplifikační reakce využívala teplotní profil: 94 °C 2 min, 35 cyklů (94 °C 1 min, 70 °C 50 s, 56 °C 50 s, 60 °C 1 min) a 60 °C 3 min. Amplifikaci následovala kontrolní elektroforéza na 2% agarosovém gelu (délky PCR produktů 151 bp a 204 bp). Amplifikované produkty byly dle protokolu výrobce hybridizovány na testovací strip (proužek) obsahující alelově specifické imobilizované oligonukleotidové proby. Navázané biotynilované sekvence byly detekovány s využitím streptavidin alkalické fosfatázy a barevného substrátu.
Ke statistickému zpracování získaných dat byl použit χ² test.
Výsledky
Vlastní soubor sestával ze 30 karcinomů a 20 zdravých kontrol. Věkový medián pacientek s karcinomem byl 65 roků (rozmezí 52 – 77 roků) a 56 roků (rozmezí 50 – 79 roků) u pacientek kontrolní skupiny.
Vyšetřeno bylo 30 vzorků endometroidního karcinomu ve stadiu I (dle FIGO), mutace genu K - ras byla prokázána v 7 případech (23 %). V kontrolní skupině 20 vzorků normálního endometria byla sledovaná mutace nalezena ve 3 případech (15 %). Se spolehlivostí 0,95 je rozmezí výskytu mutace pro ženy s endometroidním karcinomem 10 % až 42 %, pro zdravé ženy je to 3 % až 38 %. Rozdíl mezi četností výskytu mutace v obou skupinách je však statisticky nevýznamný.
S ohledem na jednotlivá stadia a grade nádoru se mutace častěji vyskytovala ve stadiu IA a ve skupině dobře diferencovaných nádorů (tab. 1 a 2).


V kontrolní skupině byla sledovaná mutace popsána ve 3 vzorcích. Ve dvou případech se jednalo o normální proliferační endometrium a v jednom o klidové endometrium u postmenopauzální ženy.
Diskuze
Kromě zcela základních charakteristik, ze kterých obvykle vycházíme (stupeň postižení, typ nádoru a grading), existuje řada dalších ukazatelů, které mohou mít svoji prognostickou významnost. Nejinak je tomu u karcinomu endometria. Gynekologické zhoubné nádory představují skupinu chorob, u kterých je prognóza závislá také na subtilních genomických, epigenetických a proteomických změnách.
Tab. 3 ukazuje nejčastěji se vyskytující genetické alterace karcinomu endometria (typ I, II).
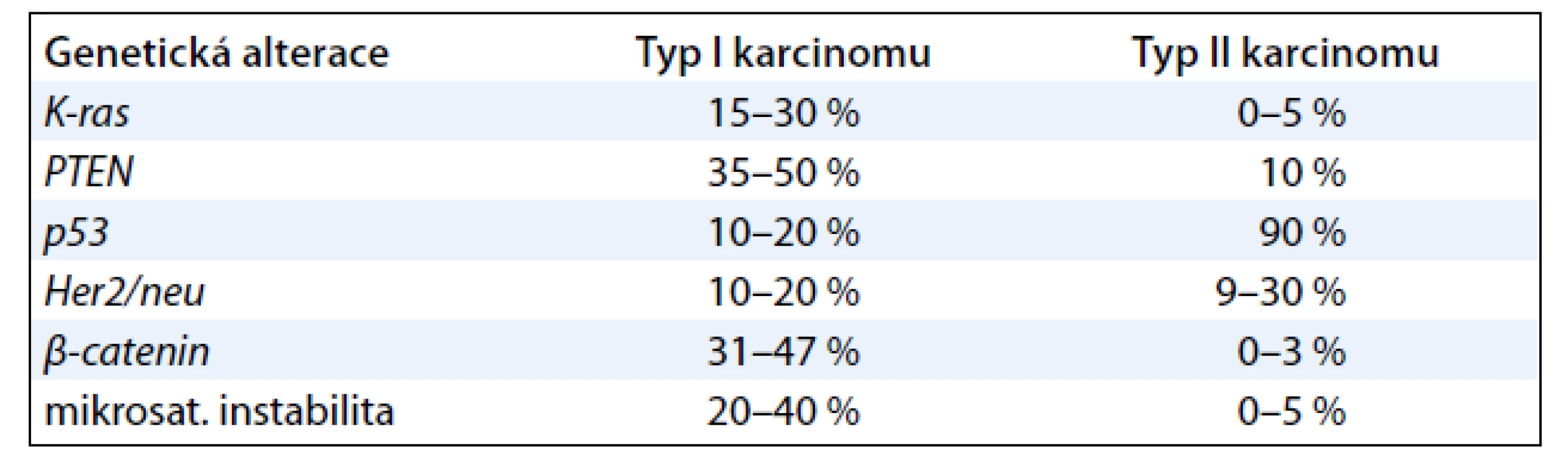
Ve vztahu k molekulární genetice je výrazněji profilován druhý typ karcinomu, který je méně častý a prognosticky horší (nevzniká na podkladě hyperplazie a není závislý na estrogenní stimulaci). Tento typ karcinomu je molekulárně geneticky charakterizován mutacemi genu p53 a četnými ztrátami heterozygozity. Některé práce uvádějí, že gen p53 je alterován až u 90 % serózních karcinomů [7]. Podle jiných autorů je mutace genu p53 dvakrát častěji popisována u tumorů bez přítomnosti hyperplazie (estrogen non dependentních) než u tumorů s hyperplazií (estrogen dependentních) [16,17]. Zvýšená exprese p53 koreluje se špatnou diferenciací nádorů endometria, hloubkou myometriální invaze, pokročilým stadiem a metastatickým šířením [18,19].
Naopak zdaleka ne tak jasná je situace u prvního typu karcinomu, který vzniká na podkladě atypické hyperplazie a je podmíněn estrogenní stimulací. Stále není jasně prokázáno, která ze změn maligní transformaci iniciuje. Zdá se, že většina genetických alterací charakteristických pro toto nádorové onemocnění vzniká již na počátku tumorigeneze. Nejčastěji se vyskytující genetickou poruchou u endometriálního karcinomu je mutace PTEN tumor - supresorového genu, která je popisována u 25 – 83 % všech tumorů [20]. Zatímco u jiných typů nádorů je tato alterace genu PTEN asociována s pokročilým onemocněním včetně metastatického postižení, u karcinomu endometria je tomu naopak a ztráta funkce PTEN genu je považována za časnou událost a navíc je spojována s velmi dobrou prognózou [21]. K nejčastěji popisovaným molekulárním abnormitám u endometroidního typu karcinomu patří spolu s mutací genu PTEN také mikrosatelitální instabilita (MI) způsobená poruchou funkce DNA mismatch repair (MMR) genů. Několik prací uvádí shodu ve výskytu MI a PTEN mutací; mutace je popisována u 60 – 86 % MI pozitivních endometroidních karcinomů a pouze u 24 – 35 % tumorů, kde MI prokázána nebyla. Pro sporadické formy endometroidního karcinomu je typická inaktivace MMR genu MLH1 následovaná poruchou exprese genů MSH2 a MSH6 [22]. Přítomnost MI je asociována s dobrou prognózou endometroidního karcinomu [8,23]. b - catenin je další z genů, jehož porušená funkce je spojována s procesem endometriální karcinogeneze. Jeho mutace je signifikantně častěji popisována u endometroidních lézí (31 – 47 %) ve srovnání s non endometroidním typem nádorů (0 – 3 %) [24]. Jiné práce uvádějí častější výskyt u endometriální hyperplazie, což by svědčilo pro podíl této mutace v časné karcinogenezi [25]. Her2/ neu patří do skupiny protoonkogenů, jehož overexprese je popisována u 10 – 20 % endometroidních karcinomů se středním a nízkým stupněm diferenciace a některými autory je dávána do souvislosti s progresí onemocnění a horší prognózou. Mutace je dále popisována u 9 – 30 % serózních karcinomů a spolu s alterovaným genem p53 je asociována s velmi špatnou prognózou u non endometroidního typu nádorů [26,27].
Z dostupných pramenů je patrné, že mutace K - ras protoonkogenu je detekována u 10 – 30 % případů endometroidního karcinomu [5,13]. Také výsledky naší práce potvrzují účast mutace K - ras genu v procesu vzniku karcinomu endometria ve smyslu časné události [28,29]. Prezentace dosavadních výsledků o K - rasmutaci u karcinomu endometria a prognostický význam tohoto ukazatele však nejsou jednotné. Například S. F. Lax ve své práci připouští, že pro vznik endometroidního karcinomu lze použít podobný model patogeneze jako u kolorektálního karcinomu. Působení K - ras mutace přichází v úvahu jednak na úrovni přechodu z atypické hyperplazie do dobře diferencovaného endometroidního karcinomu, ale především potencuje progresi do méně diferencovaných forem nádoru [9]. Z práce Mizuuchiho et al (n = 49) vyplývá, že K - ras mutace je nezávislý rizikový faktor odpovědný za agresivní chování endometriálního karcinomu [30]. Podobného názoru jsou i Ito et al (n = 221), kteří mutaci K - ras signifikantně spojují s přítomností metastáz v lymfatických uzlinách a předpokládají její důležitou roli v mechanizmu odpovědném za nepříznivé biologické chování endometroidního karcinomu u postmenopauzálních pacientek [31].
Semczuk et al (n = 57) na souboru pacientek s karcinomem endometria neprokázali souvislost přítomnosti K - ras mutace s věkem, stadiem, hloubkou invaze ani gradingem nádoru. Data podporují hypotézu o náhodné aktivaci K - ras genu v lidském neoplastickém endometriu a dále autoři naznačují, že by průkaz mutovaného protoonkogenu mohl být negativním prognostickým faktorem [32]. Naproti tomu práce kolektivu Esteller et al (n = 55) dokazuje, že K - ras mutace je relativně běžnou událostí v procesu endometriální karcinogeneze, ale bez jasného prognostického významu [33]. Ani Jones et al (n = 32) neprokázali vliv přítomnosti K - ras mutace na prognózu onemocnění. Autoři srovnávali výskyt mutace p53 a K - ras a jejich vztah k celkovému přežití pacientek s karcinomem endometria, kdy mutace p53 silně korelovala s krátkým přežitím, K - ras však nikoli [34]. Studie autorů Pijnenborga et al (n = 44) se zabývala otázkou K - ras mutace u recidivujícího endometriálního karcinomu, kdy nebyl pozorován vliv této mutace na vznik recidivy onemocnění [35]. Několik prací se zabývalo také problematikou mutovaného K - ras genu u žen léčených Tamoxifenem. Prasad et al (n = 29) porovnávali pacientky s karcinomem endometria vzniklým při léčbě Tamoxifenem s pacientkami se sporadickým endometriálním karcinomem, kdy nebyl prokázán statistický rozdíl mezi četností výskytu mutace u obou vyšetřovaných skupin [36]. Tsujioka et al (n = 28) prokázali mutovaný K - ras gen u 46 % pacientek léčených Tamoxifenem. Po zastavení léčby u pacientek mutace již prokázána nebyla. Z práce vyplývá, že ukončení léčby Tamoxifenem by mohlo redukovat riziko vzniku karcinomu endometria cestou mutovaného genu K - ras [37].
V porovnání se sporadickými formami endometriálního karcinomu je genetické pozadí u hereditárních forem nádoru mnohem méně prozkoumané. Jedná se především o endometriální karcinomy vznikající v souvislosti s Lynchovým syndromem neboli HNPCC (hereditary nonpolyposis colorectal cancer). Endometriální karcinom je nejčastější malignita, která se u pacientek s Lynchových syndromem vyskytuje [38]. Lynchův syndrom je spojován s mutací genů patřících do rodiny mismatch repair (MMR), např. MLH1, MSH2, MSH6, PMS1 nebo PMS2 [39]. Zdá se, že mechanizmus vzniku endometriálního karcinomu v rámci HNPCC je důsledkem poruchy odlišných genů, než je tomu u kolorektálního karcinomu. Inaktivace komplexu genů MSH2/ MSH6 hraje pravděpodobně zásadní roli v procesu karcinogeneze [40]. Další genetickou alterací, která se uplatňuje v nádorovém procesu, je mutace PTEN genu, která se vyskytuje asi v 90 % případů endometriálního karcinomu u pacientek s Lynchovým syndromem [41].
Závěr
Prognostický význam molekulárně genetických faktorů u karcinomu endometria se přelomově liší v závislosti na typu nádoru. Jasně je definován u tumor-supresorového genu p53 a nádorů druhého typu, kde koreluje s horší prognózou. U častějších endometroidních nádorů prvního typu však nejsou dosud publikované výsledky zdaleka tak jasné. Jako nejčastější událost na této úrovni je u nich popisována mutace genu PTENa mikrosatelitální instabilita.
Naše výsledky u představitelek místní populace podporují teorii o možném podílu K-ras mutace v procesu endometriální karcinogeneze u nádorů prvního typu ve smyslu časné události.
Práce byla podpořena grantem Grantové agentury Univerzity Karlovy č. 157310.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Eva Křepinská
Porodnická a gynekologická klinika
LF UK a FN v Hradci Králové
Sokolská 581
500 05 Hradec Králové
e-mail: evajurkova@seznam.cz
Obdrženo: 12. 12. 2011
Přijato: 27. 6. 2012
Sources
1. Bokhman JV. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol 1983; 15(1): 10 – 17.
2. Liu FS. Molecular carcinogenesis of endometrial cancer. Taiwan J Obstet Gynecol 2007; 46(1): 26 – 32.
3. Mutter GL. Pten, a protean tumor suppressor. Am J Pathol 2001; 158(6): 1895 – 1898.
4. Esteller M, Levine R, Baylin SB et al. MLH1 promoter hypermethylation is associated with the microsatellite instability phenotype in sporadic endometrial carcinomas. Oncogene 1998; 17(18): 2413 – 2417.
5. Caduff RF, Johnston CM, Frank TS. Mutations of the Ki - ras oncogene in carcinoma of the endometrium. Am J Pathol 1995; 146(1): 182 – 188.
6. Saegusa M, Hashimura M, Yoshida T et al. Beta‑catenin mutations and aberrant nuclear expression during endometrial tumorigenesis. Br J Cancer 2001; 84(2): 209 – 217.
7. Tashiro H, Isacson C, Levine R et al. p53 gene mutations are common in uterine serous carcinoma and occur early in their pathogenesis. Am J Pathol 1997; 150(1): 177 – 185.
8. Catasus L, Machin P, Matias Guiu X et al. Microsatellite instability in endometrial carcinomas: clinicopathologic correlations in a series of 42 cases. Hum Pathol 1998; 29 : 1160 – 1164.
9. Lax SF. Molecular genetic pathways in various types of endometrial carcinoma: from a phenotypical to a molecular‑based classification. Virchows Arch 2004; 444(3): 213 – 223.
10. Tashiro H, Blazes MS, Wu R et al. Mutations in PTEN are frequent in endometrial carcinoma but rare in other common gynecological malignancies. Cancer Res 1997; 57(18): 3935 – 3940.
11. Tashiro H, Lax SF, Gaudin PB et al. Microsatellite instability is uncommon in uterine serous carcinoma. Am J Pathol 1997; 150(1): 75 – 79.
12. Cibula D, Petruželka L et al. Onkogynekologie. Praha: Grada Publishing 2009.
13. Engelsen IB, Akslen LA, Salvesen HB. Biologic markers in endometrial cancer treatment. AMPIS 2009; 117(10): 693 – 707.
14. Lax SF, Kurman RJ. A dualistic model for endometrial carcinogenesis based on immunohistochemical and molecular genetic analysis. Verh Dtsch Ges Patol 1997; 81 : 228 – 232.
15. Sasaki H, Nishii H, Takahashi H et al. Mutation of the Ki - ras protooncogene in human endometrial hyperplasia and carcinoma. Cancer Res 1993; 53(8): 1906 – 1910.
16. Koul A, Willén R, Bendahl PO et al. Distinct sets of gene alteration in endometrial carcinoma implicate alternate modes of tumorigenesis. Cancer 2002; 94(9): 2369 – 2379.
17. Kaku T, Kamura T, Hirakawa T et al. Endometrial carcinoma associated with hyperplasia – immunohistochemical study of angiogenesis and p53 expression. Gynecol Oncol 1999; 72(1): 51 – 55.
18. Pilka R, Mickova I, Lubusky M et al. Expression of p53, Ki - 67, bcl - 2, c - erb - 2, estrogen, and progesterone receptors in endometrial cancer. Ceska Gynekol 2008; 73(4): 222 – 227.
19. Pilka R, Markova I, Duskova M et al. Immunohistochemical evaluation and lymph node metastasi in surgically staged endometrial carcinoma. Eur J Gynaecol Oncol 2010; 31(5): 530 – 535.
20. Bansal N, Yendluri V, Wenham RM. The molecular biology of endometrial cancers and implications for pathogenesis, classification, and targeted therapies. Cancer Control 2009; 16(1): 8 – 13.
21. Risinger JI, Hayes K, Maxwell GL et al. PTEN mutation in endometrial cancers is associated with favorable clinical and pathological characteristics. Clin Cancer Res 1998; 4(12): 3005 – 3010.
22. Okuda T, Sekizawa A, Purwosunu Y et al. Genetics of endometrial cancers. Obstet Gynecol Int 2010; 2010 : 984013.
23. Maxwell GL, Risinger JI, Alvarez AA et al. Favorable survival associated with microsatellite instability in endometroid endometrial cancers. Obstet Gynecol 2001; 97(3): 417 – 422.
24. Moreno‑Bueno G, Hardisson D, Sánchez C et al. Abnormalities of the APC/ b - catenin pathway in endometrial cancer. Oncogene 2002; 21(52): 7981 – 7990.
25. Nei H, Saito T, Yamasaki H et al. Nuclear localization of b - catenin in normal and carcinogenic endometrium. Mol Carcinog 1999; 25(3): 207 – 218.
26. Slomovitz BM, Broaddus RR, Burke TW et al. Her - 2/ neu overexpression and amplification in uterine papillary serous carcinoma. J Clin Oncol 2004; 22(15): 3126 – 3132.
27. Williams JA Jr, Wang ZR, Parrish RS et al. Fluorescence in situ hybridization analysis of HER - 2/ neu, c - myc, and p53 in endometrial cancer. Exp Mol Pathol 1999; 67(3): 135 – 143.
28. Krepinska E, Chmelarova M, Palicka V et al. Mutation of K - ras gene in carcinogenesis of endometrial carcinoma. Book of abstracts 13th Biennial Meeting of the International Gynecological Cancer Society, Prague, October 23 – 26, 2010.
29. Krepinska E, Chmelarova M, Laco J et al. Mutation of K - ras gene in pathogenesis of endometrial carcinoma. Book of abstracts 17thInternational Meeting of the European Society of Gynaecological Oncology, Milan, Italy, September 11 – 14, 2011.
30. Mizuuchi H, Nasim S, Kudo R et al. Clinical implications of K - ras mutations in malignant epithelial tumors of the endometrium. Cancer Res 1992; 52(10): 2777 – 2781.
31. Ito K, Watanabe K, Nasim S et al. K - ras point mutations in endometrial carcinoma: Effect on outcome is dependent on age of patient. Gynecol Oncol 1996; 63(2): 238 – 246.
32. Semczuk A, Berbec H, Kostuch M et al. K - ras gene point mutations in human endometrial carcinomas: correlation with clinicopathological features and patients‘ outcome. J Cancer Res Clin Oncol 1998; 124(12): 695 – 700.
33. Esteller M, García A, Martínez - Palones JM, et al. The clinicopathological significance of K - RAS point mutation and gene amplification in endometrial cancer. Eur J Cancer 1997; 33(10): 1572 – 1577.
34. Jones MW, Kounelis S, Hsu C et al. Prognostic value of p53 and K - ras - 2 topographic genotyping in endometrial carcinoma: A clinicopathologic and molecular comparison. Int J Gynecol Pathol 1997; 16(4): 354 – 360.
35. Pijnenborg JM, Dam - de Veen GC, Kisters N et al. RASSF1A methylation and K - ras and B - raf mutations and recurrent endometrial cancer. Ann Oncol 2007; 18(3): 491 – 497.
36. Prasad M, Wang H, Douglas W et al. Molecular genetic characterization of tamoxifen‑associated endometrial cancer. Gynecol Oncol 2005; 96(1): 25 – 31.
37. Tsujioka H, Hachisuga T, Fukuoka M et al. Monitoring of Endometrial K - ras Mutation in Tamoxifen – Treated Patients With Breast Cancer. Int J Gynecol Cancer 2009; 19(6): 1052 – 1056.
38. Koornstra JJ, Mourits MJ, Sijmons RH et al. Management of extracolonic tumours in patients with Lynch syndrome. Lancet Oncol 2009; 10(4): 400 – 408.
39. Peltomäki P, Vasen HF, Bisgaard ML et al. Mutations predisposing to hereditary nonpolyposis colorectal cancer: database and results of a collaborative study. The International Collaborative Group on Hereditary Nonpolyposis Colorectal Cancer. Gastroenterology 1997; 113(4): 1146 – 1158.
40. Schweizer P, Moisio AL, Kuismanen SA et al. Lack of MSH2 and MSH6 characterizes endometrial but not colon carcinomas in hereditary nonpolyposis colorectal cancer. Cancer Res 2001; 61(7): 2813 – 2815.
41. Zhou XP, Kuismanen S, Nystrom - Lahti M et al. Distinct PTEN mutational spectra in hereditary non‑polyposis colon cancer syndrome‑related endometrial carcinomas compared to sporadic microsatellite unstable tumors. Hum Mol Genet 2002; 11(4): 445 – 450.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2012 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Význam mikroprostředí kostní dřeně v patogenezi mnohočetného myelomu
- CT kolonografie – přehled vývoje metodiky a indikací
- Dlouhé nekódující RNA a jejich význam u nádorových onemocnění
- Léčba histiocytózy z Langerhansových buněk kladribinem dosáhla u 9 z 10 dospělých pacientů dlouhodobé kompletní remise
- Mutace genu EGFR u pacientů s pokročilým NSCLC
- Projekt HARDROCK: parametrický sběr a analýza dat pacientů s nádory hlavy a krku na Klinice onkologické FN Ostrava – důraz na význam frakcionace a definice cílového objemu v radioterapii
- Jaký je prognostický význam molekulárně genetických faktorů u karcinomu endometria?
- Hepatocelulární karcinom – dlouhodobě léčitelné onemocnění
- Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up-gradingu
- Porovnávanie histologických typov primárnych a korešpondujúcich recidivujúcich bazocelulárnych karcinómov kože
- Paratestikulárny mezotelióm v mladom veku. Kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hepatocelulární karcinom – dlouhodobě léčitelné onemocnění
- Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up-gradingu
- Mutace genu EGFR u pacientů s pokročilým NSCLC
- CT kolonografie – přehled vývoje metodiky a indikací
