Asociace vybraných rizikových faktorů s tíží aterosklerotického postižení v karotické bifurkaci
Association of Selected Risk Factors with the Severity of Atherosclerotic Disease at the Carotid Bifurcation
In addition to standard risk factors of atherosclerosis such as cholesterol, arterial hypertension, smoking and diabetes mellitus, also the role of other risk factors in the development of atherosclerosis has been studied in recent years. The goal of the study was to find the differences between the levels of apolipoprotein B, homocysteine, hypersensitive CRP and lipoprotein(a) in patients with initial atherosclerotic affection of the carotid arteries in the presence of atherosclerotic plaques only, and in patients with significant carotid artery disease, with internal carotid stenosis exceeding 50 %.
Study material:
Group 1 consisted of 92 patients with atherosclerotic plaque in carotid arteries without the presence of arterial stenosis. Group 2 consisted of 77 patients with carotid artery stenosis exceeding 50 %. Ultrasound examination was used to ascertain the degree of affection of the carotid arteries.
Method:
Samples for the above factors were taken in both groups and compared between each other with linear regressive analysis being performed at the next stage in order to assess the dependence on standard risk factors.
Results:
The groups were compared using the Mann-Whitney (Wilcoxon) W test. Significantly higher levels of hypersensitive GRP (p = 0.026) and apolipoprotein B (p = 0.00063) were found in Group 2. Subsequent linear regressive analysis performed with the use of the general linear model and evaluation using the ANOVA test showed the independence of both apolipoprotein B and hypersensitive CRP from standard risk factors (arterial hypertension, age, smoking, and diabetes mellitus).
Conclusion:
In our study, apolipoprotein B and hypersensitive CRP was significantly higher in patients with carotid artery stenosis as compared with patients who had atherosclerotic plaques only in their carotid arteries, without the presence of stenosis.
Key words:
carotid arteries – atherosclerotic plaque – homocysteine – hypersensitive CRP – apolipoprotein B – lipoprotein(a)
Authors:
D. Václavík 1; D. Školoudík 2; O. Škoda 3; P. Praks 4; K. Axmanová 1; I. Vlachová 5
Authors‘ workplace:
Neurologické oddělení, Vítkovická nemocnice a. s., Ostrava
1; Neurologická klinika FNsP Ostrava-Poruba
2; Neurologické oddělení, Nemocnice Pelhřimov
3; Katedra matematiky VŠB-TU Ostrava
4; Neurologická klinika LF UP a FN Olomouc
5
Published in:
Cesk Slov Neurol N 2008; 71/104(3): 285-292
Category:
Original Paper
Overview
Kromě tradičních rizikových faktorů aterosklerózy, jako jsou cholesterol, arteriální hypertenze, kouření a diabetes mellitus jsou v posledních letech zkoumány i vlivy dalších faktorů na rozvoj aterosklerózy. Ve své práci jsme se snažili zjistit rozdíly mezi hladinami apolipoproteinu B, homocysteinu, hypersenzitivního CRP (C-reaktivní protein) a lipoproteinu(a) u pacientů s počínajícím aterosklerotickým postižením karotických tepen s přítomnosti pouze aterosklerotických plátů a pacientů s výrazným postižením karotického řečiště – přítomností stenózy vnitřní karotidy nad 50 %.
Materiál:
Skupinu č. 1 tvořilo 92 pacientů s aterosklerotickým plátem v karotidách, bez přítomnosti stenózy tepny. Skupinu č. 2 tvořilo 77 pacientů se stenózou karotické tepny nad 50 %. Stupeň postižení karotid byl hodnocen ultrazvukovým vyšetřením.
Metodika:
V obou skupinách byly provedeny odběry uvedených faktorů a srovnány mezi sebou s následným provedením lineární regresivní analýzy k posouzení nezávislosti na tradičních rizikových faktorech.
Výsledky:
Soubory byly srovnávány pomocí Mannova-Whitneyova (Wilcoxonova) W testu. Ve skupině č. 2 jsme nalezli signifikantně vyšší hladiny hypersenzitivního CRP (p = 0,026 ) a apolipoproteinu B (p = 0,00063). Následná lineární regresivní analýza byla provedena pomocí obecného lineární modelu a vyhodnocena ANOVA testem. Analýza ukázala nezávislost apolipoproteinu B i hypersenzitivního CRP na tradičních rizikových faktorech (arteriální hypertenze, věk, kouření, diabetes mellitus).
Závěr:
V naší práci byl apolipoprotien B a hypersenzitivní CRP signifikantně vyšší u pacientů se stenotickým postižením karotid ve srovnání s pacienty, kteří měli v karotických tepnách pouze aterosklerotické pláty bez přítomnosti stenózy.
Klíčová slova:
karotické tepny – aterosklerotický plát – homocystein – hypersenzitivní CRP – apolipoprotein B – lipoprotein(a)
Úvod
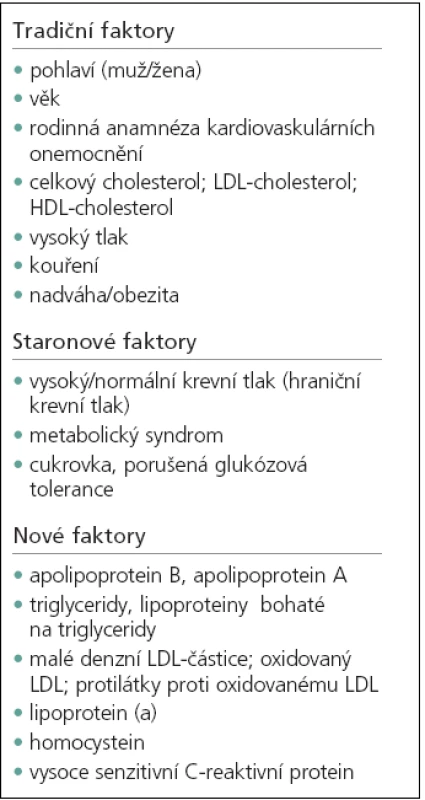
Aterosklerotické (AS) postižení karotických tepen je projevem celkového postižení aterosklerózou. Stenózy karotických tepen jsou významnou příčinou ischemických cévních mozkových příhod (iCMP). Vedle tradičních rizikových faktorů, jako jsou arteriální hypertenze (AH), diabetes mellitus (DM), kouření a věk, byl dlouho diskutován význam hyperlipidemie v souvislosti s karotickou stenózou. Zatímco ve vztahu k ischemické chorobě srdeční (ICHS) identifikovaly prospektivní epidemiologické studie abnormity lipidového spektra, především cholesterol, jako jednoznačný rizikový faktor, pak ještě v polovině 90. let minulého století rozsáhlá metaanalýza 45 prospektivních studií neprokázala nezávislou asociaci mezi vstupními koncentracemi cholesterolu v krvi a rizikem CMP. Otázka vztahu hladin jednotlivých komponent lipidového spektra a rizika CMP je studována dodnes. Zejména v posledních 10 letech je věnována pozornost i dalším rizikovým faktorům podílejícím se na vzniku AS postižení. Mezi tyto „nové“ rizikové faktory patří lipidové faktory – triglyceridy (TGD), lipoproteiny bohaté na TGD, lipoprotein(a) - Lp(a), další metabolické faktory, jako např. porucha glukózové tolerance a hladina homocysteinu (Hcy), markery porušené fibrinolýzy (např. fibrinogen) a zánětlivé faktory – např. ultrasenzitivní C-reaktivní protein (hs-CRP). Přehled hlavních tradičních, nových a „staronových“ faktorů shrnuje tab. 1. Jako staronové jsou uvedeny faktory považované za tradiční, u kterých byly nalezeny nové poznatky o jejich aterogenním působení [1].
AS postižení karotických tepen bez přítomnosti stenózy přináší roční průměrné riziko iCMP okolo 1 %. Stenóza karotické tepny nad 50 % zvyšuje toto riziko 2násobně [2–4]. V případě, že je stenóza symptomatická, se 2leté riziko cévní ischemické příhody zvyšuje na 19,9–24,5 % u stenóz 70–99 % a na 9,7–14,6 % u stenóz 50–69 % [5,6]. Důvody trvalého zájmu o rizikové faktory aterosklerózy jsou tedy více než odůvodněné.
Cílem naší práce bylo přispět k uvedené problematice. Zkoumali jsme případný rozdíl mezi hodnotami apo B, hs-CRP, Hcy a Lp(a) u pacientů s přítomností AS plátů v karotických tepnách a. carotis comunis (ACC) a a. carotis interna (ACI) bez známek stenotického postižení a u pacientů se stenózou karotid nad 50 %. Tyto faktory byly zvoleny proto, že jejich hladiny lze v současnosti běžně sledovat v klinických laboratořích a jsou většinou ovlivnitelné terapeuticky.
Materiál a metodika
Studie probíhala na 3 pracovištích v České republice: Neurologické klinice FNsP Ostrava-Poruba, neurologickém oddělení VNBMA Ostrava a neurologickém oddělení Nemocnice Pelhřimov během 12 měsíců (říjen 2003–září 2004). Do studie byli vybráni po sobě jdoucí pacienti ve věku 55–80 let, kteří byli pro neurologickou symptomatiku tranzitorní ischemické ataky (TIA), CMP či závratě odesláni k USG (ultrazvuk) vyšetření krčních tepen a souhlasili s účastí ve studii. Do 1. skupiny byli zařazeni pacienti s přítomností AS plátu, ale bez stenózy krční tepny, do 2. skupiny pacienti s výraznou stenózou karotidy nad 50 %.
Všichni pacienti splňovali tato vstupní kritéria: indikace USG vyšetření krčních tepen pro neurologickou symptomatiku (CMP, TIA, závratě apod), hyperlipidemie léčená statinem či fibrátem, věk 55–80 let, nepřítomnost fibrilace síní či infarktu myokardu v anamnéze, podpis informovaného souhlasu pacientem. Vyřazeni byli pacienti s onemocněním ledvin a zvýšenou hladinou kreatininu. Do souboru nebyli zařazeni nemocní s příznaky chronického či akutního zánětu, nebo abúzem nesteroidních antirevmatik, které by mohly ovlivnit významně hladiny hs-CRP.
1. skupinu tvořilo 92 pacientů, průměrný věk 68 let, 57 % mužů. Šíře AS plátu u těchto pacientů byla v distálních úsecích 10 mm ACC nebo proximálních 10 mm ACI 2,0 mm a více, ale bez USG známek stenózy tepny (obr. 1, 2). Ve 2. skupině bylo 77 pacientů s významnou stenózou vnitřní karotidy nad 50 % dle USG kritérií (obr. 3), průměrný věk 67 let, 66 % mužů.
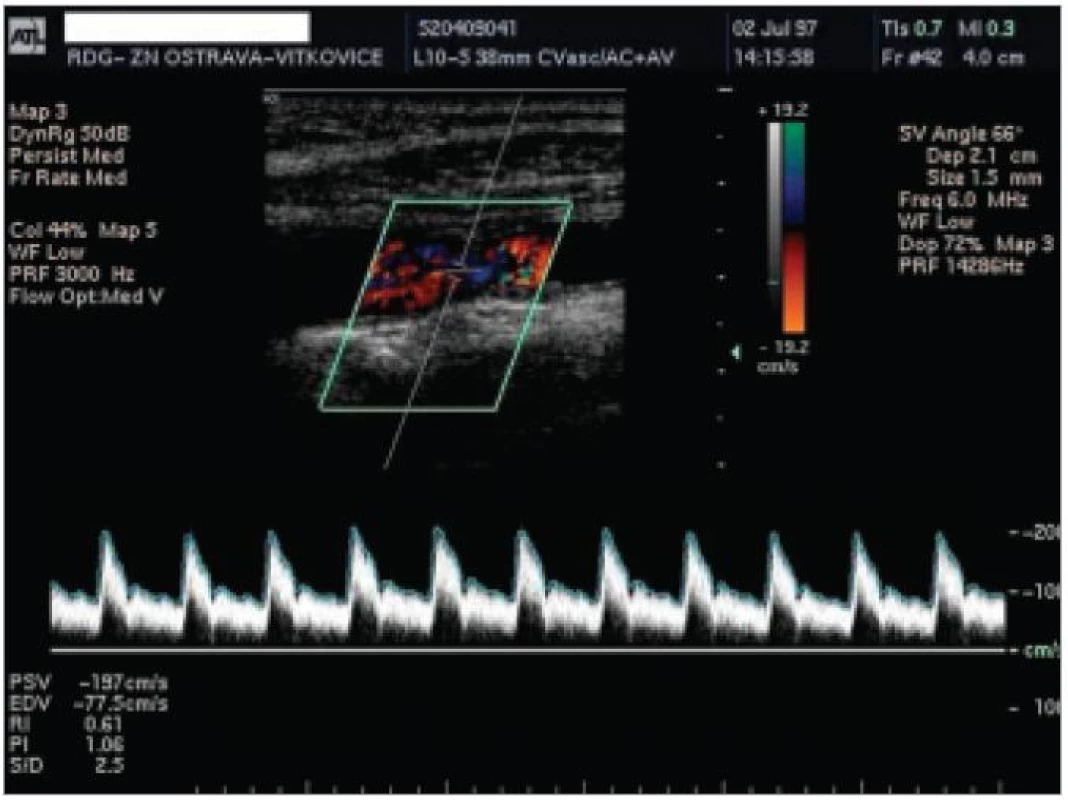
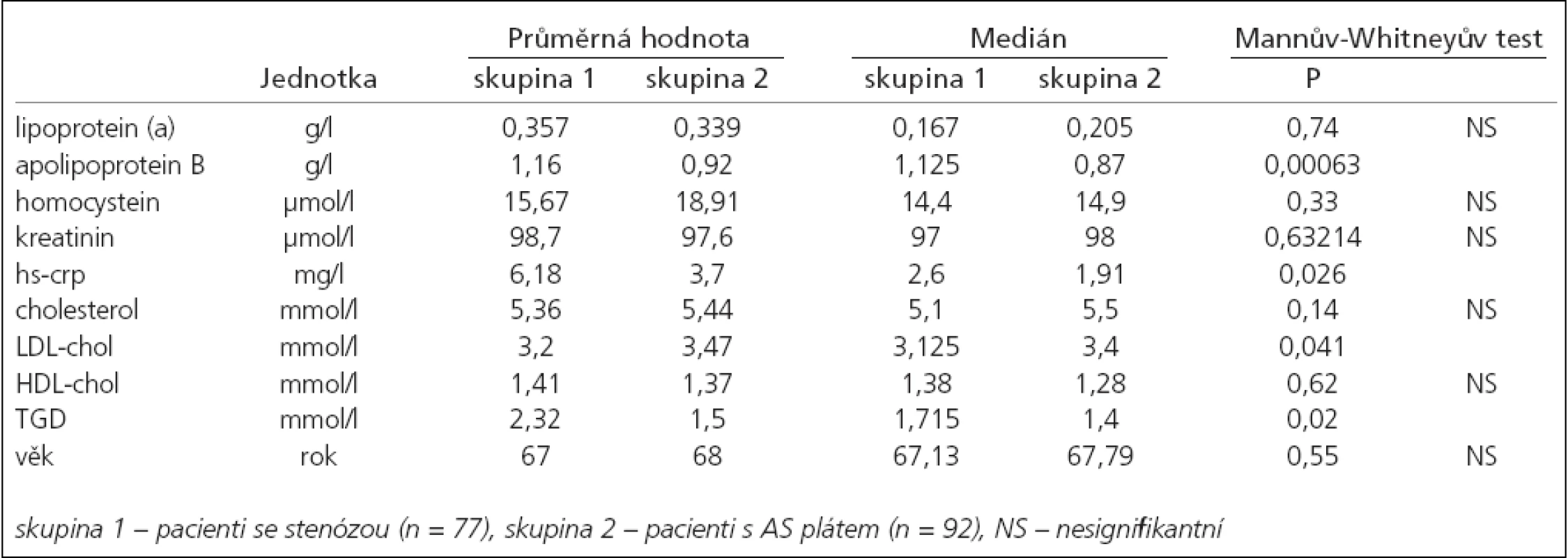
Věk pacientů v obou skupinách byl bez statisticky významného rozdílu (p = 0,55). V obou skupinách bylo vyšší procentuální zastoupení mužů, rozdíl mezi nimi však nebyl statisticky signifikantní (p = 0,36). Naměřené hodnoty jsou zaznamenány v tab. 4.
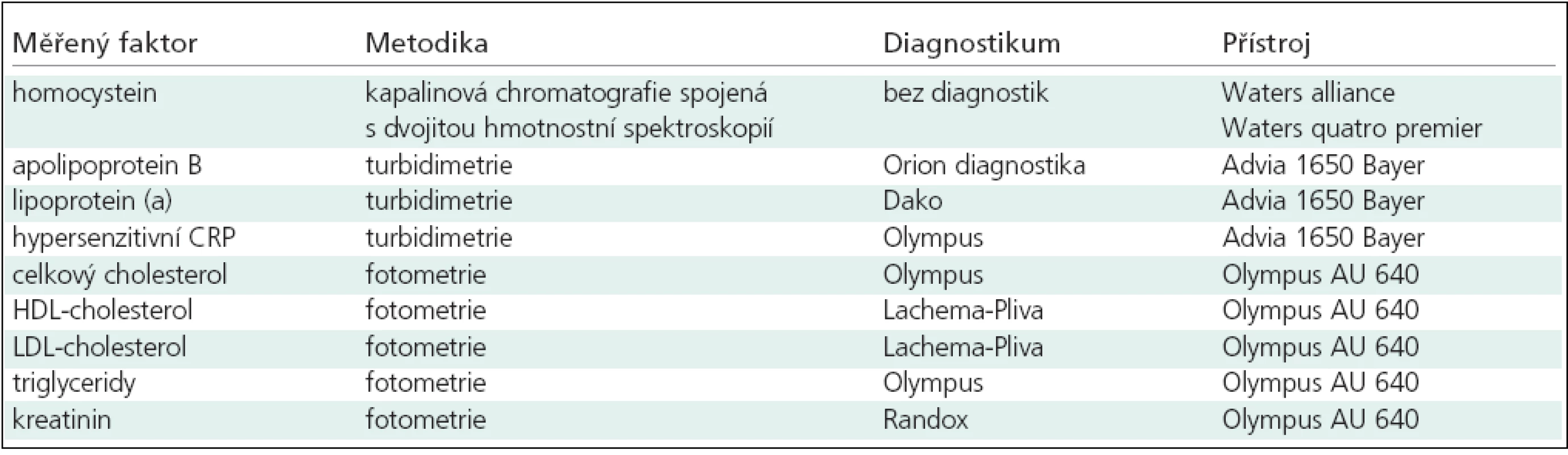
U všech pacientů byly provedeny odběry krevních vzorků na lačno a vyšetřeny následující laboratorní hodnoty: 1. Lp(a), 2. apoB, 3. Hcy, 4. kreatitin, 5. hs-CRP, 6. celkový cholesterol, 7. HDL-cholesterol, 8. LDL-cholesterol, 9. TGD. Zaznamenali jsme věk a procentuální zastoupení mužů v obou skupinách. Metodiku měření vybraných „nových rizikových faktorů“ ukazuje tab. 2.
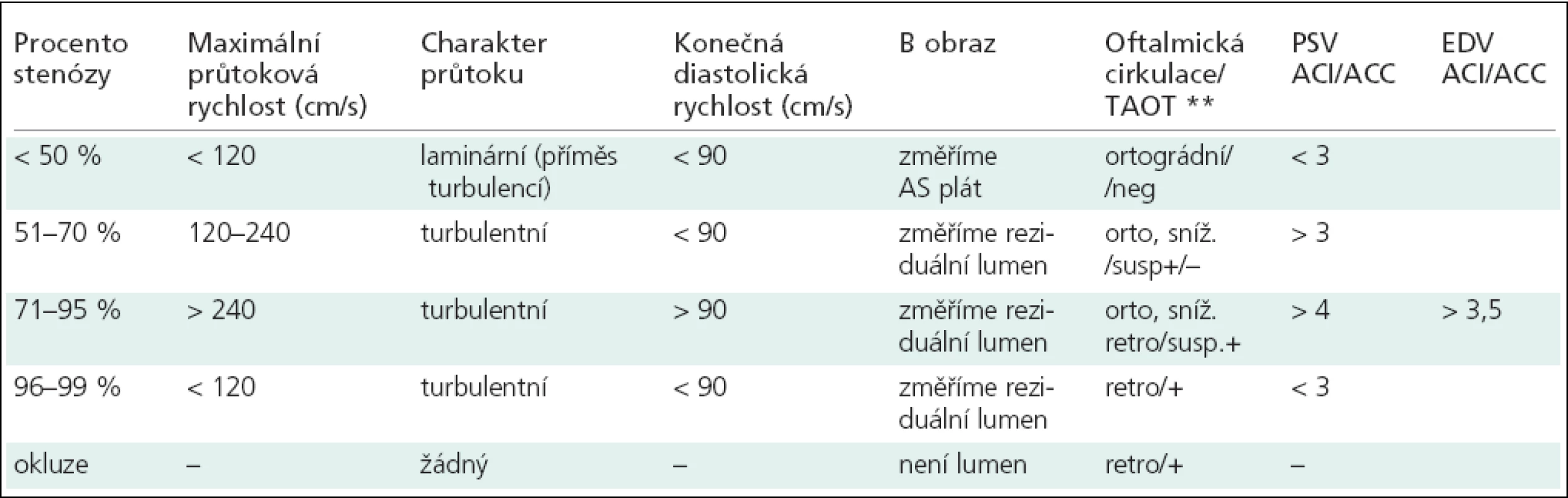
USG vyšetření byla prováděna lineární sondou na přístrojích: ATL HDI 5000 a Toshiba Nemio. Vyšetření byla provedena podle jednotné metodiky pro měření AS plátu i hodnocení karotické stenózy (tab. 3).
Statistická hodnocení
Vzhledem k charakteru rozložení výsledků, které neměly normální rozdělení, byly testovány rovnosti mediánů naměřených dat pomocí Mannova-Whitneyova testu (Wilcoxonův test). Jako statisticky signifikantní byl hodnocen rozdíl na 5% hladině významnosti. Rozdíl mezi procentuálním zastoupením mužů byl hodnocen pomocí Studentova t-testu. Následně byla pro posouzení nezávislosti faktorů, u kterých byl nalezen signifikantní rozdíl, provedena lineární regresivní analýza. Ta hodnotila jejich závislost na ostatních měřených faktorech a na přítomnosti arteriální hypertenze, kouření a DM.
Lineární regresní analýza byla provedena pro apoB a hs-CRP pomocí obecného lineárního modelu a vyhodnoceny ANOVA testem. Pro apoB jsme testovali závislost na 3 kategoriálních faktorech (arteriální hypertenze, kouření a DM) a 6 kvantitativních faktorech (LDL cholesterol, Lp(a), kreatinin, hs-CRP, věk, Hcy).Pro hs-CRP byly kategoriální faktory stejné. 6 kvantitativních parametrů představovaly LDL cholesterol, LP(a), kreatinin, apoB, věk, Hcy. Pro zhodnocení byla použita statistika R2, která ukazuje relativní předpovídající výkon modelu. R2 představuje popisnou míru mezi 0 a 1, čím blíže je k 1, tím má lepší prediktivní schopnost. Pro testování významných korelací v reziduích našeho modelu (zbytku výsledků, které R2 metoda nepopisuje) byl použit Durbinův - Watsonův test.
Výsledky
Statisticky signifikantní rozdíl jsme nalezli u hs-CRP (p = 0,026), apoB (p = 0,00063) a TGD (p = 0,02) tyto hodnoty byly vyšší ve skupině stenóz. Ve skupině plátů byla signifikantně vyšší hladina LDL cholesterolu (p = 0,041). Nenalezli jsme statisticky signifikantní rozdíl mezi hladinami Hcy a Lp(a) v obou skupinách.
Výsledky lineární regresní analýzy shrnuje tab. 5.
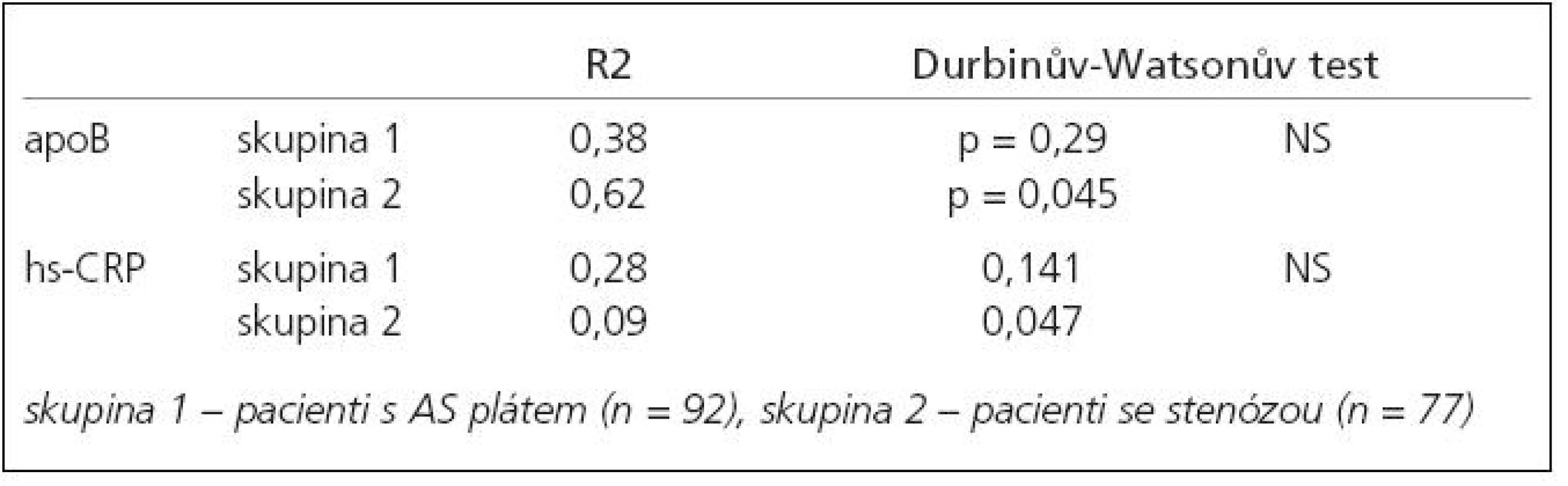
V 1. skupině u apo B ukazuje R2 (0,38) nízkou schopnost predikovat apo B pomocí 9 výše uvedených vstupních parametrů, což znamená, že apo B se jeví nezávislé na ostatních kategoriích. Durbinův-Watsonův test byl nesignifikantní (p = 0,289), což potvrzuje nezávislost apo B na těchto faktorech.
Ve 2. skupině byla v ANOVA analýze signifikantní souvislost mezi apo B a LDL cholesterolem (p = 0,000001) a kreatininem (p = 0,016). Při hodnotě R2 0,62 a Durbinově-Watsonově testu na hranici statistické významnosti (p = 0,0457) ukazuje tento nález možnosti závislosti mezi apo B a LDL a hraniční možnost závislosti mezi apo B a kreatininem. Hodnoty R2 (0,28) se statisticky nevýznamným Durbinovým-Watsonovým testem (p = 0,124) v 1. skupině svědčí pro nezávislost hs-CRP na 9 dalších zjišťovaných faktorech: arteriální hypertenze, kouření, DM, LDL cholesterol, LP(a), kreatinin, apo B, věk, Hcy.
Ve 2. skupině R2 (0,09) a Durbinův-Watsonův test (p = 0,047) opět neukazují závislost hs-CRP na 9 uvedených sledovaných faktorech.
Diskuse
Homocystein
Hyperhomocysteinemie (hHcy) je metabolický syndrom podmíněný spolupůsobením vlivů genetických, exogenních i provázejících řadu chorobných stavů. V běžné populaci je prevalence všech forem hHcy odhadována až na 0,20. U osob s rozvinutou aterosklerózou je její výskyt asi o 10–40 % vyšší [7]. Zvýšená koncentrace homocysteinu působí vaskulární změny prostřednictvím celé řady mechanizmů. Jak prokazují exprimentální modely, jde především o morfologické a funkční postižení endotelu s následnou nedostatečnou obnovou endoteliálních buněk. hHcy indukuje zvýšenou adhezivitu a agregabilitu trombocytů, proliferaci buněk hladkého svalstva arteriální stěny, způsobuje poruchy koagulační kaskády a fibrinolýzy, mění expresní aktivitu klíčových prvků vaskulárních zánětlivých markerů aterogeneze, má vliv na vulnerabilitu aterosklerotických plátů. Předpokládá se, že tyto účinky jsou zprostředkovány oxidací Hcy a následnou produkcí kyslíkových radikálů. Chemickou modifikací nízkodenzních lipoproteinů prohlubuje Hcy dále oxidační stres a poruchy fibrinolýzy, snižuje endotelium dependentní vazodilataci. Zjednodušeně lze říci, že hHcy multifaktoriálně ovlivňuje cévní strukturu a koagulační systém [8].
V naší práci byla u obou skupin přítomna lehká Hhcy, nebyl však nalezen signifikantní rozdíl mezi oběma skupinami, byla zaznamenána tendence k vyšším hladinám u pacientů s pláty než se stenózami. Výsledky naší studie jsou tedy v souladu s řadou prací, ve kterých se zvýšený Hcy jeví jako faktor provázející karotickou aterosklerózu [9–12]. Nenalezli jsme však, na rozdíl od řady prací, vztah mezi hladinou Hcy a tíží aterosklerózy karotid [13,14]. V současné době tedy není zcela zřejmé, jestli je Hcy jen markerem provázejícím aterosklerózu nebo nezávislým rizikovým faktorem způsobujícím progresi aterosklerózy. Tuto nejasnost měla pomoci odstranit dvojitě slepá randomizovaná studie The Vitamin Intervention for Stroke Prevention Randomized Controlled Trial (VISP). Během 2letého sledování však nebyl prokázán žádný efekt snížení hladiny Hcy na recidivu vaskulárního onemocnění u pacientů po neivalidizujícím mozkovém infarktu [15]. Další studie A Study of VITAmins TO Prevent Stroke (VITATOPS), která také zkoumá vliv snížení Hcy na incidenci opakovaných cévních příhod, měla být dokončena koncem roku 2006 a na její výsledky zatím čekáme [16]. V součanosti proto Česká společnost pro aterosklerózu nedoporučuje ani screeningové vyšetření Hcy ani jeho užití pro stratifikaci rizika cévních onemocnění. [17].
Ultrasenzitivní CRP
CRP je stopový protein, který má v oběhu zdravých osob střední koncentrací ≈ 1 mg/l , patří mezi proteiny akutní fáze zánětu. Zvýšená plazmatická koncentrace CRP je spojená s karotickou a koronární AS, AS tepen dolních končetin i progresí těchto onemocnění [18]. CRP je produkován především hepatocyty. Kromě hepatocytů byla produkce CRP prokázána také v aterosklerotických lézích (zejména buňkami hladkého svalstva a makrofágy), ledvinách, neuronech a v alveolárních makrofázích. Mechanizmus účinku CRP zatím není zcela objasněn. Má několik potenciálně protizánětlivých, ale i prozánětlivých efektů, které mohou přispívat také k progresi aterotrombózy a k rozvoji ischemického postižení spojeného s aterotrombotickými komplikacemi. Vazba CRP s ligandem aktivuje komplementový systém, který se váže k receptorům imunoglobinů na imunních buňkách a aktivuje produkci cytokinů. CRP navozuje zánětlivé změny v endotelových buňkách a v buňkách hladkého svalstva, které jsou spojovány s rozvojem aterosklerózy. Váže se k částem buněčných jader, poškozeným membránám a apoptotickým buňkám. CRP se váže k zoxidovanému lipoproteinu o nízké hustotě (LDL). Komplex CRP a LDL je fagocytován makrofágy a je vytvořena pěnová buňka. CRP také zvyšuje citlivost endotelových buněk k jejich destrukci buňkami cytotoxinu CD4 + T a facilituje trombogenezi stimulací tkáňového faktoru biosyntézy makrofágů. Vysoká koncentrace CRP v aterosklerotickém plátu je spojena se zvýšenou vulnerabilitou destiček a výskytem akutních trombotických příhod. CRP tedy nepředstavuje jen marker, ale je také zapojen do počátku a vývoje aterosklerózy [19,20]. Protože měření koncentrace CRP bylo používáno pro diagnózu a monitorování zánětlivých stavů, nebyla požadována jeho vysoká senzitivita, citlivost měření byla 3 až 6 mg/l. Současné metody měření hs-CRP měří s citlivostí o hodnotě ≈ 0,1 mg/l. Hodnoty hs-CRP vykazují malé intraindividuální rozdíly během roku a mají téměř nulovou cirkadiální variabilitu, proto lépe vystihují základní zánětlivý status jednotlivých osob [21].
V naší práci jsme nalezli signifikantně vyšší hs-CRP u pacientů se stenózou karotidy proti pacientům s pouze AS postižením karotických tepen bez přítomnosti stenózy. Zvýšený hs-CRP se v našem souboru ukázal jako nezávislý rizikový faktor tíže postižení karotických tepen. K podobným závěrům došla i řada dalších prací [22–24]. Blackburn nalezl asociaci mezi CRP a stupněm postižení karotid jen u mužů [25]. Studie ICARAS (Inflammation and Carotid Artery Risk for Atherosclerosis Study) přinesla důkazy o úzké korelaci mezi zánětlivými markery a rychlou progresí karotické aterosklerózy [26]. Podle The Rotterdam Study se CRP ukázal jako prediktor progrese aterosklerózy měřené na různých místech cévního řečiště (aorta, karotidy, ilické arterie a tepny horních končetin) [18]. Z našich autorů Vlachová nalezla korelaci mezi výší hs-CRP a tíží neurologického deficitu u akutní ischemické cévní příhody a stupněm AS postižení karotických tepen [27].
Zánětlivé postižení je v poslední době považováno za jednu z příčin rozvoje aterosklerózy, hs-CRP je považován za nezávislý prediktor karotické aterosklerózy [1]. Nicméně stále není jasné, jak vysoké je riziko způsobené zvýšeným CRP a zda případná medikamentózní redukce hladin CRP, například pomocí statinů či nesteroidních antirevmatik, bude benefitem pro pacienty s CMP [20].
Apolipoprotein B
Aterogenní význam jednotlivých tříd lipoproteidů se liší. Aterogenita celkového cholesterolu je dána především zmnožením LDL a částečně lipoproteinů o střední (IDL) a velmi nízké hustotě (VLDL). Aterogenní význam LDL částic je závislý na jejich koncentraci, ale také na kvalitativních vlastnostech. LDL částice v sobě zahrnují řadu subpopulací, které se liší svými chemickými a biologickými vlastnostmi. Výrazně aterogenní jsou malé, husté LDL částice. Je-li přítomno velké množství těchto částic, zůstává celková hodnota LDL cholesterolu relativně nízká, ale zvyšuje se jeho aterogenita. Jejich patologický efekt je dán především kombinací těchto faktorů: snazší prostup cévní stěnou, větší toxicita pro endoteliální buňky, způsobují větší produkci aktivátoru plazminogenu 1 endoteliálními buňkami, potencují větší sekreci tromboxanu endoteliálními buňkami, snadněji oxidují, snadněji se váží na glykosaminoglykany cévní stěny, způsobují růst obsahu intracelulárního kalcia v buňkách hladkých svalů, váží se hůře na LDL receptor a lépe na receptory scavengerů. Strukturálním proteinem lipoproteinových partikulí LDL, VLDL a IDL je apolipoprotein B zajišťující specifickou vazbu na buněčné receptory. Jelikož všechny potenciálně aterogenní částice obsahují 1 molekulu apo B, je jeho koncentrace odrazem počtu všech aterogenních lipoproteinových částic, a tedy přesnějším markerem aterogenity dyslipidemie [28].
Uvedený fakt se odrazil i v naší studii. Nalezli jsme signifikantně vyšší apo B ve skupině stenóz, přestože v této skupině byl signifikantně nižší LDL cholesterol. Srovnání mezi apo B a LDL cholesterolem a jejich asociací s dalšími rizikovými kardiovaskulárními faktory bylo provedeno v The Insulin Resistance Atherosclerosis Study (IRAS). V této studii u 1 522 subjektů apo B koreloval lépe s dalšími rizikovými faktory – obezita, lipidy, CRP, fibrinogen, inhibitor aktivátoru plazminogenu, glykemie, koncentrace inzulinu a intimomediální tloušťky (IMT) karotických tepen – než LDL [29]. V práci Karin Wallenfeldtové byla vyšší hladina apo B spojena s rozšířením intimomediální šíře v karotických tepnách [30].
V posledních letech proběhla řada studií zkoumajících zda apo B nebude lepším prediktorem pro hodnocení účinnosti léčby statiny než LDL cholesterol. V řadě z nich bylo prokázáno, že znalost hodnot apo B je důležitá nejen v odhadu rizika cévních onemocnění, ale také v hodnocení efektu léčby [31–33]. Dokladem závažnosti tohoto ukazatele je i zpřísnění cílových hodnot pro apo B v primární i sekundární prevenci, které se odrazilo i v českém Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, které nově doporučuje jako sekundární cíl terapie u pacientů s normálním LDL cholesterolem snížení apo B u pacientů s vysokými rizikem KVO pod 0,9 g/l a u pacientů v sekundární prevenci s již manifestním KVO pod 0,8 g/l [17].
Lipoprotein(a)
Uvedený lipoprotein byl poprvé popsán před 40 lety. Přes stále rozporuplné výsledky studií se ukazuje jako významný rizikový faktor cévního postižení. Aterogenní mechanizmy Lp(a) zatím nejsou zcela objasněny. Agonisticky blokuje vazbu plazminogenu na endoteliální
buňky, fibrinogen a destičky, reguluje syntézu aktivátoru plazminogenu endotelem a může hrát důležitou roli mezi atero a trombogenezí. Lp(a) je tvořen spojením lipoproteinu, který je strukturálně podobný LDL a hydrofilního proteinu bohatého na karbohydrát nazvaný apoliproprotein A (apo A). Lp(a) částice obsahují apo A a apoliproptoein B (apo B) v poměru 1 : 1 molárního koeficientu. Výsledky 9 prospektivních studií ukázaly, že Lp(a) je nezávislý rizikový faktor pro kardiovaskulární onemocnění (KVO), ale 4 další prospektivní studie dosáhly opačných závěrů [1]. Tyto rozdíly mohou souviset s nedostatečnou standardizací hodnot Lp(a) a s neschopností biochemických vyšetření posoudit všechny izoformy apo A.
V našem pozorování jsme nenalezli rozdíl mezi hladinami Lp(a) v obou skupinách. K podobným nálezům došel také Sramek v jehož práci nebyl nalezen vztah mezi výší Lp(a) a IMT ve femorálních arteriích a karotidách [34]. V práci van Wissena došlo ke snížení Lp(a) po dlouhodobé terapii statiny u pacientů s familiární hypercholesterolemií, toto snížení nemělo vliv na změny v IMT karotických tepen, což přináší podobně jako v naší práci a v práci Sramka pochybnosti o vlivu Lp(a) na progresi aterosklerózy u těchto pacientů [35]. Narozdíl od těchto výsledků Magyar [19] našla zvýšený Lp(a) u pacientů s okluzí a se stenózou karotid nad 30 % proti kontrolní skupině pacientů bez postižení karotid, nebyl však hodnocen rozdíl mezi skupinou stenóz a skupinou okluzí krkavic. Vliv Lp(a) na progresi aterosklerózy karotid tedy zůstává nejasný.
Závěr
Výsledky mnohých studií zabývajících se vlivem působení metabolických a zánětlivých rizikových faktorů v procesu aterosklerózy karotického řečiště jsou v mnohém stále rozporuplné. Přesto přinášejí v mnohém praktické konsekvence, kromě opatření režimových, která nejsou v širší neurologické veřejnosti dobře známa a akceptována v sekundární prevenci CMP. Z pohledu výsledků naší studie je zejména apo B přesnějším markerem pro hodnocení aterogenity LDL částic než samotná hladina LDL cholesterolu. Proto považujeme za významné v sekundární prevenci CMP nejen ultrazvukové sledování, ale také jeho měření u pacientů se stenózami karotických tepen a jeho monitoraci při terapii statiny s cílem best medical therapy a udržování hodnot apo B pod 0,8 g/l v souladu recentními doporučeními. Podobně jako u apo B jsme ve skupině pacientů se stenózami karotických tepen nalezli signifikantně zvýšené hladiny hs-CRP. Proto se nabízí jako vhodné i jeho sledování během terapie statiny, které mohou jeho hladinu snižovat.
Práce byla podpořena projektem MŠMT č. 1M06047 – Centrum pro jakost a spolehlivost výroby (CQR.CZ).
MUDr. Daniel Václavík
Neurologické oddělení
Vítkovická nemocnice, a.s. Ostrava
Zálužanského 15
703 84 Ostrava-Vítkovice
e-mail: daniel.vaclavik@nemvitkovice.cz
Přijato k recenzi: 3. 4. 2007
Přijato do tisku: 15. 4. 2008
Sources
1. Fruchart JCH, Melchior CN, Stroes ESG, Kastelein JJP, Duriez P. New Risk Factors for Atherosclerosis and Patient Risk Assessment. in Atherosclerosis. Evolving Vascular Biology and Clinical Implications. Circulation 2004; 109(23): 15–19.
2. Inzitari D, Eliasziw M, Gates P, Sharpe BL, Chan RK, Meldrum HE et al. The causes and risk of stroke in patients whith asymptomatic internal-carotid-artery stenosis. North American Symptomatic Caroditd Endarterectomy Trial Collaborators. N Engl J Med 2000; 342(23): 1693–1700.
3. Bock RW, Gray-Weale AC, Mock PA, App Stats M, Robinson DA, Irwing L et al. The natural history of asymptomatic carotid artery disease. J Vasc Surg 1993; 17(1): 160–171.
4. Risk of stroke in the distribution of an asymptomatic carotid artery. The European Carotid Surgery Trialist Collaborative group. Lancet 1995; 345 : 209–212.
5. Endarerectomy for Asymptomatic carotid stenosis. Interim results from the MRC European Carotid Surgery Trial. Lancet 1996; 347 : 1591–1593.
6. Barnett HJM, Taylor DW, Eliasziw M, Fox AJ, Fergusson GG, Haynes RB et al. Benefit of carotid endarerectomy in patients whit symptomatic moderate or severe stenosis. North American Symptomatic Carotid Endarerectomy Trial Collaborators. N Engl J Med 1998; 339(20): 1415–1425.
7. Selhub J. Homocysteine metabolismus. Annu Rev Nutr 1999; 19 : 217–246
8. Guilland LC, Favier A, Potier de Courcy G, Galan P, Hercberg S. Hyperhomocysteinemia: an independent risk factor or a simple marker of vascular disease? 1. Basic data. Pathol Biol 2003; 51 : 101–110.
9. Selhub J, Jacques FP, Bostom AG, Ralph B, D'Agostino, Wilson PWF et al. Association between Plasma Homocysteine Concentrations and Extracranial Carotid-Artery Stenosis. N Engl J Med 1995; 332(5): 286–291.
10. Lupattelli G, Rufini S, Locati EH, Lombardini R, Ciuffetti G, Siepi D et al. Hyperhomocyst(e)inemia is associated with carotid atherosclerosis. Angiology 1999; 50(10): 823-830.
11. Robertson J, Iemolo F, Stabler SP, Allen RH, Spence JD. Vitamin B12, homocysteine and carotid plaque in the era of folic acid fortification of enriched cereal grain products. CMAJ 2005; 172(12): 1569–1573.
12. Sasaki T, Watanabe M, Nagai Z, Hoshi T, Takasawa M, Nukata M et al. Association of Plasma Homocysteine Concentration With Atherosclerotic Carotid Plaques and Lacunar Infarction. Stroke 2002; 33(6): 1493–1496.
13. Wang HL, Fan DS, Shen Y, Sun AP, Zhang J, Yang YJ. The relationship between carotid artery atherosclerosis and hyperhomocysteinaemia. Zhonghua Nei Ke Za Zhi 2005; 44(4): 258–261.
14. Mueller T, Furtmueller B, Aigelsdorfer J, Luft C, Poelz W, Haltmayer M. Total serum homocysteine--a predictor of extracranial carotid artery stenosis in male patients with symptomatic peripheral arterial disease. Vasc Med 2001; 6(3): 163–167.
15. Toole TJF, Malinow MR, Chambless LE, Spence JD, Pettigrew LC, Howard WJ et al. Lowering Homocysteine in Patients With Ischemic Stroke to Prevent Recurrent Stroke, Myocardial Infarction, and Death The Vitamin Intervention for Stroke Prevention (VISP) Randomized Controlled. JAMA 2004; 291(5): 565–575.
16. Dusitanond P, Eikelboom JW, Hankey GJ, Thom J, Gilmore G, Loh K et al. Homocysteine-lowering treatment with folic acid, cobalamin, and pyridoxine does not reduce blood markers of inflammation, endothelial dysfunction, or hypercoagulability in patients with previous transient ischemic attack or stroke: a randomized substudy of the VITATOPS trial. Stroke. 2005; 36(1): 144–146.
17. Vaverková H, Soska V, Rosolová H, Ceska R, Cífková R, Freiberger T et al. Czech Atherosclerosis Society Guidelines for the diagnosis and treatment of dyslipidemias in adults.Vnitr Lek 2007; 53(2): 181–193.
18. Meer IM, Moniek PM, Hak AE, Kiliaan AJ, Sol AI, Van Der Kuip DA et al. C-reactive Protein Predicts Progression of Atherosclerosis Measured at Various Sites in the Arterial Tree. The Rotterdam Study. Stroke 2002; 33(12): 2750–2757.
19. Magyar MT, Szikszai Z, Balla J, Valikovics A, Kappelmayer J, Imre S et al. Early-Onset Carotid Atherosclerosis Is Associated With Increased Intima-Media Thickness and Elevated Serum Levels of Inflammatory Markers. Stroke 2003; 34(1): 58–63.
20. Napoli MD, Schwaninger M, Cappelli R, Ceccarelli E, Gianfilippo GD, Donati C et al. Evaluation of C-Reactive Protein Measurement for Assessing the Risk and Prognosis in Ischemic Stroke. Stroke 2005; 36(6): 1316–1329.
21. Dvořáková A, Poledne R. Ultrasenzitivně měřený C-reaktivní protein – nový parametr kardiovaskulárního rizika. Vnitř lék 2004; 50(11): 852–857.
22. Kazmierski R, Podsiadly E, Tylewska-Wierzbanowska S, Kozubski W. Association between carotid atherosclerosis, inflammatory markers and Chlamydia pneumoniae infection. Neurol Neurochir Pol 2005; 39(4): 277–286.
23. Benbir G, Bozluolcay M, Ince B. Is the level of C-reactive protein correlated with the extent of carotid atherosclerosis? Acta Neurol Belg 2005; 105(2): 73–80.
24. Del Rincón I, Williams K, Stern MP, Freeman GL, O'Leary DH, Escalante A. Association between carotid atherosclerosis and markers of inflammation in rheumatoid arthritis patients and healthy subjects. Arthritis Rheum 2003; 48(7): 1833–1840.
25. Blackburn R, Giral P, Bruckert E, André JM, Gonbert S, Bernard M et al. Elevated C – reactive protein constitutes an independent predictor of advanced karotid plaques in dyslipidemic subjects. Arterioscler Tromb Vasc Biol 2001; 21(12): 1962–1968.
26. Schillinger M, Exner M, Mlekusch W, Sabeti S, Amighi J, Nikowitsch R et al. Inflammation and Carotid Artery-Risk for Atherosclerosis Study (ICARAS). Circulation 2005; 111(17): 2203–2209.
27. Vlachová I, Herzig R, Vaverková H, Novotný D, Krcová V, Bártková A et al. Prediktivní hodnota ultrasenzitivního C-reaktivního proteinu u cévní mozkové příhody a jeho vztah k ateroskleróze karotid. Cesk Slov Neurol N 2007; 70/103(1): 49–55.
28. Sniderman AD, Scantlebury T, Cianflone K. Hypertriglyceridemic HyperapoB: The Unappreciated Atherogenic Dyslipoproteinemia in Type 2 Diabetes Mellitus. Ann Intern Med 2001; 135(6): 447–459.
29. Williams K, Sniderman AD, Sattar, D’Agostino, Wagenknecht LE, Haffner SM. Comparison of the Associations of Apolipoprotein B and Low-Density Lipoprotein Cholesterol With Other Cardiovascular Risk Factors in the Insulin Resistance Atherosclerosis Study (IRAS). Circulation 2003; 108(19): 2312–2316.
30. Wallenfeldt K, Bokemark L, Wikstrand J, Hulthe J, Fagerberg B. Apolipoprotein B/apolipoprotein A-I in relation to the metabolic syndrome and change in carotid artery intima-media thickness during 3 years in middle-aged men. Stroke 2004; 35(10): 2248–2255.
31. Stewart BF, Brown BG, Zhao XQ, Hillger LA, Sniderman AD, Dowdy A et al. Benefits of lipid-lowering therapy in men with elevated apolipoprotein B are not confined to those with very high low density lipoprotein cholesterol. J Am Coll Cardiol 1994; 23 : 899–906.
32. Pedersen TR, Olsson AG, Faergeman O, Kjekshus J, Wedel H, Berg K et al. Lipoprotein changes and reduction in the incidence of major coronary heart disease events in the Scandinavian Simvastatin Survival Study (4S). Circulation 1998; 97(15): 1453–1460.
33. Gotto AM Jr, Whitney E, Stein EA, Shapiro DR, Clearfield M, Weis S et al. Relation between baseline and on-treatment lipid parameters and first acute major coronary events in the Air Force/Texas Coronary Atherosclerosis Prevention Study (AFCAPS/TexCAPS). Circulation 2000; 101(5): 477–484.
34. Sramek A, Reiber JH, Baak-Pablo R, Sturk A, Rosendaal FR. Lipoprotein(a) and ultrasonographically determined early atherosclerotic changes in the carotid and femoral artery. J Thromb Haemost 2003; 1(2): 374–379.
35. Wissen S, Smilde T J, Boo TT, Kastelein JJP, Stalenhoef AFH. Long term statin treatment reduces lipoprotein(a) concentrations in heterozygous familial hypercholesterolaemia. Heart 2003; 89(8): 893–896.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2008 Issue 3
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine Eases Daily Life for Patients and Caregivers
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
-
All articles in this issue
- Přínos vyšetření čichu v časné diagnostice demencí neurodegenerativní etiologie
- Analýza pulzové vlny v objektivizaci bolesti – předběžné sdělení
- Kvalita života u pacientů po subarchnoidálním krvácení – roční katamnéza
- Retrospektivní analýza nálezů zrakových evokovaných potenciálů při akutním zánětu zrakového nervu
- Laboratorní ukazatele neurodegenerace v likvoru a míra motorického postižení u Parkinsonovy nemoci: korelační studie
- Doporučený postup sekundární prevence recidivy po akutní cévní mozkové příhodě: mozkovém infarktu/tranzitorní ischemické atace a hemoragické cévní mozkové příhodě
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Depersonalizace a derealizace – současné nálezy
- Sexuální dysfunkce u žen s epilepsií a jejich příčiny
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
- Asociace vybraných rizikových faktorů s tíží aterosklerotického postižení v karotické bifurkaci
- Funkce pravé komory srdeční a výskyt plicní hypertenze u pacientů se syndromem obstrukční spánkové apnoe
- Tau-protein, fosforylovaný tau-protein a beta-amyloid42 v likvoru u demencí a roztroušené sklerózy
- Migréna v těhotenství
- Sporadický „guamský parkinsonský komplex“ nebo koincidence více neurodegenerativních onmocnění?
- Použití DTI traktografie v neuronavigaci při operacích mozkových nádorů: kazuistiky
- Management ischemické cévní mozkové příhody a tranzitorní ischemické ataky – doporučení European Stroke Organisation (ESO) 2008 – zestručněná česká verze
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Depersonalizace a derealizace – současné nálezy
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Migréna v těhotenství
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií