Emoční paměť – patofyziologie a klinické souvislosti
Emotional Memory – Pathophysiology and Clinical Associations
The amygdala is the main structure involved in emotional memory. This independent memory system is linked to emotional events and interacts with other brain structures (hippocampus, prefrontal cortex, hypothalamus), affecting final memories. Emotional memory is a non--declarative memory but relates to and cooperates with declarative memory. In some pathological states, characterized by amygdalar atrophy and dysfunction, a variety of changes have been reported, including memory deficits of both systems, behavioral changes and reduced attention span. This results in reduced patient quality of life and a greater burden on caregivers. This applies, for example, to patients with Alzheimer’s disease as they have great difficulty with emotional face recognition.
Key words:
emotional memory – amygdala – memory deficits – Alzheimer‘s disease
Authors:
I. Mokrišová 1; M. Vališ 2; J. Hort 1,3
Authors‘ workplace:
Kognitivní centrum, Neurologická klinika 2. LF UK a FN v Motole, Praha
1; Oddělení urgentní medicíny, FN Hradec Králové
2; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
3
Published in:
Cesk Slov Neurol N 2012; 75/108(5): 546-551
Category:
Review Article
Overview
Amygdala je hlavní strukturou odpovědnou za emoční paměť. Tento nezávislý paměťový systém, vázaný na emoční prožitek interaguje i s dalšími mozkovými strukturami (hipokampus, prefrontální kůra, hypothalamus), a ovlivňuje tak výslednou paměťovou stopu. Emoční paměť řadíme do nedeklarativní paměti, avšak úzce souvisí a spolupracuje s pamětí deklarativní. V případě poruchy funkce amygdaly dochází k poruchám paměti nedeklarativní i deklarativní, k poruchám pozornosti a chování. Celkově se pak snižuje kvalita života pacienta a zvyšuje zátěž pečujících. To je významné např. u pacientů s Alzheimerovou chorobou, kteří mají problém s rozeznáním emočního náboje obličejů.
Klíčová slova:
emoční paměť – amygdala – poruchy paměti – Alzheimerova choroba
Úvod
Paměť a proces učení byly od pradávna předmětem studia mnoha vědních oborů. Za zásadní pro kvalitu života pacienta byla vždy považována paměť deklarativní. V poslední době se k tomuto problému postoj změnil a zdůrazňuje se také význam paměti nedeklarativní. Tento článek se snaží shrnout doposud získané znalosti právě o jednom z typů nedeklarativní paměti – emoční paměti, jejích poruchách a klinických projevech u pacientů s neurodegenerativními chorobami.
Paměť – základní dělení
Paměť je schopnost ukládat, uchovávat a vybavovat informace v mozku. Můžeme ji dělit podle mnoha hledisek. Nejběžnější dělení je na paměť deklarativní a paměť nedeklarativní, kdy základním rozdílem je, zda je nebo není paměť vědomě vybavitelná.
Deklarativní (explicitní) paměť je vědomě vybavitelná, uchovává vzpomínky a faktické znalosti. Je verbálně vyjádřitelná a úzce souvisí s činností hipokampu. V rámci deklarativní paměti se vymezují ještě dva typy: sémantická a epizodická. Sémantická paměť obsahuje obecná fakta, bez vztahu k místu či času vytvoření. Epizodická paměť uchovává informace o tom, co se stalo, kde se to stalo a kdy se to stalo. Právě časový údaj (kdy?) je pro její definování klíčový. Obsahuje informace ze života jedince a kombinuje epizodickou složku se sémantickou.
Nedeklarativní (implicitní) paměť naproti tomu je paměť, kde jsou paměťové stopy ovlivněné předchozím chováním a zkušenostmi. Zahrnuje především procesy na nevědomé úrovni, týká se i osvojování některých motorických a percepčních dovedností (např. chůze), neasociativního učení (habituace a senzitizace), asociativního učení (klasické podmiňování), nebo primingu. Podle tohoto dělení zařazujeme emoční paměť mezi paměť nedeklarativní. Existují samozřejmě i jiné klasifikace: dle časového hlediska (krátkodobá a dlouhodobá), struktury (okamžitá, recentní, dlouhodobá), procesu formování, mechanizmu tvorby, způsobu zapamatování a jiné.
Tradičně byla v popředí zájmu deklarativní paměť, kdy se předpokládal její zásadní vliv na kvalitu života. V poslední době se ukazuje, že paměť nedeklarativní, tedy i paměť emoční, hraje také velmi důležitou roli. Zásadní je její účast na vzniku behaviorálních poruch u neurodegenerativních onemocnění, vzniku poruch pozornosti, celkové kontrole odpovědi organizmu ve stresových situacích i regulaci explicitní paměti.
Anatomické koreláty paměti
Paměť je složitý proces, který využívá několik systémů a podle typu paměti ukládá zkušenosti a informace v různých oblastech mozku. Velký průlom v této problematice znamenala práce Brendy Milnerové [1], která popsala poruchy paměti u pacienta, jenž v devíti letech utrpěl kraniocerebrální trauma a postupně se u něj rozvinula farmakorezistentní epilepsie. U tohoto pacienta bylo kvůli nezvladatelným epileptickým záchvatům přistoupeno k operativnímu odstranění hipokampů a přilehlých temporálních oblastí, včetně amygdaly, což mělo za následek selektivní postižení paměti. Klíčovou strukturou deklarativní paměti je právě tato mediální temporální oblast. Hipokampus je jakousi bránou deklarativní paměti, do které se dostávají všechny informace zachycené v dalších korových centrech, jsou zde zpracovány a dále převedeny do asociačních oblastí mozkové kůry, kde dojde k jejich uložení. Důležitá jsou propojení i s dalšími oblastmi. Při poruchách sémantické paměti jsou rozsáhlé léze v oblasti temporální, parietální, částečně i okcipitální. Procedurální paměť je úzce spojena se subkortikálními okruhy, především mozečku a bazálních ganglií. Emoční paměť je pak spojována s amygdalou.
Patofyziologie
Poškození a změny těchto oblastí, strukturální, metabolické, změny v neuromediátorových systémech, vedou k poruchám učení a paměti, rozvíjí se amnestický syndrom nebo syndrom demence. K tomuto fenoménu dochází při řadě neurodegenerativních chorob, jako jsou Alzheimerova nemoc (AN) [2–5], choroba Lewyho tělísek nebo frontotemporální lobární degenerace (FTLD). Příčinou mohou být alkoholizmus, metabolické dysbalance, traumata, tumory a záněty.
Jak již bylo výše uvedeno, v popředí zájmu byla vždy paměť deklarativní a i při diagnostice poruch paměti se využívají neuropsychologické postupy testující epizodickou a sémantickou paměť [2]. Nejvíce používaný je Mini Mental State Examination test. Ten by měl být spíše chápán jako bed-side test, který sice odliší středně těžkou demenci od normální populace, ale selhává v diagnostice časných stadií demence a mírné kognitivní poruchy (MCI). Ze senzitivnějších testů je možné využít Adenbrook Cognitive Examination (ACE) [5], Montreal Cognitive Assessment (MOCA), Grober a Buschkého test 16 slov, Paměťový test učení (AVLT), Bentonův retenční test, Wechslerovu paměťovou škálu a další. Amygdalární funkce se bohužel běžnými skríningovými testy, jako jsou MMSE nebo Adenbrook Cognitive Examination, nevyšetřují [5]. Vyšetření kognitivních funkcí vázaných na amygdalu stojí stranou zájmů většiny běžně užívaných neuropsychologických instrumentů [6].
Diagnostice AN pomáhají také biomarkery (metabolické, strukturální, genetické), které ale samostatně pro diagnostiku nepostačují a je nutné je interpretovat v kontextu klasické diagnostické rozvahy. Příkladem je vyšetření likvoru (Aβ a tauprotein), MR volumometrie [7,8], zobrazovací metody na hypometabolizmus (PET) a hypoperfuzi (SPECT). Dnes je ale jasné, že na vznik symptomů a kvalitu života pacientů nemají vliv pouze poruchy deklarativní paměti. Časný je deficit emocí, behaviorální poruchy, ale také poruchy emoční paměti.
Demence nejsou omezeny jen na kognitivní poruchy a porucha kognice naopak nemusí být hlavní problém, který obtěžuje pacienta a jeho okolí a zhoršuje jejich kvalitu života. V takovém komplexním pojetí se používá koncepce „ABC“, kde je v souhrnu příznaků vnímána triáda: Activities of daily living (aktivity denního života), Behaviour changes (poruchy chování), Cognition (kognitivní funkce).
Emoční paměť
Změny emocí se projevují v podobě přechodných změn v činnosti mozkových struktur, které jsou doprovázeny subjektivně libým nebo nepříjemným pocitem, a zároveň jsou ještě doprovázeny somatickými příznaky, jež ovlivňuje autonomní nervový systém. Pokud se emoční stimul opakuje, vytvoří se paměťová stopa a celá reakce organizmu probíhá rychleji, nevědomě. Spojením amygdaly s dalšími mozkovými strukturami ale vznikají také vzpomínky explicitní, to znamená, že si člověk přesně vzpomene, proč v něm daná situace právě tyto pocity vyvolává.
Emoční paměť zahrnuje dva systémy: vědomá paměť na emoce je zprostředkována hipokampem a amygdala je potom odpovědná za emoční odpověď. Amygdala i hipokampus, struktury mediálního temporálního laloku, jsou dva nezávislé paměťové systémy, každý s jedinečnými charakteristickými funkcemi během emoční situace. Amygdala má specifickou schopnost ovlivnit jak vyvolání, tak i uložení vzpomínky závislé na hipokampu. Podobně hipokampus, který formuje explicitní vzpomínku na událost, může ovlivnit vybavení paměťové stopy závislé na amygdale [9–12].
Emoční zážitek je nejdříve zpracován senzorickým systémem a dále pak v mediálních temporálních strukturách [9–12]. Senzorický systém podnět zpracuje, v hipokampu je po zpracování uložena explicitní vzpomínka na podnět a amygdala je odpovědná za emoční odpověď na tuto vzpomínku [13–16].
Důkazy, že oba systémy jsou nezávislé, pocházejí ze studií pacientů s fokálním postižením amygdaly či hipokampu. Bechara et al se zabývali klasickým podmiňováním, kdy po vizuálním (modrý čtverec) nebo zvukovém stimulu následoval bolestivý podnět. Pacienti s lézí amygdaly nevykazovali normální autonomní odpověď organizmu typickou pro strach, ale byli schopni explicitně vyjádřit, že po modrém čtverci bude následovat bolestivý podnět. Naopak pacienti s poškozeným hipokampem předvedli opačnou reakci [17–19]. Autonomní odpověď organizmu odpovídala strachu, ale nebyli schopni určit, z čeho fakticky mají strach. To potvrzuje, že oba paměťové systémy jsou funkčně nezávislé, ale navzájem se ovlivňují. Stejně tak, pokud se člověk vrátí do místa nehody. Místo mu připomene onu nehodu a člověk si vzpomene, kam jel, s kým jel a další podrobnosti o této události – toto je explicitní paměť zajištěná hipokampem a dalšími strukturami paměťového systému čelního laloku. Kromě toho dochází ke zvýšení krevního tlaku a srdeční frekvence. To už je proces emoční paměti, na kterém se výrazně podílí amygdala. Vzpomínka, na jejímž uložení se podílejí oba systémy, je uložena lépe než jiné.
U pacientů s poruchou amygdaly koreluje schopnost zapamatovat si určitou situaci s amygdalárním objemem, což dokazují ve své práci Mori et al [16]. Ti porovnávali objem amygdaly a poruchu emoční paměti u pacientů s AN, kteří zažili silný emoční zážitek v podobě zničujícího zemětřesení v Kobe v roce 1995. Pacientům byl předložen dotazník týkající se zemětřesení, který byl rozdělený do tří částí a každá část měla ještě další tři podčásti. První část se týkala vybavení této události. Pokud si pacient správně vzpomněl na zemětřesení, pokračovalo se dále v testu. Druhá část byla zaměřena na osobní zkušenosti, které byly konzultovány s rodinou pacientů nebo jejich pečovateli. Poslední část testu se týkala všeobecně známých faktů o celé události. Za každou správnou odpověď se přidělil jeden bod. Celkový počet bodů se potom porovnal s objemem struktur za paměť odpovědných. 86 % pacientů si na zemětřesení vzpomnělo. Dále ale pacienti dosahovali vyššího skóre ve druhé části dotazníku než v části třetí. Výsledky naznačily, že porucha emoční paměti se odvíjí od intenzity poškození amygdaly, a tato práce tak poskytla důkazy o zásadním významu amygdaly v procesu emoční paměti.
Amygdala se také podílí na podmíněné chuťové averzi, což je jediný způsob učení, který může probíhat i v bezvědomí, např. při otravách [19]. Jedná se o zvláštní druh učení, při němž je spojena chuť anebo situace, kdy došlo k pozření potravy, s následným dyskomfortem, který je projevem otravy. Jedinec se pak dané chuti nebo situaci vyhýbá, aby minimalizoval riziko otravy. Vzhledem k biologické významnosti se paměťová stopa může vytvořit i v bezvědomí.
Otázkou tedy je, jak se amygdala a hipokampus navzájem v emoční situaci ovlivňují. Jak může amygdala ovlivnit epizodickou paměť formovanou hipokampem? Všeobecně se uznává, že vzpomínky na situace, které vyvolávají v člověku emoce, jsou silnější a jasnější než ostatní [20]. Prvním krokem při uchovávání vzpomínek je uložení prvotního stimulu. Nicméně už v tomto okamžiku může působit mnoho faktorů, které rozhodnou o tom, jak dobře bude podnět uložen. Mezi tyto faktory patří například pozornost.
Zhoršená pozornost je u pacientů s AN jednou z prvních klinických známek svědčících pro kognitivní deficit. Pacienti nejsou schopni si zapamatovat, co dělali před chvílí, je pro ně často velmi těžké vyhovět pokynům a úkolům z okolí, nesoustředí se dobře, neudrží dostatečně dlouho pozornost, takže učení se novým věcem je pro ně velmi komplikované a vyžaduje velkou trpělivost. Zhoršená pozornost může sloužit jako marker v časné diagnostice kognitivních poruch u starších osob.
V jedné ze studií [21] zabývajících se touto problematikou byla snaha stanovit reakční čas u třech skupin pacientů (zdraví, MCI, AN). Reakční čas lze určit ve dvou formách, dle toho lze posoudit psychomotorické tempo a cílenou pozornost. U AN je pozornost porušena. Ze studie ale vyplývá, že je tomu tak i u MCI pacientů. Rozdíl v reakčních časech je mezi skupinou zdravých a nemocných s AN velký. Stejně tak je ale reakční čas prodloužen u pacientů s MCI v porovnání se zdravými. Amygdala ovlivňuje pozornost díky funkčním spojům s frontálním kortexem. Pokud je tedy podnět doprovázen emocí, zlepší se tím i pozornost [22].
Dalším důvodem poklesu pozornosti u pacientů s AN je progredující ztráta cholinergních neuronů [23] a jejich kortikální projekce. Cholinergní deficit přispívá ke kognitivním poruchám, poklesu pozornosti a koncentrace, rychlosti zpracování informací.
Amygdala má reciproční spoje také se senzorickou zrakovou kůrou a bylo zjištěno, že pokud zrakový vjem obsahuje emoční náboj – např. pokud podnět obsahuje nějakým způsobem vyjádřené emoce (strach ve tváři, štěstí), dojde k její zvýšené aktivitě [24,25]. Odpověď amygdaly na zrakový podnět z okolí probíhá velmi rychle, ještě před samotným uvědoměním a hlavně bez ohledu na stav pozornosti. Tímto mechanizmem skrze zpětné spoje se zrakovou kůrou se může zvýšit celkové vnímání.
Další pozorovaný vliv amygdaly je na konsolidaci vzpomínek. Konsolidace je druhou fází při zpracování explicitní vzpomínky hipokampem a amygdala ovlivňuje i tento krok [15]. Explicitní vzpomínky závislé na hipokampu nejsou do paměti ukládány způsobem „vše, nebo nic“. Po uložení nastane období, kdy snadno podléhají poškození. Konsolidace je tedy proces zpracování vzpomínky v časovém úseku od prvotního uložení podnětu po finální vzpomínku. Jedním z možných důvodů, proč proces konsolidace vzpomínek trvá tak dlouho, je, aby emoční náboj podnětu mohl proces konsolidace ovlivnit [24]. Vzpomínky, které jsou doprovázeny i silnou emoční složkou, jsou lépe uchovávány.
Problematikou emoční paměti u pacientů s poškozením amygdaly se zabývaly i jiné práce. Potvrdily stěžejní úlohu amygdaly v procesu emoční paměti a též, že porucha emoční paměti se odvíjí od intenzity poškození této struktury [15]. Při reakci na podnět s emočním podtextem často následuje vzestup stresových hormonů [13,14,26–30]. Pokud podnět dokáže vyvolat emoční odpověď, která je adekvátní emoční odpovědi organizmu v situacích, kdy jde o přežití jedince, či jinak emočně vypjaté situaci, tehdy jsou podněty nejlépe zapamatovány [15].
Mechanizmus tohoto působení amygdaly je vysvětlován tím, že amygdala má spoje i do oblasti paraventrikulárního hypothalamu. Skrz toto spojení dochází k uvolnění ACTH z hypofýzy, ten se cirkulací dostane do nadledvin, které stimuluje k produkci glukokortikoidů.
Glukokortikoidy mají na paměť komplexní efekt. V případě, že je člověk v mírné stresové situaci nebo je stresu vystaven intermitentně, je hladina glukokortikoidů zvýšena jen mírně. Taková mírně zvýšená hladina hormonů zlepšuje explicitní paměť aktivací hipokampu. Nicméně stres a citové rozrušení není odpovědné pouze za vznik silných vzpomínek. Pokud je stres chronický nebo podnět velmi emočně nabitý, funkce hipokampu, amygdaly a s nimi propojených částí mozku je zhoršena. Důsledkem pak mohou být i poruchy nálad a úzkostné stavy. Zásadní je role noradrenalinu a jeho působení na receptory bazolaterální části amygdaly. Ten má pravděpodobně hlavní modulační účinek na konsolidaci vzpomínek, naopak například oxytocin tvorbu paměťové stopy oslabuje. Je v zájmu opakované reprodukce, aby si žena nepamatovala bolest při porodu. Celá problematika je ale mnohem složitější a celé budoucí studium se bude muset zaměřit komplexně na celé neuronové sítě, abychom byli schopni tyto složité interakce pochopit.
Předpoklad, že i ve fázi konsolidace vzpomínek se uplatňuje vliv amygdaly, a to hlavně díky zvýšené hladině stresových hormonů, je podpořen studiemi na zvířatech i studiemi u lidí [14]. Ukázalo se, že působení betablokátorů má stejný vliv na úroveň epizodické paměti [31], jako kdyby byla poškozena amygdala [31–33]. Další studie, při kterých bylo použito následně po nějakém podnětu pro zvýšení hladiny glukokortikoidů farmakologických preparátů [34] nebo bolestivého podnětu [35], ukázaly, že takový podnět byl lépe uložen a vzpomínky na něj byly silnější. Všechny tyto výsledky silně potvrzují, že emoce může pozměnit uložení emoční události a podporují představu, že amygdala ovlivňuje také proces upevnění explicitní vzpomínky, za který je odpovědný hipokampus.
Další zajímavou otázkou v této oblasti je problematika pravé a levé amygdaly a vlivu na paměť. Poslední studie založené na zobrazovacích metodách ukázaly, že levá nebo pravá amygdala může proces ukládání informací ovlivňovat odlišně v závislosti na pohlaví pozorovaného subjektu. Levá amygdala koreluje s procesem zpracování a uchovávání vzpomínek u žen, naopak pravá amygdala je odpovědná za tyto procesy u mužů [35–37]. Lze také předpokládat, že tato lateralita může mít vliv na volbu strategie při zpracování podnětu.
Většina výzkumů se zabývá otázkou, jak amygdala ovlivňuje explicitní paměť, ale objevily se i důkazy o tom, že i hipokampus může ovlivňovat amygdalu, a tedy paměť nedeklarativní. V typické situaci, kdy dochází k podmiňování strachu, se člověk učí, že neutrální podnět může předznamenávat nepříjemný zážitek. Tento způsob učení je u lidí nejčastější. Např. pokud někoho pokouše sousedův pes a on ho potká podruhé, spustí se fyziologická reakce, která odpovídá strachu. U lidí je ale možné se o emočním náboji dané události naučit i z okolí skrze jiné prostředky, třeba verbální komunikací. Jde o schopnost vědomě regulovat emocionální reakce. Přesně stejnou reakci může člověk vykazovat, pokud ho někdo nejdříve upozorní na to, že by pes mohl někoho pokousat. I v této situaci, pokud psa člověk potom uvidí, projeví se ta samá odpověď – strach.
O kontrole emocí vůlí je toho známo pouze málo. Existují ale studie, které za použití fMR, při pokusu o volní ovlivnění, prokázaly zvýšenou aktivitu laterální a mediální prefrontální oblasti, které zřejmě navodily sníženou aktivitu v amygdale a mediální orbito-frontální kůře. To podpořilo hypotézu, že prefrontální kůra se podílí na modulaci zpracování emocí. Takový způsob ovlivnění emocí vůlí je ale u pacientů s AN omezen. Důvodem je poškození hipokampu (hipokampální formace, entorinální kůry a parahipokampální bílá hmota) [36,38–40], jak je vidět i na obr. 1. Pomocí studie, která využívala MR a SPECT, byla prokázána atrofie a porucha krevního zásobení těchto struktur [36]. Poškození struktur koreluje s tíží onemocnění. Klinicky se tyto poruchy projevují poruchou deklarativní paměti, z počátku především pamětí krátkodobou, později i dlouhodobou a poruchou učení nových dovedností a postupů (nedeklarativní složka).
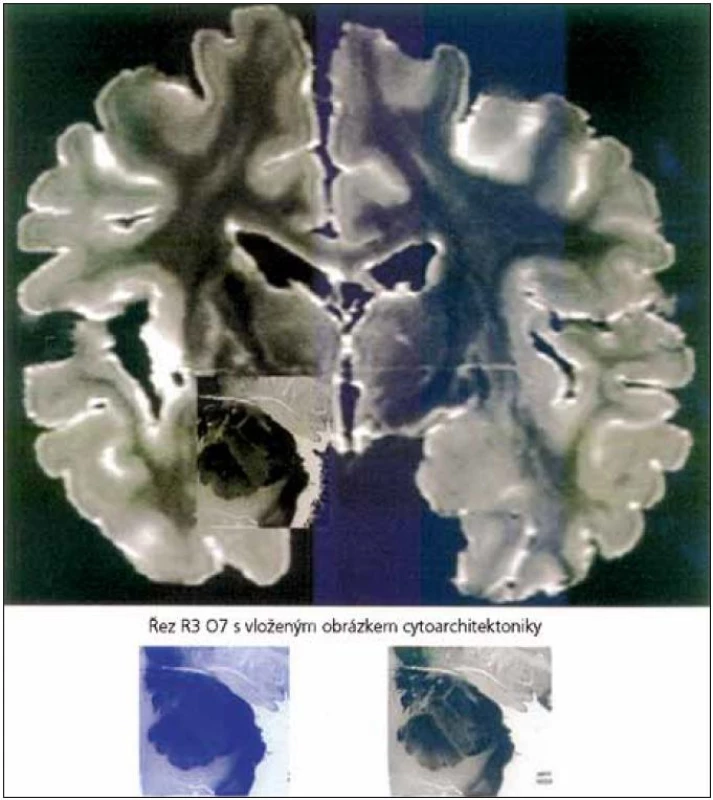
Schopnost regulace vlastních emocí tedy vyžaduje spolupráci amygdaly a hipokampu. U neurodegenerativních onemocnění musíme zvažovat poruchu regulace emocí. Poruchy chování u pacientů s AN jsou časté a v průběhu onemocnění se mění [10,41,42]. V souvislosti s poruchou regulace emocí u neurodegenerativních onemocnění se používá termín Behavioral and Psychological Symptoms of Dementia (BPSD). V praxi může například neschopnost pacienta s AN rozeznávat emoční náboj v obličeji pečovatele vést k úzkosti, agresivitě nebo i jiným BPSD.
BPSD se řadí mezi tzv. nekognitivní symptomy, které zhoršují aktivity denního života pacientů, urychlují kognitivní pokles a celkově zhoršují kvalitu života a zvyšují zátěž pacientů. Tato problematika je důležitá nejenom pro to, že tvoří jednu z hlavních komponent klinického obrazu pacienta, ale často je to jeden z hlavních důvodů, který vede k jeho institucionalizaci [42].
Etiologie BPSD není zcela jasná, mohou přispět biologické, patofyziologické, genetické, osobností faktory a faktory prostředí. Prevalence BPSD se pohybuje mezi 62 a 92 % [41] u pacientů s demencí a jsou časté i u pacientů s MCI. Nejčastěji jsou to poruchy spánku, apatie, dysforie, deprese, úzkost a beznaděj, nízká sebeúcta, změny sexuálního chování [42–44]. V patogenezi BPSD se uplatňuje souhra psychologických, sociálních a biologických faktorů [42]. Například byl pozorován častější výskyt depresí u ženského pohlaví.
Pro správnou diagnostiku a hodnoceni behaviorálních symptomů jsou nutné přístupy vyvinuté přímo pro tuto problematiku, pro pacienty s demencí [41] např. škálu Behave AD, NPI, MousePad a další postupy pro posouzení konkrétního chování, jakými jsou Cohen-Mansfield Agitation Inventory, Cornell Scale pro depresi, EURO-D stupnice pro deprese nebo Apathy Inventory. Nicméně ještě chybí specifické postupy pro hodnocení rozvoje halucinací a bludů. Při těchto testech se využívají tři různé přístupy, každý z nich má nějaké klady a zápory. Za prvé je možné použít zhodnocení situace přímo samotným pacientem, kde ale narážíme na problém subjektivity pozorování. Tito pacienti mají omezené povědomí o svém problému. Další přístup, který můžeme využít, je rozhovor s rodinným příslušníkem. Zde už je větší míra objektivity, má dobré povědomí o pacientovi, jeho denním režimu atd., na druhou stranu i tento přístup může být ovlivněn neprofesionalitou a charakterem vztahu k pacientovi. Poslední přístup, který můžeme k hodnocení behaviorálních a psychologických symptomů použít, je odborné posouzení odborníkem v oblasti poruch chování, zde ale nemůžeme těžit z celkových znalostí pacientova denního života. Mnohé z těchto symptomů se podaří zvládnout nefarmakologickou intervencí, ale u pacientů, kde to nelze nebo u těch, kteří vykazují závažné symptomy, je nutný farmakologický zásah. Za nejběžnější a nejúčinnější farmakologickou léčbu jsou považována atypická antipsychotika [45].
Zajisté je snaha ozřejmit, jak BPSD vznikají. Tady můžeme uvést práci Cummingse [46], který se zabýval přímo molekulární podstatou vzniku BPSD. Zdůrazňuje, že degenerativní onemocnění mozku souvisí především s poruchou metabolizmu bílkovin, s poruchou jejich produkce, degradace, intracelulární akumulací či produkcí neurotoxických proteinů, a právě porucha určitého proteinu potom klinicky odpovídá symptomu. Taupatie jsou tak spojovány s apatií, poruchy alfa-synukleinu s halucinacemi, zatímco u pacientů s AN vzniká komplexní porucha chování.
Rosen et al se snaží k odpovědi využít zobrazovací metody, kterými chtějí vysvětlit abnormální chování u pacientů s FTD a AN [44]. Ty odhalily významně atrofické oblasti ve ventromediálním frontálním kortexu, oboustranně v oblasti insuly a předním levém cingulu. U FTD byla navíc objevena atrofie pravého dorzolaterálního frontálního kortexu a levé premotorické kůry. U pacientů s AN naopak atrofie bilaterálně přední temporální kůry, amygdaly a přední oblasti hipokampu. Klinicky pacienti s FTD vykazují velké deprese, úzkosti, neklid, podrážděnost, desinhibici a sociální poruchy. Pacienti s AN naproti tomu více psychotických příznaků [44,45,47].
Další studie zjistily, že behaviorální a psychické poruchy u AN a MCI pacientů souvisí se změnami metabolizmu a perfuze mozkových struktur [45]. Hlavní rozdíl mezi pacienty, u kterých se objevovala apatie, a těmi, kteří apatiční nebyli, představovala signifikantně snížená perfuze v mediálním frontálním gyru. Takoví pacienti jsou potom v testech méně výkonní a nejsou schopni dobře rozdělit pozornost při úkonech. Existují i studie, které se zabývají vztahem mezi psychiatrickou symptomatologií u AN pacientů a stadiem demence [41]. Je třeba zdůraznit, že BPSD, hlavně tedy poruchy nálady a celkově depresivní ladění pacienta, by mohly být jedním z prvních markerů manifestace AN již ve stadiu MCI [41]. S progresí onemocnění klesá procento výskytu depresí, naopak ve zvýšené míře se u těchto pacientů objevuje agresivita a psychózy [41].
Závěr
Zásadní úlohu v emoční paměti má amygdala. Tato struktura je postižena atrofií u řady neurodegenerativních onemocnění, zejména u AN, a podílí na klinické symptomatologii pacientů. Poruchy paměti, poruchy pozornosti, specifické změny v chování a poruchy chování, to vše je s poruchou emoční paměti spjato. Amygdala je spojena s mnoha jinými mozkovými strukturami: s hipokampem, prefrontálním kortexem, hypothalamem, to vše se odráží na komplexním klinickém obrazu pacientů. Velmi zdůrazňované jsou funkční spoje amygdaly s hipokampem, kdy následkem postižení jejich spolupráce vzniká i porucha paměti deklarativní. Z praktického hlediska je zajímavá otázka včasného záchytu poruchy emoční paměti, ještě před plným rozvojem klinické symptomatologie u neurodegenerativních pacientů. Jistě by bylo výhodné mít specifické testy, které by byly zaměřeny na funkci amygdaly. Vyšetření těchto funkcí bohužel zatím stojí stranou zájmu většiny neuropsychologických instrumentů, ale do budoucna je to jistě jeden z možných cílů v této oblasti.
Práce byla podpořena grantem IGA NS 10331.
Autoři děkují MUDr. Aaronu Rulsehovi za korekturu abstraktu a MUDr. Jiřímu Brabcovi za laskavé zapůjčení obrázku. Za podporu autoři dále děkují European Regional Development Fund – Project FNUSA-ICRC (No. CZ.1.05/1.1.00/02.0123).
doc. MUDr. Jakub Hort, Ph.D.
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: jakub.hort@seznam.cz
Přijato k recenzi: 6. 6. 2011
Přijato do tisku: 5. 3. 2012
Sources
1. Milner B. The medial temporal-lobe amnesic syndrome. Psychiatr Clin North Am 2005; 28(3): 599–611.
2. Hort J, Vyhnálek M, Bojar M. Časná stádia demence – možnosti diagnostiky a léčby. Neurol Prax 2005; 6(6): 308–311.
3. Topinková E, Jirák R, Kožený J. Krátká neurokognitivní baterie pro screening demence v klinické praxi: sedmi minutový screeningový test. Interní Med 2002; 8(4): 368–391.
4. Ressner P, Hort J, Rektorová I, Bartoš A, Rusina R, Línek V et al. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a ostatních demencí. Cesk Slov Neurol N 2008; 71/104(4): 494–501.
5. Ahn IS, Kim JH, Kim S, Chung JW, Kim H, Kang HS et al. Impairment of instrumental activities of daily living in patients with mild cognitive impairment. Psychiatry Investig 2009; 6(3): 180–184.
6. Maruta C, Guerreiro M, De Mendonça A, Hort J, Scheltens P. The use of neuropsychological tests across Europe: the need for a consensus in the use of assessment tools for dementia. Eur J Neurol 2011; 18(2): 279–285.
7. Horinek D, Brezova V, Nimsky C, Belsan T, Martinkovic L, Masopust V et al. The MRI volumetry of the posterior fossa and its substructures in trigeminal neuralgia: a validated study. Acta Neurochir (Wien) 2009; 151(6): 669–675.
8. Horinek D, Hort J, Brabec J et al. The amygdala volume is decreased in patients with Alzheimer’s disease. Cesk Slov Neurol N 2005; 68/101 : 235–240.
9. Hummelová-Fanfrdlová Z, Rektorová I, Sheardová K, Bartos A, Línek V, Ressner P et al. Česká adaptace Addenbrookského kognitivního testu. Cesk Psychol 2009; 53(4): 376–388.
10. Horinek D, Varjassyova A, Hort J. Magnetic resonance analysis of amygdalar volume in Alzheimer’s disease. Curr Opin Psychiatry 2007; 20(3): 273–277.
11. Horinek D, Petrovicky P, Hort J, Krasensky J, Brabec J, Bojar M et al. Amygdalar volume and psychiatric symptoms in Alzheimer’s disease: an MRI analysis. Acta Neurol Scand 2006; 113(1): 40–45.
12. Langmajer M, Marešová D, Mourek J, Trojan S. Amygdala (morfologie, funkce, klinika). Psychiatrie 2006; 10 (Suppl 2): 32–34.
13. LeDoux J. The amygdala. Curr Biol 2007; 23; 17(20): R868–R874.
14. Cunningham-Bussel AC, Root JC, Butler T, Tuescher O, Pan H, Epstein J et al. Diurnal cortisol amplitude and fronto-limbic activity in response to stressful stimuli. Psychoneuroendocrinology 2009; 34(5): 694–704.
15. Schafe GE, Doyère V, LeDoux JE. Tracking the fear engram: the lateral amygdala is an essential locus of fear memory storage. J Neurosci 2005; 25(43): 10010–10014.
16. Mori E, Ikeda M, Hirono N, Kitagaki H, Imamura T, Shimomura T. Amygdalar volume and emotional memory in Alzheimer’s disease. Am J Psychiatry 1999; 156(2): 216–222.
17. Brabec J, Rulseh A, Hoyt B, Vizek M, Horinek D, Hort J et al. Volumetry of the human amygdala – an anatomical study. Psychiatry Res 2010; 182(1): 67–72.
18. Anderson AK, Phelps EA. Lesions of the human amygdala impair enhanced perception of emotionally salient events. Nature 2001; 411(6835): 305–309.
19. Bechara A, Tranel D, Damasio H, Adolphs R, Rockland C, Damasio AR. Double dissociation of conditioning and declarative knowledge relative to the amygdala and hippocampus in humans. Science 1995; 269(5227): 1115–1118.
20. Sroubek J, Hort J, Komarek V, Langmaier M, Brozek G. Acquisition and retrieval of conditioned taste aversion is impaired by brain camage caused by two hours of pilocarpine-induced status epilepticus. Physiol Res 2001; 50(6): 609–617.
21. LaBar K, Phelps EA. Role of the human amygdala in arousal mediated memory consolidation. Psychol Sci 1998; 9(6): 490–493.
22. Levinoff EJ, Saumier D, Chertkow H. Focused attention deficits in patients with Alzheimer’s disease and mild cognitive impairment. Brain Cogn 2005; 57(2): 127–130.
23. Ohman A, Flykt A, Esteves F. Emotion drives attention: detecting the snake in the grass. J Exp Psychol Gen 2001; 130(3): 466–478.
24. Fox E, Russo R, Bowles R, Dotton K. Do threatening stimuli draw or hold visual attention in subclinical anxiety? J Exp Psychol Gen 2001; 130(4): 681–700.
25. Phelps EA. Human emotion and memory: interactions of the amygdala and hippocampal complex. Curr Opin Neurobiol 2004; 14(2): 198–202.
26. Whalen PJ, Rauch SL, Etcoff NL, McInerney SC, Lee MB, Jenike MA. Masked presentations of emotional facial expressions modulate amygdala activity without explicit knowledge. J Neurosci 1998; 18(1): 411–418.
27. Brown ES. Effects of glucocorticoids on mood, memory, and the hippocampus. Treatment and preventive therapy. Ann N Y Acad Sci 2009; 1179 : 41–55.
28. Wolkowitz OM, Burke H, Epel ES, Reus VI. Glucocorticoids. Mood, memory, and mechanisms. Ann N Y Acad Sci 2009; 1179 : 19–40.
29. McGaugh JL. Memory – a century of consolidation. Science 2000; 287(5451): 248–251.
30. McGaugh JL, Roozendaal B. Role of adrenal stress hormones in forming lasting memories in the brain. Curr Opin Neurobiol 2002; 12(2): 205–210.
31. Cahill L, Babinsky R, Markowitsch HJ, McGaugh JL. The amygdala and emotional memory. Science 1995; 377(6547): 295–296.
32. Gilebus G, Lippa CF. The influence of beta-blockers on delayed memory function in people with cognitive impairment. Am J Alzheimers Dis Other Demen 2007; 22(1): 57–61.
33. Cahill L, Gorski L, Le K. Enhanced human memory consolidation with post-learning stress: interaction with the degree of arousal at encoding. Learn Mem 2003; 10(4): 270–274.
34. Cahill I, Haier RJ, White NS, Fallon J, Kilpatrick L, Lawrence C et al. Sex-related difference in amygdala activity during emotionally influenced memory storage. Neurobiol Learn Mem 2001; 75(1): 1–9.
35. Canli T, Desmond JE, Zhao Z, Gabrieli JD. Sex differences in the neural basis of emotional memories. Proc Natl Acad Sci U S A 2002; 99(16): 10789–10794.
36. Funayama ES, Grillon C, Davis M, Phelps EA. A double dissociation in the affective modulation of startle in humans: effects of unilateral temporal lobectomy. J Cogn Neurosci 2001; 13(6): 721–729.
37. Phelps EA, O’Connor KJ, Gatenby JC, Grillon C, Gore JC, Davis M. Activation of the left amygdala to a cognitive representation of fear. Nat Neurosci 2001; 4(4): 437–441.
38. Ochsner KN, Bunge SA, Gross JJ, Gabrieli JD. Rethinking feelings: an FMRI study of the cognitive regulation of emotion. J Cogn Neurosci 2002; 14(8): 1215–1229.
39. Hanyu H, Asano T, Kogure D, Sakurai H, Iwamoto T, Takasaki M. Relation between hippocampal demage and cerebral cortical fiction in Alzheimer’s disease. Nippon Ronen Igakkai Zasshi 2000; 37(11): 921–927.
40. Schaefer SM, Jackson DC, Davidson RJ, Aquirre GK, Kimberg DY, Thompson-Schill SL. Modulation of amygdalar activity by the conscious regulation of negative emotion. J Cogn Neurosci 2002; 14(6): 913–921.
41. Lopez OL, Becker JT, Sweet RA, Klunk W, Kaufer DI, Saxton J et al. Psychiatric symptoms vary with the severity of dementia in probable Alzheimer’s disease. J Neuropsychiatry Clin Neurosci 2003; 15(3): 346–353.
42. Robert PH, Verhey FR, Byrne EJ, Hurt C, De Deyn PP, Nobili F et al. Grouping for behavioral and psychological symptoms in dementia: clinical and biological aspects. Consensus paper of the European Alzheimer disease consortium. Eur Psychiatry 2005; 20(7): 490–496.
43. Shimabukuro J, Awata S, Matsuoka H. Behavioral and psychological symptoms of dementia characteristic of mild Alzheimer patients. Psychiatry Clin Neurosci 2005; 59(3): 274–279.
44. Rosen HJ, Gorno-Tempini ML, Goldman WP, Perry RJ, Schuff N, Weiner M et al. Patterns of brain atrophy in frontotemporal dementia and semantic dementia. Neurology 2002; 58(2): 198–208.
45. Cummings JL. Toward a molecular neuropsychiatry of neurodegenerative diseases. Ann Neurol 2003; 54(2): 147–154.
46. Lopez OL, Gonzales MP, Becker JT, Reynolds CF, Sudilovsky A, Dekosky ST. Symptoms of depression and psychosis in Alzheimer’s disease and frontotemporal dementia: Exploration of underlying mechanisms. Cogn Behav Neurol 1996; 9(3): 154–161.
47. Finkel SI. Behavioral and psychologic symptoms of dementia. Clin Geriatr Med 2003; 19(4): 799–824.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2012 Issue 5
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine Eases Daily Life for Patients and Caregivers
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
-
All articles in this issue
- Lze detekovat intrakraniální venózní reflux z transkondylárního přístupu? Výsledky studie s Fusion Imaging
- Náhrada defektu kalvy u dítěte po úrazu CNS biokompatibilním materiálem na míru – kazuistika
- Motorické stereotypie v dětském věku – kazuistiky
- Léčba spinálních paragangliomů – kazuistiky
- Amyotrofická laterální skleróza v zařízení paliativní hospicové péče – kazuistika
- Idiopatická stenóza akveduktu a porucha vývoje řeči u dětí s neurofibromatosis von Recklinghausen typ 1 – dvě kazuistiky
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Vliv malých dávek vína či jiných alkoholických nápojů na lidské zdraví a délku života
- Emoční paměť – patofyziologie a klinické souvislosti
- Endovaskulární léčba intrakraniálních aneuryzmat – metodika, indikace, komplikace
- Validita a prediktivní hodnota skríningových testů u prediabetické a časné diabetické polyneuropatie
- Incidence a rizikové faktory pooperačního deliria
- Bezpečnost a účinnost intravenózní trombolytické terapie mozkového infarktu u pacientů nad 80 let věku
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
- Zhoršení kognitivních funkcí a snížení perfuze v kontralaterálním frontálním laloku u pacientů s lézí mozečku
- Baha jako řešení jednostranné hluchoty po operaci vestibulárního schwannomu
- Sekvestrace MBNL1 proteinu mutovaným ZNF9 mRNA v lymfocytech pacientů s myotonickou dystrofií 2. typu
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Motorické stereotypie v dětském věku – kazuistiky
- Emoční paměť – patofyziologie a klinické souvislosti
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
