Prediktory symptomatického intracerebrálního krvácení po systémové trombolýze mozkového infarktu
Predictors of Symptomatic Intracerebral Haemorrhage after Systemic Thrombolysis for Cerebral Infarction
Background:
Symptomatic intracerebral hemorrhage (SICH) following thrombolytic therapy for stroke is associated with a high rate of morbidity and mortality. The aim of our study was to demonstrate predictive value of SICH for good clinical outcome measured by modified Rankin scale (mRS) and to identify predictors of SICH in patients after systemic thrombolysis in the Czech Republic.
Methods:
Data collected from the SITS registry (Safe Implementation of Treatments in Stroke) of Czech patients treated with intravenous thrombolysis between February 2003 and February 2010 were analyzed with uni - and multivariate regression analysis. The outcome variable was SICH, defined as deterioration in NIHSS ≥ 4 points and intracerebral hemorrhage type 2 within 22–36 hours from the start of thrombolysis.
Results:
A total of 2821 patients with ischemic stroke were treated with intravenous thrombolysis. SICH were observed in 60 (2.1%) patients. Patients with SICH were by 87% less likely to reach mRS 0–1 three months after thee stroke (OR = 0.13; 95% CI 0.04–0.44). The following independent predictors of SICH were identified: baseline NIHSS >12 (OR 0.4; 95% CI 0.25–0.79), glucose (OR 1.1, 95% CI 1.03–1.18), congestive heart failure (OR 2.1; 95% CI 1.1–4.02), hypertension (OR 2.4; 95% CI 1.03–5.81).
Conclusions:
In the Czech Republic, the frequency of symptomatic bleeding after thrombolysis was similar to other countries. SICH significantly worsened prognosis of patients after thrombolysis. Patients with hypertension, higher glucose level, more severe stroke and presence of congestive heart failure were at higher risk of SICH. Our data are useful when stratifying the risk after intravenous thrombolysis.
Key words:
ischemic stroke – systemic thrombolysis – symptomatic intracerebral hemorrhage – predictors
Authors:
D. Václavík 1,2; R. Mikulík 3; P. Kadlecová 4; M. Bar 2; K. Blejchařová 1; R. Herzig 5; J. Neumann 6; O. Škoda 7; S. Peška 8; P. Ševčík 9
Authors‘ workplace:
Iktové centrum, neurologické oddělení, Vítkovická nemocnice a. s., Ostrava
1; Neurologická klinika LF OU a FN Ostrava
2; Mezinárodní centrum klinického výzkumu (ICRC), Neurologická klinika FN u sv. Anny v Brně
3; Mezinárodní centrum klinického výzkumu (ICRC), FN u sv. Anny v Brně
4; Komplexní cerebrovaskulární centrum, Neurologická klinika LF UP a FN Olomouc
5; Iktové centrum, Krajská zdravotní a. s. – Nemocnice Chomutov, o. z.
6; Iktové centrum, Nemocnice Jihlava p. o.
7; Komplexní cerebrovaskulární centrum, Neurologická klinika LF MU a FN Brno
8; Komplexní cerebrovaskulární centrum, Neurologická klinika LF UK a FN Plzeň
9
Published in:
Cesk Slov Neurol N 2012; 75/108(6): 715-720
Category:
Original Paper
Overview
Úvod:
Symptomatická intracerebrální hemoragie (SICH) po trombolytické léčbě mozkového infarktu je spojena s vysokou morbiditou a mortalitou. Cílem naší práce bylo ukázat vliv SICH na dobrý klinický výsledek měřený modifikovanou Rankinovou škálou (mRS) a dále nalézt prediktory SICH po systémové trombolýze u pacientů v České republice.
Materiál a metodika:
Pomocí jedno - a vícerozměrné regresivní analýzy byla analyzována data pacientů ze SITS registru (Safe Implementation of Treatments in Stroke), kteří byli trombolyzováni v České republice v období od února 2003 do února 2010. SICH bylo definováno jako intracerebrální hemoragie typu 2, 22–36 hod po začátku trombolýzy se zhoršením v NIHSS o škále ≥ 4 body.
Výsledky:
Za uvedené období bylo v České republice léčeno systémovou trombolýzou 2 821 pacientů s ischemickým iktem. U 60 (2,1 %) pacientů došlo k SICH. Pacienti, kterým bylo diagnostikováno SICH, měli o 87 % menší šanci, že dosáhnou mRS 0–1 po třech měsících od vzniku mozkového infarktu (OR = 0,13; 95% CI 0,04–0,44). Jako nezávislé prediktory SICH byly zjištěny: vstupní NIHSS > 12 (OR 0,4; 95% CI 0,25–0,79 ), hladina glykemie (OR 1,1; 95% CI 1,03–1,18), městnavé srdeční selhání (OR 2,1; 95% CI 1,1–4,02) a hypertenze (OR 2,4; 95 % CI 1,03–5,81).
Závěr:
V ČR byla frekvence výskytu symptomatického krvácení po trombolýze obdobná jako v ostatních zemích. SICH významně zhoršovalo prognózu pacientů po trombolýze. Pacienti s hypertenzí, vyšší hladinou glykemie, těžším neurologickým deficitem a s kardiálním selháváním mají zvýšené riziko krvácení. Tento poznatek může přispět ke stratifikaci rizika léčby po systémové trombolýze.
Klíčová slova:
mozkový infarkt – systémová trombolýza – symptomatická intracerebrální hemoragie – prediktory
R. Mikulík a P. Kadlecová jsou podporováni z Evropského fondu regionální rozvoje – Projekt FNUSA-ICRC (No. CZ.1.05/1.1.00/02.0123).
Poděkování patří všem lékařům a dalším pracovníkům, kteří mnoho let a bez nároku na odměnu ukládají údaje do SITS registru. Tato publikace je věnována především jim. Pro možnosti další analýzy a případné publikace z registru SITS kontaktujte národního koordinátora registru SITS Roberta Mikulíka (mikulik@hotmail.com).
Seznam spolupracovníků SITS Česká republika (v abecedním pořadí): Zdena Bajková, Ludmila Bláhová, Kateřina Blejchařová, Henryk Brzeżański, Helena Dvořáková, Jan Fajstauer, Jan Fiksa, Petr Geier, Emanuela Habrovanská, Lenka Hajduková, Monika Holíková, Pavel Houška, Květa Chotětovská, Jana Jankových, Jan Kábrt, Jana Kadlčíková, Lukáš Klečka, Sylva Klimešová, Ondřej Kočí, Stanislav Kopecký, Vladislav Kopecký, Lenka Kouřilová, Martin Koutný, Martin Kovář, Martin Krobot, Barbora Křiváková, Marian Kuchár, Ctirad Lakomý, Alena Lapáčková, Jiří Loučka, Aleš Novák, Jiří Neumann, Tomáš Peisker, Marek Pernička Stanislav Peška, František Pfeifer, Richard Plný, Petr Procházka, Martin Roubec, Jaroslav Říman, Daniel Šaňák, Petr Ševčík, Vladimir Šigut, David Školoudík, Stanislav Slavík, Jiří Stehlík, Petr Štěpán, Martin Vančura, Helena Vančurová, Peter Vaško, Květoslava Večeřová, Milada Urbančíková.
Úvod
Trombolytická terapie pomocí tkáňového aktivátoru plazminogenu (rtPA) do 4,5 hod po nástupu iktu zlepšuje dle klinických studií (NINDS, ECASS) [1] výsledný klinický stav u pacientů s akutním mozkovým infarktem. Tyto výsledky byly potvrzeny i analýzou trombolytického registru SITS (Safe Implementation of Treatments in Stroke) [2]. V SITS registru bylo ve státech Evropské unie do listopadu 2011 registrováno 59 632 pacientů v 1 273 centrech.
Symptomatické intrakraniální krvácení je obávanou komplikací trombolytické léčby ischemického iktu. V současné době se používá 5stupňová klasifikace krvácení po trombolýze (tab. 1). V registru SITS je za SICH považováno krvácení typu PH2, které vede ke zhoršení NIHSS o 4 a více bodů. Cílem naší práce bylo zjistit na základě analýzy dat, která nám poskytuje trombolytický registr SITS, percentuální výskyt SICH v ČR, analyzovat vztah mezi výskytem SICH a klinickým výsledkem (mRS 0–1, po 3 měsících) a identifikovat faktory, které predikují výskyt SICH u pacientů léčených systémovou trombolýzou v České republice.

Soubor a metodika
Byla analyzována data pacientů vložených do SITS registru mezi 2/2003 a 2/2010. Metodologie byla popsána v předchozích publikacích [3–5]. Všichni pacienti vložení do registru měli akutní mozkový infarkt a byli léčeni intravenózní alteplázou v dávce 0,9 mg/kg [6]. Terapeutické okno bylo původně do 3 hod od vzniku příznaků a po zveřejnění výsledků studie ECASS III v září 2008 [7] bylo rozšířeno na 4,5 hod po nástupu příznaků. Závažnost neurologického deficitu při přijetí byla hodnocena podle National Institute of Health Stroke Scale (NIHSS). Přítomnost symptomatické intracerebrální hemoragie byla hodnocena podle následujících definicí:
- SICH podle definice SITS-MOST (Safe Implementation of Thrombolysis in Stroke-Monitoring Study) – lokální nebo vzdálené parenchymové krvácení typu 2 (tj. > 30 % hemoragicky infarzované oblasti) na CT/MR 22–36 hod po léčbě v kombinaci se zhoršením neurologického deficitu ≥ 4 body NIHSS ve srovnání s výchozím nebo vedoucím ke smrti.
- SICH podle definice NINDS (the National Institute of Neurological Disorders and Stroke study) – krvácení dokumentované na CT v časové souvislosti se zhoršením klinického stavu pacienta (zhoršení NIHSS 1 bod a více) do 36 hod od začátku léčby.
- SICH podle definice ECASS II (the Second European-Australiasian Cooperative Acute Stroke Study) krvácení dokumentované na CT asociované se zhoršením neurologického deficitu (zhoršení NIHSS 1 bod a více) v prvních 24 hod trombolytické léčby.
Všichni pacienti podstoupili vstupní a kontrolní CT vyšetření za 24–48 hod po trombolytické terapii. Následující proměnné byly dokumentovány a použity pro analýzu: věk, pohlaví, anamnéza (vysoký krevní tlak, cukrovka, hyperlipidemie, kouření, prodělaná CMP v minulosti, fibrilace síní, městnavé srdeční selhání, užívání protidestičkové terapie, modifikovaná Rankinova škála – mRS skóre před iktem), dále vstupní charakteristiky (výchozí NIHSS skóre, systolický krevní tlak, glukóza, hmotnost pacientů, dávky tPA, čas zahájení léčby od nástupu příznaků, přítomnost ischemických změn na CT/MR), léčba v pracovní době (8–16 hod, po–pá), ošetření po 1. říjnu 2008 (dle výsledků ECASS 3), mRS po 3 měsících.
Statistika
Deskriptivní statistika byla použita pro charakteristiku všech pacientů. Pro adjustaci vzájemné závislosti mezi SICH na kontrolním CT mozku a mRS 0–1 za 3 měsíce byly použity tyto parametry:
- a) demografická a klinická data: věk, pohlaví, přítomnost rizikových faktorů, užívání antiagregační terapie, mRS skóre před CMP, výchozí NIHSS skóre, hodnota systolického krevního tlaku, hladina krevního cukru, hmotnost pacientů, celková dávka tPA, přítomnost časných ischemických změn na CT/MR mozku.
- b) organizační parametry: čas od nástupu příznaků do přijetí pacienta do nemocnice, čas od přijetí pacienta do nemocnice k zahájení léčby, skutečnost, že léčba proběhla v pracovní době (8–16 hod, po–pá) a léčba po 1. říjnu 2008.
Pro identifikaci prediktorů SICH byla rovněž použita jedno - a vícerozměrná logistická regresní analýza. Proměnné, které dosáhly hladiny významnosti p < 0,1 v jednorozměrné analýze, byly následně použity pro testování ve vícerozměrném logistickém modelu. Hladina statistické významnosti v konečném modelu byla určena jako p < 0,05.
Výsledky
V letech 2003–2010 bylo v České republice dle registru SITS léčeno systémovou trombolýzou celkem 2 821 pacientů. Demografická a vstupní klinická data pacientů ukazuje tab. 2. Výskyt SICH podle jednotlivých definicí byl následující: SICH-SITS 2,1 %, SICH-NINDS 7,5 % a SICH-ECASS 5,9 %. Pacienti se symptomatickým intracerebrálním krvácením a bez SICH dosáhli po 3 měsících dobrého výsledného klinického stavu (mRS 0–1) s následující pravděpodobností: 6,6 vs 46 % dle SITS definice, 7,6 vs 48,3 % dle NINDS definice, 5,4 vs 47,7 % dle ECASS II definice. Pacienti, u kterých došlo k výskytu SICH, měli ve vícerozměrné analýze po adjustaci na vstupní charakteristiky o 87 % menší šanci (OR = 0,13, 95% CI 0,04–0,44), že dosáhnou mRS (0–1) za 3 měsíce.
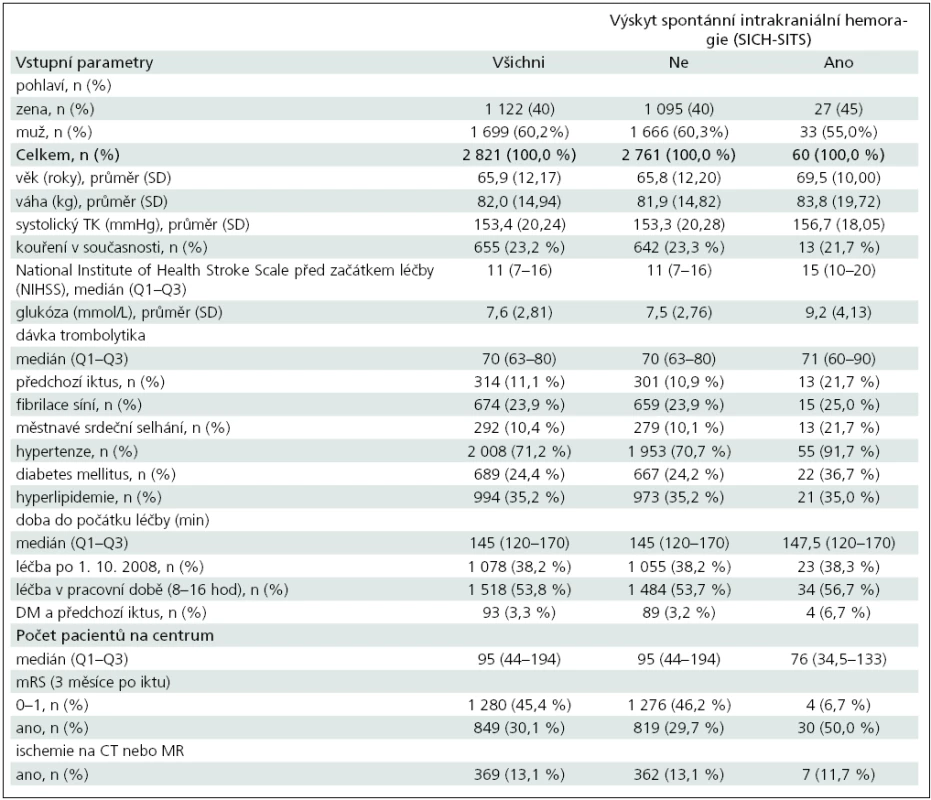
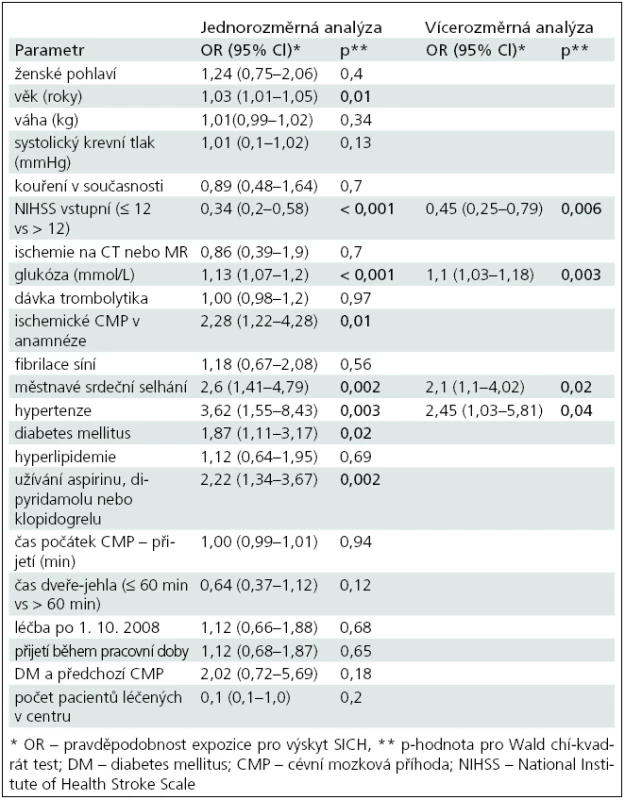
Výsledky logistické regresivní analýzy prediktorů SICH-SITS zobrazuje tab. 3. Vícerozměrná analýza ukázala jako statisticky významné následující ukazatele nezávislé na ostatních parametrech: NIHSS < 12 (OR 0,45; 95% CI 0,25–0,79), hladina glykemie (OR 1,1; 95% CI 1,03–1,18), městnavé srdeční selhání (OR 2,1; 95% CI 1,1–4,0), hypertenze (OR 2,45; 95% CI 1,03–5,8).
Diskuze
Naše studie ukázala, že v České republice mají pacienti po trombolýze riziko SICH 2,1 % dle definice SITS. Pravděpodobnost vzniku nejobávanější komplikace po trombolýze je tedy relativně malá. Navíc data z ČR velmi dobře odpovídají analýze celoevropského SITS registru, kdy byla incidence SICH 2 % z 6 483 pacientů [8]. Riziko SICH bylo obdobné v ČR jako jinde i při hodnocení SICH podle definicí NINDS a ECASS. Např. při srovnání s randomizovanými studiemi byla incidence SICH 6,4 % v NINDS a 8,9 % v ECASS II [9]. Pokud jsme incidenci SICH v našem souboru hodnotili podle definicí NINDS a ECASS, bylo procento krvácení 7,5, resp. 5,9 %. Hodnotíme-li pacienty v SITS-MOST a randomizovaných studiích (RS) podle stejných kritérií – zhoršení NIHSS o více než 1 bod do 7 dnů od příhody v přítomnosti jakéhokoliv krvácení, pak je incidence SICH stejná, 8,5 % (SITS MOST) vs 8,6 % (RS) [8]. V randomizovaných studiích byly hodnoceny jakékoliv projevy krvácení – tedy i drobná prokrvácení typu H1 H2 (tab. 1). Zhoršení klinického stavu u těchto pacientů může tudíž být spíše způsobeno progresí ischemie či mozkového edému než samotným prokrvácením. Proto jsme v naší analýze použili SITS-MOST kritéria, která pravděpodobně lépe charakterizují krvácení jako příčinu zhoršení stavu pacienta.
V naší práci jsme potvrdili, že výskyt SICH je vysoce nežádoucí událost. Pacienti, u kterých se SICH vyskytl, měli 6–8krát menší šanci dosáhnout dobrého klinického výsledku. Vzhledem k závažnosti vlivu SICH na celkový výsledný klinicky stav pacientů jsme hledali faktory podílející se na jeho vzniku. Jako nezávislé prediktory SICH byly v naší práci nalezeny: NIH pod 12 (negativní prediktor), zvýšená vstupní hladina glykemie, městnavé srdeční selhání a hypertenze.
Rizikovými faktory a prediktory SICH se zabývala řada prací [10–22]. V roce 2008 byla publikována analýza SITS-MOST studie, kde byly ve vícerozměrné regresivní analýze nalezeny tyto prediktory SICH: vyšší věk, vysoká hladina glykemie, vyšší NIHSS (nad 8), známky infarktu na CT, systolický krevní tlak, fibrilace síní a hmotnost pacienta [8]. V roce 2007 bylo publikováno Lansbergem et al review všech relevantních studií týkajících se rizikových faktorů SICH po trombolýze [10]. Celkem bylo vybráno 12 studií, které použily vícerozměrnou regresivní analýzu k identifikaci nezávislých prediktorů. Nejčastěji 6krát (ze 12 studií) byla jako nezávislý prediktor nalezena hypodenzita na CT a hyperglykemie nebo diabetes. Ve 3 (12 studií) studiích to byla tíže klinických symptomů, 1× doba do počátku léčby (10 studií), 1× vysoký systolický tlak (8 studií), 1× trombocytopenie (5 studií), 1× anamnéza městnavého srdečního selhání (3 studie), 1× nízká hladina PAI-1 (1 studie). V našem souboru pacienti s NIHSS ≤ 12 měli o 50 % menší riziko SICH proti pacientům s NIHSS nad 12. Tato data korespondují s analýzou SITS--MOST [2], kde pacienti s NIHSS nad 8 měli signifikantně vyšší riziko SICH. Částečně s tíží deficitu souvisejí i nálezy časných hypodenzit na CT, kde v Lansbergově review byly u poloviny sledovaných studií, včetně NINDS a ECASS II. Ve studii Tanneho et al [22] měli pacienti s ischemií v rozsahu do 1/3 povodí ACM riziko SICH 3krát zvýšené a pacienti s ischemií větší než 1/3 povodí ACM 6krát. Wahlgren et al v analýze SITS registru zjistili, že přítomnost časných známek ischemie zvyšuje mírně riziko symptomatického krvácení pouze dle definice RCT (Randomized Control Trial) [23]. V naší analýze, kde jsme hodnotili jen přítomnost nebo nepřítomnost ischemie na CT či MR, jsme prediktivní hodnotu tohoto faktoru na vznik intracerebrální hemoragie nenalezli. Důvodem může být, že jsme nehodnotili velikost časných známek ischemie.
S rozsahem ischemie a tíží neurologického postižení souvisí i délka trvání ischemie, kde lze předpokládat i současné zvýšení rizika SICH. V našem souboru jsme však prediktivní hodnotu pro žádný ze sledovaných časových parametrů (čas od počátku příznaků – přijetí do nemocnice, přijetí do nemocnice – počátek léčby) nenašli. Tato asociace nebyla nalezena ani ve studii SITS-MOST a v Lansbergově práci byla pouze v jedné studii predikční hodnota pro čas od počátku příznaku do počátku léčby [24]. Doba do počátku léčby tedy nemá jasnou prediktivní hodnotu pro výskyt SICH.
Vícerozměrná regresivní analýza ukázala prediktivní hodnotu pro zvýšené hladiny glykemie (OR 1,106; p < 0,003). Ve studii SITS-MOST byla vyšší hladina glykemie spojena jak s rizikem SICH, tak se špatným outcomem [8]. Hladina glykemie nebo diabetes v anamnéze byla i v Lansbergově práci nejčastějším nezávislým rizikovým faktorem SICH. Zvýšená hodnota glykemie tedy hraje jednu s nejvýznamnějších rolí při výskytu SICH a v jeho predikci. Za dvě hlavní příčiny se považují jednak chronické mikrovaskulární postižení u dlouhodobého diabetu, jednak spolu s dalšími faktory přímé toxické působení hyperglykemie na hematoencefalickou bariéru [10]. U hypertenze, která je nejvýznamnější příčinou rozvoje mikroangiopatií, jsme nalezli statisticky významnou prediktivní hodnotu ve vícerozměrné analýze (OR 2,45; p < 0,04). Nenalezli jsme statistickou významnost pro výšku systolického tlaku ani jeho nárůst o 10 mmHg. V SITS-MOST studii byla přítomnost hypertenze i zvýšený systolický TK signifikantní v jednorozměrné analýze (p < 0,001). Do modelu vícerozměrné analýzy byl zařazen jen systolický TK, kdy byl potvrzen jako nezávislý prediktor SICH s OR 1,33 [2]. V Lansbergově analýze studií byl systolický TK jako nezávislý prediktor potvrzen pouze v 1 z 8 studií [25]. Příčinou tohoto překvapivého nálezu je pravděpodobně fakt, že ve většině sledovaných studií byli pacienti s dekompenzovanou hypertenzí na počátku vyřazeni. Hypertenze jako nezávislý prediktor v našem souboru je nejspíše asociována s chronickou hypertezní angiopatií. Otázkou v našem souboru zůstává, proč jsme nenalezli jako prediktor zvýšený systolický krevní tlak, který je za rizikový faktor SICH obecně považován, což bylo potvrzeno i v analýze SITS-MOST studie. Pokud se podíváme na graf 1 ukazující proporci pacientů se SICH dle výše systolického TK, vidíme nejvyšší zastoupení pacientů se SICH se systolickým TK 170–185, ale zároveň je zde velká část pacientů se systolickým TK 115, což ukazuje, že vztah mezi systolickým TK a SICH nemusí být lineární. Dále navozuje otázku souvislosti mezi nízkým systolickým TK a projevy kardiálního selhávání, pro které jsme v našem souboru nalezli nezávislou prediktivní hodnotu na rozdíl od SITS--MOST, kde mělo srdeční selhávání prediktivní hodnotu jen pro 90denní mortalitu [8]. Srdečním selháváním jako rizikovým faktorem SICH se zabývala studie ECASS II, kde bylo mezi třemi nezávislými rizikovými faktory (věk, velikost hypodenzity na CT a srdeční selhávání) [9]. Souvislost mezi srdečním selháváním, systolickým krevním tlakem a SICH je tedy zatím nejasná a měla by být předmětem dalších analýz.

Užívání antiagregancií (acetylosalicylová kyselina [ASA], klopidogrel, tiklopidin) bylo v našem souboru statisticky významně spojeno se SICH v jednorozměrné analýze, ale ne již v analýze vícerozměrné. Podobné výsledky přinesla i Lansbergova review, kdy užívání ASA nebylo ani v jedné studii nalezeno jako nezávislý prediktor SICH [10]. Ve studii ECASS II bylo užívání ASA spojeno s jakýmkoliv typem krvácení, ale ne se SICH. Analýza SITS-MOST však přinesla výsledky opačné. Užívání ASA bylo nezávislým prediktorem SITS, pokud byla použita SITS-MOST kritéria pro SICH, při použití kritérií pro randomizované studie (jakékoliv krvácení spojené se zhoršením klinického stavu) nebyla prediktivní hodnota ASA nalezena. Užívání klopidogrelu nebo tiklopidinu nemělo pro SICH prediktivní hodnotu. Statisticky významné zvýšení SICH v jednorozměrné analýze našeho souboru ukazuje na možné potenciální riziko, které ale nejspíše působí v kombinaci s jinými faktory. Vliv antiagregace na SICH při užití trombolýzy by proto měl být nadále zkoumán.
V našem souboru nebyla nalezena souvislost mezi celkovou velikostí dávky rt-PA (při dodržení dávkování 0,9 mg/kg) a SICH. Ke stejným závěrům došla i analýza SITS-MOST studie. Dávka 0,9 mg/kg se prokazuje jako bezpečná, nepředstavující riziko pro žádnou váhovou kategorii pacientů.
Limitací naší práce byla nemožnost přímého srovnání našich dat s výsledky celého SITS registru, tedy porovnat data České republiky s celoevropskými. Další otázkou zůstává, jakou správnou klasifikaci krvácení vybrat [26]. SITS-MOST, které obsahuje pouze krvácení zasahující více než třetinu povodí ACM nebo kritéria randomizovaných studií, které obsahují jakékoliv typy krvácení – tedy i drobná petechiální prokrvácení ischemické tkáně, přičemž zvoleným typem klasifikace vzniká až 4násobný rozdíl ve výskytu SICH (2 vs 6–9 %). Při hodnocení dle randomizovaných studií spadá do skupiny SICH velké procento pacientů, u nichž je nepochybně příčinou zhoršení mozkový edém způsobený ischemickými změnami a nikoli samotné krvácení. Mají tyto dvě skupiny rozdílné prediktory a měly by být klasifikovány zvláště, nebo jsou stejné – a v tom případě je vhodnější používat klasifikace z randomizovaných studií? Dále nebyl zkoumán například vliv leukoaraiózy na výskyt SICH, přítomnost časných ischemických změn či velikost infarktu na CT anebo vliv nových zobrazovacích metod, jakými jsou multimodální CT a MR, jejichž použití podle některých prací výskyt SICH snižuje [11–16]. V neposlední řadě, protože nejčastěji užívané klasifikace krvácení sledují výskyt krvácení do 36 (SICH-MOST, SICH-NINDS), resp. 48 hod (SICH-ECASS II), v současné době není známé, jak velký a zdali vůbec je výskyt SICH po 48 hod od trombolýzy.
Závěr
Naše práce potvrdila klinickou závažnost symptomatického intrakraniálního krvácení po systémové trombolýze s 6–8krát menší šancí nemocných na dobrý klinický výsledek. Jako první ukázala prediktory SICH v české populaci. Pacienti s hypertenzí, vyšší hladinou glykemie, těžším neurologickým deficitem a s kardiálním selháváním mají zvýšené riziko krvácení, což může přispět ke stratifikaci léčby po systémové trombolýze. Ve srovnání s celoevropským SITS registrem práce demonstrovala stejné riziko krvácení po trombolýze jako v ostatních evropských zemích.
MUDr. Daniel Václavík
Iktové centrum, neurologické oddělení
Vítkovická nemocnice
Zálužanského 15
703 84 Ostrava-Vítkovice
e-mail: daniel.vaclavik@nemvitkovice.cz
Přijato k recenzi: 22. 5. 2012
Přijato do tisku: 30. 7. 2012
Sources
1. Hacke W, Donnan G, Fieschi C, Kaste M, von Kummer R, Broderick JP et al. Association of outcome with early stroke treatment: pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials. Lancet 2004; 363(9411): 768–774.
2. Ahmed N, Wahlgren N, Grond M, Hennerici M, Lees KR, Mikulik R et al. SITS Investigators. Implementation and outcome of thrombolysis with alteplase 3–4,5 h after an acute stroke: an updated analysis from SITS-ISTR. Lancet Neurol 2010; 9(9): 866–874.
3. Petrovicsová M, Kadlecová P, Václavík D, Šaňák D, Ševčík P, Škoda O et al. Bezpečnost a účinnost intravenózní trombolytické terapie mozkového infarktu u pacientů nad 80 let věku. Cesk Slov Neurol N 2012; 75/108(5): 581–585.
4. Bar M, Kadlecová P, Václavík D, Mikulík R, Neumann J, Škoda O et al. Stanovení prognostických faktorů trombolytické léčby u pacientů s akutním mozkovým infarktem – analýza registru SITS. Cesk Slov Neurol N 2012; 75/108(4): 426–431.
5. Mikulik R, Kadlecova P, Czlonkowska A, Kobayashi A, Brozman M, Svigelj V et al. Factors influencing in-hospital delay in treatment with intravenous thrombolysis. Stroke 2012; 43(6): 1578–1583.
6. Mikulík R, Neumann J, Školoudík D, Václavík D. Standard pro diagnostiku a léčbu pacientů s mozkovým infarktem. Cesk Slov Neurol N 2006; 69/102(4): 320–325.
7. Bluhmki E, Chamorro A, Dávalos A, Machnig T, Sauce C, Wahlgren N et al. Stroke treatment with alteplase given 3.0–4.5 h after onset of acute ischaemic stroke (ECASS III): additional outcomes and subgroup analysis of a randomised controlled trial. Lancet Neurol 2009; 8(12): 1095–1102.
8. Wahlgren N, Ahmed N, Eriksson N, Aichner F, Bluhmki E, Dávalos A et al. Multivariable analysis of outcome predictors and adjustment of main outcome results to baseline data profile in randomized controlled trials: Safe Implementation of Thrombolysis in Stroke-Monitoring Study (SITS-MOST). Stroke 2008; 39(12): 3316–3322.
9. Larrue V, von Kummer RR, Müller A, Bluhmki E. Risk factors for severe hemorrhagic transformation in ischemic stroke patients treated with recombinant tissue plasminogen activator: a secondary analysis of the European-Australasian Acute Stroke Study (ECASS II). Stroke 2001; 32(2): 438–441.
10. Lansberg MG, Albers GW, Wijman CA. Symptomatic intracerebral hemorrhage following thrombolytic therapy for acute ischemic stroke: a review of the risk factors. Cerebrovasc Dis 2007; 24(1): 1–10.
11. Kawai N, Keep RF, Betz AL. Hyperglycemia at the vascular effects of cerebral ischemia. Stroke 1997; 28(1): 149–154.
12. Rodríguez-Yáñez M, Castellanos M, Blanco M, Millán M, Nombela F, Sobrino T et al. Micro - and macroalbuminuria predict hemorrhagic transformation in acute ischemic stroke. Neurology 2006; 67(7): 1172–1177.
13. Ribo M, Montaner J, Molina CA, Arenillas JF, Santamarina E, Quintana M et al. Admission fibrinolytic profile is associated with symptomatic hemorrhagic transformation in stroke patients treated with tissue plasminogen activator. Stroke 2004; 35(9): 2123–2127.
14. Catto AJ, Kohler HP, Bannan S, Stickland M, Carter A, Grant PJ. Factor XIII Val 34 Leu: a novel association with primary intracerebral hemorrhage. Stroke 1998; 29(4): 813–816.
15. Thomalla G, Schwark C, Sobesky J, Bluhmki E, Fiebach JB, Fiehler J et al. Outcome and symptomatic bleeding complications of intravenous thrombolysis within 6 hours in MRI-selected stroke patients: comparison of a German multicenter study with the pooled data of ATLANTIS, ECASS, and NINDS tPA trials. Stroke 2006; 37(3): 852–858.
16. Singer OC, Humpich MC, Fiehler J, Albers GW, Lansberg MG, Kastrup A et al. Risk for symptomatic intracerebral hemorrhage after thrombolysis assessed by diffusion-weighted magnetic resonance imaging. Ann Neurol 2008; 63(1): 52–60.
17. Singer OC, Berkefeld J, Lorenz MW, Fiehler J, Albers GW, Lansberg MG et al. Risk of symptomatic intracerebral hemorrhage in patients treated with intra-arterial thrombolysis. Cerebrovasc Dis 2009; 27(4): 368–374.
18. Saver JL. Heorrhage after thrombolytic therapy for stroke: the clinically relevant number needed to harm. Stroke 2007; 38(8): 2279–2283.
19. Saqqur M, Tsivgoulis G, Molina CA, Demchuk AM, Siddiqui M, Alvarez-Sabín J et al. CLOTBUST Investigators. Symptomatic intracerebral hemorrhage and recanalization after IV rt-PA: a multicenter study. Neurology 2008; 71(17): 1304–1312.
20. Palumbo V, Boulanger JM, Hill MD, Inzitari D, Buchan AM. Leukoaraiosis and intracerebral hemorrhage after thrombolysis in acute stroke. Neurology 2007; 68(13): 1020–1024.
21. Nafría C, Fernández-Cadenas I, Mendioroz M, Domingues-Montanari S, Hernández-Guillamón M, Fernández-Morales J et al. Update on the Serum Biomarkers and Genetic Factors Associated with Safety and Efficacy of rt-PA Treatment in Acute Stroke Patients. Stroke Res Treat 2011; 2011 : 182783.
22. Tanne D, Kasner SE, Demchuk AM, Koren-Morag N, Hanson S, Grond M et al. Markers of increased risk of intracerebral hemorrhage after intravenous recombinant tissue plasminogen activator therapy for acute ischemic stroke in clinical practice: the Multicenter rt-PA Stroke Survey. Circulation 2002; 105(14): 1679–1685.
23. Wahlgren N, Ahmed N, Eriksson N. Aichner F, Bluhmki E, Dávalos A et al. Multivariable analysis of outcome predictors and adjustment of main outcome results to baseline data profile in randomized controlled trials: Safe Implementation of Thrombolysis in Stroke – Monitoring Study (SITS-MOST). Stroke 2008; 39(12): 3316–3322.
24. Hill MD, Buchan AM. Canadian Alteplase for Stroke Effectiveness Study (CASES) Investigators. Thrombolysis for acute ischemic stroke: results of the Canadian Alteplase for Stroke Effectiveness Study. CMAJ 2005; 172(10): 1307–1312.
25. Gilligan AK, Markus R, Read S, Srikanth V, Hirano T, Fitt G et al. Baseline blood pressure but not early computed tomography changes predicts major hemorrhage after streptokinase in acute ischemic stroke. Stroke 2002; 33(9): 2236–2242.
26. Mazya M, Egido JA, Ford GA, Lees KR, Mikulik R, Toni D et al. Predicting the risk of symptomatic intracerebral hemorrhage in ischemic stroke treated with intravenous alteplase: Safe Implementation of Treatments in Stroke (SITS) symptomatic intracerebral hemorrhage risk score. Stroke 2012; 43(6): 1524–1531.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2012 Issue 6
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Endovaskulární léčba ischemické cévní mozkové příhody
- Kortikální patologie u roztroušené sklerózy – morfologické, imunopatologické a klinické souvislosti
- Fázový model neurorehabilitace
- Vztah vaskulárních rizikových faktorů a Alzheimerovy choroby
- Epidemie roztroušené sklerózy ve světě?
- Kongenitální myastenie jako příčina respiračního selhání u dvou kojenců a batolete – kazuistiky
- Laboratorní preparace drah z mediálního pohledu na mozkovou hemisféru
- Papilární nádor pineální oblasti u dítěte – kazuistika
- Prediktory symptomatického intracerebrálního krvácení po systémové trombolýze mozkového infarktu
- Výskyt epileptického záchvatu pri intraoperatívnej stimulácii mozgu – naše skúsenosti
- Rekurentní analýza variability srdeční frekvence v časné diagnostice diabetické autonomní neuropatie
- Měření atrofie corpus callosum a porovnání s ostatními metodami monitorace roztroušené sklerózy
- Molekulárně genetická analýza tkáně plodu rodiny postižené myotonickou dystrofií
- Opakovaná víceetážová aplikace botulinum toxinu A dlouhodobě zabraňuje zhoršení chůze u dětí s dětskou mozkovou obrnou
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Epidemie roztroušené sklerózy ve světě?
- Kortikální patologie u roztroušené sklerózy – morfologické, imunopatologické a klinické souvislosti
- Fázový model neurorehabilitace
- Endovaskulární léčba ischemické cévní mozkové příhody
