Management tranzitorní ischemické ataky a minor stroke
Transient Ischemic Attack and Minor Stroke Management
Transient ischemic attack (TIA) and minor stroke are acute cerebrovascular diseases that are usually non-disabling. However, if not followed adequately, they may lead to potentially fatal stroke recurrence. The aim of this review is to summarize the main challenges of the current clinical practice (in the Czech Republic) and suggest a rational algorithm for TIA/minor stroke management. This review informs about the new TIA definition based on the fact that up to 50% of TIA patients have a brain infarction on MRI (magnetic resonance imaging), about risk stratification and its use in patients management, about the importance of imaging studies and about the available treatment options. Risk stratification for TIA is underused in the Czech Republic and this affects risk-benefit ratios for the available management plans. In particular, follow-up of high-risk patients need urgent attention - patients with speech and/or motor symptoms lasting ≥ 5 min, with ABCD2 score ≥ 4, with atrial fibrillation, and patients with an infarction on DWI MRI or CT (computed tomography), and with an occlusion or significant ≥ 50% stenosis of a precerebral/cerebral large vessel. The review highlights the importance of an immediate medical intervention with early endarterectomy and provides an overview of new therapeutic options, e.g. dual antiplatelet therapy, the benefit of which has recently been documented for the first time.
Key words:
transient ischemic attack – minor stroke – risk stratification
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
M. Škorňa 1,2; J. Neumann 3; S. Peška 1; R. Mikulík 2,4
Authors‘ workplace:
Neurologická klinika LF MU a FN Brno
1; ICRC – Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
2; Iktové centrum, Neurologické oddělení, Krajská zdravotní a. s., Nemocnice Chomutov
3; I. neurologická klinika LF MU a FN u sv. Anny v Brně
4
Published in:
Cesk Slov Neurol N 2016; 79/112(2): 178-187
Category:
Review Article
doi:
https://doi.org/10.14735/amcsnn2016178
Overview
Tranzitorní ischemická ataka (TIA) a minor stroke patří mezi akutní cévní onemocnění mozku, jež sama o sobě nemají ve většině případů invalidizující dopad na pacienta. Jejich podcenění však může vést k recidivě cévní mozkové příhody (CMP) s fatálními následky. Cílem tohoto přehledového článku je upozornit na hlavní problémy současné klinické praxe v České republice a navrhnout racionální algoritmus péče o pacienty s TIA/ minor stroke. Článek podává informace o nové definici TIA, která se opírá o fakt, že až u 50 % pacientů po TIA je na magnetické rezonanci (MR) přítomen infarkt, o stratifikaci rizika a jejím využití při managementu pacientů, o významu zobrazovacích vyšetření a o možnostech terapie. Poukazuje na skutečnost, že stratifikace rizika není v České republice dostatečně používána, což vede k neadekvátnímu poměru mezi rizikem pacienta a zvoleným diagnosticko-terapeutickým postupem. Urgentní péči potřebují obzvláště pacienti s vysokým rizikem recidivy CMP – tj. pacienti s poruchou řeči nebo motoriky trvající ≥ 5 min, se skóre ABCD2 ≥ 4, s fibrilací síní a pacienti s infarktem na difuzně vážených sekvencích (DWI) MR či CT (počítačové tomografii) a s okluzí nebo významnou ≥ 50% stenózou extra-/ intrakraniální velké mozkové tepny. Přehledový článek zdůrazňuje nutnost nejen okamžitého zahájení medikamentózní terapie, ale i provedení časné endarterektomie a shrnuje nové možnosti léčby, např. duální antiagregace, jejíž přínos byl v časné fázi po TIA a minor stroke nedávno dokumentován.
Klíčová slova:
tranzitorní ischemická ataka – minor stroke – stratifikace rizika
Úvod
Tranzitorní ischemická ataka (TIA) a minor stroke patří mezi akutní cévní onemocnění mozku. Význam časné diagnostiky a nezbytnost urgentního řešení jsou, zejména v případě TIA, v běžné klinické praxi podceňovány. Pacient po TIA může při prvním kontaktu (vyšetření) vyvolat falešný dojem relativně zdravého pacienta, protože se jednalo o přechodné příznaky a není přítomen žádný neurologický deficit. Podcenění rychlé diagnostiky a terapie může ale mít zásadní zdravotní následky pro pacienta, a to zejména vznik závažného mozkového infarktu, což může mít forenzní postihy pro lékaře. Na základě dat získaných v posledních letech je nutné změnit současnou klinickou praxi a optimalizovat management pacientů s TIA/ minor stroke. Hlavním důvodem pro změnu je, že současná medicína dokáže identifikovat pacienty se zvýšeným rizikem vzniku mozkového infarktu a poskytnout jim účinnou terapii. Proto je tento článek určen pro všechny lékaře, kteří se v ambulancích a na odděleních setkávají s diagnózou TIA a minor stroke.
Na základě diskuze na pracovištích autorů se domníváme, že hlavními problémy současné klinické praxe v České republice jsou:
- a) Koncept diagnostiky a terapie TIA vychází z překonané definice, která nezohledňuje pokroky v zobrazovacích metodách a jejich dopad na urgentní management.
- b) Standardně není používána stratifikace rizika u pacientů s TIA, což vede k neadekvátnímu poměru mezi rizikem pacienta a zvoleným diagnosticko - terapeutickým postupem (pacienti s vysokým rizikem nemusí dostat adekvátní urgentní péči a naopak u pacientů s nízkým rizikem mohou být diagnostika a terapie nadužívány).
- c) Nejsou diagnostikováni a správně léčeni pacienti, kteří splňují původní definici TIA, ale ve skutečnosti mají mozkový infarkt na difuzně vážených sekvencích magnetické rezonance (DWI MR) mozku.
- d) Není dostatečně využíváno cévní zobrazení, např. CT angiografie (CTA), sonografie. Důsledkem je, že vysoce rizikoví pacienti, např. ti, kteří mají pozitivní léze DWI nebo mají významné vaskulární nálezy, nejsou ošetřováni s dostatečnou urgencí.
- e) V klinické praxi je diagnóza TIA nadužívána pro jiné obtíže pacienta (izolované vertigo, hypotenze, synkopa, migréna apod.), což zbytečně odvádí pozornost a odčerpává zdroje.
Cílem tohoto článku je poskytnout informace o nové definici TIA, stratifikaci rizika, významu zobrazovacích metod a o terapii pacientů s TIA/ minor stroke.
Definice TIA
Dle tradiční definice je TIA definována jako „rychle rozvinuté klinické známky ložiskového mozkového postižení nebo poruchy monokulárního vizu, které typicky trvají méně než 1 hod, max. však 24 hod, pokud klinické, laboratorní a zobrazovací vyšetření nesvědčí pro jinou příčinu neurologického deficitu“ [1,2]. Na základě této definice je dominantním kritériem odlišení TIA od mozkového infarktu délka trvání neurologického postižení. Vychází se z předpokladu (dnes víme, že mylného), že příznaky trvající max. 24 hod jsou jen dočasný funkční deficit bez strukturálního postižení mozkové tkáně.
S rozvojem zobrazovacích metod, hlavně MR mozku, se totiž v posledních letech prokázalo, že až u 30 – 50 % pacientů s TIA je nalezen infarkt mozku, a to na DWI MR [3]. Tyto nálezy byly impulzem k zavedení nové definice TIA založené na stavu mozkového parenchymu: „TIA je přechodná epizoda neurologické dysfunkce způsobená fokální mozkovou nebo míšní ischemií či ischemií sítnice bez průkazu akutního infarktu.“ [3]. Mozkový infarkt je tedy určen buď přetrvávajícími klinickými příznaky (i bez průkazu na zobrazovacích vyšetřeních) nebo pozitivitou zobrazovacího vyšetření (i bez neurologických příznaků) [3]. V podstatě část pacientů diagnostikovaných podle původní definice TIA má „mozkový infarkt s tranzitorními příznaky“ a druhá část pacientů má „tranzitorní příznaky bez infarktu“. Je ale důležité diagnostikovat „infarkt s tranzitorními příznaky“, protože má vyšší předpovědní hodnotu pro recidivu a vznik ischemického iktu než „tranzitorní příznaky bez infarktu“ [4].
Podle současně platné Mezinárodní klasifikace nemocí (MKN-10) stále platí definice tradiční, pro kterou je dostačující k odlišení TIA od mozkového infarktu 24hod časový interval. V nové, připravované verzi Mezinárodní klasifikace nemocí (MKN-11) [5] je mimo splnění časového hlediska vyžadována i absence akutního mozkového infarktu. V připravované MKN-11 je definice TIA uvedena následovně: „TIA je tranzitorní epizoda fokální neurologické dysfunkce způsobená fokální mozkovou ischemií nebo ischemií sítnice bez akutního infarktu v klinicky relevantní oblasti mozku. Symptomy by měly kompletně odeznít do 24 hod.“ Z výše uvedeného je zřejmé, že ke správné diagnóze bude nutné provedení MR DWI. Změna definice v MKN-11 oproti MKN-10 vychází samozřejmě z již nyní existujících důkazů, které by proto měly být aplikovány v dnešní klinické praxi.
Definice minor stroke
Neexistuje jednotná definice minor stroke.Studie, která zahrnovala 760 pacientů, hodnotila vztah mezi šesti různými definicemi minor stroke a klinickým stavem. Dospěla k závěru, že minor stroke nejlépe vystihují následující dvě definice: „NIHSS 0 – 1, beze změny vědomí“ a „NIHSS ≤ 3“ [6] (National Institutes of Health Stroke Scale; NIHSS = 0 znamená žádný neurologický deficit, vyšší skóre odpovídá těžšímu deficitu, např. skóre 10 znamená střední deficit a skóre 20 znamená velmi těžký deficit). Ve studiích, které byly komentovány v tomto článku, je minor stroke nejčastěji definován jako ischemická cévní mozková příhoda (CMP) s NIHSS ≤ 3, pouze ve dvou případech jako NIHSS < 6.
Riziko u pacientů s TIA
Vlastní TIA a ve většině případů i minor stroke nezpůsobují takovou tíži neurologického deficitu, která by pacienty invalidizovala (alespoň ne fyzicky, psychologický dopad viz níže). Jak TIA, tak minor stroke je ale nutné hodnotit jako varování a hrozbu trvalých následků v případě recidivy ischemického iktu. Právě recidiva ischemické CMP je zodpovědná za trvalé invalidizující následky u pacientů po TIA/ minor stroke (studie CATCH) [7].
Přestože TIA nezpůsobuje trvalý neurologický deficit, ovlivňuje následnou kvalitu života. Britská studie publikovaná v roce 2013 hodnotila dlouhodobý (pětileté sledování) dopad TIA (440 pacientů) a ischemického nebo hemoragického iktu (748 pacientů) na kvalitu života. Bylo zjištěno, že kvalita života klesá s rostoucí tíží iktu. Mohli bychom očekávat, že vzhledem ke kompletnímu odeznění symptomů u pacientů po TIA nebude významně změněna kvalita života. Nicméně bylo prokázáno, že i pacienti po TIA mají nižší kvalitu života než kontroly. Důvodem může být vliv užívané medikace, obavy z recidivy iktu, stres či změny v rodinném a pracovním životě. Hlavními prediktory snížené kvality života byla tíže a recidiva iktu. Z toho vyplývá, že k zachování kvality života je důležitá správná terapie akutního iktu, důsledná sekundární prevence a správná (tedy ani podhodnocená, ani nadhodnocená) diagnóza TIA [8].
Riziko recidivy iktu po TIA je dle prací publikovaných v posledních 10 letech vyšší, než se předpokládalo. Do tří měsíců po TIA vznikne další ischemická CMP u 10 – 20 % pacientů, u poloviny z nich pak během prvních 24 – 48 hod [3,9,10]. Tomu odpovídá prevalence předchozí TIA u pacientů s iktem 7 – 40 % [3]. Tato data ukazují, že TIA je významný nezávislý rizikový faktor pro vznik ischemického iktu a je asociována se stejnými rizikovými faktory jako mozkový infarkt.
Incidence TIA se dle různých epidemiologických studií pohybuje v rozmezí 52 – 83/ 100 000 obyvatel [11 – 13]. Při odhadované incidenci TIA v České republice okolo 30 – 40/ 100 000 obyvatel [1] by mělo dojít ke vzniku ischemické CMP v průběhu tří měsíců po TIA přibližně u 300 – 600 pacientů ročně. Skutečná incidence bude ale vyšší, protože řada pacientů s prchavými příznaky, které odpovídají TIA, nevyhledá lékařskou péči. Ischemickým iktům, které vzniknou po TIA, je možné předcházet a u těchto pacientů může být zachráněna soběstačnost. K tomu je potřeba:
- identifikovat skupinu pacientů s TIA, kteří mají vysoké riziko vzniku ischemického iktu;
- správná preventivní léčba.
Oboje je probíráno v následujících statích.
Prospěch preventivní léčby TIA
Prospěch včasného zahájení terapie potvrdila studie EXPRESS provedená ve Velké Británii na 1 278 pacientech s TIA a minor stroke [14]. Pacienti v této studii byli léčeni ambulantně. Medián od vyhledání lékařské péče po zahájení léčby byl u kontrolní skupiny pacientů 20 dnů. U druhé skupiny (expresní léčba) to byl jeden den a léčebný protokol zahrnoval antiagregační terapii, simvastatin, snížení systolického tlaku krve (sTK) pod 130 mm Hg a antikoagulační terapii v indikovaných případech.
U druhé skupiny pacientů byla endarterektomie symptomatické stenózy vnitřní karotidy provedena dříve než u skupiny kontrolní.
Studie EXPRESS prokázala, že u pacientů po TIA či minor stroke došlo ke snížení 90denního rizika recidivy ischemického iktu z 10,3 na 2,1 % (tedy 80% redukce) při včasném (< 1 den) zahájení terapie. Tento poznatek by se měl promítnout i do běžné klinické praxe a terapie by měla být zahájena ihned po vyloučení jiné příčiny symptomů zobrazovacím vyšetřením mozku. Léčba zahrnuje antitrombotickou terapii (antiagregační či antikoagulační), důslednou kontrolu TK s cílovým sTK pod 130 mm Hg, statin v dostatečné dávce a časnou endarterektomii.
Klinická manifestace a odhad rizika na základě anamnestických a klinických údajů
Klinická manifestace TIA je různorodá. Typickými příznaky jsou porucha hybnosti nebo citlivosti poloviny obličeje, končetin nebo poloviny těla (zpravidla jednostranně), porucha řeči (afázie nebo dysartrie) či dalších symbolických funkcí (např. apraxie), poruchy vizu (monokulární, heteronymní anopsie), ataxie.
Naproti tomu samotná závrať, samotná diplopie, samotná amnézie nebo zmatenost, samotný náhlý pád či stěhování senzitivního deficitu nejsou pokládány za spolehlivé příznaky TIA [1].
Symptomy TIA by měly být charakterizovány náhlým začátkem, měly by odpovídat příslušnému vaskulárnímu teritoriu, jsou obvykle negativní a odezní typicky do 1 hod.
Krátké trvání symptomů, mnohdy málo výrazný deficit a překrývání s příznaky jiných onemocnění (komplikovaná migréna, synkopy, metabolické změny, paroxysmální a postaparoxysmální projevy) mohou vést k podhodnocení a poddiagnostikování TIA. Úkolem lékaře v ambulantní praxi, který se setkává s pacientem s TIA, by měla být identifikace těch symptomů a anamnestických dat, které představují pro konkrétního pacienta vysoké riziko recidivy ischemického iktu, protože pacienti s vysokým rizikem budou vyžadovat jiný management než pacienti s nízkým rizikem.
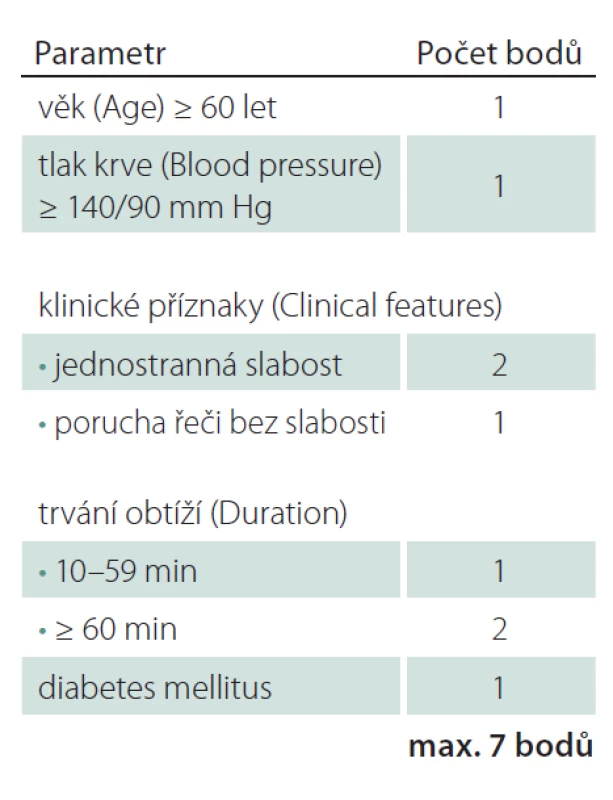
Velmi užitečný a současně jednoduchý nástroj je pro stanovení rizika a následného managementu skóre ABCD2. Hodnotíme zde pět parametrů – věk, výši krevního tlaku, klinickou symptomatiku, trvání symptomů a přítomnost diabetu. Dosahuje hodnot 0 – 7, přičemž hodnota 6 – 7 představuje vysoké riziko (dvoudenní riziko vzniku iktu 8,1 %), 4 – 5 střední riziko (dvoudenní riziko vzniku iktu 4,1 %) a 0 – 3 nízké riziko recidivy iktu (dvoudenní riziko vzniku iktu 1 %) (tab. 1, 2) [15].
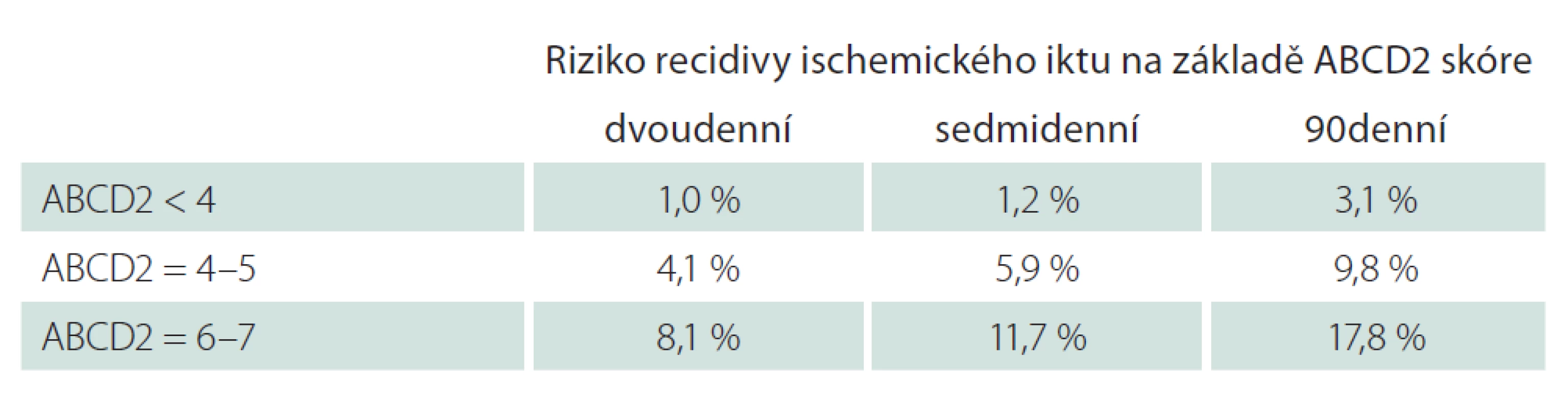
Perfektní negativní prediktivní hodnotu (100 %) prokázala retrospektivní studie u tzv. přístupu ASPIRE (Alberta Stroke Prevention in TIAs and mild strokes) ke stratifikaci rizika. Za vysoce rizikové (90denní riziko recidivy iktu 6,3 %) byli označeni pacienti se skóre ABCD2 ≥ 4, pacienti s poruchou řeči nebo motoriky trvající více než 5 min a pacienti s fibrilací síní. U žádného nízce rizikového pacienta nedošlo k recidivě příhody (tab. 3) [16].

Na základě výše uvedených údajů se může ambulantní lékař rozhodnout, které pacienty hospitalizovat a které je možno řešit ambulantně. Hospitalizováni by měli být všichni vysoce rizikoví pacienti (viz přístup ASPIRE), kteří se dostaví k vyšetření do 48 hod od vzniku symptomů. Ostatní pacienti mohou být řešeni ambulantně, ale za předpokladu, že není jiný důvod k hospitalizaci (např. dekompenzovaný diabetes). V každé lékařské zprávě by měl být takový postup (hospitalizace či ambulantní řešení) u konkrétního pacienta s TIA zdůvodněn. Lékařská zpráva by měla obsahovat přesný časový údaj o vzniku příhody, popis a délku trvání příznaků, skóre ABCD2 a nález na EKG (hlavně přítomnost fibrilace síní). Pokud v neurologické ambulanci není EKG, potom jako minimum informace o tom, zdali je tepová frekvence pravidelná.
K dalšímu zpřesnění odhadu rizika nám mohou pomoci zobrazovací vyšetření mozkového parenchymu a extra - i intrakraniálních mozkových tepen.
Zobrazovací vyšetření a jejich význam a využití při stratifikaci rizika u TIA/ minor stroke
Zobrazovací vyšetření mají zásadní význam v diagnostickém algoritmu TIA/ minor stroke, protože nám:
- a) umožní získat důkaz o cévním původu příznaků v případě nálezu mozkového infarktu na DWI MR, případně CT;
- b) pomohou objasnit subtyp příhody (ateroskleróza velkých tepen, onemocnění malých tepen, disekce, vaskulitida);
- c) umožní vyloučit jinou příčinu symptomů (nádor, absces, hematom);
- d) pomohou určit míru rizika recidivy ischemického iktu či progresi symptomatiky [3].
V další části popíšeme vyšetření mozkového parenchymu a mozkových cév u pacientů s TIA/ minor stroke.
Vyšetření mozkového parenchymu
V současnosti je u nás nejčastěji používanou modalitou k zobrazování mozkového parenchymu u pacientů s TIA/ minor stroke CT mozku vzhledem k dostupnosti a rychlosti provedení. Výtěžnost nekontrastního CT je pro zobrazení ischemických změn poměrně nízká (dle studie CATCH byla nalezena akutní ischemie u 12 % pacientů po TIA/ minor stroke) [17]. Přínos CT lze spatřovat především při odlišení jiné příčiny symptomatiky, obzvláště intrakraniálního krvácení. CT mozku je vhodné akutní vyšetření, když není k dispozici MR. MR je optimálnější a přínosnější vyšetření, protože poskytuje více informací pro stanovení diagnózy a prognózy u pacientů s TIA/ minor stroke. Mělo by zahrnovat následující sekvence:
- a) DWI (difuzně vážené obrazy): sekvence citlivá k detekci akutní ischemie.
- b) GRE (Gradient-Recalled Echo = T2* vážené obrazy): sekvence citlivá k detekci krvácení. Alternativně SWI (Susceptibility Weighted Imaging) sekvence, která je citlivější k detekci krvácení než sekvence GRE [18,19].
- c) FLAIR (Fluid-Attenuated Inversion Recovery = T2 vážené obrazy s potlačením signálu likvoru): tato sekvence pomůže detekovat subarachnoidální krvácení a částečně i určit stáří ischemie [20,21].
- d) MRA (MR angiografie) (viz dále Vyšetření tepenného systému).
Celková doba tohoto vyšetření je 15 – 20 min [20]. Při použití rychlých zobrazovacích technik můžeme docílit času až 6 min [22]. MR je schopná diagnostikovat akutní infarkty pomocí DWI sekvencí. Na základě MR tak klinik může učinit diferenciální diagnostiku mezi „infarktem s tranzitorními příznaky“, který bude vyžadovat v každém případě hospitalizaci, a „tranzitorními příznaky bez infarktu“, které hospitalizaci nemusí vyžadovat. Zároveň je možné s mnohem větší jistotou u pacientů s nespecifickými příznaky ze zadní jámy (typicky vestibulární syndrom) identifikovat nejrizikovější podskupinu pacientů, tedy ty, kteří mají kmenový infarkt [3]. Dále je možné diagnostikovat pacienty s případným subarachnoidálním krvácením (SAK), jež může probíhat i pod obrazem TIA, a krev nemusí být detekovatelná na CT [23]. V prvních třech dnech je senzitivita CT k detekci SAK velmi vysoká a blíží se 100 %, v dalších dnech však senzitivita CT klesá a SAK již nemusí být detekovatelný na CT [24]. V subakutním období je proto k detekci SAK výhodnější MR při použití sekvencí GRE (nejcitlivější sekvence s citlivostí až 100 % v subakutní fázi) a FLAIR [25].
Bylo prokázáno, že u pacientů s trváním symptomů < 24 hod se vyskytuje infarkt na DWI MR ve 30 – 50 %. Z klinických a anamnestických údajů nelze přesně určit, u koho budou a u koho nebudou přítomny léze DWI. Nicméně jsou známy prediktory, kdy můžeme očekávat přítomnost lézí DWI s větší pravděpodobností. Těmito prediktory pozitivity DWI jsou přítomnost motorických symptomů (šance na výskyt lézí DWI je téměř dvojnásobná u pacientů s motorickými symptomy než bez nich), délka trvání symptomů a provedení MR do 24 hod od odeznění symptomů.
S rostoucí dobou trvání příznaků stoupá i pravděpodobnost záchytu akutní ischemie na DWI MR. Při trvání symptomů 0 – 1 hod byly nalezeny na DWI MR hyperintenzity až u 34 %, při trvání symptomů 18 – 24 hod pak u 50 % pacientů. Časovou hranici trvání symptomů však k odlišení příhod s rozvojem mozkového infarktu či bez něj nelze s dostatečně vysokou senzitivitou a specificitou definovat [3].
Pozitivita DWI, tedy přítomnost infarktu, byla častější u pacientů po TIA, u kterých byla MR provedena do 24 hod po odeznění symptomů (37 %) než po 24 hod (30 %) [15]. Nutnost provedení časné MR pro možnost podhodnocení ischemických lézí na odložené MR dokumentuje i kanadská studie s 263 pacienty [26].
Pravděpodobnost přítomnosti infarktuna DWI MR stoupá s rostoucím skóre ABCD2.V porovnání s pacienty, kteří měli skóre ABCD2 0 – 1, měli pacienti se středním rizikem (ABCD2 4 – 5) více než 4 – 6násobnou pravděpodobnost přítomnosti infarktu na DWI a pacienti ve vysokém riziku (ABCD2 6 – 7) dokonce 8 – 9násobnou pravděpodobnost [4].
Nález infarktu na DWI MR má značný prognostický význam. To dokumentuje multicentrická studie zkoumající, jak skóre ABCD2 a nález na DWI MR ovlivňuje riziko recidivy příhody [4]. Studie ukázala, že pacienti s prokázaným mozkovým infarktem na DWI mají podstatně vyšší riziko recidivy příhody než pacienti bez lézí DWI. Pacienti s vyšším skóre ABCD2 mají vyšší riziko recidivy příhody jak u skupiny DWI pozitivních, tak i negativních. Abychom věděli, že pacienti mají nízké riziko vzniku ischemické CMP po „TIA“, potom musí nejspíše mít jak nízké skóre ABCD2, tak nepřítomnost lézí DWI, i když více informací je potřeba získat u pacientů s nízkým rizikem, jak pojednává následující odstavec. V každém případě z výše uvedeného vyplývá, že ke stratifikaci rizika je vhodný kombinovaný přístup – klinický doplněný MR vyšetřením. Nativní CT nepomůže ve stratifikaci rizika.
U pacientů vysoce rizikových budou léze na DWI MR přítomny častěji než u pacientů s nízkým rizikem. Nevíme však mnoho o prognóze u pacientů s nízce rizikovou TIA, tedy u pacientů s nízkým skóre ABCD2. Nevíme, kolik procent pacientů s nízkým skóre ABCD2 bude mít akutní infarkt na DWI MR, jaké klinické příznaky predikují přítomnost lézí DWI a jaké jsou klinické a paraklinické prediktory recidivy iktu, infarktu myokardu nebo vaskulární smrti během jednoho roku u této skupiny pacientů. Na tyto otázky by měla odpovědět právě probíhající mezinárodní multicentrická studie DOUBT, na níž se podílí i naše pracoviště (FN u sv. Anny a FN Brno). Tato skupina pacientů je velmi heterogenní a je zde pravděpodobně větší četnost nevaskulární etiologie příznaků (např. vertigo, parestezie) než u pacientů vysoce rizikových. Studie DOUBT by nám mohla pomoci z této nízce rizikové skupiny selektovat pacienty rizikovější, u nichž bude vaskulární etiologie pravděpodobnější.
Přínos perfuzního vyšetření na CT či MR není obecně jasný a hledá se nejen u pacientů s akutním mozkovým infarktem, ale i u pacientů s TIA. Je známo, že zatímco rozsah akutní léze DWI odpovídá přibližně velikosti ireverzibilně poškozené mozkové tkáně, oblast s porušenou perfuzí (PWI MR) reprezentuje dokonaný infarkt, penumbru a oblast benigní oligemie. Rozdíl mezi perfuzním a difuzním deficitem (tzv. difuzně-perfuzní mismatch) přibližně určuje tkáň, kterou lze časnou reperfuzí zachránit [27]. Zajímavé výsledky byly prezentovány ve studii z Calgary. Byl sledován vztah lézí DWI/ PWI na MR a výsledný klinický stav a definitivní rozsah infarktu u pacientů s vysoce rizikovou TIA a minor stroke. Bylo zjištěno, že difuzně-perfuzní mismatch o objemu ≥ 10 ml byl prediktorem růstu infarktu či vzniku nového infarktu v hypoperfundované tkáni (téměř 10krát větší riziko) a časného neurologického zhoršování (více než devětkrát větší riziko). Tento poznatek může mít značný klinický význam. Takto definovaná riziková skupina pacientů s difuzně-perfuzním mismatchem (pacienti s rizikovou TIA a minor stroke, tj. pacienti, kteří nejsou obvykle kandidáti reperfuzní terapie) by mohla profitovat z rekanalizační léčby [28].
Vyšetření tepenného systému
Součástí vyšetřovacího algoritmu u pacientů s TIA/ minor stroke by mělo být zobrazení krčních a intrakraniálních tepen z důvodu stanovení příčiny TIA, léčby a prognózy, jak pojednáváme níže. Je známo, že přes vysokou dostupnost neinvazivních vyšetření jsou cévy u pacientů s TIA často nedostatečně vyšetřovány, dle vlastních zkušeností především intrakraniální [29]. K vyšetření tepenného systému můžeme volit z několika neinvazivních modalit (ultrazvuk (UZ), CTA, MRA) [30 – 32]. Ideální vstupní vyšetření je CTA (v případě použití CT k zobrazení mozku), která poskytne velmi rychlou a kompletní vizualizaci extra - i intrakraniálních mozkových tepen. Alternativou je při kontraindikaci CTA nebo preferenci MR provedení MRA. Nejlevnější možností je UZ extrakraniálních mozkových tepen doplněný o TCD/ TCCS (Transcranial Doppler/ Transcranial Color Coded Sonography).
Mimo klasického UZ vyšetření (tzn. přímá vizualizace tepen, zhodnocení aterosklerotického plátu a určení směru a rychlostí krevního toku pomocí Dopplera se stanovením stupně stenózy) umožňuje UZ vyšetřit cerebrální vazomotorickou reaktivitu či detekovat mikroemboly. Bylo prokázáno, že porušená cerebrální vazomotorická reaktivita a detekce mikroembolizací u pacientů se stenózou vnitřní karotidy představuje vyšší riziko vzniku ipsilaterálního ischemického iktu. Přínos obou vyšetření pro klinickou praxi není jednoznačně stanoven, nicméně by tato vyšetření mohla identifikovat rizikovější podskupinu pacientů se stenózou vnitřní karotidy, u kterých není indikace endarterektomie jednoznačná (asymptomatické 60 – 99 % stenózy a symptomatické 50 – 69 % stenózy) [33 – 36].
Řada studií prokázala, že patologické nálezy na tepnách jsou asociovány s vyšším rizikem recidivy iktu po TIA/ minor stroke či s progresí symptomů. Jedná se především o pacienty s významnou stenózou (≥ 50 %) nebo okluzí extra - i intrakraniálních tepen [17,37 – 40].
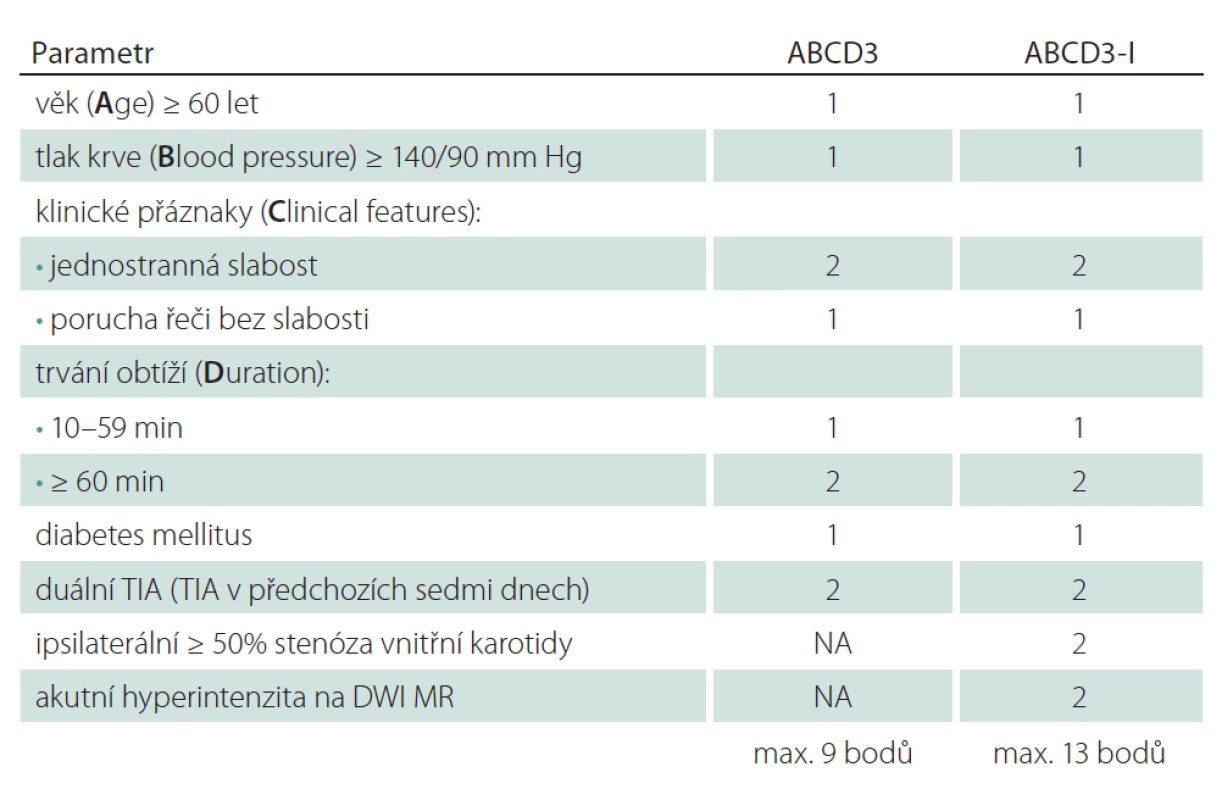
Zjištění, že zobrazovací metody mohou pomoci ve zpřesnění odhadu rizika u pacientů s TIA/ minor stroke vedlo k vytvoření nového skóre ABCD3-I. U ABCD3 je přidán oproti skóre ABCD2 další parametr – duální TIA (TIA v předchozích sedmi dnech), která je ohodnocena dalšími dvěma body. Do skóre ABCD3-I jsou implementována zobrazovací vyšetření – angiografie a DWI MR. Stenóza karotidy ≥ 50 % je hodnocena dvěma body a abnormální DWI MR dalšími dvěma body. Skóre ABCD3-I tedy dosahuje celkem 13 bodů (tab. 4). Může zlepšit odhad rizika u pacientů s TIA, nicméně jeho použití v klinické praxi musí být ještě validováno [41].
Souhrnně lze konstatovat, že vyšší riziko recidivy iktu, progrese neurologického deficitu a horšího výsledného funkčního stavu mají pacienti s infarktem na DWI MR či CT a s okluzí či významnou ≥ 50% stenózou extra-/ intrakraniální velké mozkové velké tepny. Mezi klinické prediktory progrese neurologického deficitu patří fluktuující symptomy a symptomy probíhající při prvním vyšetření. Vyšší pravděpodobnost horšího funkčního výsledku je asociována s věkem ≥ 60 let a NIHSS > 0.
Tento závěr v sobě implikuje i jednoduše zapamatovatelný logický algoritmus, který je jednoduché v klinické praxi sledovat: pacienti s infarktem na DWI MR nebo pacienti se stenózou tepny jsou indikováni k hospitalizaci a intenzivnějšímu managementu.
Terapie TIA/ minor stroke a nové léčebné postupy
Léčba TIA a minor stroke je založena na:
a) Ovlivnění modifikovatelných rizikových faktorů a jejich následků
Ovlivnění arteriální hypertenze, diabetu mellitu, kouření, srdečních chorob, hyperlipidemie, vysoké konzumace alkoholu, nedostatečné fyzické aktivity, obezity a nevhodných stravovacích návyků režimovými opatřeními, farmakologickými, chirurgickými a endovaskulárními postupy.
b) Léčba antiagregační
Z antiagregačních preparátů je možno použít kombinaci aspirinu (2 × 25 mg) a dipyridamolu (2 × 200 mg) nebo klopidogrel (1 × 75 mg), alternativně samostatný aspirin (1 × 75 – 150 mg). Aspirin snižuje relativní riziko ischemické CMP o 15 – 25 %. Kombinace aspirinu a dipyridamolu s protrahovaným uvolňováním je o něco účinnější než samotný aspirin a srovnatelná s účinností klopidogrelu. Kombinace aspirinu a klopidogrelu není dle guidelines ESO doporučena pro dlouhodobou prevenci, výjimkou jsou specifické situace (nestabilní angina pectoris, infarkt myokardu typu non-Q a nedávná implantace stentu) [42 – 47].
Na trhu existují další, novější antiagregancia (ticagrelor, prasugrel) účinnější než klopidogrel, která jsou zatím schválena jen v kardiologických indikacích [43]. V současné době probíhající studie SOCRATES (účastní se pracoviště v České republice) má za cíl zjistit, zdali terapie ticagrelorem je účinnější než terapie aspirinem u pacientů s TIA a minor stroke.
V současnosti se v sekundární prevenci TIA/ minor stroke začíná užívat i kombinace aspirinu a klopidogrelu. Použití této kombinace (mimo výše uvedené situace) se s odstupem tří měsíců od TIA/ iktu nedoporučuje.
Řada studií totiž neprokázala přínos kombinace aspirinu a klopidogrelu. Hlavním nedostatkem těchto studií je dlouhodobá a odložená duální terapie (studie MATCH a studie SPS3) a významný podíl asymptomatických pacientů (studie CHARISMA). Přes tyto nedostatky byl nalezen trend v redukci rizika recidivy iktů způsobených aterosklerózou velkých tepen, ale nikoliv lakunárních iktů (studie SPS3), a došlo k hraničně významné redukci rizika vzniku infarktu myokardu, iktu či smrti z kardiovaskulární příčiny u pacientů se symptomatickým aterotrombotickým onemocněním (studie CHARISMA). Tyto studie nepředstavují definitivní důkaz o neprospěchu duální terapie u pacientů po TIA/ mozkovém infarktu, protože stále není jisté, jestli podání v akutním (a ne chronickém) stadiu na omezené (nejrizikovější) období nemůže představovat prospěch [48 – 51].
Na možnost redukce recidivy ischemického iktu při použití duální antiagregace poukazují studie CARESS a CLAIR [52,53]. Prokázaly, že kombinace aspirinu a klopidogrelu u pacientů se stenózou extra - nebo intrakraniální mozkové tepny vede k redukci mikroembolizací oproti samotnému aspirinu.
První důkaz o prospěchu kombinace aspirinu s klopidogrelem u pacientů s akutní TIA a minor stroke přinesla nedávno publikovaná čínská studie CHANCE na rozsáhlém souboru 5 170 pacientů [54]. Terapie byla zahájena u všech pacientů do 24 hod a byla krátkodobá (tři týdny), což je hlavní rozdíl oproti dříve zmíněným studiím (např. MATCH či CHARISMA). Všem pacientům byl podán první den aspirin 75 – 300 mg. První skupina pacientů byla léčena klopidogrelem 300 mg první den (sytící dávka) s následným podáváním klopidogrelu 75 mg 90 dnů s aspirinem 75 mg 21 dnů. Druhá skupina pacientů dostala placebo a aspirin 75 mg 90 dnů. Byla prokázána vyšší účinnost kombinované terapie v redukci rizika recidivy iktu (ischemického nebo hemoragického) v prvních 90 dnech. Nedošlo ke zvýšení rizika krvácení. Otázka zůstává, zda jsou tyto výsledky studie CHANCE aplikovatelné na naši populaci. Aplikovatelné být totiž úplně nemusí, protože Číňané mají vyšší incidenci aterosklerózy velkých intrakraniálních tepen a vyšší prevalenci genetického polymorfizmu, který ovlivňuje metabolizmus klopidogrelu. Zdali duální antiagregace přináší prospěch i pro jinou populaci než čínskou, by měla zodpovědět právě probíhající podobně designovaná americká studie POINT [55].
Ve studii CHANCE nebyla zohledněna etiologie TIA/ minor stroke, nicméně lze předpokládat významné zastoupení pacientů s aterosklerózou intrakraniálních tepen, vzhledem k její vyšší prevalenci v čínské populaci. Na základě výsledků studií CHANCE, SPS3, CHARISMA, SAMMPRIS (viz níže), CARESS a CLAIR může být duální antiagregace (aspirin + klopidogrel) používána u pacientů s aterosklerózou velkých tepen. Měla by být nasazena co nejdříve od vzniku aterotrombotické ischemické mozkové příhody a omezena na nejrizikovější období (tři týdny až tři měsíce) od vzniku TIA/ ischemické CMP. To je však třeba ověřit ještě dalšími studiemi a do té doby zůstává monoterapie standardem léčby.
c) Antikoagulační terapie
Antikoagulační terapie je indikována především u pacientů s fibrilací síní, dále pak ve specifických situacích, jako jsou ateromy aorty, fuziformní aneuryzma bazilární tepny, cervikální arteriální disekce, foramen ovale patens za přítomnosti potvrzené hluboké žilní trombózy nebo aneuryzmatu septa síní, jak je uvedeno v guidelines ESO [42].
Nejčastější indikací k antikoagulační terapii je fibrilace síní. Kromě warfarinu můžeme v primární i sekundární prevenci použít u pacientů s fibrilací síní nová perorální antikoagulancia, jejichž hlavní výhody (méně potravinových a lékových interakcí a dobře predikovatelný účinek bez nutnosti monitorování) byly popsány i v řadě českých publikací. V současné době máme k dispozici tři preparáty – přímý inhibitor trombinu (dabigatran) a přímé inhibitory faktoru Xa (rivaroxaban a apixaban). Výběr konkrétního preparátu a dávkování je u každého pacienta individuální. Záleží především na riziku trombembolizmu a krvácení, na komorbiditách, obzvláště onemocnění ledvin, věku, compliance a dalších proměnných [56,57].
Neexistuje jasný důkaz, kdy bychom měli zahájit antikoagulační terapii po TIA či ischemickém iktu. Obecně je doporučováno, že po TIA bez prokázaného infarktu můžeme nasadit antikoagulancia ihned, při nálezu drobného infarktu bychom měli počkat tři dny, u středně velkého infarktu jeden týden a u velkých infarktů bychom měli odložit antikoagulační léčbu o nejméně dva týdny. Je třeba si uvědomit, že oproti warfarinu nastupuje u nových perorálních antikoagulancií efekt již po podání první dávky [58]. Bezpečnost podání dabigatranu již v akutní fázi (do 24 hod od vzniku) TIA/ minor stroke prokázala pilotní studie DATAS prezentovaná na ISC 2014 (International Stroke Conference). U žádného pacienta nedošlo ke vzniku symptomatického intracerebrálního krvácení [59].
Diagnostika fibrilace síní, a to především paroxysmální, vyžaduje dlouhodobou monitoraci. Standardní 12svodové EKG je velmi málo výtěžné. Dokonce výtěžnost 24hod monitorace je pouze několik málo procent (3 – 5 %) [58,60,61]. Je zřejmé, že pravděpodobnost záchytu arytmie se zvyšuje s celkovou délkou monitorace, což potvrdila studie EMBRACE. U pacientů s kryptogenním iktem, kteří byli monitorováni 30 dnů, došlo k záchytu fibrilace síní u více než 16 % [61]. Proto by u kryptogenních iktů měla být zvážena i dlouhodobější monitorace EKG. Řada firem uvádí na trh zařízení pro dlouhodobou monitoraci, většina je neinvazivních. Další možností je implantabilní monitorovací jednotka Reveal XT – malý bezelektrodový přístroj, který se implantuje do podkoží v prekordiu a umožňuje až tříletou kontinuální monitoraci s automatickou detekcí arytmií. Nevýhodou je cena a invazivita [62]. Význam dlouhodobé monitorace pacientů s kryptogenním iktem pomocí Reveal XT potvrdila studie CRYSTAL AF (441 pacientů). Fibrilace síní byla po šestiměsíční monitoraci detekována u 8,9 % pacientů s kryptogenním iktem, zatímco u kontrolní skupiny, která podstoupila standardní vyšetření, pouze u 1,4 %. Po třech letech (48 pacientů) byla detekována až u 30 %, což je téměř devětkrát více než u kontrolní skupiny [60]. Nález fibrilace síní u pacientů s kryptogenním iktem je klinicky velmi významný, protože vede ke změně terapie. U těchto pacientů je indikována trvalá antikoagulační léčba, protože antiagregace nepředstavuje účinnou prevenci CMP.
Zavedení dlouhodobé monitorace EKG u pacientů po TIA a minor stroke je nyní jednou z hlavních priorit klinické praxe, kterou je potřeba zásadně změnit (a to z hlediska organizace s mnohem větší angažovaností neurologů).
Na pracovišti autorů (LF MU a FN u sv. Anny v Brně) začala být dlouhodobá monitorace prováděna rutinně a záchyt fibrilace síní je 16 % při jednoměsíční monitoraci (zatím nepublikovaná data).
d) Karotická endarterektomie
Skutečnost, že po proběhlé TIA/ minor stroke u pacientů se symptomatickou významnou stenózou karotidy je indikováno provedení endarterektomie, a to hlavně časně, je potřeba nepodceňovat. Dle guidelines AHA/ ASA by měla být endarterektomie provedena do dvou týdnů od vzniku příhody (TIA/ minor stroke) [63]. Je třeba si uvědomit, že čím dříve je karotická endarterektomie provedena a čím významnější je stenóza, tím větší je redukce rizika recidivy iktu [64].
e) Endovaskulární léčba intrakraniálních stenóz
Hlavní studie, která porovnává efekt agresivní neinvazivní léčby s agresivní neinvazivní léčbou + stentingem pomocí stentu Wingspan, je recentní studie SAMMPRIS [65]. Do studie byli zařazeni vysoce rizikoví pacienti s TIA/ neinvalidizujícím ischemickým iktem s významnou 70 – 99% intrakraniální stenózou velké tepny. U všech pacientů byla zahájena agresivní neinvazivní terapie, která zahrnovala duální antiagregaci (aspirin 325 mg denně po celou dobu sledování a klopidogrel 75 mg po 90 dnů od zařazení), intenzivní léčbu cévních rizikových faktorů s cílovým sTK pod 140 mm Hg (u diabetiků pod 130 mm Hg) a cílovou koncentrací LDL-cholesterolu pod 1,81 mmol/ l a úpravu životního stylu. Ukázalo se, že pacienti léčení neinvazivně měli nižší riziko iktu, úmrtí i významných krvácivých komplikací jak v krátkém období od první příhody (30 dnů), tak v delším časovém úseku (2 – 3 roky). Dle FDA (Food and Drug Administration) je indikováno endovaskulární ošetření intrakraniální 70 – 99% stenózy stentem Wingspan jen u pacientů, kteří prodělají dva a více ischemických iktů i přes agresivní medikamentózní léčbu. Příčinou selhání endovaskulární léčby s velkým množstvím periprocedurálních iktů může být jak obtížnost výkonu, tak nedostatečná zkušenost intervenčních radiologů vzhledem k faktu, že endovaskulární ošetření intrakraniálních stenóz zůstává stále neobvyklým postupem. Hlavním poznatkem pro klinickou praxi ze studie SAMMPRIS je způsob použité konzervativní léčby, který byl překvapivě účinný u tak rizikové skupiny pacientů, a který je proto vhodné aplikovat na klinickou praxi.
f) Trombolýza
Metaanalýza devíti trombolytických studií (ATLANTIS A/ B, ECASS I/ II/ III, EPITHET, IST-3, NINDS A/ B) zahrnující celkově 6 756 pacientů prezentovaná na ICS 2014 přinesla velmi zajímavé výsledky o prospěchu trombolýzy [66]. Zjistila, že pokud byla trombolýza podána pacientům s NIHSS 0 – 4, měli tito pacienti 69% šanci na dosažení mRS 0 – 1, zatímco bez trombolýzy měli pouze 59% šanci. To znamená, že absolutně o 10 % více pacientů léčených trombolýzou bylo zcela vyléčeno. Rizikem postupu byl rozvoj fatálního intracerebrálního krvácení u tří pacientů (0,9 %).
V současnosti probíhá v Kanadě multicentrická studie TEMPO [67]. Pacientům s TIA/ minor stroke (NIHSS < 6) s prokázanou intrakraniální okluzí je experimentálně aplikována do 12 hod od vzniku systémová trombolýza – tenectepláza. Jsou studována dvě dávkovací schémata tenecteplázy (0,1 mg/ kg a 0,25 mg/ kg). Zatím jsou k dispozici výsledky první fáze studie (25 pacientů léčených dávkou 0,1 mg/ kg). Úpravy neurologického stavu (NIHSS 0 – 1) za 90 dnů dosáhlo 80 % pacientů a funkční úpravy (mRS 0 – 1) 56 % pacientů. Nebyly zaznamenány žádné komplikace léčby. Nyní probíhá nábor pacientů do druhé fáze studie (dávka 0,25 mg/ kg) a účast České republiky je zvažována.
Trombolýza je zatím experimentální léčba u pacientů s TIA a uzávěrem mozkové tepny.
g) Statiny
Řada studií potvrdila přínos statinů pro snížení rizika vzniku mozkového infarktu a ostatních kardiovaskulárních příhod u pacientů s nekardioembolickým iktem [43]. Největší studií zkoumající efekt vysoké dávky atorvastatinu (80 mg) v sekundární prevenci ischemického iktu a TIA je studie SPARCL [68]. Prokázala, že atorvastatin ve vysoké dávce 80 mg snížil významně riziko recidivy iktu nebo závažnějších kardiovaskulárních příhod bez ohledu na etiologii první ischemické CMP (nebyly zahrnuty kardioembolické ikty). Analýza podskupin naznačila, že nejvíce by mohli z této terapie profitovat pacienti s onemocněním karotidy. Z toho vyplývá, že podobně vyšší benefit by mohli mít i pacienti s aterosklerózou aorty a intrakraniálních tepen [69]. Ve skupině pacientů léčených atorvastatinem byla vyšší incidence hemoragických iktů (2,3 vs. 1,4 %). Riziko vzniku/ recidivy hemoragického iktu byla největší u pacientů s lakunárním ischemickým iktem (pětkrát vyšší riziko) a u pacientů s intracerebrálním krvácením (čtyřikrát vyšší riziko) [70].
Dle amerických guidelines AHA/ ASA (2010) by cílová hodnota LDL-cholesterolu měla být u pacientů po aterosklerotické CMP < 2,59 mmol/ l, pokud nemají současně onemocnění koronárních tepen. Mají-li onemocnění koronárních tepen, měli bychom dosáhnout snížení LDL-cholesterolu alespoň o 50 % výchozí hodnoty nebo < 1,81 mmol/ l [71]. Evropské guidelines ESO (2008) uvádějí, že u pacientů s nekardioemboligenním iktem je doporučena léčba statinem [43].
Dle výše řečeného se domníváme, že užití vysokých dávek statinu by mělo být rezervováno především pro pacienty s aterosklerózou velkých tepen. U pacientů s intrakraniálním krvácením a u lakunárních iktů bychom měli být opatrnější a použít dávky nižší.
Souhrn a navrhovaný algoritmus péče o pacienty po TIA/ minor stroke (schéma 1)

a) Management pacientů dle zjištěného rizika
- Riziko konkrétního pacienta zjistíme na základě neurologického vyšetření a zobrazovacího vyšetření mozkového parenchymu a extra - i intrakraniálních tepen, které by mělo být provedeno ihned po klinickém vyšetření či nejpozději do 24 hod (primárně MR se sekvencí DWI, při nedostupnosti MR provedením CT).
- Vysoce rizikoví pacienti s klinickou manifestací TIA/ minor stroke do 48 hod by měli být došetřeni za hospitalizace, prvních 24 hod od vzniku symptomatiky (nebo pokud jsou jiné důvody k monitoraci – např. kardiovaskulární, respirační) na monitorovaném lůžku; ostatní lze došetřit ambulantně.
b) Medikamentózní terapie
- Zahájení ihned po vyloučení jiné příčiny symptomů na zobrazovacím vyšetření.
- Z antiagregačních preparátů možno použít aspirin v úvodní dávce 200 – 300 mg p.o. nebo 500 mg i.v., následně pak dávku 75 – 150 mg, event. kombinaci aspirinu (2 × 25 mg) s dipyridamolem (2 × 200 mg); alternativou je klopidogrel 75 mg denně, v úvodu zvážit podání sytící dávky 300 – 600 mg (sytící dávka nezvýší hladinu, ale urychlí její nástup).
- U pacientů po TIA/ minor stroke aterotrombotické etiologie zvážit nasazení duální antiagregace (aspirin + klopidogrel) na tři týdny až tři měsíce s následnou monoterapií (za předpokladu, že není vysoké riziko krvácení); sledovat publikace, zdali efekt časné duální antiagregace bude potvrzen nebo budou nalezeny účinnější způsoby monoterapie (např. v současné době testovaný ticagrelor).
- Antikoagulační terapie u kardioembolizačního mechanizmu; u TIA možno nasadit okamžitě; dlouhodobá monitorace, pokud fibrilace síní a jiná zjevná příčina není přítomna.
- Okamžitě zahájit intenzivní léčbu cévních rizikových faktorů (medikamentózní, režimová opatření).
- Cílový sTK pod 140 mm Hg (u diabetiků pod 130 mm Hg).
- Cílová koncentrace LDL-cholesterolu u pacientů po aterosklerotické CMP pod 2,59 mmol/ l u pacientů bez současného onemocnění koronárních tepen a pod 1,81 mmol/ l u pacientů s onemocněním koronárních tepen a/ nebo intrakraniální 70 – 99% stenózou.
- Vysoké dávky statinu použít u pacientů s aterosklerózou velkých tepen, u pacientů s lakunárním iktem a po předchozím intracerebrálním krvácení použít spíše nižší dávky vzhledem k vyššímu riziku vzniku hemoragického iktu.
c) Endarterektomie
- U symptomatické významné 70 – 99% stenózy vnitřní karotidy je nutné její provedení do dvou týdnů od vzniku příznaků (pokud nejsou kontraindikace k operaci).
Závěr
TIA a minor stroke patří mezi velmi častá cévní onemocnění mozku, jejichž příznaky jsou laiky a často i zdravotníky mimo neurologickou specializaci nesprávně hodnoceny a bagatelizovány. Je třeba je vždy hodnotit jako urgentní situaci, protože jde o varování s různě velkým rizikem vzniku těžkého iktu. Toto riziko lze zjištěním specifických klinických a paraklinických markerů poměrně lehce a rychle kvantifikovat, což nám určí správný management pacientů. Především u pacientů s vysokým rizikem je nutné zahájit diagnostiku a agresivní terapii okamžitě. Správným řešením těchto situací docílíme snížení rizika recidivy/ progrese iktu a jeho negativního dopadu na pacientovu soběstačnost a kvalitu života. Nesprávným postupem je nadužívání diagnózy TIA u pacientů, kteří mají izolované neurologické symptomy (např. vertigo), protože i v těchto případech dochází ke zhoršení kvality života pacientů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Miroslav Škorňa
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: mskorna@seznam.cz
Přijato k recenzi: 10. 11. 2014
Přijato do tisku: 5. 3. 2015
Sources
1. Neumann J, Mikulík R, Václavík D, et al. Standard pro diagnostiku a léčbu pacientů po tranzitorní ischemické atace. Dostupné z URL: www.czech-neuro.cz/ data/ k/ W/ A/ phpkWAE7u.doc.
2. Mohr JP. Historical perspective. Neurology 2004;62(Suppl 6):S3 – 6.
3. Easton JD, Saver JL, Albers GW, et al. Definition and evaluation of transient ischemic attack: a scientific statement for healthcare professionals from the american heart association/ american stroke association stroke council; council on cardiovascular surgery and anesthesia; council on cardiovascular radiology and intervention; council on cardiovascular nursing; and the interdisciplinary council on peripheral vascular disease. The american academy of neurology affirms the value of this statement as an educational tool for neurologists. Stroke 2009;40(6):2276 – 93. doi: 10.1161/ STROKEAHA.108.192218.
4. Giles MF, Albers GW, Amarenco P, et al. Early stroke risk and ABCD2 score performance in tissue - vs time-defined tia: a multicenter study. Neurology 2011;77(13):1222 – 8. doi: 10.1212/ WNL.0b013e3182309f91.
5. Transient ischemic attack of the brain. Available from URL: http:/ / id.who.int/ icd/ entity/ 1050192520.
6. Fischer U, Baumgartner A, Arnold M, et al. What is a minor stroke? Stroke 2010;41(4):661 – 6. doi: 10.1161/ STROKEAHA.109.572883.
7. Coutts SB, Modi J, Patel SK, et al. What causes disability after transient ischemic attack and minor stroke?: results from the ct and mri in the triage of tia and minor cerebrovascular events to identify high risk patients (CATCH) study. Stroke 2012;43(11):3018 – 22. doi: 10.1161/ STROKEAHA.112.665141.
8. Luengo-Fernandez R, Gray AM, Bull L, et al. Quality of life after tia and stroke: Ten-year results of the oxford vascular study. Neurology 2013;81(18):1588 – 95. doi: 10.1212/ WNL.0b013e3182a9f45f.
9. Albers GW, Caplan LR, Easton JD, et al. Transient ischemic attack – proposal for a new definition. N Engl J Med 2002;347(21):1713 – 6.
10. Johnston SC, Gress DR, Browner WS, et al. Short-term prognosis after emergency department diagnosis of TIA. JAMA 2000;284(22):2901 – 6.
11. Kleindorfer D, Panagos P, Pancioli A, et al. Incidence and short-term prognosis of transient ischemic attack in a population-based study. Stroke 2005;36(4):720 – 3.
12. Brown RD, Petty GW, O‘Fallon WM, et al. Incidence of transient ischemic attack in Rochester, Minnesota, 1985 – 1989. Stroke 1998;29(10):2109 – 13.
13. Cancelli I, Janes F, Gigli GL, et al. Incidence of transient ischemic attack and early stroke risk: validation of the ABCD2 score in an Italian population-based study. Stroke 2011;42(10):2751 – 7. doi: 10.1161/ STROKEAHA.110.612705.
14. Rothwell PM, Giles MF, Chandratheva A, et al. Effect of urgent treatment of transient ischaemic attack and minor stroke on early recurrent stroke (EXPRESS study): a prospective population-based sequential comparison. Lancet 2007;370(9596):1432 – 42.
15. Johnston SC, Rothwell PM, Nguyen-Huynh MN, et al. Validation and refinement of scores to predict very early stroke risk after transient ischaemic attack. Lancet 2007; 69(9558):283 – 92.
16. Coutts SB, Sylaja PN, Choi YB, et al. The ASPIRE approach for TIA risk stratification. Can J Neurol Sci 2011;38(1):78 – 81.
17. Coutts SB, Modi J, Patel SK, et al. CT/ CT angiography and MRI findings predict recurrent stroke after transient ischemic attack and minor stroke: results of the prospective CATCH study. Stroke 2012;43(4):1013 – 7. doi: 10.1161/ STROKEAHA.111.637421.
18. Haacke EM, DelProposto ZS, Chaturvedi S, et al. Imaging cerebral amyloid angiopathy with susceptibility-weighted imaging. AJNR Am J Neuroradiol 2007;28(2):316 – 7.
19. Guo LF, Wang G, Zhu XY, et al. Comparison of ESWAN, SWI-SPGR, and 2D T2*-weighted gre sequence for depicting cerebral microbleeds. Clin Neuroradiol 2013;23(2):121 – 7. doi: 10.1007/ s00062-012-0185-7.
20. Merino JG, Warach S. Imaging of acute stroke. Nat Rev Neurol 2010;6(10):560 – 71. doi: 10.1038/ nrneurol.2010.129.
21. Ebinger M, Galinovic I, Rozanski M, et al. Fluid-attenuated inversion recovery evolution within 12 hours from stroke onset: a reliable tissue clock? Stroke 2010;41(2):250 – 5. doi: 10.1161/ STROKEAHA.109.568410.
22. Nael K, Khan R, Johnson K, et al. Acute MR stroke protocol in six minutes. MAGNETOM Flash 2013;5 : 44 – 50.
23. Izenberg A, Aviv RI, Demaerschalk BM, et al. Crescendo transient aura attacks: A transient ischemic attack mimic caused by focal subarachnoid hemorrhage. Stroke 2009;40(12):3725 – 9. doi: 10.1161/ STROKEAHA.109.557009.
24. Connolly ES, Rabinstein AA, Carhuapoma JR, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the american heart association/ american stroke association. Stroke 2012;43(6):1711 – 37. doi: 10.1161/ STR.0b013e3182587839.
25. Mitchell P, Wilkinson ID, Hoggard N, et al. Detection of subarachnoid haemorrhage with magnetic resonance imaging. J Neurol Neurosurg Psychiatry 2001;70(2):205 – 11.
26. Moreau F, Modi J, Almekhlafi M, et al. Early magnetic resonance imaging in transient ischemic attack and minor stroke: do it or lose it. Stroke 2013;44(3):671 – 74. doi: 10.1161/ STROKEAHA.111.680033.
27. Reif M, Mikulík R. Zobrazovací vyšetření u mozkového infarktu. Neurol Prax 2006;6 : 317 – 20.
28. Asdaghi N, Hill MD, Coulter JI, et al. Perfusion MR predicts outcome in high-risk transient ischemic attack/ minor stroke: a derivation-validation study. Stroke 2013;44(9):2486 – 92. doi: 10.1161/ STROKEAHA.111.000208.
29. Gladstone DJ, Kapral MK, Fang J, et al. Management and outcomes of transient ischemic attacks in Ontario. CMAJ 2004;170(7):1099 – 104.
30. Buskens E, Nederkoorn PJ, Buijs-Van Der Woude T, et al. Imaging of carotid arteries in symptomatic patients: cost-effectiveness of diagnostic strategies. Radiology 2004;233(1):101 – 12.
31. Josephson SA, Bryant SO, Mak HK, et al. Evaluation of carotid stenosis using CT angiography in the initial evaluation of stroke and TIA. Neurology 2004;63(3):457 – 60.
32. Wardlaw JM, Chappell FM, Stevenson M, et al. Accurate, practical and cost-effective assessment of carotid stenosis in the UK. Health Technol Assess 2006;10(30):iii – iv,ix – x,1 – 182.
33. Silvestrini M, Vernieri F, Pasqualetti P, et al. Impaired cerebral vasoreactivity and risk of stroke in patients with asymptomatic carotid artery stenosis. JAMA 2000;283(16):2122 – 7.
34. Markus HS, MacKinnon A. Asymptomatic embolization detected by doppler ultrasound predicts stroke risk in symptomatic carotid artery stenosis. Stroke 2005;36(5):971 – 5.
35. Molloy J, Markus HS. Asymptomatic embolization predicts stroke and TIA risk in patients with carotid artery stenosis. Stroke 1999;30(7):1440 – 3.
36. Siebler M, Nachtmann A, Sitzer M, et al. Cerebral microembolism and the risk of ischemia in asymptomatic high-grade internal carotid artery stenosis. Stroke 1995;26(11):2184 – 6.
37. Purroy F, Montaner J, Delgado P, et al. Usefulness of urgent combined carotid/ transcranial ultrasound testing in early prognosis of TIA patients. Med Clin (Barc) 2006;126(17):647 – 50.
38. Coutts SB, Hill MD, Eliasziw M, et al. Final 2 year results of the vascular imaging of acute stroke for identifying predictors of clinical outcome and recurrent ischemic events (VISION) study. BMC Cardiovasc Disord 2011;11(4):18. doi: 10.1186/ 1471-2261-11-18.
39. Horton M, Modi J, Patel SK, et al. Refinement of imaging predictors of recurrent events following transient ischemic attack and minor stroke. PLoS One 2013;8(6):e65752.
40. Coutts SB, O‘Reilly C, Hill MD, et al. Computed tomography and computed tomography angiography findings predict functional impairment in patients with minor stroke and transient ischaemic attack. Int J Stroke 2009;4(6):448 – 53. doi: 10.1111/ j.1747-4949.2009.00346.x.
41. Merwick A, Albers GW, Amarenco P, et al. Addition of brain and carotid imaging to the ABCD² score to identify patients at early risk of stroke after transient ischaemic attack: a multicentre observational study. Lancet Neurol 2010;9(11):1060 – 9. doi: 10.1016/ S1474-4422(10)70240-4.
42. Herzig R, Školoudík D, Šaňák D. Management ischemické cévní mozkové příhody a tranzitorní ischemické ataky – doporučení european stroke organisation (ESO) 2008 – zestručněná česká verze. Cesk Slov Neurol N 2008;71/ 104(3):364 – 71.
43. Kalita Z. Farmakologická sekundární prevence nekardioemboligenního mozkového infarktu/ tranzitorní ischemické ataky – současnost a budoucnost. Cesk Slov Neurol N 2011;74/ 107(3):261 – 72.
44. Malloy RJ, Kanaan AO, Silva MA, et al. Evaluation of antiplatelet agents for secondary prevention of stroke using mixed treatment comparison meta-analysis. Clin Ther 2013;35(10):1490 – 500. doi: 10.1016/ j.clinthera.2013.09.004.
45. Chaturvedi S. Acetylsalicylic acid + extended-release dipyridamole combination therapy for secondary stroke prevention. Clin Ther 2008;30(7):1196 – 205.
46. Sacco RL, Diener HC, Yusuf S, et al. Aspirin and extended-release dipyridamole versus clopidogrel for recurrent stroke. N Engl J Med 2008;359(12):1238 – 51. doi: 10.1056/ NEJMoa0805002.
47. Creager MA. Results of the CAPRIE trial: efficacy and safety of clopidogrel. Clopidogrel versus aspirin in patients at risk of ischaemic events. Vasc Med 1998;3(3):257 – 60.
48. Schipperheijn JJ. Results of the match trial on stroke prevention. Neth Heart J 2004;12(7/ 8):371 – 2.
49. Diener HC, Bogousslavsky J, Brass LM, et al. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomized, double-blind, placebo-controlled trial. Lancet 2004;364(9431):331 – 7.
50. Benavente OR, Hart RG, McClure LA, et al. Effects of clopidogrel added to aspirin in patients with recent lacunar stroke. N Engl J Med 2012;367(9):817 – 25. doi: 10.1056/ NEJMoa1204133.
51. Bhatt DL, Fox KA, Hacke W, et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006;354(16):1706 – 17.
52. Markus HS, Droste DW, Kaps M, et al. Dual antiplatelet therapy with clopidogrel and aspirin in symptomatic carotid stenosis evaluated using doppler embolic signal detection: the clopidogrel and aspirin for reduction of emboli in symptomatic carotid stenosis (CARESS) trial. Circulation 2005;111(17):2233 – 40.
53. Wang X, Lin WH, Zhao YD, et al. The effectiveness of dual antiplatelet treatment in acute ischemic stroke patients with intracranial arterial stenosis: a subgroup analysis of clair study. Int J Stroke 2013;8(8):663 – 8. doi: 10.1111/ j.1747-4949.2012.00828.x.
54. Wang Y, Johnston SC. Clopidogrel with aspirin in minor stroke or transient ischemic attack. N Engl J Med 2013;369(1):1376 – 7. doi: 10.1161/ CIRCULATIONAHA.114.014791.
55. Johnston SC, Easton JD, Farrant M, et al. Platelet-oriented inhibition in new TIA and minor ischemic stroke (POINT) trial: rationale and design. Int J Stroke 2013;8(6):479 – 83. doi: 10.1111/ ijs.12129.
56. Cairns JA. Which oral anticoagulant for which atrial fibrillation patient: recent clinical trials and evidence-based choices. Can J Cardiol 2013;29(10):1165 – 72. doi: 10.1016/ j.cjca.2013.05.010.
57. Heidbuchel H, Verhamme P, Alings M, et al. European heart rhythm association practical guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Europace 2013;15(5):625 – 51. doi: 10.1093/ europace/ eut083.
58. Mandzia JL, Hill MD. Acute stroke management in patients with known or suspected atrial fibrillation. Can J Cardiol 2013;29(Suppl 7):S45 – 53. doi: 10.1016/ j.cjca.2013.04.031.
59. Butcher K, Kate M, Gioia L, et al. Safety and feasibility of acute dabigatran therapy in minor ischemic stroke patients without atrial fibrillation. International Stroke Conference; 2014 Feb 12 – 14; San Diego, California, USA.
60. Sanna T, Diener HC, Passman RS, et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014;370(26):2478 – 86. doi: 10.1056/ NEJMoa1313600.
61. Gladstone DJ, Spring M, Dorian P, et al. Atrial fibrillation in patients with cryptogenic stroke. N Engl JMed 2014;370(26):2467 – 77. doi: 10.1056/ NEJMoa1311376.
62. Wichterle D, Bulková V. Monitorace léčby fibrilace síní. Postgrad Med 2010;12(5):529 – 33.
63. Brott TG, Halperin JL, Abbara S, et al. 2011 ASA/ ACCF/ AHA/ AANN/ AANS/ ACR/ ASNR/ CNS/ SAIP/ SCAI/ SIR/ SNIS/ SVM/ SVS guideline on the management of patients with extracranial carotid and vertebral artery disease. A report of the american college of cardiology foundation/ american heart association task force on practice guidelines, and the american stroke association, american association of neuroscience nurses, american association of neurological surgeons, american college of radiology, american society of neuroradiology, congress of neurological surgeons, society of atherosclerosis imaging and prevention, society for cardiovascular angiography and interventions, society of interventional radiology, society of neurointerventional surgery, society for vascular medicine, and society for vascular surgery. Circulation 2011;124(4):e54 – 130. doi: 10.1161/ CIR.0b013e31820d8c98.
64. Rothwell PM, Eliasziw M, Gutnikov SA, et al. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet 2004;363(9413):915 – 24.
65. Derdeyn CP, Chimowitz MI, Lynn MJ, et al. Aggressive medical treatment with or without stenting in high-risk patients with intracranial artery stenosis (SAMMPRIS): the final results of a randomized trial. Lancet 2014;383(9914):333 – 41. doi: 10.1016/ S0140-6736(13)62038-3.
66. Emberson J. Impact of treatment delay, age and stroke severity on the effects of intravenous thrombolysis with alteplase in acute ischemic stroke: an individual-patient-data meta-analysis. International Stroke Conference; 2014 Feb 12 – 14; San Diego, California, USA.
67. Dubuc V, Mandzia J, Hill M, et al. Thormbolysis for minor ischemic stroke with proven acute symptomatic occlusion using TNK-tPA (TEMPO-1). International Stroke Conference; 2014 Feb 12 – 14; San Diego, California, USA.
68. Amarenco P, Benavente O, Goldstein LB, et al. Results of the stroke prevention by aggressive reduction in cholesterol levels (SPARCL) trial by stroke subtypes. Stroke 2009;40(4):1405 – 9. doi: 10.1161/ STROKEAHA.108.534107.
69. Huisa BN, Stemer AB, Zivin JA. Atorvastatin in stroke: a review of SPARCL and subgroup analysis. Vasc Health Risk Manag 2010;6 : 229 – 36.
70. Goldstein LB, Amarenco P, Szarek M, et al. Hemorrhagic stroke in the stroke prevention by aggressive reduction in cholesterol levels study. Neurology 2008;70(2):2364 – 70.
71. Furie KL, Kasner SE, Adams RJ, et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack: a guideline for healthcare professionals from the american heart association/ american stroke association. Stroke 2011;42(1):227 – 76. doi: 10.1161/ STR.0b013e3181f7d043.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2016 Issue 2
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Gliomy limbického a paralimbického systému, technika a výsledky resekcí
- Nová éra endovaskulární terapie v léčbě akutních iktů
- Nanočástice jako nosiče léků přes hematoencefalickou bariéru – naděje pro léčbu neurodegenerativních onemocnění v budoucnosti?
- Robotická rehabilitace chůze
- Výsledky studií srovnávajících efekt angioplastik a endarterektomií v léčbě karotických stenóz
- Management tranzitorní ischemické ataky a minor stroke
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy
- Kognice a hemodynamika po karotické endarterektomii pro asymptomatickou stenózu
- Klinická rekognícia spinálneho lipómu a chirurgické riešenie vlastného súboru
- Využití CT perfuze a multifázické CT angiografie v predikci rozvoje maligního mozkového edému u pacientů s akutním mozkovým infarktem
- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Neurosarkoidóza u muže středního věku – kazuistika
- Doporučení pro rekanalizační léčbu akutního mozkového infarktu – verze 2016
- Neobvyklé endovaskulární řešení trombózy mozkových splavů použitím aspiračního systému – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Management tranzitorní ischemické ataky a minor stroke
- Neurosarkoidóza u muže středního věku – kazuistika
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy