Diabetická retinopatie a změny nervových vláken hodnocené konfokální mikroskopií rohovky
Diabetic Retinopathy and Changes in Corneal Nerve Fibers Assessed by Confocal Microscopy
Aim:
The aim of the study was to test possible correlation between corneal sub-basal nerve plexus changes and the grade of diabetic retinopathy (DR).
Methods:
A total of 38 patients with type 1 diabetes, divided into three groups according to the grade of diabetic retinopathy, and 12 age-matched healthy subjects underwent corneal confocal microscopy. Corneal main nerve fiber density (CNFD), total corneal nerve fiber density (t-CNFD), nerve fiber length (CNFL) and nerve tortuosity (CNFT) were evaluated.
Results:
CNFD was lower in patients without DR, with mild grade DR, and with advanced grade DR than in healthy subjects (p < 0.0001, p = 0.004 and p < 0.0001, respectively). There was also lower CNFD in patients with advanced grade DR than with mild grade DR (p = 0.036). T-CNFD was lower in patients without DR and advanced grade DR than in healthy subjects (p = 0.024 and p < 0.0001, respectively). CNFL was lower in patients without DR and advanced grade DR than in healthy subjects (p = 0.028). CNFT was higher in patients with advanced grade DR than in healthy subjects and patients without DR (p < 0.0001; p = 0.001).
Conclusion:
We demonstrated changes in corneal sub-basal nerve fiber count in all diabetic patient groups, with or without DR. The changes were more pronounced in patients without DR than with mild grade DR. The study suggests no direct correlation between progression of corneal nerve fiber changes and changes in DR.
Key words:
confocal microscopy – cornea – small fiber neuropathy – diabetes mellitus type 1 – diabetic retinopathy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
糖尿病性视网膜病和神经纤维的改变额定角膜共聚焦显微镜
摘要
目标:
研究I型糖尿病患视网膜病患患者角膜神经丛变化与糖尿病程度的相关性。
方法:
根据角膜共聚焦显微镜检查,根据糖尿病性视网膜病的程度(DR)将38例患者分为三组,以及12名健康志愿者。评价神经纤维和芯毛(CNFD,CNFD)的数量,总长度(CNFL)和扭曲(CNFT)。
结果:
轻度和重度DR患者的CNFD比健康人降低(P <0.0001,P = 0.004,P <0.0001)。 CNFD在较低组比DR轻微程度(P = 0.036),重度。 T-CNFD在较低没有DR和DR严重组较健康者(P = 0.024,P <0.0001)。 CNFL较健康无DR和DR组中重度低受试者(P = 0.007,P <0.0001),重症患者有轻步比较DR(p值= 0.028)。 CNFT是比较健康有严重的DR组高个人和无DR组(p <0.0001; P = 0.001)。
结论:
我们证明角膜受损神经纤维的DM患者所有组
1.变化更为明显在患者无DR比DR的程度轻微。这表明角膜神经纤维受损程度和DR的程度不平行。
关键词:
共聚焦显微镜 - 角膜 - 糖尿病第一类型 - 糖尿病视网膜病变
Authors:
M. Česká Burdová 1; T. Lainová Vrabcová 1; D. Dotřelová 1; G. Mahelková 1,2
Authors‘ workplace:
Oční klinika dětí a dospělých 2. LF UK a FN Motol, Praha
1; Ústav fyziologie, 2. LF UK v Praze
2
Published in:
Cesk Slov Neurol N 2017; 80/113(1): 59-65
Category:
Original Paper
Overview
Cíl:
Testovat korelaci změn subbazálního nervového plexu rohovky a stupně diabetické retinopatie u pacientů s diabetes mellitus 1. typu (DM 1).
Metodika:
Konfokální mikroskopií rohovky bylo vyšetřeno 38 pacientů rozdělených do tří skupin podle stupně diabetické retinopatie (DR) a 12 zdravých dobrovolníků. Byl hodnocen počet všech nervových vláken a počet hlavních vláken (t-CNFD, CNFD), celková délka (CNFL) a jejich tortuozita (CNFT).
Výsledky:
CNFD byla u pacientů bez diabetické retinopatie, s lehkým a těžkým stupněm DR nižší než u zdravých jedinců (p < 0,0001; p = 0,004; p < 0,0001). CNFD byla nižší ve skupině s těžkým než s lehkým stupněm DR (p = 0,036). T-CNFD byla nižší ve skupině bez DR a s těžkým stupněm DR než u zdravých jedinců (p = 0,024; p < 0,0001). CNFL byla nižší ve skupině bez DR a s těžkým stupněm DR než u zdravých jedinců (p = 0,007; p < 0,0001) a u pacientů s těžkým stupněm oproti lehkému stupni DR (p = 0,028). CNFT byla vyšší ve skupině s těžkým stupněm DR oproti zdravým jedincům i skupině bez DR (p < 0,0001; p = 0,001).
Závěr:
Prokázali jsme postižení nervových vláken rohovky ve všech skupinách pacientů s DM 1. Změny byly výraznější u pacientů bez DR než s lehkým stupněm DR. To naznačuje, že míra postižení nervových vláken rohovky a stupeň DR neprobíhají paralelně.
Klíčová slova:
konfokální mikroskopie – rohovka – neuropatie tenkých vláken – diabetes mellitus 1. typu – diabetická retinopatie
Úvod
Počet pacientů s diabetes mellitus (DM) v posledních letech celosvětově značně narůstá. Od počátku 21. století se hovoří již o epidemii diabetu [1]. Diabetická retinopatie (DR) a neuropatie (DN) jsou spolu s diabetickou nefropatií nejvážnější mikroangiopatické komplikace DM.
Z hlediska oftalmologie je v popředí zájmu především DR, která je vedoucí příčinou slepoty ve vyspělých zemích ve věkové kategorii 25–65 let. Prevalence u pacientů s DM 1. typu (DM 1) je až 71 % [2]. Její výskyt stoupá s délkou trvání DM 1 a po 20 letech má alespoň lehký stupeň DR až 92 % pacientů [3] .
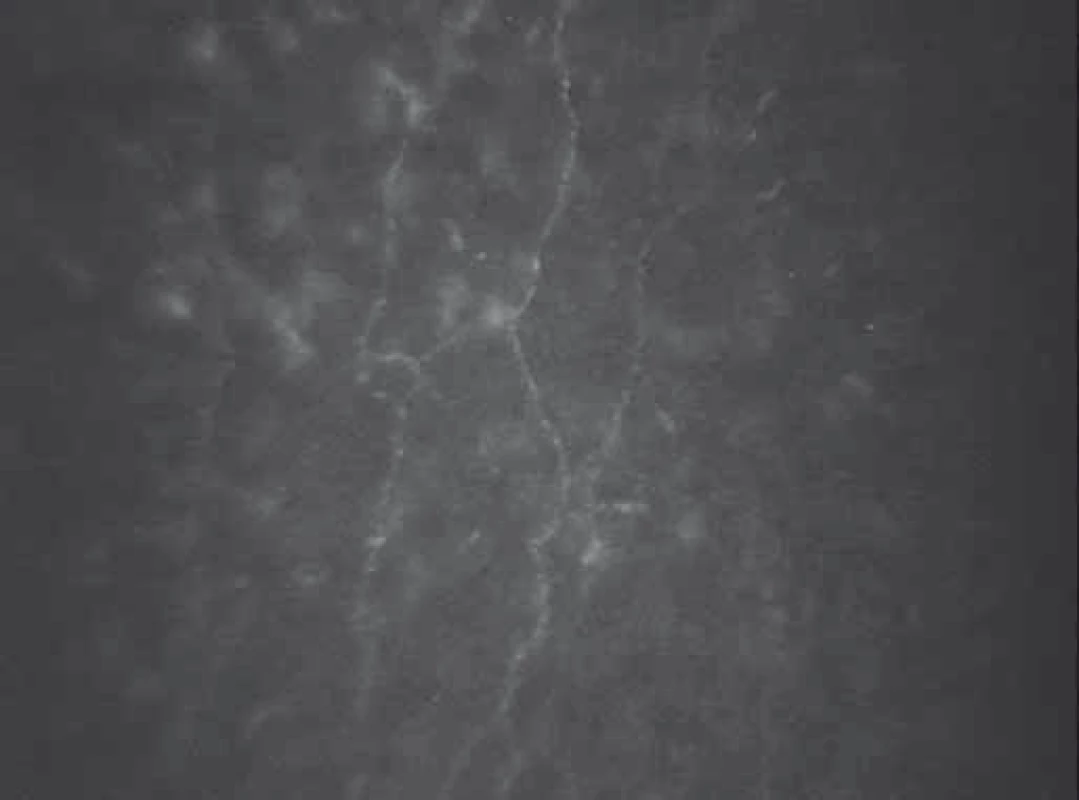
Vedle DR se v oftalmologii v současné době věnuje značná pozornost změnám v rohovce a ostatních tkáních povrchu oka [4]. Rohovka patří mezi tkáně s nejhustší inervací v lidském těle. Hustota nervového zakončení je 300–400× větší než v lidské pokožce. Nervové zásobení rohovky je tvořeno volnými terminálními zakončeními senzitivních nervových vláken nn. ciliares longi (n. ophthalmicus via n. nasociliaris). Vstupují do rohovky skrz skléru v oblasti limbu rohovky a vytvářejí stromální plexus (stromální nervová vlákna). Před průchodem Bowmanovou membránou se vlákna větví do subbazálního nervového plexu, poté se otáčí o 90 stupňů směrem k povrchu rohovky, prochází Bowmanovou membránou a končí jako volná subepiteliální nervová zakončení [5–7]. Vlákna subbazálního nervového plexu probíhají paralelně s povrchem rohovky, proto jsou velmi dobře hodnotitelná ve svém průběhu pomocí nově se rozvíjející zobrazovací metody – in vivo konfokální mikroskopie rohovky (Corneal Confocal Microscopy; CCM) [8]. Termín konfokální (confocal) znamená „mající společné ohnisko“ a označuje se jím optické uspořádání, ve kterém jsou objektiv a kondenzor mikroskopu zaostřeny na stejný bod neboli ohnisko. U CCM je světlo bodového zdroje zaostřeno na vybraný bod do roviny objektu a světlo odražené je zaostřeno na bodovou clonu, která zachytí světlo přicházející z okolí, tzn. ze stran a z míst nad ohniskovou rovinou i pod ní. Tato clona tedy působí jako prostorový filtr a světlo nenesoucí informaci ze zvoleného bodu je z tvorby výsledného obrazu vyloučeno. Konfokální obrazy jsou vždy zaostřené a představují optické řezy vzorkem. Výsledná zobrazovací soustava má malou hloubku ostrosti a vysokou rozlišovací schopnost [9]. Díky tomuto uspořádání získáme obraz jednotlivých vrstev rohovky ve frontální rovině. In vivo tak lze hodnotit změny struktury všech vrstev rohovky na mikroskopické úrovni, vč. nervových vláken subbazálního nervového plexu rohovky [10,11].
Abnormality rohovky u pacientů s DM jsou označovány termínem diabetická keratopatie, která zahrnuje i rohovkovou neuropatii. Ta je důsledkem narušení celistvosti nervové pleteně rohovky [1,12]. Dosavadní studie naznačují velmi dobrou korelaci úbytku nervových vláken subbazálního nervového plexu rohovky hodnoceného pomocí CCM s DN zjištěnou v současnosti používanými klinickými a paraklinickými vyšetřovacími postupy [13]. Obdobně jako u DR výskyt DN stoupá s délkou trvání diabetu, přičemž její prevalence je až 50 % [14]. Společný patofyziologický podklad uváděný v patofyziologických, epidemiologických a některých genetických studiích naznačuje závislost výskytu DR (zejména těžších stupňů) a DN [15].
Cílem naší prospektivní studie bylo porovnat stav nervových vláken subbazálního nervového plexu rohovky u pacientů s DM 1 s různým stupněm DR a kontrolní skupinou jedinců bez DM.
Materiál a metodika
Do studie byli zařazeni dospělí pacienti Oční kliniky dětí a dospělých 2. LF UK a FN Motol a dobrovolníci z řad zdravých pacientů, personálu a studentů 2. LF UK. Všichni účastníci studie podepsali informovaný souhlas schválený etickou komisí FN Motol. V rámci očního vyšetření byla odebrána celková a oční anamnéza a zároveň bylo provedeno zhodnocení předního a zadního segmentu oka. Do studie byly zařazeny jen subjekty s normálním nálezem na předním segmentu oka. Ze studie byli vyřazeni nositelé kontaktních čoček a pacienti s onemocněním nebo po operaci předního segmentu oka, glaukomem a ostatní pacienti užívající chronickou lokální terapii s obsahem konzervačních látek. Pacienti s DM 1 byli dle Early Treatment of Diabetic Retinopathy Study (ETDRS) rozděleni na tři skupiny dle stupně DR [16,17]. První skupinu tvořili pacienti bez DR. Druhá skupina obsahovala pacienty s nálezem neproliferativní diabetické retinopatie (NPDR) maximálně do stupně modica (NPDR levis + modica) označované jako lehký stupeň DR nevyžadující laserové ošetření sítnice v rozsahu panretinální fotokoagulace sítnice (PRP). Třetí skupinu tvořili pacienti s proliferativní diabetickou retinopatií (PDR) a těžkou NPDR (NPDR gravis + PDR) označovanou jako těžký stupeň DR, u kterých již pro pokročilost ischemických změn sítnice je zahájení laserového ošetření sítnice v rozsahu PRP dle ETDRS indikováno. Následně byly vzájemně porovnány nálezy u skupiny zdravých jedinců a jednotlivých skupin s DM 1 rozdělených dle stupně DR.
Bylo provedeno vyšetření rohovky pomocí in vivo konfokálního mikroskopu (Confoscan 3.0, NIDEK Technologies, Itálie). Tento typ konfokálního mikroskopu používá pro osvětlení i pozorování aperturu ve formě úzké vertikální štěrbiny (Slit-Scanning Confocal Microscopy; SSCM). Zdrojem světla je 12V halogenová lampa. Mikroskop je vybaven 40× zvětšujícím, bezkontaktním, imerzním objektivem (Achroplan, Zeiss, Oberkochen, Germany). Laterální rozlišení je udáváno 1–2 µm, axiální rozlišení přibližně 26 µm. V souladu s návodem k použití byla po lokální aplikaci 0,4% oxybuprokainu (Benoxi, Unimed Pharma) a nanesení imerzního gelu (carbomerum, Vidisic gel, Bausch & Lomb) skenována centrální oblast rohovky (450 × 335 µm) v celé její tloušťce (v automatickém nebo semiautomatickém modu, 350 snímků na jeden cyklus). Předozadní posun objektivu byl nastaven na 5 µm. U každého oka bylo snímání provedeno nejméně dvakrát, sledovaná oblast rohovky byla zachycena min. 4–6krát. Následně byl vybrán nejkvalitnější snímek subbazálního nervového plexu z pravého i levého oka a průměr těchto hodnot použit k dalšímu hodnocení [18]. Confoscan 3 produkuje snímky s horší kvalitou v okrajových částech [19], proto byla hodnocena nervová vlákna pouze v centrální ostré části skenu o ploše 0,10 mm². Byla posuzována denzita nervových vláken na mm² (CNFD = počet hlavních vláken, t-CNFD = počet všech zachycených vláken; počet/mm²), celková délka nervových vláken na mm² (CNFL; mm/mm²) a tortuozita nervových vláken (CNFT; bezrozměrné číslo, poměr absolutní délky zachyceného nervového vlákna k délce spojnice krajních bodů) [20]. Vyšetření konfokálním mikroskopem a následné hodnocení snímků prováděl u všech sledovaných subjektů pouze jeden vyšetřující (GM) bez znalosti celkového a očního nálezu.
Statistické vyhodnocení výsledků bylo provedeno pomocí IBM softwaru SPSS v.23 (Shapirův-Wilkův test pro ověření normality dat, ANOVA a Bonferroni post-hoc test pro testování rozdílů mezi skupinami) a IBM SamplePower v.23 software byl použit pro zhodnocení statistické síly použitých testů. Výsledky jsou uváděny jako průměr ± směrodatná odchylka. Hodnota p ≤ 0,05 byla považována za statisticky významnou.
Výsledky
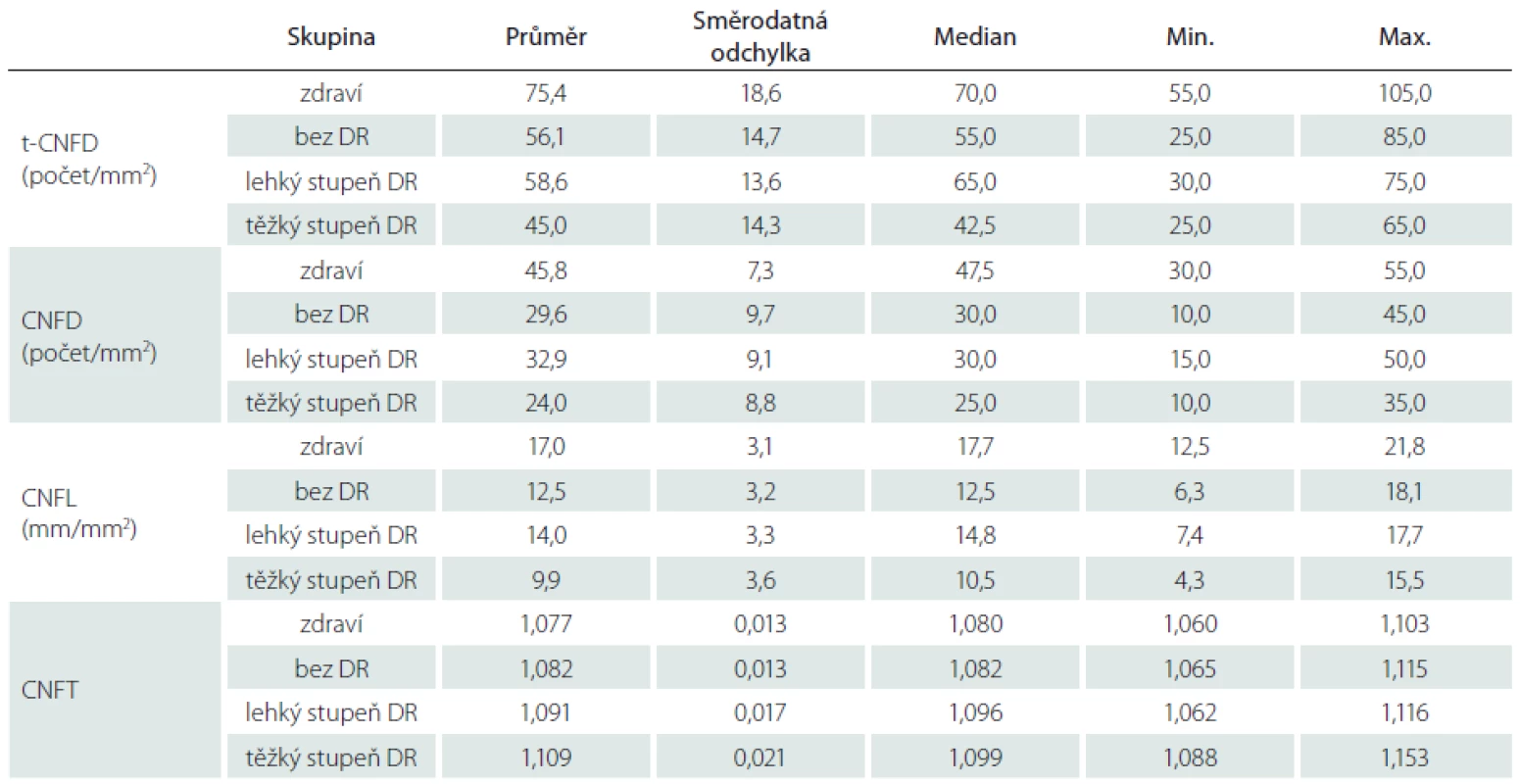
Celkem bylo vyšetřeno 50 subjektů (23 mužů a 27 žen) – 38 pacientů s DM 1 a 12 zdravých jedinců. Průměrná úroveň kompenzace hodnocená na základě hodnoty glykovaného hemoglobinu (HbA1C) se mezi jednotlivými skupinami DR statisticky významně nelišila (p = 0,86) (tab. 1). Rovněž průměrný věk se mezi jednotlivými skupinami pacientů ani kontrolní skupinou statisticky významně nelišil (p = 0,80). Doba trvání diabetu byla u pacientů s těžkým stupněm DR statisticky významně delší než u pacientů bez DR a s lehkým stupněm DR (p = 0,009). U všech vyšetřovaných očí byly získány kvalitní a dobře hodnotitelné snímky subbazálního nervového plexu rohovky.
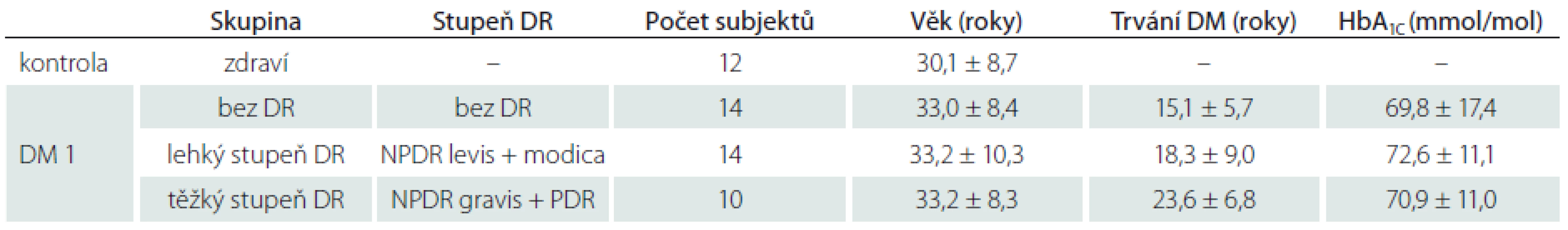
Ve všech sledovaných parametrech nervových vláken byly prokázány testem ANOVA statisticky významné rozdíly mezi skupinami (p < 0,0001) při statistické síle testu > 99 %. Při hodnocení CNFD byl ve všech skupinách pacientů s DM 1 (bez DR, s lehkým stupněm DR a těžkým stupněm DR) prokázán úbytek počtu nervových vláken ve srovnání se zdravými jedinci (p < 0,0001; p = 0,004, resp. p < 0,0001) (graf 1). Rovněž počet nervových vláken byl statisticky významně nižší ve skupině s těžkým stupněm DR než ve skupině s lehkým stupněm DR (p = 0,036) (graf 1). Při srovnání počtu všech zastižených vláken (t-CNFD) byl prokázán statisticky významně nižší počet nervových vláken u pacientů ve skupině bez DR a ve skupině s těžkým stupněm DR než u zdravých jedinců (p = 0,024; resp. p < 0,0001) (graf 2). Obdobně při srovnání CNFL byl prokázán statisticky signifikantní pokles celkové délky vláken ve skupině bez DR a s těžkým stupněm DR oproti hodnotám zdravých jedinců (p = 0,007; resp. p < 0,0001) (graf 3). Zároveň byla prokázána nižší hodnota CNFL u pacientů s těžkým stupněm DR i oproti pacientům s lehkým stupněm DR (p = 0,028). Při zhodnocení CNFT byl naopak patrný nárůst tortuozity ve skupině s těžkým stupněm DR ve srovnání se skupinou zdravých jedinců i skupinou bez DR (p < 0,0001; resp. p = 0,001) (graf 4).




Podrobně jsou výsledky pro CNFD, t-CNFD; CNFL a CNFT pro jednotlivé sledované skupiny uvedeny v tab. 2.

Diskuze
U pacientů s DM bylo opakovaně prokázáno poškození nervových vláken subbazálního nervového plexu rohovky pomocí CCM. Změny korelují s výskytem a progresí DN [13,21]. Studie naznačují, že poškození nervových vláken rohovky může předcházet diagnóze DN stanovené běžnými klinickými a elektrofyziologickými testy [22–24]. Dokonce bylo prokázáno poškození nervových vláken u subjektů pouze s diagnózou poruchy glukózové tolerance [25].
Mezi mikroangiopatické komplikace diabetu patří DN stejně jako DR. Jen omezené množství studií, převážně u pacientů s DM 2. typu nebo v souborech obsahujících současně pacienty s DM 1. a 2. typu, se dosud zabývalo možným vztahem stupně DR a rozsahem poškození vláken subbazálního nervového plexu rohovky, přestože se jedná o hlavní oční komplikaci DM [17,26 – 30]. Hodnocení úbytku nervových vláken subbazálního nervového plexu rohovky na souboru dospělých pacientů pouze s DM 1, ve vztahu k stupni DR, nebyla zatím věnována dostatečná pozornost.
Porovnávání jednotlivých výsledků ze studií je komplikováno nejednotností používaných přístrojů a používáním různé metodiky hodnocení snímků a následné analýzy získaných dat [21]. Tavakoli et al publikovali normativní hodnoty sledovaných parametrů nervových vláken rohovky u zdravých jedinců za použití přístroje Heidelberg Retina Tomograph (HRT III) Rostock Cornea module (RCM) využívající na rozdíl od našeho přístroje laser skenovací systém (CLSM) [31]. Tento systém dosahuje axiálního rozlišení až 4 µm, a umožňuje tím lepší detekci nervových vláken rohovky [21]. Pro ostatní dostupné konfokální mikroskopy jednotná normativní databáze chybí.
Hodnoty získané z různých typů přístrojů tak nejsou přímo porovnatelné [19,32] a průměrné hodnoty CNFD a CNFL se liší dle použitého vyšetřovacího přístroje či použité metodiky, která je v jednotlivých studiích rovněž rozdílná.
Hodnoty počtu nervových vláken (CNFD) jsou obecně při použití přístroje typu SSCM vyšší než při použití LCSM. CNFD se obvykle definuje jako počet hlavních nervových vláken. Právě nižší rozlišovací schopnost SSCM přístroje může být důvod, že rozpoznání „hlavních“ vláken (CNFD) je obtížnější a počet je nadhodnocován oproti studiím s LSCM [29,31,33]. V naší práci jsme proto sledovali i počet všech zachycených vláken (t-CNFT). Tento parametr se však nezdá být přesnější a přínosný. Hodnota celkové délky nervových vláken je naopak při použití SSCM nižší [32,34].
V naší studii jsme v souladu s předchozími pracemi prokázali pokles hodnot CNFD a CNFL u pacientů s DM 1 při srovnání se zdravými subjekty [17,27–30]. Při hodnocení nervových vláken subbazálního nervového plexu u pacientů rozdělených dle stupně DR jsme prokázali signifikantně nižší průměrné hodnoty CNFD ve všech třech skupinách pacientů s DM 1 oproti kontrolní skupině. Důvodem může být i poměrně dlouhá průměrná doba trvání DM ve všech našich skupinách pacientů, která je delší než 15 let. Zároveň jsme prokázali ve shodě s předešlými pracemi nižší hodnoty CNFD i CNFL u pacientů s těžkým stupněm DR vzhledem k lehkému stupni DR [17,29], a také u pacientů bez DR oproti zdravým jedincům. Naopak mezi zdravými jedinci a pacienty s lehkým stupněm DR se CNFL nelišila.
Tento výsledek může naznačovat nelineárnost výskytu jednotlivých orgánových komplikací u pacientů s DM 1. Zhivov et al v souladu s našimi výsledky uvádějí rovněž statisticky významně nižší hodnoty CNFD i CNFL již u pacientů s DM 1 bez klinicky prokazatelné DR ve srovnání se zdravými jedinci [30]. Ve studii Utsunomiya et al se obdobně jako v našem souboru počet nervových vláken i jejich celková délka u pacientů bez DR statisticky významně nelišily od skupiny pacientů s lehkou DR či těžkou DR a jejich průměrná hodnota se dokonce spíše blížila hodnotě pacientů s těžkou DR [17].
Vysvětlením může být polymorfizmus mikrovaskulárních komplikací vedoucích k DR a rohovkové neuropatii [15]. Jiným možným vysvětlením může být fakt, že diagnostika počínající DR vede u pacientů s DM 1 k intenzifikaci terapie a/ nebo k odpovědnějšímu přístupu pacienta k léčbě, a tím ke zlepšení kompenzace, což může umožnit i částečnou regeneraci nervových vláken [35,36]. V našem souboru ovšem této hypotéze neodpovídají aktuální hodnoty glykovaného hemoglobinu, i když tento nezobrazuje dynamiku vývoje onemocnění v delším časovém úseku, jenž je zásadní pro pomalý rozvoj orgánových komplikací, vč. neuropatie [37]. Dalším prokázaným významným faktorem pro rozvoj orgánových komplikací je délka trvání DM 1 [3]. Ta se v našem souboru ve skupině bez DR a lehkým stupněm DR nelišila.
Nejednotnost v metodice je ještě výraznější při stanovení tortuozity. Ve starších studiích je tortuozita hodnocena subjektivně na stupnici 1 – 4 [27,28]. Některé další studie se pokoušely zavést automatizované či semiautomatizované hodnocení tortuozity za asistence individuálně zhotoveného softwaru, ale výsledky jsou nejednoznačné [21]. Messmer et al upozorňují na fakt, že při současném úbytku nervových vláken (pokles CNFD a CNFL) nemusí být nárůst tortuozity prokázán [28].
V našem souboru jsme proto testovali hodnocení tortuozity dle metodiky, jež byla použita při posuzování tortuozity drobných tepen v kardiologii [20]. Při použití této techniky jsme v souladu s výsledky některých předešlých studií [27,29] potvrdili nárůst tortuozity vláken subbazálního nervového plexu u pacientů s těžkým stupněm DR oproti zdravým jedincům. Přestože průměrné hodnoty tortuozity se zvyšovaly paralelně s progresí DR, statisticky se CNFT u pacientů bez DR a s lehkým stupněm DR významně nelišila od zdravých kontrol. Ve shodě s De Cilia et al jsme prokázali statisticky významný nárůst tortuozity mezi skupinami bez DR a s těžkým stupněm DR [27]. Použitou metodiku je třeba ještě dále ověřit a posoudit její vhodnost v návaznosti na další práce zaměřené na postupy k hodnocení tortuozity nervových vláken rohovky [38,39].
Ačkoli je DR považována za mikroangiopatickou komplikaci, nemůže být považována jen za izolovanou vaskulární patologii. Obecněji je možné DR posuzovat jako neurosenzorické postižení odrážející systémové a lokální metabolické procesy při DM, které zahrnují nejen změny cév sítnice. Obdobně jako u DN může docházet k postižení cévního zásobení jednotlivých nervových vláken [40]. Pravděpodobné buněčné neurodegenerativní změny v oku, vč. rohovky, by tak mohly předcházet změnám sítnice [30].
Limitem naší studie je poměrně malý soubor pacientů. Výsledky je tak nutno ověřit na větším souboru. Dle dostupných publikací je počet pracovních týmů zabývajících se touto problematikou dosud jen velmi omezený. Tato pracoviště převážně využívají konfokální mikroskop typu LSCM. Naše studie však demonstruje, že přes určitá omezení v zobrazování nervových vláken systémem SSCM, která neumožňují přímo srovnávat výsledky se studiemi na LSCM, jsou výsledné závěry ohledně vlivu DM na nervová vlákna rohovky srovnatelné. Bez ohledu na absolutní hodnoty lze jednoznačně prokázat úbytek nervových vláken u diabetických pacientů. Je však třeba si uvědomit, že pro případné sledování změn v čase jsou použitelné pouze snímky získané na stejném typu přístroje.
Seznam použitých zkratek
CCM – konfokální mikroskopie rohovky (Corneal Confocal Microscopy)
CLSM – laser-scanning konfokální mikroskopie (Laser-Scanning Confocal Microscopy)
CNFD – počet hlavních nervových vláken rohovky (Corneal Main Nerve Fiber Density)
CNFL – celková délka nervových vláken rohovky (Corneal Nerve Fiber Lenght)
CNFT – tortuozita nervových vláken rohovky (Corneal Nerve Fiber Tortuosity)
DM – diabetes mellitus
DM 1 – diabetes mellitus 1. typu
DR – diabetická retinopatie
ETDRS – Early Treatment of Diabetic Retinopathy Study
SSCM – slit-scanning konfokální mikroskopie (Slit-Scanning Confocal Microscopy)
t-CNFD – počet všech nervových vláken rohovky(Corneal Total Nerve Fiber Density)
DN – diabetická neuropatie
PDR – proliferativní diabetická retinopatie (Proliferative Diabetic Retinopathy)
NPDR – neproliferativní diabetická retinopatie (Non-Proliferative Diabetic Retinopathy)
PRP – panretinální fotokoagulace (Panretinal Photocoagulation)
HbA1C – glykovaný hemoglobin
Podpořeno projektem (Ministerstvo zdravotnictví České republiky) koncepčního rozvoje výzkumné organizace 00064203 a projektem CZ.2.16/ 3.1.00/ 24022.
Poděkování Ing. Veronice Konrádové za pomoc při statistickém zpracování dat.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Marie Česká Burdová
Oční klinika dětí a dospělých
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: marie.ceska-burdova@fnmotol.cz
Přijato k recenzi: 11. 4. 2016
Přijato do tisku: 14. 10. 2016
Sources
1. Threatt J, Williamson JF, Huynh K, et al. Ocular disease, knowledge and technology applications in patients with diabetes. Am J Med Sci 2013;345(4):266 – 70. doi: 10.1097/ MAJ.0b013e31828aa6fb.
2. LeCaire TJ, Palta M, Klein R, Klein BE, et al. Assessing progress in retinopathy outcomes in type 1 diabetes: comparing findings from the Wisconsin Diabetes Registry Study and the Wisconsin Epidemiologic Study of Diabetic Retinopathy. Diabetes Care 2013;36(3):631 – 7. doi: 10.2337/ dc12-0863.
3. Lorenzi GM, Braffett BH, Arends VL, et al. Quality Control Measures over 30 Years in a Multicenter Clinical Study: Results from the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions andComplications (DCCT/ EDIC) Study. PLoS One 2015;10(11): e0141286. doi: 10.1371/ journal.pone.0141286.
4. Lutty GA. Effects of diabetes on the eye. Invest Ophthalmol Vis Sci 2013;54:ORSF81 – 7. doi: 10.1167/ iovs.13-12979.
5. Muller LJ, Vrensen GF, Pels L, et al. Architecture of human corneal nerves. Invest Ophthalmol Vis Sci 1997;38(5):985 – 94.
6. Guthoff RF, Wienss H, Hahnel C, et al. Epithelial innervation of human cornea: a three-dimensional study using confocal laser scanning fluorescence microscopy. Cornea 2005;24(5):608 – 13.
7. Stachs O, Zhivov A, Kraak R, et al. In vivo three-dimensional confocal laser scanning microscopy of the epithelial nerve structure in the human cornea. Graefes Arch Clin Exp Ophthalmol 2007;245(4):569 – 75.
8. Oliveira-Soto L, Efron N. Morphology of corneal nerves using confocal microscopy. Cornea 2001;20(4):374 – 84.
9. Chiou AG, Kaufman SC, Kaufman HE, et al. Clinical corneal confocal microscopy. Sury Ophthalmol 2006;51(5):482 – 500.
10. Jalbert I, Stapleton F, Papas E, et al. In vivo confocal microscopy of the human cornea. Br J Ophthalmol 2003;87(2):225 – 36.
11. Erie JC, McLaren JW, Patel SV. Confocal microscopy in ophthalmology. Am J Ophthalmol 2009;148(5):639 – 46. doi: 10.1016/ j.ajo.2009.06.022.
12. Zochodne DW. Diabetes mellitus and the peripheral nervous system: manifestations and mechanisms. Muscle Nerve 2007;36(2):144 – 66.
13. Jiang MS, Yuan Y, Gu ZX, et al. Corneal confocal microscopy for assessment of diabetic peripheral neuropathy: a meta-analysis. Br J Ophthalmol 2015;100(1):9 – 14. doi: 10.1136/ bjophthalmol-2014-306038.
14. Dyck PJ, Kratz KM, Karnes JL, et al. The prevalence by staged severity of various types of diabetic neuropathy, retinopathy, and nephropathy in a population-based cohort: the Rochester Diabetic Neuropathy Study. Neurology 1993;43(4):817 – 24.
15. Hosseini SM, Boright AP, Sun L, et al. The association of previously reported polymorphisms for microvascular complications in a meta-analysis of diabetic retinopathy. Hum Genet 2015;134(2):247 – 57.
16. Wilkinson CP, Ferris FL, Klein RE, et al. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales. Ophthalmology 2003;110(9):1677 – 82.
17. Utsunomiya T, Nagaoka T, Hanada K, et al. Imaging of the Corneal Subbasal Whorl-like nerve plexus: more accurate depiction of the extent of corneal nerve damage in patients with diabetes. Invest Ophthalmol Vis Sci 2015;56(9):5417 – 23. doi: 10.1167/ iovs.15-16609.
18. Smith AG, Kim G, Porzio M, et al. Corneal confocal microscopy is efficient, well-tolerated, and reproducible. J Peripher Nerv Syst 2013;18(1):54 – 8. doi: 10.1111/ jns5.12008.
19. Szaflik JP. Comparison of in vivo confocal microscopy of human cornea by white light scanning slit and laser scanning systems. Cornea 2007;26(4):438 – 45.
20. Heneghan C, Flynn J, O‘Keefe M, et al. Characterization of changes in blood vessel width and tortuosity in retinopathy of prematurity using image analysis. Med Image Anal 2002;6(4):407 – 29.
21. Papanas N, Ziegler D. Corneal confocal microscopy: Recent progress in the evaluation of diabetic neuropathy. J Diabetes Investig 2015;6(4):381 – 9. doi: 10.1111/ jdi.12335.
22. Misra SL, Craig JP, Patel DV, et al. In vivo confocal microscopy of corneal nerves: an ocular biomarker for peripheral and cardiac autonomic neuropathy in type 1 diabetes mellitus. Invest Ophthalmol Vis Sci 2015;56(9):5060 – 5. doi: 10.1167/ iovs.15-16711.
23. Dehghani C, Pritchard N, Edwards K, et al. Risk factors associated with corneal nerve alteration in type 1 diabetes in the absence of neuropathy: a longitudinal in vivo corneal confocal microscopy study. Cornea 2016;35(6):847 – 52. doi: 10.1097/ ICO.0000000000000760.
24. Lovblom LE, Halpern EM, Wu T, et al. In vivo corneal confocal microscopy and prediction of future-incident neuropathy in type 1 diabetes: a preliminary longitudinal analysis. Can J Diabetes 2015;39(5):390 – 7. doi: 10.1016/ j.jcjd.2015.02.006.
25. Asghar O, Petropoulos IN, Alam U, et al. Corneal confocal microscopy detects neuropathy in subjects with impaired glucose tolerance. Diabetes Care 2014;37(9):2643 – 6.
26. Szalai E, Deak E, Modis L, et al. Early corneal cellular and nerve fiber pathology in young patients with type 1 diabetes mellitus identified using corneal confocal microscopy. Invest Ophthalmol Vis Sci 2016;57(3):853 – 8. doi: 10.1167/ iovs.15-18735.
27. De Cilla S, Ranno S, Carini E, et al. Corneal subbasal nerves changes in patients with diabetic retinopathy: an in vivo confocal study. Invest Ophthalmol Vis Sci 2009;50(11):5155 – 8. doi: 10.1167/ iovs.09-3384.
28. Messmer EM, Schmid-Tannwald C, Zapp D, et al. In vivo confocal microscopy of corneal small fiber damage in diabetes mellitus. Graefes Arch Clin Exp Ophthalmol 2010;248(9):1307 – 12. doi: 10.1007/ s00417-010-1396-8.
29. Nitoda E, Kallinikos P, Pallikaris A, et al. Correlation of diabetic retinopathy and corneal neuropathy using confocal microscopy. Curr Eye Res 2012;37(10):898 – 906. doi: 10.3109/ 02713683.2012.683507.
30. Zhivov A, Winter K, Hovakimyan M, et al. Imaging and quantification of subbasal nerve plexus in healthy volunteers and diabetic patients with or without retinopathy. PLoS One 2013;8(1):e52157. doi: 10.1371/ journal.pone.0052157.
31. Tavakoli M, Ferdousi M, Petropoulos IN, et al. Normative values for corneal nerve morphology assessed using corneal confocal microscopy: a multinational normative data set. Diabetes Care 2015;38(5):838 – 43. doi: 10.2337/ dc14-2311.
32. Erie EA, McLaren JW, Kittleson KM, et al. Corneal subbasal nerve density: a comparison of two confocal microscopes. Eye Contact Lens 2008;34(6):322 – 5. doi: 10.1097/ ICL.0b013e31818b74f4.
33. Petropoulos IN, Green P, Chan AW, et al. Corneal confocal microscopy detects neuropathy in patients with type 1 diabetes without retinopathy or microalbuminuria. PLoS One 2015;10(4):e0123517. doi: 10.1371/ journal.pone.0123517.
34. Patel DV, Tavakoli M, Craig JP, et al. Corneal sensitivity and slit scanning in vivo confocal microscopy of the subbasal nerve plexus of the normal central and peripheral human cornea. Cornea 2009;28(7):735 – 40.
35. Mehra S, Tavakoli M, Kallinikos PA, et al. Corneal confocal microscopy detects early nerve regeneration after pancreas transplantation in patients with type 1 diabetes. Diabetes Care 2007;30(10):2608 – 12.
36. Tavakoli M, Mitu-Pretorian M, Petropoulos IN, et al. Corneal confocal microscopy detects early nerve regeneration in diabetic neuropathy after simultaneous pancreas and kidney transplantation. Diabetes 2013;62(1):254 – 60. doi: 10.2337/ db12-0574.
37. Gorst C, Kwok CS, Aslam S, et al. Long-term glycemic variability and risk of adverse outcomes: a systematic review and meta-analysis. Diabetes Care 2015;38(12):2354 – 69. doi: 10.2337/ dc15-1188.
38. Lagali N, Poletti E, Patel DV, et al. Focused tortuosity definitions based on expert clinical assessment of corneal subbasal nerves. Invest Ophthalmol Vis Sci 2015;56(9):5102 – 9. doi: 10.1167/ iovs.15-17284.
39. Edwards K, Pritchard N, Vagenas D, et al. Standardizing corneal nerve fibre length for nerve tortuosity increases its association with measures of diabetic neuropathy. Diabet Med 2014;31(10):1205 – 9. doi: 10.1111/ dme.12466.
40. Barber AJ, Lieth E, Khin SA, et al. Neural apoptosis in the retina during experimental and human diabetes. Early onset and effect of insulin. J Clin Invest 1998;102(4):783 – 91.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 1
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Hodnocení rohovkové inervace pomocí konfokální mikroskopie
- Diabetická retinopatie a změny nervových vláken hodnocené konfokální mikroskopií rohovky
- Validace dotazníku kvality života pro pacienty s myastenií – česká verze MG-QOL15
- Periodické pohyby končetinami ve spánku jsou závažnější u narkolepsie s kataplexií než u narkolepsie bez kataplexie
- Vztah časných metabolických změn mozku a vybraných vstupních parametrů u pacientů posubarachnoidálním krvácení z prasklého aneuryzmatu
- Základní neurologické vyšetření – nastal čas pro změny?
- Úskalí diagnostiky atypické formy kongenitální svalové dystrofie – parciálního deficitu merosinu – kazuistiky
- Endoskopická exstirpace koloidní cysty III. mozkové komory
- Transkraniální sonografie – možnosti zobrazení intrakraniálních struktur v B obraze
- Kmenové buňky v léčbě amyotrofické laterální sklerózy – přehled současných klinických zkušeností
- Genetika atypického parkinsonizmu
- Současný pohled na kontraindikace a komplikace elektromyografie
- Změna mikrobiologickýho vzorku u pacientů s potvrzenou bakteriální meningitidou po postkraniotomiální operaci
- Neurologický a MR skríning pacientů s Crohnovou chorobou může zvýšit bezpečnost dlouhodobé terapie anti-TNF-α
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Současný pohled na kontraindikace a komplikace elektromyografie
- Základní neurologické vyšetření – nastal čas pro změny?
- Endoskopická exstirpace koloidní cysty III. mozkové komory
- Periodické pohyby končetinami ve spánku jsou závažnější u narkolepsie s kataplexií než u narkolepsie bez kataplexie
