Transkraniální sonografie – možnosti zobrazení intrakraniálních struktur v B obraze
Using Transcranial Sonography to Display Intracranial Structures in the B-mode
Transcranial sonography (TCS) enables displaying of intracranial structures in the B-mode. Recently, TCS has been established mostly as a tool for the diagnosis and monitoring of degenerative brain disorders, less frequently also for the diagnosis and monitoring of other intracranial pathologic processes. Transtemporal and transfrontal approaches are most frequently used to display the intracranial structures. Technological advances enabled standardization of the TCS and definition of the standard imaging planes. These standard imaging planes enable evaluation of echogenicity and the size of the different intracranial structures, such as substantia nigra, midbrain raphe, thalamus, caudate nucleus, lentiform nucleus, insular cortex, cerebral or cerebellar white matter, dentate nucleus, hippocampus and ventricular system. Pathological findings of increased or decreased echogenicity, the width or the area of the individual intracranial structures can be found not only in various degenerative brain disorders, where the TCS plays the role in the diagnosis and differential diagnosis, but also in patients with cerebrovascular diseases, hydrocephalus or intracranial hypertension. The review brings information about usefulness of the TCS in patients with neurological and psychiatric diseases.
Key words:
ultrasound – transcranial sonography–neurosonology – neurodegenerative diseases
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
D. Školoudík
Authors‘ workplace:
Neurologická klinika 1. LF UK a VFN v Praze
; Centrum vědy a výzkumu, Fakulta zdravotnických věd UP v Olomouci
Published in:
Cesk Slov Neurol N 2017; 80/113(1): 8-23
Category:
Minimonography
doi:
https://doi.org/10.14735/amcsnn20178
Overview
Transkraniální sonografie (TCS) je založena na zobrazení intrakraniálních struktur v ultrazvukovém B obraze. V posledních letech došlo k rozšíření této metody především jako nástroje pro diagnostiku a monitorování degenerativních onemocnění mozku, v menší míře také v diagnostice nebo monitorování jiných intrakraniálních patologických procesů. K zobrazení intrakraniálních struktur se využívají hlavně dva přístupy – transtemporální a transfrontální. Díky technickému pokroku bylo možno standardizovat transkraniální sonografické vyšetření a stanovit základní řezy. V těchto základních řezech lze hodnotit echogenitu nebo velikost jednotlivých intrakraniálních struktur – substantia nigra, ncl. raphe, thalamu, caput ncl. caudati, ncl. lentiformis, inzulární kůry, bílé hmoty hemosfér a mozečku, ncl. dentatus, hippocampu a komorového systému. Patologické nálezy v podobě zvýšené či snížené echogenity nebo zvětšené či zmenšené šíře nebo plochy jednotlivých struktur lze nalézt nejen u různých neurodegenerativních onemocnění mozku, kde může TCS hrát svou roli v diagnostice a diferenciální diagnostice, ale také u cévních onemocnění mozku, hydrocefalu nebo u pacientů s nitrolební hypertenzí. V přehledovém článku jsou shrnuty dostupné informace o využití TCS u pacientů s neurologickým nebo psychiatrickým onemocněním.
Klíčová slova:
ultrazvuk – transkraniální sonografie – neurosonologie – neurodegenerativní onemocnění
Úvod
V tomto přehledovém článku jsou shrnuty dostupné informace o využití transkraniální sonografie (Transcranial Sonography; TCS) u pacientů s neurologickým nebo psychiatrickým onemocněním. TCS je založena na zobrazení intrakraniálních struktur v ultrazvukovém B obraze (obr. 1). V posledním desetiletí se rozšířila tato metoda především jako nástroj pro diagnostiku a monitorování neurodegenerativních onemocnění [1]. Nicméně ji lze využít také v diagnostice nebo monitorování jiných intrakraniálních patologických procesů (cévních onemocnění mozku, expanzivních intrakraniálních procesů či hydrocefalu) [2].
Rozvoj TCS je spojen s velkým technologickým pokrokem, vývojem multifrekvenčních ultrazvukových sond, zlepšením post-processingu a rozvojem nových technologií jako např. fúzovaného obrazu TCS s magnetickou rezonancí (MR) nebo výpočetní tomografií (CT) [3]. V minulém desetiletí bylo možno použít k TCS vyšetření jen high-end přístroje, avšak nyní lze zobrazit intrakraniální struktury velmi kvalitně i s přenosnými ultrazvukovými přístroji [4]. Se současnými high-end ultrazvukovými systémy je pak možno dosáhnout velmi vysokého rozlišení obrazu mozkových struktur, jež dokonce může být za klinických podmínek vyšší než u MR [5].
Rozvoj TCS diagnostiky umožnil vytvoření standardizace vyšetření s používáním standardních řezů pro zvýšení reprodukovatelnosti této vyšetřovací techniky a možnostmi srovnání s jinými vyšetřovacími metodami [1,3,6]. Ačkoli TCS má ve srovnání s CT nebo MR lehce nižší rozlišovací schopnost [2], každá z těchto tří metod má v diagnostice patologických intrakraniálních procesů své nezastupitelné místo, protože využívá jiný fyzikální princip. Některé patologické procesy lze zobrazit pomocí CT, MR i TCS, avšak některé jsou lépe zobrazitelné jednou z nich jako např. CT je superiorní v diagnostice intracerebrálního krvácení, MR v diagnostice roztroušené sklerózy mozkomíšní a TCS v diferenciální diagnostice Parkinsonovy nemoci a esenciálního třesu díky zobrazení změny echogenity substantia nigra [1–4,6].
Výhodou TCS oproti CT a MR je vysoká mobilita ultrazvukového přístroje, krátká doba vyšetřování, neinvazivita vyšetření, nízká cena a relativně vysoká odolnost proti pohybovým artefaktům. Dokonce i rychlé pohyby hlavou (třes), které se často vyskytují u pacientů s extrapyramidovým onemocněním, může být dobře kompenzována sonografistou [3]. Při využití technologie fúzovaného obrazu pak lze tyto mimovolní pohyby kompenzovat pomocí snímací elektrody připevněné na čelo pacienta [7].
Metodika TCS
Přístroj
K provedení TCS vyšetření intrakraniálních struktur lze využít ultrazvukové přístroje vybavené transkraniální duplexní fázovou sondou (phased array) emitující ultrazvukové vlnění s nízkými nosnými frekvencemi v rozsahu 1–5 MHz, zpravidla v rozsahu 2 – 4 MHz. Doporučené nastavení ultrazvukového přístroje je shrnuto v tab. 1.
![Doporučené nastavení ultrazvukového přístroje pro TCS (upraveno dle [3]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3bc1273c91745b4d31ed43777bc92a84.png)
Je potřeba však mít na paměti, že různé typy ultrazvukových přístrojů (nejen přístrojů různých firem, ale také různých typů přístrojů jedné firmy) používají odlišné sondy a post-processing, vedoucí k různé rozlišovací schopnosti v jednotlivých hloubkách obrazu, odlišné světlosti a kontrastu zobrazovaných struktur. Díky fyzikální charakteristice ultrazvukového svazku je při TCS vyšetření laterální rozlišení (kolmé na ultrazvukový svazek) 2–3krát nižší než rozlišení axiální (podél ultrazvukového svazku), obvykle okolo 0,7 × 2,0 mm, které se dále snižuje se snižující se frekvencí ultrazvukového svazku. Nejnovější high-end přístroje však dokážou v ohniskové zóně (focal zone) zlepšit laterální rozlišení až na 0,7 × 1,1 mm díky technologiím inteligentního post-processingu obrazu [3,5].
Díky různé tvorbě a úpravě B obrazu v jednotlivých typech ultrazvukových přístrojů nelze ani při použití standardního nastavení přístroje jednoduše převzít hodnoty měření posuzovaných echogenních oblastí malých mozkových struktur mezi různými typy ultrazvukových přístrojů. Proto je doporučeno, aby bylo individuálně stanoveno normální rozmezí echogenity nebo rozměrů (obsahu) echogenní oblasti (např. substantia nigra) pro jednotlivé typy přístrojů a jednotlivé laboratoře [3].
Vyšetřovací postup
Pacient by měl být umístěn v poloze na zádech na vyšetřovacím lehátku nebo sklopitelném vyšetřovacím křesle v maximálně pohodlné poloze, aby se omezily pohyby v průběhu vyšetření. Ve vyšetřovací místnosti by mělo být při vyšetření šero, aby bylo dosaženo vizuálního vjemu maximální ostrosti obrazu na monitoru. Sonografista obvykle sedí za hlavou pacienta, protože toto postavení je nejvýhodnější pro vyšetření přes temporální kostní okno, které je nejpoužívanějším TCS přístupem.
Vyšetřovací přístupy
Jelikož ultrazvukový svazek pronikne jen přes určitá místa kalvy, kde je kost nejtenčí, využívá se při TCS vyšetření, podobně jako při transkraniální dopplerometrii, kostních „okének“ [2]. Pro jednotlivé typy transkraniálních vyšetření (dopplerovské, duplexní nebo jen vyšetření v B obraze) se v současnosti používá sedmi přístupů: transtemporální přes temporální kostní okno, transfrontální přes frontální kostní okno, transokcipitální přes okcipitální kostní okno, transforaminální přes forman magnum, submandibulární pro zobrazení tkání pod bazí lební pod mandibulou, transorbitální přes orbitu (pozor na nutnost snížení energie ultrazvukového svazku) a transkondylární přes maxillu [2,7]. Pro zobrazení intrakraniálních struktur pomocí TCS se v současnosti využívají první dva přístupy – transtemporální a transfrontální [3]. Intrakraniální struktury však lze zobrazit také z transokcipitálního přístupu; tento přístup ale dosud nebyl ve studiích testován.
Transtemporální přístup
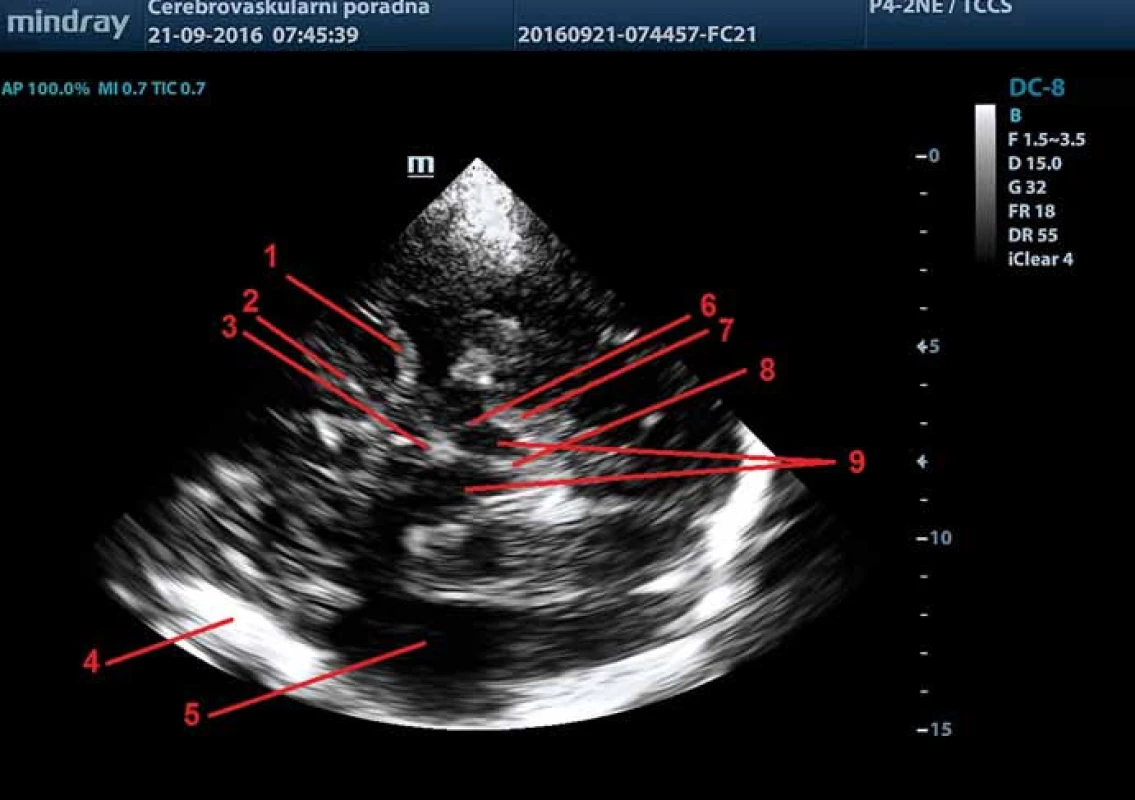
Při transtemporálním přístupu je využíváno nejtenčí oblasti temporální kosti, které se nachází na spánku v blízkosti ucha. Sondu přikládáme na spánek před ušní boltec rovnoběžně s orbitomeatální linií, aby se dosáhlo standardizovaného transverzálního zobrazení intrakraniálních struktur. Následně je potřeba pohybem sondy po temporální kosti před a nad ušním boltcem nalézt optimální kostní okno s nejkontrastnějším zobrazením intrakraniálních struktur (středočárových struktur s motýlovitou strukturou mozkového kmene a kontralaterální echogenní oblastí kortexu a subarachnoidálních prostor) s minimem artefaktů (obr. 2) [2,3]. Po identifikaci optimálního kostního okna je nezbytné udržení tohoto okna v průběhu celého vyšetření, k čemuž lze využít opření malíčku, event. ulnární hrany ruky o hlavu pacienta [3].
Nicméně i v případě optimálního nastavení ultrazvukového přístroje může být zčásti nebo úplně nemožné posouzení intrakraniálních struktur u 5–40 % pacientů díky nedostatečnému kostnímu oknu, a to v závislosti na věku, pohlaví a zeměpisném původu [4–6,8].
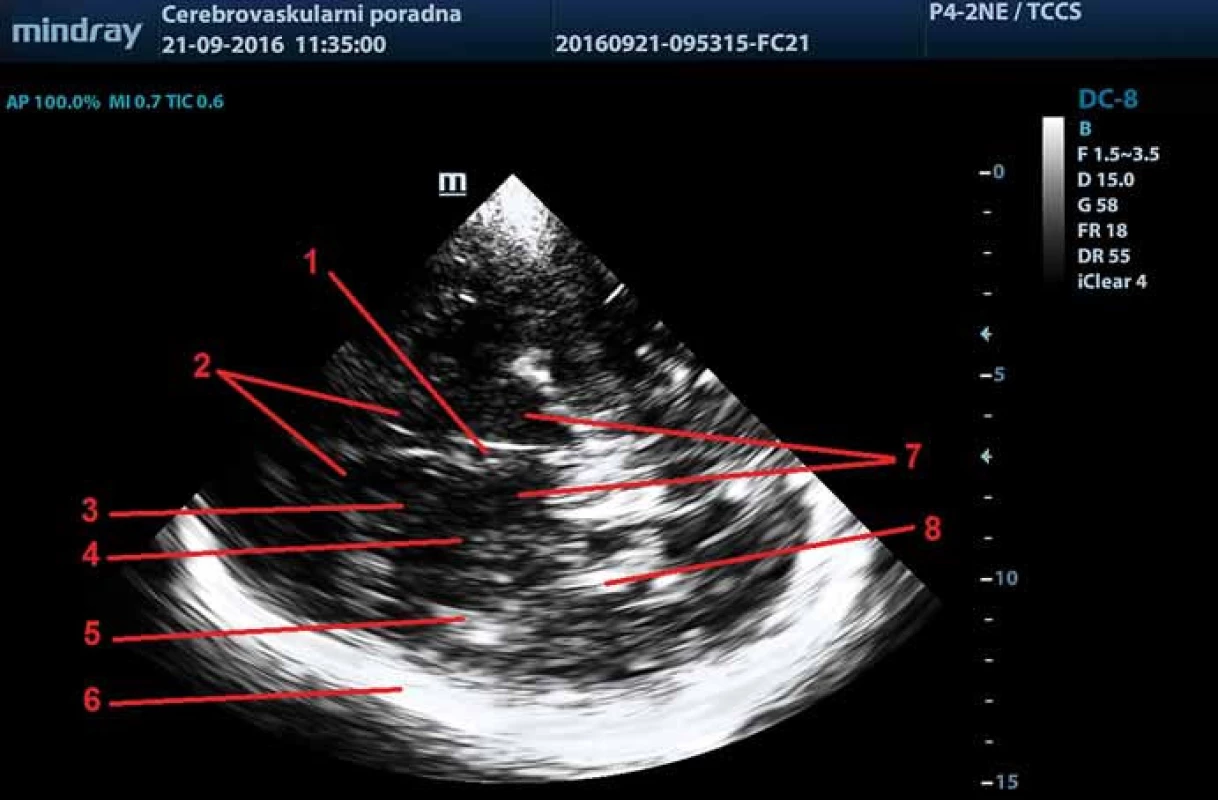
Pro standardizaci hodnocení echogenity intrakraniálních struktur byly definovány čtyři transverzální řezy: pontinní/mozečkový, mezencefalický, thalamický a řez těly postranních komor ve výši cella media; a tři řezy koronární: přední, střední a zadní (obr. 3, 4).


Kromě transtemporálního přístupu lze pro zobrazení intrakraniálních struktur využít také transfrontální přístup, ze kterého lze provést transverzální nebo sagitální řezy. Zatím však bylo popsáno klinické využití pouze sagitálního řezu k hodnocení šíře corpus callosum.
Zobrazované intrakraniální struktury
Při TCS vyšetření lze standardně zobrazit různé intrakraniální struktury. Pro hodnocení normálního a patologického nálezu jsou využívána měření vzdálenosti pomocí kaliperu (vzdálenost struktur, délka a šířka jednotlivých intrakraniálních struktur), plochy (obsahu echogenní plochy zobrazené struktury) nebo kvantitativní či semi-kvantitativní hodnocení echogenity dané struktury, obvykle ve srovnání s echogenitou okolních struktur [3].
Struktury zobrazitelné v transverzálním mezencefalickém řezu
Pro zobrazení mezencefalických struktur je používán transverzální řez ve výši mezencefala. V tomto řezu je zobrazitelný střední mozek jako anechogenní motýlovitý útvar obklopený vysoce echogenními bazálními cisternami (cisterna ambiens, cisterna quadrigemina, cisterna suprasellaris) (obr. 2, 3b). Frontálně od těchto struktur se zobrazuje echogenní proužek odpovídající a. cerebri media a horní okraj malého křídla sfenoidální kosti. V tomto řezu lze zobrazit následující struktury:
a) Substantia nigra
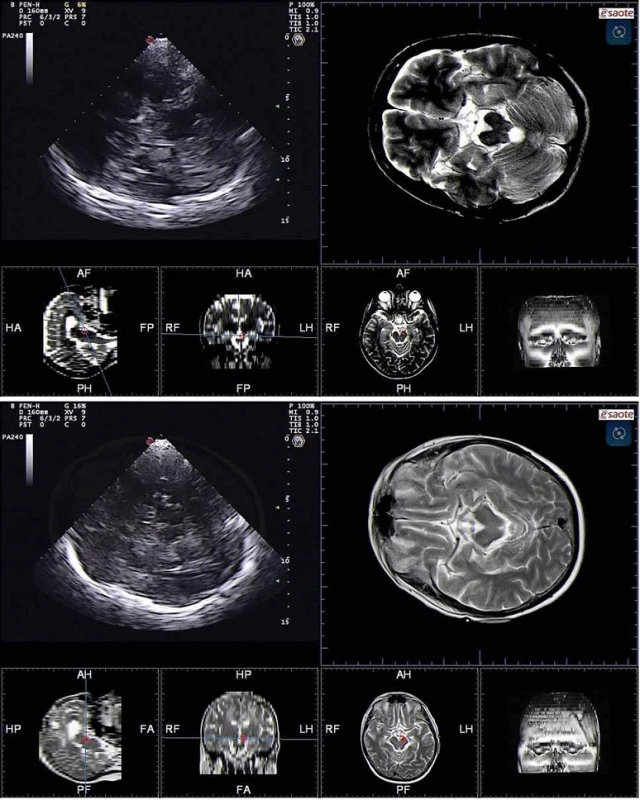
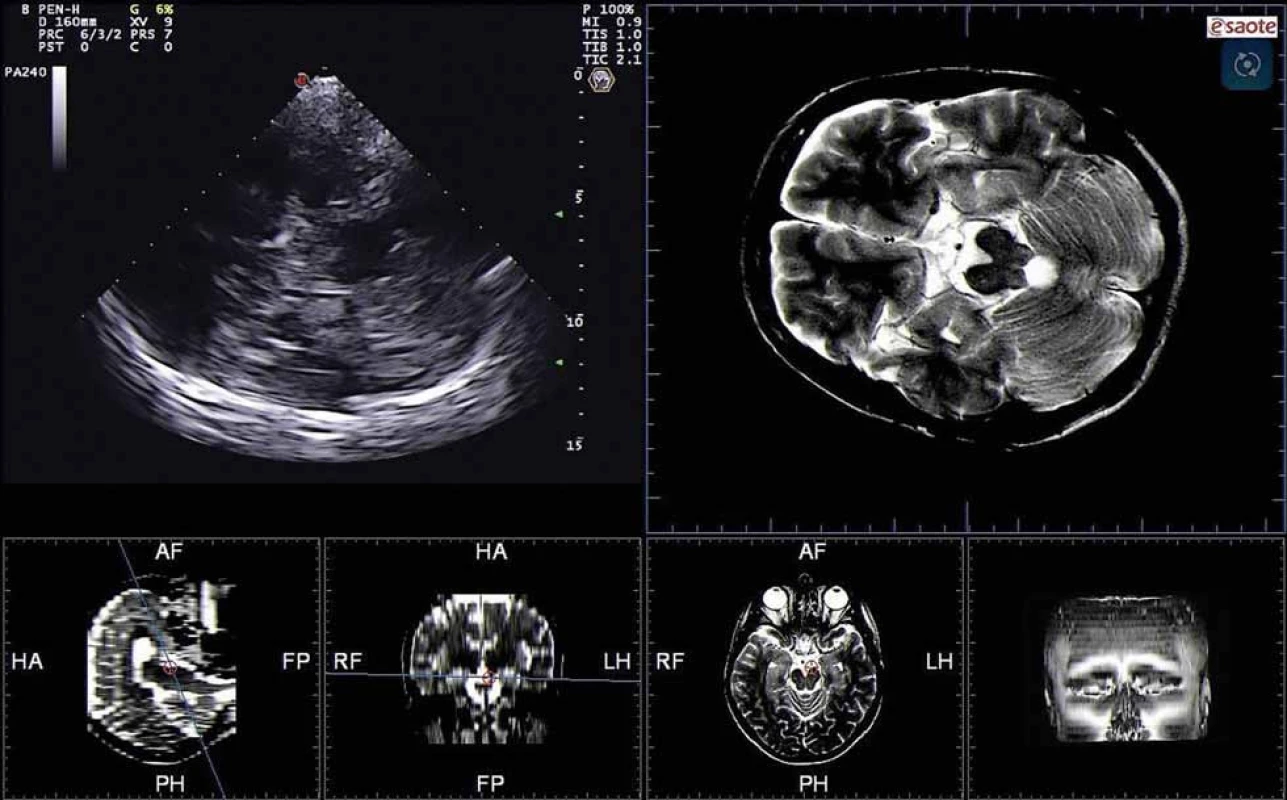
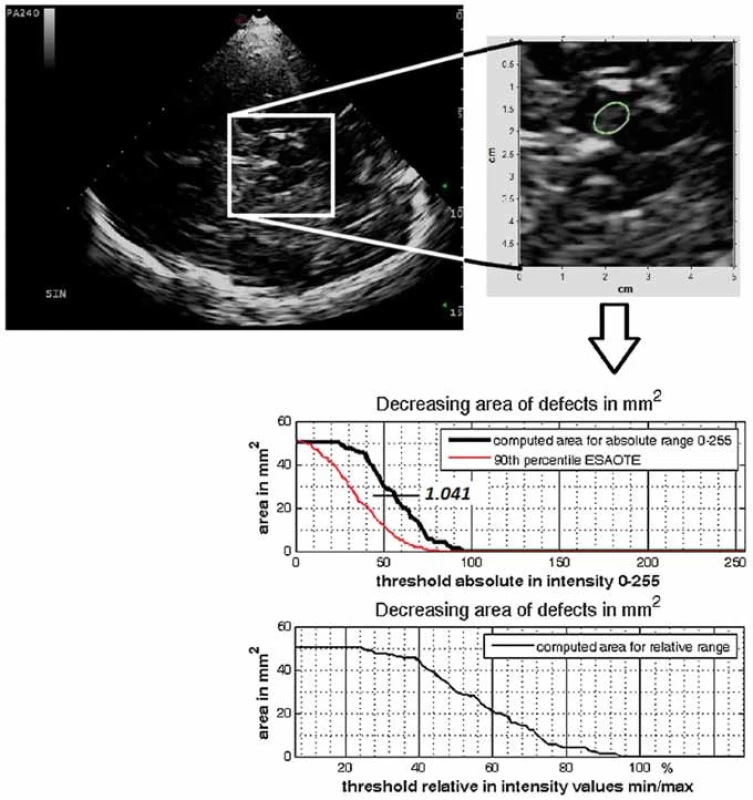
Jádro substantia nigra se zobrazuje při TCS vyšetření jako nehomogenní tečkovitá, proužkovitá či oválná, lehce echogenní struktura v anechogenním mezencefalu (obr. 5). Při TCS hodnocení tohoto jádra lze použít měření plochy echogenní části jádra nebo semikvantitativní hodnocení její echogenity, které je však ještě více závislé na zkušenosti sonografisty [1,8–11]. V současné době jsou vyvíjeny nové postupy, jak snížit závislost kvality hodnocení echogenity substantia nigra na zkušenosti sonografisty [3]. Zatím největší klinický přínos má kombinace technologie fúzovaného obrazu TCS s MR a digitální analýza obrazu pomocí B-Mode Assist programu (obr. 6) [3,12]. Vzhledem k možným artefaktům pocházejícím ze struktur bazálních cisteren je echogenita substantia nigra hodnocena pouze ipsilaterálně k sondě [3]. Proto musí být vyšetření provedeno vždy z obou stran.
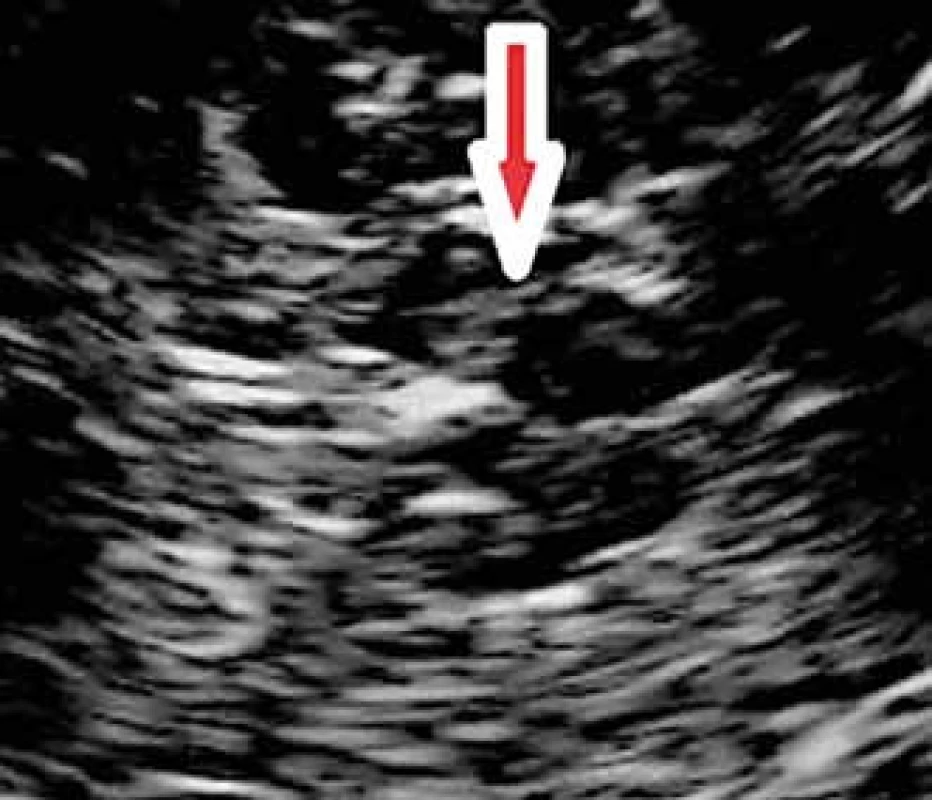
Interindividuální rozdíly v echogenitě a velikosti echogenní plochy substantia nigra zatím nebyly plně vysvětleny. Pravděpodobně se na nich podílí lokální akumulace kovů, především železa a abnormálních proteinových látek vážících železo, a gliózní změny [1–3,13,14]. Echogenita substantia nigra se mezi 18. a 75. rokem věku mění jen minimálně [15,16] s postupným zvyšováním echogenity, které je nejvýraznější po 80. roku věku [17,18].
Za hranici normální hodnoty obsahu plochy echogenní části substantia nigra se považuje 90. percentil hodnot v běžné populaci. Někdy se jako hraniční popisuje hodnota mezi 75. a 90. percentilem [1,3]. V současnosti je doporučeno stanovit rozmezí normálních hodnot velikosti echogenní plochy v oblasti substantia nigra pro jednotlivé ultrazvukové přístroje a ultrazvukové laboratoře. Za tímto účelem by mělo být vyšetřeno alespoň 50 zdravých dospělých. U většiny přístrojů se hranice normální hodnoty obsahu plochy echogenní části substantia nigra, tedy 90. percentil hodnot v běžné populaci, pohybuje mezi 0,20 a 0,25 cm2. V neurosonologické laboratoři Fakultní nemocnice Ostrava je tato hranice 0,24 cm2, a to pro přístroj ESAOTE My Lab Twice (ESAOTE, Janov, Itálie) i GE Vivid 7 Pro (GE Healthcare, Horten, Norsko) [12].
b) Ncl. raphe
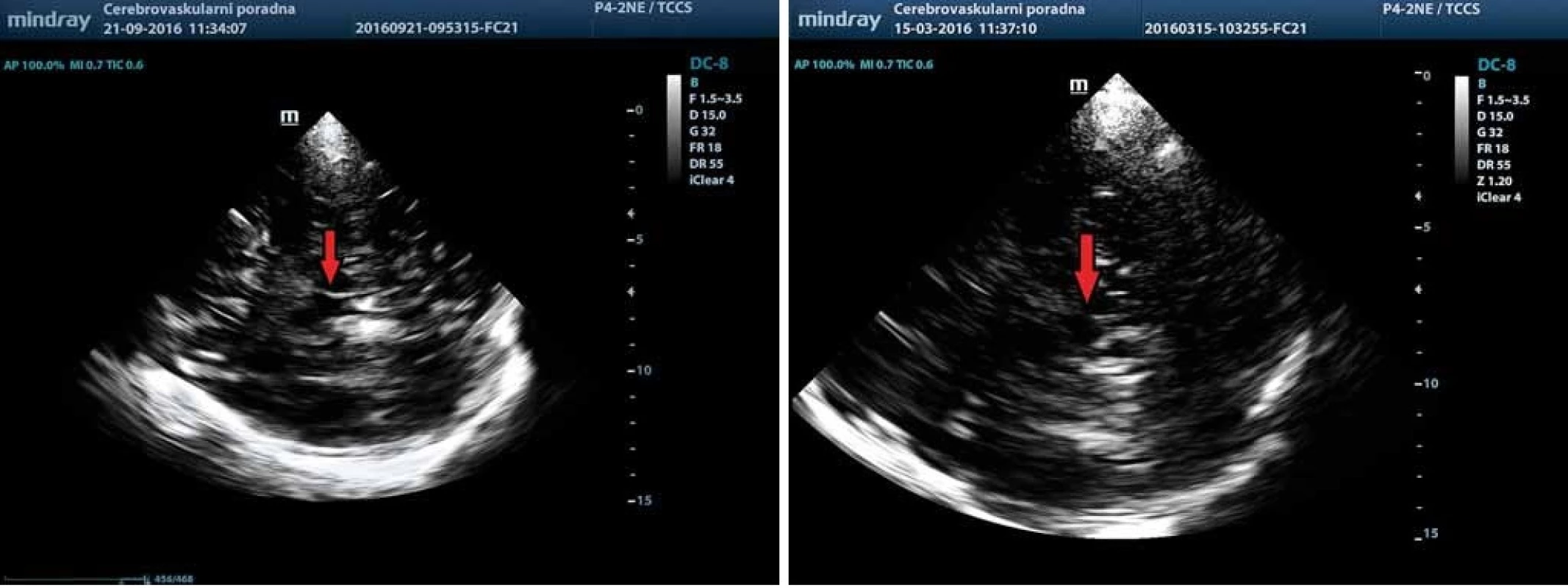
Posouzení echogenity rafeální oblasti mozkového kmene je náročnější kvůli vyšší variabilitě sonografického nálezu, která je závislá na kvalitě ultrazvukového přístroje a nastavení parametrů vyšetření. Ncl. raphe lze obvykle zobrazit jako jasně echogenní proužek ve střední části mozkového kmene, umístěný lehce kaudálně od substantia nigra, takže je obvykle potřeba lehce sondu sklopit. Obvykle v tomto řezu je dobře viditelný ncl. ruber. Hodnocení echogenity rafeální zóny se provádí převážně semikvantitativně. V minulosti se používala čtyřstupňová škála (anechogenní, přerušená echogenní linka, normální kontinuální echogenní linka a hyperechogenní) [19], ale pro omezené klinické uplatnění je dle současného konsenzu doporučeno pouze rozdělení do dvou stupňů echogenity: normální a snížená (obr. 7) [3,6]. Pro snížení vlivu zkušenosti sonografisty lze k hodnocení echogenity ncl. raphe použít digitální analýzu pomocí B-Mode Assist programu [20].
c) Ncl. ruber
Červená jádro, které se anatomicky nachází v kaudální části středního mozku mezi rafeálními jádry a substantia nigra, je typicky zobrazitelné při TCS jako dva malé echogenní proužky ohraničující jeho vnitřní a vnější hranice. Někdy laterální echosignál nelze odlišit od echosignálu substantia nigra. V některých případech může být toto jádro hyperechogenní, avšak diagnostický význam tohoto zvýšení echogenity červeného jádra není jasný a často se objevuje u zcela zdravých jedinců [3].
Struktury zobrazitelné v transverzálním pontinním/mozečkovém řezu
Zobrazení pontu a mozečku lze dosáhnout mírným sklopením sondy kaudálně a rotací o 45° do semikoronárního řezu (obr. 3a). V tomto řezu je zobrazitelná i 4. komora jako dvojlinka v dorzální části mozkového kmene. U dětí a mladších dospělých však nemusí být detekovatelná pro svou malou šířku [21].
a) Mozeček
Mozeček je zobrazen v transverzálním pontinním/ mozečkovém řezu jako anechogenní struktura (bílá hmota mozečkových hemisfér) s hyperechogenními linkami odpovídajícími gyrifikaci mozečku. V současné době neexistují jasná kritéria pro hodnocení patologií mozečku. Jako abnormní jsou popisovány hyperechogenity v bílé hmotě mozečkových hemisfér.
b) Ncl. dentatus
Ncl. dentatus se za normálních okolností zobrazuje jako nízce echogenní struktura, která není jasně ohraničená od bílé hmoty mozečku. Teprve patologicky zvýšená echogenita tohoto jádra umožňuje vizualizaci tohoto jádra. Hodnocení echogenity se provádí semikvantitativně, tedy normální echogenity nebo hyperechogenní.
c) 4. komora
V pontinním/mozečkovém řezu je 4. komora zobrazitelná jako dvojlinka. Lze měřit její šířku nebo plochu průřezu, kdy je za normální považována velikost do 0,6 cm² [3].
Struktury zobrazitelné v transverzálním thalamickém řezu
Sklopením sondy z transverzálního mezencefalického řezu lehce kraniálně lze zobrazit intrakraniální struktury v thalamickém řezu (obr. 1, 3c). V tomto řezu lze zobrazit hyperechogenní šišinku (gl. pinealis) díky kalcifikacím, frontálně pak anechogenní thalamy, 3. komoru jako jasně detekovatelnou dvojlinku a frontální rohy postranních komor.
a) Thalamus
V thalamickém řezu se zobrazují oba thalamy (ipsilaterální i kontralaterální) jako anechogenní oválné struktury. Výjimečně byly popsány případy, kdy byla detekována zvýšená echogenita obou thalamů, ale dosud nebylo popsáno spojení s žádnými klinickými příznaky a diagnostický význam tohoto zvýšení echogenity není jasný.
b) Ncl. caudatus
Caput ncl. caudati je za normálních okolností nízce echogenní struktura dorzálně od frontálního roku postranní komory, která není jasně ohraničena od okolí. Někdy bývá patrná echogenní linie ohraničující caput ncl. caudati na jeho laterální straně. Pro hodnocení echogenity ncl. caudatus je nutná správná anatomická identifikace lokalizace tohoto jádra se zobrazením okolních struktur – frontálního roku postranní komory, 3. komory, okcipitálního roku postranní komory a inzulárního kortexu. Jako patologické se popisuje zvýšení echogenity tohoto jádra ve srovnání s okolní bílou hmotou.
c) Ncl. lentiformis
Obdobně jako ncl. caudatus se i ncl. lentiformis za normálních okolností zobrazuje jako nízce echogenní od okolí neohraničená struktura dorzálně od caput ncl. caudati. I zde je pro hodnocení echogenity nutná správná anatomická identifikace lokalizace tohoto jádra se zobrazením okolních struktur. Jako patologické se popisuje zvýšení echogenity z oblasti tohoto jádra ve srovnání s okolní bílou hmotou, obsah této hyperechogenity by měl být > 0,20 cm² [3]. Jádro lze zobrazit ipsilaterálně i kontrolaterálně, ipsilaterálně je však toto jádro zobrazeno s lepší rozlišovací schopností. Z důvodu vyššího rozlišení obrazu v ohniskové zóně preferujeme vyhodnocení ipsilaterálně k insonaci také při hodnocení pozice elektrody pro hlubokou mozkovou stimulaci v bazálních gangliích (globus pallidus internus, thalamus) [22].
d) Inzulární kůra
Díky gyrifikaci je oblast inzulárního kortexu zobrazována jako dobře ohraničená hyperechogenní struktura obklopena nízce echogenní bílou hmotou hemisfér. Zvýšení echogenity této struktury nelze posuzovat vizuálně, ale jen s pomocí digitální analýzy s využitím B-Mode Assist programu [23].
e) 3. komora, frontální a okcipitální rohy postranních komor
V thalamickém řezu lze zobrazit hyperechogenní okcipitální rohy postranních komor, echogenními linkami ohraničenou 3. komoru a frontální rohy postranních komor s anechogenním likvorem uvnitř komorového systému. Hyperechogenita v okcipitálním roku postranní komory odpovídá choroidálnímu plexu. U 3. komory a kontralaterálního frontálního rohu postranní komory lze měřit jejich šířku, která je však věkově závislá. Hranice normy šíře 3. komory se pohybuje mezi 7 mm u subjektů do 60 let a 10 mm u subjektů nad 60 let. U šíře frontálního rohu postranní komory se pak hranice normy pohybuje mezi 17 a 20 mm pro subjekty do 60, resp. nad 60 let. [3,6]. Patologické je také zvýšení echogenity uvnitř komorového systém, nejčastěji způsobené krví – hemocefalem. Dále je pomocí TCS možno měřit přetlak středočárových struktur, které se provádí oboustranným měřením vzdálenosti 3. komory od kontralaterálních echogenních struktur odpovídajících kortexu a subarachnoidálním prostorám pod kalvou [2].
Struktury zobrazitelné v transverzálním řezu tělem postranní komory – cella media
Dalším sklopením sondy z transverzálního thalamického řezu kraniálně lze zobrazit těla postranních komor a corpus callosum (obr. 3d). Obrazu dominují hyperechogenní linky ohraničující corpus callosum a těla postranních komor.
a) Těla postranních komor
Jelikož transverzálního řezu těly postranních komor lze dosáhnou jen výrazným sklopením sondy kraniálně, tento řez již neodpovídá řezům na CT nebo MR, protože se jedná o šikmý řez. Z těchto důvodů se těla postranních komor zobrazují asymetricky a jejich symetrii z jednostranného přístupu nelze hodnotit. Je možno měřit šíři kontralaterálního těla postranní komory, avšak přesné normy zatím stanoveny nebyly. Symetričnost komorového systému lze posoudit při měření z obou stran. Jako patologie je hodnocena zvýšená echogenita uvnitř komorového systému, přítomná především u hemocefalu [2].
b) Corpus callosum
Corpus callosum je zobrazitelné jako anechogenní struktura ohraničená dvěma echogenními liniemi od těl postranních komor. Lze měřit šíři kalózního tělesa z transtemporálního přístupu nebo také z tranfrontálního přístupu v sagitálním řezu. Zatím však nejsou stanovena přesná kritéria pro hodnocení patologických nálezů.
c) Bílá hmota mozkových hemisfér
Bílá hmota mozkových hemisfér se v transverzálním řezu těly postranních komor zobrazuje jako nízce echogenní, podobně jako v ostatních transtemporálních, transfrontálních a transokcipitálních řezech. Patologie v oblasti bílé hmoty hemisfér (tumory, abscesy, cévní malformace apod.) se obvykle zobrazují jako ložiska odlišné (zvýšené nebo snížené) echogenity. Pro hodnocení patologií v oblasti mozkových hemisfér je výhodné použít technologii fúzovaného obrazu TCS s MR nebo CT [24].
Struktury zobrazitelné v koronárním řezu
Koronárních řezů lze dosáhnout otočením transkraniální sondy z transverzálního řezu o 90°. Sklopením sondy frontálně nebo okcipitálně pak lze zobrazit intrakraniální struktury v předním, středním a zadním koronárním řezu (obr. 4). Koronární řezy se využívají při měření kraniokaudálního rozměru intrakraniálních patologií, např. tumorů, abscesů nebo cévních malformací. Další strukturou, kterou lze zobrazit z koronárního řezu, je hippocampus, resp. mediotemporální lalok.
a) Mediotemporální lalok
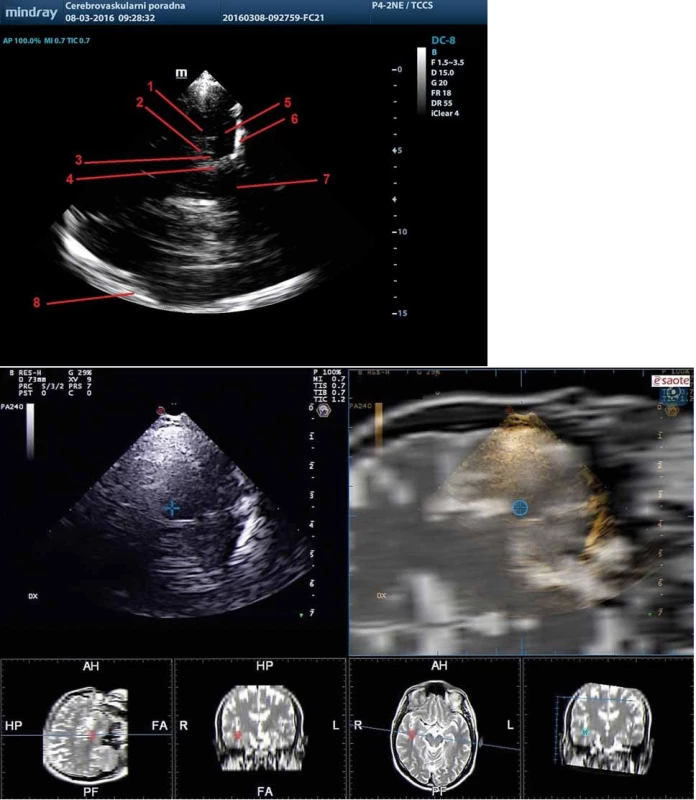
Mediotemporální lalok je relativně dobře identifikovatelná struktura zobrazitelná z transtemporálního přístupu v koronárním řezu. V tomto řezu lze zobrazit echogenní cisterna ambiens, choroidáln í fisura a hranice temporálního rohu postranní komory, které ohraničují mediotemporální lalok. Orientační strukturou v tomto řezu může být také a. cerebri posterior (obr. 8). Poměr výšky mediotemporálního laloku a šíře choroidální fisury lze využít v diagnostice Alzheimerovy demence [25].
Možnosti klinického využití
V posledním desetiletí se díky technologickému pokroku a zlepšení kvality transkraniálního B obrazu nejen u high-end ultrazvukových přístrojů výrazněji rozšířilo i klinické využití TCS, a to především v diagnostice a diferenciální diagnostice neurodegenerativních onemocnění.
Neurodegenerativní onemocnění
Již před více než 20 lety bylo popsáno zvýšení echogenity substantia nigra u pacientů s idiopatickou Parkinsonovou nemocí a snížení echogenity ncl. raphe u pacientů s unipolární depresí [19,26]. Mnoho následných studií potvrdilo, že hyperechogenní substantia nigra je charakteristickým TCS znakem Parkinsonovy nemoci, který se vyskytuje u více než 90 % pacientů s idiopatickou Parkinsonovou nemocí, je patrný již v asymptomatickém stadiu nemoci, v průběhu onemocnění se výrazně nemění a nesouvisí se závažností nebo dobou trvání nemoci [1,6]. Zvýšenou echogenitu substantia nigra však lze detekovat také asi u 10 % zdravé populace, kde koreluje se subklinickými poruchami v striatonigrálním dopaminergním systému [1,27]. Metaanalýza 31 TCS studií s více než 4 300 subjekty prokázala vysokou senzitivitu (0,83) a specifitu (0,87) hyperechogenní substantia nigra pro idiopatickou Parkinsonovu nemoc s diagnostickým podílem rizik (diagnostic odds ratio) 42,9 [28]. U asymptomatických subjektů ve věku 50 – 70 let je hyperechogenní substantia nigra spojena s 20násobným zvýšením rizika vzniku Parkinsonovy nemoci během následujících 5 let [29]. Nicméně význam tohoto sonografického znaku je omezen tím, že se častěji než ve zdravé populaci vyskytuje u řady dalších neurodegenerativních onemocnění, např. u multisystémové atrofie, progresivní supranukleární obrny, Alzheimerovy demence, deprese nebo amyotrofické laterální sklerózy [2,3,6].
Hlavní klinický význam hyperechogenní substantia nigra je v diskriminaci Parkinsonovy nemoci od esenciálního třesu [30,31]. V diferenciální diagnostice Parkinsonovy nemoci a atypických parkinsonských syndromů lze pak s výhodou použít kombinace měření echogenity substantia nigra a dalších mozkových struktur (ncl. lentiformis, caput ncl. caudati, inzuly), měření šíře 3. komory a různých klinických příznaků, např. hyposmie nebo snížení barvocitu (tab. 2) [3]. Dle doporučení European Federation of Neurological Societies (EFNS) a European Section of the Movement Disorder Society (MDS-ES) je v diagnostice Parkinsonovy nemoci doporučeno TCS na úrovni A pro: diferenciální diagnózu Parkinsonovy nemoci od atypických a sekundárních parkinsonských syndromů, včasnou diagnostiku Parkinsonovy nemoci a detekci osob v riziku vzniku Parkinsonovy nemoci [32].
![Typický TCS nálezy u zdravé populace, pacientů s extrapyramidovou symptomatikou [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b3796ae9c9a015cb4a37e66cfbff6fde.png)
Praktické využití TCS vyšetření lze demonstrovat na dvou kazuistikách z Neurologické kliniky LF OU a FN Ostrava. U 65letého muže byl nasazen agonista dopaminu a posléze levodopa pro ztuhlost levé horní končetiny a klidový třes. Po nasazení léčby pacient udával zlepšení příznaků, především hybnosti levé horní končetiny. Po 2 letech nedošlo ke změně klinických příznaků a pacient byl odeslán k TCS vyšetření, které prokázalo normální nález na substantia nigra i ostatních intrakraniálních strukturách. Po tomto vyšetření byly zkušebně vysazeny oba preparáty beze změny v subjektivních a objektivních příznacích. Pacientovi byla stanovena diagnóza esenciálního třesu. Po dalších 7 letech je klinický stav pacienta nezměněn.
Druhou pacientkou byla 51letá žena, u které byl nasazen agonista dopaminu pro klidový i posturální třes obou horních končetin s prevalencí vpravo. Po nasazení léčby pacientka udávala mírné zlepšení příznaků. TCS vyšetření prokázalo normální nález na substantia nigra i ostatních intrakraniálních strukturách. U pacientky byla následně za hospitalizace vysazena léčba bez zhoršení příznaků, při vyšetření se objevuje posturální a intenční třes obou horních končetin měnné intenzity a atypická porucha chůze. Pacientka byla odeslána na psychiatrii s diagnózou psychogenní poruchy.
Snížená echogenita substantia nigra byla prokázána u pacientů s idiopatickým syndromem neklidných nohou [33,34]. Jako hypoechogenní by měla být hodnocena substantia nigra v případě, pokud součet měřené plochy pravé a levé substantia nigra je ≤ 0,20 cm²; měření je potřeba provádět oboustranně s hodnocením vždy jen ipsilaterální substantia nigra [34]. Diagnostická hodnota tohoto nálezu však musí být ještě potvrzena v dalších studiích, optimálně při použití digitální analýzy obrazu.
Substantia nigra představuje důležitou strukturu při TCS hodnocení polohy elektrody hluboké mozkové stimulace zavedené do subthalamického jádra u pacientů s idiopatickou Parkinsonovou nemocí. Hodnocení polohy elektrody se provádí v axiálním (transverzálním) nebo lehce semiaxiálním řezu. Pokud je sonda zavedena do subthalamického jádra, pak by se měl v TCS obraze její echogenní hrot dotýkat (hyper-)echogenní substantia nigra [3,22].
Snížení echogenity ncl. raphe se vyskytuje výrazně častěji u pacientů s depresivní poruchou, kde je detekovatelná pomocí TCS u 50–70 % pacientů, než v běžné populaci, kde je detekovatelná jen v 5–10 % [19,35]. Také u pacientů s panickou poruchou, pacientů s depresí spojenou s Parkinsonovou nemocí a u migreniků bylo detekováno snížení echogenity ncl. raphe [20,36,37]. Změna echogenity ncl. raphe se dává do souvislosti s alterací centrálního serotoninergního systému. Zatím však není jasné, zda je tento nález snížení echogenity stabilní nebo se v čase mění.
Rozšíření 4. komory a hyperechogenity v bílé hmotě mozečku a ncl. dentatus byla popsána u pacientů s různými formami hereditární spinocerebelární ataxie (Friedreichova ataxie, SCA-3, SCA-17), ale zatím není známá specifita tohoto nálezu [21,38].
Dilatace 3. komory je charakteristickým nálezem již v raných fázích progresivní supranukleární paralýzy (Richardson syndrom) a je typickým znakem pro odlišení Parkinsonovy nemoci, a to zejména v kombinaci s hyperechogenním ncl. lentiformis [39]. Rozšíření 3. komory a frontálních rohů postranních komor koreluje se stupněm kognitivní poruchy [40].
Hyperechogenní ncl. lentiformis je charakteristickým nálezem u idiopatické dystonie, a to generalizované, segmentové, fokální nebo „task-related“ formy [41,42], u pacientů s onemocněním mozku způsobeným akumulací kovů (mědi, železa či manganu), např. Wilsonovy choroby, u které však byla nalezena také zvýšená echogenita inzulární oblasti [13, vlastní nepublikovaná data], a u pacientů s atypickými parkinsonskými syndromy, u nichž se vyskytuje až v 70–90 % [1,39]. Hodnocení echogenity ncl. lentiformis lze v kombinaci s hodnocením echogenity inzulární oblasti, subst. nigra, ncl. raphe a změřením šíře 3. komory využít v diferenciální diagnostice výše zmíněných onemocnění od Parkinsonovy nemoci [1,3,40]. Hyperechogenita caput ncl. caudati je pak častým nálezem u pacientů s Huntingtonovou choreou [43].
Výrazné hyperechogenity v oblasti bazálních ganglií s echogenitou podobnou echogenitě epifýzy či plexus choroideus v okcipitálním rohu postranní komory odpovídají kalcifikacím např. u m. Fahr; nicméně drobné tečkovité kalcifikace lze detekovat i u starších osob bez korelace k onemocnění mozku [1,3,44].
Cévní onemocnění mozku
TCS umožňuje zobrazení arteriovenózních malformací, kavernomů a venózních angiomů, které se zobrazují jako hyperechogenní struktury. Tyto patologie jsou nejlépe detekovatelné, pokud jsou umístěny v bílé hmotě mozkových hemisfér, která se zobrazuje jako hypoechogenní. Nicméně primární diagnostika těchto patologií pomocí TCS je velmi obtížná, výhodnější je použití fúzovaného obrazu s CT nebo lépe MR mozku. Klinická využitelnost TCS v této indikaci zatím nebyla stanovena. Jako hyperechogenní se zobrazují také coilované a klipované aneuryzmata, nicméně pro klinické využití je potřeba i vyšetření zbytkového toku v ošetřeném aneuryzmatu, což dovoluje jen transkraniální barevná duplexní sonografie [2].
TCS lze využít v diferenciální diagnostice mozkové ischemie od intracerebrálního krvácení, jelikož mozková ischemie nemění echogenitu mozkového parenchymu, ale krvácení se zobrazuje jako homogenní hyperechogenní léze, jehož echogenita v prvních 72 hod dále lehce narůstá. Okolní edém mozku je hypoechogenní, což zvyšuje kontrast okraje hemoragie. Avšak senzitivita a specifita TCS v této diferenciální diagnostice zatím nebyla testována a v éře dostupnosti CT/MR u pacientů s akutní cévní mozkovou příhodou v České republice zůstává pole využití TCS jen na ojedinělé případy, např. při zhoršení klinických příznaků pacienta v průběhu intravenózní trombolýzy nebo endovaskulárního rekanalizačního výkonu nebo při monitorování resorpce intracerebrálního krvácení u ventilovaných pacientů, kdy lze dle TCS nálezu specifičtěji indikovat následné CT vyšetření mozku [2,45]. Větší využití u pacientů s cévním onemocněním mozku má transkraniální barevná duplexní sonografie, event. transkraniální dopplerometrie [2].
Hydrocefalus
Dilatace 3. komory a postranních komor u pacientů s hydrocefalem nebo výraznou mozkovou atrofií je z transtemporálního přístupu jednoduše detekovatelná v řezu mezencefalickém, thalamickém i řezu těly postranních komor. Šíře 3. komory měřená pomocí TCS velmi dobře koreluje s měřením pomocí MR nebo CT mozku [2,3,46]. Jednoduchým testem pokývání hlavou (shaking test) lze navíc orientačně rozlišit normotenzní a hypertenzní hydrocefalus, k čemuž je využíván M-mod [2].
Nitrolební hypertenze
U pacientů s nitrolební hypertenzí lze TCS využít pro měření posunu středočárových struktur a zobrazení patologií především v oblasti bílé hmoty mozkových hemisfér (krvácení, tumor, absces apod.). Měření posunu středočárových struktur ve výši 3. komory nebo ve výši corpus callosum se provádí vždy pomocí oboustranného měření vzdálenosti středu 3. komory, resp. corpus callosum a laterálního okraje kontralaterálních echogenních struktur pod kalvou; polovina rozdílu hodnot při měření zprava a zleva odpovídá vzdálenosti posunu střední čáry. Korelace měření posunu středočárových struktur pomocí TCS a CT je vysoká, a to především v úrovni 3. komory. Ve výši corpus callosum je odchylka obou měření větší, protože při TCS je využíván lehce šikmý řez. [2,47]. Využití TCS je především u ventilovaných pacientů, avšak významnější roli zde hraje transkraniální barevná duplexní sonografie, event. transkraniální dopplerometrie, které lze lépe využít v monitorování nitrolební hypertenze a také v diagnostice mozkové smrti [3,48].
Expanzívní intrakraniální procesy
Ačkoli již v 80. letech 20. století byly publikovány první práce s možností využití TCS nebo transkraniální barevné duplexní sonografie u pacientů s mozkovým tumorem nebo abscesem, toto pole TCS diagnostiky bylo v současnosti opuštěno. Teoretickým využitím TCS by mohla být detekce reziduálního tumoru po exstirpaci nebo dlouhodobé monitorování růstu tumoru [2].
Nové technologie
Rozvoj nových technologií umožňuje stálé rozšiřování klinického využití TCS. Cílem je nejen zlepšit rozlišovací schopnost a snížit výskyt artefaktů v transkraniálním B obraze, ale především snížit vliv zkušeností a zručnosti sonografisty spojeného s potenciálním subjektivním zkreslením hodnocení nálezu, především hodnocení echogenity intrakraniálních struktur, a event. ovlivnit kvalitu kostního okna [1–3,6]. Kvalita zobrazení intrakraniálních struktur při nižší prostupnosti kostního okna je ovlivněna především typem a kvalitou používané transkraniální sondy a post-processingu.
Vliv závislosti hodnocení TCS nálezu na zkušenosti a zručnosti sonografisty může být výrazně snížena použitím optimalizované techniky pro automatickou detekci struktur a digitalizované analýzy obrazu, např. pomocí B-Mode Assist programu nebo jiných počítačových aplikací [3,12,20,36]. Nicméně, přesnost digitalizované analýzy TCS obrazu je stále do značné míry závislá na schopnosti vyšetřovatele vizualizovat, identifikovat a optimálně zaměřit specifickou strukturu mozku. Nová technologie online fúze obrazů umožňují v reálném čase fúzi TCS s MR, CT nebo PET zobrazením mozku. Při této technologii se využívá již provedených MR, CT nebo PET vyšetření. Data z vybraného vyšetření se nahrají do paměti ultrazvukového přístroje [3,7,23]. Následně lze pomocí virtuální navigace fúzovat TCS obrazy s obrazy nahraného CT, MR nebo PET vyšetření díky možnosti sledování pohybů TCS sondy v prostoru pomocí elektromagnetického systému [12]. Pilotní studie prokázaly velmi vysokou přesnost fúzovaných obrazů s průměrnou kranio-kaudální chybou 0,5 cm (v rozmezí 0–0,7 cm) a laterální chybou 0,1 cm (v rozmezí 0–0,5 cm) [12]. Průměrná doba TCS vyšetření vč. fúzovaného obrazu obvykle nepřekročí 40 min.
Obě tyto nové technologie, tj. digitalizovaná analýza obrazu a technologie fúze TCS obrazu s MR nebo CT, umožňují spolehlivější detekci mozkových patologií pomocí TCS, a to dokonce i hodnocení mozkový struktur, které jsou obtížně (či vůbec) hodnotitelné vizuálně díky jejich podobné echogenitě s okolními strukturami. Další možností využití těchto technologií je v možnosti detekce velmi malých změn echogenity určitých mozkových struktur v čase jako korelátu progrese vybraných nemocnění.
Závěr
Klinické využití TCS v posledních letech výrazně stoupá, a to především u pacientů s neurodegenerativním onemocněním. Další rozvoj technologií, jako je digitalizovaná analýza obrazu nebo technologie fúze TCS s MR či CT, by mohl dále zvýšit klinický přínos TCS diagnostiky.
Indikovat TCS vyšetření z diagnostických důvodu nebo při zvažování úpravy léčby pacienta lze:
- u pacientů s extrapyramidovými příznaky, především pokud není stanovená diagnóza nebo diagnóza není jasná;
- při klinických známkách jiných neurodegenerativních onemocnění, a to v kombinaci s dalšími neurozobrazovacími metodami;
- při sledování pacientů s hydrocefalem, mozkovým nádorem nebo intracerebrálním krvácením k správnému načasování kontrolního CT nebo MR vyšetření mozku;
- při implantaci nebo podezření na dislokaci elektrody hluboké mozkové stimulace k detekci její polohy;
- u pacientů s podezřením na nitrolební hypertenzi vč. následného monitorování změn nitrolebního tlaku, a to v kombinaci s vyšetřením průtokových parametrů v tepnách Willisova okruhu.
Podpořeno grantovými projekty Agentury pro zdravotnický výzkum České republiky 15-25602A, 16-28914A a Grantové agentury České republiky 16-07879S.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. David Školoudík, Ph.D., FESO
Centrum vědy a výzkumu
Fakulta zdravotnických věd UP v Olomouci
Hněvotínská 3
775 15 Olomouc
e-mail: skoloudik@email.cz
Přijato k recenzi: 27. 9. 2016
Přijato do tisku: 18. 11. 2016
prof. MU Dr. David Školoudík, Ph.D., FESO
Profesor Školoudík se narodil 2. března 1972 v Havířově. V letech 1990–1996 vystudoval Lékařskou fakultu Univerzity Palackého v Olomouci, obor všeobecné lékařství. Od roku 1996 pracoval jako sekundární lékař na Neurologickém oddělení Vítkovické nemocnice. V roce 1999 absolvoval atestaci I. stupně z oboru neurologie. Od roku 2001 pracoval jako sekundární lékař, později staniční lékař iktové jednotky a zástupce přednosty pro vědu a vzdělávání ve FN Ostrava. V roce 2002 složil atestaci II. stupně z oboru neurologie. Od roku 2005 vyučoval na Lékařské fakultě a později na Fakultě zdravotnických věd UP v Olomouci. V roce 2007 obhájil dizertační práci, o 2 roky později habilitoval na LF UP v Olomouci a v září 2014 byl jmenován profesorem v oboru neurologie. Od roku 1998 vede neurosonologické kurzy. Je autorem nebo spoluautorem 177 odborných článků, z toho 121 prací v impaktovaných časopisech. Autorsky se podílel na čtyřech monografiích, devíti kapitolách v monografiích a čtyřech pedagogických publikacích. Počet citací v současnosti převyšuje 700, z toho 645 citací je v WOS, Hirschův index je 13 dle WOS, 15 dle SCOPUS. Za své vědecké práce byl oceněn Výroční cenou Českého literárního fondu (Literární cena Josefa Hlávky) za nejlepší odbornou publikaci v České republice za rok 2003 (monografie Neurosonologie), Haškovcovou cenou Nadačního fondu Paula Janssena, Hennerovou cenou za nejlepší odbornou práci v oboru neurologie pro autory do 35 let za rok 1999 a 2004, cenou ČNS za vynikající krátké sdělení či kazuistiku za rok 2010, cenou ČNS za vynikající originální práci za rok 2015, cenou předsednictva ČLS JEP za rok 2015 a čestným uznáním ministra zdravotnictví zdravotnický výzkum a vývoj pro rok 2010 a 2015. Podílel se na řešení devíti grantů (šesti v CEP), z toho v pěti případech jako hlavní řešitel. V současnosti je spoluřešitelem pěti grantů CEP. Od roku 2008 je členem redakční rady časopisu Neurológia a člen Advisory Board časopisu Ultrasound in Medicine and Biology. Podílel se na organizaci 12 kongresů a je školitelem 11 postgraduálních studentů, z nichž dva již úspěšně obhájili dizertační práci. V současnosti je proděkanem Fakulty zdravotnických věd UP v Olomouci.
Sources
1. Berg D, Godau J, Walter U. Transcranial sonography in movement disorders. Lancet Neurol 2008;7(11):1044 – 55. doi: 10.1016/ S1474-4422(08)70239-4.
2. Školoudík D, Škoda O, Bar M, et al. Neurosonologie. Praha: Grada 2003.
3. Walter U, Školoudík D. Transcranial sonography (TCS) of brain parenchyma in movement disorders: quality standards, diagnostic applications and novel technologies. Ultraschall Med 2014;35(4):322 – 31. doi: 10.1055/ s-0033-1356415.
4. Go CL, Frenzel A, Rosales RL, et al. Assessment of substantia nigra echogenicity in German and Filipino populations using a portable ultrasound system. J Ultrasound Med 2012;31(2):191 – 6.
5. Walter U, Kanowski M, Kaufmann J, et al. Contemporary ultrasound systems allow high-resolution transcranial imaging of small echogenic deep intracranial structures similarly as MRI: a phantom study. Neuroimage 2008;40(2):551 – 8. doi: 10.1016/ j.neuroimage.2007.12.019.
6. Walter U, Behnke S, Eyding J, et al. Transcranial brain parenchyma sonography in movement disorders: state of the art. Ultrasound Med Biol 2007;33(1):15 – 25. doi: 10.1016/ j.ultrasmedbio.2006.07.021.
7. Forzoni L, D‘Onofrio S, De Beni S, et al. Virtual Na-vigator Registration Procedure for Transcranial Applic-ation. In: Hellmich C, Hamza MH, Simsik D, eds. Proceed-ings of the IASTED International Conference Biomedical Engineering (BioMed 2012). Innsbruck: International Association of Science and Technology for Development (IASTED) 2012 : 496 – 503.
8. Skoloudik D, Walter U. Method and validity of transcranial sonography in movement disorders. Int Rev Neurobiol 2010;90 : 7 – 34. doi: 10.1016/ S0074-7742(10)90002-0.
9. Skoloudik D, Fadrna T, Bartova P, et al. Reproducibility of sonographic measurement of the substantia nigra. Ultrasound Med Biol 2007;33(9):1347 – 52.
10. van de Loo S, Walter U, Behnke S, et al. Reproducibility and diagnostic accuracy of substantia nigra sonography for the diagnosis of Parkinson‘s disease. J Neurol Neurosurg Psychiatry 2010;81(10):1087 – 92. doi: 10.1136/ jnnp.2009.196352.
11. Walter U. How to measure substantia nigra hyperechogenicity in Parkinson’s disease: detailed guide with video. J Ultrasound Med 2013;32(10):1837 – 43. doi: 10.7863/ ultra.32.10.1837.
12. Skoloudik D, Jelinkova M, Blahuta J, et al. Transcranial sonography of the substantia nigra: digital image analysis. AJNR Am J Neuroradiol 2014;35(12):2273 – 8. doi: 10.3174/ ajnr.A4049.
13. Walter U. Transcranial sonography in brain disorders with trace metal accumulation. Int Rev Neurobiol 2010;90 : 166 – 78. doi: 10.1016/ S0074-7742(10)90012-3.
14. Berg D, Godau J, Riederer P, et al. Microglia activation is related to substantia nigra echogenicity. J Neural Transm 2010;117(11):1287 – 92. doi: 10.1007/ s00702-010-0504-6.
15. Berg D, Becker G, Zeiler B, et al. Vulnerability of the nigrostriatal system as detected by transcranial ultrasound. Neurology 1999;53(5):1026 – 31.
16. Mehnert S, Reuter I, Schepp K, et al. Transcranial sonography for diagnosis of Parkinson‘s disease. BMC Neurol 2010;10 : 9. doi: 10.1186/ 1471-2377-10-9.
17. Hagenah J, König IR, Sperner J, et al. Life-long increase of substantia nigra hyperechogenicity in transcranial sonography. Neuroimage 2010;51(1):28 – 32. doi: 10.1016/ j.neuroimage.2010.01.
18. Behnke S, Double KL, Duma S, et al. Substantia nigra echomorphology in the healthy very old: correlation with motor slowing. Neuroimage 2007;34(3):1054 – 9.
19. Becker G, Becker T, Struck M, et al. Reduced echogenicity of brainstem raphe specific to unipolar depression: a transcranial color-coded real-time sonography study. Biol Psychiatry 1995;38(3):180 – 4.
20. Silhan P, Jelinkova M, Walter U, et al. Transcranial sonography of brainstem structures in panic disorder. Psychiatry Res 2015;234(1):137 – 43. doi: 10.1016/ j.pscychresns.2015.09.010.
21. Postert T, Eyding J, Berg D, et al. Transcranial sonography in spinocerebellar ataxia type 3. J Neural Transm Suppl 2004;68 : 123 – 33.
22. Walter U, Kirsch M, Wittstock M, et al. Transcranial sonographic localization of deep brain stimulation electrodes is safe, reliable and predicts clinical outcome. Ultrasound Med Biol 2011;37(9):1382 – 91. doi: 10.1016/ j.ultrasmedbio.2011.05.017.
23. Skoloudik D, Bartova P, Maskova J, et al. Transcranial Sonography of the Insula: Digitized Image Analysis of Fusion Images with Magnetic Resonance. Ultraschall Med 2016 Aug 3. [Epub ahead of print].
24. Skoloudik D, Walter U. Sonographic brain atlas. 2nd ed. Praha: Rekesh Comp Ltd 2014.
25. Yilmaz R, Pilotto A, Roeben B, et al. Structural Ultrasound of the Medial Temporal Lobe in Alzheimer‘s Disease. Ultraschall Med 2016, Jun 7. [Epub ahead of print].
26. Becker G, Seufert J, Bogdahn U, et al. Degeneration of substantia nigra in chronic Parkinson‘s disease visualized by transcranial color-coded real-time sonography. Neurology 1995;45(1):182 – 4.
27. Berg D, Becker G, Zeiler B, et al. Vulnerability of the nigrostriatal system as detected by transcranial ultrasound. Neurology 1999;53(5):1026 – 31.
28. Li DH, He YC, Liu J, et al. Diagnostic Accuracy of Transcranial Sonography of the Substantia Nigra in Parkinson‘s Disease: a Systematic Review and Meta-analysis. Sci Rep 2016;6 : 20863. doi: 10.1038/ srep20863.
29. Berg D, Behnke S, Seppi K, et al. Enlarged hyperechogenic substantia nigra as a risk marker for Par-kinson‘s disease. Mov Disord 2013;28(2):216 – 9. doi: 10.1002/ mds.25192.
30. Stockner H, Sojer M, K KS, et al. Midbrain sonography in patients with essential tremor. Mov Disord 2007;22(3):414 – 7.
31. Doepp F, Plotkin M, Siegel L, et al. Brain parenchyma sonography and 123I-FP-CIT SPECT in Parkinson‘s disease and essential tremor. Mov Disord 2008;23(3):405 – 10.
32. Berardelli A, Wenning GK, Antonini A, et al. EFNS/ MDS-ES/ ENS recommendations for the diagnosis of Parkinson‘s disease. Eur J Neurol 2013;20(1):16 – 34. doi: 10.1111/ ene.12022.
33. Schmidauer C, Sojer M, Seppi K, et al. Transcranial ultrasound shows nigral hypoechogenicity in restless legs syndrome. Ann Neurol 2005;58(4):630 – 4.
34. Godau J, Schweitzer KJ, Liepelt I, et al. Substantia nigra hypoechogenicity: definition and findings in restless legs syndrome. Mov Disord 2007;22(2):187 – 92.
35. Walter U, Hoeppner J, Prudente-Morrissey L, et al. Parkinson‘s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain 2007;130(7):1799 – 807.
36. Berg D, Supprian T, Hofmann E, et al. Depression in Parkinson‘s disease: brainstem midline alteration on transcranial sonography and magnetic resonance imaging. J Neurol 1999;246(12):1186 – 93.
37. Hamerla G, Kropp P, Meyer B, et al. Midbrain raphe hypoechogenicity in migraineurs: an indicator for the use of analgesics but not triptans. Cephalalgia 2016, Aug 17. pii: 0333102416665225. [Epub ahead of print].
38. Synofzik M, Godau J, Lindig T, et al. Transcranial sonography reveals cerebellar, nigral, and forebrain abnormalities in Friedreich‘s ataxia. Neurodegener Dis 2011;8(6):470 – 5.
39. Walter U, Dressler D, Probst T, et al. Transcranial brain sonography findings in discriminating between parkinsonism and idiopathic Parkinson’s disease. Arch Neurol 2007;64(11):1635 – 40.
40. Wollenweber FA, Schomburg R, Probst M, et al. Width of the third ventricle assessed by transcranial sonography can monitor brain atrophy in a time - and cost-effective manner – results from a longitudinal study on 500 subjects. Psychiatry Res 2011;191(3):212 – 6.
41. Walter U, Blitzer A, Benecke R, et al. Sonographic detection of basal ganglia abnormalities in spasmodic dysphonia. Eur J Neurol 2014;21(2):349 – 52. doi: 10.1111/ ene.12151.
42. Naumann M, Becker G, Toyka KV, et al. Lenticular nucleus lesion in idiopathic dystonia detected by transcranial sonography. Neurology 1996;47(5):1284 – 90.
43. Postert T, Lack B, Kuhn W, et al. Basal ganglia alterations and brain atrophy in Huntington‘s disease depicted by transcranial real time sonography. J Neurol Neurosurg Psychiatry 1999;67(4):457 – 62.
44. Brüggemann N, Schneider SA, Sander T, et al. Distinct basal ganglia hyperechogenicity in idiopathic basal ganglia calcification. Mov Disord 2010;25(15):2661 – 4. doi: 10.1002/ mds.23264.
45. Škoda O, Herzig R, Mikulík R, et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N 2016;79/ 112(3):351 – 63. doi: 10.14735/ amcsnn2016351.
46. Seidel G, Kaps M, Gerriets T, et al. Evaluation of the ventricular system in adults by transcranial duplex sonography. J Neuroimaging 1995;5(2):105 – 8.
47. Woydt M, Greiner K, Perez J, et al. Transcranial duplex-sonography in intracranial hemorrhage. Evaluation of transcranial duplex-sonography in the diagnosis of spontaneous and traumatic intracranial hemorrhage. Zentralbl Neurochir 1996;57(3):129 – 35.
48. Tomek A, Školoudík D, Škoda O, et al. Metodika stanovení smrti mozku pomocí transkraniální sonografie vypracovaná Neurosonologickou komisí a Cerebrovaskulární sekcí České neurologické společnosti ČLS JEP. Cesk Slov Neurol N 2016;79/ 112(5):608 – 11.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 1
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Hodnocení rohovkové inervace pomocí konfokální mikroskopie
- Diabetická retinopatie a změny nervových vláken hodnocené konfokální mikroskopií rohovky
- Validace dotazníku kvality života pro pacienty s myastenií – česká verze MG-QOL15
- Periodické pohyby končetinami ve spánku jsou závažnější u narkolepsie s kataplexií než u narkolepsie bez kataplexie
- Vztah časných metabolických změn mozku a vybraných vstupních parametrů u pacientů posubarachnoidálním krvácení z prasklého aneuryzmatu
- Základní neurologické vyšetření – nastal čas pro změny?
- Úskalí diagnostiky atypické formy kongenitální svalové dystrofie – parciálního deficitu merosinu – kazuistiky
- Endoskopická exstirpace koloidní cysty III. mozkové komory
- Transkraniální sonografie – možnosti zobrazení intrakraniálních struktur v B obraze
- Kmenové buňky v léčbě amyotrofické laterální sklerózy – přehled současných klinických zkušeností
- Genetika atypického parkinsonizmu
- Současný pohled na kontraindikace a komplikace elektromyografie
- Změna mikrobiologickýho vzorku u pacientů s potvrzenou bakteriální meningitidou po postkraniotomiální operaci
- Neurologický a MR skríning pacientů s Crohnovou chorobou může zvýšit bezpečnost dlouhodobé terapie anti-TNF-α
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Současný pohled na kontraindikace a komplikace elektromyografie
- Základní neurologické vyšetření – nastal čas pro změny?
- Endoskopická exstirpace koloidní cysty III. mozkové komory
- Periodické pohyby končetinami ve spánku jsou závažnější u narkolepsie s kataplexií než u narkolepsie bez kataplexie

