Prediktory pozitivního léčebného výsledku u pacientů s akutní cévní mozkovou příhodou podstupujících endovaskulární léčbu - výsledky z registru CERBERUS
Authors:
M. Roubec 1; D. Krajíčková 2; J. Hommerová 3; P. Kešnerová 4; S. Klimošová 5; P. Rapantová 6; R. Herzig 2; D. Školoudík 1,7; Cerberus Study Group
Authors‘ workplace:
Comprehensive Stroke Center, Department of Neurology, University Hospital Ostrava, Czech Republic
1; Comprehensive Stroke Center, Department of Neurology, Charles University Faculty of Medicine and University Hospital Hradec Králové, Czech Republic
2; Comprehensive Stroke Center, Department of Neurology, Faculty of Medicine Charles University and University Hospital Plzeň, Czech Republic
3; Comprehensive Stroke Center, Department of Neurology, Faculty of Medicine Charles University and University Hospital Praha Motol, Czech Republic
4; Comprehensive Stroke Center, Department of Neurology, Regional Hospital Liberec, Czech Republic
5; Stroke Center, Department of Neurology, Vítkovice Hospital, Ostrava, Czech Republic
6; Center for Research and Science, Department of Nursing, Faculty of Health Science, Palacký University Olomouc, Czech Republic
7
Published in:
Cesk Slov Neurol N 2017; 80(6): 666-674
Category:
Original Paper
Overview
Úvod:
Endovaskulární terapie (EVT) s použitím stent-retrieverů (v přední cirkulaci) již prokázala svou superioritu a bezpečnost ve srovnání se samotnou intravenózní trombolýzou (IVT) nebo žádnou specifickou terapií. Srovnali jsme klinický výsledek pacientů s ischemickou cévní mozkovou příhodou (iCMP) podstupujících EVT přijatých direktně do komplexních cerebrovaskulárních center (KCC) s pacienty transferovanými sekundárně z lokálních iktových center (IC) do KCC.
Metodika a pacienti:
Byly zaznamenány demografické údaje, rizikové faktory a zdravotní anamnéza všech konsekutivních pacientů léčených EVT ve spolupracujících iktových centrech KCC/IC. Pacienti byli rozděleni do tří skupin: léčba IVT v IC před transferem k EVT do KCC; léčba IVT přímo v KCC s navazující EVT v tomtéž centru; žádná IVT před EVT. Neurologický stav při přijetí a 7. den byl hodnocen za využití National Institutes of Health Stroke Scale. Soběstačnost pacientů 90. den byla hodnocena pomocí modifikované Rankinovy škály (mRS). Jako dobrý klinický výsledek bylo označeno skóre mRS 0 – 2. Kontrolní vyšetření výpočetní tomografií nebo magnetickou rezonancí byla provedena k vyloučení symp tomatického intracerebrálního krvácení (SICH).
Výsledky:
Celkem 568 pacientů (313 mužů; průměrný věk 66,1 ± 13,2 roku) bylo zařazeno do registru od ledna 2006 do konce července 2015. Pacienti ze všech třech skupin se statisticky nelišili ve vstupních charakteristikách mimo času od vzniku příhody do zahájení EVT. Průměrné zdržení začátku EVT u pacientů transferovaných z IC do KCC činilo 45 min. Podskupiny se také statisticky nelišily ve výskytu SICH (celková prevalence 5,5 %) a dosaženém dobrém klinickém výsledku (celkově 46,7 %).
Závěr:
Benefit přímého transferu pacienta do KCC si zaslouží další sledování. Prezentovaná studie prokázala, že obě varianty organizace transportu pacienta s iCMP k EVT v České republice jsou srovnatelně efektivní a bezpečné.
Klíčová slova:
cévní mozková příhoda – rekanalizace – endovaskulární léčba – stent retriever – management
Úvod
Akutní uzávěr magistrálních mozkových tepen je zpravidla spojen s těžkým neurologickým deficitem a nízkou šancí na časnou rekanalizaci pomocí intravenózní trombolýzy (IVT) [1]. V roce 2015 byla prokázána superiorita a bezpečnost endovaskulární terapie (EVT) za použití stent-retrieverů (v přední mozkové cirkulaci) ve srovnání s IVT samotnou nebo žádnou specifickou terapií [2–9]. Z tohoto důvodu by tato metoda měla být nyní zvažována u všech pacientů s akutní ischemickou cévní mozkovou příhodou (iCMP) spojenou s okluzí magistrální mozkové tepny (za dodržení časového okna). EVT si žádá změny v protokolu řízení akutní iktové péče jak na úrovní přednemocniční, tak v oblasti komunikace a organizace mezi lokálními iktovými centry (IC) a komplexními cerebrovaskulárními centry (KCC). Cílem je stanovit optimální algoritmus péče pro pacienty s iCMP a okluzí magistrální mozkové tepny. Iktová péče prošla v ČR v posledních 20 letech významným rozvojem. IVT začala být podávána rutinně pacientům s iCMP na vybraných neurologických odděleních od roku 1998. Některé nemocnice zřídily specializované iktové jednotky poskytující komplexní cerebrovaskulární péči již od samého počátku, jiné spolupracovaly s interními či mezioborovými jednotkami intenzivní péče (JIP). EVT začala být prováděna v ČR od roku 2005, většinou ve fakultních nemocnicích, vzácně v lokálních nemocničních zařízeních. V roce 2010 byla vytvořena dvouúrovňová síť iktových center. První úroveň tvořilo celkem 32 IC poskytující základní akutní iktovou péči (multimodální zobrazování, iktová jednotka, léčba IVT, časná rehabilitace, vedení primární a sekundární prevence a léčba běžných komplikací) a spolupracujících s nejbližším KCC. KCC pak navíc poskytují EVT, komplexní neurochirurgickou péči a konzultační činnost pro IC a také ostatní spádová neurologická oddělení stran preventivní a následné terapie s ohledem na cerebrovaskulární problematiku (druhá úroveň, 13 KCC). Každé IC má příslušný spád (≈ 250 000 – 500 000 obyvatel) založený na zeměpisných podmínkách a hustotě osídlení. Iktovou péči poskytují neurologové a každé IC musí mít specializovanou iktovou jednotku. Vyšetřovací algoritmus se napříč IC a KCC významně neliší a představuje u každého iktového pacienta neurologické vyšetření, základní laboratorní testy, vyšetření mozku CT nebo MR a u všech pacientů potencionálně vhodných pro léčbu IVT či EVT navíc CT angiografii (CTA) nebo MR angiografii (MRA). Typický diagnostický čas ve zkoumané populaci (leden 2006 – červenec 2015) odpovídá času od přijetí do podání IVT – „door-to-needle time“ (DNT) a činil ≈ 55 min. V každém kraji ČR obvykle existuje jedno KCC, které spolupracuje s lokálními centry v daném regionu a obstarává zhruba 800 000 – 1 200 000 obyvatel. Cestovní vzdálenosti a časy mezi jednotlivými IC a KCC se mezi regiony liší od zhruba od 10 do 90 min [10,11].
Čas do rekanalizace je stěžejní parametr, nicméně jak v prehospitalizační fázi selektovat pacienty vhodné pro EVT (tedy jestli je transferovat nejprve do nejbližšího IC s časným zahájením IVT a teprve následně transferovat do KCC nebo zvolit přímý transport do KCC pro pacienty s těžkým neurologickým deficitem) nebylo ve sledovaném období jednoznačně známo. Porovnali jsme klinický výsledek mezi pacienty: 1. indikovanými k EVT po selhání IVT přijatými direktně do KCC s pacienty sekundárně transferovanými z IC do KCC po selhání IVT; 2. léčenými EVT po selhání IVT a pacienty léčenými EVT, kteří byli kontraindikováni k IVT. Dále jsme se pokusili identifikovat prediktory symptomatické intracerebrální hemoragie (SICH) a dobrého klinického výsledku 90. den po EVT. Dále jsme porovnali bezpečnost a účinnost EVT mezi pacienty s rozdílnou lokalizací okluzí mozkových tepen.
Materiál a metodika
Registr
Český registr cerebrálních mechanických rekanalizací u akutního ischemického iktu (Czech Registry of Cerebral Mechanical Recanalizations in Acute Ischemic Stroke – CERBERUS) byl založen za účelem prospektivního sběru dat v ČR. Sedm následujících iktových center poskytujících EVT zadávalo do registru svá data: Fakultní nemocnice Ostrava (od ledna 2006), Vítkovická nemocnice Ostrava (od září 2013), Fakultní nemocnice Hradec Králové, Krajská nemocnice Liberec, Fakultní nemocnice v Motole, Ústřední Vojenská nemocnice v Praze (od ledna 2014) a Fakultní nemocnice Plzeň (od ledna 2015). Celá studie byla prováděna v souladu s Helsinskou deklarací z roku 1975 (dle revizí z roku 2004 a 2008). Studie byla schválena lokální etickou komisí zakládajícího centra (číslo usnesení 169/2013). Pacienti poskytli informovaný souhlas. Podpis nezávislého svědka potvrdil souhlas pacienta, který nebyl schopen podpisu.
Soubor pacientů, vstupní a vylučující kritéria pro EVT
V ČR musí být všichni pacienti v časovém okně a bez známých kontraindikací pro IVT transferováni do nejbližšího iktového centra (IC nebo KCC) k diagnostice a terapii IVT. EVT byla v centrech participujících na registru CERBERUS u překládaného souboru indikována za splnění náledujících pěti podmínek: 1. okluze velké mozkové tepny (střední mozková tepna (ACM), vnitřní karotida (ACI) – okluze krčního segmentu s nebo bez okluze ACM anebo T-typ okluze ACI, okluze bazilární arterie (AB) diagnostikována CTA nebo MRA); 2. začátek výkonu EVT do 6–8 h od vzniku příznaků (8hodinové časové okno bylo aplikováno ve vybraných KCC po schválení lokální etickou komisí) se specifickými výjimkami (např. ischemie v zadní cirkulaci při okluzi AB); 3. selhání IVT (žádné neurologické zlepšení od začátku IVT do zahájení EVT nebo během transferu) nebo kontraindikace k IVT; 4. neurologický deficit při přijetí do nemocnice ≥ 8 bodů ve škále National Institutes of Health Stroke Scale (NIHSS) nebo kolísající neurologický deficit; 5. soběstačnost pacienta před iktem (0–2 body v modifikované Rankinově škále – mRS).
Všechna vyšetření CT/MR byla hodnocena lokálně. Žádná standardizovaná (postavená na zobrazovacích vyšetřeních) metoda pro výběr pacientů, jako je Alberta Stroke Program Early CT (ASPECT) skóre, nebyla rutinně užívána. Endovaskulární týmy byly svolávány bezprostředně po diagnóze okluze magistrální mozkové tepny za předpokladu absence kontraindikací k EVT. Iktový lékař IC měl za povinnost kontaktovat KCC ihned po zobrazovacím vyšetření. Transfer z IC do KCC byl realizován lokální Zdravotnickou záchrannou službou v režimu nejvyšší priority. Skeny CT a MR byly zasílány cestou národního obrazového archivačního a komunikačního systému (picture archiving and communication system – PACS) do KCC; tímto však nesměla být zdržena organizace transferu. Zobrazovací vyšetření nebylo v KCC rutinně před EVT opakováno, pokud nedošlo ke zhoršení neurologického deficitu během transferu (> 4 body v NIHSS).
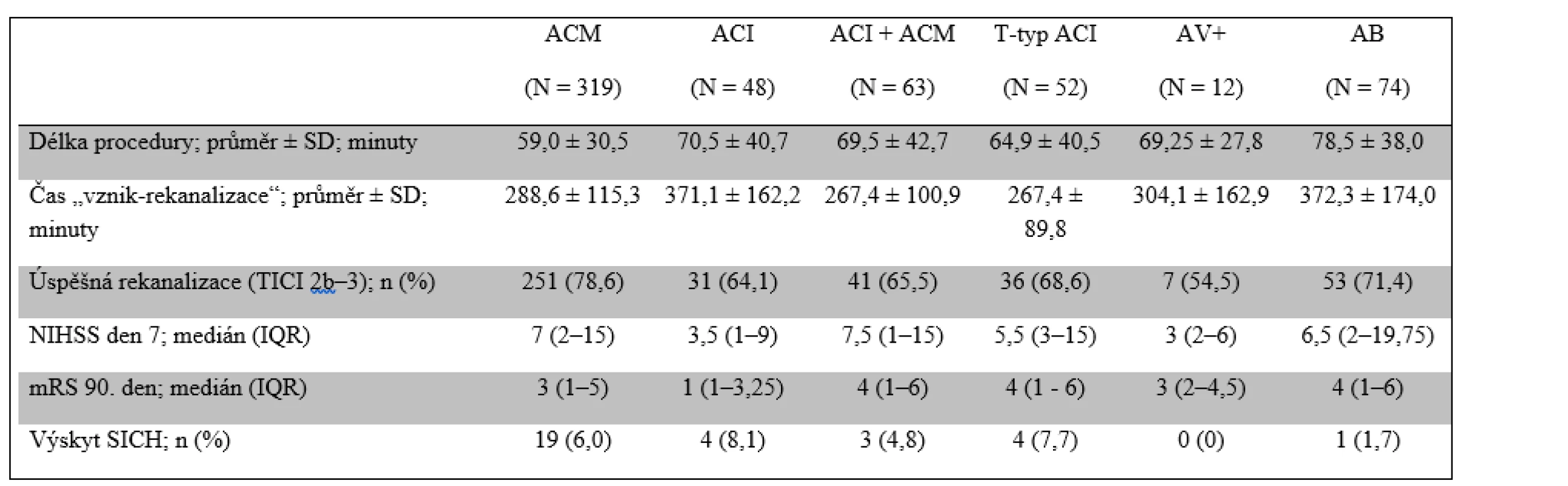
Všechna centra, jež byla součástí registru CERBERUS, sbírala prospektivně data všech konsekutivních pacientů s iCMP léčených EVT. Při přijetí byly zaznamenány demografické údaje (věk, pohlaví), dále informace o rizikových faktorech a zdravotní anamnéza (krevní tlak, hladina glukózy a cholesterolu v krvi, údaje o kuřáctví, konzumaci alkoholu, terapii antiagregačními léky a statiny, body mass index (BMI), údaj o předchozí tranzitorní ischemické atace (TIA) nebo iktu, anamnéza fibrilace síní). K posouzení tíže neurologického deficitu byla využita škála NIHSS a k posouzení soběstačnosti pak škála mRS. Pacienti byli rozděleni do 3 skupin: 1. léčba IVT v IC a následný transfer do KCC k EVT (skupina 1); 2. léčba IVT přímo v KCC s navazující EVT v tomtéž centru (skupina 2); 3. žádná IVT před EVT pro kontraindikace nebo nesplnění časového okna pro IVT (skupina 3). CERBERUS obsahuje data pacientů s iktem jak v přední, tak v zadní cirkulaci. Bylo vytvořeno 6 podskupin s ohledem na místo okluze ke srovnání účinnosti (úspěch rekanalizace, soběstačnost 90. den od iCMP) a bezpečnosti EVT (výskyt SICH a maligního mozkového edému): 1. izolovaný uzávěr ACM; 2. izolovaný uzávěr ACI; 3. okluze ACI + ACM (s průchodnou přední mozkovou artérií – ACA); 4. T-typ okluze ACI; 5. okluze vertebrální artérie (AV) s chronickou kontralaterální okluzí AV nebo distální embolizací do zadní cirkulace (AV+); 6. okluze AB.
Léčebné metody
V zúčastněných centrech bylo užito pět různých přístupů k EVT uzavřené mozkové tepny: 1. mechanická trombektomie stent-retrieverem; 2. perkutánní transluminální angioplastika s/bez použití stentu; 3. endovaskulární sonolýza; 4. intra-arteriální trombolýza; 5. kombinace výše uvedených metod. Výběr metody rekanalizace byl na intervenčním radiologovi.
Zaznamenána byla všechna logistická data (čas od vzniku do podání IVT a DNT pro IVT; čas od vzniku do zahájení EVT, čas od přijetí do nemocnice do zahájení EVT, délka procedury EVT a čas od vzniku příhody do dosažení rekanalizace při EVT) u všech skupin (tam, kde lze aplikovat).
Hodnocení rekanalizace a klinického výsledku
Stupeň dosažené rekanalizace byl hodnocen za pomocí škály Thrombolysis in Cerebral Infarction (TICI). Úspěšná rekanalizace byla hodnocena jako skóre 2b–3. Neurologický stav 7. a 90. den byl hodnocen u všech pacientů pomocí škály NIHSS a soběstačnost 90. den pomocí škály mRS. Jako dobrý klinický výsledek bylo označeno mRS 0–2. Kontrolní CT nebo MR mozku byly provedeny u všech pacientů do 24 h od vzniku příhody (a dle potřeby v případě zhoršení neurologického stavu) k vyloučení SICH. SICH byla definována jako přítomnost intracerebrální hemoragie na kontrolní CT nebo MR mozku společně s prohloubením neurologického deficitu o 4 a více body ve škále NIHSS. Maligní mozkový edém pak byl definován jako klinické zhoršení stavu pacienta o 4 a více bodů ve škále NIHSS za přítomnosti přetlaku středočárových struktur na kontrolní CT nebo MR mozku.
Statistická analýza
Normálnost distribuce dat byla ověřena užitím Shapiro-Wilkova testu. Kategorické proměnné jsou předkládány jako frekvence a procenta. Data s normální distribucí referujeme jako průměr ± směrodatná odchylka (SD). Parametry nenaplňující normální distribuci prezentujeme jako medián a interkvartilní rozsah (IQR). Kategorické proměnné ve dvou větvích byly porovnány Fisherovým exaktním testem, kontinuální proměnné pak Mann-Whitneyho U-testem. Univarietní a násobné logistické regresní analýzy s kalkulacemi upravených a neupravených poměrů pravděpodobnosti (odds ratio; OR) byly využity k určení možných prediktorů úspěchu rekanalizace, maligního mozkového edému a dobrého klinického výsledku 90. den. Následné proměnné byly zavzaty do analýz: věk, pohlaví, anamnéza arteriální hypertenze, diabetu mellitu, hyperlipidemie, BMI, kouření, abuzus alkoholu, fibrilace síní, předchozí TIA, předchozí ischemický iktus, předchozí užívání antitrombotické terapie, terapie statiny započatá před nebo během 24 h od vzniku iCMP, NIHSS při přijetí, vstupní systolický a diastolický tlak krve, vstupní glykemie a hladina celkového cholesterolu v krvi, údaj o podání IVT, lokalizace cévního uzávěru, délka procedury EVT a čas do dosažení rekanalizace. Všechny testy byly vedeny na hladině statistické významnosti 0,05. Data byla analyzována pomocí software SPSS v22.0 (IBM, Armonk, NY, USA).
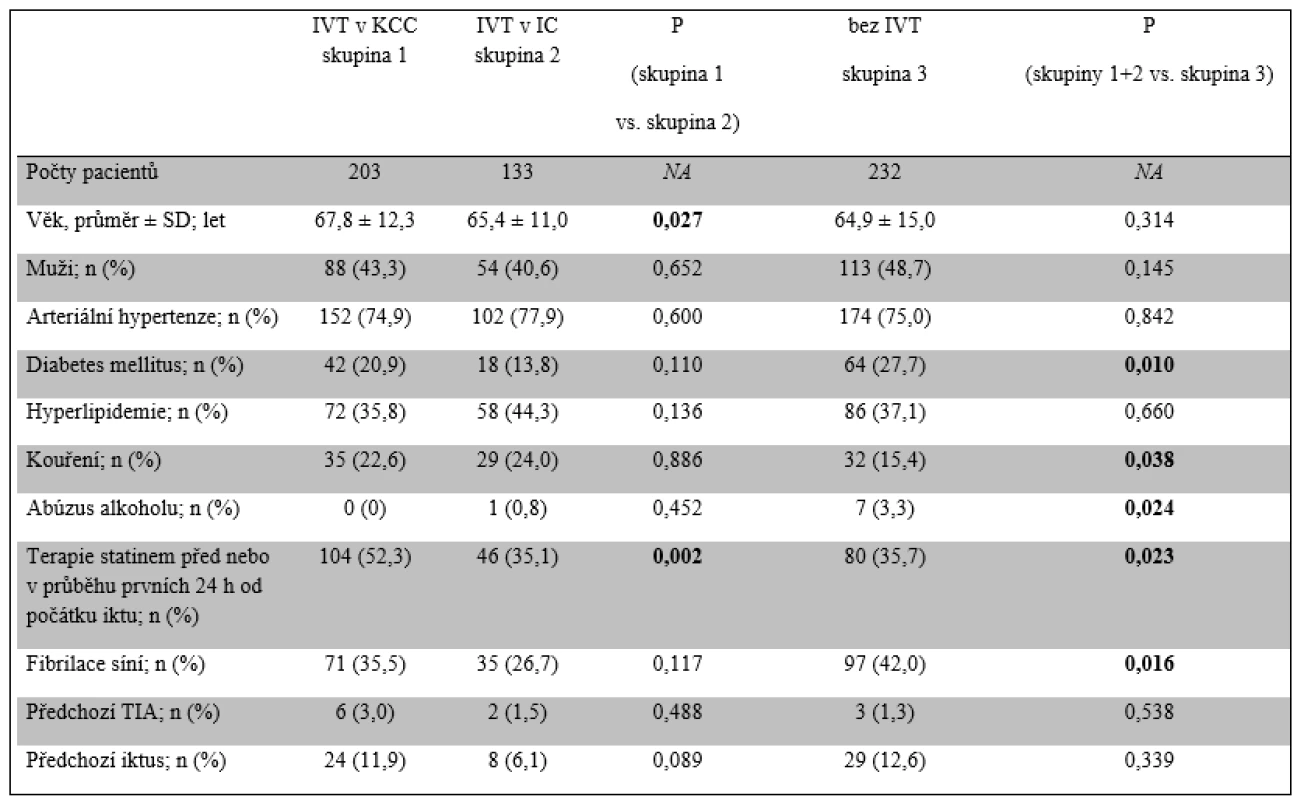
Výsledky
Byla sesbírána data celkem 568 pacientů (313 mužů; průměrný věk 66,1 ± 13,2 let), kteří podstoupili EVT v období od ledna 2006 do konce července 2015. Z těchto 568 pacientů 133 podstoupilo EVT po selhání IVT v KCC (79 mužů; průměrný věk 65,4 ± 11,0 let), 203 bylo léčeno EVT v KCC po IVT podané v IC (115 mužů; průměrný věk 67,8 ± 12,3 let) a 232 pacientů, kteří byli kontraindikováni k IVT, ale podstoupili EVT v KCC (119 mužů; průměrný věk 64,9 ± 15,0 let).
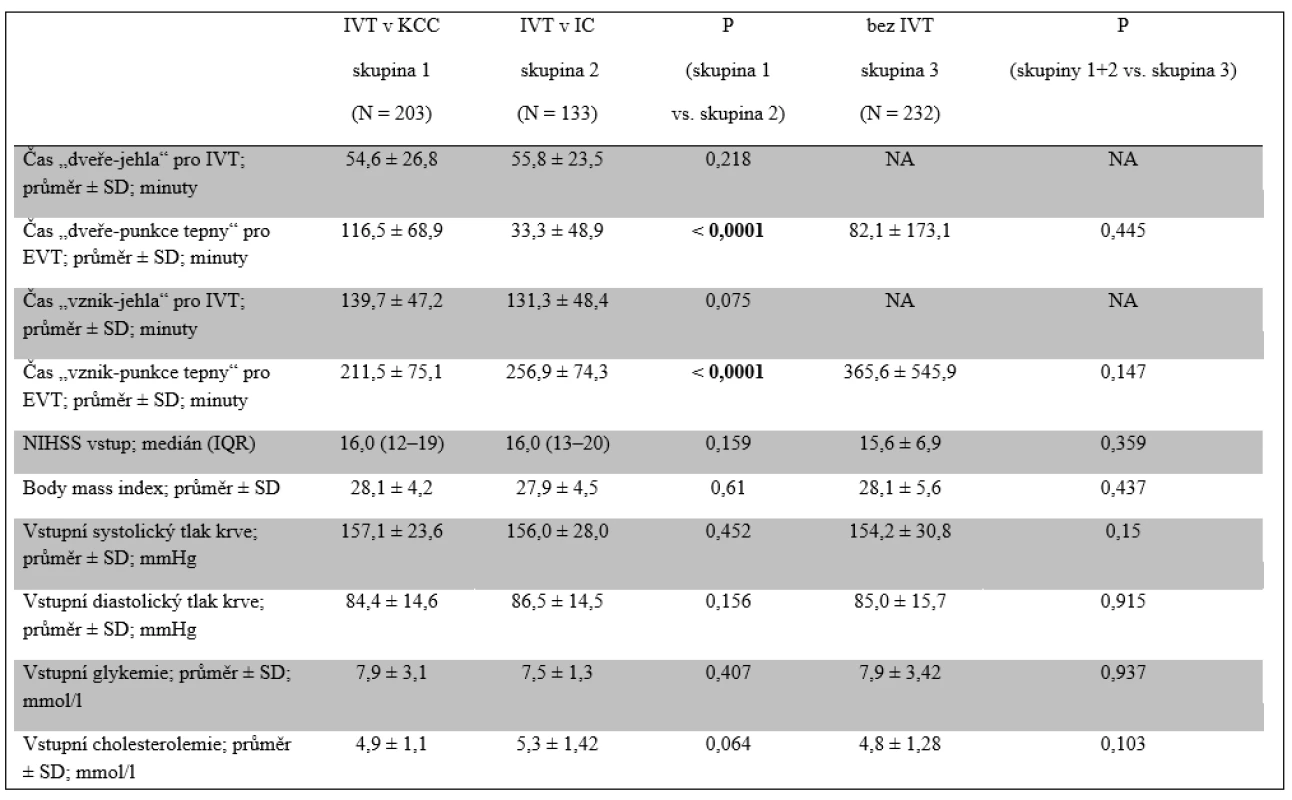
Pacienti všech tří skupin se nelišili ve vstupních charakteristikách mimo času do zahájení EVT. Čas od přijetí do KCC do zahájení EVT (DGT) byl signifikantně kratší u pacientů diagnostikovaných a léčených IVT v IC, u nichž byla diagnostika provedena již v IC. Na druhé straně, čas od vzniku iktu do zahájení EVT byl významně kratší u pacientů léčených IVT přímo v KCC s navazující EVT v tomtéž centru. Délka procedury EVT se nelišila mezi jednotlivými skupinami s ohledem na případnou předchozí IVT. Také čas do dosažení rekanalizace nebyl významně odlišný mezi pacienty léčenými IVT (skupina 1 a 2) a bez podání IVT (skupina 3), byl ale významně kratší u pacientů léčených IVT přímo v KCC (skupina 1) ve srovnání s pacienty s IVT podanou v IC (skupina 2). Čas od vzniku příhody do přijetí do nemocnice (68 min vs. 75 min) a DNT se významně nelišily mezi IC a KCC. Průměrné zdržení zahájení EVT u pacientů transferovaných z IC činilo 45 min a záviselo na dostupnosti transportu cestou záchranné služby, délce transferu a diagnostického času v IC. Údaje o trvání transportu a času stráveném pacientem v IC před odjezdem nebyly bohužel sbírány (tab. 1 a 2).
Pacienti byli léčeni pomocí: 1. mechanická trombektomie stent-retrieverem (254 pacientů); 2. perkutánní transluminální angioplastiky s/bez použití stentu (157 pacientů); 3. endovaskulární sonolýzy (3 pacienti); 4. intra-arteriální trombolýzy (24 pacientů); 5. kombinace výše uvedených metod (130 pacientů).
Celková prevalence SICH činila 5,5 %. Dobrého klinického výsledku dosáhlo 90. den celkem 46,7 % pacientů a dalších 8,5 % pacientů dosáhlo klinického výsledku mRS 3. Podskupiny se nelišily co do prevalence SICH a klinického výsledku (tab. 3 a obr. 1). Žádný významný rozdíl nebyl shledán ani u pacientů, kteří byli léčeni intra-arteriální trombolýzou samotnou nebo v kombinaci s jinou metodou. Dobrého klinického výsledku bylo dosaženo u 55,4 % pacientů s úspěšnou rekanalizací (TICI 2b–3) oproti jen 22,1 % pacientů se skóre TICI 0–2a (p < 0,0001).
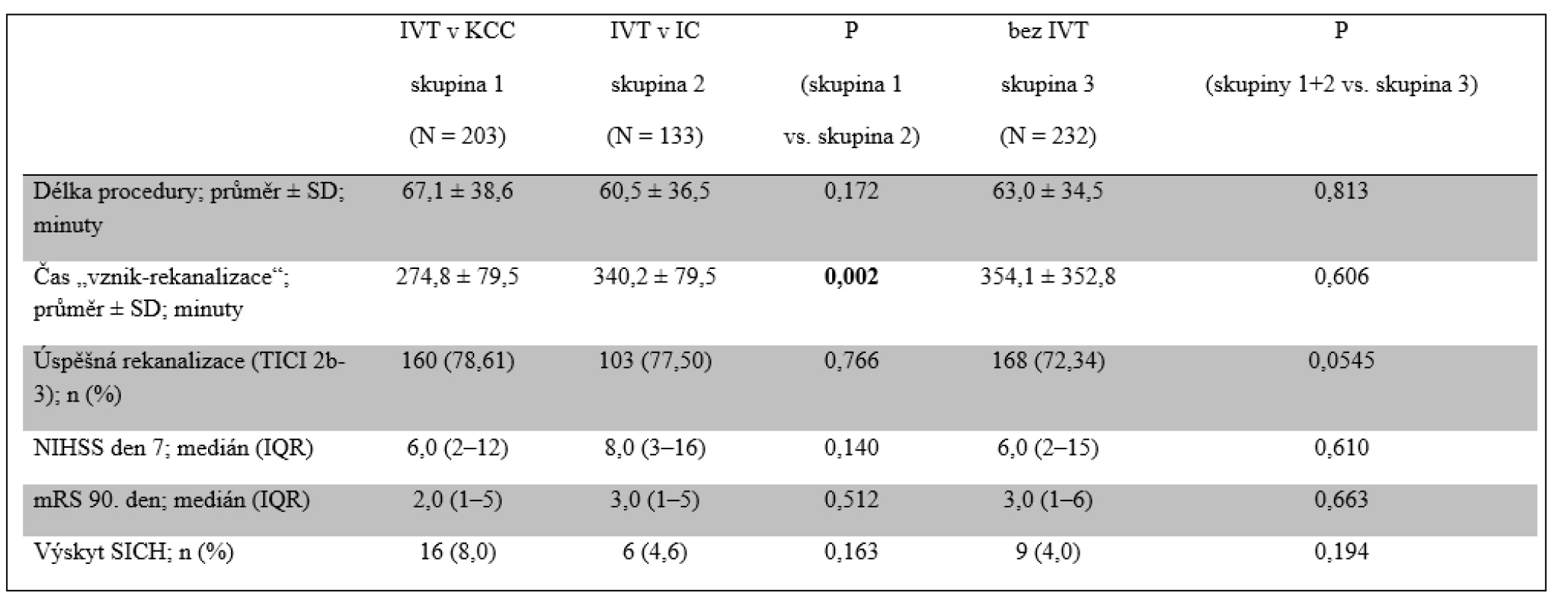

U všech pacientů byla jako jediný nezávislý negativní prediktivní faktor úspěšné rekanalizace prokázána délka procedury EVT (upravené OR 0,985; 95% interval spolehlivosti (CI) 0,976–0,993; p = 0,0002) a u pacientů s okluzí v přední cirkulaci pak navíc DNT pro IVT (upravené OR 0.986; 95% CI: 0,974–0,998, p = 0,027). Nebyl prokázán statisticky signifikantní rozdíl v šanci na dosažení rekanalizace mezi skupinami s rozdílnou lokalizací okluze (tab. 4).
Vysoká glykemie při přijetí a delší DNT byly identifikovány u všech pacientů jako nezávislé prediktory rizika SICH (upravené OR 1,016; 95% CI 1,002–1,029; p = 0,024, resp. upravené OR 1,145; 95% CI 1,018–1,288; p = 0,024).
Vyšší hodnota škály NIHSS, vyšší glykemie, ischemie pravé hemisféry, okluze ACI + ACM a T-typ okluze ACI byly prokázány jako nezávislé negativní prediktivní faktory maligního edému mozku u pacientů s ischémií v přední cirkulaci (tab. 5). Pro ischemie v zadním povodí nebyly nalezeny žádné prediktory maligního edému.
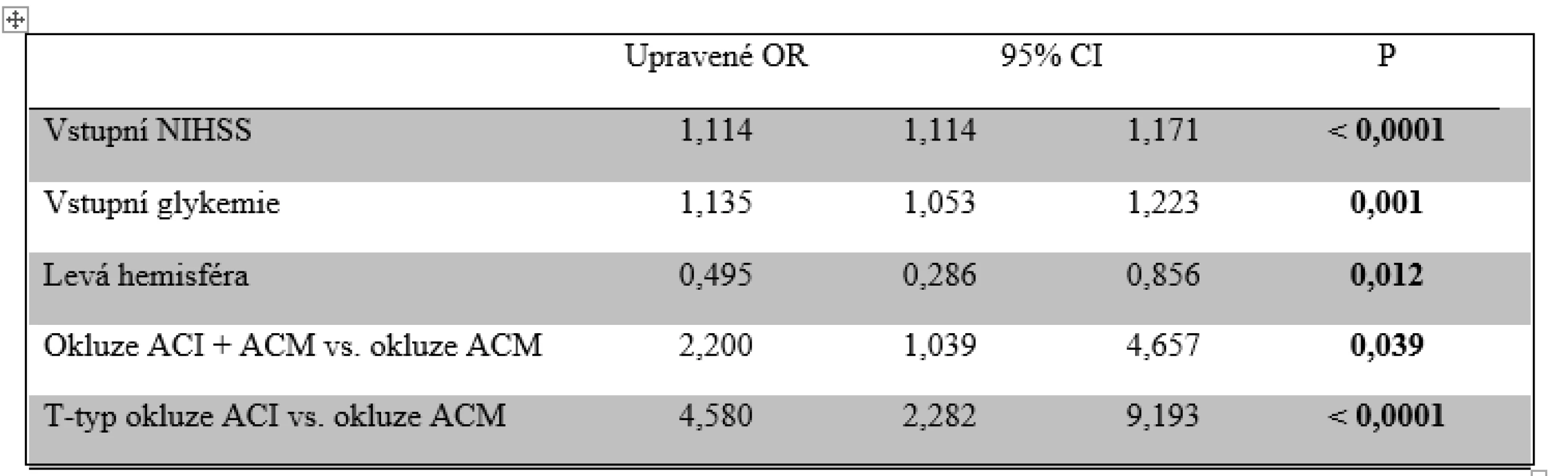
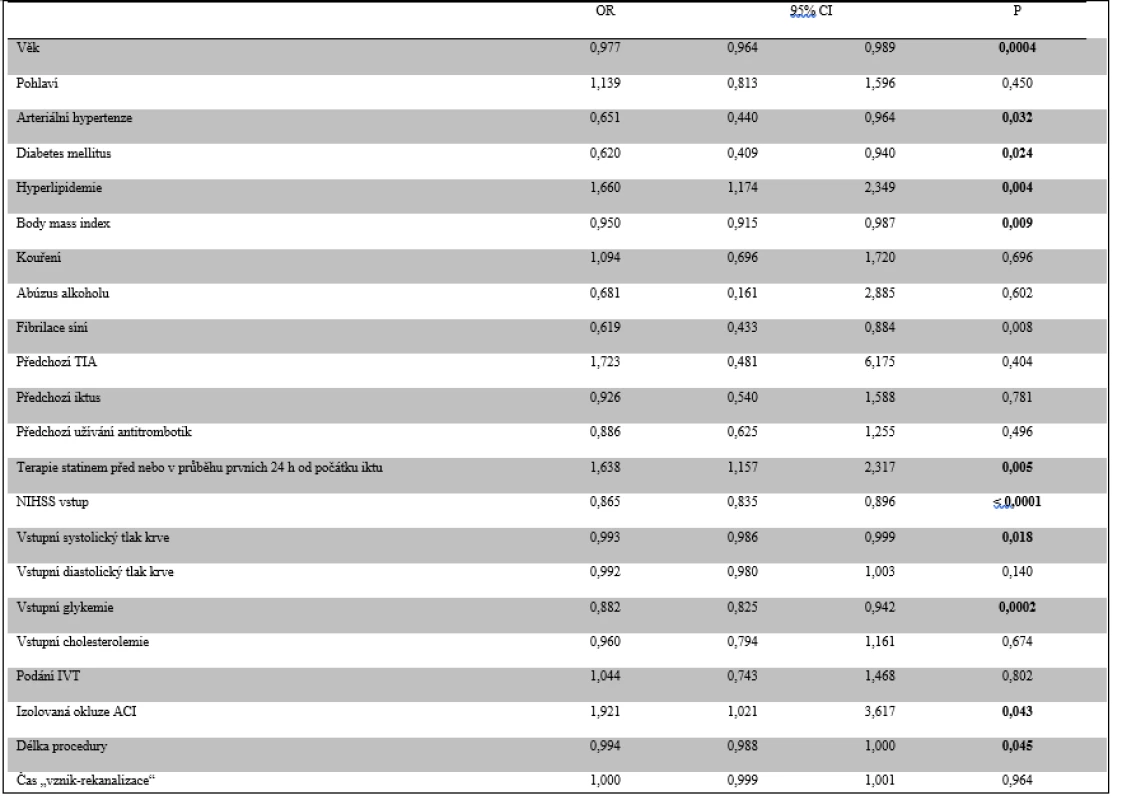
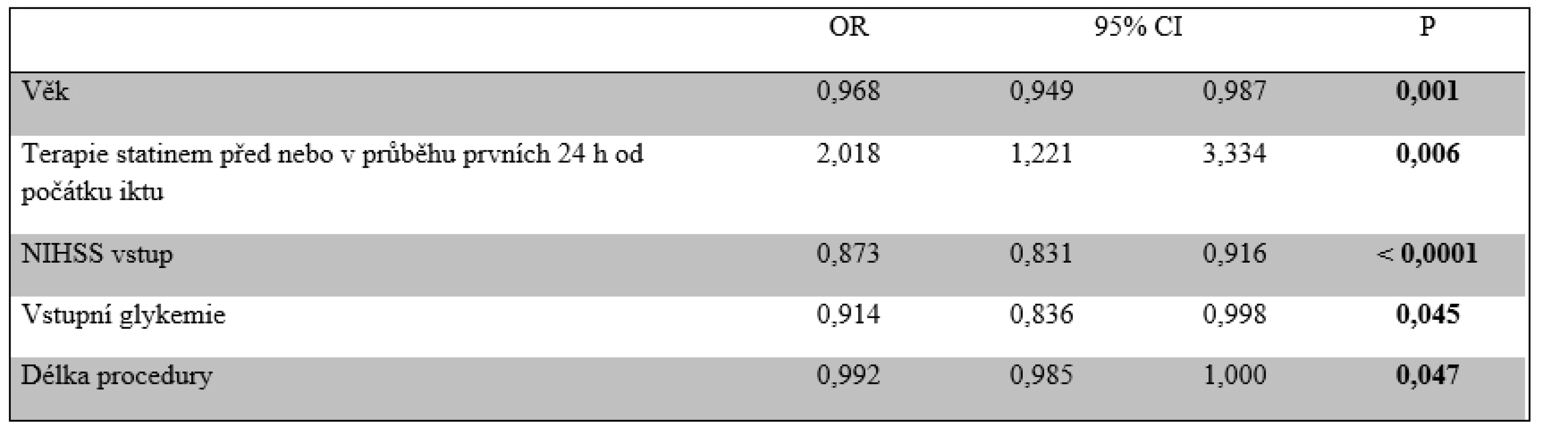
Vyšší věk, anamnéza arteriální hypertenze a diabetu, vstupní NIHSS, hodnota systolického a diastolického tlaku krve, glykemie, BMI a délka procedury EVT byly negativními prediktory dobré klinického výsledku 90. den. Izolovaná okluze ACI, anamnéza hyperlipidemie a užívání statinu se pak projevily jako pozitivní prediktory dobré klinického výsledku 90. den (tab. 6). Z těchto parametrů se pouze vyšší věk, vstupní NIHSS, glykemie a délka procedury EVT ukázaly jako nezávislé negativní prediktory a anamnéza užívání statinu jako nezávislý pozitivní prediktor dosažení dobrého klinického výsledku (tab. 7).
Diskuze
Toto je první studie zabývající se srovnáním dvou možností organizace iktové péče. Pacienti léčeni EVT po selhání IVT přijatí direktně do KCC mají signifikantně kratší čas od vzniku iCMP do zahájení procedury než pacienti léčeni IVT v IC s následným transferem do KCC. Tento rozdíl by nicméně mohl být ještě větší, kdyby intervenční týmy byly dostupné v nemocnici v režimu „24/7“. V současnosti jsou tyto týmy v ČR zejména v době ústavních pohotovostních služeb k dispozici „na zavolání“ [10,11]. Jejich členové jsou kontaktováni až po stanovení diagnózy akutní okluze magistrální mozkové tepny, a proto trvá (v průměru) dalších 40 min, než může být procedura zahájena. Toto zdržení je samozřejmě eliminováno u pacientů transferovaných z IC, neboť tým zpravidla dorazí do nemocnice během transferu pacienta do KCC. V našem souboru proto nebyl rozdíl v klinickém výsledku mezi těmito skupinami signifikantní, byl sledován pouze trend k lepšímu výsledku pacientů léčených přímo v KCC. Zkracování DGT v KCC se proto jeví jako zásadní a mohlo by vést k statisticky signifikantnímu rozdílu, toto však naráží zejména na omezené finanční a lidské zdroje. Nehledě na to však současný dvouúrovňový systém organizace péče v ČR (v případě příkladné organizace) ukazuje, že obě cesty jsou srovnatelné, přinášející u pacientů podobné výsledky v dosahování dobrého klinického výsledku. Nejvhodnější přístup (primární transfer do KCC nebo první vyšetření v IC a následný převoz do KCC) by tak měl být zvolen s ohledem na charakteristiku daného regionu tak, aby terapie IVT neoddálila zahájení EVT a naopak.
Úspěšné rekanalizace (TICI 2b–3) bylo v jednotlivých povodích u pacientů v registru CERBERUS dosaženo v 54,5–78,6 %, s nejnižší úspěšností u okluzí AV+ a nejvyšší u okluzí ACM. Prevalence dosažené reperfuze (TICI 2b–3) v přední cirkulaci dosáhla 74 %, což je obdobné jako u randomizovaných klinických studií (72,4–88,0 %) [2–6] a téměř identické jako v podobném retrospektivním belgickém registru (73 %). Dosažená rekanalizace v zadní cirkulaci byla u pacientů z registru CERBERUS nižší než ta v tomtéž belickém registru (71 vs. 100 %) [12].
Pacienti, kteří podstoupili EVT po selhání IVT, a pacienti kontraindikování k IVT léčení pouze EVT, se nelišili v klinickém výsledku (mRS 0–2 u 46,3 vs. 47,0 %) a SICH (6,5 vs. 4,0 %). Tato čísla jsou podobná jako u srovnatelných skupin subjektů v randomizovaných studiích [2–6].
Výskyt SICH nebyl statisticky významně vyšší u pacientů léčených přímo v KCC a lišil se v jednotlivých teritoriích od 0 % (VA+) do 8,1 % (ACI). V naší studii byl výskyt SICH vyšší v přední cirkulaci (6,2 %) než ve vertebrobazilárním povodí (1,1 %). Tato pozorování jsou odlišná od dat z již jmenované belgické studie (3 vs. 13 %) [12]. Naše pozorování jsou nicméně obdobná, jako referovali Dorňák et al., kteří popsali u pacientů léčených IVT (bez EVT) výskyt ICH v přední cirkulaci u 17,2 % pacientů oproti jen u 5,1 % pacientů s iktem v zadním povodí. Tato zjištění mohou být způsobena: 1. menším objemem ischemických lézí u ischémií v zadní jámě a lepší kolaterální cirkulací ve srovnání s povodím ACM; 2. skutečností, že mozkový kmen je zásoben jen tepnami velmi malého průměru [13].
Vyšší glykemie a delší DNT se v naší studii projevily jeko nezávislé negativní prediktory rizika SICH u všech pacientů. Ve studii, kterou prováděli Nogueira et al, byly jako nezávislé prediktory hemoragické transformace infarktu popsány diabetes mellitus, předchozí podání IVT, trombektomie MERCI retrieverem a delší DGT [14]. Vyšší hodnota ve škále NIHSS, glykemie, iktus v pravostranném povodí, společná okluze ACI + ACM a T-typ okluze ACI pak byly u pacientů v registru CERBERUS identifikovány jako nezávislé negativní prediktory maligního edému mozku. V porovnání pak jen souběžná okluze ACA, tj. při T okluzi ACI, predikovala mortalitu u težkých iktů v přední cirkulaci ve studii Walcotta et al [15]. V naší kohortě pacientů jsme nenalezli žádný prediktor maligního edému v zadní cirkulaci.
V našem pozorování se jako nezávislý negativní prediktor dobrého klinického výsledku projevily vyšší věk, vstupní NIHSS, glykemie a délka procedury EVT a jako nezávislý pozitivní prediktor dobrého klinického výsledku pak anamnéza předchozího užívání statinu. Ozdemir et al. publikovali výsledky, kde se obdobně projevily jako negativní prediktory dobrého klinického výsledku u iktu v přední cirkulaci vyšší věk, glykemie, vyšší skóre ASPECT a delší čas od vzniku do rekanalizace [16]. Nálezy z registru jsou konzistentní také s našimi předchozími pozorováními ze studie s ikty v zadní cirkulaci při okluzi AB, kde byly také vyšší hodnoty ve škále NIHSS v okamžiku zahájení léčby, delší čas do zahájení terapie a anamnéza arteriální hypertenze potvrzeny jako nezávislé negativní prediktory dobrého klinického výsledku [17]. Rovněž vyšší skóre ASPECT pro zadní cirkulaci [18], vyšší věk, tíže iktu a anamnéza diabetu, byly negativními prediktory dobrého klinického výsledku u ischémií v zadní cirkulaci [19].
Podíl pacientů s výsledným mRS 0–2 byl 33,3–65,0 %, přičemž nejnižší byl u okluzí AV+ a nejvyšší u izolovaných okluzí sifonu ACI. V registru CERBERUS dosáhlo dobrého klinického výsledku celkově 47,7 % pacientů, zatímco v randomizovaných klinických studiích to bylo: 32 % v MR CLEAN [3], 44 % v REVASCAT [4], 53 % v ESCAPE [5] a 60 % v SWIFT PRIME [6]. Byli zařazováni jen pacienti s okluzí velké mozkové tepny, ale selekce na podkladě perfuzního CT skenu (CTP) nebyla v centrech registru CERBERUS rutinně používána. Proto jsou výsledky téměř identické se studiemi, kde také nebyly užity žadné perfuzní metody [3,12]. Ve studii EXTEND-IA, kde CTA/CTP byly užity pro selekci pacientů standardně, bylo dosaženo vyšší prevalence dobrého klinického výsledku (71 %) [2].
Naše studie má několik hlavních limitací. Zaprvé nebyla sledována žádná kontrolní skupina, takže efekt EVT oproti IVT samotné nemohl být posouzen. Zadruhé, vzhledem k použítí individuálních protokolů pro EVT v jednotlivých centrech, nemohl být zcela vyloučen selekční bias. Zatřetí nebyly použity žádný jednotný, na zobrazovacích metodách založený, selekční systém a zaslepené hodnocení stupně rekanalizace. Začtvrté nebylo provedeno kontrolní CT vyšetření bezprostředně před zahájením EVT u pacientů, kteří byli transferováni z IC do KCC. Zapáté všechna data byla sice sbírána prospektivně, ale údaje některých prediktivních proměnných mohly zůstat opomenuty. Zašesté nebyla prováděna žádná centralizovaná evaluace rekanalizace ani klinického výsledku. Konečně v časných začátcích EVT byly v zakládajícím centru registru CERBERUS (Ostrava) užívány různé rekanalizační metody nebo jejich kombinace (zejména perkutánní transluminální angioplastika s/bez použití stentu), nicméně výsledky byly plně srovnatelné s klinickými studiemi používajícími výhradně stent-retrievery [20].
Naše studie má také silné stránky. Jednalo se o multicentrické hodnoceni klinické praxe s EVT, které přineslo podobné výsledky jako velké randomizované klinické studie. Proto může být EVT označena u vybraných pacientů jako účinná a bezpečná i v rutinní klinické praxi. Protože byli zařazováni jen pacienti po selhání IVT, nebo ti, kteří byli k IVT kontraindikováni, bylo minimalizováno zavzetí pacientů, kteří by dosáhli dobrého výsledku po samotné IVT (což by mohlo výsledky ovlivnit).
Závěr
Prokázali jsme, že EVT je účinná a bezpečná. Může být rutinně používána u vybraných pacientů s akutní ischemickou cévní mozkovou příhodou spojenou s okluzí magistrální mozkové tepny a zejména u těch, u nichž IVT selhala nebo k ní byli kontraindikováni. Benefit přímého přijetí pacienta do KCC si zaslouží další sledování. Trend k lepšímu klinickému výsledku pozorovaný u pacientů vezených přímo do KCC však naznačuje, že terapie by měla být vedena ve specializovaných centrech s dostupností všech léčebných metod. Volba vhodné strategie může být nicméně v jednotlivých regionech odlišná, závisející na počtu jednotlivých IC a KCC v dané oblasti a jejich vzájemné vdálenosti. Prezentovaná studie prokázala, že obě varianty organizace transportu pacienta s iCMP k EVT v ČR jsou srovnatelně efektivní a bezpečné.
*CERBERUS Study Group: Martin Kuliha, Michal Bar (Comprehensive Stroke Center, Department of Neurology, Faculty of Medicine, Ostrava University and University Hospital Ostrava, Czech Republic), Václav Procházka, Tomáš Jonszta, Daniel Czerný, Jan Krajča (Comprehensive Stroke Center, Department of Radiology, University Hospital Ostrava, Czech Republic), Eva Vítková, Jan Waishaupt (Comprehensive Stroke Center, Department of Neurology, Charles University Faculty of Medicine and University Hospital Hradec Králové, Czech Republic), Antonín Krajina, Miroslav Lojík, Jan Raupach, Ondřej Renc, Vendelín Chovanec (Comprehensive Stroke Center, Department of Radiology, Charles University Faculty of Medicine and University Hospital Hradec Králové, Czech Republic), Jiří Polívka, Petr Ševčík, Vladimir Rohan (Comprehensive Stroke Center, Department of Neurology, Faculty of Medicine Charles University and University Hospital Plzeň, Czech Republic), Vladimir Přibáň, Jan Mraček (Comprehensive Stroke Center, Department of Neurosurgery, Faculty of Medicine Charles University and University Hospital Plzeň, Czech Republic), Frantisek Šlauf, Vít Buriánek, Petr Duras (Comprehensive Stroke Center, Department of Radiology, Faculty of Medicine Charles University and University Hospital Plzeň, Czech Republic), Ivana Šarbochová, Aleš Tomek (Comprehensive Stroke Center, Department of Neurology, Faculty of Medicine Charles University and University Hospital Motol, Praha, Czech Republic), Miloslav Roček, Radek Pádr, Michal Polovinčák (Comprehensive Stroke Center, Department of Radiology, Faculty of Medicine Charles University and University Hospital Motol, Praha, Czech Republic), Daniel Václavík, Michal Kusyn (Stroke Center, Department of Neurology, Vítkovice Hospital, Ostrava, Czech Republic), Dušan Kučera (Stroke Center, Vascular Department, Vítkovice Hospital, Ostrava, Czech Republic), Jaroslav Krátký (Stroke Center, Department of Radiology, Vítkovice Hospital, Ostrava, Czech Republic), Roman Havlíček (Comprehensive Stroke Center, Department of Neurology, Military University Hospital, Prague, Czech Republic), Kateřina Langová (Department of Biophysics, Faculty of Medicine and Dentistry, Institute of Molecular and Translation - al Medicine, Palacký University Olomouc, Olomouc, Czech Republic).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Prof. David Školoudík, MD, PhD, FESO
Center for Research and Science Department of Nursing
Faculty of Health Science Palacký University Olomouc
Hněvotínská 3,
775 15 Olomouc
Czech Republic
e-mail: skoloudik@hotmail.com
Sources
1. Hacke W, Kaste M, Bluhmki E, et al. ECASS Investigators. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008;359(13):1317 – 29. doi: 10.1056/ NEJMoa0804656.
2. Campbell BC, Mitchell PJ, Kleinig TJ, et al. EXTEND-IAInvestigators. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl JMed 2015;372(11):1009 – 18. doi: 10.1056/ NEJMoa1414792.
3. Berkhemer OA, Fransen PS, Beumer D, et al. MR CLEAN Investigators. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med 2015; 372(1):11-20. doi: 10.1056/ NEJMoa1411587.
4. Jovin TG, Chamorro A, Cobo E, et al. REVASCAT Trial Investigators. Thrombectomy within 8 hours after symptom onset in ischemic stroke. N Engl J Med 2015; 372(24):2296 – 306. doi: 10.1056/ NEJMoa1503780.
5. Goyal M, Demchuk AM, Menon BK, et al. ESCAPE Trial Investigators. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015;372(11):1019 – 30. doi: 10.1056/ NEJMoa1414905.
6. Saver JL, Goyal M, Bonafe A, et al. SWIFT PRIME Investigators. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. N Engl J Med 2015;372(24):2285 – 95. doi: 10.1056/ NEJMoa1415061.
7. Wahlgren N, Moreira T, Michel P, et al. Mechnical thrombectomy in avute ischemic Stroke: Consensus statement by ESO-Karolinska Update 2014/ 2015, supported by ESO, ESMINT, ESNR amd EAN. Int J Stroke 2016;11(1):134 – 47. doi: 10.1177/ 1747493015609778.
8. Powers WJ, Derdeyn CP, Biller J, et al. AmericanHeart Association Stroke Council. 2015 American Heart Association/ American Stroke Association FocusedUpdate of the 2013. Guidelines for the Early Manage-ment of Patients With Acute Ischemic Stroke Regarding Endovascular Treatment: A Guideline for Healthcare Professionals From the American Heart Association/ American Stroke Association. Stroke 2015 Oct; 46(10):3020 – 35. doi: 10.1161/ STR.0000000000000074.
9. Šaňák D, Neumann J, Tomek A, et al. Doporučení pro rekanalizační léčbu akutního mozkového infarktu – verze 2016. Cesk Slov Neurol N 2016; 79/ 112(2):231 – 4. doi: 10.14735/ amcsnn2016231.
10. Věstník Ministerstva zdravotnictví České republiky 3/ 2012. Prague: Ministry of Health of the Czech Republic 2012.
11. Škoda O, Herzig R, Mikulík R, et al. Clinical Guideline for the Diagnostics and Treatment of Patients with Ischemic Stroke and Transitory Ischemic Attack – Version 2016. Cesk Slov Neurol N 2016; 79/ 112(3): 351 – 363. doi: 10.14735/ amcsnn2016351.
12. Fockaert N, Coninckx M, Heye S, et al. Mechanical endo-vascular thrombectomy for acute ischemic stroke: a retro-spective multicenter study in Belgium. Acta Neurol Belg 2016;116(1):7 – 14. doi: 10.1007/ s13760-015-0552-7.
13. Dorňák T, Král M, Hazlinger M, et al. Posterior vs. anterior circulation infarction: demography, outcomes, and frequency of hemorrhage after thrombolysis. Int J Stroke 2015;10(8):1224 – 8. doi: 10.1111/ ijs.12626.
14. Nogueira RG, Gupta R, Jovin TG, et al. Predictors and clinical relevance of hemorrhagic transformation after endovascular therapy for anterior circulation large vessel occlusion strokes: a multicenter retrospective analysis of 1122 patients. J Neurointerv Surg 2015;7(1):16 – 21. doi: 10.1136/ neurintsurg-2013-010743.
15. Walcott BP, Miller JC, Kwon CS, et al. Outcomes in severe middle cerebral artery ischemic stroke. Neurocrit Care 2014;21(1):20 – 6. doi: 10.1007/ s12028-013-9838-x.
16. Ozdemir O, Giray S, Arlier Z, et al. Predictors of a good outcome after endovascular stroke treatment with stent retrievers. Scientific World Journal 2015; 2015 : 403726. doi: 10.1155/ 2015/ 403726.
17. Dorňák T, Herzig R, Kuliha M, et al. Endovascular -treatment of acute basilar artery occlusion: time-to-treatment is crucial. Clin Radiol 2015; 70(5):e20 – 7. doi: 10.1016/ j.crad.2015.01.008.
18. Yoon W, Kim SK, Heo TW, et al. Predictors of goodoutcome after stent-retriever thrombectomy in acutebasilar artery occlusion. Stroke 2015;46(10):2972 – 5. doi: 10.1161/ STROKEAHA.115.010840.
19. Dorňák T, Herzig R, Školoudík D, et al. Outcome predictors in acute basilar artery occlusion. Can JNeurol Sci 2014;41(3):368 – 74. doi: 10.1017/ S0317167100017327.
20. Roubec M, Kuliha M, Procházka V, et al. A controlled trial of revascularization in acute stroke. Radiology 2013;266(3):871 – 8. doi: 10.1148/ radiol.12120798.
Labels
Paediatric neurology Physiotherapist, university degree Neurosurgery Neurology Rehabilitation Pain managementArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 6
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine Eases Daily Life for Patients and Caregivers
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
-
All articles in this issue
- Využití ultrazvuku pro navigaci v neurochirurgii
- H-reflex – jeho role v neurofyziologii a klinice
- Moderní techniky MR zobrazení u roztroušené sklerózy
- Případ časné neurosyfilis s neurokognitivní poruchou
- Periferní paréza lícního nervu vázaná na cestování letadlem
- AMETYST – výsledky observační studie fáze IV sledující účinky intramuskulárně podávaného interferonu beta-1a u pacientů s klinicky izolovaným syndromem/ klinicky definitivní roztroušenou sklerózou
- Hodnocení životní spokojenosti u pacientů s klinicky izolovaným syndromem
- Krátký test slovní paměti pomocí věty u Alzheimerovy nemoci
- Kdy operovat zlomeniny spánkové kosti?
- Cievne nehemoragické komplikácie hlbokej mozgovej stimulácie
- Účinky robotické rehabilitace chůze na psychosomatické indikátory u osob s různou etiologií lehké mentální retardace
- Prediktory pozitivního léčebného výsledku u pacientů s akutní cévní mozkovou příhodou podstupujících endovaskulární léčbu - výsledky z registru CERBERUS
- Kvantitativní analýza MRI textury pro rozlišení enhancujících a neenhancujících T1 hypointenzních lézí bez podání kontrastní látky u roztroušené sklerózy
- Syndrom reverzibilní mozkové vazokonstrikce
- Závažný serotoninový syndrom
- Předávkování baklofenem a klonazepamem u pacienta s chronickou bolestí krční páteře a ramen
- Nová mutace v genu GIGYF2 u pacienta s Parkinsonovou chorobou
- Stereotaktická biopsie mozku pomocí bezrámové navigace – výhody, omezení a technické tipy
- Dermatomyositis – úvodní projev pokročilého stadia primárního karcinomu ovaria z prstenčitých buněk
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Krátký test slovní paměti pomocí věty u Alzheimerovy nemoci
- Moderní techniky MR zobrazení u roztroušené sklerózy
- H-reflex – jeho role v neurofyziologii a klinice
- Kdy operovat zlomeniny spánkové kosti?
