Syndrom GLUT-1 deficience – expandující klinické spektrum léčitelného onemocnění
Glucose transporter-1 deficiency syndrome – expanding the clinical spectrum of a treatable disorder
Glucose transporter-1 deficiency syndrome (GLUT1DS) is a relatively rare form of treatable epileptic encephalopathy caused by impaired glucose transport across the blood-brain barrier associated with the mutation in the SLC2A1 gene. The disorder has a very variable phenotype. The phenotypic spectrum of GLUT1DS is now known to be a continuum that includes the classic phenotype as well as dystonia 9 and 18, atypical childhood absence epilepsy, myoclonic astatic epilepsy, and paroxysmal non-epileptic abnormalities of movement such as intermittent ataxia, choreoathetosis, dystonia, and alternating hemiplegia. The classic phenotype is characterized by pharmacoresistant infantile-onset seizures, delayed neurologic development, and acquired microcephaly. Non-classical phenotype is characterised by complex movement disorder without epilepsy (hypotonia, spasticity, ataxia and dystonia). Adult form with mild symptoms rarely occurs. In suspicion of GLUT1DS, the lumbar puncture should be provided. The disease hallmark is hypoglycorrhachia in association with normoglycemia. The CSF/ blood glucose ratio is typically less than 0.4. Final confirmation of the diagnosis is the detection of the mutation in the SLC2A1 gene. GLUT1DS is treatable disorder. Ketogenic diet is the treatment of choice. Early diagnosis is crucial, because treatment with the ketogenic diet dramatically improves the symptoms and may also improve the long-term outcome of the patients.
Key words:
GLUT-1 deficiency syndrome – pharmacoresistant epilepsy – SLC2A1 gene – ketogenic diet – spectrum of the phenotype
Authors:
Š. Aulická; K. Česká; H. Ošlejšková
Authors‘ workplace:
Klinika dětské neurologie LF MU a FN Brno, Centrum pro epilepsie, Brno
Published in:
Cesk Slov Neurol N 2018; 81(2): 171-173
Category:
Review Article
doi:
https://doi.org/10.14735/amcsnn2018171
Overview
Syndrom GLUT-1 deficience (Glucose transporter-1 deficiency syndrome; GLUT1DS) je relativně vzácná forma léčitelné epileptické encefalopatie způsobené poruchou transportu glukózy přes hematoencefalickou bariéru do mozku, která vzniká na podkladě mutace v SLC2A1 genu. Onemocnění má velmi variabilní fenotyp. Fenotypické spektrum je nyní považováno za kontinuum, do kterého zahrnujeme klasický fenotyp, dystonii typu 9 a 18, atypické dětské absence, myoklonicko-astatickou epilepsii a paroxyzmální neepileptické poruchy hybnosti (jako je například intermitentní ataxie, choreoatetóza, dystonie, alternující hemiplegie). V klasickém případě k manifestaci dochází v kojeneckém období. Typické jsou farmakorezistentní záchvaty, mírné až těžké opoždění psychomotorického vývinu a získaná mikrocefalie. Byl definován i tzv. neklasický fenotyp, pro který je typické opoždění psychomotorického vývinu a komplexní pohybové poruchy bez epilepsie (hypotonie, spasticita, ataxie a dystonie). Výjimečně se vyskytuje adultní forma s minimálními příznaky. Při podezření na syndrom GLUT1DS je klíčové provedení lumbální punkce nalačno, kde v typickém případě nalezneme hypoglykorachii při absenci hypoglykemie v kombinaci s normální nebo nízkou hladinou laktátu. Poměr glykorachie/ glykemie je typicky nižší než 0,4. Definitivním potvrzením diagnózy je průkaz mutace v SLC2A1 genu. Syndrom GLUT1DS je léčitelné onemocnění. Léčbou volby je ketogenní dieta. Časná diagnostika GLUT1DS je rozhodující, protože ketogenní dieta dramaticky zlepšuje symptomy onemocnění a dlouhodobou prognózu pacientů.
Klíčová slova:
syndrom GLUT-1 deficience – farmakorezistentní epilepsie – SLC2A1 gen – ketogenní dieta – fenotypové spektrum
Úvod
Glukóza je esenciální substrát energetického metabolizmu pro mozek. V klidovém stadiu spotřebuje mozek u dospělého člověka 25 % celkového příjmu glukózy, zatímco u kojenců a malých dětí to může být až 80 %. Transport glukózy přes hematoencefalickou bariéru je zabezpečen glukózovým transportérem typu 1 (GLUT-1). V mozku tento transportér interaguje s dalšími specifickými izoformami GLUT, které zprostředkují transport glukózy do astrocytů a neuronů [1]. Syndrom deficience GLUT-1 (Glucose transporter-1 deficiency syndrome; GLUT1DS) na podkladě poruchy energetického metabolizmu mozku způsobené insuficiencí GLUT, který zabezpečuje transfer glukózy do mozku na úrovni hematoencefalické bariéry – výsledkem čehož je hypoglykorachie. GLUT1DS poprvé popsal de Vivo v roce 1991 jako časnou epileptickou encefalopatii v dětství (uvádí případ dvou dětí s refrakterními infantilními záchvaty, psychomotorickou retardací (PMR) a získanou mikrocefalií s dobrou odpovědí na ketogenní dietu) [2].
Klinický obraz
Byly rozpoznány 3 odlišné klinické fenotypy onemocnění:
- Klasický fenotyp (84 % pacientů), který lze dále rozdělit na klasický fenotyp s časným počátkem (do 2 let věku; 65 % pacientů) a klasický fenotyp s pozdějším počátkem (po 2. roce života; 19 % pacientů). Typický je rozvoj farmakorezistentní epilepsie, opoždění psychomotorického vývinu, dále získaná mikrocefalie, hypotonie, spasticita a komplexní pohybové poruchy (zejména ataxie a dystonie). V novorozeneckém věku jsou první známkou onemocnění mimovolní nepravidelné rychlé pohyby bulbů různými směry, které doprovází stejnosměrný pohyb hlavou. Jednotlivé pohyby v trvání průměrně 2 s jsou zřetelně odlišeny tzv. fixačním intervalem v trvání 200–800 ms. Tyto paroxyzmální pohyby bulbů a hlavy jsou specifickým diagnostickým symptomem onemocnění a vyskytují se jako první symptom GLUT1DS u 38 % pacientů. Mohou imitovat opsoklonus. Diferenciálně diagnosticky odlišíme od opsoklonu přítomností stejnosměrného pohybu hlavou a fixačního intervalu [3].
Záchvaty začínají u 90 % pacientů před 2. rokem života, jen u 10 % pacientů později. Typicky se objevují po delším lačnění, v ranních hodinách a ke zlepšení naopak dochází po jídle. Snížení frekvence záchvatů nastává také při infekčních onemocněních. Mohou se vyskytnout záchvaty generalizované tonické nebo klonické, myoklonické, fokální, atonické, atypické absence. Frekvence, závažnost a typ záchvatu varíruje u jednotlivých pacientů. Záchvaty jsou zpočátku krátké subtilní myoklonie končetin s alternujícím zárazem v činnosti a stáčením očí, může být přítomen „head nodding“ (přikyvování hlavou). V pozdějším období se často přidávají generalizované tonicko-klonické záchvaty a myoklonické záchvaty. GLUT1DS je příčinou až 10 % dětských absencí s časným počátkem (před 4. rokem života) a 5 % myoklonicko-astatických epilepsií [4].
Pro klasický syndrom dětských absencí je typický rozvoj záchvatů mezi 4. a 10. rokem života u jinak zdravých dětí. Pacienti s časným počátkem dětských absencí (před 4. rokem života) mají komplexnější fenotyp, který zahrnuje další typy záchvatů, extrapyramidové poruchy a kognitivní poruchy. Ukazuje se, že absence s časným počátkem tvoří prominentní typ záchvatu u GLUT1DS, resp. 10 % absencí s časným počátkem je způsobeno GLUT1DS [4]. Zřídka jsou popsány v literatuře myoklonické absence s vazbou na mutaci R126C v SLC2A1 genu [5].
Stupeň kognitivního poškození se pohybuje v rozmezí od poruch učení až po těžkou mentální retardaci. Byla popsána korelace stupně mentální retardace s typem mutace. Mírná forma mentální retardace byla prokázána u 79 % pacientů s missence mutací a jen u 26 % pacientů s jinými typy mutací (frame shift, splice site, delece) [6].
Komplexní pohybové poruchy (chorea, ataxie, dystonie) se vyskytují u 69 % pacientů s časným klasickým fenotypem a 90 % pacientů s pozdním klasickým fenotypem GLUT1DS [6].
- „Neklasický“ fenotyp (15 % pacientů), pro který jsou typické mentální retardace a komplexní pohybové poruchy. Epilepsie není přítomna. Mikrocefalie se vyskytuje u 50 % pacientů. Komplexní pohybové poruchy (typicky dystonie, ataxie a chorea) mohou být přítomny v různých kombinacích a mohou být kontinuální, paroxyzmální nebo kontinuální s paroxyzmálním zhoršováním, nejčastěji vázaným na hladovění a/ nebo cvičení. Typ mutace koreluje také s výskytem abnormních pohybových poruch (nejméně frekventované jsou u missence mutace). Ke zmírnění příznaků dojde zpravidla po zahájení ketogenní diety [6].
- Adultní forma s minimálními příznaky (1 % pacientů) – zřídkavá forma tohoto onemocnění, psychomotorický vývoj je normální, ostatní neurologické příznaky jsou minimální. Je popsán případ pacientky, u které se onemocnění manifestovalo izolovaným epileptickým záchvatem ve 2 letech věku po prolongovaném hladovění bez další klinické manifestace onemocnění [6].
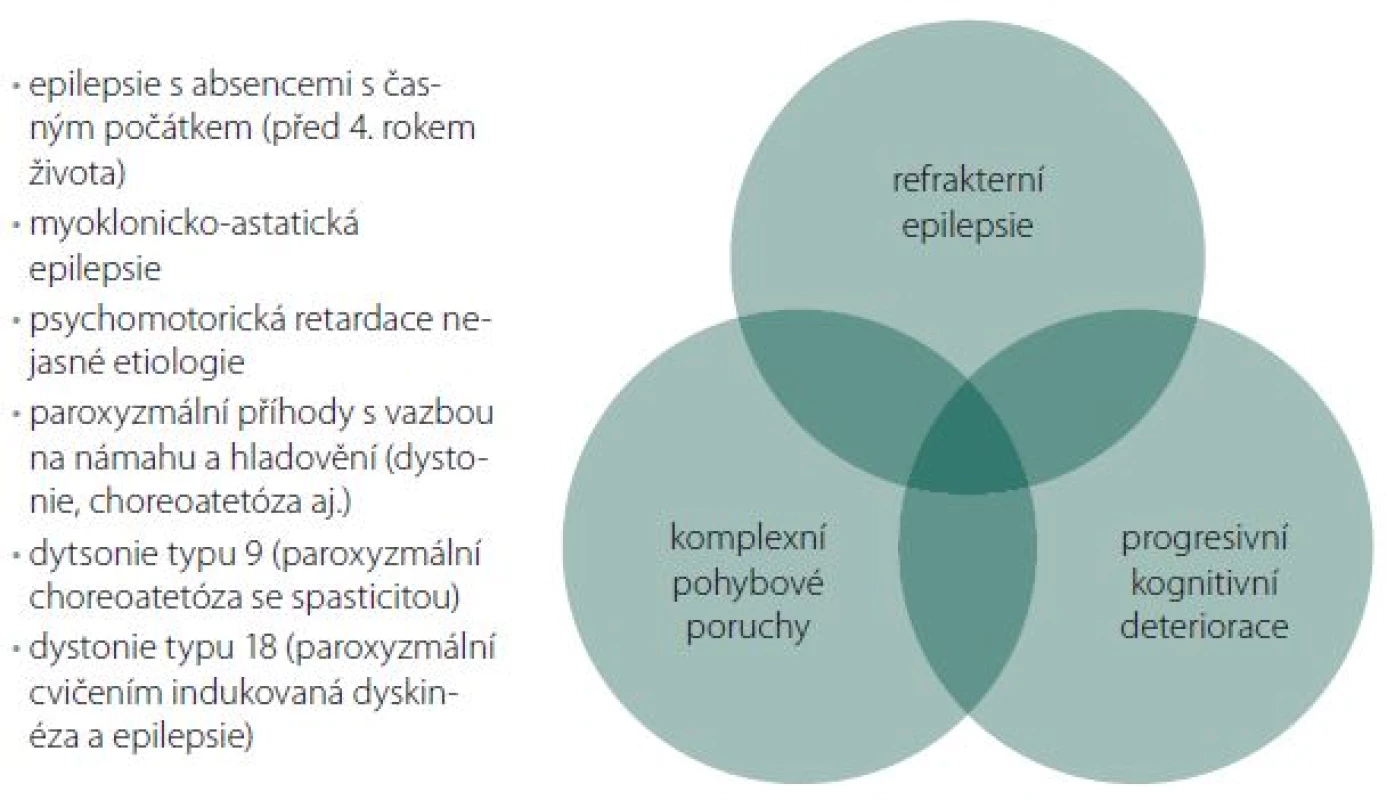
Shrnutí možné klinické manifestace GLUT1DS
- refrakterní dětské epilepsie
- epilepsie s absencemi s časným počátkem (před 4. rokem života)
- myoklonicko-astatické epilepsie
- PMR nejasné etiologie
- komplexní pohybové poruchy
- paroxyzmální pohyby s vazbou na námahu a hladovění (dystonie, choreoatetóza aj.)
Bylo popsáno několik klinických jednotek známých pod jinými názvy, které jsou v současnosti zařazeny dle etiopatogeneze pod jednotku GLUT1DS. Patří sem např. dystonie typu 9 (paroxyzmální choreoatetóza se spasticitou) a dystonie typu 18 (paroxyzmální, cvičením indukovaná dyskinéza a epilepsie). Fenotypické spektrum pacientů s GLUT1DS je tedy mnohem širší, než se původně předpokládalo [6].
Diagnostika
Charakteristickým diagnostickým znakem onemocnění je přítomnost hypoglykorachie (glykorachie pod 2,2 mmol/ l) při normoglykemii, přičemž poměř glykorachie/ glykemie je nižší než 0,4. Hladina laktátu v likvoru je normální nebo snížená. Zvýšená hladina laktátu v mozkomíšním moku diagnózu GLUT1DS vylučuje. Počet buněk v likvoru a proteinorachie jsou v normě. Lumbální punkci provádíme po 4–6 h hladovění. Doporučuje se provádět odběr v analgosedaci jako prevenci stresové hyperglykemie, která by mohla znamenat falešně negativní výsledek [7]. Likvor neodebíráme z ventrikuloperitoneálního shuntu, protože vlivem stázy likvoru je zde často přítomna hypoglykorachie (riziko falešně pozitivního výsledku). V případě nejasností lumbální punkci opakujeme. U mírných forem GLUT1DS, u epilepsie s absencemi s časným počátkem a u paroxyzmální dystonie je glykorachie normální.
Definitivním potvrzením diagnózy je průkaz mutace v SLC2A1 genu. Ve většině případů se jedná o autozomálně dominantní dědičnost. U 90 % pacientů je přítomna heterozygotní mutace de novo. Ve familiárních případech je dědičnost autozomálně dominantní s kompletní penetrací. Dosud bylo popsáno více než 60 různých typů mutací tohoto genu [6]. Velmi zřídka se může vyskytnout autozomálně recesivní dědičnost. Novinkou je mutace R126C v SLC2A1 genu s vazbou na myoklonické absence [5].
Pokud není nalezena mutace v SLCN2A1 genu a trvá podezření na GLUT1S, provádí se test na vychytávání 3-O-metyl-D-glukózy v erytrocytech. Jedná se o funkční měření transportu glukózy přes membránu erytrocytů. Test se provádí spíše experimentálně a má nízkou senzitivitu (35–74 %) [6,8].
Novinkou je analýza exprese GLUT1 na povrchu cirkulujících erytrocytů pomocí průtokové cytometrie (flow cytometry). Jedná se o rychlý, minimálně invazivní diagnostický test pro časnou detekci GLUT1DS. K vyšetření je potřebné odebrat minimálně 0,5 ml nesrážlivé krve do zkumavky EDTA (zkumavka s přídavkem antikoagulačního činidla). Výsledky analýzy jsou dostupné do 24 h a při opakovaných měřeních jsou konzistentní [9].
K pomocným diagnostickým metodám patří EEG, které při hladovění vykazuje vyšší abnormitu v porovnání s EEG po jídle. MR mozku provádíme zejména v rámci diferenciální diagnostiky. U většiny pacientů nacházíme normální nález, zřídka jsou přítomny rozšíření zevních likvorových prostor nebo difuzní mozková atrofie. PET mozku se provádí minimálně kvůli vysoké radiační zátěži. Typické je globální snížení vychytávání glukózy s maximem v meziotemporálních oblastech a talamech [8].
Terapie
Léčbou volby je ketogenní dieta. Principem ketogenní diety je dodání téměř 90 % energetického příjmu ve formě tuků. Dieta se skládá z vysokého množství tuků (obsahujících zejména dlouhé řetězce saturovaných triglyceridů) a nízkého množství proteinů a sacharidů. Podíl tuků vůči proteinům se sacharidy je podle typu diety 3 : 1 nebo 4 : 1. Ketolátky využívají jiný transportní mechanizmus přes hematoencefalickou bariéru a představují tak náhradní zdroj energie pro mozek. Čím dříve je ketogenní dieta u GLUT1DS zahájena, tím lze očekávat lepší prognózu a kvalitu života u pacientů [10].
Podpůrná/ alternativní terapie [10,7]
- Kyselina α-lipoová (využívána zejména v léčbě diabetické neuropatie) – antioxidant, koenzym energetického metabolizmu, neutralizuje volné radikály, zlepšuje vstup glukózy do buňky.
- Triheptanoin – triglycerid, který vede k produkci ketolátek s pěti atomy uhlíku, jež lehce pronikají přes hematoencefalickou bariéru, čímž tvoří alternativní energii pro mozek.
- Acetazolamid (inhibitor karbonanhydrázy) – diuretikum, výborná odpověď u pacientů s paroxyzmální, cvičením indukovanou dystonií.
Závěr
Cílem tohoto sdělení je upozornit na široké fenotypové spektrum GLUT1DS. Aktuálně je toto onemocnění považováno za kontinuum, které zahrnuje jednotky s minimální klinickými projevy až po těžké encefalopatie. Až u 15 % pacientů není přítomna epilepsie (neklasický fenotyp). Onemocnění se může zřídka manifestovat až v dospělém věku [6]. Při podezření na GLUT1DS je základním diagnostickým krokem provést lumbální punkci s průkazem hypoglykorachie v likvoru při poměru glykorachie/ glykemie nižším než 0,4. Definitivním potvrzením diagnózy je průkaz mutace v SLC2A1 genu. U mírných forem GLUT1DS, u absencí s časným počátkem a u paroxyzmální dystonie je glykorachie normální a jediným způsobem, jak potvrdit diagnózu, je provedení genetického vyšetření. Novou perspektivní metodou k časné detekci GLUT1DS je analýza exprese GLUT-1 na povrchu cirkulujících erytrocytů pomocí průtokové cytometrie (flow cytometry). Tato metoda detekuje GLUT1DS bez ohledu na věk, závažnost, fenotypovou variabilitu onemocnění a glykorachii (umožňuje detekci GLUT1DS i u pacientů s glykorachií nad 2,2 mmol/ l). Předpokládá se, že tato rychlá a minimálně invazivní metoda se stane běžně dostupnou skríningovou metodou k časné detekci GLUT1DS v klinické praxi [9].
Časné rozpoznání GLUT1DS je rozhodující, protože se jedná o léčitelné onemocnění. Ketogenní dieta vede ke zlepšení záchvatů u 86 % pacientů s klasickým fenotypem a redukuje mimovolní pohyby u 48 % pacientů s klasickým fenotypem a 71 % pacientů s atypickým fenotypem [6]. V ČR zůstává toto onemocnění nadále poddiagnostikováno.
Tento projekt byl podpořen grantem LF MU Brno – ROZV/ 25/ LF/ 2017.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 16. 11. 2017
Přijato do tisku: 12. 2. 2018
MUDr. Štefánia Aulická, Ph.D.
Klinika dětské neurologie LF MU a FN Brno
Centrum pro epilepsie
Černopolní 9
613 00 Brno
e-mail: stefania.aulicka@gmail.com
Sources
1. Vannuci SJ, Maher F, Simpson IA. Glucose transporter protein in brain: delivery of glucose to neurons and glia. Glia 1997; 21(1): 2–21.
2. Tzadok M, Nissenkorn A, Porper K et al. The many faces of Glut1 deficiency syndrome. J Child Neurol 2014; 29(3): 349–359. doi: 10.1177/ 0883073812471718.
3. Pearson T, Pons R, Engelstad K et al. Paroxysmal eye-head movements in GLUT1-deficiency syndrome. Neurology 2017; 88(17): 1666–1673. doi: 10.1212/ WNL.0000000000003867.
4. Mullen SA, Marini C, Suls A et al. Glucose transporter 1 deficiency as a treatable cause of myoclonic astatic epilepsy. Arch Neurol 2011; 68(9): 1152–1155. doi:10.1001/ archneurol.2011.102.
5. Gökben S, Yilmaz S, Klepper J et al. Video/ EEG recording of myoclonic absences in GLUT1 deficiency syndrome with a hot-spot R126C mutation in SLC2A1 gene. Epilepsy Behav 2011; 21(2): 200–202. doi: 10.1016/ j.yebeh.2011.03.027.
6. Lee WG, Klepper J, Verbeek M et al. Glucose transporter-1 deficiency syndrome: expanding clinical and genetic spectrum of a treatable disorder. Brain 2010; 133(3): 655–670. doi: 10.1093/ brain/ awp336.
7. Klepper J. GLUT1 deficiency syndrome in clinical practice. Epilepsy Res 2012; 100(3): 272–277. doi: 10.1016/ j.eplepsyres.2011.02.007.
8. De Giorgis V, Veggiotti P. GLUT1 deficiency syndrome 2013: current state of the art. Seizure 2013; 22(10): 803–811. doi: 10.1016/ j.seizure.2013.07.003.
9. Gras D, Cousin C, Kappeler C et al. a simple blood test expedities the diagnosis of glucose transprter type 1 deficiency syndrome. Ann Neurol 2017; 82(1): 133–138. doi: 10.1002/ ana.24970.
10. Tyrliková I, Klein P. Ketogenní dieta-její účinnost a praktické užití. Neurologia pre prax 2015; 16 (3) 150–152.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2018 Issue 2
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Syndrom GLUT-1 deficience – expandující klinické spektrum léčitelného onemocnění
- Syndrom karpálního tunelu v kontextu funkčních poruch pohybového systému
- Identifikace dětských pacientů s farmakorezistentní epilepsií a výběr kandidátů nefarmakologické terapie
- Lehké řetězce neurofilament v séru a mozkomíšním moku a stav hematolikvorové bariéry u vybraných neurologických onemocnění
- Fyzioterapie u Parkinsonovy nemoci v České republice – demografická studie
- Follow-up pacientů s idiopatickou poruchou chování v REM spánku – fenokonverze do parkinsonského syndromu a demence
- Pilotní studie Edinburské kognitivně-behaviorální zkoušky pro amyotrofickou laterální sklerózu na české populaci
- Akutní myelitida u dětí – soubor 20 pacientů
- Nádor z granulárních buněk stopky hypofýzy
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
- Ataxie
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Antikoagulační léčba u pacientů s fibrilací síní a cerebrální amyloidovou angiopatií
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Je amyloid podstatný pro senilní demenci?
- Hladiny anti-Mülleriánského hormonu v séru při roztroušené skleróze – multicentrická případová kontrolní studie
- Invazivní primarně intracerebrální infekce u žen způsobené Streptococcus intermedius a manifestující se jako purulentní meningitida a intracerebrální absces
- Maligní melanotický schwannom obratlového těla u pacienta s Carneyho komplexem
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Ataxie
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Syndrom GLUT-1 deficience – expandující klinické spektrum léčitelného onemocnění
