Peletizace tavenin a kapalin
Pelletization of melts and liquids
During the second half of the last century, pelletization methods based on wetting were developed, e.g. agglomeration in coating pans, pelletization plates or fluid-bed equipment, layering of the drug in solution or suspension on inactive spherical cores, extrusion/spheronization and later on also rotoagglomeration in rotogranulators or rotoprocessors. These technologies have become a requisite part of industrial production of solid dosage forms. At present, numerous experimental papers deal with pellet preparation from melts and liquids. These new pelletization methods are the topic of the present article. Pellet preparation from melts is represented by three methods, i.e. fluid hot melt agglomeration, hot melt extrusion, and freeze pelletization. Jet cutting and cryopelletization are the techniques dealing with pellet preparation from liquids.
Key words:
fluid hot melt agglomeration – hot melt extrusion – freeze pelletization – jet cutting – cryopelletization
:
Miloslava Rabišková
:
Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků
:
Čes. slov. Farm., 2011; 60, 54-60
:
Review Articles
Ve druhé polovině 20. století se vyvinuly peletizační technologie založené na vlhčení, např. aglomerace v dražovacích bubnech, peletizačních talířích nebo fluidních zařízeních, vrstvení léčiva v roztoku nebo suspenzi na neaktivní sférické částice, extruze/sferonizace a později také rotační aglomerace v rotogranulátorech a rotoprocesorech. Tyto technologie se staly nepostradatelnou součástí průmyslové výroby pevných lékových forem. V současnosti je řada experimentálních článků věnována přípravě pelet z tavenin a kapalin. Právě těmto novým peletizačním metodám se věnuje přehledový článek. Příprava pelet z tavenin je reprezentována třemi postupy, tj. aglomerací tavením, extruzí tavenin a chlazením tavenin. Peletizaci kapalin zastupují metody odsekávání proudu kapaliny a kryopeletizace.
Klíčová slova:
peletizace tavením ve fluidních zařízeních – extruze tavenin – chlazení tavenin – odsekávání proudu kapaliny – kryopeletizace
Úvod
Peletizační metody se začaly rozvíjet v šedesátých letech 20. století. Jejich vývoj souvisel se zdokonalením technologických přístrojů (Wursterova kolona – 1959 1)) i vynálezem nových zařízení (Marumerizer Japonsko 1964; USA 1970 2); rotogranulátory a rotoprocesory v osmdesátých letech 3)).
Technologie pelet spočívaly ve vlhčení neaktivních částic roztokem nebo suspenzí léčiva (metoda vrstvení) nebo vlhčení práškové směsi s obsahem léčiva a pomocných látek vodou nebo roztokem pojiva (extruze/sferonizace; rotační aglomerace). Kromě vody lze použít i její směsi s ethanolem nebo jinými vhodnými rozpouštědly. Tyto technologie byly zavedeny během let do farmaceutického průmyslu a osvědčily se při hromadné výrobě pelet. Každá z uvedených technologií má své klady a nedostatky. Technologie vrstvení roztoku, suspenze nebo prášku léčiva na neaktivní jádra tvořená nejčastěji sacharosou nebo mikrokrystalickou celulosou poskytuje pelety stejné velikosti, vhodné k dalšímu zpracování, např. potahování obalem řídícím uvolňování aktivní složky. Nevýhodou procesu je maximální obsah léčivé látky do 50 %, protože značnou část lékové formy tvoří neaktivní jádro. Metoda extruze/sferonizace produkuje matricové pelety s léčivou látkou rovnoměrně rozptýlenou v celém objemu pelety. Obsah léčiva může při jeho vhodných fyzikálně-chemických vlastnostech dosáhnout až 90 %. Výsledkem procesu jsou díky stejnému průměru otvorů extruzní přepážky pelety s velmi úzkou distribucí velikosti vykazující výbornou pevnost a nízký oděr. Nevýhodou procesu je několik stupňů a přenos meziproduktů z jednoho zařízení na druhé, i když v této oblasti se v poslední době učinila mnohá zlepšení týkající se kontinuity procesu. Nespornou výhodou nejmladší z uvedených metod – rotační aglomerace je průběh procesu v jednom zařízení od homogenizované práškové směsi až po suché, případně i obalené pelety. Určitou nevýhodou jsou nemalé finanční náklady na zařízení a širší distribuce velikosti pelet, která je však u nejmodernějších zařízení rovněž vyřešena. Každá z uvedených technologií poskytuje pelety poněkud odlišných vlastností 4).
V posledních letech nabývají na významu peletizační metody vycházející z tavenin a kapalin léčivých a pomocných látek. Peletizace tavenin jsou výhodné pro léčiva náchylná k hydrolýze, jsou ekonomicky i časově méně náročné, protože odpadá proces vlhčení a sušení. Vzniklé pelety mají méně pórů a lepší mechanické vlastnosti než pelety připravené vlhčením vodou. Taveniny lze formovat do pelet trojím způsobem: ve fluidních zařízeních nebo vysokoobrátkových mixerech, extruzí (následovanou případně sferonizací) a chlazením taveniny v nemísitelné kapalině.
Peletizace tavenin
Proces peletizace tavením ve fluidních zařízeních (fluid hot melt granulation, fluid hot melt agglomeration) probíhá aglomerací nerozpuštěných částic práškové směsi roztaveným kapalným pojivem za vzniku kapalných můstků, které při teplotě místnosti tuhnou. Proces je ovlivněn několika faktory, mezi které patří čas aglomerace, množství použitého pojiva, jeho viskozita a velikost částic a velikost částic nerozpuštěných látek. Studiem uvedených faktorů se zabýval Zhai et al. 5), který zveřejnil dosažené výsledky v roce 2009. Ve své studii vycházeli ze skleněných částic stejné velikosti (150–250 μm nebo 300–400 μm), pojivem byl poloxamer 188 s teplotou tání 52–57 °C a různou velikostí částic (45–90 μm, 75–355 μm, 355–500 μm, 500–710 μm, 710–1000 μm, 1000–2000 μm). Aglomeráty se z předehřátých částic (5 min při 50 °C) tvořily rychle, během 60 s. Prodlužování procesu nevedlo ke vzniku větších částic. Za použití 4, 6 a 8 % pojiva velikost aglomerátů rostla se zvyšujícím se množstvím pojiva. Koncentrace pojiva měla vliv také na jejich tvar. Při určité optimální koncentraci vznikaly sférické aglomeráty. Dalším zvyšováním množství pojiva se stával jejich tvar méně pravidelným. Vysvětluje se to tak, že u velkých částic se vlivem hmotnosti a pohybu po určité době pendulární vazba narušila a aglomeráty se rozlomily na několik menších částí. Ty se pak v místě dotyku opět spojily za vzniku nových aglomerátů nepravidelných tvarů. Tyto závěry však souvisí pouze s aglomerací stejně velkých částic a neplatí pro aglomeraci částic se širokou distribucí velikosti nebo částic velmi jemných 6). Zhai et al.5) sledovali ve své práci i vliv velikosti částic pojiva (poloxamer 88; částice 75–2000 μm) na tvar aglomerátů vzniklých spojením částic o jednotné velikosti 200 μm. Zjistilo se, že pokud je částice pojiva větší (např. 710–1000 μm), pohltí jeho roztavená kapka nerozpustné částice a vznikne kulatější aglomerát bez pórů nebo s malým množstvím pórů. Viskozita pojiva pak určuje, jak snadno může pevná částice připojená k povrchu kapky migrovat dovnitř. Z malých částic pojiva (75–355 μm) na druhé straně vznikají malé kapky, které vážou pevné částice pouze spojením v místě dotyku. Může tak často dojít k uzavření vzduchových bublin uvnitř aglomerátů a výsledkem je méně pravidelný tvar. Ve stejné práci 5) sledovali také vliv velikosti nerozpustných částic na tvar výsledných aglomerátů: jemnější částice (150–250 μm) vedly ke vzniku pravidelnějších aglomerátů, než tomu bylo u částic větších (300–400 μm).
Získané výsledky napovídají, že jak velikost částic pojiva, tak velikost nerozpustných, aglomerovaných částic mají významný vliv na konečnou distribuci velikosti aglomerátů i jejich tvar. Studie naznačuje, že aglomeráty se tvoří poměrně rychle, během 60 s, což souvisí s rovnoměrnou distribucí roztaveného pojiva na povrchu pevných částic a tedy také se smáčivostí povrchu těchto částic použitým zkapalněným pojivem.
Extruze taveniny (hot melt extrusion) nabývá na významu, o čem svědčí více než pětinásobný nárůst publikovaných článků i udělených patentů v období let 1990–2004. Tato tendence se projevuje v celosvětovém měřítku: mezi nejaktivnější státy, co se patentů týká, patří USA, Německo, Japonsko a z dalších evropských zemí také Francie a Anglie 7). Podobně jako extruze/sferonizace vlhčením, zahrnuje také extruze/sferonizace tavenin několik stupňů, ke kterým patří homogenizace práškové směsi, vznik plastické hmoty – taveniny zahřátím, formování hmoty do provazců stejného průměru (extruze) a přeměna extrudátu na sférické pelety (sferonizace). Časově náročné sušení odpadá, pelety tuhnou většinou při teplotě místnosti. Vlhčivo je nahrazeno roztaveným zkapalněným pojivem. K extruzi tavenin se používají šnekové extrudery s vyhřívaným (v případě potřeby i částečně ochlazovaným) pláštěm a přídavným zařízením k tvarování požadované lékové formy (sferonizery, peletizery, válce) 8). Extruzní zóna má tři části: zásobovací, kterou se prášková směs ze zásobníku transportuje do nejrozsáhlejší tavicí části a mění se v taveninu, kterou šnek v poslední dávkovací části protlačuje otvory extruzní přepážky. Často není třeba směs ani zahřívat, protože teplo, vzniklé třením uvnitř extruderu je dostačující k roztavení pojiva. Doba extruze je krátká (asi 2 min) a představuje minimální zátěž pro léčiva i pomocné látky. Proces probíhá bez přístupu vzduchu a vlhkosti; to je výhodné pro léčivé látky citlivé na oxidaci a hydrolýzu. V procesu lze použít extruder se dvěma šneky, jednošnekový extruder je však oblíbenější vzhledem k relativně nízkým nákladům, robustnosti a spolehlivosti. Dizajn extruzní přepážky se řídí složením extrudátu a podmínkami procesu.
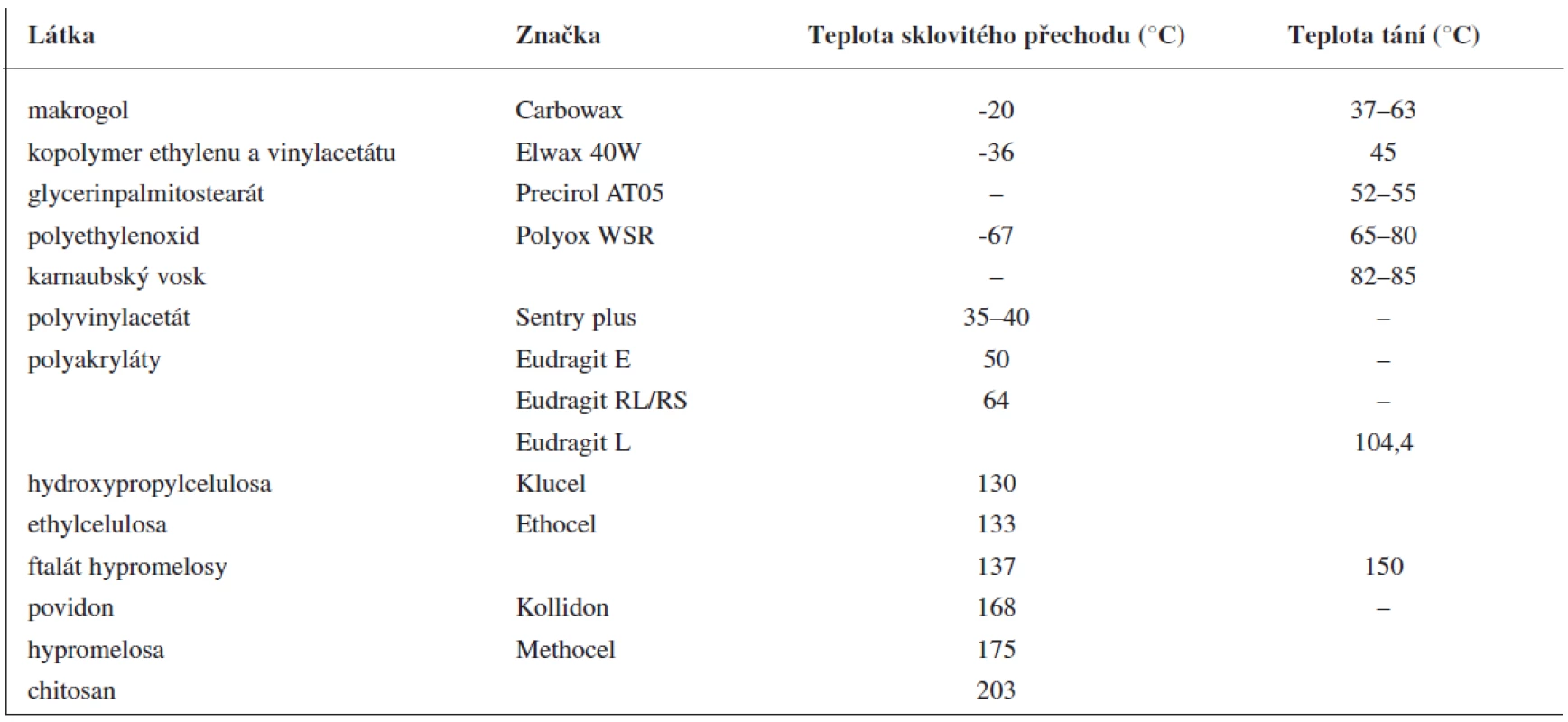
Při extruzi taveniny se nosná pomocná látka, ve které je rozptýlena léčivá látka, obvykle nachází v roztaveném stavu. Může jí být vosk s nízkou teplotou tání nebo vhodný polymer (tab. 1). Fyzikálně chemické vlastnosti nosné pomocné látky mají značný vliv na uvolňování léčiva. Při použití polymerů se do směsi často přidávají změkčovadla (plastifikátory). Včlenění změkčovadel (tab. 2) usnadňuje tavení směsi, modifikuje uvolňování léčivé látky a zlepšuje povrchový vzhled lékové formy (hladší povrch). Po přidání změkčovadel se doba tavení zkracuje, to minimalizuje rozklad termolabilních látek. Změkčovadla zlepšují pohyblivost polymerových řetězců a snižují teplotu sklovitého přechodu polymeru. Někdy mohou mít funkci změkčovadel i léčiva (ibuprofen 9), lidokain 10), vitamin E 11)) nebo pomocné látky (methylparaben 12)). Podobně jako u jiných lékových forem mohou být ve formulaci obsaženy i další pomocné látky, např. látky modifikující uvolňování léčiva.
Léčivé látky mohou být v extrudátu přítomny jako nerozpuštěné částice (tuhá suspenze), rozpuštěné molekuly (tuhý roztok) nebo jejich kombinace. První zmínka o tuhých roztocích a jejich vlivu na biologickou dostupnost léčiva pochází z roku 1961 13). V roce 1974 byl již popsán pozitivní vliv tuhých roztoků na disoluci, absorpci a terapeutický účinek léčiv 14). Problémy omezující průmyslové využití tuhých roztoků byly spojeny se způsobem přípravy, reprodukovatelností fyzikálně chemických vlastností, včleněním tuhého roztoku do lékové formy, přenosem postupu do výrobního procesu nebo fyzikální a chemickou stabilitou léčiva a nosné pomocné látky. V tomto ohledu přináší metoda extruze tavenin do této oblasti značný pokrok. Stav molekulové disperze (tuhého roztoku) je stabilizován polymerní matricí a závisí na mezimolekulových interakcích mezi léčivem a nosnou pomocnou látkou a na její viskozitě. V tuhém roztoku často přispívají ke zvýšené disoluční rychlosti následující mechanismy: velikost částic dosahuje minimální hodnotu, nosná pomocná látka může mít solubilizační účinek, zvyšuje smáčivost a dispergovatelnost léčivé látky v disolučním prostředí. Některé tuhé roztoky jsou velmi stálé, zejména tehdy, když není překročena rozpustnost léčiva v dané nosné pomocné látce. Tyto systémy jsou termodynamicky stálé. Jejich stabilita se vztahuje k rozpustnosti léčiva a ne k viskozitě dané pomocné látky v matrici, jako tomu je u přesycených systémů, které jsou kineticky stálé a mohou mít se stabilitou problémy 15). Tuhé suspenze se připravují homogenizací jemně rozdrobněného léčiva a pomocných látek a zahřátím směsi na teplotu, při které se nosná pomocná látka roztaví nebo změkne. Teplota tání nosiče by měla být nižší než teplota tání léčiva. Velmi důležitý je poměr léčiva a nosné pomocné látky. Na rozdíl od tuhých roztoků by se léčivá látka neměla v nosiči rozpouštět. Nosič by měl obalit jednotlivé částice léčiva a zvýšit jejich smáčivost 16). Tuhé suspenze lze snadněji připravit a jsou stálejší než přesycené tuhé roztoky, tuhé roztoky však výrazněji zlepšují biologickou dostupnost léčivých látek 8). Léčiva samotná mohou také do značné míry ovlivnit podmínky extruze, ať již v pozitivním (snížení teploty sklovitého přechodu), nebo v negativním smyslu (ztekucování extrudátu, prodloužení doby tuhnutí částic) 7).
Extruzí tavenin lze připravit lékové formy několika typů 17). Jsou to především pelety a granuláty s prodlouženým nebo okamžitým uvolňováním léčiva. K prodlouženému uvolňování se využívají zejména vosky, ethylcelulosa, polyethylenoxid nebo polyakryláty, zatímco k okamžitému uvolňování se upřednostňují nízkomolekulární makrogoly, povidon, hydroxypropylcelulosa a hypromelosa; možná je i kombinace léčiva, cyklodextrinu a polymeru 18). Pelety i granulát lze naplnit do tvrdých tobolek nebo slisovat do tablet. Zajímavou lékovou formou založenou na extruzi tavenin jsou transdermální a mukoadhezivní filmy, k jejichž formování se používají na extruder navazující přídavná zařízení (např. válce) 19). Základem jsou podobné nosné pomocné látky jako u pelet s prodlouženým uvolňováním. Publikována byla příprava filmů s několika modelovými léčivy. Lidokain se použil jako modelové léčivo při formování mukoadhezivních filmů s Eudragitem E 10) nebo hydroxypropylcelulosou 20) ve funkci nosných pomocných látek. Ketokonazol byl aktivní látkou u filmů s polyethylenoxidem nebo hydroxypropylcelulosou 21) navržených pro léčbu onchomykóz. Z dalších léčiv se studovaly např. chlorfeniramin maleát 22), guaifenesin 23), vitamin E 24) a klotrimazol v základech tvořených hydroxypropylcelulosou nebo polyethylenoxidem 25–27). Extruzí taveniny se připravily také implantáty s vapreotidem a kopolymerem kyseliny mléčné a glykolové 28) nebo inserty s etonorgestrelem, resp. ethinylestradiolem a kopolymerem ethylenu a vinylacetátu 29).
Při peletizaci chlazením taveniny (freeze pelletization) se tavenina obsahující léčivou látku aplikuje ve formě kapek do sloupce s nemísitelnou kapalinou. Kapky se pohybují ve sloupci nahoru, nebo dolů v závislosti na hustotě taveniny a nemísitelné kapaliny přítomné ve sloupci a tuhnou do sférických pelet. K přípravě se používají dva typy zařízení a jejich výběr závisí na hustotě roztaveného nosiče. Nosné pomocné látky mohou být hydrofilní nebo lipofilní povahy a roztaví se při teplotě o 5–10 °C vyšší, než je jejich teplota tání. Léčivé a další pomocné látky se smísí s roztaveným nosičem za vzniku roztoku nebo suspenze 30–32).
V přístroji I (obr. 1a) se tavenina aplikuje ve formě kapek do sloupce kapaliny jehlami nebo tryskami z určité výšky tak, aby kapky zůstaly neporušené při pádu do kapaliny. Kapky s vyšší hustotou, než má kapalina ve sloupci, se pohybují ke dnu přístroje, kde se hromadí jako tuhé částice. Pokud je hustota kapek menší než hustota nemísitelné kapaliny, tavenina se aplikuje zdola tryskou přímo do kapaliny. Kapky stoupají vzhůru a hromadí se u povrchu kapaliny (obr. 1b). Sloupec přístroje má dvě části: část vstupní, která může být temperována na teplotu 25–100 °C, a delší část chladicí, která je ochlazována na teplotu 0 až -40 °C směsí acetonu a suchého ledu.
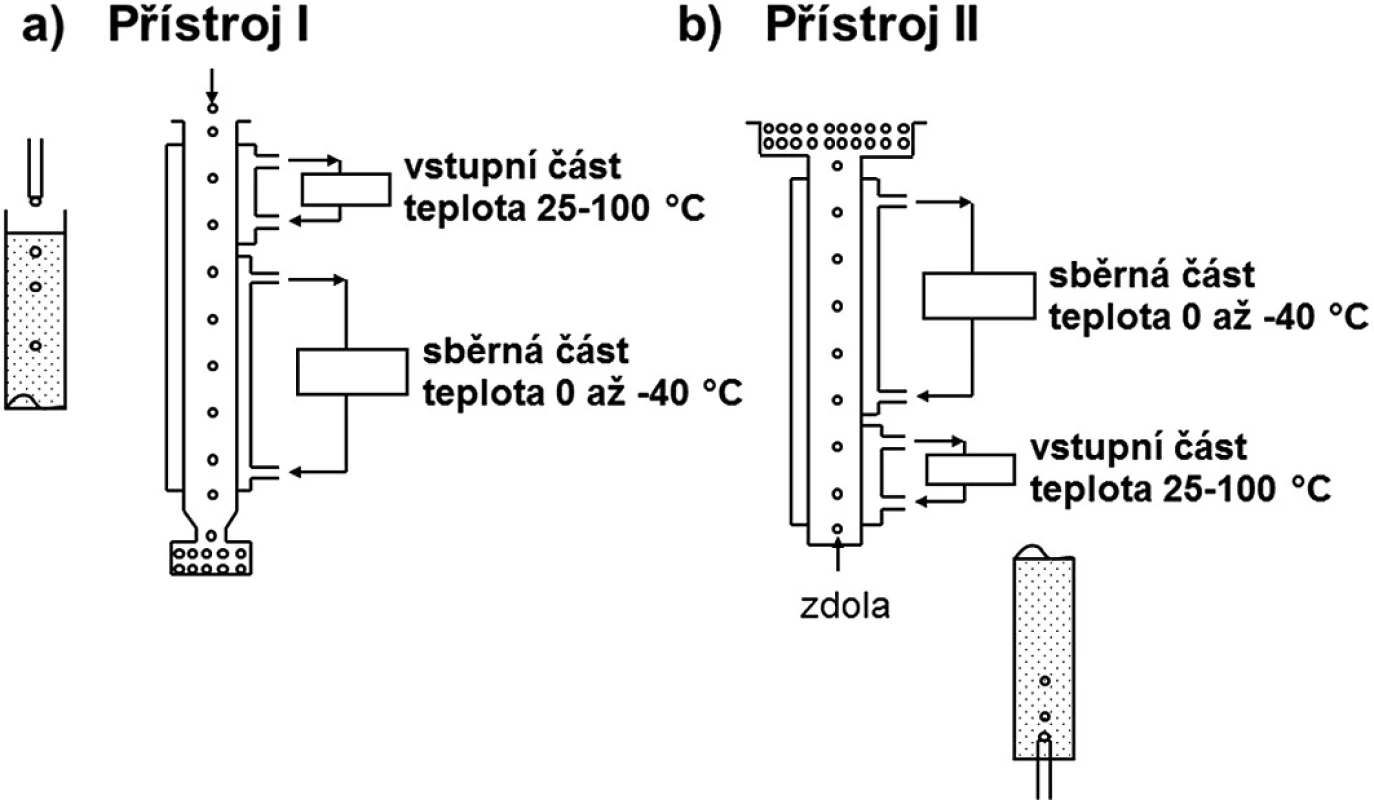
Jako nosné pomocné látky lze použít polyvinylalkohol, makrogoly nebo cukry tající při nízké teplotě (dextrosa: 83 °C 33), maltosa: 120–125 °C 34)) v kombinaci s oleji s nízkou hustotou (přístroj I) nebo glycerylpalmitostearát, glycerylbehenát či glycerylmonostearát v kombinaci s kapalnými makrogoly, glycerinem nebo vodou (přístroj II). Pro pelety obsahující směsi hydrofilních i hydrofobních látek se ve sloupci používají kapaliny nemísitelné s oběma složkami 30).
Peletizace kapalin
Peletizaci kapalin reprezentuje několik metod založených na vytékání proudu kapaliny z trysky, formování kapky u jejího ústí a vzniku sféry po jeho opuštění vlivem povrchového napětí. Vzhledem k tomu, že použití menších trysek nevede k ovlivnění velikosti získaných částic, je třeba kapky odstranit silou tak, aby se získaly menší pelety. K tomu se využívají tři typy mechanismů:
- laminární tok vzduchu obklopujícího trysku (blow off – odfukování kapek 35)),
- definovaná vibrace k odstranění – přerušení toku kapaliny 36–37) (např. Droppo peletizery s vibračním prstencem) a
- odsekávání proudu kapaliny 38).
Při tzv. odfukování kapek lze použít jen kapaliny s nízkou viskozitou a průběh procesu není kontinuální vzhledem k zasychání kapaliny v ústí otvoru 35). Vibraci lze použít jak u trysky, tak u kapaliny, metoda je aplikovatelná do výroby. Částice s průměrem menším než 1 mm je možné připravit pouze z kapalin o viskozitě do 500 mPa, což je omezením této technologie 37). Obě metody neumožňují použití kapalin s vysokou viskozitou, to však umožňuje peletizace odsekáváním proudu kapaliny, kde lze použít kapalinu o viskozitě až do několika Pa 38).
Při peletizaci odsekáváním proudu kapaliny (jet cutting) 38) se nepřetržitý proud kapaliny vytlačuje tryskou velkou rychlostí a odsekává se ve formě částic cylindrického tvaru pomocí rychle se pohybujícího řezacího zařízení, což je většinou několik tenkých drátků připojených k rotujícímu zařízení. Vzniklé válečkovité útvary se během pádu do tvrdící lázně mění ve sféry vlivem povrchového napětí kapaliny. Určité množství kapaliny se přitom odstříkne (obr. 2). Množství odstříknuté kapaliny závisí na několika parametrech. Drátek by měl být co nejtenčí. Snazší je pracovat s tenkým proudem kapaliny a rozsekat ho na delší válečky než se silnějším proudem, který je třeba rozsekat na krátké válečky. Záleží také na umístění trysky (vertikální nebo šikmé) a na umístění řezacího zařízení (horizontální nebo šikmé). Pouze při určitém sklonu válečky odstřikují minimum kapaliny. Pokud se použije drát s průměrem 50 μm a nastaví se optimální sklon, může se ztráta kapaliny snížit velmi výrazně na pouhá 2 % 39).
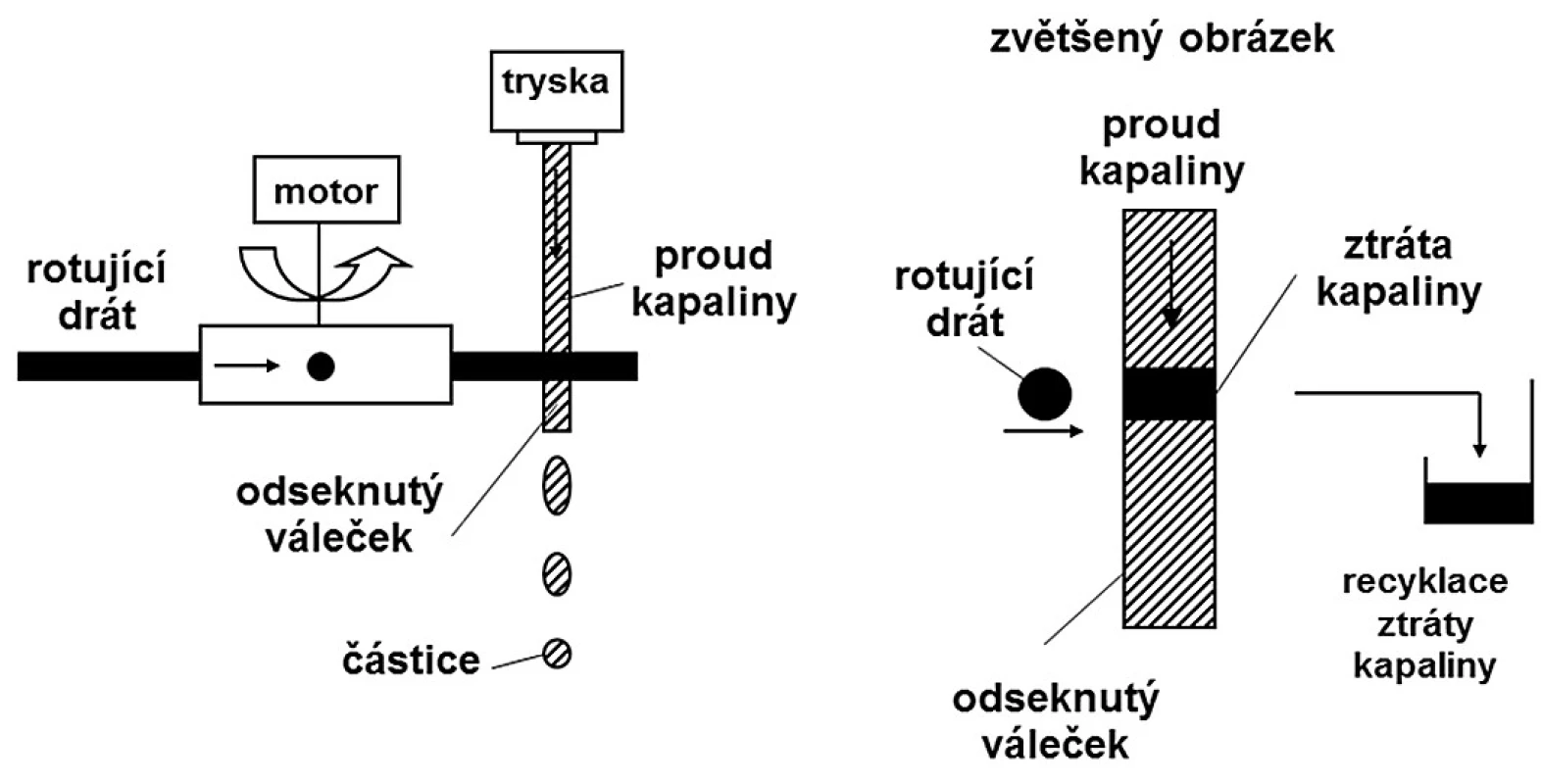
Protože je rychlost proudu kapaliny konstantní a drát rotuje také konstantní rychlostí, všechny odseknuté částice mají stejnou velikost a výsledkem jsou pelety s úzkou distribucí velikosti. Uvedeným postupem lze dosáhnout velikosti částic od 150 μm do 2,5–3 mm v závislosti na vlastnostech kapaliny. Rychlost produkce může být až 15 000 částic za sekundu. V závislosti na použitém materiálu by se měl zajistit jejich bezproblémový transport do lázně. Vzhledem k velkému množství vyprodukovaných částic a jejich velké rychlosti (až 30 m/s) je třeba lázeň intenzivně míchat nebo vyměňovat.
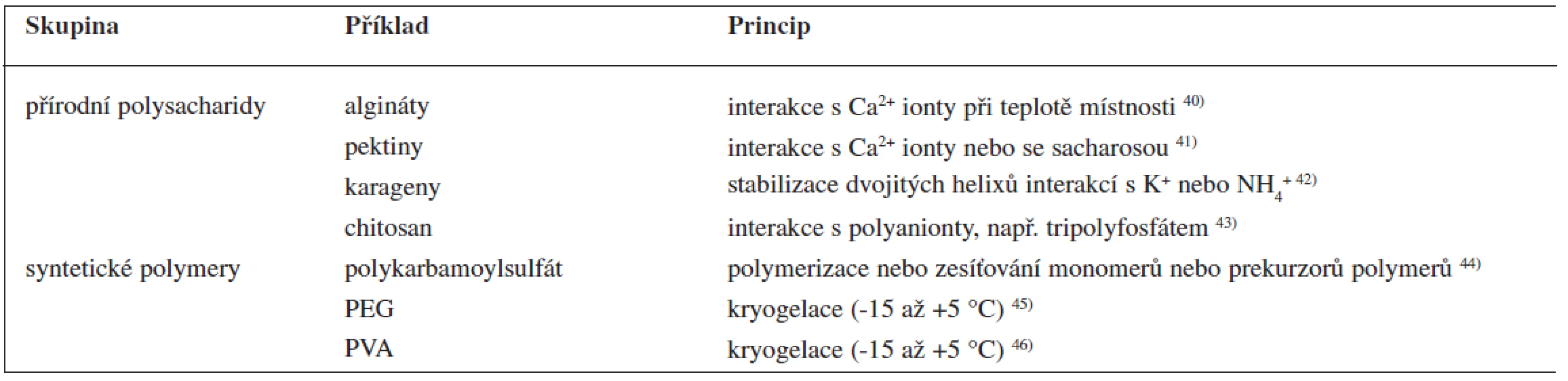
Nosnými pomocnými látkami mohou být algináty, chitosan, karagenan, želatina a syntetické polymery, jako jsou polyvinylalkohol a silikony 38). Mimo uvedených nosných materiálů lze pro enkapsulaci léčivých látek použít také anorganické nosiče nebo roztavené vosky. Dají se v podstatě použít všechny látky, které lze převést do podoby hydrogelů (tab. 3). Formování gelu může probíhat na principu iontové interakce nebo chemické vazby, nebo je lze uspíšit pomocí teploty (např. jejím snížením – kryogelací). Vzhledem k mírným podmínkám metody lze enkapsulovat také mikroorganizmy nebo enzymové preparáty.
Metoda kryopeletizace (cryopelletization) se poprvé použila k lyofilizaci bakteriálních suspenzí v potravinářském průmyslu a v současnosti se používá ve farmaceutickém průmyslu k výrobě pelet s okamžitým i řízeným uvolňováním léčiva. Pelety s okamžitým uvolňováním léčiva se skládají z léčiv, hydrofilních plniv (laktosa a mannitol) a pojiv (želatina a povidon), zatímco pelety s prodlouženým účinkem obsahují kromě léčiva zesíťované polymery založené na derivátech kolagenu. Při této metodě se mění kapky roztoku, emulze nebo suspenze na sférické pelety za použití kapalného dusíku jako zpevňujícího prostředí při teplotě -196 °C. Vzniklé zmrazené pelety se následně vysuší lyofilizací. Obsah pevné fáze a teplota kapalné formulace určují množství kapalného dusíku použitého během procesu. Použití kapalného dusíku je výhodné pro jeho inertnost, absenci zbytkových rozpouštědel a promývání 47).
Zařízení se skládá z perforovaného talíře, pod kterým je rezervoár kapalného dusíku s dopravním pásem. Nastavitelná rychlost dopravníku umožňuje setrvat peletám na místě až do doby zmrznutí. Zmrazené pelety jsou transportovány do kontejneru při -60 °C před vysušením. Formování kapek je nejkritičtějším stupněm tohoto procesu a je ovlivněno formulačními faktory, jako jsou obsah pevných látek, viskozita a povrchové napětí kapaliny, i procesními faktory, jako jsou dizajn zařízení a podmínky procesu. Velikost a tvar pelet jsou dány průměrem otvorů perforovaného talíře (čím menší průměr otvorů, tím menší průměr částic). Vzdálenost mezi perforovaným talířem a zásobníkem kapalného dusíku by měla být taková, aby dovolila formování kulatých kapek před dotykem s kapalným dusíkem. Pokud se požaduje průměr pelet menší než 2 mm, pak by se měl kapalný dusík kontinuálně míchat k zabránění aglomerace tvořících se částic. Přidáním povrchově aktivní látky k formulaci lze snížit povrchové napětí kapaliny a získat tak pelety menší velikosti. Pelety vzniklé touto metodou jsou velmi pórovité. Zařízení zahrnují laboratorní typy (produkující 0,5–2 kg částic/ hod.), poloprovozní přístroje i zařízení výrobní (s produkcí až 250 kg částic/hod.).
ZÁVĚR
Nové peletizační metody jsou nesporným přínosem pro produkci pelet rozdílných typů a vlastností. Z peletizace tavenin se jeví jako nejperspektivnější extruze pro své nesporné výhody, kterými jsou zlepšení biologické dostupnosti řady léčiv, uvolňování prodloužené i okamžité, ekonomická i časová úspora, malé náklady na zařízení (úprava extruderů) a možnost formování několika druhů lékových forem. Metoda odsekávání proudu kapaliny je výhodná využitím v laboratorních podmínkách i výrobní produkci, umožňuje peletizaci kapalin s různou viskozitou a poskytuje stejně velké částice při mírných procesních podmínkách vhodných i pro zpracování mikroorganizmů a enzymů. Kryopeletizace je cennou metodou pro vznik pelet s vysokou pórovitostí, schopných zabezpečit okamžité i prodloužené uvolňování léčiva. Nezbývá než si přát, aby se nové peletizační metody staly běžnými technologiemi farmaceutického průmyslu a obohatily peletovou lékovou formu o další typy částic s odlišnými vlastnostmi rozšiřující možnosti jejich použití.
Došlo 27. ledna 2011
Přijato 2. února 2011
Adresa pro korespondenci:
doc. PharmDr. Miloslava Rabišková, CSc.
Ústav technologie léků FaF VFU
Palackého 1–3, 612 42 Brno
e-mail: rabiskovam@vfu.cz
Sources
1. Jones, D. M.: Air suspension coating. In: Swarbrick, J., Boylan, J. C. eds. Encyclopedia of Pharmaceutical Technology, Vol. 1. New York: Marcel Dekker 1988; 188–216.
2. Ghebre-Sellassie, I.: A general overview. In: Ghebre-Sellassie, I. ed. Pharmaceutical Pelletization Technology. New York: Marcel Dekker 1989; 1–13.
3. Goodhart, F. W.: Centrifugal equipment. In: Ghebre-Sellassie, I. ed. Pharmaceutical Pelletization Technology. New York: Marcel Dekker 1989; 101–122.
4. Häring, A., Vetchý, D., Janovská, L., Krejčová, K., Rabišková, M.: Differences in characteristics of pellets prepared by different pelletization methods. Drug Dev. Ind. Pharm. 2008; 34, 289–296.
5. Zhai, H., Andrews, G., Jones, D., Bell, S., Walker, G. M.: Nucleation and growth in fluidised hot melt granulation. Powder Technol. 2009; 189, 230–237.
6. Walker, G. M., Andrews, G., Jones, D.: Effect of proces parameters on the melt granulation of pharmaceutical powders. Powder Technol. 2006; 165, 161–166.
7. Crowley, M. M., Zhang, F., Repka, M. A., Thumma, S., Upadhye, S. B., Battu, K. S., McGinity, J. W., Martin, C.: Pharmaceutical application of hot-melt extrusion: Part I. Drug Dev. Ind. Pharm. 2007; 33, 909–926.
8. McGinity, J. W.: Melt-extruded controlled release dosage forms. In: Ghebre-Sellassie, I. ed. Pharmaceutical Extrusion Technology. New York: Marcel Dekker 2003; 183–208.
9. Repka, M. A., Gerding, T. G., Repka, S. l., McGinity, J. W.: Influence of plasticizers and drugs on the physical-mechanical properties of hydroxypropylcellulose films prepared by hot melt extrusion. Drug Dev. Ind. Pharm. 1999; 25, 625–633.
10. Aitken-Nichol, C., Zhang, F., McGinity, J. W.: Hot melt extrusion of acrylic films. Pharm. Res. 1996; 13, 804–808.
11. Crowley, M. M., Zhang, F., Koleng, J. J., McGinity, J. W.: Stability of polyethylene oxide in matrix tablets prepared by hot-melt extrusion. Biomaterials 2002; 23, 4241–4248.
12. Wu, C. M. J.: Influence of methyl paraben as solid state plasticizer on the physicochemical properties of Eudragit RS PO hot-melt extrudates. J. Pharm. Biopharm. 2003; 56, 95–100.
13. Sekiguchi, K., Obi, N.: Studies on absorption of eutectic mixtures. 1. A comparison of the behaviour of eutectic mixtures of sulfathiazole and that of ordinary sulfathiazole in man. Chem. Pharm. Bull. 1961; 9, 866–872.
14. Hajratwala, B. R.: Dissolution of solid dispersion systems. Aust. J. Pharm. Sci. 1974; 4, 101–109.
15. Breitenbach, J., Magerlein, M.: Melt-extruded molecular dispersions. In: Ghebre-Sellassie, I. ed. Pharmaceutical Extrusion Technology. New York: Marcel Dekker 2003; 245–260.
16. Dyar, S. C., Mollan, M.: Melt-extruded particulate dispersions. In: Ghebre-Sellassie, I. ed. Pharmaceutical Extrusion Technology. New York: Marcel Dekker 2003; 261–275.
17. Repka, M. A., Battu, S. K., Upadhye, S. B., Thumma, S., Crowley, M. M., Zhang, F., Martin, C., McGinity, J. W.: Pharmaceutical applications of hot-melt extrusion: Part II. Drug Dev. Ind. Pharm. 2007; 33, 1043–1057.
18. European Patent 0003612, 1999.
19. Elliot, B.: Film, sheet and laminates. In: Ghebre-Sellassie, I. ed. Pharmaceutical Extrusion Technology. New York: Marcel Dekker 2003; 225–244.
20. Repka, M. A., Gutta, K., Prodduturi, S., Munjal, M., Stodghill, S. P.: Characterization of cellulosic hot-melt extruded films containing lidocaine. Eur. J. Pharm. Biopharm. 2005; 59, 189–196.
21. Repka, M. A., Mididoddi, P. K., Stodghill, P.: Influence of etching on humans nails for the assessment of treatment modalities for onchomycosis, Int. J. Pharm. 2004; 283, 95–106.
22. Repka, M. A., Gerding, T. G., Repka, S. L., McGinity, J. W.: Influence of plasticizers and drugs on the physical-mechanical properties of hydroxypropylcellulose films prepared by hot melt extrusion. Drug Dev. Ind. Pharm. 1999; 25, 625–633.
23. Crowley, M. M., Fredersdorf, A., Schroeder, B., Ucera, S., Prodduturi, S., Repka, M. A.: The influence of guaifenesin and ketoprofen on the properties of hot-melt extruded polyethylene oxide films. Eur. J. Pharm. Sci. 2004; 22, 409–418.
24. Repka, M. A., McGinity, J. W.: Influence of vitamin E TPGS on the properties of hydrophilic films produced by hot-melt extrusion. Int. J. Pharm. 2000; 202, 63–70.
25. Podduturi, S., Manek, R. V., Kolling, W. M., Stodghill, S. P., Repka, M. A.: Water vapor sorption isotherms of hot-melt extruded hydroxypropylcellulose films: Effects on physico-mechanical properties, release characteristics and stability. J. Pharm. Sci. 2004; 93, 3047–3056.
26. Podduturi, S., Manek, R. V., Kolling, W. M., Stodghill, S. P., Repka, M. A.: Solid state stability and characterization of hot-melt extruded poly (ethylene oxide) films. J. Pharm. Sci. 2005; 94, 2232–2245.
27. Repka, M. A., Prodduturi, S., Stodghill, S. P.: Production and characterisation of hot-melt extruded films containing clotrimazole. Drug Dev. Ind. Pharm. 2003; 29, 757–765.
28. Rothen-Weinhold, A., Oudry, N., Schwach-Abdellaoui, K., Frutiger-Hughes, S., Hughes, G. J., Jeannerat, D.: Formation of peptide impurities in polyester matrices during implant manufacturing. Eur. J. Pharm. Sci. 2000; 49, 253–257.
29. Van Laarhoven, J. A. H., Kruft, M. A. B., Vromans, H.: In vitro release properties of ethonorgestrel and ethinyl estradiol from a contraceptive vaginal ring. Int. J. Pharm. 2002; 232, 163–173.
30. Cheboyina, S., O’Haver, J., Wyandt, C. M.: A mathematical model to predict the size of the pellets formed in freeze pelletization techniques: Parameters affecting pellet size. J. Pharm. Sci. 2006; 95, 167–180.
31. Cheboyina, S., Wyandt, C. M.: Wax-based sustained release matrix pellets prepared by a novel freeze pelletization technique. I. Formulation and proces variables affecting pellet characteristics. Int. J. Pharm. 2008; 359, 158–166.
32. Cheboyina, S., Wyandt, C. M.: Wax-based sustained release matrix pellets prepared by a novel freeze pelletization technique. II. In vitro drug release studies and release mechanisms. Int. J. Pharm. 2008; 359, 167–173.
33. Rowe, R. C., Sheskey, P., Owen, S. C.: Handbook of Pharmaceutical Excipients. 5th ed., London: Pharmaceutical Press 2006; 231–233.
34. Rowe, R. C., Sheskey, P., Owen, S. C.: Handbook of Pharmaceutical Excipients. 5th ed., London: Pharmaceutical Press 2006; 447–448.
35. Vorlop, K. D., Klein, J.: New developments in the field of cell immobilization: formation of biocatalysts by inotropic gelation. In: Lafferty, R. M. ed. Enzyme Technology. Berlin: Springer 1983; 219–235.
36. Brandenberger, H., Widmer, F.: A new multinozzle encapsulation/ immobilisation system. In: Godia, F., Poncelet, D. eds. Proceedings of the International Workshop Bioencapsulation VI. Barcelona: 1997; poster 9.
37. Case, C. C.: Melt pelletization. In: Ghebre-Sellasie, I. ed. Pharmaceutical Extrusion Technology, New York: Marcel Dekker 2005; 171–182.
38. Jahnz, U., Wittlich, P., Prusse, U., Vorlop, K.-D.: New matrices and bioencapsulation proces. In: Hofman, M., Thonart, P. eds. Engineering and Manufacturing for Biotechnology, Holandsko: Kluwer Academic Publishers 2001; 293–307.
39. Prusse, U., Bruske, F., Breford, J., Vorlop, K.-D.: Improvement of the Jet Cutting method for the production of spherical particles from viscous polymer solutions. Chem. Eng. Technol. 1998; 21, 153–157.
40. Smidsrod, V., Skjak-Braek, G.: Alginate as immobilisation matrix for cells. Trends Biotechnol. 1990; 8, 71–78.
41. Berger, R., Ruhlemann, I.: Stable inotropic gel for cell immobilization using high molecular weight pectic acid. Acta Biotechnol. 1988; 8, 401–405.
42. Chibata, I., Tosa, T., Sato, T., Takata, I.: Immobilisation of cells in carageenan. Methods Enzymol. 1987; 135, 189–198.
43. Vorlop, K.-D., Klein, J.: Entrapment of microbial cells in chitosan. Methods Enzymol. 1987; 135, 259–268.
44. Muscat, A., Prusse, U., Vorlop, K.-D.: Stable support materials for the immobilisation of viable cells. In: Wijffels, R. H., Buitelaar, R. M., Bucke, C., Tramper, J. eds. Immobilised cells: Basic and Applications. Elsevier Sciences B. V. 1998; 55–61.
45. Emori, H., Mikawa, K., Hamaya, M., Yamaguche, T., Tanaka, K., Takeshima, T.: PEGASUS Innovative biological nitrogen removal proces using entrappedt nitrifiers. In: Wijffels, R. H., Buitelaar, R. M., Bucke, C., Tramper, J. eds. Immobilised cells: Basic and Applications. Elsevier Sciences B. V. 1998; 85–97.
46. Lozinsky, V. I., Plieva, F. M.: Poly(vinyl alcohol) cryogels employed as matrices for cell immobilisation. Rnzyme Microbiol. Technol. 1998; 23, 227–242.
47. Knoch, A.: Cryopelletization. In: Ghebre-Sellasssie, I. ed. Multiparticulate Oral Drug Delivery. New York: Marcel Dekker 1994; 35–49.
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2011 Issue 2
-
All articles in this issue
- Myasthenia gravis – current treatment standards and emerging drugs
- Pelletization of melts and liquids
- Dyer’s Greenweed (Genista tinctoria L.): constituents and biological activity
- Bacteriocins produced by lactic acid bacteria
- Generic substitution, replacement and substitution of drugs: contemporary extent
- Study of local anaesthetics – Part 194 Evaluation of carbopol hydrogels with lidocaine
- Analytical evaluation of mono[{3-[4-(2-etoxyetoxy)-benzoyloxy]-2-hydroxypropyl}-isopropyl-ammonium]fumarate
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Generic substitution, replacement and substitution of drugs: contemporary extent
- Myasthenia gravis – current treatment standards and emerging drugs
- Bacteriocins produced by lactic acid bacteria
- Pelletization of melts and liquids
