Postavení vitaminu D v primární a sekundární prevenci u ortopedických pacientů
The role of vitamin D in primary and secondary prevention in orthopaedic patients
The article discusses the effect of vitamin D on primary and secondary prevention of fractures and its effect on conditions after selected orthopaedic procedures. Fractures can be divided into traumatic, fatigue and pathological according to the cause. One of the complications of fracture is the formation of a nonunion. In addition to dealing with fractures, a total joint replacement is another common procedure in orthopaedic surgery. Because insufficient muscle strength can increase the risk of falls and thus result in a fracture, these topics are also mentioned in this article. Due to the impact of vitamin D deficiency on various musculoskeletal disorders, orthopaedic surgeons should pay more attention to the patient’s vitamin D status and be familiar with different strategies for preventing hypovitaminosis D, although clear evidence-based medical recommendations are still insufficient.
Keywords:
vitamin D – orthopaedics – fracture – total joint replacement – osteoporosis
Authors:
Michal Čečrle; Norbert Didič; Milada Halačová; Dalibor Černý
Published in:
Čes. slov. Farm., 2021; 70, 127-135
Category:
Review Articles
doi:
https://doi.org/https://doi.org/10.5817/CSF2021-4-127
Overview
Článek má za cíl diskutovat vliv vitaminu D na primární a sekundární prevenci zlomenin a jeho vliv na stavy po vybraných ortopedických výkonech. Zlomeniny můžeme podle příčiny vzniku rozdělit na úrazové (traumatické), únavové a patologické. Jednou z komplikací zlomenin je tvorba pakloubu (nesrůst kosti). Kromě řešení zlomenin je velmi častým výkonem v ortopedii i totální náhradu kloubu. Jelikož i nedostatečná svalová síla může vést k riziku pádu, a dojít tak ke zlomenině, budou v článku tato témata také zmíněna. Vzhledem k dopadu nedostatku vitaminu D na různé poruchy pohybového aparátu by si ortopedičtí chirurgové měli u pacienta stále více všímat stavu vitaminu D a obeznámit se s různými strategiemi prevence hypovitaminózy D, ačkoliv jasná doporučení medicíny založená na důkazech v této oblasti jsou stále insuficientní.
Klíčová slova:
vitamín D – ortopedie – zlomenina – totální náhrada kloubu – osteoporóza
Úvod
Vitamin D je nezbytný pro regulaci vápníku a fosfátu v lidském organismu. Jeho snížený příjem nebo tvorba mohou vést ke změně procesu mineralizace kostí. Subklinický nedostatek vitaminu D se vyskytuje i ve vyspělých zemích a je spojen s rizikem osteopenie (stav předcházející osteoporóze nebo jako normální projev stárnutí) nebo osteoporózy, zvýšeným rizikem pádů a s nimi souvisejícími zlomeninami. Osteopenie je definována jako úbytek kostní denzity o 1–2,5 směrodatné odchylky (SD) od průměru kostní denzity u mladého jedince téhož pohlaví, osteoporóza pak nad 2,5 SD. Klíčové vyšetření, které musí pacient podstoupit, je osteodenzitometrie na dvou místech skeletu – proximálním femuru a bederní páteři. V České republice je registrován vitamin D2 (ergokalciferol) pro i.m. podání a poté celá řada přípravků s vitaminem D3 (cholekalciferol) pro perorální použití. Dle databáze Státního ústavu pro kontrolu léčiv jsou z perorálních přípravků obsahujících pouze cholekalciferol v České republice aktuálně registrované dva přípravky ve formě kapek (Vigantol®, Fultium D3®) a jeden přípravek ve formě tablet ve třech různých silách (Vitamin D3 Axonia® 1000 IU, 7000 IU, 30000 IU). Na trhu existuje i bohatá nabídka doplňků stravy s obsahem cholekalciferolu od několika set mezinárodních jednotek (IU) až po jednotky tisíců IU jako monokomponentní přípravky nebo jako součást multikomponentních/ multivitaminových preparátů a potravin pro zvláštní lékařské účely. Dále je zde několik látek obsahující přímo kalcitriol nebo jeho prekurzor alfakacidiol např. pro pacienty s těžkou renální insuficiencí neschopných transformovat kalcidiol na kalcitriol renálně. Vitamin D3 (cholekalciferol) je nejpřirozenější formou u většiny pacientů, protože tatáž forma vitaminu D se fyziologicky vytváří v kůži každého člověka při osvitu UV zářením. Syntetická schopnost kůže tvořit cholecalciferol však s věkem klesá a je závislá na množství denního slunečního osvitu, proto riziko hypovitaminózy vzrůstá zejména v zimním období1–3). Nedostatek vitaminu D se popisuje jako globální zdravotní problém, který je významný nejen u ortopedických pacientů4). Kromě jasně prokázané souvislosti osteoporózy a nízkoprahových zlomenin5–8) se ukázalo, že nedostatek vitaminu D ovlivňuje funkční výsledky i po jiných typech fraktur a ortopedických výkonech9, 10).
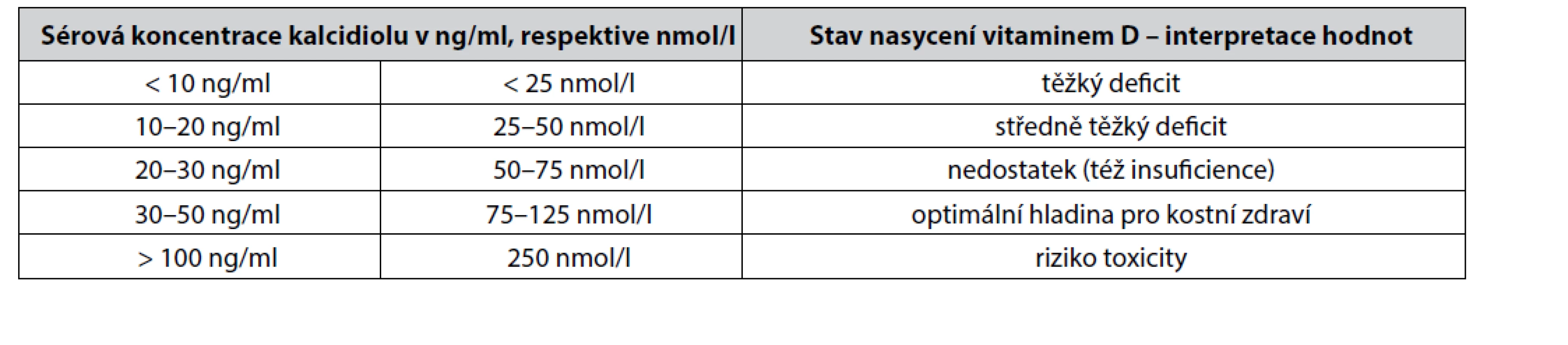
Stále běžným standardem pro laboratorní vyšetření množství zásob vitaminu D získaného ze všech zdrojů (sluneční záření, potrava) je stanovení sérové koncentrace kalcidiolu (25(OH)D). Dolní hranice pro normální hladinu 25(OH)D je odlišná v závislosti na geografické lokaci a sluneční expozici dané populace (rozmezí od 20 do 40 nmol/ml). Jednotlivé stupně deficitu vitaminu D podle hladiny kalcidiolu shrnuje tabulka 1. Kalcidiol však není nejideálnějším markerem pro posuzování celkového stavu množství vitaminu D v organismu. Optimálně by se vždy měly současně vyšetřovat koncentrace kalcidiolu i kalcitriolu, aby se odhalily i extrarenálně metabolizované zásoby kalcidiolu na kalcitriol. Součet obou koncentrací se potom označuje jako totální 25-OH-D koncentrace v séru. Ani tato hodnota však neodráží intracelulární zásoby různých forem vitaminu D uložených zejména v tukové tkáni. Biologický poločas cholecalciferolu v séru je cca 60 dní, biologický poločas kalcidiolu je cca 15–20 dní, biologický poločas kalcitriolu je 6–8 hodin. To znamená, že optimální frekvence měření obou hladin kalcidiolu i kalcitriolu je 2krát ročně (jaro, podzim)11).
Dopad hypovitaminózy vitaminu D na rozvoj osteoporózy
V rámci primární prevence zlomenin je zcela jasně prokázaný efekt suplementace cholecalciferolu u osteoporotických pacientů – nejen v důsledku zvýšení kostní denzity, ale i v důsledku jiných faktorů – např. prevence sarkopenie, zlepšení svalové síly, snížením rizika pádu zejména u geriatrických pacientů12).
Současné doporučené dávky cholecalciferolu pro prevenci hypovitaminózy nejen u ortopedických pacientů z Institutu Medicíny jsou 600–800 IU/den, v závislosti na věku nemocného a přítomnosti nebo nepřítomnosti základního onemocnění kostí13, 14). Takové dávkování je považováno za univerzální a nevyžaduje monitoraci hladin kalcidiolu a kalcitriolu. Mnoho odborníků však považuje tyto dávky za příliš nízké, proto doporučení např. Americké endokrinologické společnosti je 1500 IU/den15, 16). Další doporučení navrhují, aby minimální příjem vitaminu D pro dospělé byl 1000–2000 IU/den15, 17–19).
Aby se zabránilo opakovanému nedostatku vitaminu D anebo se udržovala přiměřená hladina u těch, kteří mají již dostatek vitaminu D, je nutné pokračovat v doplňování vitaminu D. Toho lze dosáhnout podáváním vitaminu D2 50 000 IU 2krát měsíčně nebo ekvivalent 1000–2000 IU/den, což je mnohými považováno za konzervativní doporučení20). Opatrnosti je třeba u podávání bolusů vysokých dávek vitaminu D, které byly spojeny se zvýšeným rizikem pádů21–23).
Dle databáze Uptodate se například doporučuje při hojení zlomenin rutinně doplňovat 1000 IU/den24).
Dopad hypovitaminózy vitaminu D na svalovou hmotu a sílu
Svalová síla je u ortopedických pacientů kriticky důležitá jednak v prevenci zlomenin vlivem pádů (viz dále) a jednak během pooperační rehabilitační fáze. S věkem spojená změna koncentrace různých růstových faktorů a hormonů hraje důležitou roli při ztrátě svalové hmoty a síly ve stáří (senilní sarkopenie). Jedním z těchto hormonů je právě kalcitriol, aktivní metabolit vitaminu D25–27).
Observační studie naznačují souvislost mezi nízkou koncentrací zásobního kalcidiolu (definovaným jako < 25 nebo < 50 nmol/l) a svalovou slabostí nejen u starších osob, ale i u dětí28–32). V randomizovaných studiích však nebyl jasně prokázán kauzální vztah mezi doplňováním vitaminu D a zlepšením svalové slabosti a rovněž není známa žádná korelace mezi optimální koncentrací 25(OH)D a vyváženou svalovou funkcí. Nejpravděpodobnější přínos v doplňování vitaminu D pro svalovou sílu je u pacientů s výchozími hladinami 25(OH)D pod 25 nmol/l33).
Asociace hypovitaminózy D s rizikem pádů
Pády se u starších osob vyskytují běžně a jsou hlavním faktorem ohrožujícím nezávislost starších osob. Stejně jako u mnoha geriatrických syndromů k pádům obvykle dochází, pokud zhoršení zdraví ve více orgánových soustavách naruší kompenzační schopnost jedince34).
Pády zvyšují riziko zlomeniny až 10krát u pacientů s osteopenií nebo osteoporózou35).
Pády jsou často bez klinické pozornosti z různých důvodů: Pacient se o události nikdy nezmíní poskytovateli zdravotní péče; v době pádu nedošlo k žádnému zranění; poskytovatel se nezeptá pacienta na anamnézu pádů nebo poskytovatel nebo pacient mylně věří, že pády jsou nevyhnutelnou součástí procesu stárnutí. Léčba zranění způsobených pádem často nezahrnuje vyšetřování příčiny pádu.
Přestože vliv vitaminu D na pády je značně kontroverzní, řadu faktorů (včetně tělesné kondice) a situací, které mohou zapříčinit riziko pádu, lze ovlivnit. Účinek vitaminu D na riziko pádů zůstává nejasný. Výsledky metaanalýz a randomizovaných studií se vzájemně rozporují, a to pravděpodobně souvisí s různými kritérii pro zařazení do studií, odlišnými výchozími hladinami kalcidiolu a různými dávkovacími režimy. Největší přínos doplňování vitaminu D pro svalovou sílu (a tedy prevenci pádu) se pravděpodobně vyskytuje u pacientů s výchozími hladinami 25(OH)D 25 nmol/l31, 32). Je však třeba vyvarovat se intermitentnímu podávání vysokých dávek vitaminu D (např. 500 000 mezinárodních jednotek ročně), protože takové dávkování může přechodně zvýšit riziko pádů22). To může platit i pro dávky vitaminu D (např. 60 000 mezinárodních jednotek měsíčně), které zvyšují sérové hladiny nad 125 nmol/l36).
Postavení vitaminu D u zlomenin
Co se týče primární prevence jakýchkoliv zlomenin, metaanalýza z roku 2019 ukázala, že ani intermitentní ani denní podávání standardních dávek samotného vitaminu D (400 000–30 000 IU) nebylo spojeno se sníženým rizikem zlomenin. Slibnější strategií byla denní suplementace jak vitaminem D (400–800 IU) spolu s vápníkem (1000–1200 mg), kde byl zaznamenán pokles všech zlomenin o 6 % a zlomenin pánve o 16 %37).
Kvalita a délka hojení kosti po fraktuře je samozřejmě nesmírně komplexní proces závisející na mnoha faktorech, zejména na rozsahu a typu zlomeniny, lokalizaci zlomeniny ve skeletu (hodně mechanicky namáhavá kost, méně namáhaná kost), konkrétním umístění lomné linie (diafyzární – méně osteoprogenitorních buněk, epifyzární a metafyzární – více osteoprogenitorních buněk, lépe prokrvené), věku pacienta, komorbiditách pacienta, způsobu ortopedické léčby atd.
Cílem dalších odstavců této stati je přehledně zmapovat postavení zejména vitaminu D v sekundární prevenci po zlomeninách kostí a vybraných nejčastějších ortopedických výkonech.
Pro účely tohoto článku jsme zlomeniny z pohledu významu sekundární prevence se vztahem k vitaminu D rozdělili na nízkotraumatické, vysokotraumatické a únavové (stresové). Dále je potřeba deklarovat, že se článek zabývá zlomeninami kompletními, tj. těmi, při kterých vznikají minimálně dva fragmenty (nejedná se o infrakci ani kostní fisuru).
Význam vitaminu D u nízkotraumatických zlomenin
Nízkotraumatické zlomeniny, rovněž nazývané jako nízkoprahové, jsou definovány jako fraktury způsobené pádem ne vyšším než z prostého stoje či ještě z nižší výšky. Jejich etiopatogeneze je vždy spojená s patologickou stavbou kosti, většinou s osteopenií nebo osteoporózou. Osteoporóza je onemocnění se sníženou kostní denzitou a narušenou mikroarchitektonikou kosti, což má za následek snížené mechanické napětí a zvýšení rizika následné fraktury, dokonce po minimálním traumatu38). Fraktury osteoporotické jsou tedy známkou tohoto onemocnění jak u žen, tak u mužů. Dle statistických podkladů více než 50 % žen po menopauze a 30 % mužů po věku 60 let utrpí tento druh zlomeniny39, 40). Pacienti s nízkoprahovými frakturami pak mají sklon k refrakturám až předčasné smrti41, 42). Ze statistických dat vyplývá, že pacienti (ženy i muži) s nízkoprahovou frakturou mají 2–3krát vyšší predispozici k další fraktuře43). V rámci sekundární prevence po těchto frakturách je vitamin D jednoznačně indikován, a to vždy spolu se suplementací vápníku a případně dalšími léčivy osteoporózy na základě osteodenzitometrického nálezu. Doetsch et al. uvádí úlohu doplňování vitaminu D a vápníku při léčbě pacientů s akutní zlomeninou proximálního humeru. Třicet žen s osteopenií nebo osteoporózou bylo randomizováno do dvou skupin: skupina s placebem a skupina s léčbou (přípravek s vápníkem 1000 mg a vitaminem D3 800 IU/den). V celkové době 12 týdnů byla nejvyšší hladina kostní denzity v okolí zlomeniny pozorována v 6. týdnu v léčené skupině oproti placebu, trend pak klesal44). Optimální dávkování vitaminu D je stejné jako u léčby osteoporózy samotné a liší se stupněm vstupního deficitu kalcidiolu. Pravidelné kontroly dosaženého terapeutického cíle kalcidiolu (70–100 nmol/l v plazmě by se měly realizovat vždy v půlročních intervalech, a to ideálně v jarních a podzimních měsících, kde nejsou přítomny extrémy v slunečním osvitu.
Kromě osteoporózy může být s rizikem nízkoprahové zlomeniny spojena i mnohem vzácnější Pagetova choroba kostí, známá také jako osteitis deformans, což je lokalizovaná porucha kostního metabolismu charakterizovaná zrychlenou remodelací kosti, která vede k přerůstání kosti na vybraných místech a narušení integrity postižené kosti. Hlavními klinickými projevy jsou bolest a deformity v postižených oblastech a zvýšené riziko zlomenin, ačkoliv mnoho pacientů je bez příznaků. Základ léčby představují bisfosfonáty, u nichž by měla být při zahájení léčby přítomna normální hladina 25(OH)D, vápníku a fosforu v séru. Spojení mezi stavem nasycení vitaminem D a rizikem zlomenin u pacientů s Pagetovou chorobou chybí.
Zatímco přístupy k doplňování vitaminu D se mohou lišit, praxe je taková, že lze podávat vitamin D, pokud je hladina kalcidiolu nižší než 75 nmol/l. U pacientů, jejichž hladina kalcidiolu je 50 nmol/l nebo méně, lze doporučit suplementaci vitaminem D (50 000 mezinárodních jednotek týdně) po dobu až 8 týdnů, přičemž je třeba zajistit monitoraci pro adekvátní nastavení hladiny kalcidiolu, vápníku a fosforu před zahájením intravenózní léčby bisfosfonáty. Vápník by měl být podáván v závislosti na příjmu potravy, s cílem dosáhnout 1200 mg elementárního vápníku denně, aby se zabránilo hypokalcemii45).
Význam vitaminu D u vysokotraumatických zlomenin
Nedávná metaanalýza uvedla, že ačkoliv velké procento pacientů se zlomeninami má hypovitaminózu D, neexistuje zatím dostatek literatury jednoznačně prokazující příznivé účinky jeho suplementace na zrychlení nebo zkvalitnění hojení zlomenin46). Nicméně samotná zlomenina může rozkolísat hladinu kalcidiolu. V prospektivní studii u 73 pacientů (věkový medián 38 let) se zlomeninou tibie a femuru, kteří měli při přijetí „normální“ hladinu kalcidiolu, byl pozorován 20% pokles koncentrací vitaminu D v séru po 1 týdnu od traumatu. Tento pokles nadále přetrvával a do konce 3. týdne průměrná sérová hladina vitaminu D v kohortě klesla do kategorie nedostatečnosti (< 75 nmol/l)47).
Míra hojení se značně liší podle věku pacienta, komorbidit a dalších faktorů, jako je hladina hormonů štítné žlázy a růstového hormonu, hladina kalcitoninu a stavu výživy. Mezi běžné stavy, které zhoršují hojení zlomenin, patří diabetes mellitus, arteriovaskulární onemocnění, anemie, hypotyreóza, podvýživa (např. nedostatek vitaminu C nebo D, nedostatečný příjem bílkovin), nadměrné chronické užívání alkoholu a užívání tabáku. Některé dlouhodobě podávané léky mohou také narušit hojení zlomenin. Mezi tato léčiva patří nesteroidní antiflogistika, glukokortikoidy a některá antibiotika zejména fluorochinolony a tetracykliny48, 49).
V roce 2019 byl publikován protokol studie VITA-Shock. Tato zaslepená, randomizovaná, placebem kontrolovaná studie probíhající již od roku 2016 by měla na 96 účastnících sledovat optimální dávkování vitaminu D u akutních zlomenin femuru a tibie50). Pevně věříme, že nám odpoví na otázku jak doplňovat vitamin D u vysokotraumatických zlomenin alespoň v těchto lokalizacích.
Význam vitaminu D u únavových zlomenin
Stresová (únavová) zlomenina (někdy též nazývána jako zlomenina z přetížení) nastává, když se zdravá (neinsuficientní) kost zlomí poté, co byla vystavena opakovanému namáhání v tahu nebo tlaku, přičemž žádný z těchto impulzů by nebyl dostatečně velký na to, aby způsobil selhání kosti (u osob bez známého onemocnění kostí). Stresové zlomeniny mohou být výsledkem malého počtu opakování s relativně velkou zátěží (např. voják pochodující několik hodin s těžkým batohem) nebo velkého počtu opakování s obvyklou zátěží (např. sportovec trénující na závod na dlouhé vzdálenosti) anebo kombinace zvýšené zátěže a zvýšeného počtu opakování. K únavové zlomenině dochází, když na kost působí normální napětí s normální pružnou odolností.
Insuficientní zlomenina je podtyp únavové zlomeniny u kostí s porušením pružné odolnosti. Nastává v případech, když je mechanická pevnost kosti snížena do bodu, kdy napětí, které by nezlomilo kost zdravou, zlomí slabou kost. Stav, který způsobuje sníženou pevnost kostí, se obvykle vyskytuje v celé kostře (např. osteoporóza, osteomalacie nebo osteogenesis imperfecta), nebo může být více lokalizován (např. demineralizace končetiny v důsledku imobility končetiny, kostní nádor) 51).
Jinými slovy, běžné stresové zlomeniny nastanou díky abnormálnímu svalovému přepětí na zdravou kost, zatímco zlomeniny insuficientní se objeví, když i normální svalová aktivita způsobí zlomeninu kosti, která je již oslabená52).
Ruohola et al. zaznamenali souvislost mezi nízkými hladinami kalcidiolu v séru a stresovou zlomeninou u 756 vojáků v přípravě s průměrným věkem 19 let. Po 90 dnech vojenského výcviku mělo 22 vojáků (2,9 %) stresové zlomeniny s incidencí 11,6 na 100 osobo-roků. Autoři zjistili, že nízká hladina séra kalcidiolu byla významným rizikovým faktorem stresových zlomenin53).
Ačkoliv důkazy podporující suplementaci vitaminu D a vápníku jsou omezené a vycházejí primárně ze studií prevence zlomenin, v průběhu léčby stresové zlomeniny doporučujeme užívat dodatečně denní dávku vápníku (1500 mg) a vitaminu D (800–2000 IU), která pomůže zajistit hojení zlomenin51).
Význam vitaminu D na tvorbu pakloubů
Po zlomenině dochází k hojení kosti ve třech mírně se překrývajících fázích: zánětlivá, reparativní a fáze remodelace54).
Pakloub je charakterizován jako porucha hojení zlomeniny (nesrůst), kdy nedochází ke kostěnému srůstu fragmentů ani za dobu dvojnásobnou v porovnání s normálním průběhem hojení. Nesrůst končetiny se může projevit pakloubem pevným (snese zatížení), nebo nepevným (nesnese zatížení). Paklouby nepevné se obvykle vyskytují s trvalou bolestí, otoky a instabilitou, zatímco pevné paklouby jsou často asymptoma - tické. Podle prokrvení se pak paklouby dělí na vitální (s tendencí k hojení) a avitální (bez tendence k dalšímu hojení). Ve většině případů jsou symptomatické paklouby léčeny repozicí a trvalou fixací. Vyšší riziko tvorby pakloubu je pozorováno u nízkoprahových zlomenin.
Několik studií prokázalo, že délka hojení zlomenin je ovlivňována řadou endokrinních a metabolických abnormalit, včetně nedostatku vitaminu D, což může mít za následek nesrůst kosti (tvorba pakloubu)55–57). I přes množství studií na zvířatech s nízkými hladinami kalcidiolu poukazujících na zlepšující se trend v hojení zlomenin nejsou prozatím k dispozici klinická data, která by toto potvrzovala. Nejbližší očekávaná data budou snad ze studie Vita-Shock (NCT02786498).
Postavení vitaminu D u totálních náhrad kloubů
Totální náhrada kloubu je zlatým standardem léčby u pacientů s těžkou symptomatickou osteoartrózou (OA) v poslední fázi, kteří nereagovali na nefarmakologickou, nebo farmakologickou léčbu a mají významné zhoršení kvality života kvůli OA58).
Přestože je výskyt osteoartrózy a osteoporózy nepřímo úměrný, vysoká prevalence obou poruch znamená, že je u osteoporotických jedinců běžné zvažovat totální artroplastiku kloubů59–61).
Vliv hypovitaminozy na životnost náhrady kloubu
Vliv hladiny kalcidiolu na životnost totální náhrady kolenního kloubu není dosud znám, nicméně studie z roku 2018 testovala, zda podávání 2000 IU cholecalciferolu denně v porovnání s 800 IU denně během 24 měsíců u pacientů nad 60 let má vliv na lepší rekonvalescenci po jednostranné totální náhradě kolene. Hodnotil se test rychlosti chůze, bolestivost kontralaterálního neoperovaného kolene, startovací obtíže ze sedu do stoje atd. Došlo se k závěru, že vyšší denní dávka 2000 IU nepřinesla lepší výsledky oproti dávce 800 IU/den, nicméně tato studie nebyla placebem kontrolována, takže není možné porovnat stav bez suplementace vitaminu D62).
Vliv hypovitaminozy na periprostetické zlomeniny
Periprostetická zlomenina (zlomenina v blízkosti implantátu) je pooperační komplikace s incidencí menší než 1 % po primární náhradě kyčelního kloubu (THA)63, 64). Periprostetické zlomeniny se nejčastěji vyskytují na femorální straně v místech oslabené kosti, například v blízkosti osteolytických lézí nebo v oblastech se zvýšením napětím v kosti (např. perforace kortikální kosti).
Sice neexistují žádné studie podporující přímou souvislost mezi nedostatkem vitaminu D a periprostetickými zlomeninami, nicméně vzhledem k vysoké koincidenci mezi osteoporózou a osteomalací a skutečnosti, že vitamin D ovlivňuje kvalitu kostí, by měli být všichni pacienti s celkovou artroplastikou kloubů se sníženou zásobou kostní hmoty suplementováni dostatečným množstvím vápníku a vitaminu D. Pokud je to možné, měl by být deficit vitaminu D vyřešen již před plánovaným chirurgickým výkonem65).
Vliv vitaminu D na hojení chirurgických ran po ortopedických výkonech
Existují dílčí důkazy o negativní korelací mezi nízkou hladinou vitaminu D a špatným hojením ran. A rovněž existují práce prokazující pozitivní vliv suplementace vitaminem D na hojení ran66–68). Nicméně větší randomizované studie, které by vedly k nějakým EBM důkazům, chybí.
Optimální dávkování cholekalciferolu u ortopedických pacientů
Určení velikosti dávky při známém deficitu kalcidiolu
Neexistuje konsenzus pro optimální hladinu 25(OH)D stran skeletálního i non-skeletálního zdraví, a dokonce ani pro toxickou hladinu 25(OH)D. Nejčastěji vedla ke snížení rizika zlomenin suplementace vitaminem D s dosažením hladin kalcidiolu od 70–100 nmol/l69–71). V jedné studii však bylo naopak vyšší riziko zlomenin u pacientů léčených jednorázově vysokou dávkou vitaminu D (500 000 IU jednou ročně), což vedlo k dlouhodobým koncentracím kalcidiolu v séru > 100 nmol/l22). Odborné společnosti (Národní nadace pro osteoporózu – NOF, Mezinárodní nadace pro osteoporózu – IOF, Americká geriatrická společnost – AGS) naznačují, že u starších dospělých je nutná minimální hladina 75 nmol/l, aby se minimalizovalo riziko pádů a zlomenin72 – 74).
Jak již bylo řečeno v úvodu, konsenzus pro optimální hladinu 25(OH)D stran skeletálního i non-skeletálního zdraví neexistuje. Optimální příjem vitaminu D by měl být nastaven monitorováním hladin 25(OH)D a parathormonu (PHT) v séru. Cílem je zabránit zvýšení PTH v séru, proto by měla být hladina 25(OH)D v séru udržována nad 80 nmol/l75, 76).
V literatuře a klinické praxi existuje velké množství různých doporučení jak suplementovat vitamin D, která se odchylují od schématu dávkování uvedeného v SmPC. Tato schémata shrnuje a posuzuje rozsáhlé německé systematické review z roku 2014, které hodnotilo různá dávkovací schémata od roku 1975 do roku 201377) celkem v 144 studiích na 11 500 pacientech po průměrnou dobu 274 dní, tedy 9 měsíců, a závěry jsou takové, že suplementace je závislá na pacientově hmotnosti a věku, a dávkovací schémata jsou např. tato:
• u 75 kg pacienta, 30 let věku, dávka 2520 IU/den zvýší za dobu 274 dní hodnotu kalcidiolu o 50 nmol/l (resp. z 25 na 75 nmol/l), což odpovídá celkové kumulativní dávce 690 480 IU vitaminu D (resp. 1380 kapkám), což je 38 kapek/týdně
• u 75 kg pacienta, 70 let věku, dávka 1460 IU/den zvýší za dobu 274 dní hodnotu kalcidiolu o 50 nmol/l (resp. z 25 na 75 nmol/l), což odpovídá celkové kumulativní dávce 400 040 IU vitaminu D (resp. 800 kapkám), což je 22 kapek/týdně
Na základě této studie docházíme k různým dávkovacích režimům při různých nálezech – koncentrace kalcidiolu v séru. Tyto výpočty sice nekalkulují s ročním obdobím a množstvím slunečního osvitu, ale na druhou stranu vycházejí z poměrně velkého souboru pacientů, kde se tato odchylka musela rovněž vyskytnout.
Pacienti s těžkým deficitem vitaminu D, resp. hladinou kalcidiolu v rozmezí 0–24 nmol/l by měli dostávat 2500 IU/den, a po ½ roce očekáváme u nich zvýšení hladiny kalcidiolu o cca 75 nmol/l.
Pacienti se středně těžkým deficitem vitaminu D, resp. hladinou kalcidiolu v rozmezí 25–49 nmol/l by měli dostávat 2000 IU/den a po ½ roce očekáváme u nich zvýšení hladiny kalcidiolu o cca 50 nmol/l.
Pacienti s lehkým nedostatkem vitaminu D, resp. hladinou kalcidiolu v rozmezí 50–75 nmol/l by měli dostávat 1000 IU/den a po ½ roce očekáváme u nich zvýšení hladiny kalcidiolu o cca 25 nmol/l.
Určení dávkovacího intervalu
Při porovnávání, zda podat vitamin D 1krát denně, 1krát týdně nebo 1krát měsíčně nebo 1krát ročně, vyšlo, že podání dílčích denních dávek pravidelně denně nebo podání kumulativní týdenní dávky 1krát týdně bylo srovnatelné. Už se však hůře suplementovali pacienti dávkou 1krát měsíčně a úplně nejhůř dopadla suplementace megadávkami 1krát ročně nebo půlročně78).
Shrnutí doporučených dávkovacích schémat ve vztahu k nejčastějším indikacím
Prevence hypovitaminózy vitaminu D: 500–1000 IU/den trvale bez nutnosti monitorace hladin kalcidiolu.
Léčba těžkého deficitu vitaminu D (kalcidiol pod 25nmol/l): 2500–3000 IU/den s monitorací hladin kalcidiolu vždy po ½ roce (ideálně na jaře a na podzim) do normalizace stavu (hladinu kalcidiolu nad 80 nmol/l), poté přechod na udržovací dávku 800–1000 IU/den trvale bez nutnosti další monitorace.
Léčba středně těžkého deficitu vitaminu D (kalcidiol 25–50 nmol/l): 1500–2000 IU/den s monitorací hladin kalcidiolu vždy po ½ roce (ideálně na jaře a na podzim) do normalizace stavu (hladinu kalcidiolu nad 80 nmol/l), poté přechod na udržovací dávku 800–1000 IU/den trvale bez nutnosti další monitorace.
Prevence osteoporózy: 1000–1500 IU/den spolu s vápníkem trvale bez nutnosti monitorace hladin kalcidiolu.
Léčba osteoporózy: obvykle 2000–3000 IU/den spolu s kalciem, před zahájením monitorace hladiny kalcidiolu a udržovat cílovou hladinu kalcidiolu nad 80 nmol/l.
Závěr
Role vitaminu D v ortopedické chirurgii zahrnuje kostní metabolismus a funkci svalů. Dostatek vitaminu D by měl zvýšit pevnost kostí, sílu svalů a snížit riziko pádu.
Vzhledem k vysoké prevalenci deficitu vitaminu D u pacientů v ortopedické chirurgii je důležitost vyšetření a následné léčby nezbytná, aby se zabránilo komplikacím, které vznikají z nízkých hladin vitaminu D. Edukace pacienta by měla směřovat do oblasti fyzikální terapie a životního stylu včetně výživy. Ačkoliv význam vitaminu D hraje v oblasti skeletálního zdraví svou roli, doposud není jednotný názor ani na optimální sérové koncentrace 25(OH)D ani na dávkování vitaminu D jak v primární, tak v sekundární prevenci v ortopedické chirurgii, tedy i stavech po zlomeninách kostí. Budoucí výzkum v této oblasti je proto oprávněný.
Jedinou oprávněnou indikací pro nasazení vitaminu D v sekundární prevenci zůstávají nízkoprahové fraktury, kde se sekundární prevence překrývá s prevencí nebo léčbou osteopenie nebo osteoporózy.
Zbývá však několik důležitých indikací pro nasazení vitaminu D do medikace pacienta a těmi jsou prevence hypovitaminózy D, léčba těžkého deficitu vitaminu D (kalcidiol pod 25 nmol/l), léčba středně těžkého deficitu vitaminu D (kalcidiol 25–50 nmol/l), vitamin D jako součást prevence a léčby osteoporózy.
Aktuální doporučení na základě Medicíny založené na důkazech
1. Depistáž, prevence a případně léčba středně a těžké karence vitaminu D u všech ortopedických pacientů s frakturami a totálními náhradami kloubů
a) Doporučuje se zmonitorovat hladinu kalcidiolu i kalcitriolu u pacientů s rizikovými faktory, jenž mohou vést ke karenci vitaminu D, u pacientů, kteří nejsou současně léčeni nějakou formou vitaminu D.
Rizikové faktory karence vitaminu D: věk nad 75 let, pacienti s tmavou pigmentací kůže, těhotenství zejména u obézních žen, malabsorbční syndromy, malnutrice, jaterní cirhóza, pacient masivně používající sluneční UV blokátory na pokožku – např. pacienti s melanomem kůže i v rodinné anamnéze, hypoparatyreoidismus, používání některých antiepileptik – zejména karbamazepinu a fenytoinu, nefrotický syndrom, vzácné receptorové poruchy na VD receptoru a poruchy metabolismu vitaminu D.
Podle výsledku laboratorního a klinického nálezu pak rozhodnout, zda pacienta suplementovat/nesuplementovat cholecalciferolem nebo např. kalcitriolem (pacienti s renálním selháním po dohodě s nefrologem). Suplementovat by se měly osoby s karencí vitaminu D pod 50 nmol/l, a to dle schémat uvedených výše.
b) U všech ostatních pacientů se doporučuje začít podávat cholekalciferol v preventivní dávce 1000 IU/den jako součást primární prevence nedostatku vitaminu D. Kalcium lze přidat pouze na přechodnou dobu aktivního hojení kosti.
2. Depistáž, prevence a případně léčba osteoporózy u všech ortopedických pacientů s frakturami a náhradami kloubů
a) Všechny ortopedické pacienty s rizikovými faktory osteoporózy se doporučuje odeslat ke vstupnímu komplexnímu osteologickému dovyšetření, pokud tito již nejsou pro osteoporózu léčeni (často nutné aktivně pátrat v osobní anamnéze).
Rizikové faktory osteoporózy: věk nad 75 let, nízký BMI pacienta, stav po menopauze/adnexotomii u žen, pacienti s nízkotraumatickými frakturami.
Léčbu osteoporózy má řídit komplexně ortoped ve spolupráci s osteologem, endokrinologem nebo klinickým biochemikem. Vitamin D a kalcium jsou zpravidla součástí farmakoterapie spolu s dalšími léčivy. Jejich použití je závislé na individuálním posouzení u každého pacienta. Vždy je nutné dovyšetřit i ostatní osteotropní markery jako parathormon, sérové kalcium, fosfáty a další.
b) Po dobu čekání na vyšetření osteologem lze začít podávat cholekalciferol v preventivní dávce 600–800 IU/den spolu s kalciem 500–1000 mg/den jako součást primární prevence osteoporózy.
Střet zájmů: žádný.
Práce byla podpořena MZ ČR – RVO (NNH, 00024883).
Došlo 5. června 2021 / Přijato 6. července 2021
Mgr. Michal Čečrle
Farmakologický ústav, 1. lékařská fakulta Univerzity Karlovy
Albertov 4, 128 00 Praha 2
e-mail: cecrle.michal@seznam.cz
Oddělení klinické farmacie, Nemocnice Na Homolce, Praha
Oddělení klinické farmacie, Lékárna Nemocnice Hořovice
N. Didič
Oddělení ortopedie a traumatologie, Nemocnice Rudolfa a Stefanie,
a.s., Benešov
M. Halačová
Oddělení klinické farmacie, Nemocnice Na Homolce, Praha
Ústav farmakologie, 2. lékařská fakulta Univerzity Karlovy, Praha
D. Černý
Farmakologický ústav, 1. lékařská fakulta Univerzity Karlovy, Praha
Oddělení ortopedie a traumatologie, Nemocnice Rudolfa a Stefanie,
a.s., Benešov
Oddělení klinické farmacie, Nemocnice Na Homolce, Praha
Sources
1. Tsai K. S., Wahner H. W., Offord K. P., Melton L. J. 3rd, Kumar R., Riggs B. L. Effect of aging on vitamin D stores and bone density in women. Calcif. Tissue Int. 1987; 40(5), 241–243.
2. Webb A. R., Kline L., Holick M. F. Influence of season and latitude on the cutaneous synthesis of vitamin D3: exposure to winter sunlight in Boston and Edmonton will not promote vitamin D3 synthesis in human skin. J. Clin. Endocrinol. Metab. 1988; 67(2), 373–378.
3. MacLaughlin J., Holick M. F. Aging decreases the capacity of human skin to produce vitamin D3. J. Clin. Invest. 1985; 76(4), 1536–1538.
4. Mithal A., Wahl D. A., Bonjour J. P., Burckhardt P., Dawson-Hughes B., Eisman J. A., El-Hajj Fuleihan G., Josse R. G., Lips P., Morales-Torres J., Group IOFCo - SANW. Global vitamin D status and determinants of hypovitaminosis D. Osteoporos. Int. 2009; 20, 1807–1820.
5. Bischoff-Ferrari H. A., Willett W. C., Wong J. B., Giovannucci E., Dietrich T., Dawson-Hughes B. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials. JAMA 2005; 293(18), 2257–2264.
6. Diamond T., Smerdely P., Kormas N., Sekel R., Vu T., Day P. Hip fracture in elderly men: the importance of subclinical vitamin D deficiency and hypogonadism. Med. J. Aust. 1998; 169(3), 138–141.
7. Grant A. M., Avenell A., Campbell M. K., McDonald A. M., MacLennan G. S., McPherson G. C., Anderson F. H., Cooper C., Francis R. M., Donaldson C., Gillespie W. J., Robinson C. M., Torgerson D. J., Wallace W. A. & RECORD Trial Group. Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium Or vitamin D, RECORD): a randomised placebo-controlled trial. Lancet 2005; 365(9471), 1621–1628.
8. Jackson R. D., LaCroix A. Z., Gass M., Wallace R. B., Robbins J., Lewis C. E., Bassford T., Beresford S. A., Black H. R., Blanchette P., Bonds D. E., Brunner R. L., Brzyski R. G., Caan B., Cauley J. A., Chlebowski R. T., Cummings S. R., Granek I., Hays J., Heiss G., … Women’s Health Initiative Investigators. Calcium plus vitamin D supplementation and the risk of fractures. N. Engl. J. Med. 2006; 354(7), 669–683.
9. Rubinovitch M., Said S. E., Glorieux F. H.., Cruess R. L., Rogala E. Principles and results of corrective lower limb osteotomies for patients with vitamin D-resistant hypophosphatemic rickets. Clin. Orthop. Relat. Res. 1988; 237, 264–270.
10. Oh J. H., Kim S. H., Kim J. H., Shin Y. H., Yoon J. P., Oh C. H. The level of vitamin D in the serum correlates with fatty degeneration of the muscles of the rotator cuff. J. Bone Joint Surg. Br. 2009; 91(12), 1587–1593.
11. Jones G. Why dialysis patients need combination therapy with both cholecalciferol and a calcitriol analogs. Semin. Dial. 2010; 23(3), 239–243.
12. Robinson S. M., Reginster J. Y., Rizzoli R., Shaw S. C., Kanis J. A., Bautmans I., Bischoff-Ferrari H., Bruyère O., Cesari M., Dawson-Hughes B., Fielding R. A., Kaufman J. M., Landi F., Malafarina V., Rolland Y., van Loon L. J., Vellas B., Visser M., Cooper C. & ESCEO working group. Does nutrition play a role in the prevention and management of sarcopenia? Clinical nutrition 2018; 37(4), 1121–1132.
13. Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium, Ross, A. C., Taylor, C. L., Yaktine, A. L.,& Del Valle, H. B. (Eds.). Dietary Reference Intakes for Calcium and Vitamin D. National Academies Press (US) 2011.
14. Rosen C. J., Gallagher J. C. The 2011 IOM report on vitamin D and calcium requirements for north america: clinical implications for providers treating patients with low bone mineral density. J. Clin. Densitom. 2011; 14(2), 79–84.
15. Holick M. F., Binkley N. C., Bischoff-Ferrari H. A., Gordon C. M., Hanley D. A., Heaney R. P., Murad M. H., Weaver C. M., Endocrine Society. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011; 96(7), 1911–1930.
16. Gehrig L. M., Collinge C., Kaufman J., Lane J. M., O’Connor M. I., Tosi L. L. Osteoporosis: management and densitometry for orthopaedic surgeons. Instr. Course Lect. 2009; 58, 805–815.
17. Holick M. F. Optimal vitamin D status for the prevention and treatment of osteoporosis. Drugs Aging. 2007; 24(12), 1017–1029.
18. Heaney R. P., Davies K. M., Chen T. C., Holick M. F., Barger - Lux M. J. Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol [published correction appears in Am J Clin Nutr. 2003; 78(5), 1047]. Am. J. Clin. Nutr. 2003; 77(1), 204–210.
19. Tangpricha V., Koutkia P., Rieke S. M., Chen T. C., Perez A. A., Holick M. F. Fortification of orange juice with vitamin D: a novel approach for enhancing vitamin D nutritional health. Am. J. Clin. Nutr. 2003; 77(6), 1478–1483.
20. Vieth R. Vitamin D toxicity, policy, and science. J. Bone Miner. Res. 2007; 22(Suppl 2), V64–V68.
21. Sanders K., Seibel M. New findings on vitamin D3 supplementation and falls — when more is perhaps not better. Nat. Rev. Endocrinol. 2016; 12, 190–191.
22. Sanders K. M., Stuart A. L., Williamson E. J., Simpson J. A., Kotowicz M. A., Young D., Nicholson G. C. Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. JAMA 2010; 303(18), 1815–1822.
23. Gallagher J. C. Vitamin D and falls – the dosage conundrum. Nat. Rev. Endocrinol. 2016; 12(11), 680–684.
24. Beutler A. General principles of definitive fracture management. UpToDate 2019. General principles of definitive fracture management – UpToDate (cuni.cz).
25. Aniansson A., Hedberg M., Henning G. B., Grimby G. Muscle morphology, enzymatic activity, and muscle strength in elderly men: a follow-up study. Muscle Nerve 1986; 9(7), 585–591.
26. Hurley B. F. Age, gender, and muscular strength. J. Gerontol. A Biol. Sci. Med. Sci. 1995; 50(Spec No), 41–44.
27. Lexell J. Human aging, muscle mass, and fiber type composition. J. Gerontol. A Biol. Sci. Med. Sci. 1995; 50(Spec No), 11–16.
28. Plotnikoff G. A, Quigley J. M. Prevalence of severe hypovitaminosis D in patients with persistent, nonspecific musculoskeletal pain. Mayo. Clin. Proc. 2003; 78(12), 1463–1470.
29. Glerup H., Mikkelsen K., Poulsen L., Hass E., Overbeck S., Andersen H., Charles P., Eriksen E. F. Hypovitaminosis D myopathy without biochemical signs of osteomalacic bone involvement. Calcif. Tissue Int. 2000; 66(6), 419–424.
30. Bischoff-Ferrari H. A., Dietrich T., Orav E. J., Hu F. B., Zhang Y., Karlson E. W., Dawson-Hughes B. Higher 25-hydroxyvitamin D concentrations are associated with better lower-extremity function in both active and inactive persons aged > or =60 y. Am. J. Clin. Nutr. 2004; 80(3), 752–758.
31. Visser M., Deeg D. J., Lips P. Longitudinal Aging Study Amsterdam. Low vitamin D and high parathyroid hormone levels as determinants of loss of muscle strength and muscle mass (sarcopenia): the Longitudinal Aging Study Amsterdam. J. Clin. Endocrinol. Metab. 2003; 88(12), 5766–5772.
32. Wicherts I. S., van Schoor N. M., Boeke A. J., Visser M., Deeg D. J., Smit J., Knol D. L., Lips P. Vitamin D status predicts physical performance and its decline in older persons. J. Clin. Endocrinol. Metab. 2007; 92(6), 2058 – 2065.
33. Buillon R. Vitamin D and extraskeletal health. UpToDate. 2012. https://www-uptodate-com.ezproxy.is.cuni.cz/ contents/vitamin-d-and-extraskeletal-health?search= - vitamin%20d%20muscle&source=search_result&selectedTitle= 1~150&usage_type=default&display_rank =1#H651640
34. Tinetti M. E., Inouye S. K., Gill T. M., Doucette J. T. Shared risk factors for falls, incontinence, and functional dependence. Unifying the approach to geriatric syndromes. JAMA 1995; 273(17), 1348–1353.
35. Geusens P., Autier P., Boonen S., Vanhoof J., Declerck K., Raus J. The relationship among history of falls, osteoporosis, and fractures in postmenopausal women. Arch. Phys. Med. Rehabil. 2002; 83(7), 903–906.
36. Bischoff-Ferrari H. A., Dawson-Hughes B., Orav E. J., Staehelin H. B., Meyer O. W., Theiler R., Dick W., Willett W. C., Egli A. Monthly High-Dose Vitamin D Treatment for the Prevention of Functional Decline: A Randomized Clinical Trial. JAMA Intern. Med. 2016; 176(2), 175–183.
37. Yao P., Bennett D., Mafham M., Lin X., Chen Z., Armitage J., Clarke R. Vitamin D and Calcium for the Prevention of Fracture: A Systematic Review and Meta-analysis. JAMA Netw. Open. 2019; 2(12), e1917789.
38. World Health Organization. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study group Geneva: WHO, 1994 (Technical report Series 843). In: Osteoporosis prevention, diagnosis and therapy. JAMA 2001; 285, 785–795.
39. Kanis J. A., Johnell O., Aea O. Long-term risk of osteoporotic fracture in Malmö. Osteoporos. Int. 2000; 11(8), 669–674.
40. Nguyen N. D., Ahlborg H. G., Center J. R., Eisman J. A., Nguyen T. V. Residual lifetime risk of fractures in women and men. J. Bone Miner. Res. 2007; 22(6), 781–788.
41. Bliuc D., Nguyen N. D., Milch V. E., Nguyen T. V., Eisman J. A., Center J. R. Mortality risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. JAMA 2009; 301(5), 513–521.
42. Center J. R., Nguyen T. V., Schneider D., Sambrook P. N., Eisman J. A. Mortality after all major types of osteoporotic fracture in men and women: an observational study. Lancet 1999; 353(9156), 878–882.
43. Langsetmo L., Goltzman D., Kovacs C. S., Adachi J. D., Hanley D. A., Kreiger N., Josse R., Papaioannou A., Olszynski W. P., Jamal S. A. & CaMos Research Group. Repeat low-trauma fractures occur frequently among men and women who have osteopenic BMD. J. Bone Miner. Res. 2009; 24(9), 1515–1522.
44. Doetsch A. M., Faber J., Lynnerup N., Wätjen I., Bliddal H., Danneskiold-Samsøe B. The effect of calcium and vitamin D3 supplementation on the healing of the proximal humerus fracture: a randomized placebo-controlled study. Calcif. Tissue Int. 2004; 75(3), 183–188.
45. Julia F. C. Treatment of Paget disease of bone. UpTo - Date 2020; https://www.uptodate.com/contents/treatment - of-paget-disease-of-bone?search=paget%20 disease%20vitamin%20d&source=search_result&selectedTitle= 2~150&usage_type=default&display_rank=2
46. Sprague S., Petrisor B., Scott T., Devji T., Phillips M., Spurr H., Bhandari M., Slobogean G. P. What Is the Role of Vitamin D Supplementation in Acute Fracture Patients? A Systematic Review and Meta-Analysis of the Prevalence of Hypovitaminosis D and Supplementation Efficacy. J. Orthop. Trauma. 2016; 30(2), 53–63.
47. Ettehad H., Mirbolook A., Mohammadi F., Mousavi M., Ebrahimi H., Shirangi A. Changes in the serum level of vitamin d during healing of tibial and femoral shaft fractures. Trauma Mon. 2014; 19(1), e10946.
48. Jones E. T. Skeletal growth and development as related to trauma. In: Green N. E., Swiontkowski M. F. (eds.) Skeletal Trauma in Children, 3rd ed. Philadelphia: Saunders 2003.
49. Gaston M. S, Simpson A. H. Inhibition of fracture healing. J. Bone Joint Surg. Br. 2007; 89, 1553.
50. Sprague S., Bzovsky S., Connelly D., Thabane L., Adachi J. D., Slobogean G. P. Study protocol: design and rationale for an exploratory phase II randomized controlled trial to determine optimal vitamin D3 supplementation strategies for acute fracture healing. Pilot Feasibility Stud. 2019; 5, 135.
51. deWeber K. Overview of stress fractures. UpToDate 2020. https://www-uptodate-com.ezproxy.is.cuni. cz/contents/overview-of-stres s-fractures?search= - stress%20fracture&source=search_result&selected - Title=1~140&usage_type=default&display_rank=1
52. Court-Brown C. M. Fractures of the tibia and fibula. In: Rockwood C. A., Bucholz R. W., Green D. P. (eds.) Rockwood and Green’s fractures in adults. Philadelphia: Lippincott Williams and Wilkins 2006; 2079–2046.
53. Ruohola J. P., Laaksi I., Ylikomi T., Haataja R., Mattila V. M., Sahi T., Tuohimaa P., Pihlajamäki H. Association between serum 25(OH)D concentrations and bone stress fractures in Finnish young men. J. Bone Miner. Res. 2006; 21(9), 1483–1488.
54. Wilkins K. E. Principles of fracture remodeling in children. Injury. 2005; 36(Suppl 1), A3–A11.
55. de Francisco A. L. Medical therapy of secondary hyperparathyroidism in chronic kidney disease: old and new drugs. Expert. Opin. Pharmacother. 2006; 7(16), 2215 – 2224.
56. Lancourt J. E., Hochberg F. Delayed fracture healing in primary hyperparathyroidism. Clin. Orthop. Relat. Res. 1977; (124), 214–218.
57. Brinker M. R., O’Connor D .P., Monla Y. T., Earthman T. P. Metabolic and endocrine abnormalities in patients with nonunions. J. Orthop. Trauma 2007; 21(8), 557–570.
58. Mandl L. A. Determining who should be referred for total hip and knee replacements. Nat. Rev. Rheumatol. 2013; 9(6), 351–357.
59. Cherubino P., Ratti C., Fagetti A., Binda T. Total hip arthroplasty and bone fragility. Aging. Clin. Exp. Res. 2011; 23(2 Suppl), 76–77.
60. Spinarelli A., Petrera M., Vicenti G., Pesce V., Patella V. Total knee arthroplasty in elderly osteoporotic patients. Aging. Clin. Exp. Res. 2011; 23(2 Suppl), 78–80.
61. Mäkinen T. J., Alm J. J., Laine H., Svedström E., Aro H. T. The incidence of osteopenia and osteoporosis in women with hip osteoarthritis scheduled for cementless total joint replacement. Bone 2007; 40(4), 1041–1047.
62. Bischoff-Ferrari H. A., Orav E. J., Egli A., Dawson-Hughes B., Fischer K., Staehelin H. B., Rizzoli R., Hodler J., von Eckardstein A., Freystaetter G., Meyer U., Guggi T., Burckhardt P., Schietzel S., Chocano-Bedoya P., Theiler R., Willett W. C., Felson D. Recovery after unilateral knee replacement due to severe osteoarthritis and progression in the contralateral knee: a randomised clinical trial comparing daily 2000 IU versus 800 IU vitamin D. RMD Open 2018; 4(2), e000678.
63. Berry D. J. Epidemiology: hip and knee. Orthop. Clin. North. Am. 1999; 30(2), 183–190.
64. Della Rocca G. J., Leung K. S., Pape H. C. Periprosthetic fractures: epidemiology and future projections. J. Orthop. Trauma 2011; 25(Suppl 2), S66–S70.
65. Unnanuntana A., Dvorzhinskiy A., Rebolledo B.J., Doyle S. M., Andreopoulou P., Lane J. M. The role of vitamin D in Orthopedic Surgery. In: Feldman, D., Pike, J. W., Bouillon, R., Giovannucci, E., Goltzman, E., Hewison, M. eds. Vitamin D, 4th ed. London: Elsevier 2018.
66. Burkiewicz C. J., Guadagnin F. A., Skare T. L., do Nascimento M. M., Servin S. C., de Souza G. D. Vitamin D and skin repair: a prospective, double-blind and placebo controlled study in the healing of leg ulcers. Rev. Col. Bras. Cir. 2012; 39(5), 401–407.
67. MacKay D., Miller A. L. Nutritional support for wound healing. Altern. Med. Rev. 2003; 8(4), 359–377.
68. Colins N. Vitamin D is a hot topic. Does it have a role in wound healing? Adv. Skin Wound Care 2011; 24 (11), 498.
69. Dawson-Hughes B., Harris SS, Krall E. A., Dallal G. E. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N. Engl. J. Med. 1997; 337(10), 670–676.
70. Chapuy M. C., Pamphile R., Paris E., Kempf C., Schlichting M., Arnaud S., Garnero P., Meunier P. J. Combined calcium and vitamin D3 supplementation in elderly women: confirmation of reversal of secondary hyperparathyroidism and hip fracture risk: the Decalyos II study. Osteoporos. Int. 2002; 13(3), 257–264.
71. Trivedi D. P., Doll R., Khaw K. T. Effect of four monthly oral vitamin D3 (cholecalciferol) supplementation on fractures and mortality in men and women living in the community: randomised double blind controlled trial. BMJ 2003; 326(7387), 469.
72. Vieth R. What is the optimal vitamin D status for health? Prog. Biophys. Mol. Biol. 2006; 92(1), 26–32.
73. Dawson-Hughes B., Mithal A., Bonjour J. P., Boonen S., Burckhardt P., Fuleihan G. E., Josse R. G., Lips P., Morales-Torres J., Yoshimura N. IOF position statement: vitamin D recommendations for older adults. Osteoporos. Int. 2010; 21(7), 1151–1154.
74. American Geriatrics Society Workgroup on Vitamin D Supplementation for Older Adults. Recommendations abstracted from the American Geriatrics Society Consensus Statement on vitamin D for Prevention of Falls and Their Consequences. J. Am. Geriatr. Soc. 2014; 62(1), 147–152.
75. Hollis B. W. Circulating 25-hydroxyvitamin D levels indicative of vitamin D sufficiency: implications for establishing a new effective dietary intake recommendation for vitamin D. J. Nutr. 2005; 135(2), 317–322.
76. Hollis B. W., Wagner C. L. Normal serum vitamin D levels. N. Engl. J. Med. 2005; 352(5), 515–516.
77. Zittermann A., Ernst J. B., Gummert J. F., Börgermann J. Vitamin D supplementation, body weight and human serum 25-hydroxyvitamin D response: a systematic review. European journal of nutrition 2014; 53(2), 367–374.
78. Haines S. T., Park S. K. Vitamin D supplementation: what’s known, what to do, and what’s needed. Pharmacotherapy 2012; 32(4), 354–382.
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2021 Issue 4
-
All articles in this issue
- Specifický charakter léčiv a hodnota léčiv
- Postavení vitaminu D v primární a sekundární prevenci u ortopedických pacientů
- 68Ga-DOTATOC
- Farmaceutické špecifiká v latinskej dizertačnej tlači De phthisi (O tuberkulóze) z roku 1679 od slovenského lekára Matúša Palumbiniho
- Česká farmacie 150 let pod křídly odborné společnosti
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- About the journal
Most read in this issue
- 68Ga-DOTATOC
- Postavení vitaminu D v primární a sekundární prevenci u ortopedických pacientů
- Specifický charakter léčiv a hodnota léčiv
- Farmaceutické špecifiká v latinskej dizertačnej tlači De phthisi (O tuberkulóze) z roku 1679 od slovenského lekára Matúša Palumbiniho
