Věkem podmíněná makulární degenerace
Age-related macular degeneration
Age-related macular degeneration (AMD) is the most common cause of vision loss in developed countries in people older than 55 years. The wet form of this disease is the cause of severe vision impairment in 90 percent of patients. AMD develops as a result of an interaction between genetic and lifestyle factors. The key mechanism in the development of wet AMD is the growth of new vessels, stimulated by the vascular endothelial growth factor (VEGF). The treatment of choice is, therefore, the use of anti-VEGF agents administered as intravitreal injections. International clinical studies are evaluating new AMD treatments. It is necessary to start the treatment early, before severe visual impairment occurs.
Key words:
age-related macular degeneration – anti-VEGF – Avastin
Authors:
I. Fišer
Authors‘ workplace:
EVROPSKÁ OČNÍ KLINIKA LEXUM, PRAHA
4
Published in:
Čes Ger Rev 2010; 8(1-2): 33-39
Overview
Věkem podmíněná makulární degenerace (VPMD) je v rozvinutých zemích nejčastější příčinou ztráty zraku lidí starších 55 let. Vlhká forma této choroby je příčinou těžké ztráty zraku u 90% postižených. VPMD vzniká spolupůsobením genetických faktorů a faktorů životního stylu. Klíčovým mechanizmem vzniku vlhké formy VPMD je novotvorba cév, stimulovaná růstovým faktorem VEGF. Léčbou volby VPMD jsou proto preparáty antiVEGF, podávané formou injekcí do sklivce. V mezinárodních studiích jsou zkoumány nové léky na VPMD. Léčbu je třeba zahájit včas, dokud není vážně postižena zraková ostrost.
Klíčová slova:
věkem podmíněná makulární degenerace – antiVEGF – Avastin
Definice VPMD
Věkem podmíněná makulární degenerace (VPMD), dříve nazývaná senilní makulární degenerací (SMD), je oční onemocnění, které je v rozvinutých zemích nejčastější příčinou ztráty zraku lidí starších 55 let [1]. Postihuje centrální část oční sítnice, kterou nazýváme žlutá skvrna neboli macula lutea, zkráceně makula. Tato oblast sítnice nám umožňuje rozeznávat detaily, tedy číst, rozeznávat obličeje, řídit auto apod.
VPMD má dvě formy, suchou a vlhkou (obr. 1, 2). Vlhká forma, nazývaná též neovaskulární či exsudativní, je agresivnější a má dramatičtější průběh; představuje sice jen 10% případů VPMD, ale působí 90% těžké ztráty zraku. Suchá forma VPMD, nazývaná též jako atrofická, je přítomna u 90% případů VPMD, ale pouze u 10% nemocných působí závažnější ztrátu zraku [3].
Projevy VPMD
Žlutá skvrna – makula nám poskytuje ostré vidění detailů, proto pacienti při jejím onemocnění ztrácejí schopnost číst, poznávat tváře, tvary vnímají pokřiveně, přestávají rozeznávat barvy, nakonec nedokážou přečíst ani titulky v novinách nebo sledovat televizi, nemohou řídit auto, v pokročilých stadiích se ani nedokážou orientovat a samostatně pohybovat, nakupovat apod. Postižení ztrácejí nezávislost a samostatnost, jsou odkázáni na pomoc okolí, nastává praktická slepota. Choroba má následky i v psychické oblasti, nemocní jsou zklamaní, nešťastní, cítí se být na obtíž, dostávají se do izolace, ztrácejí sebevědomí, až 32% z nich trpí depresemi. Ztráta zraku se podílí na zvýšené úrazovosti; až 50% zlomenin ve stáří je způsobeno zhoršeným viděním. Je pochopitelné, že VPMD má závažné důsledky i ve sféře ekonomické: ztráta zrakové ostrosti vede ke snížené produktivitě práce, je častým důvodem invalidního důchodu a sociální péče, zvyšuje náklady na optické i jiné kompenzační pomůcky pro nevidomé.
Epidemiologie VPMD
Věkem podmíněnou makulární degenerací je podle některých epidemiologických studií postiženo 0,3 % bílé populace ve věku od 50 do 59 let, avšak až 16 % obyvatel starších 80 let [3]. Celosvětová incidence VPMD je 50 000 nových případů ročně; podle ní lze odhadovat počet nových pacientů v ČR asi na 1 000 ročně. Jelikož průměrná délka života populace narůstá, nepříznivý vliv této choroby na obyvatelstvo se bude v příštích desetiletích dramaticky zvyšovat. Během následujících 25 let se počet nemocných podle odhadů ztrojnásobí [2]. Vzhledem k „šedivějící“ populaci v naší zemi se tato skutečnost stává velmi závažným sociálním a ekonomickým problémem.
Rizikové faktory vzniku VPMD
Na rozdíl od dříve tradovaných tvrzení, že VPMD je závislá na barvě duhovky, barvě vlasů a slunečním záření, podle nových výzkumů se tyto teorie nepotvrdily [5]. Jako zjevná rizika však byly identifikovány různé další faktory: věk, rasa, genetické vlivy, kouření cigaret, stravovací návyky a tělesná aktivita.
Věk je jedním z hlavních faktorů vzniku VPMD. Podle analýz výsledků různých studií (Beaver Dam Eye Study, Rotterdam Eye Study a Blue Mountain Eye Study) byl prokázán silný vliv věku na VPMD: prevalence VPMD je 0,2% ve věku 55–64 let, avšak až 13% ve věku přes 85 let [6]. Bílá rasa je více postižena VPMD než ostatní rasy. Riziko postižení VPMD zvyšuje rovněž genetická zátěž. Místem, na němž dochází ke genetickým odchylkám, vedoucím k VPMD, je dlouhé raménko chromozomu 1 (1q31). Různé výzkumy potvrdily, že polymorfizmus genu CFH pro faktor komplementu H (complement factor H) odpovídá za 20–50% rizika vzniku VPMD [7]. Studie AREDS (AgeRelated Eye Disease Study) prokázala, že existuje přímá souvislost mezi kouřením cigaret a VPMD [8]. Delší doba kouření je spojena s vyšším rizikem VPMD a umění přestat kouřit snižuje toto riziko, přičemž osoby, které nekouřily 20 let, měly stejně nízké riziko jako nekuřáci a naopak pasivní kouření toto riziko zvyšuje. Množství určitých tuků v potravě (např. másla) je úměrné riziku pokročilé VPMD, zatímco omega-3 nenasycené mastné kyseliny (obsažené např. v olivovém oleji) a konzumace ryb (nikoli však ryb smažených, které naopak riziko zvyšují) jsou spojeny s nižším rizikem VPMD. V preventivní dietě dále hrají důležitou úlohu ovoce, karotenoidy a zelená listová zelenina [8]. Osoby, v jejichž stravě jsou bohatě zastoupeny vitamin E a zinek, mají menší riziko VPMD. Kombinace vitaminu C a E, beta karotenu a zinku vede k 35% snížení rizika VPMD. Studie AREDS rovněž prokázala riziko VPMD narůstající se vzrůstajícím indexem tělesné hmotnosti (body mass index – BMI) a s hypertenzí [9–11]. Alarmující je, že pacienti s VPMD mají rovněž dvojnásobné riziko úmrtí na infarkt myokardu a mozkovou mrtvici.
Společným závěrem uvedených studií je, že VPMD je zřejmě chorobou, při jejímž vzniku spolupůsobí vrozené faktory genetické s faktory životního prostředí a životního stylu, které můžeme způsobem života výrazně ovlivnit. Pacienti s rizikem VPMD by tudíž měli jíst více ovoce, zeleniny a ryb, měli by dbát na tělesnou aktivitu a dobře kompenzovat svůj krevní tlak a ostatní kardiovaskulární rizikové faktory.
Etiopatogeneze VPMD
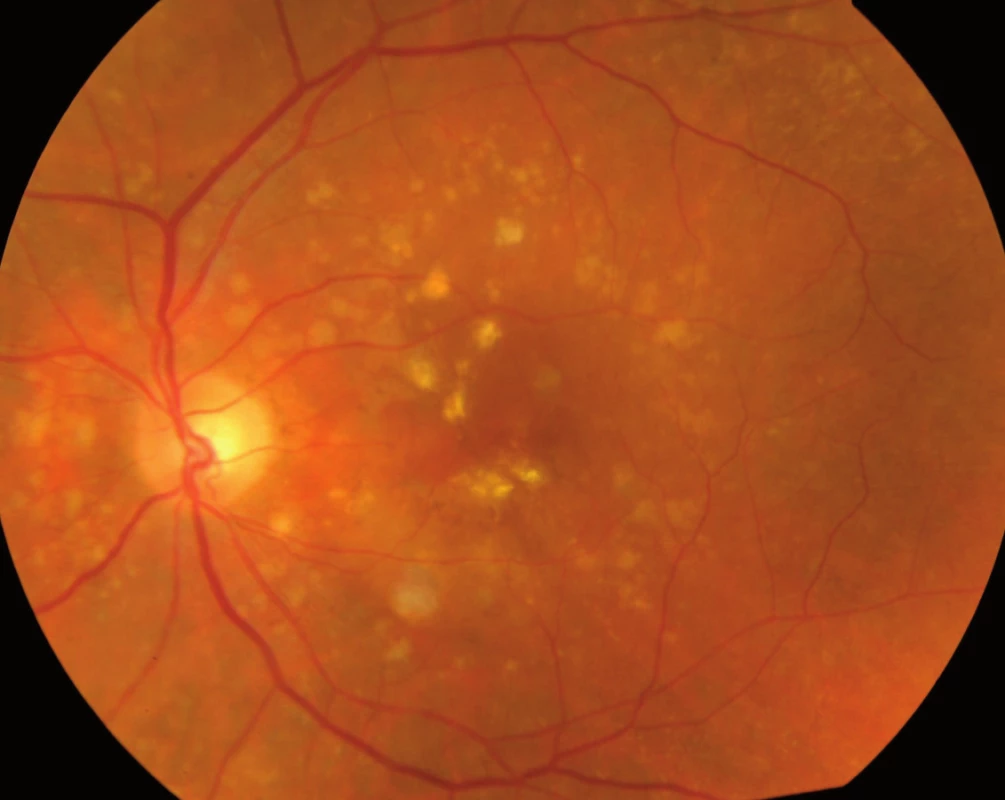
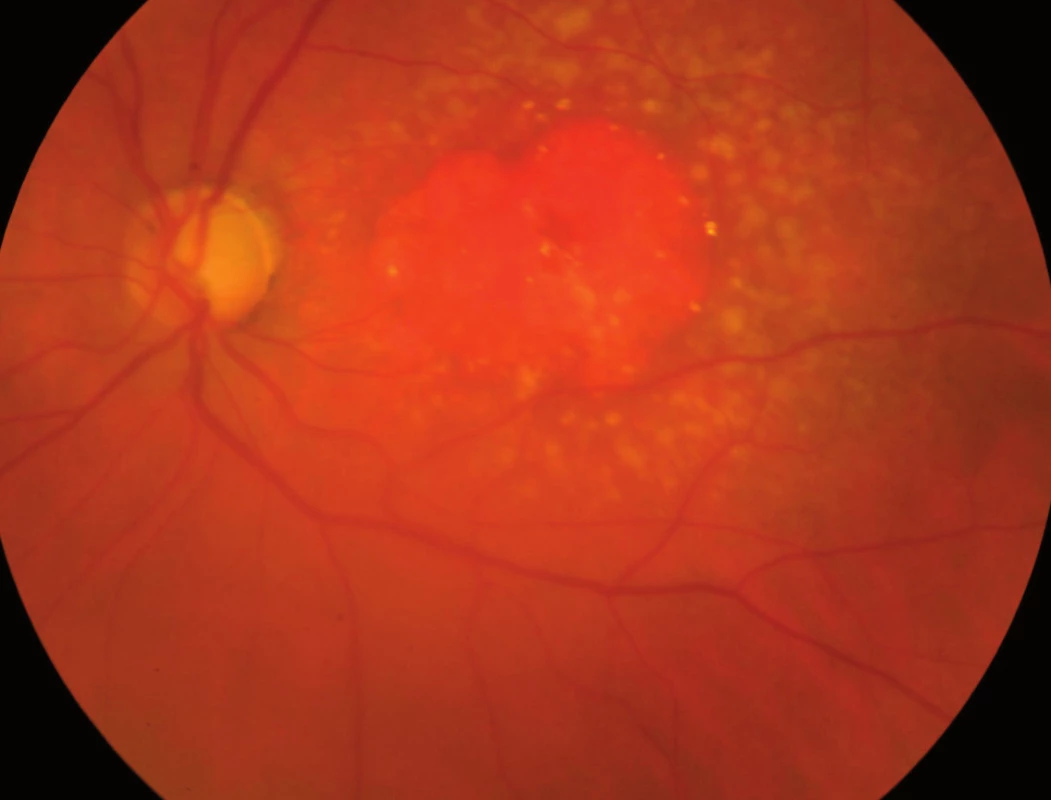
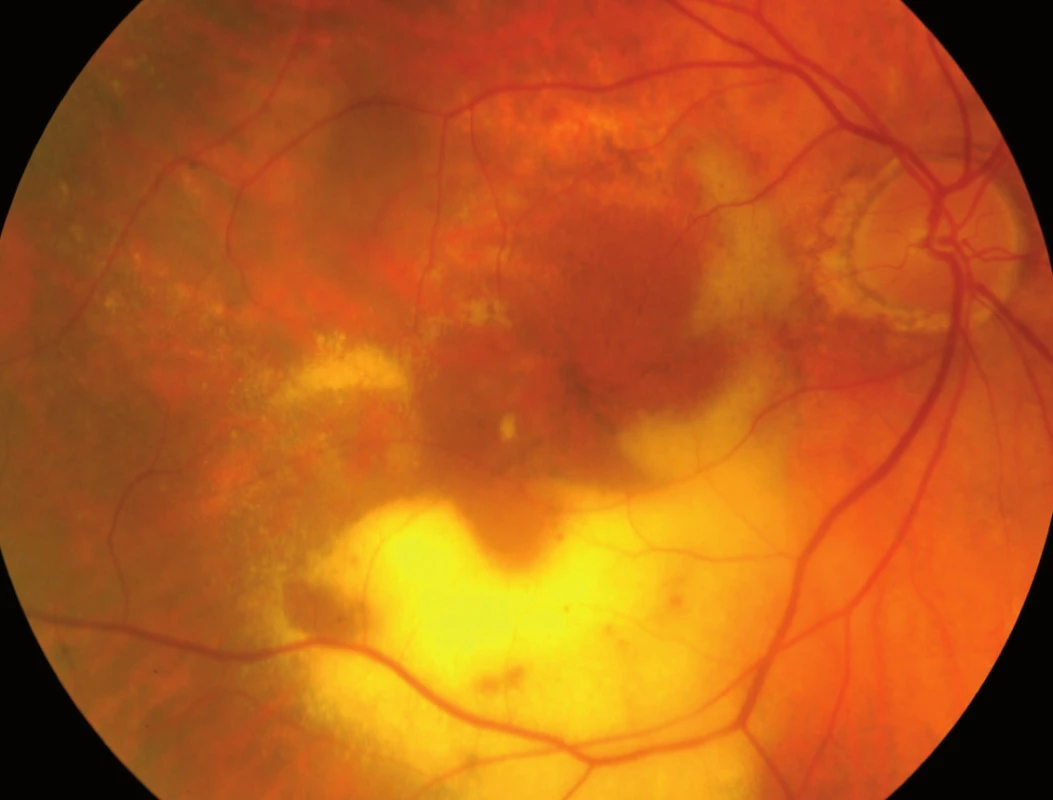
Jak bylo zmíněno výše, na vzniku VPMD se podílejí mnohočetné vlivy, které společně vedou k procesu, který se velmi podobá ohraničenému zánětu. Zánět v úrovni Bruchovy membrány a pigmentového epitelu sítnice, tedy vrstev ležících pod vlastní sítnicí, vede k tvorbě shluků usazenin v Bruchově membráně zvaných drúzy (obr. 3) a k zániku pigmentových buněk a buněk světločivných, tedy tyčinek a čípků. Atrofická – suchá forma VPMD je pouhou atrofií (zánikem) pigmentových i světločivných buněk sítnice (tyčinek a čípků), která působí výpad střední části zorného pole, postupující poměrně pomalu. Vlhká forma spočívá v prorůstání neovaskularizací – novotvořených cév z cévnatky pod sítnici – spojeném s jejich prosakováním s následným otokem sítnice, jejím centrálním odchlípením a často krvácením pod sítnici (obr. 4). Její průběh je někdy dramatický; choroba vede během několika měsíců k praktické slepotě. Novotvořené cévy vytvářejí pod sítnicí membránovitý útvar, nazývaný choroidální neovaskularizace (CHNV). Choroidální neovaskularizace je odpovědná za prosakování tekutiny či krve. Proces je ukončen vznikem vazivové jizvy koláčovitého útvaru podobného nádoru, zrak je zhoršen na praktickou slepotu (obr. 5). Někdy se objevuje i masivní krvácení pod sítnici i do sklivce (obr. 6), které má za následek úplnou slepotu [4].
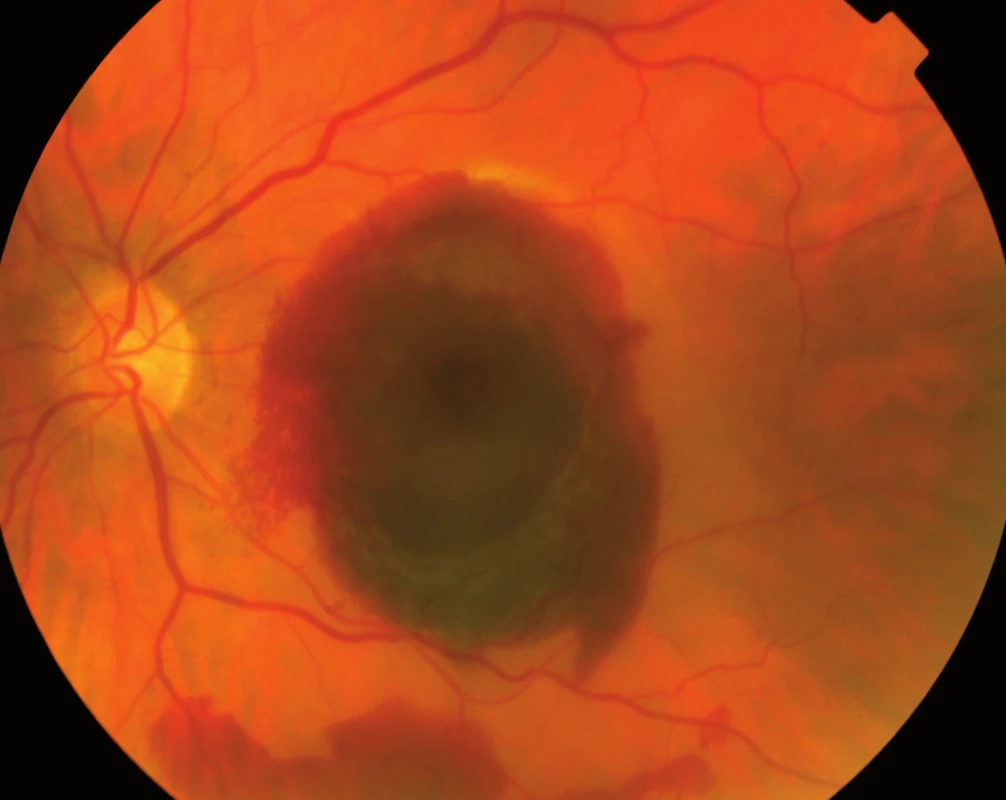
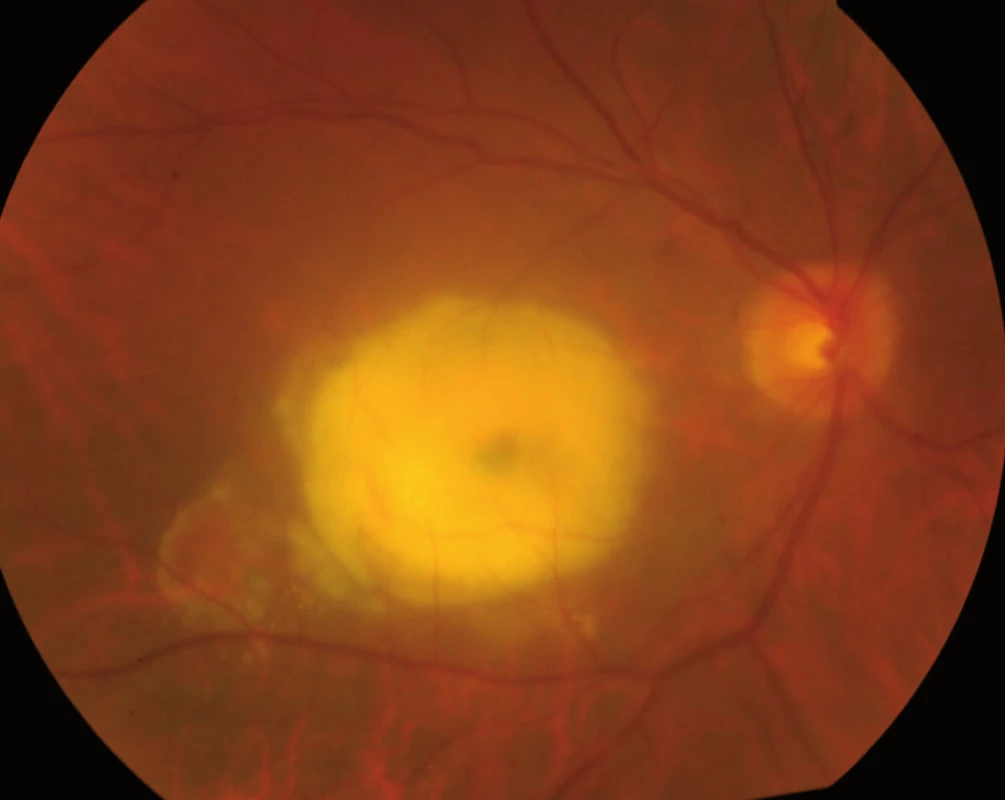
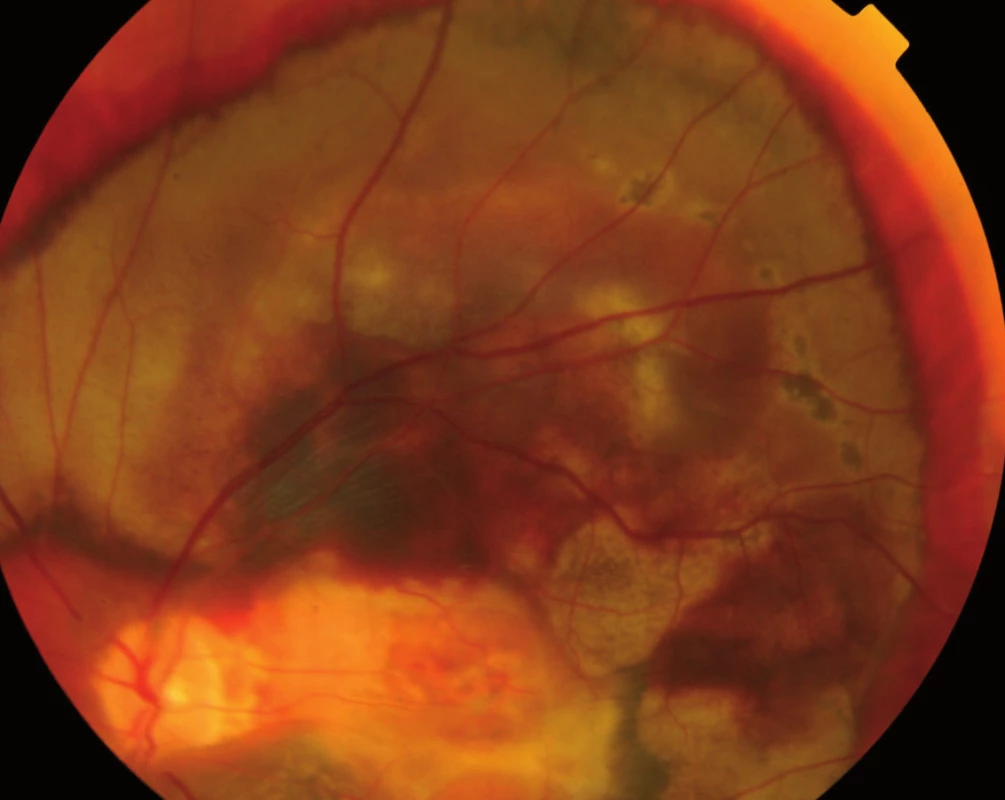
Přítomnost suché formy VPMD neznamená, že oko nemůže být postiženo formou vlhkou. Naopak, vlhká forma často vzniká v terénu suché degenerace, zejména v přítomnosti velkých drúz nebo na podkladě výrazné atrofie pigmentového epitelu sítnice nazývané geografická atrofie. V jiných případech ovšem exsudativní forma vzniká náhle, aniž by jí předcházela forma suchá.
VPMD vzniká většinou pouze v jednom oku, druhé oko bývá postiženo během dalších let, přičemž míra rizika narůstá každým rokem o 10%. Po pěti letech je tedy druhé oko postiženo u 50% nemocných a po deseti letech je oboustranné postižení jisté.
Novotvorba cév je ovlivňována mechanizmy a faktory stimulačními i inhibičními, které jsou za fyziologického stavu v rovnováze, avšak při vzniku VPMD získávají převahu faktory stimulační. Klíčovou roli mezi faktory stimulujícími neovaskularizaci hraje cévní endoteliální růstový faktor (vascular endothelial growth factor – VEGF). Moderní léčba VPMD proto spočívá v podávání preparátů proti tomuto růstovému faktoru, tedy látek s antiVEGF působením.
Diagnostika VPMD
Pacienta přivede k lékaři zpravidla porucha vidění. Mezi symptomy VPMD patří vnímání pokřivených linií a tvarů, centrální skotom (skvrna uprostřed zorného pole) a neschopnost rozeznávat tváře, číst apod. Postižení oka bohužel velmi často bývá zjištěno náhodně, tedy když si pacient z nějakého důvodu zakryje druhé oko, někdy dokonce až tehdy, když VPMD začíná již v druhém oku. Naprostá většina nemocných přichází k očnímu vyšetření pozdě. Téměř nikdo nezkouší svůj zrak každým okem zvlášť, při zakrytí jednoho oka dlaní. Mnozí lidé makulární degeneraci podceňují, či naopak ji chybně považují za neléčitelnou.
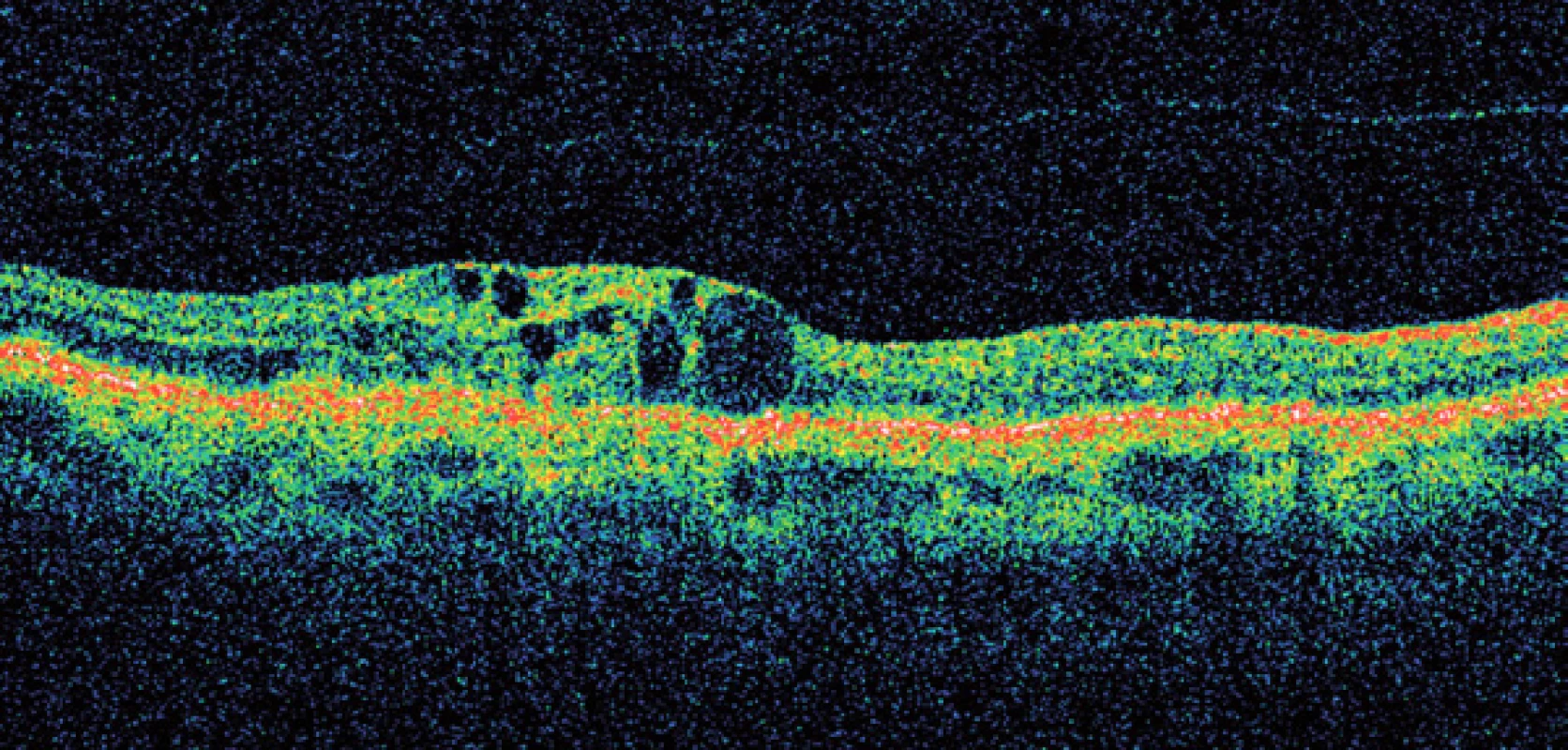
Základní oční vyšetření u VPMD spočívá ve stanovení zrakové ostrosti na dálku i na blízko, oftalmoskopii, biomikroskopii na štěrbinové lampě a použití Amslerovy mřížky. Při zjištění VPMD je pacient odeslán na specializované vitreoretinální pracoviště, kde provádíme barevnou fotografii sítnice, fluorescenční či indocyaninovou angiografii a optickou koherenční tomografii. Technický pokrok umožňuje stále přesnější metody diagnostiky a monitoringu VPMD (obr. 7, 8).
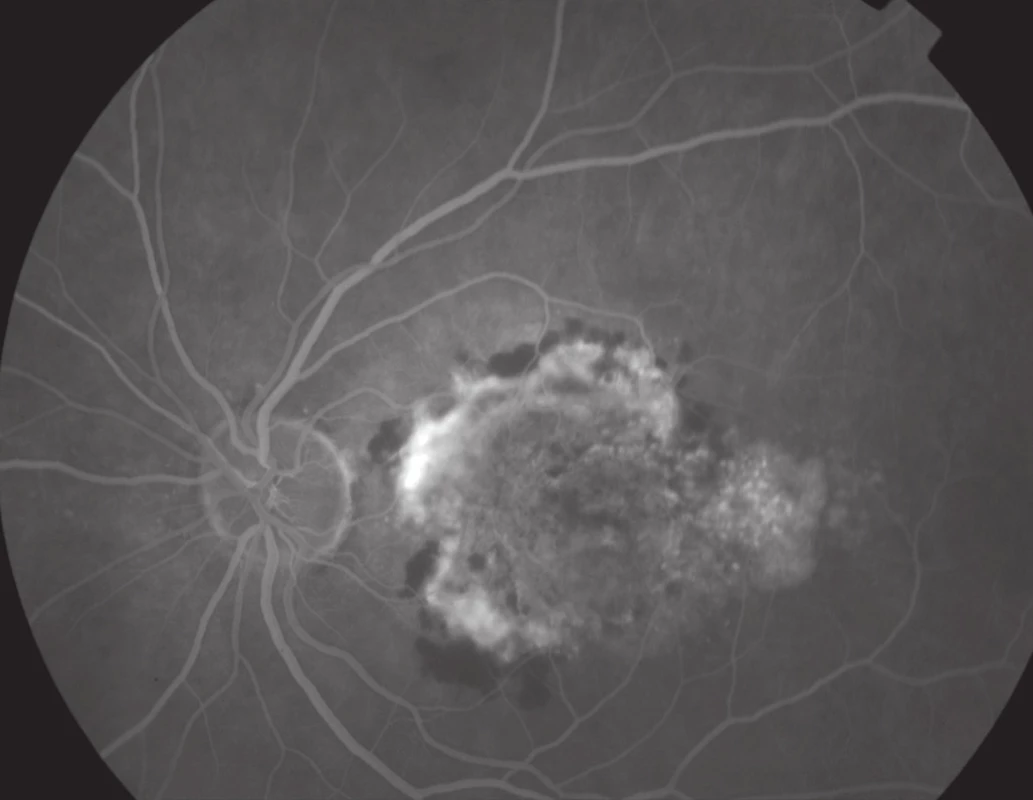
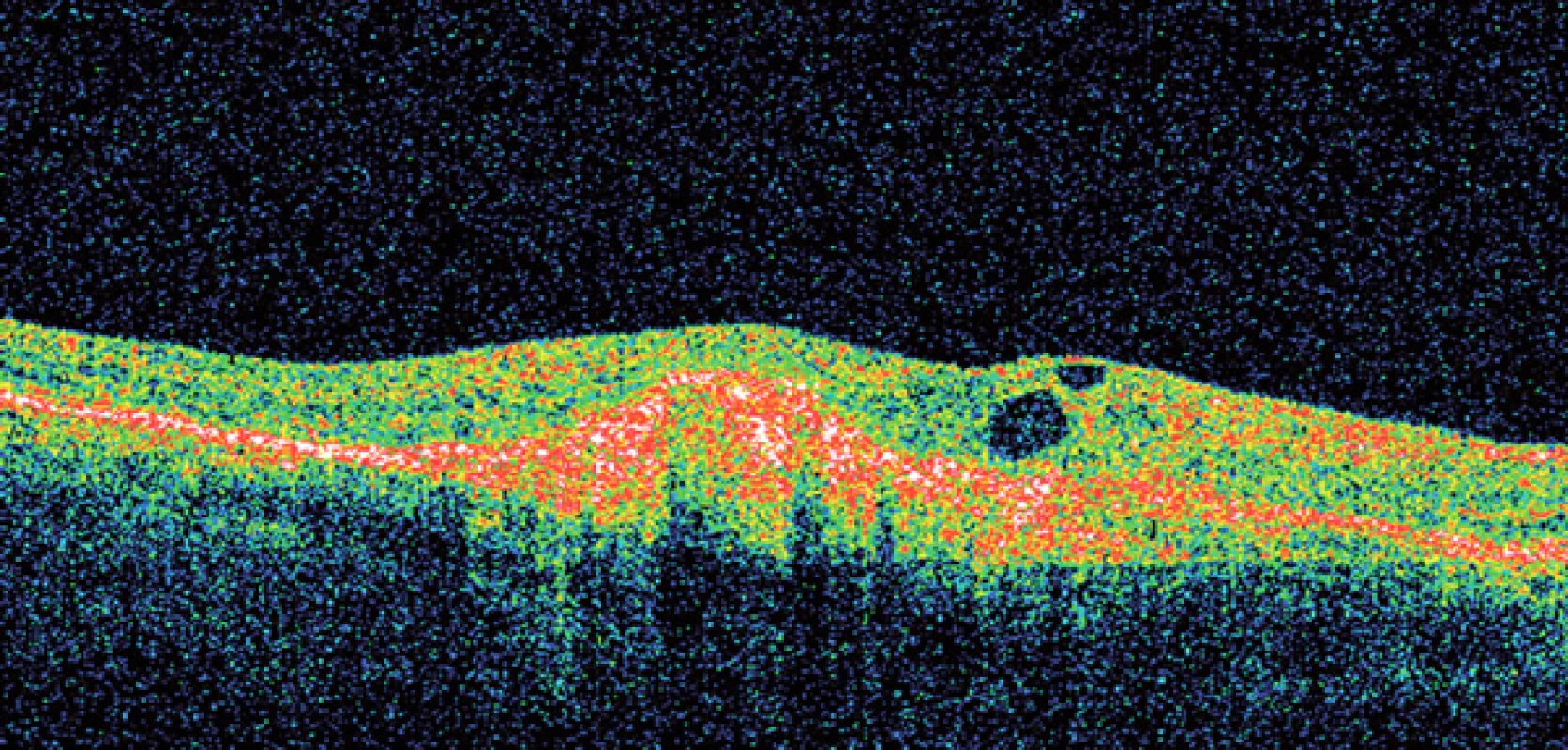
Pro upřesnění podtypu léze se choroidální neovaskularizace dělí na klasické, minimálně klasické a okultní. Tato klasifikace měla význam především v éře před nástupem antiVEGF preparátů, jelikož pomáhala indikovat léčbu, která se lišila podle podtypů neovaskularizace.
Léčba VPMD
Suchá, atrofická forma VPMD je na jedné straně relativně méně agresivní, poněvadž při ní u pouhých 10% postižených nastává těžká ztráta zraku, avšak trápí až 90% nemocných s VPMD, i když mírnějšími poruchami vidění v podobě vypadávání písmen a částí obrazu. Suchou formu bohužel dodnes nedokážeme účinně ovlivnit. Vycházejíce z výsledků studie AREDS [10–11] soudíme, že některé vitaminy, minerály a antioxidanty mají ochranný vliv na sítnici, avšak jednoznačně se neprokázal jejich léčebný vliv na atrofickou formu VPMD. Studie AREDS měla nejpřesvědčivější výsledky u nemocných, kteří trpěli drúzovou formou suché VPMD a u těch, kteří již měli v jednom oku formu neovaskulární. Při dlouhodobém užívání směsí doplňků výživy, obsahujících zinek, karotenoidy (zejména lutein a zeaxantin), rybí tuk a vitamíny C a E těmito pacienty, poklesl počet nemocných, u nichž vznikla vlhká forma VPMD i v oku druhém. Je vhodné zmínit, že existují výzkumy, které ochrannou úlohu dietních opatření nepotvrzují, avšak obecně se soudí, že je vhodné, aby strava obsahovala hojnost ovoce, zeleniny a ryb a aby pacienti s rizikovými nálezy (pigmentové změny v makule, drúzy) navíc užívali zmíněné doplňky výživy v podobě tablet.
Vlhká, exsudativní forma VPMD je obávanější, jelikož u ní trpí těžkou ztrátou zraku až 90% nemocných. Na druhé straně vlhkou formu již dnes dokážeme účinně léčit. Výčet metod, které se používaly k léčbě vlhké formy VPMD před nástupem léčby antiVEGF preparáty, přesahuje rámec tohoto článku. Za zmínku stojí pouze léčba zářením, laserová koagulace, chirurgická extrakce neovaskulární membrány a fotodynamická léčba s Visudynem. Tyto procedury byly pouze omezeně účinné a byly zhruba před pěti lety nahrazeny moderní léčbou, spočívající v podávání antiVEGF preparátů.
Prvním z těchto léků blokujících růstový faktor VEGF byl pegaptanib sodium, Macugen, aptamer RNA, specificky blokující izomer VEGF165 Macugen. Ve studii VISION prokázal u léčených pacientů lepší výslednou zrakovou ostrost v porovnání s kontrolní skupinou, avšak zlepšení vizu o 3 řádky optotypů nastalo u pouhých 6% nemocných [12]. Macugen tedy pouze zpomaloval zhoršování zraku (graf 1).
![Účinnost Macugenu v porovnání s kontrolní neléčenou skupinou pacientů [12,20].](https://pl-master.mdcdn.cz/media/image/aab9532a9993a3750384cfcb6c11a1f8.png?version=1537790283)
Ranibizumab – Lucentis, tedy fragment monoklonální protilátky IgG1(Fab) proti proteinu VEGF s malou molekulovou hmotností (48 kD), byl prvním preparátem, u něhož bylo prokázáno zlepšení zraku u 34% očí. Ranibizumab blokuje všechny biologicky aktivní formy VEGFA (izomery 110, 121, 165, 189 a 206), čímž inhibuje angiogenezi a cévní permeabilitu [13]. Studie MARINA a ANCHOR potvrdily schopnost Lucentisu zabránit ztrátě zrakové ostrosti o více než 15 písmen v průběhu 2 let při pravidelném podávání 1krát měsíčně (graf 2). Další studie PIER zkoumala možnost snížení frekvence aplikace Lucentisu: tři měsíční injekce Lucentisu byly následovány opakováním injekce po třech měsících, všichni pacienti tedy dostali během jednoho roku 6 injekcí. Studie PIER ukázala, že u 40% pacientů lze při léčbě aplikovat individualizovaný režim, zatímco u 60% je nutno injekce opakovat každý měsíc. Tyto výsledky podporují koncept léčby, spočívající v podávání dalších dávek léku podle vývoje zrakové ostrosti a nálezu v makule.
![Účinnost Lucentisu v porovnání s kontrolní neléčenou skupinou [19].](https://pl-master.mdcdn.cz/media/image/471999f5c83c09d3dfd89f5df2f70136.png?version=1537790283)
Ještě před ukončením studií zkoumajících účinnost ranibizumabu se objevily výsledky studie léku bevacizumab – Avastin [13,14]. Přestože se jedná o lék, doporučený primárně pro léčbu kolorektálního karcinomu a jeho použití v očním lékařství je tzv. “offlabel”, přestože jeho použití v oftalmologii bylo na celém světě provázeno velkým negativním tlakem farmaceutických firem, četné další výzkumy prokázaly jeho vysokou účinnost a bezpečnost podávání [15]. Avastin – bevacizumab je rekombinant humanizované monoklonální protilátky IgG1, odvozený z téhož myšího monoklonálního protilátkového prekurzoru jako ranibizumab. Od roku 2004 je registrován v ČR. Avastin v dávce 1,25mg v 0,05ml lze aplikovat za cenu řádově tisíců korun (na rozdíl od Macugenu a Lucentisu, které stojí desetitisíce za jednu dávku), což umožňuje léčit i méně majetné pacienty [16]. Dnes je Avastin používán v mnoha zemích na celém světě a v některých státech je léčba Avastinem hrazena ze zdravotního pojištění. Léčebné schéma buď dodržuje doporučení studie PIER, tedy spočívá v podání tří “nasycovacích” dávek, následovaných individualizovaným podáváním dalších injekcí podle vývoje nálezu v makule, zrakové ostrosti a OCT, nebo je zcela individuální. Při plně individualizované léčbě “na míru” podáváme pouze první injekci Avastinu a poté pacienta opakovaně kontrolujeme; další dávku podáváme pouze při přetrvávání či zhoršení nálezu. Tento režim umožňuje snížit množství dávek na minimum, a snížit tak nejen riziko, plynoucí z nitroočních injekcí, ale i finanční náklady na léčbu. V každém případě však je žádoucí, aby léčba byla zahájena včas, tedy ve stadiu, kdy je dosud zachována dobrá zraková ostrost [17] (obr. 9, 10).
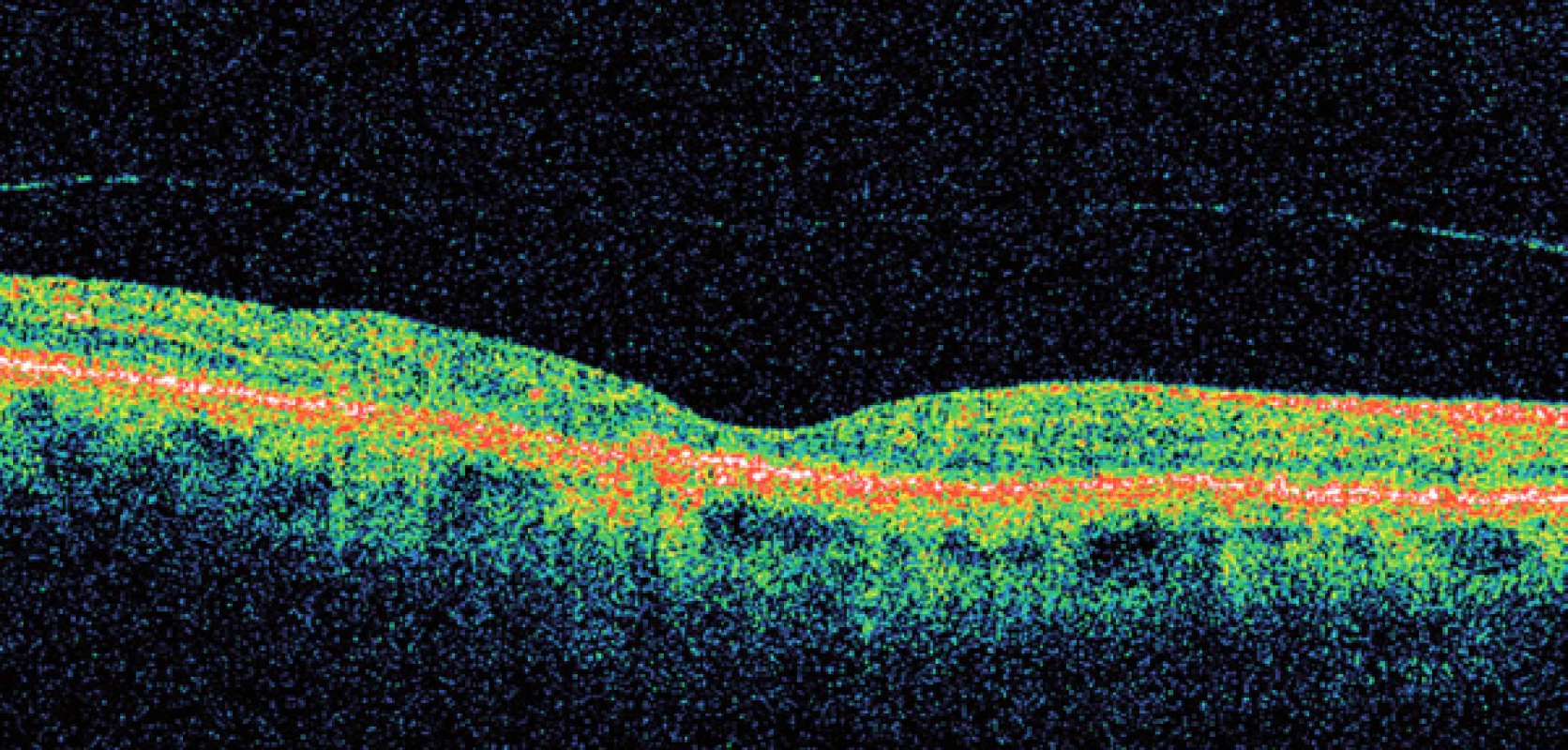
Mezi nové preparáty, jejichž účinnost je zkoumána v rozsáhlých mezinárodních studiích, patří VEGF Trap, Bevasiranib, PTK 787 (inhibitor tyrozin kinázy), PEDF (faktor odvozený z pigmentového epitelu); výzkum se zabývá též kmenovými buňkami.
Snaha nových výzkumů směřuje ke snížení počtu aplikací účinného léku nebo k nalezení pohodlnější cesty aplikace, např. injekčním podáváním léků pod spojivku, depotním podáváním léku do sklivce apod. Některé postupy vycházejí z předpokladu, že jeli VPMD multifaktoriální chorobou, lze kombinací preparátů zvýšit účinnost léčby. Různí autoři proto kombinují uvedené léky a procedury mezi sebou, ba dokonce je doplňují i chirurgickými a semichirurgickými (laserovými) výkony [17]. Pokračují i výzkumy v oblasti genové terapie, která ovlivní vznik choroby v jejím počátku, a to buď snížením exprese abnormálního genu, nebo dokonce podáním zdravého genu pomocí adenovektoru a „opravou“ metabolizmu makuly.
Léčba VPMD se v posledních pěti letech revolučně změnila k lepšímu a její vývoj dále slibně pokračuje. České zdravotnictví má značné dluhy v oblasti osvěty, směřující k časné diagnostice nemoci [17]. Léčba musí být zahájena v počátku onemocnění, kdy postačí menší množství aplikací léku, léčba je úspěšnější, šetrnější a lacinější. Zatímco v pokročilých stadiích již nemůžeme dosáhnout zlepšení, pouze zpomalení zhoršování nálezu, při zachycení časné fáze VPMD lze dokonce pacientům navrátit téměř normální vizus. Které léky a způsoby jejich aplikace se nakonec ukážou nejúspěšnějšími, a zda budou lépe účinkovat jako monoterapie či v kombinaci, ukážou až výsledky srovnávacích klinických studií [18].
Doručeno do redakce 24. 9. 2010
Přijato po recenzi: 16. 11 2010
MUDR. IVAN FIŠER, PH.D.
EVROPSKÁ OČNÍ KLINIKA LEXUM, PRAHA 4
FISER@LEXUM.CZ
Sources
1. Congdon N, O’Colmain B, Klaver CC et al. Eye Diseases Prevalence Research Group. Causes and prevalence of visual impairment among adults in the United States. Arch Ophthalmol 2004; 122 (4): 477–485.
2. Friedman DS, O’Colmain BJ, Muñoz B et al. Eye Diseases Prevalence Research Group. Prevalence of agerelated macular degeneration in the United States. Arch Ophthalmol 2004; 122 (4): 564–572. Abstract.
3. Ferris FL 3rd, Fine SL, Hyman L. Agerelated macular degeneration and blindness due to neovascular maculopathy. Arch Ophthalmol 1984; 102 (11): 1640–1642.
4. Green WR. Histopathology of agerelated macular degeneration. Mol Vis 1999; 5 : 27–36.
5. Khan JC, Shahid H, Thurlby DA et al. Age related macular degeneration and sun exposure, iris colour, and skin sensitivity to sunlight. Br J Ophthalmol 2006; 90 : 29–32. Abstract.
6. Smith W, Assink J, Klein R et al. Risk factors for agerelated macular degeneration: Pooled findings from three continents. Ophthalmology 2001; 108 (4): 697–704. Abstract.
7. Haines JL, Hauser MA, Schmidt S et al. Complement factor H variant increases the risk of agerelated macular degeneration. Science 2005; 308 (5 720): 419–421. Abstract.
8. Seddon JM, Ajani UA, Superduto RD et al. Dietary carotenoids, vitamins A, C and E and advanced agerelated macular degeneration. Eye Disease CaseControl Study Group. JAMA 1994; 272 : 1413–1420. Abstract.
9. van Leuwen R, Boekhoorn S, Vingerling JR et al. Dietary intake of antioxidants and risk of agerelated macular degeneration. JAMA 2005; 294 (24): 3101–3107. Abstract.
10. Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of highdose supplementation with vitamins C and E, beta carotene, and zinc for agerelated macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol 2001; 119 (10): 1417–1436. Abstract.
11. Agerelated Eye Disease Study Group. Risk factors associated with agerelated macular degeneration. A casecontrol study in the agerelated eye disease study: AgeRelated Eye Disease Study Report Number 3. Ophthalmology 2000; 107 (12): 2224–2232. Abstract.
12. Gragoudas ES, Adamis AP, Cunningham ET jr et al. VEGF Inhibition Study in Ocular Neovascularization Clinical Trial Group. Pegaptanib for neovascular agerelated macular degeneration. NEJM 2004; 351 (27): 2805–2816.
13. Rosenfeld PJ, Brown DM, Heier JS et al. MARINA Study Group. Ranibizumab for neovascular agerelated macular degeneration. NEJM 2006; 355 (14): 1419–1431.
14. Avery RL, Pieramici DJ, Rabena MD et al. Intravitreal bevacizumab (Avastin) for neovascular agerelated macular degeneration. Ophthalmology 2006; 113 (3): 363–372.
15. Arevalo JF, FromowGuerra J, Sanchez JG et al. PanAmerican Collaborative Retina Study Group. Primary intravitreal Bevacizumab for subfoveal choroidal neovascularization in agerelated macular degeneration: results of the PanAmerican Collaborative Retina Study Group at 12 months followup. Retina 2008; 28 (10): 1387–1394.
16. Karel I. Možnosti a ekonomické ukazatele léčby exsudativní věkem podmíněné makulární degenerace s choroidální neovaskulární membránou. Čes a slov oftal 2007; 5(63): 311–319.
17. Ernest J, Fišer I, Kolář P. Věkem podmíněná makulární degenerace (VPMD). 1. vyd. Praha: Česká vitreoretinální společnost 2007.
18. Fišer I. Léčba věkem podmíněné makulární degenerace. New EU Magazine of Medicine 2008; 3 (4): 13–22.
19. Rosenfeld PJ, Brown DM, Heier JS et al. MARINA Study Group. Ranibizumab for neovascular agerelated macular degeneration. N Engl J Med 2006; 355 (14): 1419–1431.
20. D’Amico DJ for the VISION Clinical Trial Group. Results of the second year of Macugen for the treatment of neovascular AMD (VISION). Abstract presented at: American Society of Retinal Specialists Meeting; Montreal, July 16–20, 2005.
Labels
Geriatrics General practitioner for adultsArticle was published in
Czech Geriatric Review

2010 Issue 1-2
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Závažná metabolická komplikácia diabetes mellitus u seniorov – hyperosmolárny hyperglykemický syndróm
- Prevalencia vybraných farmakologických a nefarmakologických faktorov ovplyvňujúcich bezpečnosť a účinnosť liečiv u hospitalizovaných seniorov
- GERIATRIE 2010
- Hypotyreóza u seniorov
- Věkem podmíněná makulární degenerace
- Stáří a alergie – jedná se o problém?
- Význam dietní vlákniny ve stáří
- Smysluplnost života ve stáří
- Hypertyreózne stavy u geriatrických pacientov
- Lékařská posudková služba v dotazníkovém šetření
- Czech Geriatric Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hypotyreóza u seniorov
- Smysluplnost života ve stáří
- Věkem podmíněná makulární degenerace
- Stáří a alergie – jedná se o problém?