Kožní reakce na moderní látky (biologická a ostatní cílená onkologická léčiva)
Skin Reactions to New Agents (Biologicals and Targeted Anticancer Drugs)
In the last years, the knowledge of pathophysiology of immune diseases and cancer increased very rapidly. Better understanding of signal transduction and metabolic pathways enables to establish potential molecular targets of therapy. Targeted therapy brings better efficacy, safety profile and possibility of long-term treatment together with improved quality of life of seriously ill patients. On the other hand, it leads to unusual and unexpected side effects in comparison to immunosupressive or anti-cancer therapy. The article introduces the side effects of new targeted agents including biologicals and some new chemotherapeutic drugs.
Key words:
targeted anti-cancer therapy – biological therapy – chemotherapy – TNF α antagonists – EGFR inhibitors – multikinase inhibitors – inhibitors of proteasomes – monoclonal antibodies – skin side effects
Authors:
P. Cetkovská
Authors‘ workplace:
Dermatovenerologická klinika FN a LFUK v Plzni
přednosta prof. MUDr. Karel Pizinger, CSc.
Published in:
Čes-slov Derm, 85, 2010, No. 2, p. 68-75
Category:
Reviews (Continuing Medical Education)
Overview
V posledních letech došlo k velmi rychlému rozvoji znalostí o imunopatofyziologii imunitně zprostředkovaných nemocí a zhoubných nádorů. Díky lepšímu poznání přenosu signálů a metabolických procesů byly pak vytipovány četné možné molekulární cíle léčby. Cílená léčba přináší vyšší molekulárně cílenou účinnost, lepší profil bezpečnosti, možnost dlouhodobé léčby spolu se zlepšením kvality života vážně nemocných pacientů. Na druhou stranu na podkladě různých mechanismů účinků či interakcí tato terapie vede k neobvyklým a neočekávaným nežádoucím reakcím oproti konvenční imunosupresivní léčbě či chemoterapii. Cílem článku je uvést nežádoucí kožní reakce po moderních tzv. cílených lécích, jako jsou biologika a některá nová chemoterapeutika.
Klíčová slova:
cílená onkologická léčba – biologická léčba – chemoterapie – antagonisté TNF α – inhibitory EGFR – inhibitory multikináz – inhibitory proteasomu – monoklonální protilátky – kožní nežádoucí reakce
Úvod
Moderní chemoterapeutika a biologika mohou způsobovat řadu nežádoucích účinků na podkladě nejrůznějších mechanismů postihujících kůži, vlasy, sliznice nebo nehty. Kožní změny vznikající při podávání této nové terapie jsou však většinou neurčitě popsané, protože klinické studie a jiní terapeuti než dermatologové uvádějí pouze obecně výskyt vyrážky („rash“) po příslušném léku. Navíc dosud neexistuje optimální jednotná klasifikace nových kožních reakcí zohledňující také kvalitu života nemocných a funkční a estetické aspekty. Proto je důležité dlouhodobé sledování všech pacientů léčených novými léčebnými přípravky v registrech a důsledné vyšetření a hlášení nežádoucích reakcí příslušnými odborníky. V tomto článku je podán přehled nejčastějších kožních změn vyskytujících se při dnes dostupné moderní cílené léčbě.
1. Biologická léčba imunologicky podmíněných zánětlivých chorob
Biologická léčba zahrnuje monoklonální protilátky, fúzní proteiny a další biotechnologicky připravené léky. Využívá se nejen v léčbě imunologicky podmíněných zánětlivých chorob (psoriáza, roztroušená skleróza, Crohnova choroba, revmatoidní a psoriatická artritida aj.), ale také u hematologických malignit a solidních tumorů (2).
1.1. Antagonisté TNF α
V dnešní době nejvíce používané biologické léky v dermatologii a revmatologii jsou antagonisté tumor necrosis faktoru (TNF). TNF α, dříve nazývaný kachektin, je ubikviterní molekula tvořená řadou buněk, TNF β (dříve lymfotoxin α) je tvořený pouze lymfocyty. Jde o výrazně prozánětlivé cytokiny s pleiotropními účinky, včetně regulace apoptózy (13). V současnosti jsou u nás registrovány adalimumab, etanercept a infliximab.
Blokátory TNF α vedou k tvorbě antinukleárních protilátek (ANA) zejména během léčby infliximabem, a to až u 60 % léčených, méně často jsou pozitivní protilátky proti dvouvláknové (anti-ds) DNA (19). Vzácně mohou tyto léky vyvolat lupus erythematosus, a to jak systémový, tak subakutní, u pacientů léčených etanerceptem nebo infliximabem (pouze v 0,19 % případů). Při tzv. lupus-like syndromu se pozoruje pozitivita ANA, anti-dsDNA, hematologické změny, polyserozitida, nefritida, artritida a kožní projevy. Při ukončení léčby dojde během roku ke spontánnímu vymizení příznaků.
Intravenózní podávání infliximabu může být komplikováno časnými či pozdními infúzními reakcemi na podkladě hypersenzitivní reakce na myší protein obsažený v molekule léku, proti němuž se tvoří lidské antichimérické protilátky. Akutní reakce postihuje až 6 % pacientů léčených infliximabem, projeví se hypotenzí, dyspnoí, palpitacemi, bolestí hlavy a na hrudi a nespecifickými kožními změnami (pálení, erytém, kopřivka). Většinou při zpomalení infúze dojde k vymizení symptomů, takže se lék může po premedikaci antihistaminiky či kortikosteroidy opět opatrně podat. Současné podávání imunosupresiv snižuje riziko vzniku infúzních reakcí. Pozdní typ infúzní reakce se projevuje jako sérová nemoc u 1 až 2,8 % léčených infliximabem (10,13).
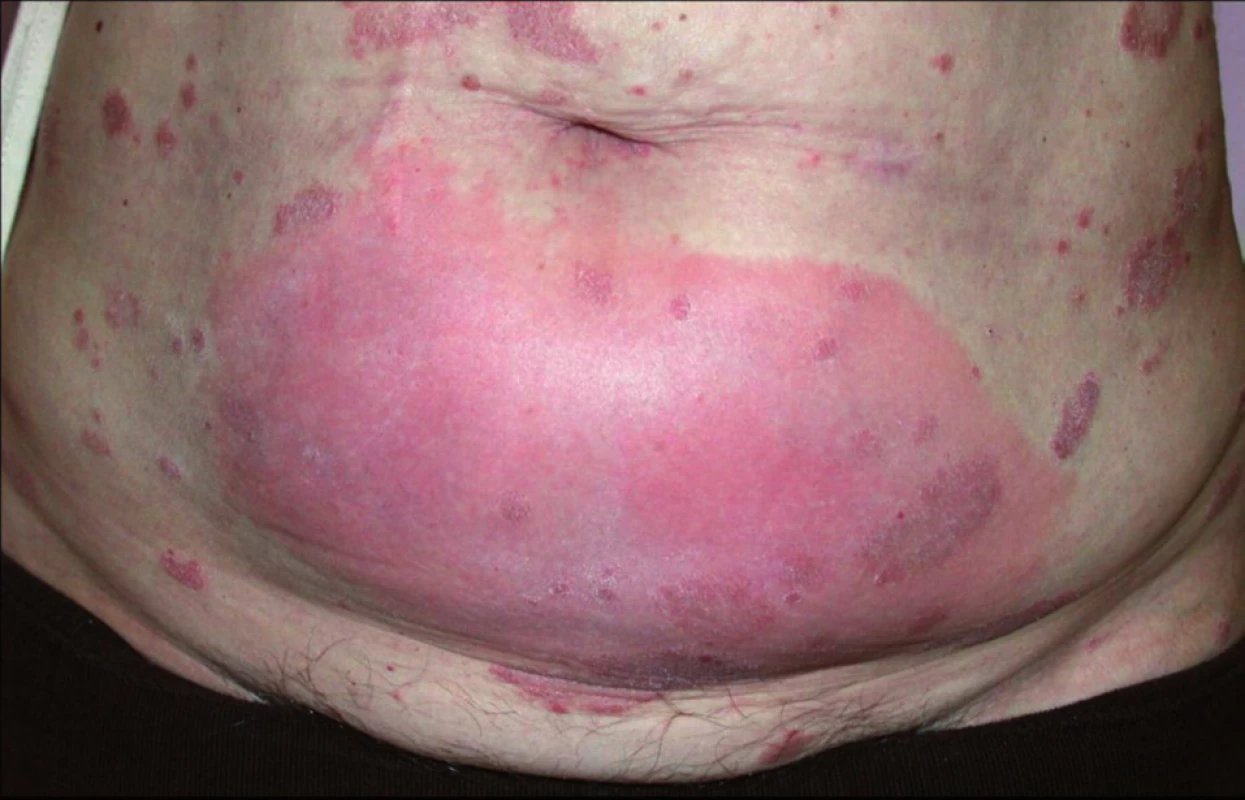
V místě vpichu subkutánně aplikovaných biologik se může většinou v prvním měsíci léčby objevit lokální reakce v podobě erytému a prosáknutí(obr. 1). Někdy dochází k recidivám lokálních reakcí v místě předchozí aplikace při pokračování léčby (tzv. recall reakce). Pozorují se také případy leukocytoklastické vaskulitidy, ekzémové či lichenoidní projevy, granulomatózní reakce a častější kožní infekce (herpes zoster). Vzácně se udává vznik erythema multiforme, Stevensova-Johnsonova syndromu a toxické epidermální nekrolýzy (3).
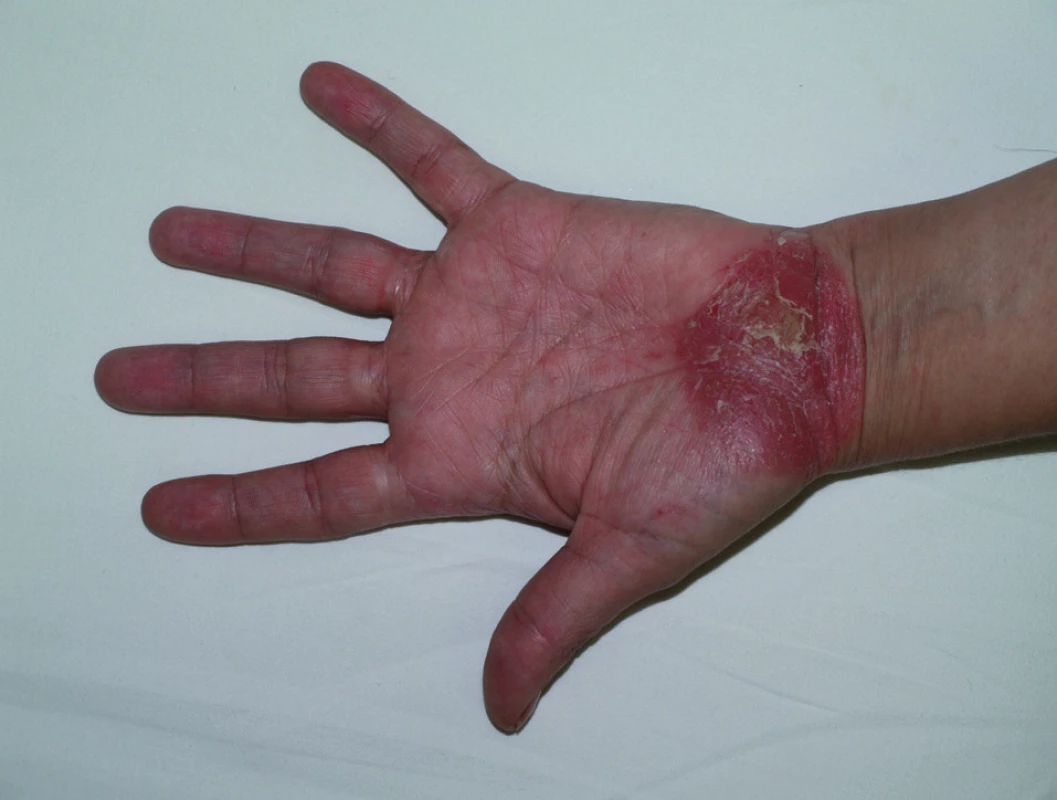
Paradoxním nežádoucím účinkem léčby je vznik psoriázy při léčení antagonisty TNF α, a to především při terapii revmatoidní artritidy, ankylozující spondylitidy a jiných spondylartritid, Behςçetovy nemoci a střevních zánětlivých nemocí. Nejčastěji se objevuje pustulózní psoriáza na dlaních a ploskách (obr. 2). Mechanismus vzniku není znám, ale předpokládá se účast plazmocytoidních dendritických buněk a jejich zvýšená tvorba interferonu α (5). Při podezření na vznik psoriázy během léčby je třeba pátrat po možné vyvolávající příčině (virové či bakteriální infekci, předchozí traumatizaci) a odeslat pacienta k dermatologovi k potvrzení diagnózy klinicky a histologicky. Nemocní většinou mohou pokračovat v léčbě jinými antagonisty TNFα. Profylaktická opatření proti vzniku těchto kožních reakcí zatím nejsou známa. Lokálně se doporučují silně účinné kortikosteroidy, ale i jiná antipsoriatika, při neúspěchu celková terapie stejně jako při závažné psoriáze.
2. Cílená onkologická léčba
Cílená léčba znamená používání takových látek, které zabrání růstu a šíření malignity ovlivněním specifických molekul účastnících se v procesu růstu a šíření tumoru. Zahrnuje léky, které narušují přenosy signálu pro růst tumoru nebo angiogenezi, stimulují imunitní systém k destrukci nádorových buněk, přenášejí toxické látky do buněk tumoru či navozují přímo apoptózu buněk. Jde buď o malé molekuly schopné pronikat do buněk a působit na cíle uvnitř buněk anebo o monoklonální protilátky, které jsou namířené na cíle na povrchu buněk (12).
Podle mechanismu účinku (6, 7) je možné rozdělit nově chemoterapii na:
- inhibitory přenosu signálu EGFR,
- inhibitory multikináz,
- inhibitory BCR-ABL tyrozinkinázy,
- inhibitory proteasomu,
- inhibitory mitózy: taxany, vinca alkaloidy,
- antimetabolity: purinová a pyrimidinová analoga,
- genotoxická agens: alkylační činidla, antracykliny, inhibitory topoizomerázy I.
K moderní cílené léčbě nádorů jsou dnes schválené malé molekuly inhibitorů enzymů tyrozinkináz: imatinib, dasatinib, nilotinib, sunitinib, sorafenib, gefitinib, erlotinib a lapatinib a molekulární protilátky: cetuximab, trastuzumab, panitumumab, bevacizumab, rituximab a alemtuzumab (20). Cílenými mechanismy ovlivňují proliferaci, apoptózu nádorových buněk nebo angiogenezi v nádoru tím, že narušují růst cév nádoru přímou inhibicí receptoru pro vaskulární endotelový růstový faktor (VEGFR – vascular endothelial growth factor receptor) nebo působí inhibici receptorů pro růstový faktor odvozený z krevních destiček (PDGFR – platelet derived growth factor receptor), působí na různé kinázy či epidermální růstový faktor (EGFR – epidermal growth factor receptor).
2.1 Inhibitory EGFR
Inhibitory přenosu signálu EGFR jsou zejména monoklonální protilátky cetuximab a panitumumab, používané v léčbě metastazujících karcinomů tlustého střeva a rekta a karcinomu hlavy a krku, a malé molekuly inhibující tyrozinkinázovou aktivitu EGFR erlotinib a gefitinib, podávané perorálně u nemalobuněčného karcinomu plic, po případě karcinomu pankreatu. Dostupné jsou také látky inhibující i další receptory EGFR skupiny, jako je 2. receptor lidského epidermálního růstového faktoru HER2 (lapatinib, trastuzumab) schválené pro léčbu metastatického karcinomu prsu s expresí HER-2 receptoru.
EGFR je transmembránový protein, který aktivuje tyrozinkinázu a následně vede k proliferaci a migraci buněk a k angiogenezi. Je na povrchu nejen nádorových buněk, ale i keratinocytů zejména v bazální vrstvě epidermis, sebocytů a buněk zevní vlasové pochvy, proto kožní reakce na podkladě blokády EGFR v kůži patří k nejčastějším nežádoucím účinkům této lékové skupiny. Zahrnují akneiformní výsevy, xerózu, ekzém a fisury, změny růstu vlasů a nehtů, teleangiektázie a slizniční změny (6, 18).
Pro nežádoucí kožní změny vyvolané antagonisty EGFR se zavedl název PRIDE syndrom (z angl. Papulopustules and/or paronychia, Regulatory abnormalities of hair growth, Itching, Dryness caused by Epidermal growth factor inhibitors) (8).
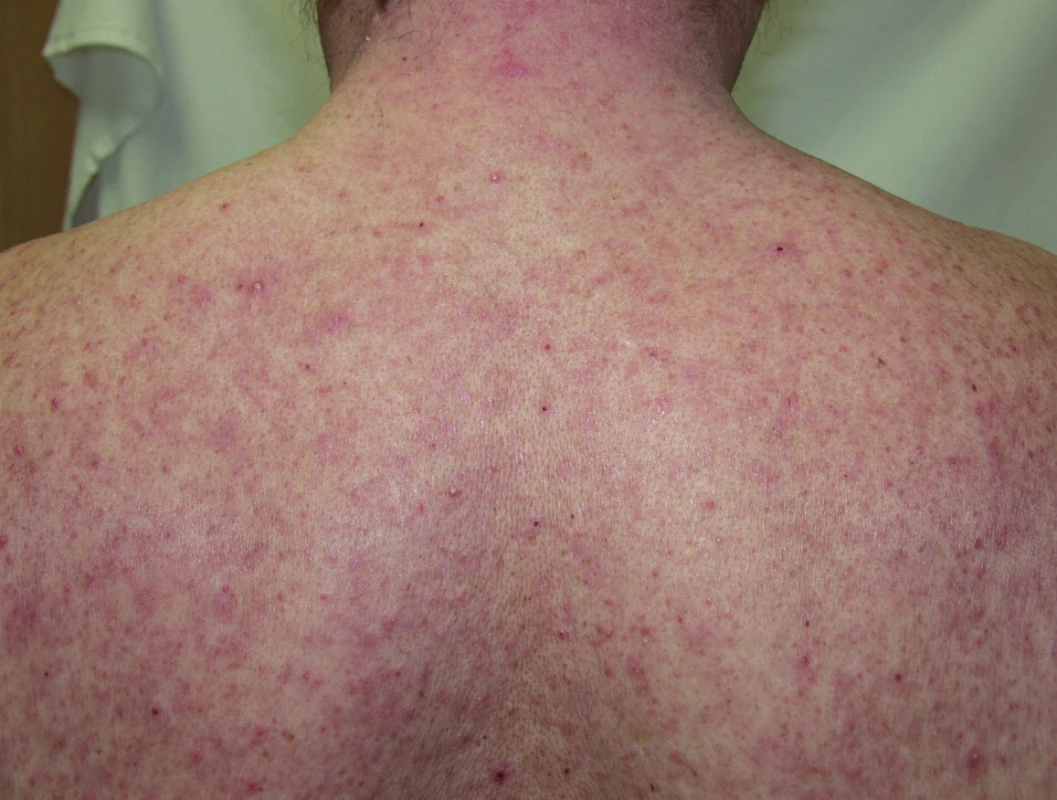
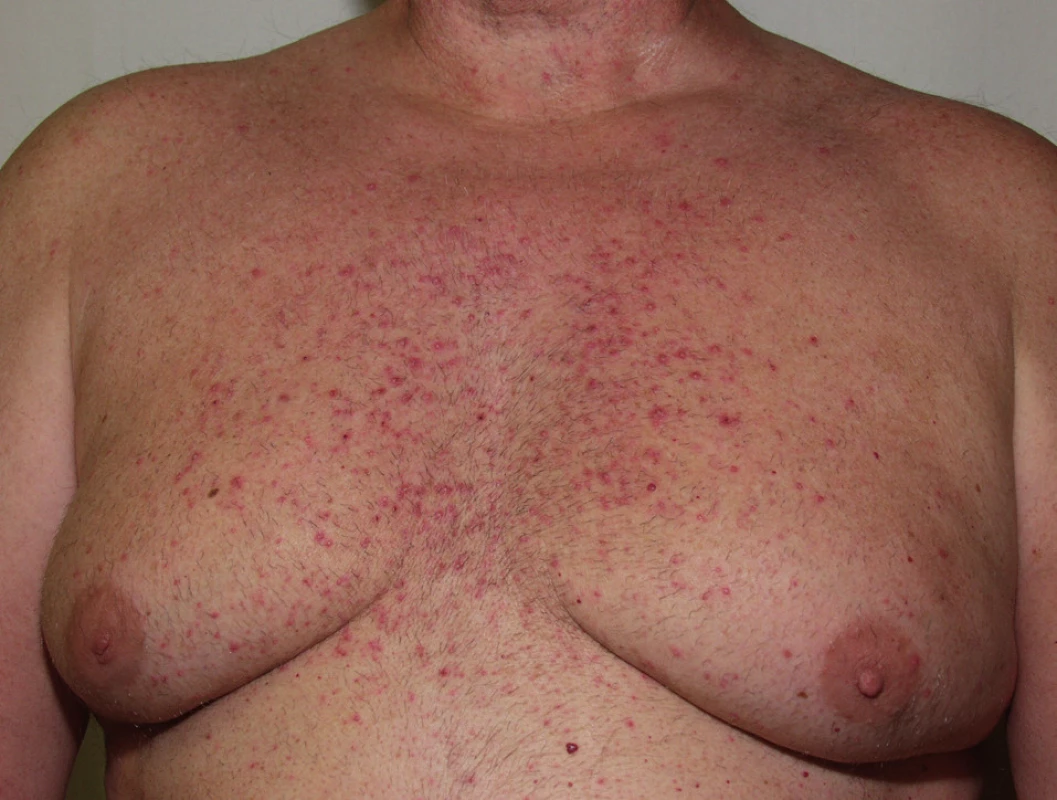
Papulopustulózní exantém postihuje až dvě třetiny pacientů při léčbě erlotinibem (obr. 3) či gefitinibem, až 91 % léčených cetuximabem (obr. 4) a 62 % panitumumabem. Při léčbě trastuzumabem se pozorují jen mírné změny u 18 % léčených (14). Objevuje se nejvíce v seboroické oblasti, v centru obličeje, ve kštici, na krku, ramenou a hrudníku. Jde o folikulárně vázané „akneiformní“ papuly a pustuly, které v těžších případech splývají, jsou doprovázené erytémem, medově žlutými krustami a olupováním, v okolí se tvoří teleangiektázie, což může připomínat rozaceu, impetigo či pyoderma faciale (obr. 5), jindy seboroickou dermatitidu. Podobně jako při rozacee jsou nejvíce postiženi lidé se světlou pletí. Exantém typicky vynechává místa dříve ozařovaná (18).
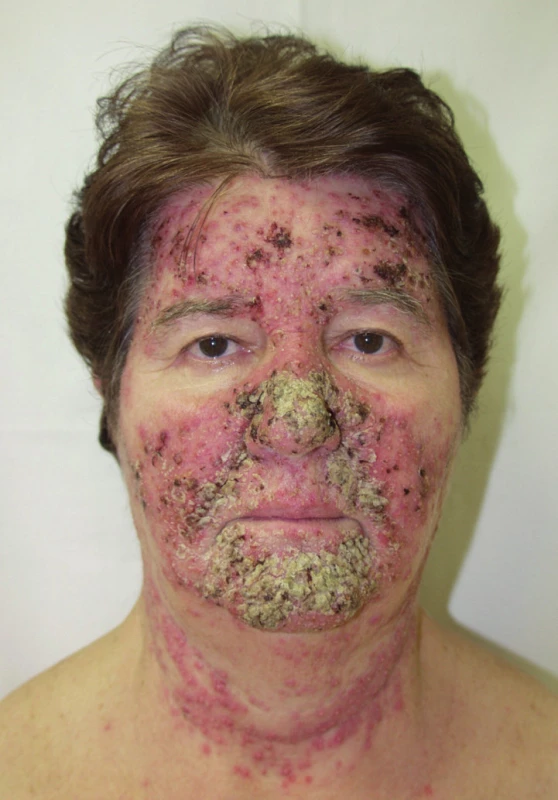
Projevy se mohou objevit již za 2–3 dny po monoklonálních protilátkách nebo za 7 až 10 dní při léčbě malými molekulami, s maximem postižení druhý a třetí týden a hojí se spontánně po ukončení léčby, někdy i již během terapie, mírnou hyperpigmentací, po případě jizvením.
Obsah pustul je sterilní, ale snadno dochází k druhotné infekci zlatým stafylokokem.
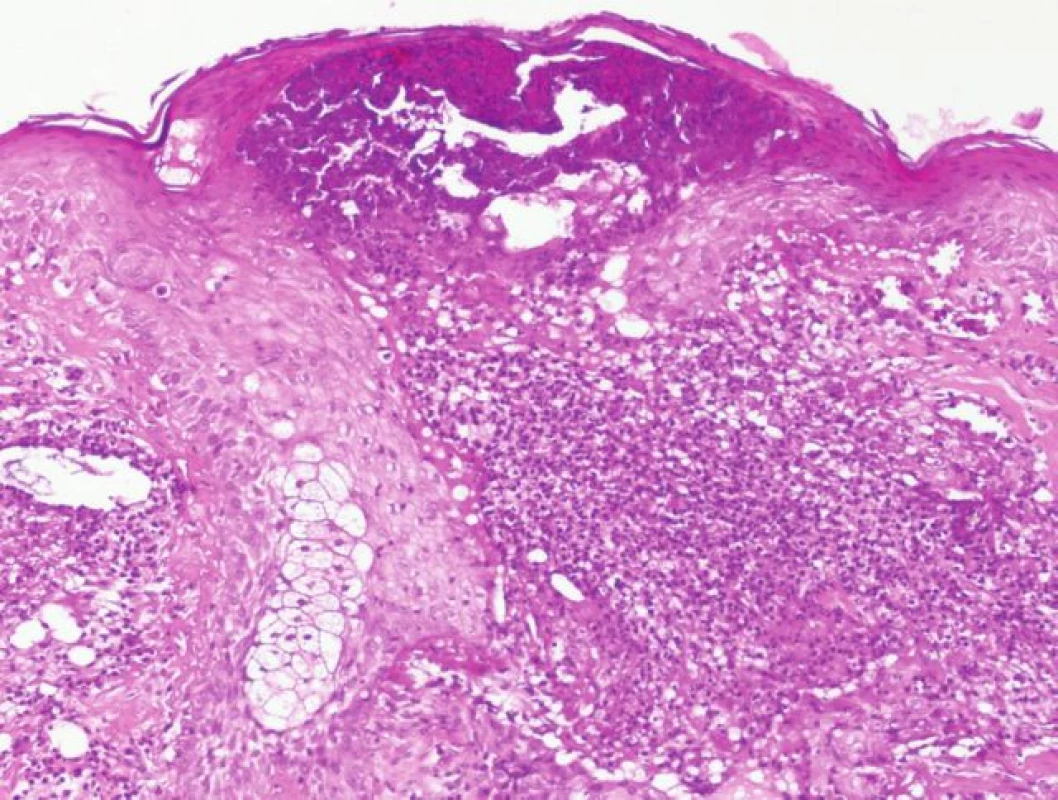
Histologicky se zjistí v počátku T-buněčný infiltrát okolo folikulu, poté se rozvíjí obraz neutrofilní folikulitidy a perifolikulitidy (obr. 6).
K hodnocení se používají klasifikace NCI-CTC (National Cancer Institute – Common Terminology Criteria). Podle poslední 4. verze klasifikace se rozlišují 4 stupně kožního postižení (viz dále).
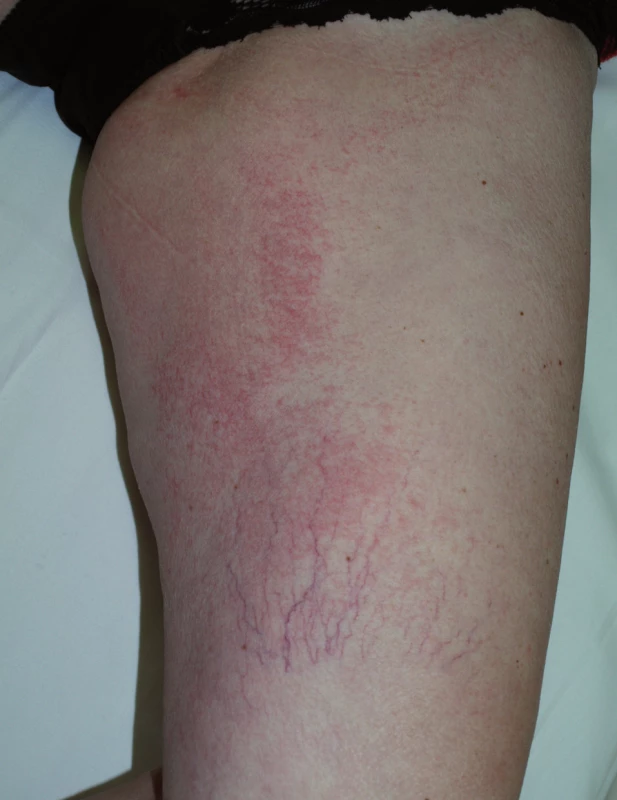
K dalším kožním změnám patří pruritus a suchost kůže (xeróza), která postihuje až 35 % nemocných, zejména starší nemocné s anamnézou atopického ekzému a po předchozích kúrách chemoterapie. Vyskytuje se v místech akneiformního výsevu a na končetinách, kde se tvoří až asteatotický ekzém (obr. 7). Na špičkách prstů dochází k olupování a objevují se bolestivé fisury (obr. 8).
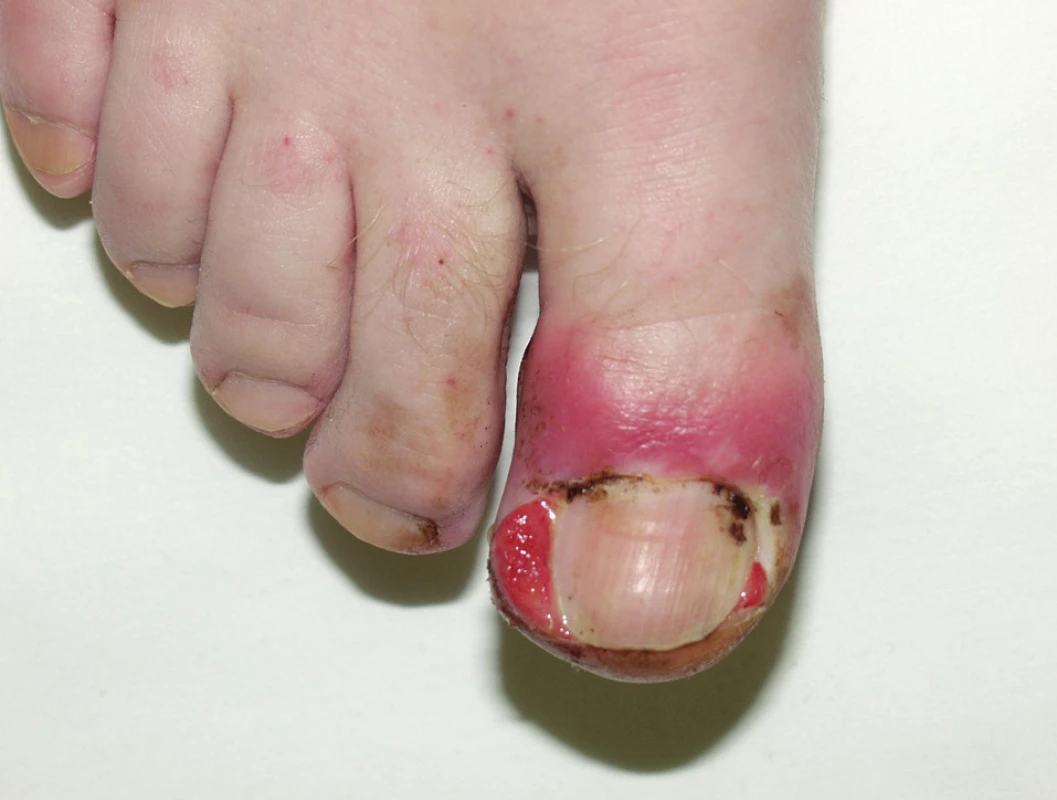
U 10 až 15 % pacientů vznikají po 2 až 4 měsících terapie paronychia s bolestivými pyogenními granulomy. Začínají většinou na palcích, ale mohou postihnout i jiné prsty (obr. 9), častá je opět sekundární infekce.
Vzhledem k obecně špatné prognóze a časnému úmrtí nemocných existují jen ojedinělé studie o kožních změnách při dlouhodobém podávání inhibitorů EGFR (15). Po několika měsících léčení již nebývají tak výrazné papulopustulózní výsevy, ale predominantně se vyskytuje xeróza, mukozitidy, změny růstu vlasů, vousů, obočí a řas (hypertrichóza, pomalý růst, jemné a vlnité vlasy, alopecie, trichomegalie), bolestivá paronychia a distální onycholýza.
Při prvním intravenózním podání cetuximabu a panitumumabu se mohou objevit vážné anafylaktické infúzní reakce (14), podobně i po trastuzumabu, vzácně je popsána vaskulitida a exacerbace psoriázy.
Vznik kožních nežádoucích reakcí se zdá být spojen s dobrou odezvou na protinádorovou léčbu. Proto je důležité kožní projevy léčbou dostatečně zmírnit, aby nebylo nutné snižovat či ukončit onkologickou léčbu. Také Dermatoonkologická sekce Onkologické společnosti JEP vytvořila podrobná doporučení k léčbě kožních změn vyvolaných EGFR inhibitory pro r. 2010.
Návrh léčebné strategie u papulopustulózního exantému (dle 4. verze NCI-CTC):
Prevence: emoliencia, hojivé antibakteriální krémy, fotoprotekce
Stupeň 1: papuly a/nebo pustuly na <10 % kožního povrchu (BSA): preventivní opatření
Stupeň 2: papuly a/nebo pustuly na 10–30 % BSA:
- lokální metronidazol 2krát denně
- lokální antibiotika
- benzoylperoxid
- v kombinaci s obklady s antiseptickými roztoky
- topické kortikosteroidy lze podat krátkodobě na úvod léčby
Stupeň 3: papuly a/nebo pustuly na ≥30 % BSA:
- celková tetracyklinová antibiotika (např. Doxybene 100 mg) v kombinaci s lokální léčbou
- při superinfekci protistafylokoková antibiotika (peniciliny, cefalosporiny)
- při svědění antihistaminika
- popř. snížení dávky EGFR inhibitoru
Stupeň 4: generalizované papuly a/nebo pustuly se sekundární infekcí:
- celková antibiotika ve vyšších dávkách (např. Doxybene 200 mg)
- přerušení léčby EGFR inhibitorem
Doporučený postup u xerózy, ekzému a fisur:
- emoliencia – vhodné krémy voda v oleji, masti, koupelové oleje
- lokální mírné až středně účinné kortikosteroidy
- při sekundární infekci lokální antibiotika
- u fisur masti s kyselinou salicylovou, ureou, přípravky pro vlhké hojení ran
Doporučený postup u paronychií:
- volné boty, antiseptické roztoky k obkladům či koupeli, antiseptické krémy
- silně účinné kortikosteroidní krémy pod okluzi v počátku
- při sekundární infekci lokální antibiotika, popř. celková protistafylokoková antibiotika
2.2 Inhibitory BCR-ABL tyrozinkinázy
Imatinib je inhibitor četných tyrozinkináz (blokující c-kit, onkoprotein BCR-ABL, PDGFR). Používá se zejména u chronické myeloidní leukémie, ale i u gastrointestinálních stromálních tumorů, metastazujícího dermatofibrosarkomu protuberans, hypereozinofilního syndromu a dalších chronických myeloproliferativních nemocí. Druhou generaci inhibitorů BCR-ABL tyrozinkinázy představují dasatinib a nilotinib, používané nově u chronické myeloidní leukémie při rezistenci na imatinib (6, 7).
Kožní nežádoucí reakce se popisují až v 89 % případů. Nejpestřejší škála kožních reakcí je zatím popisována u imatinibu. Obvykle se objevují již v prvních týdnech léčby a nejčastějšími jsou makulopapulózní exantémy, edémy nebo pruritus. Otoky mohou být okolo víček, na obličeji, ale i generalizované. Frekvence výskytu a tíže kožních reakcí závisí na dávce léku. Většinou jsou tyto reakce mírné intenzity a odeznívají spontánně, ale jsou popsány i závažné reakce, jako vaskulitidy, Stevensův-Johnsonův syndrom a akutní generalizovaná exantematická pustulóza (AGEP) vyžadující ukončení léčby (6, 7). Popisují se též lichenoidní exantémy, poruchy pigmentace, např. depigmentace kůže, hyperpigmentace nehtů, repigmentace již šedivých vlasů, a četné další kožní změny (obr. 10).
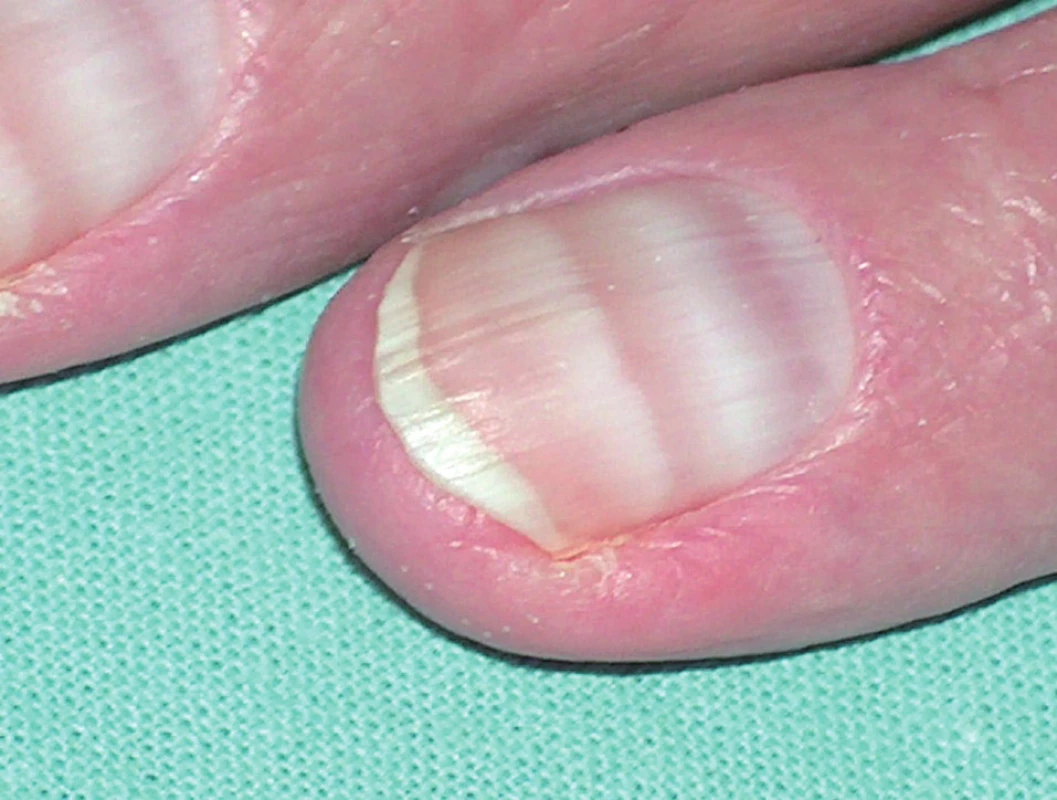
Klinické zkušenosti s léčením dalšími inhibitory jsou zatím omezené, kožní reakce se uvádějí u dasatinibu. Dasatinib vyvolává erytémy, exantémy a „exfoliativní dermatitidy“ až v 35 %, mukozitidy nebo stomatitidy a pruritus. Mezi další časté změny patří hyperhidróza, alopecie, xeróza, akné a poruchy pigmentace, vzácně se objevily případy panikulitidy (11).
2.3 Inhibitory multikináz
Sorafenib je perorální malá molekula schválená k léčbě karcinomu ledvin a jater; výzkumně je též účinná u řady dalších tumorů (maligní melanom, nemalobuněčný plicní karcinom a jiné solidní nádory). Působí inhibici receptorů VEGFR, PDGFR, inhibici Raf kinázy, Flt-3 a c-kit proteinu (1). Sunitinib je také perorální malá molekula multikinázového inihibitoru (PDGFR, VEGFR, Flt-3, c-kit), která se používá v léčbě pokročilého karcinomu ledvin a gastrointestinálních stromálních karcinomů, v klinických studiích se zkouší i v léčbě řady dalších nádorů.
Sorafenib (až v 48 %) a sunitinib (v 36 %) mohou způsobit za 3 až 4 týdny kožní reakce na rukou a nohou označované jako syndrom ruka-noha (anglicky hand-foot skin reaction), které se liší od akrálních erytémů pozorovaných při klasické chemoterapii (taxany, cytosin arabinosid, 5-fluorouracil aj). V místech tlaku (paty, hlavičky metatarzů) vznikají ostře ohraničené, erytémové, prosáklé otlaky, které jsou silně bolestivé a zhoršují se v horku (obr. 11).
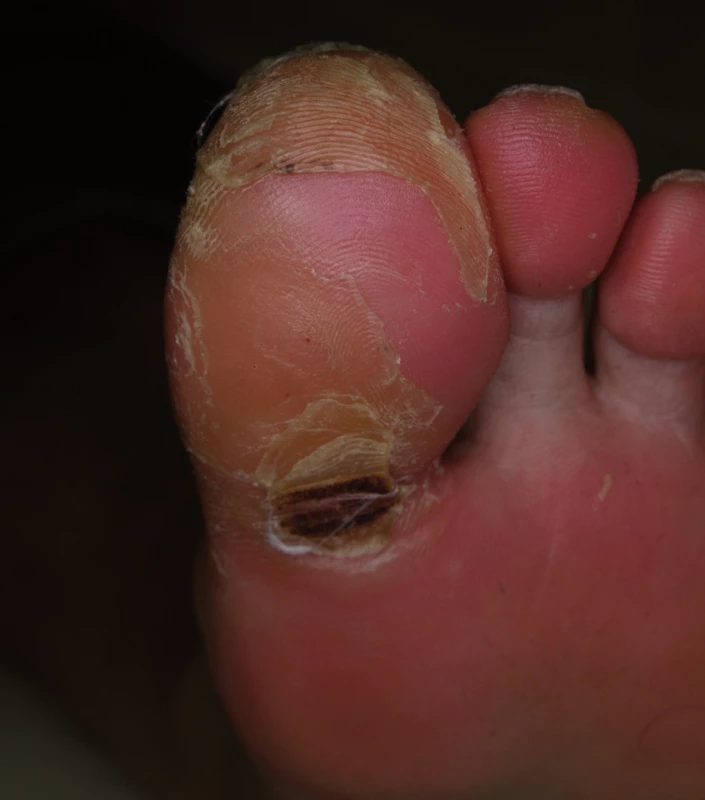
K hodnocení je možné použít 3. verzi klasifikace NCI-CTC pro nežádoucí účinky (16):
st. 1. minimální kožní změny (např. erytém)
st. 2. kožní změny (olupování, otok, puchýře) nebo bolest, bez narušení funkce
st. 3. ulcerace nebo bolestivé kožní změny s narušením funkce
Asymptomatické třískovité podnehtové hemoragie se pozorují u 40–70 % nemocných (obr. 12), častá je suchost kůže a sliznic, po případě alopecie či dysestézie kůže hlavy (9).
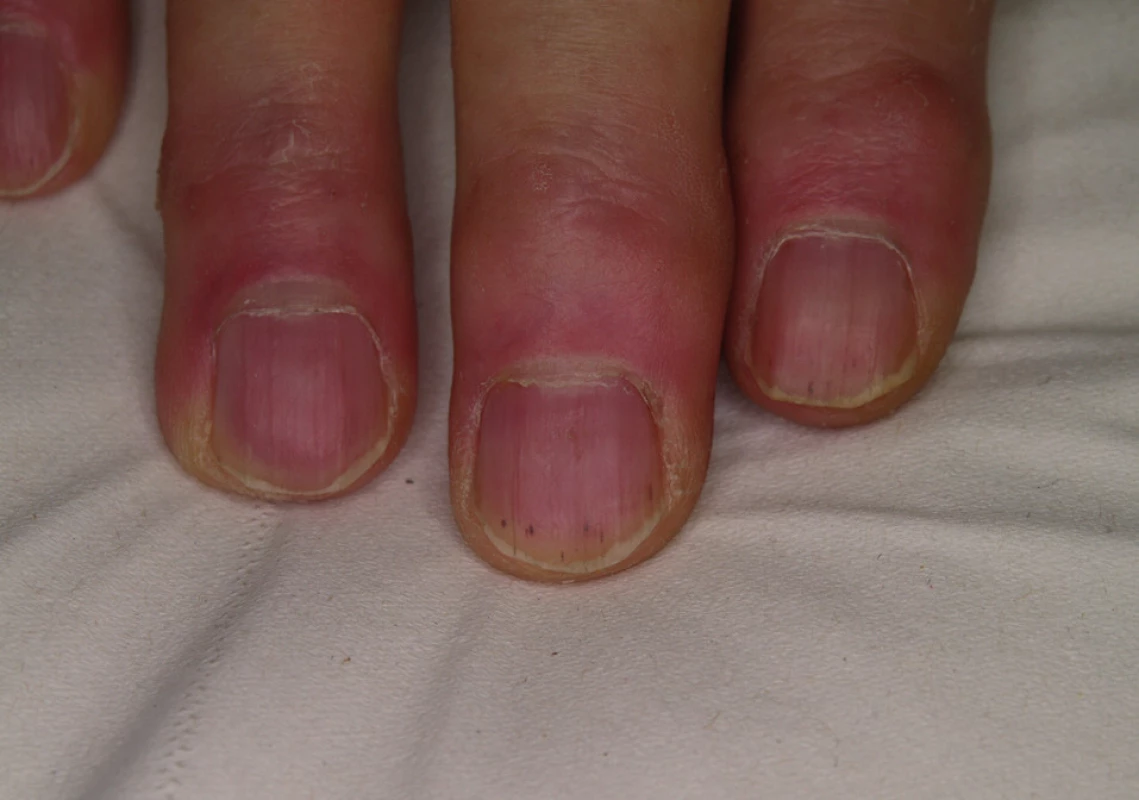
Sorafenib může vést také k erytému obličeje a ve kštici připomínajícímu seboroickou dermatitidu, někdy (ve 14–38 %) vzniká mírný stupeň papulopustulózního výsevu jako u inhibitorů EGFR.
Sunitinib vyvolává žluté zabarvení moči a také pokožky akumulací jeho žluté molekuly v kůži, reverzibilní depigmentaci vlasů a periorbitální edém (až v 50 %).
Profylaxí vzniku kožních palmoplantárních reakcí je používání emoliencií, mastí s kyselinou salicylovou či ureou k léčbě již existujících hyperkeratóz, koupelových olejů, nošení vhodné obuvi a ochranných rukavic, omezení zatěžujících aktivit a sportů. K léčbě se používají chladivé adstringentní obklady, silně účinné lokální kortikosteroidy a analgetika. Při neústupu pak v úvahu připadá dočasné snížení dávky léku, po případě podání celkových kortikosteroidů. Při xeróze a pruritu se používají emoliencia a antihistaminika, na projevy seboroické dermatitidy se doporučují krémy s ketokonazolem a mírně účinné kortikosteroidy (16).
2.4 Inhibitory proteasomu
Bortezomib selektivně a reverzibilně inhibuje proteasom, proteinový komplex v cytoplazmě a jádru buněk, který kontroluje degradaci buněčných proteinů. Je schválený k léčbě pokročilého mnohočetného myelomu. Nežádoucí účinky jsou většinou mírné. Z kožních změn se popisuje vznik červených nodulůči ložisek a makulopapulózníchexantémů na podkladě nekrotizující vaskulitidy cévek. Obvykle se tyto změny objevují během 3. až 4. cyklu podání a odeznívají za několik dní. Celkově se podávají antihistaminika anebo nízké dávky prednisonu, lokálně symptomatická léčba (6, 7).
2.5 Monoklonální protilátky a jiná onkologická léčba
Mezi další novou biologickou onkologickou léčbu patří monoklonální protilátky bevacizumab, rituximab, alemtuzumab, imunotoxin gemtuzumab ozogamicin a řada dalších, které se zatím zkoušejí v klinických studiích. Monoklonální protilátky jsou aplikovány intravenózně. Ve srovnání s klasickou chemoterapií jsou nežádoucí reakce vesměs mírné, nejčastěji jde o alergické reakce při první aplikaci, jak již bylo zmíněno při léčbě monoklonálními protilátkami – EGFR inhibitory.
Bevacizumab je monoklonální protilátka schválená jako první antiangiogenní látka, protože se váže na VEGFR, čímž ovlivní přímo angiogenezi řady tumorů (metastatický kolorektální karcinom, nemalobuněčný plicní karcinom aj). Mezi nežádoucí kožní reakce patří nespecifické změny neurčitě uváděné v rámci studií (exfoliativní dermatitidy, pruritus, xeróza, stomatitidy) a zpomalené hojení ran během léčby při ovlivnění angiogeneze (11).
Rituximab je monoklonální protilátka proti molekule CD 20 na povrchu B-lymfocytů, používá se proto v léčbě některých B-buněčných nehodgkinských lymfomů a revmatoidní artritidy (14, 19). Léčba je dobře snášena, pouze po prvním podání se až v 35 % rozvíjí infúzní reakce, projevující se horečkou, zimnicí, dyspnoí, bronchospasmem a také kožními změnami, jako kopřivkou, svěděním či začervenáním kůže. Jiné kožní reakce jsou poměrně vzácné, byly popsány případy vzniku psoriázy, paraneoplastického pemfigu, lichenu, vaskulitidy, toxické epidermální nekrolýzy a Stevensova-Johnsonova syndromu během léčby (10, 11, 19).
Alemtuzumab je monoklonální protilátka proti proteinu CD 52 na povrchu buněk, navázáním se navodí imunitní mechanismy vedoucí k destrukci buněk. Používá se v léčení chronické B-lymfocytární leukémie a nově u Sézaryho syndromu. Může opět vyvolat infúzní reakce při prvním podání na podkladě uvolnění cytokinů, při subkutánní aplikaci často vzniká lokalizovaný erytém a otok v místě injekce a může dojít k reaktivaci infekce herpes simplex či zoster.
Cytokiny(hematopoetické růstové faktory, interferony, interleukiny aj) většinou vyvolají jen mírné reakce v místě injekce, erytémy a pruritus, i když jsou popsány i případy vzniku závažných život ohrožujících reakcí (erytrodermie, bulózní dermatózy, autoimunitní nemoci) a exacerbace zánětlivých dermatóz (11).
Denileukin diftitox, fúzní protein s IL-2, způsobuje velmi časté hypersenzitivní reakce při prvním podání v léčbě primárních kožních lymfomů, při kterých se objeví exantémy až ve 25 % případů.
Palifermin, rekombinantní lidský růstový keratinocytový faktor, používaný ke zmírnění příznaků mukozitidy, může také vyvolat kožní reakce charakteru exantémů, erytému a pruritu.
2.6 Chemoterapie
Kožní reakce při klasické chemoterapii byly již probrány v časopise Čs. Dermatologie v roce 2001 (4). Zahrnují především velmi časté klinické změny jako alopecie, poruchy pigmentace, dystrofie nehtů, mukozitidy či stomatitidy, reakce na extravazaci, akrální erytém, tzv. recall reakce, fotosenzitivní a hypersenzitivní reakce a ekrinní dermatózy. Po nových cytostatikách se popisují i případy vzniku pseudolymfomu (gemcitabin), pseudosklerodermie (taxany, gemcitabin), lupus erythematosus (docetaxel), AGEP, toxické epidermální nekrolýzy (cladribin), paraneoplastického pemfigu (fludarabin) a lineární IgA dermatózy (gemcitabin) (6).
Závěr
Nežádoucí dermatologické reakce po moderních cílených lécích jsou velmi různorodé, někdy jsou tak časté, že postihují téměř všechny léčené. Protože neustále přibývají nová velmi účinná cílená léčiva, používaná také v různých kombinacích s jinou cílenou terapií nebo tradičními léky, zvyšuje se počet a doba přežívání vážně nemocných. Proto lze předpokládat, že se dermatologové budou setkávat s kožními reakcemi po onkologické léčbě stále častěji. Tyto kožní změny mají nepříznivý vliv na kvalitu života nemocných, kteří jsou vděčni za dermatologickou pomoc. Důležitá je proto víceoborová spolupráce, zejména mezi onkology a dermatology, jejímž cílem je zabránit rozvoji intenzivních kožních změn a nalezení vhodných léčebných strategií.
Doc. MUDr. Petra Cetkovská, Ph.D.
Dermatovenerologická klinika FN a LFUK
Dr. E. Beneše 13
305 99 Plzeň
E-mail:
cetkovska@fnplzen.cz
Sources
1. AUTIER, J., ESCUDIER, B., WECHSLER, J., et al. Prospective study of the cutaneous adverse effects of sorafenib, a novel multikinase inhibitor. Arch Dermatol, 2008, 144/7, p. 886-892.
2. BENÁKOVÁ, N., CETKOVSKÁ, P. Biologika v dermatologii. Biologická léčba, 2008, vol. 1, p. 31-37.
3. BORRÁS-BLASCO, J., NAVARRO-RUIZ, A., BORRÁS, C., CASTERÁ, E. Adverse cutaneous reactions induced by TNF-[alpha] antagonist therapy. Southern Med J, 2009, 102, p. 1133-1140.
4. CETKOVSKÁ, P., PIZINGER, K. Kožní změny při chemoterapii hematologických nemocí. Čes-slov Derm, 2001, 76(4), p. 196-200.
5. COLLAMER, AN., GUERRERO, KT., HENNING, JS., et al. Psoriatic skin lesions induced by tumor necrosis factor antagonist therapy: A literature review and potential mechanisms of action. Arthritis &Rheumatism, 2008, 59, p. 996-1001.
6. HAMMOND-THELIN, LA. Cutaneous reactions related to systemic immunomodulators and targeted therapeutics. Dermatol Clin, 2008, 26, p. 121-159.
7. HEIDARY, NH., NAIK, H., BURGIN, S. Chemotherapeutic agents and the skin: An update. J Am Acad Dermatol, 2008, 58, p. 545-563.
8. LACOUTURE, ME., LAI, SE. The PRIDE (Papulopustules and/or paronychia, Regulatory abnormalities of hair growth, Itching, and Dryness due to Epidermal growth factor receptor inhibitors) syndrome. Br J Dermatol, 2006, 155 (4), p. 852-4.
9. LEE, WJ., LEE, JL., CHANG, SE., et al. Cutaneous adverse effects in patients treated with the multitargeted kinase inhibitors sorafenib and sunitinib. Br J Dermatol, 2009, online early, p. 1-7.
10. LIMA, XT., SEIDLER, EM., LIMA, HC., et al. Long-term safety of biologics in dermatology. Dermatologic Therapy, 2009, 22, p. 2-21.
11. LITT, JZ. Drug eruption reference manual.14th ed. London: Informa healthcare, 2008, 658 p.
12. KRAJSOVÁ, I. Kožní projevy cílené léčby nádorů. Remedia, 2006, 16, p. 416-420.
13. MOSTOU, AE., MATEKOVITS, A., DESSINIOTI, C., et al. Cutaneous side effects of anti-tumour factor biologic therapy: a clinical course. J Am Acad Dermatol, 2009, 61, p. 486-500.
14. MYSKOWSKI, PL., HALPERN, AC. Cutaneous adverse reactions to therapeutic monoclonal antibodies for Cancer. Current Allergy and Asthma reports, 2008, 8, p.63-68.
15. OSIO, A., MATEUS, C., SORIA, J., et al. Cutaneous side-effects in patients on long-term treatment with epidermal growth factor receptor inhibitors. Br J Dermatol, 2009, 16/3, s. 515-521.
16. ROBERT, C., MATEUS, CH., SPATZ, A., et al. Dermatologic symptoms associated with the multikinase inhibitor sorafenib. J Am Acad Dermatol, 2009, 60, p. 299-304.
17. ROÉ, E., MURET, MPG., MARCUELLO, E., et al. Description and management of cutaneous side effects during cetuximab or erlotinib treatments: A prospective study of 30 patients. J Am Acad Dermatol, 2006, 55, p. 429-437.
18. SEGAERT, S., CHIRITESCU, G., LEMMENS, L., et al. Skin toxicities of targeted therapies. Eur J Cancer, 2009, 45, suppl.1, p. 295-308.
19. VENCOVSKÝ, J. a výbor České revmatologické společnosti. Bezpečnost biologické léčby – doporučení České revmatologické společnosti. Čes Revmatol, 2009, 17/3, s. 145-159. Web pages National Cancer Institute Fact Sheet
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2010 Issue 2
-
All articles in this issue
- Rosacea fulminans
- Kazuistický případ pacientky s netypickou lokalizací primárního syfilitického vředu
- Kožní reakce na moderní látky (biologická a ostatní cílená onkologická léčiva)
- Kontaktní přecitlivělost na pomocné látky přípravků kosmetických a farmaceutických u ekzematiků
- Kožné nežiaduce účinky inhibítorov receptora epidermálneho rastového faktora v onkologickej terapii
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Kazuistický případ pacientky s netypickou lokalizací primárního syfilitického vředu
- Kožní reakce na moderní látky (biologická a ostatní cílená onkologická léčiva)
- Rosacea fulminans
- Kožné nežiaduce účinky inhibítorov receptora epidermálneho rastového faktora v onkologickej terapii

