Retinoidy v dermatologii
Retinoids in Dermatology
The authors discuss the history of the development and classification of retinoids, their pharmacodynamic properties, including the biological potential for the treatment. The overview discusses the pharmacological and clinical characteristics of topical and systemic retinoids, their availability and current conditions of reimbursement in the Czech Republic. The main part is the use of retinoids in practice, more in detail the use of three systemic retinoids – acitretin, bexarotene and isotretinoin. The tables show the standard indications as well as the less common possibilities of their use, contraindications, dosing and current recommendations for clinical and laboratory examinations before and during treatment and follow-up. Detailed side effects and measures for their prevention, alleviation and early recognition are discussed. The advantages of retinoids such as the absence of immunosuppression, the possibility of combination therapy, the minimal drug interactions, and a generally good safety profile that outweight the potential risks that allow their use for long-term maintenance therapy, are also emphasized.
Key words:
retinoids – systemic therapy – practical use and perspective in dermatology
Authors:
N. Benáková 1,2; V. Vašků 3
Authors‘ workplace:
Dermatovenerologická klinika 1. LF UK a VFN Praha
přednosta prof. MUDr. Jiří Štork, CSc.
1; Dermato-alergologická ordinace ImmunoFlow Praha
vedoucí pracoviště MUDr. Matrin Fuchs
2; Dermatovenerologická klinika LF MU Brno
přednosta prof. MUDr. Vladimír Vašků, CSc.
3
Published in:
Čes-slov Derm, 92, 2017, No. 3, p. 111-122
Category:
Reviews (Continuing Medical Education)
Overview
Autoři předkládají historii vývoje a klasifikaci retinoidů, věnují se jejich farmakodynamickým vlastnostem včetně biologického potenciálu pro léčbu. V přehledu jsou probrány farmakologické a klinické charakteristiky lokálních a celkových retinoidů, jejich dostupnost a aktuální podmínky úhrady v České republice. Stěžejní část tvoří použití retinoidů v praxi, detailněji rozvedená pro tři systémové retinoidy – acitretin, bexaroten a isotretinoin. V tabulkách jsou uvedeny standardní indikace i méně obvyklé možnosti jejich použití, kontraindikace, dávkování a současná doporučení pro klinická a laboratorní vyšetření před zahájením léčby a sledování v jejím průběhu a po ukončení. Podrobně jsou probrány vedlejší a nežádoucí účinky a opatření k jejich předcházení, zmírnění a včasnému záchytu. Zdůrazněny jsou přednosti retinoidů, jako jsou absence imunosupresivity, možnost kombinované léčby, minimum lékových interakcí a obecně dobrý profil účinnosti k bezpečnosti, které převažují nad potenciálními riziky a umožňují použití retinoidů i pro dlouhodobou udržovací léčbu.
Klíčová slova:
retinoidy – celková léčba – praxe a perspektivy v dermatologii
ÚVOD
Retinoidy jsou významnou skupinou léčiv užívanou téměř výhradně v dermatologii. Po zavedení kortikoidů představovaly retinoidy další léky se zásadním významem pro celkovou i lokální dermatologickou léčbu [3]. V praxi se používají již přes čtyřicet let, jsou i nadále předmětem výzkumu, ale přesto nebyly jejich přesné mechanismy účinku v léčbě dermatologických chorob dosud plně objasněny. U většiny dermatóz není totiž jejich klinický efekt vysvětlitelný pouze vazbou na retinoidní receptory. Retinoidy mají řadu biologických účinků, což se odráží ve velkém množství indikací, u zcela odlišných jednotek. Zájem o retinoidy střídavě polevuje a potom, obvykle s příchodem nového léku či indikace, se znovu oživuje [23].
Retinoidy jsou přirozená či syntetická analoga vitaminu A, a to buď strukturální, nebo funkční. Strukturální retinoidy mají chemicky obdobnou strukturu vitaminu A, jedná se o jeho deriváty. Jako funkční retinoidy se označují léčiva s chemickou strukturu odlišnou od vitaminu A, jejichž biologický účinek je však retinoidům obdobný. Retinoidy vykazují pleiotropní účinky – modulují buněčnou proliferaci a diferenciaci, normalizují keratinizaci, snižují buněčnou kohezi; mají i určité imunomodulační a protizánětlivé účinky [1, 2, 3].
Vitamin A jako takový je důležitý pro morfogenezi, respektive embryogenezi, diferenciaci a fungování epiteliálních tkání, pro reprodukci a zrakové funkce. Vliv vitaminu A na biologii kůže se ozřejmil již počátkem 20. století, kdy se ve zvířecím modelu prokázaly poruchy keratinizace u myší s deficiencí vitaminu A. Později se při léčebném použití vitaminu A u lidí s poruchou keratinizace ukázaly jeho prodiferenciační účinky. Samotný vitamin A byl ale v účinných dávkách špatně tolerovaný a toxický, v nízkých pak málo účinný. To bylo podnětem k výzkumu syntetických derivátů vitaminu A – retinoidů. V 60. letech 20. století byl jako první retinoid syntetizován tretinoin, později pak isotretinoin, který byl zpočátku testovaný zejména u psoriázy a ichtyóz a až později u těžké akné. V 70. letech se zdařila syntéza aromatických retinoidů, tzv. arotinoidů, etretinátu a jeho metabolitu acitretinu, později motretinidu. Byl to průlomový počin pro léčbu psoriázy a dalších chorob s poruchou keratinizace, protože jejich účinnost a snášenlivost mnohonásobně převýšila terapeutický index původního tretinoinu. Koncem 90. let se objevil alitretinoin, vhodný pro lokální i celkovou léčbu ekzémů rukou. Tehdy se též objevily první údaje o zvláštní skupině léčiv s retinoidními účinky, tzv. RAMBAs, které blokují metabolismus endogenní kyseliny retinové. Jejich představiteli jsou liarozol a talarozol [3].
Odhalení jaderných receptorů pro kyselinu retinovou odstartovalo vývoj 3. generace retinoidů s vazbou na specifické receptory – jedná se o polyaromatické retinoidy, jako jsou adapalen, tazaroten a temaroten. Následovaly další retinoidy jako bexaroten, fenretinid a temibaroten, představující podskupinu s vazbou na receptory RXR, tzv. rexinoidy [3, 24]. Přehled generací retinoidů uvádí tabulka 1.
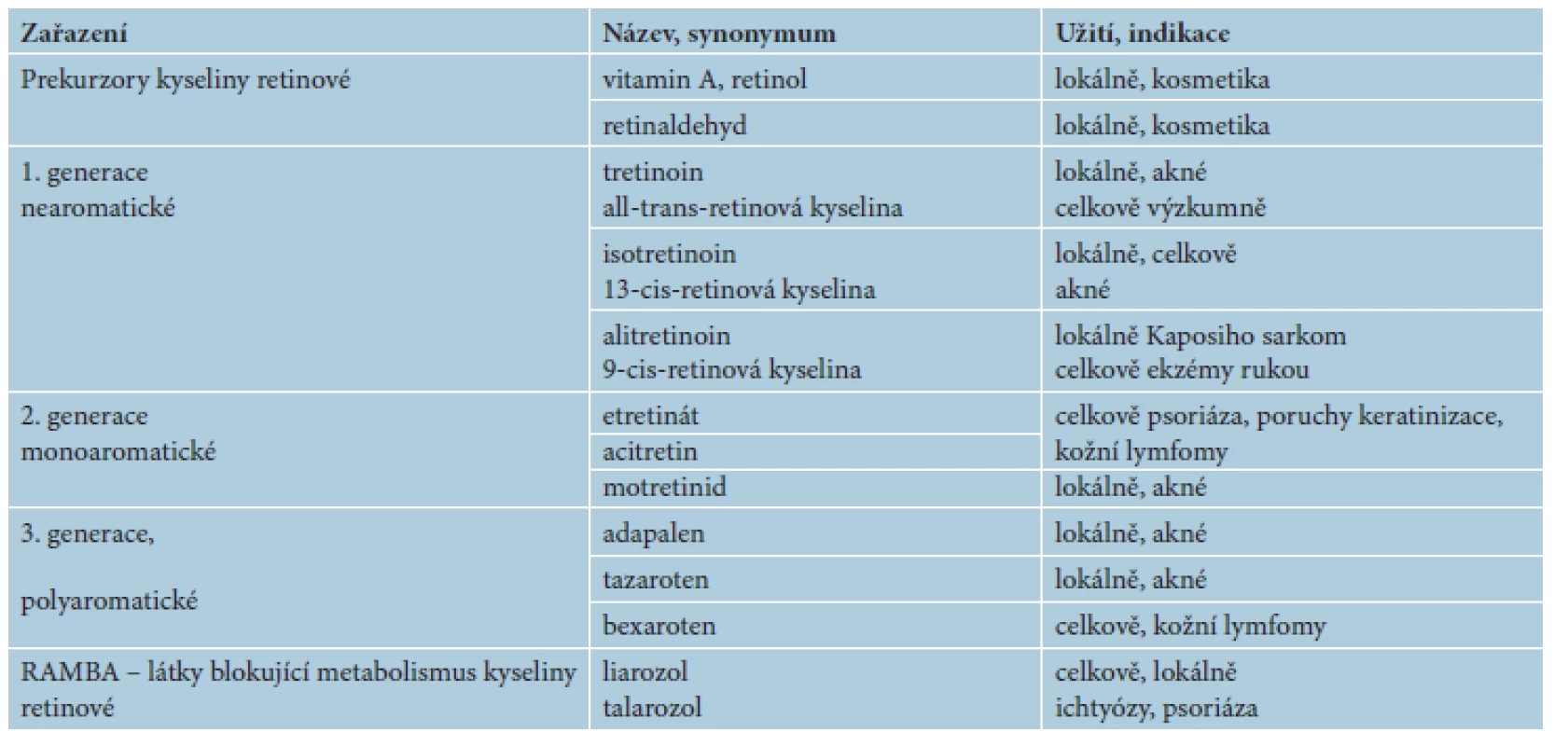
Retinoidy byly primárně zkoumány a vyvíjeny jako protinádorové léky. Mechanismus jejich chemopreventivního působení u rakoviny kůže i dalších orgánů, ale není dosud přesně znám. Předpokládá se indukce apoptózy, vliv na cyklus buněčného dělení, aktivace tumor suprimujících genů, inhibice ornitin dekarboxylázy, stimulace buněčné diferenciace aj. Údaje z experimentů ukazují, že retinoidy působí především ve fázi růstu a šíření nádoru. Skupina tzv. rexinoidů se uplatňuje právě u některých nádorových onemocnění [3, 19, 22].
Ve vývoji byla řada nových molekul retinoidů pro celkové užití. Jejich další osud je neznámý, neboť farmaceutickému výzkumu nyní dominují biologika a malé molekuly. Více lze od výzkumu retinoidů pro dermatologii v dohledné době očekávat spíše u lokálních retinoidů, kde se pozornost zaměřuje na lokální rexinoidy, na nové chemické a galenické formy stávajících retinoidů, případně na fixní kombinace retinoidů s jinými léčivy.
V článku se zaměřujeme na retinoidy k celkové léčbě, pro přehlednost jsou zmíněny i retinoidy k léčbě lokální.
FARMAKODYNAMIKA
Pro léčebné použití retinoidů je pochopení farmakodynamiky, tedy mechanismů jejich účinku, zásadní. A to i pro jejich léčebný potenciál u jiných dermatóz než je psoriáza, poruchy keratinizace či akné. Z farmakologických vlastností retinoidů vyplývají pro klinickou praxi i potenciální způsoby, jak ovlivňovat jejich účinnost, bezpečnost i snášenlivost, a zlepšit tak celkové výsledky léčby.
Vitamin A musí organismus získávat ze zevního prostředí, tedy potravou ve formě esterů retinolu (živočišný zdroj) a karotenoidů (rostlinný zdroj); zejména betakaroten je jedním z nejúčinnějších provitaminů A. Vitamin A je v krvi přítomen ve vazebném komplexu s retinol vazebným proteinem (RBP) a transthyretinem. Aktivní formou vitaminu A je all-trans-retinová kyselina, která je primárním ligandem pro všechny známe jaderné receptory. Retinová kyselina vzniká v cytoplazmě konverzí přes retinaldehyd za účasti transportních proteinů CRABP (cytosolické retinol vazebné proteiny). Tyto proteiny též přímo ovlivňují metabolizaci kyseliny retinové přes cytochrom P 450, a tak regulují její transkripční aktivitu, tedy i výsledné biologické účinky [2, 3, 24].
Účinek retinoidů je dán, podobně jako u hormonů, přímým působením na specifické regulační úseky DNA, tzv. RARE (retinoid acid response elements). Vazbou retinoidů na jaderné receptory dochází k transkripci specifických skupin genů. Do současnosti bylo odhaleno přes 500 genů regulovaných retinoidy. Dosud jsou známy dvě třídy těchto receptorů: receptory pro kyselinu retinovou (RAR, retinoid acid receptors) a retinoidní receptory X (RXR, retinoid X receptors). Označení X dostaly proto, že ligand těchto receptorů nebyl při jejich objevu tehdy znám [2, 3, 24].
Retinoidní receptory patří do velké skupiny jaderných receptorů, kam patří též receptory pro steroidy, vitamin D, tyroxin a receptory PPAR (receptory aktivované proliferátory peroxisomů) – ty všechny fungují jako transkripční faktory. Každá třída receptorů má tři izoformy (α, β, γ), které jsou kódovány vlastními geny. PPAR jsou oproti jiným receptorům v medicíně známy relativně krátce. Mají jako ostatní jaderné receptory velmi široké a zásadní účinky – uplatňují se při buněčné proliferaci, zánětu, metabolismu cukrů a tuků. Teprve nedávno byly zjištěny jejich přirozené ligandy, jako jsou např. polynenasycené mastné kyseliny, eikosanoidy, prostaglandiny, ze syntetických, léčebně využívaných jsou to např. statiny, glitazony či glitazary používané v léčbě metabolického syndromu [24].
Retinoidní receptory typu RXR tvoří jednak homodiméry s dalšími RXR, ale mohou tvořit i heterodimery, a to nejen s retinoidními receptory RAR, ale i s výše uvedenými receptory „hormonálními“. Následně tak dochází k interakci proteinů a signálních drah. Takže velmi zjednodušeně řečeno mohou tyto rexinoidy potenciálně nepřímo zasahovat, vyvolávat či tlumit některé účinky uvedených hormonů, respektive mediátorů, a to jak pozitivní, tak i negativní. Například bexaroten má antitumorozní účinky u T lymfomů, ale může způsobovat hypotyreózu, což klasické retinoidy s vazbou na RAR nepůsobí. Fenretinid má antitumorózní účinky u karcinomu prsu a experimentálně i další účinky, jako je např. léčba pseudomonádové plicní infekce u cystické fibrózy. Temibaroten se používá pro akutní promyelocytovou leukémii, výzkumně u mnohočetného myelomu, Alzheimerovy a Crohnovy choroby [3, 24].
Nepřímý účinek retinoidů na transkripci DNA je dán negativní regulací genů, které nemají úsek RARE. Komplex retinoidu s receptorem vede totiž ke snížení prozánětlivých transkripčních faktorů, jako jsou AP-1 (aktivátorový protein 1) a NF-IL 6 (jaderný faktor pro IL-6). Výsledný biologický účinek retinoidů může být dán ale i negenomicky mimo DNA, a to působením na buněčné membráně, fosforylací a dalšími mechanismy [3].
Obecně lze konstatovat, že mechanismus účinku retinoidů u konkrétní kožní choroby, a tedy i jejich účinnost, lze jen částečně vysvětlit výše zmíněnou koncepcí jaderných receptorů. Plejáda zcela rozdílných biologických účinků retinoidů ukazuje, že se zde uplatňují i jiné mechanismy a dráhy.
PŘEHLED RETINOIDŮ
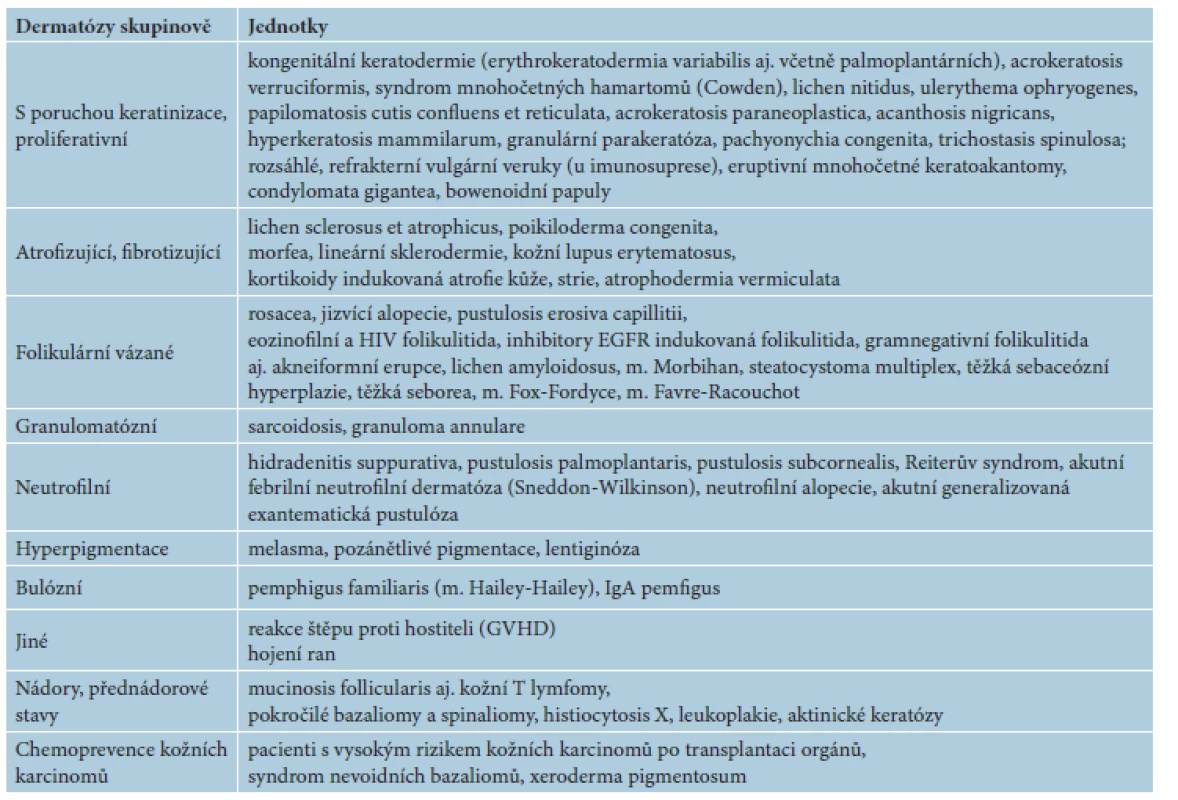
V následujícím textu jsou probrány základní farmakologické a klinické charakteristiky jednotlivých retinoidů, včetně dostupnosti a úhrady v České republice (ČR). Výčet hlavních indikací pro léčbu lokálními a celkovými retinoidy včetně dávkování je uveden v tabulce 2. Souhrn dalších indikací a možností jejich použití je uveden v tabulce 3. Kapitola je rozčleněna na lokální a na celkové retinoidy, z nichž jsou podrobněji rozvedeny acitretin, bexaroten a isotretinoin.
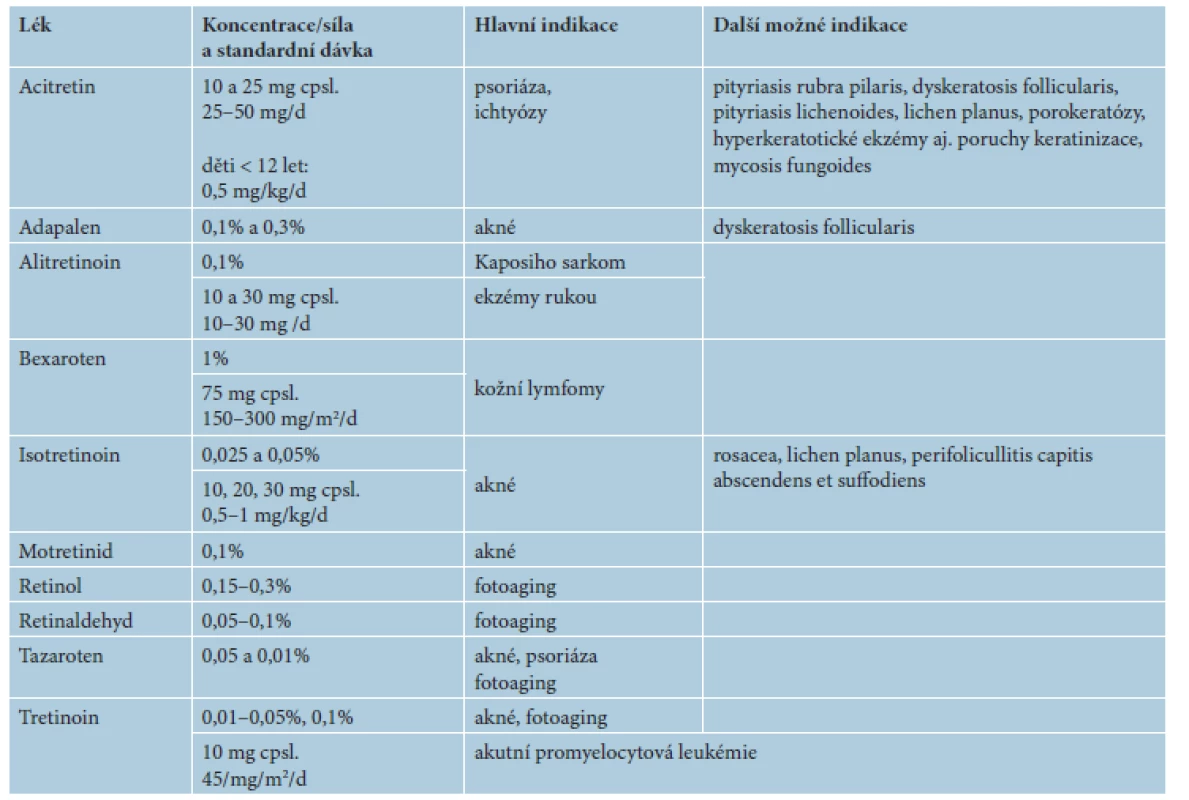
Lokální retinoidy
Adapalen je vysoce lipofilní, lokálně používaný syntetický retinoid 3. generace s afinitou pro receptory RAR β/γ, méně pro RAR α.V epidermis je cílovým receptorem RAR γ. Selektivně se vychytává v pilosebaceózní jednotce, proto má velmi dobrý efekt u akné. Ovlivňuje příznivě abnormální keratinizaci a zánět, nemá sebostatický účinek. Díky rozpustnosti v kožním mazu má minimální systémovou absorpci, a tudíž dobrou bezpečnost [3]. V ČR je registrovaný v lokální formě pro léčbu akné jako Differine a Belakne gel a krém, úhrada ze zdravotního pojištění a preskripce jsou bez limitace odborností (www.sukl.cz).
Tazaroten je „pro-léčivo“, které se kožními esterázami rychle konvertuje na aktivní metabolit, kyselinu tazarotenovou, s afinitou pro receptory RAR β/γ, méně pro RAR α. Rychle se metabolizuje, tudíž je systémová bezpečnost dobrá. Uplatňuje se v léčbě psoriázy ovlivněním řady mechanismů. Lokální tazaroten, Tazorac gel, již není v ČR dostupný (www.sukl.cz).
Účinnost celkové léčby psoriázy tazarotenem p. o. je prokazována v mnoha studiích III. fáze, pro běžnou praxi není v této formě zatím k dispozici. Má lepší profil bezpečnosti (jaterní a lipidový metabolismus) a snášenlivosti (mukokutánní vedlejší účinky) než acitretin [3].
Tretinoin (all-trans-retinová kyselina) představuje první syntetický retinoid. V lokální formě je součástí extern na léčbu akné, v ČR pod názvem Acnatac gel (kombinace s klindamycinem) a Aknemycin plus roztok (kombinace s erytromycinem), úhrada ze zdravotního pojištění a preskripce jsou bez limitace odborností. Lokální tretinoin samotný (Airol, Locacid, Retin A) již není v ČR registrovaný (www.sukl.cz).
V zahraničí se používá celkově jako součást kombinované léčby u akutní promyelocytové leukémie [3, 26], v ČR není pro celkové podání registrovaný.
I když nebyly teratogenní účinky při používání lokálních retinoidů u lidí nikdy prokázány, nedoporučuje se je v graviditě používat [2, 3].
Celkové retinoidy
Před zahájením celkové léčby retinoidy je třeba provést aktuální anamnestické, klinické a laboratorní vyšetření, zmapovat celkový zdravotní stav pacienta vzhledem k dlouhodobosti léčby. Vhodná edukace a pečlivé vyšetření pacienta před zahájením léčby, jakož i sledování v jejím průběhu a po ukončení umožňují jejich bezpečné použití. Z forenzního pohledu se lékař obecně řídí podle SPC platného v ČR a z praktického pohledu podle aktuálního anamnestického a klinického nálezu.
Laboratorně se obecně doporučuje vyšetření krevního obrazu a diferenciálního rozpočtu leukocytů, z lipidogramu minimálně triglyceridy a cholesterol, z jaterních testů pak vyšetření bilirubinu a transamináz ALT, AST, GMT, z ledvinných testů urea, kreatinin a dále glykémie. Před krevním odběrem je žádoucí dodržovat 12 hodin stravu bez tuků a 36 hodin bez alkoholu [1, 3, 29].
Kontraindikace celkové léčby retinoidy zahrnují: ženy gravidní, kojící a ve fertilním věku, které nemohou či nejsou schopné používat účinnou antikoncepci. Dále těžké nefropatie, hepatopatie a chronické abnormálně zvýšené hodnoty sérových lipidů, těžký diabetes a těžká osteoporóza. K relativním kontraindikacím se počítají abúzus alkoholu, drog, léků, pankreatitida v anamnéze, nespolupracující pacient.
Rizikoví jsou z hlediska výskytu potenciálních nežádoucích účinků pacienti, u nichž je současně diabetes mellitus, obezita, hyperlipoproteinémie, skeletální abnormity. Relativním rizikem je i vyšší věk [1, 2, 3, 12, 20, 29].
Lékové interakce se týkají z hlediska závažnosti především cyklinových antibiotik (doxycyklin, minocyklin aj.), kde hrozí intrakraniální hypertenze s příznaky pseudotumor cerebri. Další méně závažné, respektive potenciální interakce uvádí tabulka 4. Je vhodné abstinovat či výrazně omezit konzumaci alkoholu a doporučuje se nízkotučná strava. Léky inhibující P450 mohou zvyšovat hladinu, a tak i potenciální toxicitu retinoidů: cyklosporin A, imidazolová antimykotika, makrolidová antibiotika, gemfibrozil, nesteroidní antiflogistika a také grapefruitová šťáva. Nedoporučuje se užívat kyselinu acetylsalicylovou pro potenciaci slizničních nežádoucích účinků [3, 5]. Nevhodné jsou potravinové doplňky obsahující vitamin A, denní přísun vitaminu A by neměl přesáhnout 3000 IU, respektive 1 mg/kg/d [1, 3, 16, 20, 29].
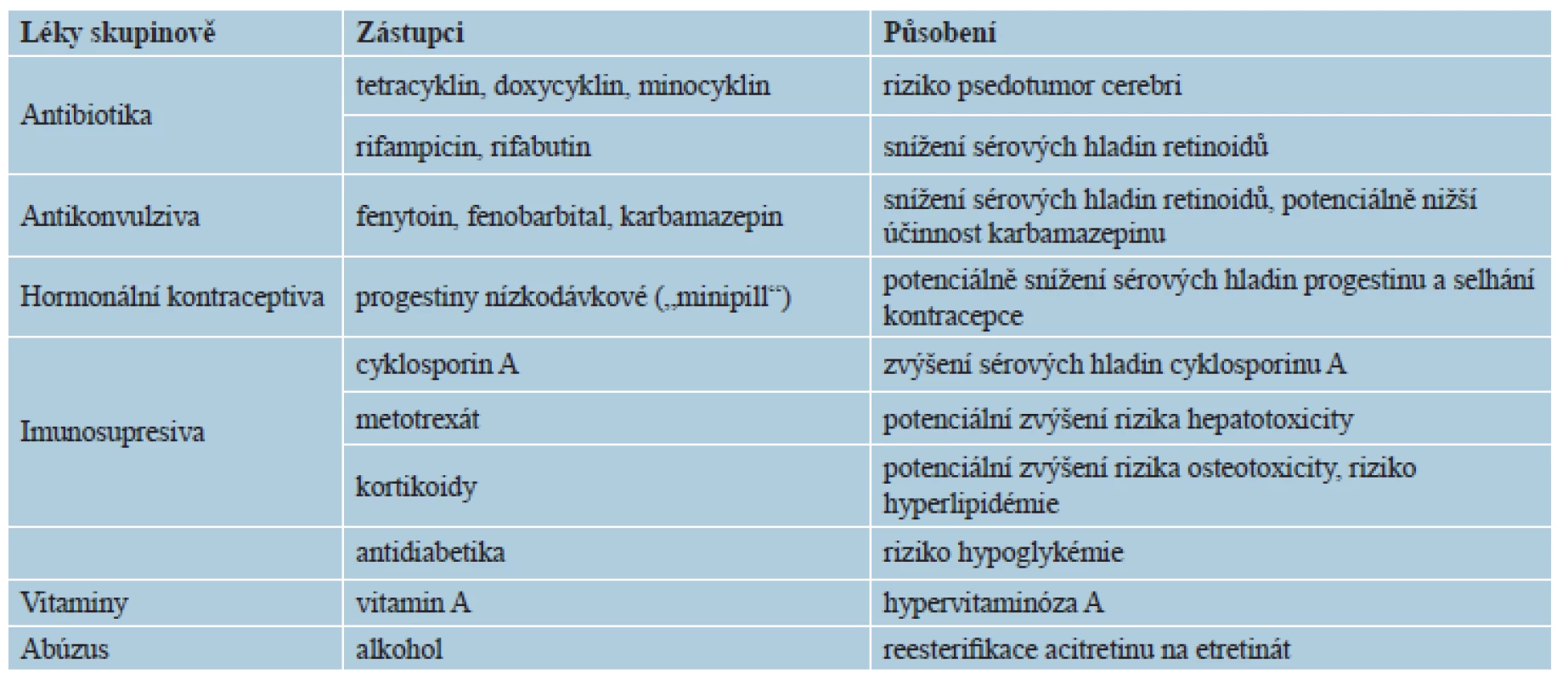
Pacienti obou pohlaví nesmí být po dobu tří let od ukončení léčby acitretinem dárci krve [20, 29], u ostatních retinoidů se tato doba odvíjí od jejich biologického poločasu [3, 29].
Ženy ve fertilním věku musí být poučeny, schopny a ochotny používat účinnou antikoncepci (optimálně dva typy) jeden měsíc před zahájením léčby, během léčby a ještě po jejím ukončení [29]. V případě acitretinu po tři roky, u isotretinoinu, bexarotenu (a alitretinoinu) je doporučována kontracepce jeden měsíc po ukončení léčby. Léčba by se u žen měla zahajovat v 2.–3. den menstruačního cyklu. Pokud žena léčená retinoidy přeci jen otěhotní, je nutno lék vysadit a kromě gynekologicko-prenatálních vyšetření se doporučuje provést stanovení hladiny retinoidů v krvi [1, 3]. Každá země má stran pravidel pro preskripci retinoidů u fertilních žen a monitorování pacientek během léčby poněkud odlišné regionální požadavky. V ČR jsou ve finální fázi přípravy speciální materiály Programu prevence početí pro isotretinoin (viz dále), u acitretinu a bexarotenu se takovéto materiály zatím nepřipravují.
Pro všechny retinoidy platí doporučení užívat lék po jídle nebo ho zapíjet mlékem, protože biologická dostupnost retinoidů je jinak nízká (okolo 25 %). Klinický neúspěch je často zaviněn špatným vstřebáváním [2, 3].
Z úhradového hlediska je rozhodující aktuálně platné znění indikačního omezení úhrady, u jiných indikací než uvedených lze zažádat u zdravotní pojišťovny o tzv. zvýšení úhrady léku.
Alitretinoin je přirozeně se vyskytující retinoid, který se váže na všechny typy receptorů RAR i RXR (pan-agonista). Absorpce z gastrointerstinálního traktu je variabilní. Biologický poločas alitretinoinu je 2–10 hodin, vylučuje se včetně jaterních metabolitů primárně močí. Koncentrace alitretinoinu v séru se navrací k normálním hladinám do 1–3 dnů po ukončení léčby. Mechanismus účinku u ekzému rukou není přesně znám, uplatňují se patrně imunomodulační a protizánětlivé účinky na antigen prezentující buňky a aktivované lymfocyty. Používá se u ekzému rukou dospělých, jež je refrakterní na lokální léčbu silnými kortikoidy. Doporučené dávkování se pohybuje v rozpětí 10–30 mg/den, léčba má být dlouhodobá, obvykle 3–6 měsíců. Lepší účinnost se udává u ekzému hyperkeratotického než u dyshidrotického [3].
V ČR byl alitretinoin registrovaný pod názvem Toctino 10 a 30 mg kapsle, registrace pozbyla platnosti v roce 2017 v důsledku tzv. sunset clause (§ 34 zákon č. 378/2007 Sb.). Ze sousedních zemí je lék dostupný např. v Slovenské republice či Spolkové republice Německo. V lokální formě je alitretinoin v ČR registrovaný jako Panretin gel pro léčbu kožních projevů Kaposiho sarkomu u pacientů se syndromem AIDS, kteří nereagují na antiretrovirovou léčbu a kde není třeba orgánové léčby AIDS. K dalším indikačně úhradovým podmínkám patří nemožnost použít radioterapii či chemoterapii, nepřítomnost lymfedému a ulcerací. V databázi léků SÚKLu je zařazen do skupiny cytostatik (www.sukl.cz).
Acitretin je hlavním metabolitem etretinátu, který byl jeho předchůdcem, zavedeným do klinické praxe před více než 40 lety. Acitretin patří do 2. generace retinoidů, aktivuje všechny typy receptorů RAR α,β i γ, přestože je jeho vazebná afinita k nim paradoxně slabá. U psoriázy vede k normalizaci keratinizace (patrně přes ovlivnění exprese genů pro EGF), ke zmírnění zánětu přes imunomodulaci (IL-6, Th17) a ovlivnění funkce neutrofilů [3, 5, 16, 20, 26, 29].
Předchůdce acitretinu etretinát byl 50krát lipofilnější než acitretin a kumuloval se v tukové tkáni. To vedlo k jeho velmi pomalému poločasu vylučování, až 120 dnů. Byl proto z bezpečnostních důvodů (teratogenita) v celkové léčbě zcela nahrazen acitretinem. U psoriázy je acitretin nejúčinnější u formy pustulózní, a to lokalizované i generalizované, kde představuje první linii léčby [13]. U ložiskové psoriázy je jeho účinnost obvykle nižší, v závislosti na tolerované dávce. Acitretin má biologickou dostupnost při užívání po jídle okolo 60 % (20–90 %), poločas vylučování acitretinu je jen 2–4 dny, kompletně se vyloučí do jednoho měsíce. V tukové tkáni se nekumuluje, ale může se v kombinaci s alkoholem reesterifikovat na etretinát. Z forenzních důvodů se proto doporučuje ženám kontracepce i po ukončení léčby – původně uváděné dva roky [1, 2, 3, 26] byly nyní výrobcem v rámci sjednocení s doporučeními v USA rozšířeny na roky tři i v Evropě – viz aktuální Souhrn údajů o léčivu [29]. V ČR je nyní registrován jediný acitretin – Neotigason (Actavis), 10 a 25 mg kapsle. Původní Neotigason (Roche) již registrován není (www.sukl.cz).
Acitretin je v ČR hrazený ze zdravotního pojištění při:
- a) léčbě těžkých generalizovaných forem psoriázy a všech forem pustulózní psoriázy nereagujících na jinou léčbu,
- b) léčbě morbus Darier, ichtyóz a jiných poruch keratinizace, léčbě zánětlivých chorob, jako např. lichen planus, lupus erythematodes aj., nereagujících na jinou léčbu.
Stran úhrady je třeba poznamenat, že indikační kritéria pro úhradu jakéhokoliv léku ze zdravotního pojištění nebývají identická s indikacemi v SPC či odbornými publikacemi. Znění indikačního omezení je uvedeno v Seznamu cen a úhrad léčebných prostředků a není neměnné, může dojít k úpravám na základě pravidelných revizí referenčních skupin léků SÚKLem. Preskripce a úhrada acitretinu je v ČR vázaná na dermatologa, nelze ji delegovat na jinou odbornost (symbol E, www.sukl.cz).
Nejčastější indikací acitretinu je závažná psoriáza všech forem [1, 2, 7, 9, 15, 16, 18, 20, 21, 25). Pustulózní psoriáza mívá nástup účinku rychlejší, do 2–4 týdnů, u ložiskové je pozvolný, pomalejší a může s dobou podávání dále narůstat. Zhodnocení účinku se vzhledem k latenci jeho nástupu doporučuje provádět až za 3–6 měsíců [1, 3, 12, 16, 25]. Při samotné monoterapii se kompletně zhojí jen cca 30 % případů, v dalších 50 % dochází k výraznému zlepšení ve všech zásadních parametrech – erytému, zejména ale infiltraci a deskvamaci, což se odráží v průměrném snížení PASI skóre o 60–70 %, podle dávky a doby léčby [3, 12, 25]. Ke kompletnímu zhojení je u ložiskové psoriázy obvykle zapotřebí kombinované léčby s lokálními léky (kortikoidy, analoga D vitaminu, cignolin) anebo s fototerapií (PUVA, NB UVB). Zbylých 20 % případů na systémovou léčbu acitretinem nereaguje („non-responders“) [3]. V dlouhodobé léčbě dosahuje acitretin srovnatelné účinnosti podle PASI 75 jako biologikum etanercept [16]. Lékem volby je acitretin u lokalizované pustulózní psoriázy a u palmoplantární psoriázy [1, 3, 25]. U generalizované pustulózní psoriázy či u erytrodermie má acitretin také velmi dobrý účinek (vyšší dávky až 1 mg/kg/den), lékem první volby je pouze v případě, že se nejedná o těžký, život ohrožující stav [3, 25]. Tam je zapotřebí léků s rychlým nástupem účinku, jako je cyklosporin A či některá biologika. Výhodný je acitretin též u pacientů s psoriázou a chronickým aktinickým poškozením kůže, kde může potlačovat vznik aktinických keratóz a i kožních nádorů [9]. Vzhledem k absenci imunosupresivních účinků lze acitretin použít u HIV pozitivních, onkologických a jinak imunosuprimovaných psoriatiků, kde je indikována celková léčba (a kde není acitretin kontraindikovaný). Vakcinace není v průběhu léčby nikterak omezena [9]. U větších operativních výkonů lze, spíše z pragmatických důvodů (zátěž jaterního metabolismu, lékové interakce), léčbu přechodně ukončit.
Dávkování u psoriázy se obecně pohybuje v rozpětí 25–75 mg/den, respektive 0,5–1 mg/kg/den. U diseminované ložiskové psoriázy má acitretin efekt až ve vyšších dávkách, které jsou ale špatně snášeny, proto se doporučuje začít dávkou nižší (25 mg/den) a postupně ji zvyšovat podle tolerance a účinku [1, 3, 25]. Optimální dávka, kde je vyvážená účinnost ke snášenlivosti, se průměrně pohybuje okolo 30 mg/den (25–50 mg/den), respektive 0,3–0,5 mg/kg/den [3, 12, 16, 25]. Vyšší dávky vedou ke zvýšené incidenci nežádoucích účinků a ukončení léčby pacientem. Po zhojení či stabilizaci se klesá na nejnižší, ještě účinnou dávku, adjustace je individuální [21, 25]. Výhodná je také potencující se kombinace s fototerapií (re-NB UVB, re-PUVA), která je účinnější než samotný acitretin a též účinnější než samotná fototerapie [1, 3, 7, 11, 12]. Léčbu acitretinem se doporučuje zahájit dva týdny před zahájením fototerapie, dostačující jsou dávky 25 mg/den a i méně [21], které jsou dobře snášené. Při kombinaci s fotochemoterapií PUVA snižují retinoidy též potenciální kancerogenní riziko [3].
Obdobné schéma léčby (re-NB UVB, re-PUVA) se používá i u mycosis fungoides, často v kombinaci s interferonem alfa nebo chemoterapií [3, 28].
Acitretin je nejen u psoriázy dobře kombinovatelný s lokálními, ale i celkovými biologickými léčivy. Kombinace s konvenčními celkovými léky (metotrexát, cyklosporin A) je možná v sekvenčním či rotačním režimu. Z důvodů bezpečnosti se souběžná dlouhodobá léčba nedoporučuje, je relativní kontraindikací. Souběžná léčba acitretinem a metotrexátem je možná s nejvyšší opatrností u těžké pityriasis rubra pilaris a u psoriázy [3].
Dávkování acitretinu u ichtyóz je obdobné jako u psoriázy. U morbus Darier se doporučuje začínat nízkými dávkami okolo 10 mg/kg/den z důvodu prevence potenciální počáteční exacerbace choroby. Obecně u této choroby dostačují ke zlepšení nižší dávky než u psoriázy. U rozsáhlé pityriasis rubra pilaris jsou často zapotřebí maximální dávky, kde je problém s tolerancí, proto se výjimečně používá i kombinace s metotrexátem. Jako chemoprofylaxe se acitretin užívá obvykle v dávkování 30 mg/den. Chronický a subakutní lupus erythematosus reaguje stejně dobře na isotretinoin i acitretin, výsledky jsou srovnatelné s léčbou hydroxychlorochinem. U všech těchto léčiv je problémem recidiva projevů po ukončení léčby [3, 12, 23].
Doporučený rozsah, ale i frekvence laboratorních vyšetření v průběhu léčby acitretinem doznaly v průběhu let změn a nejsou v současnosti ve světové odborné literatuře udávány jednotně. V posledním vydání uznávané americké učebnice [3] se u acitretinu doporučují kontroly lipidů, jaterních funkcí 1krát měsíčně v prvních dvou měsících a pak v 2–3měsíčních intervalech včetně krevního obrazu a glykémie. Pokud nejsou laboratorní hodnoty v normě nebo se zvyšuje se dávka nebo se jedná o potenciálně rizikového pacienta (obezita, diabetes, alkohol) anebo se objevily klinické potíže, tak častěji. V evropských doporučeních [16] se uvádí vyšetření lipidů a jaterních funkcí ve frekvenci 1krát měsíčně po první dva měsíce a pak po třech měsících, krevního obrazu po dvou měsících od zahájení léčby a pak po třech měsících. Jiný recentní zdroj [18] uvádí jednodušší schéma – kontroly všech parametrů se provádí v prvních třech měsících 1krát měsíčně, pak po třech měsících.
Vyšetření a vyloučení gravidity je třeba provádět každý měsíc (datum poslední menstruace, pravidelnost používání antikoncepčních metod atp.). Provádění těhotenského testu v průběhu léčby, jak je uváděno v SPC [29], je na zvážení lékařem (analogicky jako u isotretinoinu). U acitretinu nejsou zatím zavedeny obligatorní speciální materiály SÚKLu (Program prevence početí), a tak jsou dostačující záznamy ve standardní zdravotnické dokumentaci jako doposud. Antikoncepce pacientů mužů není nutná [29].
U dětí se acitretin používá v situacích, kdy selhaly jiné možnosti léčby a kde prospěch léčby převažuje nad jejími riziky. Vzhledem k absenci imunosupresivních účinků představuje acitretin první volbu u dětí v léčbě generalizované pustulózní psoriázy, u gutátní psoriázy a u diseminované vulgární psoriázy s malou infiltrací ložisek („thin-plaque psoriasis“), dále u palmoplantární psoriázy [13]. V SPC není dolní věková hranice uvedena [29]. Reference o účinnosti a bezpečnosti acitretinu u dětí s psoriázou jsou již od věku šesti měsíců [13]. Pečlivé klinické a laboratorní sledování je podmínkou a odpovídá doporučením pro dospělé. U dětí je při dlouhodobé léčbě pro riziko předčasného uzávěru epifyzeálních štěrbin a retardace růstu třeba ve spolupráci s pediatrem sledovat růstové parametry – kostní věk, výšku, růstový poměr. V udržovací léčbě se doporučují dávky 0,1–2 mg/kg/den [29]. Kostní změny jsou u dávek pod 1 mg/kg/den vzácné, údaje jsou spíše u dávek vyšších, a to při léčbě ichtyóz [3, 4, 13].
Bexaroten je selektivní retinoid 3. generace, váže se téměř jen na RXR receptory, respektive vazba na receptory RXR je stonásobně vyšší než na receptory RAR [3]. Tento rexinoid se používá pro lokální i celkovou léčbu kožních T-buněčných lymfomů (CTCL) [3, 10, 29]. Na bílkoviny se váže 99 % léku, metabolizuje se v játrech prostřednictvím cytochromu P4503A4 na hydroxybexaroten a oxybexaroten a vylučuje se pouze stolicí, respektive žlučí přes hepatobiliární systém. Biologický poločas je 7–9 hodin.
Bexaroten je lék v praxi používaný výlučně v onkologické indikaci, a to pro T-buněčné kožní lymfomy (CTCL). Předchozí retinoidy, jako jsou isotretinoin, etretinát a acitretin, se pro své působení jako modifikátory imunitní odpovědi v léčbě kožních kožních T-buněčných lymfomů využívaly po více než dvě desetiletí. Bexaroten jako představitel rexinoidů (poprvé popsán v roce 1990 Mangelsdorfem) se svou biologickou aktivitou od zmíněných agonistů receptorů pro kyselinu retinovou (RAR) liší. Váže se a aktivuje receptory RXR α , β a γ , tyto tři izotypy vykazují tkáňově specifickou expresi a částečně se funkčně překrývají. Receptory RXR působí jako transkripční faktory v regulaci mnoha buněčných dějů včetně buněčné diferenciace a proliferace, apoptózy, citlivosti na inzulin a metabolismu tuků. Receptory RXR můžeme považovat za intracelulární senzory regulující buněčnou a tkáňovou homeostázu. Bexatoren je prvním selektivním retinoidem s vazbou na RXR, který se uplatnil v humánní medicíně. Jeho antikancerogenní a metabolické účinky jsou dány schopností tvořit homodimery a homotetramery. Zdál se být slibný i u solidních tumorů, některých leukémií apod. [19, 22]. Nejdříve se do praxe dostal v USA v roce 1999, v Evropě je dostupný od roku 2002, a to k léčbě pokročilých kožních T-buněčných lymfomů (CTCL), nereagujících nejméně na jednu celkovou léčbu. Bexaroten, pan-RXR-agonista, rovněž prokázal svou účinnost a bezpečnost u CTCL časných stadií nereagujících na jinou terapii.
Mechanismus účinku u CTCL není zcela přesně známý, pravděpodobně přes regulaci buněčné proliferace a diferenciace a indukcí apoptózy [3, 19, 22, 28]. Bexaroten spouští apoptózu závislou na dávce u buněčných linií CTLC, dále snižuje expresi receptoru CCR4 a expresi E-selektinu, narušuje tedy přestup maligních buněk T-lymfomu do kůže. Léčba bexarotenem snižuje matrixmetaloproteinázy (MMP) a zvyšuje sekreci jejich tkáňových inhibitorů TIMP (tissue inhibitors of matrix metaloproteinases). MMP jsou důležité v remodelaci tkání, ale uplatňují se významně v procesu šíření nádorů, zde lymfomu. Bexaroten snižuje také potenciál angiogeneze. Je používán v monoterapii i v kombinovaných režimech. Bexaroten schválila Evropská léková agentura (EMA) pro léčbu kožních projevů stadia II B až IV B u pacientů neodpovídajících na nejméně jednu celkovou terapii. V USA je bexaroten podle FDA (Federal Drug Agency) schválen již od stadia I B [10, 28].
Pro celkovou léčbu je v ČR registrovaný a dostupný Targretin 75 mg kapsle. Podle aktuálního indikačního omezení úhrady je bexaroten hrazen v další linii léčby pokročilého stadia kožního T-buněčného lymfomu (CTCL), rezistentního vůči nejméně jedné celkové léčbě, u dospělých pacientů. V databázi léků SÚKL je zařazen do skupiny cytostatik. Lék je vázán na specializovaná pracoviště se smlouvou se zdravotní pojišťovnou pro léčbu tímto lékem (symbol S). V lokální formě není bexaroten v ČR registrován (www.sukl.cz).
Dávkování bexarotenu p. o. se řídí podle plochy tělesného povrchu. Doporučená úvodní dávka je 300 mg/m2/den a je podávána současně s jídlem. Za dvě hodiny po podání je koncentrace v plazmě nejvyšší. K minimalizaci vedlejších účinků může být úvodní dávka i nižší, 150 mg/m2/den. Další vývoj dávkování se poté řídí podle klinické odpovědi a toxicity, po měsíci se obvykle zvyšuje na 300 mg/m2/den [3]. Maximální dávka je 650 mg/m2/den. V případě léčebné odpovědi by měla být léčba kontinuální [19, 29].
Bexaroten je kromě obecných kontraindikací retinoidů kontraindikován dále u pacientů s pankreatitidou v anamnéze, relativní kontraindikací je leukopenie a hypotyreóza. U pacientů s postižením jater či ledvin je nutná zvýšená opatrnost. Striktním požadavkem u žen ve fertilním věku je zajištění dvou typů antikoncepce, kterou je nutno začít užívat měsíc před zahájením léčby a pokračovat ještě měsíc po jejím ukončení. Kontrolu stran vyloučení gravidity je třeba provádět při každé návštěvě u lékaře. U bexarotenu nejsou zatím zavedeny obligatorní speciální materiály SÚKLu (Program prevence početí), a tak jsou dostačující záznamy ve standardní zdravotnické dokumentaci jako doposud. V SPC je uvedena nutnost antikoncepce mužů pacientů, jejichž partnerky jsou těhotné nebo mohou otěhotnět, tedy používání kondomu během léčby a jeden měsíc po jejím ukončení [29].
Vedlejší účinky bexarotenu lze předvídat; tíže vedlejších účinků souvisí s výší dávky. Bexaroten má odlišný profil vedlejších účinků než předchozí retinoidy – účinky mukokutánní a muskuloskeletální prakticky nevyvolává [3]. Téměř u všech pacientů se vyskytuje hyperlipidémie, především zvýšení triacylglycerolů. Je tedy nutná dieta s omezením tuků, větší část pacientů však potřebuje hypolipidemika, obvykle fibráty. Konstantním nálezem je snížení hladin TSH, substituce levotyroxinem v dávce 25–50 μg je obvykle nutná. U 18 % pacientů se vyvíjí leukopenie, anémie je méně častá. Kromě obecných lékových interakcí pro retinoidy je u bexarotenu zmiňován zejména gemfibrosil, který zvyšuje plazmatickou hladinu bexarotenu, a tím jeho potenciální toxicitu [3].
Laboratorní sledování v průběhu léčby zahrnuje kromě obvyklých vyšetření jaterních testů a lipidů též hladiny thyroideu stimulujícího hormonu a volného tyroxinu 4 (TSH, fT4) v intervalu 1–2 týdnů až do dosažení cílové dávky, pak v intervalu po 1–2 měsících. U bexarotenu se totiž objevuje jako nežádoucí účinek hypotyreóza, patrně v důsledku suprese TSH [19, 22, 28, 29]. Také může dojít k neutropenii, nejčastěji v 2. – 4. týdnu léčby, takže se s uvedenými testy sleduje i kompletní krevní obraz [3, 28, 29]. U ostatních retinoidů se hematologické nežádoucí účinky nevyskytují a není třeba je tak často sledovat, u HIV pozitivních je však monitorování hematologických hodnot žádoucí [3]. Některé zdroje uvádějí u bexarotenu i sledování clearance kreatininu [3].
Bexaroten lze použít u pokročilých CTCL jako monoterapii, nejvyšší účinnost, vyjádřená prostřednictvím ORR (overal response rate), se popisuje u dávky 650 mg/m2/den. Léčebná odpověď může být při udržovací terapii dlouhodobá. Bexaroten lze s úspěchem kombinovat s dalšími postupy, jako je: fotochemoterapie PUVA, extrakorporální fotochemoterapie-fotoferéza (ECP), elektronová radioterapie (TSEB – total surface elektron beam), metotrexát a interferon alfa. K léčbě reziduálního kožního nálezu lze úspěšně použít bexaroten v kombinaci s fotodynamickou terapií, případně i imiquimodem. Možné jsou kombinace s vorinostatem, gemcitabinem, pralatrexátem, denileukin diftitoxem [10, 19, 28].
Isotretinoin (stereoizomer tretinoinu) je přirozený metabolit vitaminu A. Afinita k dosud známým retinoidním receptorům je slabá, takže mechanismus účinku na mazovou žlázu u akné vede jinými cestami. Na rozdíl od vitaminu A nedochází u isotretinoinu ke kumulaci v játrech či tukové tkáni. Vylučuje se – včetně metabolitů – močí a stolicí. Biologický poločas je okolo 20 hodin. Po ukončení léčby klesne jeho hladina na fyziologické hodnoty do 2 týdnů. Tomu odpovídá i doporučovaný bezpečnostní interval kontracepce pro fertilní ženy – jeden měsíc po léčbě. Isotretinoin je jediný retinoid se sebostatickým účinkem a jediný lék, se kterým lze dosáhnout dlouhodobé remise až vyléčení akné [2, 3, 6].
Aktuální znění indikačního omezení úhrady zahrnuje pouze akné, a to těžké formy akné (acne nodulocystica/conglobata nebo formy s rizikem trvalého jizvení), kde prokazatelně selhala jiná léčba. Po vymizení příznaků, respektive po dosažení doporučené kumulativní dávky, není léčba dále hrazena. Preskripce isotretinoinu je v ČR vázaná na dermatologa, nelze ji delegovat na jinou odbornost (symbol E). V ČR jsou registrované a dostupné Aknenormin 10 a 20 mg kapsle a Curacné 10, 20 a 40 mg kapsle. Originální Roaccutan již není registrován. V lokální formě byl isotretinoin v kombinaci s erytromycinem součástí Isotrexin gelu (registrace ukončena). A ani jako monopreparát není lokální isotretinoin na trhu v ČR dostupný (www.sukl.cz).
Nejčastější indikací isotretinoinu je závažná akné, dolní věková hranice je 12 let. Kromě obvyklých kontraindikací celkových retinoidů zde přistupují kontraindikace psychiatrické, respektive suicidální tendence v anamnéze.
Dávkování isotretinoinu v léčbě akné doznalo během let řady změn. Obdobného léčebného účinku jako u původně doporučované vysoké dávky 1 mg/kg/den lze totiž dosáhnout dávkami nižšími, ale podávanými po delší dobu, které mají podstatně méně nežádoucích účinků [2, 3, 6, 17]. Rozhodující pro účinek je tedy nejen dávka, ale i doba léčby, neměla by však být kratší než 6 měsíců. Podle posledních doporučených postupů Evropského dermatologického fóra (EDF) z roku 2016 [6, 17] se u středně těžké akné doporučuje dávkování 0,3–0,5 mg/kg/den, u těžké akné nad 0,5 mg/kg/den. V udržovací léčbě se doporučuje nízká dávka 0,3 mg/kg/den. K prevenci relapsů při nižším dávkování je vhodné dosáhnout doporučované kumulativní dávky 120–150 mg/kg. Ani ta již není vnímána rigidně, u dobře reagujících případů může být nižší, rozhodně by ale neměla být nižší než 70 mg/kg. Nástup účinku je i u isotretinoinu pozvolný, v horizontu 1–3 měsíců. Přibližně jedna třetina pacientů potřebuje druhou kúru isotretinoinu z důvodu perzistence či relapsu [3]. U rosacey jsou obvykle dostačující nízké dávky okolo 10–20 mg/den.
Laboratorní kontroly jaterních testů a lipidů se podle současných evropských doporučení provádí v průběhu léčby po třech měsících, vyloučit těhotenství je třeba při každé kontrole, respektive každý měsíc a ještě pět týdnů po ukončení léčby [6, 17, 29]. Provádění přímo těhotenského testu je podle aktuálního stanoviska SÚKLu obligatorní pouze před zahájením léčby a po jejím ukončení; v průběhu léčby je na zvážení lékaře. Antikoncepce mužů pacientů není nutná [29]. Při každé kontrole se anamnesticky sleduje i případný vznik poruch nálady, deprese.
Program prevence početí je u isotretinoinu řešen speciálními materiály v gesci SÚKLu a držitelů registračního rozhodnutí pro p. o. isotretinoin. Spadá do agendy farmakovigilance SÚKLu, záměrem je dostát požadavkům Evropské lékové agentury EMA. Smyslem je minimalizace rizik léčby (teratogenita, ale i jaterní a lipidový metabolismus, deprese). Jedná se o materiály pro lékaře a pacienty (ženy i muže): příručka pro lékaře, kontrolní seznam provedených vyšetření, informační brožura, brožura o antikoncepci, kartička pro pacienty, informovaný souhlas. Odborná veřejnost s nimi bude seznámena, jakmile bude k dispozici definitivní znění, a to na dermatologických odborných akcích, cestou Sekce pro akné a obličejové dermatózy ČDS ČLS JEP, SÚKLu (www.sukl.cz) nebo i Veřejně přístupné informační služby výrobce (např. www.pf-vpois.cz).
LÁTKY BLOKUJÍCÍ METABOLISMUS KYSELINY RETINOVÉ
Tyto látky zvyšují endogenní hladiny kyseliny retinové v kůži a dalších tkáních prostřednictvím blokování její metabolizace jaterními enzymy cytochromu P 450 (retinoid acid blocking agents, RAMBAs). To s sebou nese riziko systémové toxicity, zejména v oblasti lékových interakcí. Zástupci jsou liarozol (imidazolový derivát) a talarozol (triazolový derivát), které ale nemají antimykotické účinky. Vývoj vytvořil jak celkové, tak lokální formy těchto léků. Liarozol je účinný u ichtyóz, má stejnou účinnost jako acitretin při podstatně lepší toleranci. U kongenitálních ichtyóz patří do kategorie vzácných léčiv, tzv. orphan drugs (www.ema.org). Talarozol je podle klinických studií potenciálním lékem u ložiskové psoriázy a u akné. V ČR není žádný ze jmenovaných léků registrovaný (www.sukl.cz).
PŘEHLED VEDLEJŠÍCH A NEŽÁDOUCÍ ÚČINKŮ CELKOVÝCH RETINOIDŮ
Potenciální vedlejší a nežádoucí účinky celkových retinoidů (tab. 4, 5) lze ve většině případů předvídat a preventivními opatřeními eliminovat či redukovat a zvládat. Ve srovnání s jinými systémovými léky (imunosupresiva) jsou nežádoucí účinky retinoidů minimální. Prevence teratogenních účinků je probrána výše. Vznik a intenzitu ostatních nežádoucích účinků lze minimalizovat vhodným výběrem pacienta, vzestupným dávkováním a klinickým a laboratorním sledováním. Podrobně jsou probírány proto, aby je lékař mohl zavčasu zachytit a zvládnout.
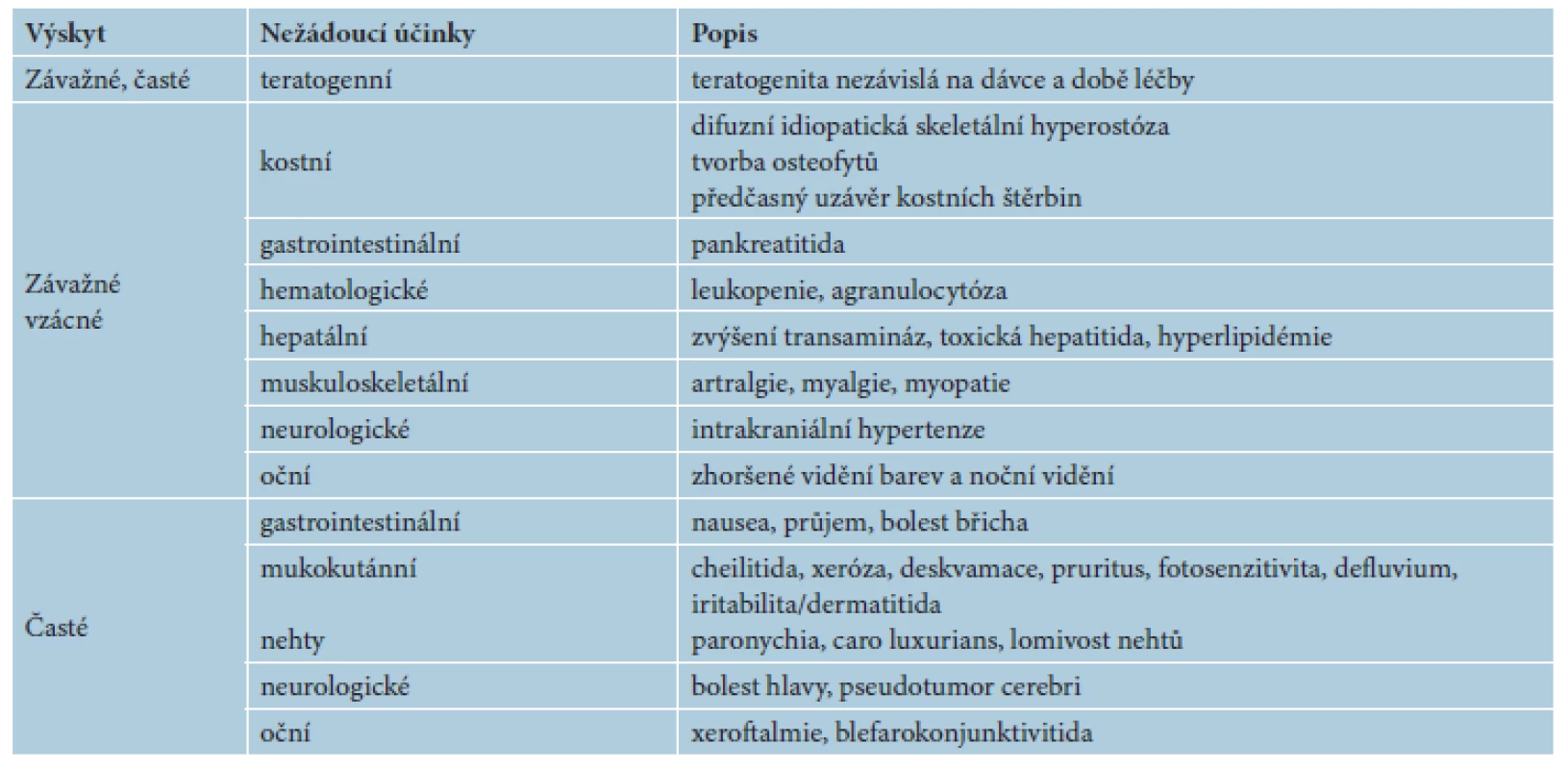
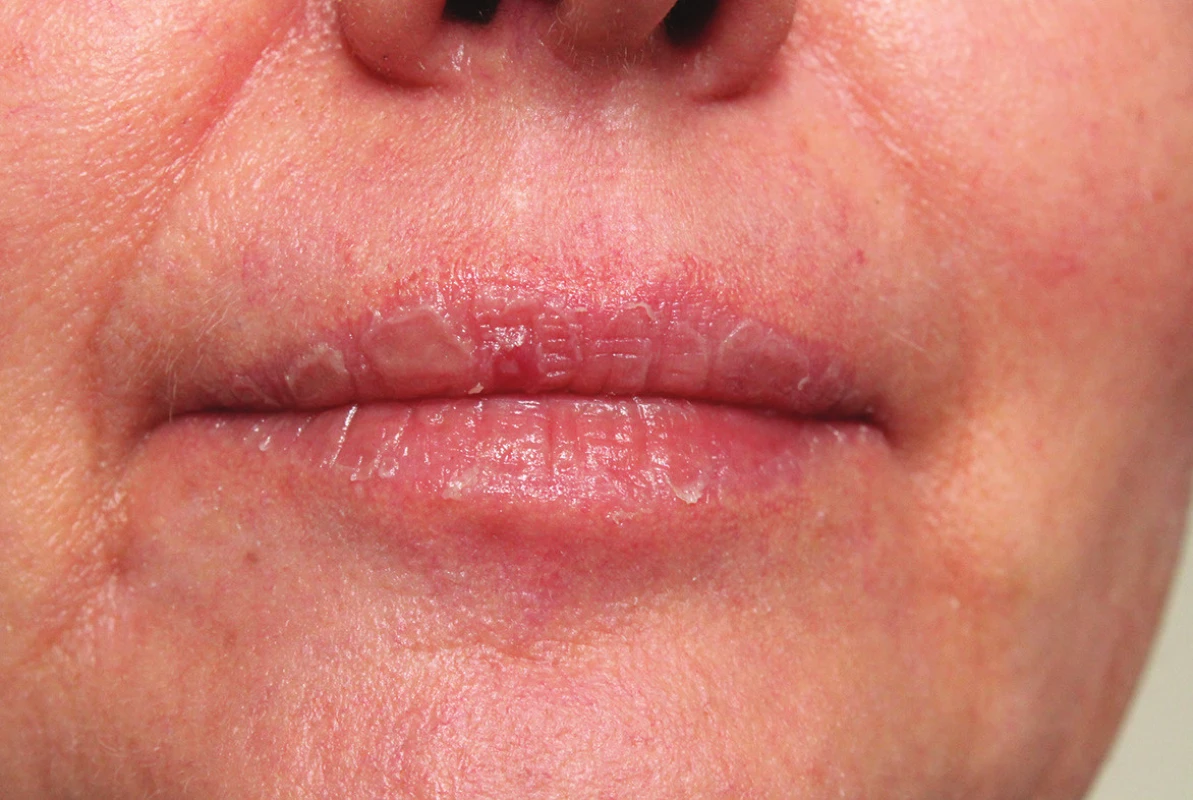
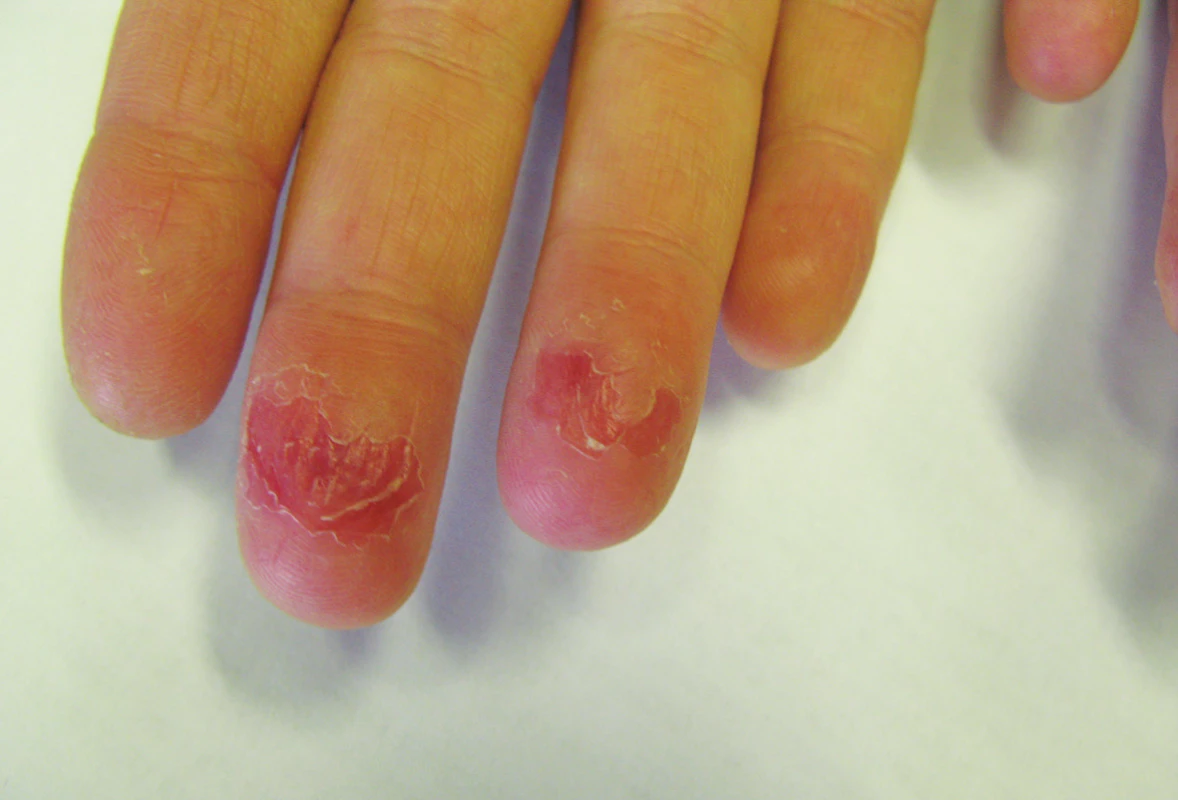
Mukokutánní účinky se objevují nejčastěji a v různé intenzitě, podobně jako u hypervitaminózy A. Jsou běžné, předvídatelné, na dávce závislé a reverzibilní, obvykle neškodné a zvladatelné. Pacienta je třeba poučit o preventivním používání emoliencií, případně očních a nosních extern a vyhýbání se dráždivým a vysušujícím vlivům. Vnímavost, respektive maximální tolerovaná dávka, je individuální. Cheilitida je přítomná prakticky vždy a je ukazatelem dostatečné biologické dostupnosti léku. Typická je také angulární cheilitida, suchost sliznice dutiny ústní, ojediněle i tvorba ragád (obr. 1). Dále suchost a fragilita nosní sliznice až s epistaxí, suchost spojivek (cave oční čočky). Častá je suchost kůže spojená s deskvamací pruritem a její zvýšenou zranitelností, dochází k olupování a tvorbě prasklin na dlaních a ploskách, často na bříškách prstů (obr. 2). Ke vzniku pruritu a iritabilitě kůže jsou náchylnější starší pacienti a děti. Zvýšená citlivost vůči UV záření je stran intenzity projevů individuální, častěji se objevuje u isotretinoinu. Retinoidy mohou způsobovat retinoidní dermatitidu, ale být i spouštěčem pro dermatitidu atopickou. Ve vyšších dávkách se může objevit ztenčení a difuzní výpad vlasů typu telogenního defluvia, zejména u postklimakterických žen. U nehtů mohou velmi řídce vznikat pseudoparonychia až periungální granulační tkáň, lomivost a jiné onychodystrofie. Mukokutánní vedlejší účinky se mezi jednotlivými retinoidy liší – isotretinoin působí častěji xerózu kůže než acitretin, ten naopak častěji vyvolává defluvium či palmoplantární deskvamaci. Bexaroten vyvolává mukokutánní vedlejší účinky v podstatně menší míře než ostatní retinoidy [3]. Při neobvyklých či intenzivních potížích je vhodné dávku léku přechodně snížit a je-li třeba pokračovat v léčbě, pak dávku postupně opatrně zvyšovat. Při perzistenci výrazných potíží navzdory nízkým dávkám a zmírňujícím opatřením je třeba léčbu ukončit [1, 2, 3, 29].
Oční účinky jako poruchy nočního vidění či fotofobie jsou pozorovány řídce. Je třeba je zohlednit u profesionálních řidičů, zejména dálkové dopravy a podobných profesí. Při podezření na zvýšený nitrolební tlak – perzistující bolesti hlavy spojené s nauzeou a zvracením, je vhodné provést vyšetření očního pozadí (edém papily).
Kloubní a svalové vedlejší účinky jako artralgie a myalgie se mohou objevit u fyzicky náročných povolání a vrcholových sportovců, častěji u isotretinoinu než u acitretinu. Vhodné je všem pacientům doporučit omezení fyzické zátěže [3, 29].
Změny v lipidovém metabolismu jsou časté, zvýšení triglyceridů až u 50 % pacientů a cholesterolu až u 30 %, méně často lipoproteinů VLDL, LDL a snížení HDL. U bexarotenu jsou tyto abnormity častější, u těžké hypetriglyceridémie se objevují eruptivní xantomy a může vzácně dojít k akutní hemoragické pankreatitidě [29]. Větší riziko lipidových odchylek je u osob obézních, diabetiků a konzumentů alkoholu. Zvýšení hodnot 2–3krát nad normu není důvodem k vysazení, ale ke zpřísnění životosprávy (tuky, cukry, alkohol), snížení dávky, častějšímu monitorování, případně k přechodnému přerušení léčby až do úpravy hodnot. Hodnoty se obvykle zcela normalizují do 1–2 měsíců po ukončení léčby. Při zvýšení triglyceridů nad 8 g/l je třeba léčbu přerušit [3, 20, 28, 29].
Hepatotoxicita je vzácná (< 1%) a nepředvídatelná. Spíše než k akutní hepatální lézi dochází k prostému zvýšení jaterních transamináz ALT a AST u 15–20 % pacientů léčených acitretinem, méně u isotretinoinu či bexarotenu. Objevuje se v prvních 2–8 týdnech léčby, k normalizaci obvykle dochází i bez přerušení léčby do 2–4 týdnů. Rizikoví jsou pacienti s jaterní steatózou, obézní, diabetici, respektive s metabolickým syndromem a zvýšenou konzumací alkoholu. Řídce dochází ke zvýšení alkalické fosfatázy a laktát dehydrogenázy (ALP, LDH) a bilirubinu. Při zvýšení transamináz nad trojnásobek horního limitu je třeba léčbu ukončit, při dvoj - až trojnásobném zvýšení je třeba léčbu přechodně přerušit až do normalizace hodnot. Pochopitelně je vhodné vyloučit jinou příčinu zvýšení jaterních enzymů [1, 3, 29].
Gastrointestinální potíže se objevují vzácně (anorexie, nauzea, bolesti břicha, průjem), mohou být příznakem pankreatitidy. V odborné literatuře lze nalézt zprávy o isotretinoinu jako spouštěči střevních zánětů (ulcerózní kolitida), jiné rozsáhlé studie toto však vyvracejí.
Poruchy nálady jsou v odborné literatuře kontroverzním tématem. U depresí až suicidálních sklonů u dospívajících s akné nebyl vztah k isotretinoinu ani k ostatním retinoidům nikdy spolehlivě prokázán. Naopak existují reference o zlepšení depresivních příznaků při léčbě akné isotretinoinem. Pacienty s poruchami nálady je před započetím léčby žádoucí v tomto smyslu informovat a v průběhu léčby je pečlivě sledovat [6, 17].
Renální toxicita není pro retinoidy typická. U osob s anamnézou nefropatie je proto během léčby vhodné sledovat ledvinné funkce [3, 29].
Kostní nežádoucí účinky patří k vzácným a nepředvídatelným účinkům. Kostní a kloubní bolesti se u léčby retinoidy objevují, a to často bez objektivních známek nějakých abnormit. Kostní nežádoucí účinky jsou podle současných odborných referencí i u dlouhodobého používání retinoidů (acitretin) vzácné, respektive nejsou údaje o zvýšeném riziku kostních abnormit. Retinoidy spíše mohou vést k zhoršení stavu u již preexistujících potíží. Před léčbou je však vhodné se cíleně pacienta dotázat na kloubní a svalové obtíže a, pokud je odpověď kladná, provést rentgenologické vyšetření příslušných kostí ještě před zahájením léčby. U bezpříznakových pacientů se pravidelné rentgenové screeningy nepovažují za přínosné [3, 25]. Difuzní idiopatická hyperostóza (DISH) je vysloveně vzácným nežádoucím účinkem, projevuje se degenerativní spondylózou, artritidou páteřních kloubních spojení, syndesmofyty, exostózami, kalcifikacemi intervertebrálních ligament. Riziko je pravděpodobnější u dlouhodobé léčby vysokými dávkami retinoidů. Jedna studie sledující DISH u pětileté léčby etretinátem uvádí nález 4% výskytu DISH, ale jiné observační studie mapující výskyt osteoartikulárních příznaků souvislost neprokázaly, a to ani s denní dávkou, kumulativní dávkou a dobou podávání retinoidu [25]. U dlouhodobé léčby vysokými dávkami se určité monitorování v literatuře uvádí, provádí se rentgenologické vyšetření páteře a kloubů (zápěstí, loket, koleno), ovšem bez jednotného doporučení konkrétního časového údaje [3, 25]. U velmi dlouhé léčby (nad 20 let) se doporučuje provést kostní denzitometrii. Je třeba tedy postupovat individuálně, pacienta sledovat pravidelně klinicky, cíleně se dotazovat na příslušné příznaky [1, 3, 8, 12,14, 27, 28].
Akutní toxicita retinoidů je nízká. Předávkování retinoidy má klinicky stejné příznaky jako akutní hypervitaminóza A – bolesti hlavy, nausea, zvracení, suchost, vertigo, podrážděnost či svědění. Léčba je symptomatická, potíže by měly spontánně odeznít dle biologického poločasu daného retinoidu (3,16, 25).
ZÁVĚR
Léčba retinoidy, respektive acitretinem a isotretinoinem, je prověřena v praxi více než 40 let. Používají se jak v monoterapii, tak v kombinované léčbě u závažných forem klasických indikací, jako je psoriáza, poruchy keratinizace a akné. Díky svým rozmanitým účinkům se retinoidy používají i jako druhá linie v léčbě řady dalších zánětlivých a proliferativních kožních chorob, kde v celkové léčbě selhala linie první. Rexinoidy jako podskupina retinoidů ukazují na potenciál retinoidů i v protinádorové léčbě, kde je v praxi nejvíce zkušeností s bexarotenem v léčbě kožních T-buněčných lymfomů.
Hlavní limitací většího použití retinoidů je teratogenita. Hlavními výhodami jsou nepřítomnost imunosupresivity a minimum lékových interakcí. Nejen proto jsou retinoidy vhodnými léky pro kombinovanou léčbu s dalšími celkovými léky. Problematická může být mukokutánní snášenlivost, zejména při potřebě vyššího dávkování pro dosažení vyšší účinnosti. Využívá se proto vzestupného dávkování anebo kombinované léčby s jinými celkovými či zevními léky, eventuálně se světloléčbou, kde pak stačí nižší, dobře tolerované dávky. Vzhledem k dobrému dlouhodobému bezpečnostnímu profilu patří retinoidy k celkovým lékům i pro dlouhodobou udržovací léčbu. Kromě bezpečnosti mají i příznivou cenu, takže v sekvenčním režimu lze po navození zhojení či stabilizace indukční léčbou velmi účinným, ale nákladným lékem, pokračovat v udržovací léčbě k udržení remise či stability právě retinoidy. Navzdory faktu, že hlavní výzkumný proud systémových léčiv jde v současnosti jinou cestou, zůstávají retinoidy pro svůj mnohočetný biologický potenciál perspektivní skupinou celkových léků i mimo dermatologii.
Adresa pro korespondenci:
MUDr. Nina Benáková, Ph.D.
Dermatovenerologická klinika 1. LF UK
U Nemocnice 2
128 00 Praha 2
e-mail: nina.benakova@email.cz
Sources
1. BENÁKOVÁ, N., ETTLER, K., ŠTORK, J., VAŠKŮ, V.: Psoriáza nejen pro praxi. Triton: Praha, 2007, s. 173–193.
2. BIENOVÁ, M., KUČEROVÁ, R.: Retinoidy v dermatologii. Dermatol. praxi 2008, 2, s. 171–174.
3. BOLOGNIA, J. L., JORIZZO, J. L., SCHAFFER, J. V.: Dermatology. Elseviere: 2013, Third Edition, p. 2089–2103.
4. BUČKOVÁ, H. et al.: Léčba psoriázy u dětí. Čs. Derm., 2013, 2, s. 59–71.
5. GOLLNICK, H. P.: Retinoids for the future: Oral retinoids – efficacy and toxicity in psoriasis. Br. J. Dermatol., 1996, Suppl. 135, p. 6–17.
6. GOLLNICK, H. P., BETTOLI, V., LAMBERT, J. et al. A consenus-based practical and daily guide for treatment of acne. JEADV, 2016, 30, p. 1480–1490.
7. GRUPPER, Ch., BERETTI, B.: Retinoid combinations. In: Roenigk, H. H, Maibach, H. I.: Psoriasis. 2. ed., New York 1991, p. 775–782.
8. HALVERSATM, C. P., ZEICHNER, J., LEBWOHL, M.: Lack of signifikant skeletal changes after long-term, low-dose retinoid therapy: case report and review of literature. J. Cutan. Med. Surg., 2006, 10, p. 291–299.
9. HSU, S., PAPP, K. A., LEBWOHL, M. G. et al. Consensus guidelines for the management of plaque psoriasis. Arch. Dermatol., 2012, 148, p. 95–102.
10. CHUNG, C. G., POLIGONE, B. Cutaneous T cell Lymphoma: an Update on Pathogenesis and Systemic Therapy. Curr. Hematol. Malig. Rep., 2015, 10, p. 468–476.
11. IEST, J., BOER, J. Combined treatment of psoriasis with acitretin and UVB phototherapy compared with acitretin alone and UVB phototherapy alone. Br. J. Dermatol., 1989, 120, p. 665–670.
12. LYNDE, CH. W., KRAFT, J. N., LYNDE, C. B. Acitretin revisited. Skin Therapy Letter, 2011, 16, p. 3.
13. MARQUELING, A. L., CORDOR, K. M. Systemic treatment for severe pediatric psoriasis. Dermatol. Clin., 2013, 31, p. 267–288.
14. MENÉNDEZ-GUTIÁRREZ, M. P., RICOTE, M. The multi-faceted role of retinoid X receptor in bone remodeling. Cell. Mol. Life Sci., DOI 10.1007/s00018-017-2458-4.
15. MENTER, A., KORMAN, N. J., ELMET, C. A. et al. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents. JAAD, 2009, 61, p. 451–485.
16. NAST, A., GISONDI, P., ORMEROD, A. D. et al. S3 – Guidelines on the systemic treatment of psoriasis vulgaris – update 2015. JEADV, 2015, 29, p. 2277–2294.
17. NAST, A., DRÉNO, B., BETTOLI, V. et al. European evidence-based (S3) guideline for treatment of acne – update 2016. JEADV, 2016, 30, p. 1261–1268.
18. ORMEROD, A. D., CAMPALANI, E., GOODFIELD, M. J. D.: BAD guidelines on the efficacy and use of acitretin in dermatology. Br. J. Dermatol., 2010, 162, p. 952–963.
19. PANCHAL, M. R., SCARISBRICK, J. J. The utility of bexarotene in mycosis fungoides and Sézary syndrome. Onco Targets and Therapy, 2015, 8, p. 367–373.
20. PATHIRANA, D., ORMEROD, A. D., SAIAG, P. et al. European S3-guidelines on the systemic treatment of psoriasis vulgaris. JEADV, 2009, 23, p. 1–70.
21. PAUL, C., GALLINI, A., MAZA, A. et al. EBM recommendations on conventional systemic treatments in psoriasis. JEADV, 2011, 25, Suppl. 2, S 2–11.
22. QU, L., TANG, X. Bexarotene: a promising anticancer agent. Cancer. Chemother. Pharmacol., 2010, 65, p. 201–205.
23. SARDANA, K., SEHGAL, V. N. Retinoids: Fascinating Up-and-Coming Scenario. J. Dermatol., 2003, 30, p. 335–380.
24. SAURAT, J. H.: RXR – ligands: their evolving clinical potential. Přednáška na sympoziu Oral retinoids – dermatology and beyond. 12. kongres EADV, Barcelona 2003.
25. SBIDIAN, E., MAZA, A., MONTAUDIÉ, H. et al. Efficacy and safety of oral retinoids in different psoriasis subtypes: a systematic literature review. JEADV, 2011, 25, Suppl. 2, S 28–33.
26. ŠTORK, J. et al. Dermatovenerologie. Galén 2007, s. 463.
27. Van DOOREN-GREEBE, R. J., LEMMENS, J. A., De BOO, T. et al. Prolonged treatment with oral retinoids in adults: no influence on the frequency and severity of spinal abnormities. Br. J. Dermatol., 1996, 134, 71–76.
28. ZINZANI, P. L., BONTHAPALLY, V., HUEBNER, D. et al. Panoptic clinical review of the current and future treatment of relapsed/refractory T-cell lymphomas: Cutaneous T-cell lymphomas. Critical Reviews in Oncology/Hematology, 2016, 99, p. 228–240.
29. Souhrn údajů o přípravku (SPC 2017) Neotigason, Curacné, Aknemycin, Targretin. www.sukl.cz
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2017 Issue 3
Most read in this issue
- Retinoidy v dermatologii
- Nodulární fasciitis
- Psychodermatózy – popis čtyř případů
- Sweetův syndrom při myelodysplastickém syndromu – popis případu
