Naše zkušenosti s metodou fluorescenční in situ hybridizace při detekci uroteliálního karcinomu
Our Experience in Using Fluorescence in situ Hybridization FISH-Uro Vysion in Diagnostics of Urothelial Carcinoma
Urothelial carcinoma is a disease at high risk of recurrence after the initial therapy (70-80 %) and with the tendency to progression accomplishing the recurrence (30 %). Long lasting monitoring of patients with urothelial carcinoma is necessary. Cystoscopy and cytology are currently the primary modalities used to detect and monitor urothelial carcinoma. However, cytology has relatively poor sensitivity especially in well differentiated tumors. Cystoscopy is an invasive and relatively expensive method. Therefore, methods improving detection of urothelial carcinoma from urine specimens are employed. Uro Vysion (Vysis) fluorescence in situ hybridization (FISH) for improved detection of urothelial carcinoma was evaluated.
Materials and methods:
Bladder tumor progression is accompanied by increased chromosomal instability and aneuploidy of chromosomes 3, 7, 17 and loss of locus 9p21. A total of 124 patients were analyzed at Dpts. of Urology and Pathology, Faculty Hospital in Brno. Cytologically analyzed urine specimens were tested by FISH and simultaneously cystoscopy was employed including biopsy for histological examination.
Results:
FISH analysis was positive in 35 cases, including 5 cases with negative biopsy and cytology. Negative FISH result was detected in 24 cases where the malignant status was determined. The sensitivity of FISH in our series was 58.9 % and the specificity 88.1 %.
Conclusions:
FISH is a relatively simple, speedy and non invasive diagnostic method. It detects the symptoms of malignity on the molecular level, which leads to earlier diagnosis and therapy and, hence, to potential extended survival. FISH makes it possible to take decision in cases of atypical or unclear cytological finding. The FISH method using the Uro Vysion kit appears as a prospective non invasive method capable of early UK detection, with a higher sensitivity than the standard cytology of urine.
Key words:
urothelial carcinoma – chromosomal abnormalities – cytology – fluorescence in situ hybridization – histology
:
V. Vít 1; D. Pacík 1; A. Čermák 1; I. Falková 2; J. Šmardová 2; R. Hrabálková 2; M. Svitáková 2; Z. Pavlovský 2; M. Votava 2
:
Urologická klinika FN a LF MU, Brno
1; Ústav patologie FN a LF MU, Brno
2
:
Čes.-slov. Patol., 45, 2009, No. 2, p. 46-49
:
Original Article
Úvod:
uroteliální karcinom (UK) je onemocnění s vysokým počtem recidiv po prvotní léčbě (70–80 %) a s tendencí k progresi při recidivě (30 %). Dlouhodobé sledování pacientů s tímto onemocněním je tedy nezbytné. Cystoskopie a cytologie jsou v současnosti hlavními metodami používanými k prokazování a sledování uroteliálních karcinomů. Cytologie však vykazuje nedostatečnou senzitivitu, především u dobře diferencovaných nádorů, cystoskopie pak je invazivní a relativně drahá metoda. Proto jsou hledány takové metody, které by umožnily lepší detekci uroteliálního karcinomu ze vzorku moči. V této práci jsou hodnoceny výsledky použití UroVysion (Vysis) fluorescenční in situ hybridizace (FISH) v detekci UK.
Materiál a metodika:
progrese karcinomu močového měchýře je provázena zvýšením chromozomální nestability a aneuploidií chromozomů 3, 7, 17 a ztrátou lokusu 9p21. Na Urologické klinice a Ústavu patologie FN Brno bylo vyšetřeno 124 pacientů. Vzorky moči byly vyšetřeny cytologicky a metodou FISH a současně byla provedena cystoskopie s odběrem bioptického materiálu pro histologické vyšetření.
Výsledky:
vyšetření FISH bylo pozitivní v 35 případech, včetně 5 případů s negativní biopsií a cytologií. Negativní výsledek FISH byl zjištěn u 24 pacientů, u kterých byla malignita jednoznačně prokázána histologicky. Senzitivita FISH v hodnoceném souboru byla 58,9 %, specificita 88,1 %.
Závěr:
FISH je relativně jednoduchá, rychlá a neinvazivní diagnostická metoda. Detekuje známky malignity na molekulární úrovni, což umožňuje časnější diagnostiku a terapii a tak může potenciálně dojít k prodloužení přežití.
Metoda FISH s užitím kitu UroVysion se jeví jako perspektivní neinvazivní metoda schopná časné detekce UK, s vyšší senzitivitou než u standardní močové cytologie.
Klíčová slova:
uroteliální karcinom – chromozomální abnormality – cytologie – fluorescenční in situ hybridizace – histologie
Uroteliální karcinom (UK) je onemocnění s vysokým počtem recidiv po iniciální léčbě (70–80 %) a s tendencí k progresi při recidivě (30 %) (4). Pečlivé a dlouhodobé sledování pacientů s tímto onemocněním je tedy nezbytné. Ke standardním metodám monitorování pacientů s UK patří cystoskopie, která je invazivní a drahá, a alternativně cytologické vyšetření moči, která má však nízkou senzitivitu, zejména u dobře a středně diferencovaných tumorů. Neinvazivní diagnostika a monitorování UK je vysoce progresivní variantou pro lékaře i pacienty. Molekulárně biologické studie prokázaly u UK časté a prognosticky významné chromozomální aberace, které mohou být detekovány s vysokou senzitivitou pomocí fluorescenční in situ hybridizace (FISH).
Metoda FISH je založena na schopnosti dvou komplementárních jednořetězcových DNA spolu navzájem hybridizovat. Pomocí značené DNA sondy lze v analyzovaném materiálu vyhledávat specifické cílové sekvence komplementární se sondou. Sonda je značena fluorescenční barvou, její přítomnost ve zkoumaném materiálu lze snadno sledovat fluorescenční mikroskopií.
Průkaz zhoubného nádoru močového měchýře pomocí UroVysion kitu (Vysis-Uro Vysion bladder cancer recurrence kit Abbot Diagnostics) spočívá v detekci aneuploidie chromozomů 3, 7, 17 a ztrátě specifického signálu lokusu 9p21 metodou FISH. Kombinuje čtyři fluorescenční přímo značené DNA sondy. Tři centromerické (CEP 3 SpectrumRed, CEP 7 SpectrumGreen a CEP 17 SpectrumAqua) a jednu lokus specifickou sondu pro gen p 16 (9p21, LSI p16 SpectrumGold) (2, 3, 10).
Materiál a metodika
Na Urologické klinice a Ústavu patologie FN Brno bylo touto metodou v r. 2004 a 2005 vyšetřeno 124 pacientů.Byla odebírána spontánní moč na cytologické vyšetření a na molekulárně biologické vyšetření, poté byla provedena cystoskopie s odběrem vzorků na histologické vyšetření.
Spontánní moč byla hodnocena:
- 1. Standardní cytologií na cytospinových preparátech barvených dle May-Grunwald- Giemsy (MGG) a hematoxylin eosinem.
- 2. Fluorescenční in situ hybridizací. Vzorky byly připraveny a FISH provedena podle pokynů výrobce Vysis-Uro Vysion bladder cancer recurrence kit: Spontánní moč (50 ml) byla zpracována v den odběru. Po centrifugaci (600 g, 10 min) a opakovaném promývání peletů (1xPBS, Phosphate Buffered Saline, 10 ml) a centrifugaci (600 g, 10 min) následovala opakovaná fixace směsí metanolu a kyseliny octové v poměru 3:1, inkubace při -20 C (30 min) a centrifugace (600 g, 5 min). Fixované buňky byly uchovány v mrazničce.
K určení optimální koncentrace buňek pro hybridizaci a hodnocení vzorku byly resuspendované pelety napipetovány na podložní skla (SuperForstPlus, Menzel-Glaser) v objemu 3 μl, 10 μl a 30 μl a mikroskopicky (Leica DMIL) vybráno podložní sklo s optimální hustotou buněk.
Skla se vzorky byla inkubována v roztoku 2x SSC (Saline Sodium Citrat, 73 °C, 2 min), permeabilizována pepsinem (38 °C, 10 min), několikrát promývána v roztoku 1x PBS (5 min), fixována paraformaldehydem (4 % paraformaldehyd v PBS) a vysušena vzestupnou etanolovou řadou (70, 80, 96 %). DNA vzorku byla denaturována v roztoku formamidu (70 % formamid, 73 °C, 5 min) a dehydratována ve vzestupné etanolové řadě (70, 80, 96 %). DNA směsná sonda byla denaturována (74 °C, 5 min, pak 45 °C do aplikace sondy) a aplikována na sklo se vzorkem. Hybridizace sondy se vzorkem probíhala ve vlhké komůrce (37 °C) do druhého dne, kdy následovalo vymytí nespecificky navázané sondy v roztocích SSC (2x SSC+0,1 % NP 40; 73 °C, 3 min, Nonidet P-40, Sigma a 0,4x SSC+0,3 % NP 40; pokojová teplota, 1 min).
Celkový jaderný chromatin byl obarven pomocí DAPI (4’,6-Diamidino-2-phenylindole, Vector).
Všechny vzorky byly analyzovány bez znalosti bioptického a cytologického výsledku.
Fluorescenční signály byly hodnoceny mikroskopem Leica DMRXA2 se setem filtrů SpectrumRed (CEP 3), SpectrumGreen (CEP7), SpectrumAqua (CEP 17), SpectrumGold (LSI 9p21) a DAPI filtrem (barvení chromatinu pomocí DAPI).
Pro numerické hodnocení fluorescenčních signálů byla vybírána jádra, která jsou morfologicky odlišná nebo shluky takovýchto jader. Tato jádra jsou zvětšená, s nepravidelnými okraji a „skvrnitá“ v DAPI jaderném barvení. Pokud bylo ve vzorku zachyceno málo takto morfologicky odlišných jader, byly pro hodnocení fluorescenčních signálů vybírány buňky s největšími jádry.
U vybraných abnormálních jader byly zaznamenány počty signálů. Pokud počet červených (CEP 3), zelených (CEP 7) a aqua (CEP 17) signálů byl 3 a více a/nebo bylo pozorováno méně nebo více než 2 zlaté signály (9p21) pak bylo analyzováno 25 takovýchto buněk. V případě, kdy byly přítomny morfologicky abnormální buňky s normálním počtem signálů (dizomické buňky) byl hodnocen celý preparát.
Buňky se slabými signály a překrývající se buňky nebyly analyzovány. Signály, které byly lokalizovány velmi blízko u sebe a rozdělené („split“) signály byly hodnoceny jako jeden signál.
Pokud 4 a více buněk z 25 hodnocených aberantních buněk měly u dvou a více chromozomů (CEP 3, CEP 7 a CEP 17) 3 a více signálů nebo 12 buněk mělo nulový počet signálů 9p21, byl daný vzorek hodnocen jako pozitivní.
- 3. Preparáty pro bioptické vyšetření byly zality do parafinu a následně barveny hematoxylinem-eosinem. Všechna tři vyšetření byla provedena a vyhodnocena nezávisle.
Výsledky
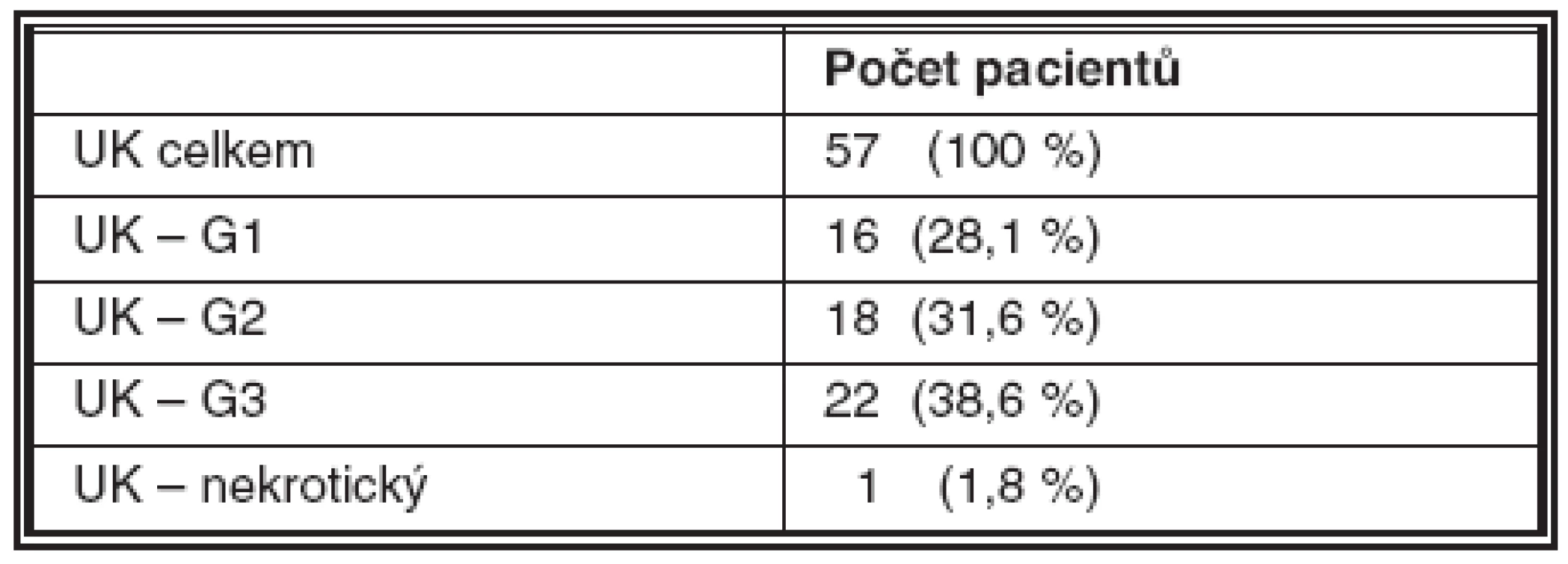
Malignita byla histologicky detekována u celkem 59 pacientů (58,4 %) – UK u 57 pacientů (56,4 %), CIS u 1 (1 %) a spinocelulární karcinom /SCC/ u 1 (1 %), negativní histologický nález byl u 42 pacientů (41,6 %); 23 vzorků bylo nehodnotitelných z důvodu nedostatečné kvality biologického materiálu. Výsledek metody FISH s použitím kitu UroVysion byl pozitivní celkem ve 35 případech (34,7 %). FISH byla pozitivní i u 5 případů, které byly negativní jak v biopsii tak v cytologii. Naopak negativní výsledek FISH byl zaznamenán u 24 případů, ve kterých byla jasně prokázána malignita (tab. 1–4).
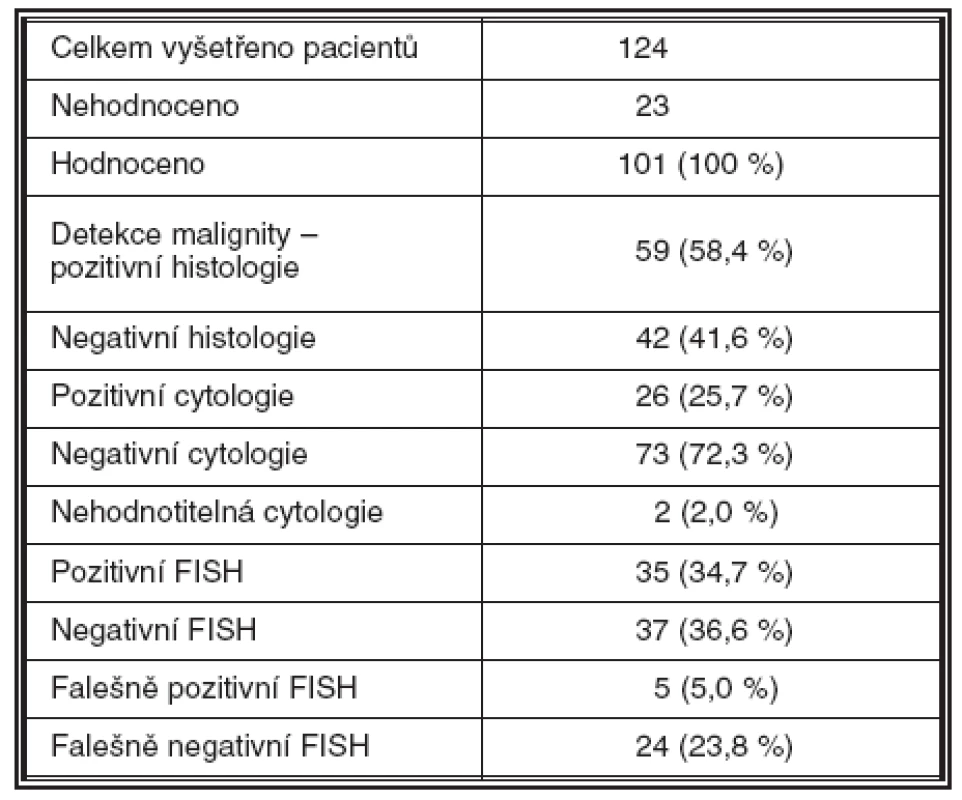
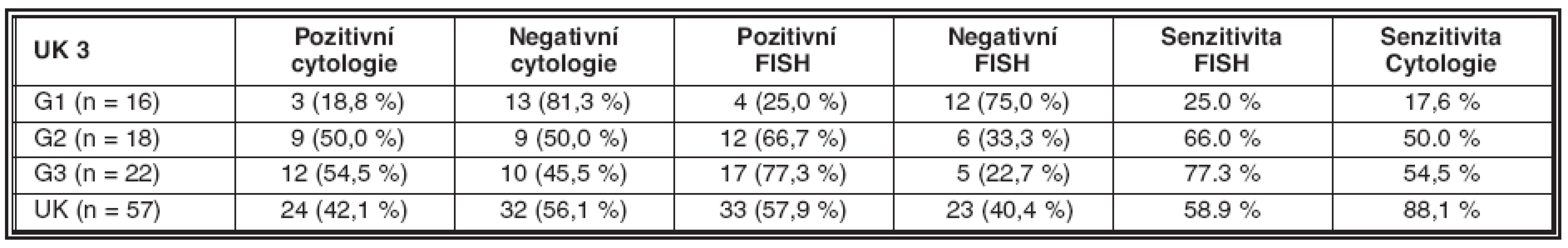
Senzitivita metody je v našem souboru 58,9 %, specificita 88,1 % (tab. 4).

Diskuse
Cystoskopie a cytologické vyšetření moči jsou stále standardními metodami k detekci a monitorování pacientů s UK. Cystoskopie je metoda invazivní a relativně nákladná. Je sice možné použít flexibilní cystoskop, který představuje méně invazivní alternativu vyšetření, ale standardní využití flexibilní technologie je u nás limitováno tím, že není u žen hrazeno ze zdravotního pojištění. Pokud porovnáme cenu jednotlivých vyšetření – flexibilní cystoskopie stojí cca 50 Euro, cena jednoho vyšetření FISH je cca 140 Euro. Přesto při poměrně vysokých pořizovacích nákladech a omezené možnosti využití není v současné době možno flexibilní endoskopii považovat za standardní metodu k diagnostice a monitorování pacientů s UK.Cytologie moči má relativně nízkou senzitivitu, zejména u dobře a středně diferencovaných tumorů (1, 6). Navíc, výsledky cytologického vyšetření nejsou spolehlivé v případě uroinfekce nebo po intravezikální léčbě, a protože se jedná o subjektivní metodu, její výsledky jsou závislé na erudici cytopatologa. Proto jsou vyvíjeny četné snahy o zavedení takové diagnostické metody, která by byla neinvazivní, spolehlivá a pokud možno i levná.
V posledních letech došlo k výraznému rozvoji molekulárních metod, které dnes umožňují citlivou detekci specifických chromozomálních lokusů bez nutnosti užití radioaktivního značení.
FISH nabízí vyšší senzitivitu než cytologie, bez ohledu na stupeň diferenciace a stadium onemocnění. Současně poskytuje srovnatelnou specificitu (1).
Pokud naše výsledky srovnáme s výsledky posledních publikovaných prací, kde je udávána pro UroVysion celková senzitivita 39,1%, specificita 89,7% a pro cytologii senzitivita 40,6% a specificita 89,7%, můžeme konstatovat, že naše výsledky jsou srovnatelné, a pokud jde o senzitivitu metody, jsou dokonce lepší (6).
Ve skutečnosti může být senzitivita a specificita metody FISH dokonce vyšší než by se mohlo zdát na základě našich výsledků a to zejména z následujících důvodů:
„falešně pozitivní výsledky“ mohou být v rozporu s výsledky standardních metod (cytologie a cystoskopie), nicméně toto nemusí znamenat, že nejsou správné. Tyto výsledky mohu naopak ukazovat na vyšší senzitivitu metody FISH, která je na rozdíl od klasických metod schopna odhalit rané genetické změny, které předcházejí morfologickým a cytologickým změnám. Tato hypotéza musí být sice ještě experimentálně prokázána, nicméně není v kancerogenezi bezprecedentní. Například u pacientů s kolorektálním karcinomem byly genetické změny pozorovány i v normálních buňkách střevního epitelu, vzdálených 10 cm od vlastního nádoru (5).
Některé „falešně pozitivní“ výsledky mohou proto odhalovat latentní genetickou prekancerózu, a tedy případy zvláště důležité z hlediska prevence a výzkumu progrese UK. Nelze také vyloučit, že „falešně negativní“ případy ukazují spíše na nepřítomnost sledovaných genetických změn u poměrně vysokého procenta pacientů (26,8 %) než na metodologicky nízkou senzitivitu metody FISH. Ve většině případů může být „falešně negativní“ výsledek způsoben normálním genotypem nádorových buněk ve sledovaných parametrech. Je tedy možné, že tyto výsledky spíše poukazují na heterogenitu UK tumorů, kde genetické změny nejsou přítomny u všech pacientů.
Z metodologického hlediska se proto nemusí jednat o negativní výsledky, nicméně z hlediska diagnostického a výzkumného se potvrzuje důležitost paralelních analýz vzorků více různými metodami. Významnou výhodou metody FISH je kromě výše uvedeného i to, že v případě odhalení dalšího genetického markeru UK je poměrně jednoduché rozšířit metodu FISH tímto směrem.
FISH není ovlivněna probíhající BCG terapií a může být užita k monitorování účinnosti intravezikální terapie u pacientů s povrchovým UK. Detekuje známky malignity na molekulární úrovni, což vede k časnější diagnóze a terapii, a tak může potenciálně dojít k prodloužení přežití (7, 8, 9).
FISH umožňuje rozhodnutí i v případech atypického či nejasného cytologického nálezu.
Závěr
Metoda FISH s užitím kitu UroVysion se jeví jako perspektivní, neinvazivní metoda schopná časné detekce UK s vyšší senzitivitou než u standardní močové cytologie.
MUDr. Vítězslav Vít
Urologická klinika FN Brno a LF MU Brno
Jihlavská 20, 625 00 Brno
Tel: +420 53223 3860,
Fax: +420 53223 2306,
e-mail: v-vit@email.cz
Sources
1. Halling, K.C., King, W., Sokolova, I.A. et al.: A comparison of cytology and fluorescence in situ hybridization for the detection of urothelial carcinoma. J. Urol. 164, 2000, s. 1768–1775.
2. Kipp, B.R., Karies, R.J., Brankley, S.M. et al.: Monitoring intravesical therapy for superficial bladder cancer using fluorescence in situ hybridization. J. Urol. 173, 2005, s. 401–404.
3. Kruger, S., Mess, F., Bohle, A. et al.: Numerical aberrations of chromosome 17 and the 9p21 locus are independent predictors of tumor recurrence in non-invasive transitional cell carcinoma of the urinary bladder. Int. J. Oncol. 23, 2003, s. 41–48.
4. Kurth, K.H., Bouffioux, C., Sylvester, R. et al.: Treatment of superficial bladder tumors. Achievements and needs. Eur. Urol. 37(Suppl 3), 2000, s. 1–9.
5. Lukášova, E., Kozubek, S., Falk, M. et al.: Topography of genetic loci in the nuclei of cells of colorectal carcinoma and adjacent tissue of colonic epithelium. Chromosoma 112, 2004, s. 221–230.
6. Mengual, L., Marin-Aguilera, M., Ribal, M.J. et al.: Clinical utility of fluorescent in situ hybridisation for the surveillance of bladder cancer patients treated with Bacillus Calmette-Guérin therapy. European Urology, 52, 2007, s. 752–759.
7. Moonen, P.M.J., Merkx, G.F.M., Perlen, P. et al.: UroVysion compared with cytology and quantitative cytology in the surveillance of non-muscle-invasive bladder cancer. European Urology, 51, 2007, s. 1275–1280.
8. Sarosdy, M.F., Schellhammer, P., Bílinsky, G. et al.: Clinical evaluation of a multi-target fluorescence in situ hybridization assay for detection of bladder cancer. J. Urol. 168, 2002, s. 1950–1954.
9. Skacel, M., Fahmy, M., Brainard, J.A. et al.: Multi-target fluorescence in situ hybridization assay detects transitional cell carcinoma in the majority of patients with bladder cancer and atypical or negative urine cytology. J. Urol. 169, 2003, s. 2101–2105.
10. Varella-Garcia, M., Akduman, B., Sunpaweravong, P. et al.: The UroVysion fluorescence in situ hybridization assay is an effective tool for monitoring recurrence of bladder cancer. Urol. Oncol.: Seminars and Original Investigations 22, 2004, s. 16–19.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2009 Issue 2
Most read in this issue
- New Trends in Diagnostics and Classification of Breast Carcinoma
- Immunohistochemical Detection of ZAP-70 Protein and its Importance in the Diagnostics of B-CLL
- Our Experience in Using Fluorescence in situ Hybridization FISH-Uro Vysion in Diagnostics of Urothelial Carcinoma
- PAG: A POTENTIAL TUMOUR SUPPRESSOR AND HOW IT ALL STARTED. FROM IMMUNE SIGNALLING TO NEOPLASTIC TRANSFORMATION
