Clostridium difficile – narastajúca hrozba?
Clostridium difficile – a rising threat?
Clostridium difficile infection (CDI) represents a serious problem in healthcare that continues to evolve, evidenced by increased incidence and greater morbidity and mortality. A symptomatic patient can present with a broad spectrum of disease severity, ranging from mild, watery, self-limiting diarrhoea to life threatening fulminant pseudomembranous colitis, toxic megacolon, bowel perforation, septic shock, and death. Toxin testing is most important clinically, but is hampered by its lack of sensitivity. One potential strategy to overcome this problem is a two-step method that uses enzyme immunoassay detection of glutamate dehydrogenase as an initial screening and then uses a cell cytotoxicity assay or toxigenic culture as the confirmatory test. It is important to stratify the severity of CDI by means of laboratory parameters that may indicate an increased risk of severe outcomes associated with CDI. The currently available treatments for CDI are insufficient to impede the increased spread and virulence of the infection, avoid recurrence or prevent infection in at-risk populations. Current efforts are focused on preservation of the gut microflora and optimization of the immune response to CDI and toxins. Promising therapies still need time to be adopted in routine management of CDI, due to feasibility, acceptability and economic concerns. Improved monitoring, judicious antibiotic use and universal implementation of prevention schemes are paramount to reducing disease incidence and recurrence.
Key words:
Clostrium difficile – infection – diagnostics techniques and procedures – therapeutics
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
3. 7. 2012
Accepted:
1. 9. 2012
Authors:
M. Bátovský
Authors‘ workplace:
Gastroenterologická klinika SZU a UNB, UN sv. Cyrila a Metoda, Bratislava
Published in:
Gastroent Hepatol 2012; 66(6): 438-443
Category:
Clinical and Experimental Gastroenterology: Review Article
Overview
Infekcia Clostridium difficile (CDI) je vážnym zdravotníckym problémom pre svoju stúpajúcu incidenciu a mortalitu. Klinické spektrum CDI je veľmi široké – môže prebiehať ako ľahké a prechodné hnačkovité ochorenie, ale aj ako život ohrozujúca pseudomembranózna kolitída, toxické megakolon, perforácia čreva až septický šok vedúci k úmrtiu pacienta. V diagnostike CDI je závažným nedostatkom enzýmových immunoassay testov ich nízka senzitivita. Na preklenutie tohto problému bol navrhnutý dvojkrokový diagnostický postup s detekciou glutamát dehydrogenázy s následným stanovením cytotoxicity alebo s kultiváciou bunkových kultúr. Stratifikácia pacientov s CDI podľa stupňa závažnosti ochorenia pomocou anamnézy a laboratórnych vyšetrení je veľmi dôležitá, pretože pomáha vyselektovať najmä pacientov s nepriaznivou prognózou. Súčasná liečba CDI nedokáže zatiaľ dostatočne zabrániť šíreniu infekcie, zabrániť jej rekurencii alebo predchádzať CDI v rizikovej populácii. Zameriava sa najmä na zachovanie vlastnej črevnej mikroflóry a zvýšenie imunologickej odpovede. Ďalšie sľubné terapeutické postupy vyžadujú čas na začlenenie do rutinného managementu CDI z hľadiska ich akceptácie, ale i ekonomických nákladov. Incidenciu a rekurenciu CDI pomáha znižovať aj zodpovedná preskripcia antibiotík a dodržiavanie hygienických pravidiel.
Kľúčové slová:
Clostridium difficile – infekcia – diagnostika – liečba
Clostridium difficile (CDI) je grampozitívna sporulujúca anaeróbna baktéria, ktorú prvýkrát popísali Hall a O´Toole už r. 1935. Za príčinu pseudomembranóznej kolitídy spojenej s predchádzajúcim užívaním antibiotík je označovaná od r. 1978 [1]. CDI je vedúcou príčinou nozokomiálnych hnačiek v rozvinutých krajinách, kde ako primárny patogén tvorí 15–25 % nozokomiálnych hnačiek viazaných na antibiotickú liečbu. Pravdepodobným zdrojom infekcie sú domáce zvieratá a mäsové produkty. Baktéria vo svojom životnom cykle prechádza dvoma fázami, v ktorých sa spóry striedajú s vegetatívnymi bunkami. Najčastejším spôsobom prenosu je obvykle feko-orálna cesta. Po ingescii spór dochádza ku kolonizácii čreva, spóry rýchlo dozrievajú a z vegetatívnych baktérií sa začínajú uvoľňovať toxíny. Infekciu Clostridium difficile (CDI) vyvolávajú toxigenické kmene, ktoré produkujú toxíny A a/alebo B. Kolonizáciu čreva CDI inhibuje normálna intestinálna flóra, o ktorej sa predpokladá, že „súťaží“ s CDI o nutrienty i o miesto na slizničnom povrchu čreva. Preto je užívanie antibiotík najdôležitejším rizikovým faktorom vzniku CDI. Vegetatívne štádia CDI sa vyznačujú rezistenciou na početné antibiotiká a spóry sú odolné voči väčšine nechlórovaných dezinficiencií [2]. Prežívajúce spóry sú potom zdrojom neskoršej rekurujúcej CDI (5–47 % pacientov), čo je jeden z najdôležitejších terapeutických problémov. Ďalším je zlyhanie liečby ťažkej CDI s progredujúcou kolitídou, ktorá sa spája s vysokou morbiditou a mortalitou.
Definícia
CDI je charakterizovaná
- klinickým obrazom
- v stolici dokázanou baktériou CDI produkujúcou toxín bez inej príčiny hnačky
- pseudomembranóznou kolitídou dokázanou endoskopicky, po kolektómii alebo autopsiou
Epidemiológia a rizikové faktory
Epidemiologická situácia CDI sa v posledných rokoch dramaticky zmenila. V Európe sa incidencia tohto ochorenia zvýšila 2–4-násobne. V USA a v Kanade za 10 rokov 5-násobne stúpol počet hospitalizovaných pacientov kvôli CDI, najmä vo vekovej skupine nad 65 rokov. V európskych nemocniciach sa incidencia pohybuje na úrovni 4,1/10 000 pacientov/dní. 11–28 % pacientov s CDI akviruje túto infekciu v komunite. V porovnaní z nozokomiálnymi infekciami bývajú častejšie postihnutí mladší ľudia (okolo 50 rokov), ženy, s menším počtom komorbidít, bez predchádzajúceho užívania antibiotík, pričom CDI má väčšinou ľahší priebeh [3]. Garcia [4] na základe prieskumu v rodinách pacientov s CDI udáva riziko nákazy 4,71/1 000 manželov a 5,99/1 000 detí. Inak je priebeh ochorenia v posledných rokoch ťažší, komplikácií je viac, rovnako ako aj smrteľných prípadov. Na príčine sú zrejme agresívnejšie kmene CDI. V Montreale bol diagnostikovaný hypervirulentný kmeň označený ako NAP1/BI/027 podľa charakteristík získaných na základe elektroforézy (North American Pulsed Field type 1 = NAP 1), vyšetrenia reštrikčnej analýzy endonukleáz (BI) a polymerázovej reťazovej reakcie (ribotyp 027). Týmto kmeňom bolo v quebeckých nemocniciach infikovaných 67–82 % pacientov s CDI, pričom okrem vyššej virulentnosti sa ochorenie vyznačovalo ťažším priebehom v porovnaní s infekciou vyvolanou inými kmeňmi [5,6].
Jeden z novších prehľadov o rekurencii CDI medzi hospitalizovanými pacientmi v Európe poukázal na 18% výskyt opakovaných infekcií a na až 45 % rekurencií CDI u tých pacientov, ktorí prekonali CDI aspoň raz [7]. Až 88 % pacientov mestskej nemocnice v New Yorku, ktorí prekonali CDI viac ako trikrát, malo vykultivované rovnaké kmene CDI, čo napovedá, že išlo skôr o relaps ako o reinfekciu [8].
Okrem predchádzajúcej antibiotickej liečby sa v súčasnosti rieši otázka užívania inhibítorov protónovej pumpy, ktoré sa označujú za rizikový faktor CDI [9]. Rizikom je aj inglescia kontaminovaného mäsa, viac ohrozené sú peripartálne ženy, pacienti na imunosupresívnej terapií, s nešpecifickými črevnými zápalmi, po transplantácii orgánov, gastrostómii a jejunostómii, ako aj deti [7].
Klinický obraz a diagnostika
Kvôli nárastu incidencie a závažnosti CDI je namieste požiadavka jej rýchlej a presnej diagnostiky. Takáto diagnostika umožňuje nielen včas zahájiť individuálny management pacienta, ale aj rýchle prijatie účinných preventívnych opatrení nozokomiálnej transmisie. Diagnostika CDI je založená na anamnéze a klinickom obraze v kombinácii so špecifickými laboratórnymi testami.
V predchorobí sa možno anamnesticky dopátrať u väčšiny pacientov užívania antibiotík v predchádzajúcich dvoch mesiacoch alebo prípadného kontaktu s CDI najmä v komunite získaných ochorení. Z antibiotík sa pri vzniku CDI uplatňujú najmä aminopenicilíny, cefalosporíny, linkozamidy a fluorochinóny. Dôležitými prognostickými informáciami môžu byť závažné sprievodné ochorenia, užívanie liekov tlmiacich sekréciu žalúdočnej šťavy alebo imunomodulačná terapia.
Klinický obraz kompatibilný s epizódou CDI zahŕňa hnačky, pri ktorých konzistencia stolíc zodpovedá Bristolskej škále 5–7 a ich frekvenciu vníma pacient ako veľmi vysokú (počet stolíc nemusí byť udaný). Klinické príznaky sa manifestujú do 2–3 dní po kontakte s CDI. Symptomatológia kolíše od výskytu ľahkej sebalimitujúcej hnačky až po život ohrozujúce stavy. Závažnou klinickou manifestáciou je ileus s ťažko narušenou pasážou tráviacim traktom, so zvracaním a so zástavou odchodu vetrov a stolice, pričom sú prítomné rádiologické znaky distenzie čreva, prípadne už aj s hladinkami. Pri toxickom megakolone sa okrem týchto RTG zmien objavujú aj laboratórne znaky systémovej zápalovej reakcie (SIRS). Závažné komplikácie sa, našťastie, vyskytujú len do 1 % prípadov. Častejšími sú dehydratácia, elektrolytová nerovnováha, hypotenzia alebo renálne zlyhanie. Na druhej strane je v endemických oblastiach až 20–50 % hospitalizovaných pacientov s náhodným nálezom CDI v stolici asymptomatických (nosiči). V ostatných oblastiach sa toto číslo pohybuje medzi 5 a 7 % v nemocničných zariadeniach dlhodobej starostlivosti a kolíše medzi 7 a 26 % na akútnych oddeleniach [10]. V odporúčaniach SHEA sa nevyskytuje rutinné vyhľadávanie týchto pacientov ani ich liečba [11]. Extraintestinálne manifestácie v zmysle artritídy a bakteriémie sú vzácne.
Do obrazu ťažkej kolitídy patria horúčky, triašky striedané s pocitmi chladu sledované výstupom telesnej teploty, hemodynamická instabilita s príznakmi rozvíjajúceho sa septického šoku alebo aj pozitívne peritoneálne dráždenie. Laboratórne možno zistiť leukocytózu s posunom doľava, hypoalbuminémiu, hyperkreatininémiu, elevovaný sérový laktát a niekdy aj proteíny akútnej fázy. Charakteristickým endoskopickým nálezom pri CDI je pseudomembranózna kolitída. Endoskopický nález pablán na sliznici kolonu je patognomický pre diagnózu klostrídiovej kolitídy, i keď nemusí byť prítomný u každého pacienta s týmto ochorením. Na druhej strane treba vedieť, že pablany sa môžu vyskytovať aj pri iných typoch kolitíd (napr. pri difterickej). Ďalšie zobrazovacie metódy zachytávajú distenziu kolonu, zhrubnutie jeho steny, rozvláknenie perikolonického tuku alebo ascites. CDI sa aj bez týchto znakov ťažkej kolitídy považuje za ťažkú u pacientov nad 65 rokov veku, so závažnými komorbiditami alebo s imunodeficienciou.
Diagnostické testy sa delia na tri základné skupiny:
- stanovenie produktov CDI – glutamát dehydrogenéza, aromatické mastné kyseliny, toxíny A a B
- kultivačné metódy – na detekciu kmeňa CDI produkujúceho toxíny
- stanovenie génov CDI – 16S RNA, toxínové gény, gény glutamát dehydrogenázy
Referenčnou metódou stanovenia toxínov, ktorá je stále považovaná za „zlatý štandard“, je stanovenie cytotoxicity bunkových kultúr. Všetky tieto metódy sú časovo náročné a vyžadujú špeciálne laboratórne podmienky. Preto viaceré laboratória prešli na enzýmovú immunoassay, ktorá je rýchlejšia a jednoduchšia, a to bez ohľadu na skutočnosť, či sa stanovujú CDI toxíny alebo glutamát dehydrogenáza. Relatívne novšou metodikou je aj použitie PCR v reálnom čase na identifikáciu génov toxínov CDI v stolici. Na zvýšenie senzitivity a špecificity týchto testov sa používa buď vyšetrenie viacerých vzoriek stolice, alebo kombinácie uvedených metód.
Európska spoločnosť klinickej mikrobiológie a infekčných chorôb (ESCMID) pred štyrmi rokmi systematicky porovnala diagnostickú úspešnosť jednotlivých testov CDI a napokon vydala tieto odporúčania:
- Na vyšetrenie CDI treba poslať iba neformovanú stolicu, pričom stačí odobrať do skúmavky určenej na vyšetrenie parazitov v stolici 2 ml tej časti stolice, v ktorej sa nachádza hlien.
- Vyšetreniu na CDI sa podrobujú všetci pacienti s potenciálne infekčnou hnačkou a s negatívnym nálezom testov na bežné enteropatogény. Nezáleží pritom na veku pacienta, na predchádzajúcej antibiotickej liečbe, komorbidite alebo sprievodnej medikácii a ani na tom, kedy a kde hnačka vznikla (komunitná či nozokomiálna).
- Všetci pacienti hospitalizovaní pre hnačkovité ochorenie, ktorí sú v nemocnici dlhšie ako 72 hod, by mali byť testovaní na CDI, dokonca aj bez indikácie tohto vyšetrenia lekárom. (Táto požiadavka neznamená, že by sa normálne nevyšetrovali vzorky stolice dodané počas prvých 72 hod hospitalizácie). Pacienti, ktorí dostali hnačkovité ochorenie do 3 mesiacov od predchádzajúceho pobytu v zdravotníckom zariadení, by sa mali taktiež podrobiť vyšetreniu na CDI.
- Interpretácia laboratórnych výsledkov by mala brať do úvahy bežnú prevalenciu CDI v danom zdravotníckom zariadení.
- Vzorky s negatívnym CDI testom treba interpretovať ako negatívne. Vzorky s pozitívnym CDI testom treba znova vyšetriť buď metódou detegujúcou voľné toxíny, glutamát dehydrogenázu, alebo gény toxínu. Druhý použitý test sa však musí metodicky odlišovať od prvého [12].
Identické stanovisko k diagnostike CDI vydala pred dvoma rokmi aj Society for healthcare epidemiology of America (SHEA) [11].
Na záver svojho hodnotenia ESCMID trochu sklamane skonštatovala:
- Závažným nedostatkom komerčne dostupných enzýmových immunoassay testov CDI je ich nízka pozitívna prediktívna hodnota (čiže nízka senzitivita a veľa falošne pozitívnych výsledkov), pokiaľ sa používajú v populácii s nízkou prevalenciou CDI (do 5 %). Pozitívna prediktívna hodnota testu sa stáva akceptabilnou, až keď stúpne prevalencia CDI vo vyšetrovanej populácii na 50 %, čo je nereálne vysoká hodnota. Na preklenutie tohto problému bol navrhnutý dvojkrokový prístup buď s použitím ďalšieho testu, alebo s použitím referenčnej metódy v prípade pozitivity prvého testu.
- Ďalšie zníženie počtu falošne negatívnych výsledkov vyžaduje opakovanie vyšetrenia v prípade negativity prvého testu, resp. retestovanie všetkých vzoriek v prípade pozitívneho prvého a negatívneho druhého testu.
Takéto diagnostické postupy sú príliš komplikované a náročné na čas. ESCMID preto vyjadrila potrebu vývoja lepších diagnostických testov. Súčasný dvojkrokový prístup zostáva zatiaľ platný [12].
V slovenských podmienkach sa stanovenie glutamátdehydrogenázy považuje za finančne náročné vyšetrenie s nízkou senzitivitou, ktoré iba potvrdí prítomnosť Clostridium difficile, nie však toxín, ktorého stanovenie sa považuje za dôležitejšie. Najvhodnejšie by bolo použitie duálneho testu, ktorý by súčasne stanovil glutamátdehydrogenázu aj toxín, avšak problémom takéhoto testu bude zrejme jeho cena. V súčasnosti preto pri nedostupnosti stanovenia glutamátdehydrogenázy možno odporúčať pre bežnú diagnostickú prax (nie pre potreby štúdií) určenie CDI toxínov v korelácii s klinickým obrazom. Keď sa zistí pozitivita CDI toxínu a pacient má ťažkú CDI, treba stanoviť ribotyp. Rovnako treba pristúpiť k určeniu ribotypu aj v prípade zistenia výskytu CDI u viac ako 4 pacientov na oddelení. Ďalšie preventívne kroky má na starosti nemocničný hygienik.
Prognostické kritéria
Určiť presné prognostické kritéria, ktoré by zohľadňovali komplikácie, mortalitu a frekvenciu rekurencií, bolo dosť dlho pomerne ťažké, najmä preto, že dlho neboli k dispozícii valídne prognostické štúdie. V menej reprezentatívnych štúdiách boli za všeobecné markery nepriaznivej prognózy označené závažnosť ochorenia, vyšší vek, komorbidity, prijatie na jednotku intenzívnej starostlivosti a predchádzajúca antiperistaltická či imunomodulačná liečba. Pre ťažkú formu CDI svedčí fekálna inkontinencia, endoskopický nález pseudomembranóznej kolitídy a dlhé trvanie predchádzajúcich epizód. Leukocytóza nad 20 × 109/l sa spája s vyššou mortalitou, komplikovanejším priebehom, zlyhaním terapie, ako aj so zvýšeným rizikom rekurencie. Podobne korelovala aj hypoalbuminémia pod 25 g/l, pokročilý vek a závažné pridružené ochorenia. U pacientov s nešpecifickými črevnými zápalmi sa k týmto prognostickým parametrom pridáva ešte anémia s Hb do 9 g/dl. Užívanie antagonistov H2-receptorov asociovalo s vyššou rekurenciou a podávanie inhibítorov protónovej pumpy s refraktérnosťou na liečbu. Za markery ťažkej kolitídy boli označené horúčka, triaška, vazodilatačný alebo septický šok, peritonitída a ileus, ďalej leukocytóza nad 15 × 109/l s posunom doľava, nárast hladiny sérového kreatinínu o 50 % nad normálnu hodnotu a zvýšenie sérového laktátu. Nápadná leukocytóza často kontrastuje s len málo zvýšenou hladinou CRP. Keď sa pacient po 3 dňoch liečby nezhoršuje (resp. po 5 dňoch liečby metronidazolom), možno očakávať priaznivú terapeutickú odpoveď [9,13,14].
Harvardská štúdia [1], postavená na dvoch kohortách CDI pacientov, komplikovanou multivariačnou logisticko--regresnou štatistickou analýzou dokázala vyselektovať signifikatné prognostické kritéria. Radia sa k nim vek nad 65 rokov, závažnosť ochorenia a antibiotická liečba po prerušení CDI terapie. Ďalej zistili, že hladina IgG sérového antitoxínu A na 12. deň trvania a liečby CDI dobre koreluje rekurenciou CDI. Okrem iných predností, stanovenie prognostických kritérií umožňuje aj selektovanie rizikových pacientov pre potreby klinických štúdií nových agensov preventujúcich rekurenciu CDI, ako napr. alternatívnych antibiotík (rifaximín, nitazoxanid), liekov viažucich toxín CDI (tolevamer) alebo aktívnu či pasívnu imunizáciu voči CDI toxínom.
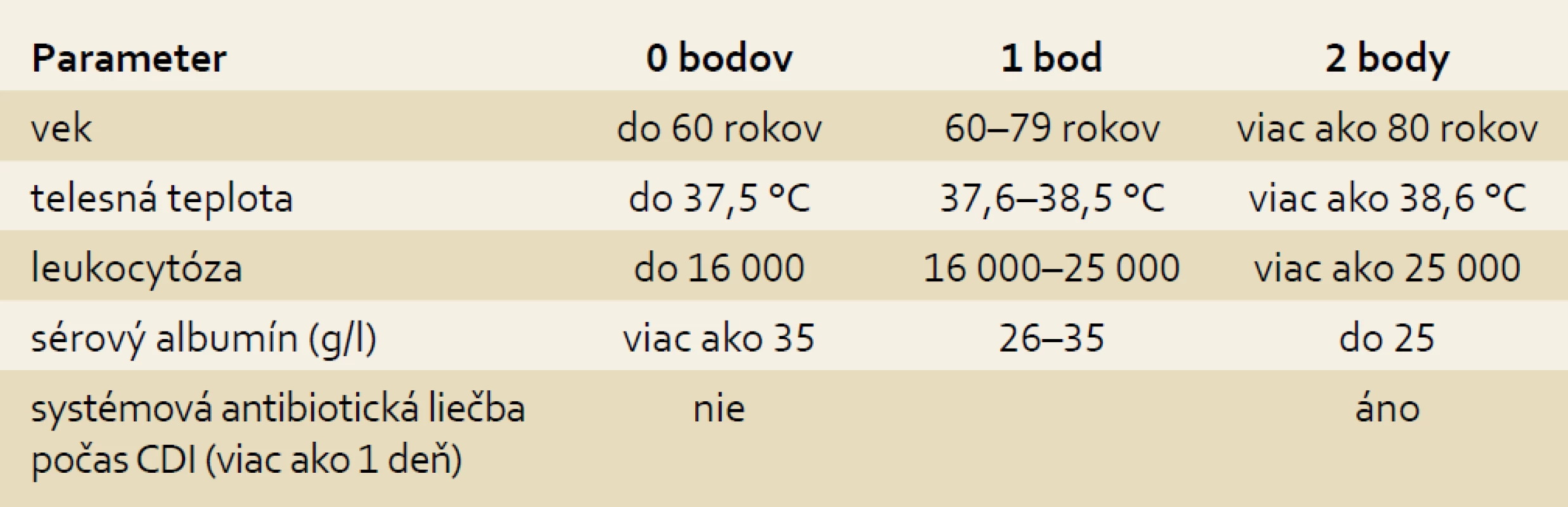
Pre posúdenie zdravotného stavu a rizika úmrtia sa v súčasnosti používajú rôzne klinické bodovacie systémy. Systém ATLAS boduje 5 rizikových faktorov (Age, Temperature, Leukocytosis, Albumin, Systémové podávanie antibiotík počas CDI dlhšie ako 24 hod). Každému z príznakov je priradených 0–2 body podľa tab. 1. Skóre ATLAS u pacientov, ktorí zomreli na CDI, presahovalo 6, pacienti, ktorí prežili, mali skóre nižšie ako 5. Skórovací systém ATLAS je ľahko zapamätateľný a použiteľný i v nočnej službe, kedy na stratifikáciu napr. stačí vek pacienta, horúčka a údaj o užívaní antibiotík. Iným, často používaným systémom je CSI – Clostridium difficile Severity Index – ktorý boduje iba tri parametre, a to kreatinín, leukocytózu a sérový albumín (tab. 2). Pacienti s CSI skóre nad 2 majú významne vyššiu mortalitu, a preto vyžadujú agresívnejšiu iniciálnu terapiu.

Liečba
ESCMID vo svojom odporúčaní liečby CDI zdôrazňuje dodržiavanie týchto zásad:
- nepoužívať antiperistaltickú liečbu a opiáty
- nasadiť antibiotiká podľa zistenej citlivosti vykultivovanej CDI alebo podľa doteraz známej citlivosti v danom zariadení alebo regióne
Prvá epizóda CDI alebo prvá rekurencia CDI sa lieči podľa toho, či môže pacient prijímať per os, alebo nie. Ak je perorálny príjem zachovaný, treba pri ľahkej forme CDI nasadiť metronidazol 3 × 500 mg počas 10 dní, pri ťažkej CDI vankomycín 4 × 125 mg, taktiež počas 10 dní. V prípade, že pacient nemôže prijímať per os, nasadzuje sa pri ľahkej forme intravenózny metronidazol v dávke 2 × 500 mg. Pri liečbe ťažkej CDI sa k nemu pridáva 500 mg vankomycínu v 100 ml fyziologického roztoku v podobe rektálneho nálevu každých 4–12 hod alebo 4 × 500 mg vankomycínu cez nazogastrickú sondu počas 10 dní. Kolektómia je indikovaná pri objavení sa príznakov perforácie kolonu, ileu alebo toxického megakolon a má sa k nej pristúpiť ešte predtým, než hladina sérového laktátu presiahne 5 µmol/l.
Liečba ďalšieho a nasledujúcich vzplanutí CDI spočíva v podávaní tých istých medikamentov ako pri prvej epizóde alebo pri prvej rekurencii ťažkej CDI, pričom pri perorálnom podávaní možno zvážiť postupný pokles dennej dávky perorálneho vankomycínu o 125 mg každý tretí deň („taper“). Ďalším variantom je pulzná liečba, pri ktorej sa podáva vankomycín v dávke 125–500 mg raz za 2–3 dni. Ak nie je zachovaný perorálny príjem, opäť sa podáva 3 × 500 mg metronidazolu i. v. spolu s intrakolonickým nálevom vankomycínu 500 mg každých 4–12 hod alebo s jeho aplikáciou cez nazogastrickú sondu v dávke 4 × 500 mg.
Vo všetkých spomínaných prípadoch orálnej aplikácie vankomycínu môže byť tento nahradený teikoplanínom v dávke 2 × 100 mg. Aditívny efekt probiotík zatiaľ nebol signifikantne preukázaný. Profylaxia CDI spočíva vo zvýšenej hygiene rúk, vrátane povinnosti nosiť rukavice v izbách pacientov s CDI, v dezinfekcii povrchov chlórovanými preparátmi, ďalej v promptnej izolácii suspektných pacientov, ako aj v zodpovednej preskripcii antibiotík [2,13].
SHEA vo svojich odporúčaniach ešte pridáva nutnosť čo najskoršieho prerušenia antibiotickej liečby, ktorá viedla k vzniku CDI. V liečbe ľahkej formy CDI predlžuje podávanie metronidazolu na 10–14 dní. Ak je nutná chirurgická liečba, špecifikuje ju na subtotálnu kolektómiu so zachovaním rekta [11]. Neal et al [15] sa prikláňajú k alternatíve ileostómie s lavážou kolonu vankomycínom, ktorá vykazovala nižšiu mortalitu v porovnaní s kolektómiou (p = 0,006).
Za pozitívnu terapeutickú odpoveď sa považuje:
- pokles frekvencie
- zvýšenie konzistencie stolice do 3 dní od zahájenia liečby
Absencia takejto odpovede sa označuje ako zlyhanie terapie.
Rekurencia CDI znamená:
- opakovaný nárast počtu stolíc
- zníženie ich konzistencie
- vznik nových príznakov ťažkej kolitídy počas dvoch za sebou nasledujúcich dní
- so súčasným opakovaným mikrobiologickým dôkazom toxigenickej CDI bez prítomnosti inej príčiny hnačiek
- po predchádzajúcom úspešnom terapeutickom zvládnutí CDI [13]
Nevýhodou metronidazolu môže byť jeho nedostatočná koncentrácia v čreve a systémové vedľajšie účinky: nauzea, bolesti hlavy, poruchy chuťových vnemov a periférna neuropatia. V porovnaní s vankomycínom táto terapia častejšie zlyháva a vyskytuje sa viac rekurencií, najmä po ťažších infekciách. Tieto sa však objavujú aj po liečbe vankomycínom. Možno zhrnúť, že jedným z najzávažnejších problémov liečby metronidazolom a vankomycínom je 20–30% výskyt opakovaných CDI počas 2 mesiacov od úspešnej liečby, najčastejšie však už po prvých 2 týždňoch tejto terapie [6]. Preto je namieste hľadanie ďalších antibiotík, ktoré by sa účinnejšie uplatnili v liečbe CDI.
Fidaxomycín – nová terapeutická možnosť?
Fidaxomycín je makrocyklické antibiotikum, ktoré sa v štúdiách in vitro ukázalo ako aktívnejšie v porovnaní s vankomycínom voči všetkým kmeňom CDI, vrátane NAP1/BI/027. Táto aktivita v kombinácii s minimálnou systémovou absorpciou, vysokou fekálnou koncentráciou a limitovanou aktivitou voči komponentom normálnej črevnej flóry sa potvrdila aj in vivo. Fidaxomycín je baktericídne antibiotikum, zatiaľ čo vankomycín má iba baktériostatický efekt. Fidaxomycín má predľžený postantibiotiký efekt, ktorý nebol pozorovaný po liečbe vankomycínom.
Azda najznámejšia porovnávacia klinická štúdia bola publikovaná v r. 2011 v New England Journal of Medicine [6]. Spolu 596 CDI pacientov bolo podrobených modifikovanej analýze typu „intention-to-treat“: 287 pacientov užívalo fidaxomycín a 309 vankomycín. 88,2 % pacientov zo skupiny liečených fidaxomycínom a 85,8 % pacientov zo skupiny liečených vankomycínom splnili kritéria klinického vyliečenia, čím sa dokázala non-inferiorita fidaxomycínu. Táto bola potvrdená aj analýzou „per-protocol“ (92,1 vs 89,8 %). V oboch skúmaných skupinách neboli zaznamenané prípadné rozdiely v efekte liečby vzhľadom na vek, ambulantný alebo nemocničný status pacienta, predchádzajúci výskyt CDI, liečbu CDI 24 hod pred zaradením do štúdie, závažnosť CDI, predchádzajúcu liečbu metronidazolom a sprievodnú antimikróbnu liečbu kvôli inej infekcii. Pacienti po liečbe fidaxomycínom však vykazovali signifikantne nižší výskyt rekurencie CDI – 15,4 vs 25,3 % v „intention-to-treat“ analýze (p = 0,005) a 13,3 vs 24,0 % v „per-protocol“ analýze (p = 0,004). Rekurencia CDI vyvolaná kmeňom NAP1/BI/027 bola podobná v oboch skupinách pacientov (24,4 vs 23,6 %). CDI pacienti infikovaní inými kmeňmi mali po liečbe fidaxomycínom rekurenciu o 69 % nižšiu než po liečbe vankomycínom alebo inými slovami, relatívne riziko rekurencie CDI bolo v skupine pacientov užívajúcich vankomycín 3,3-krát vyššie než v skupine pacientov liečených fidaxomycínom. Po liečbe fidaxomycínom bol zaznamenaný aj skorší ústup hnačiek, avšak rozdiel nebol štatisticky významný, rovnako ako výskyt nežiaducich príznakov.
O rok neskôr bola publikovaná ďalšia komparatívna štúdia, zahŕňajúca 509 pacientov z Európy, Kanady a USA, ktorá potvrdila výsledky predchádzajúcej americkej štúdie: zaznamenala nesignifikantne vyšší liečebný efekt fidaxomycínu v porovnaní s vankomycínom pri približne rovnakom výskyte vedľajších účinkov [16]. Na základe týchto výsledkov, ako aj výsledkov ďalších štúdií, bol fidaxomycín zaradený do liečby CDI v USA v máji 2011 a v Európe v decembri 2011. Pre svoju pomerne vysokú cenu by mal byť vyhradený na liečbu ťažkých a rekurujúcich CDI, ako aj pre pacientov s nepriaznivými prognostickými faktormi [17,18].
Autori tejto štúdie zároveň konštatovali skutočnosť, ktorú naši infektológovia „cítia“ už dávnejšie – CDI ribotyp 027 má v Európe nižšiu incidenciu než v Kanade a v USA. V európskych podmienkach je nahradzovaný ribotypom 078 (Nizozemsko) alebo 106 (Anglicko), ktoré taktiež spôsobujú závažné infekcie, ale ich častejší výskyt bol zachytený skôr pri komunitne získaných infekciach a u mladých ľudí. Ďalší ribotyp 017, ktorý sa vyskytuje v Európe i v Kanade, ale asi najčastejšie v Ázii, sa spája s vyššou mortalitou.
Ďalšie liečebné možnosti
Fekálne transplantáty darcovských nálevov stolice, či už v podobe rektálnych (kolonoskopických), alebo duodeno-jejunálnych (cez nazojejunálnu sondu) aplikácií, sa podávajú v predstave obnovenia ochrany čreva pred CDI prostredníctvom obnovenia jeho mikroflóry. Stolica darcu sa pred podaním rozpúšťa v 2 ml vody. Tento spôsob baktérioterapie môže okrem jej akceptovania naraziť na problém bakteriálneho prestania v tenkom čreve po duodenálnej instilácii stolice. V niekoľkých doterajších štúdiách sa tento liečebný postup stretol s nevýznamným počtom nežiaducich účinkov a bol zaťažený minimálnym rizikom prenosu črevných patogénov od darcu. Väčšinou sa nasadil u pacientov s rezistentnou CDI a s častými rekurenciami. Efektivita dosiahla až 87 %. Zdá sa, že „ide o neelegantnú metódu s elegantným výsledkom“ [7,19]. Rovnaké výsledky v porovnaní s vankomycínom boli hlásené v ojedinelej štúdii [20] aj po črevnom náleve turmeriku, zázvorovitej rastliny s obsahom kurkumy, pričom autori oceňovali predovšetkým nízke ekonomické náklady tejto liečby.
Probiotiká reprezentujú ďalšiu alternatívu rekolonizácie črevnej sliznice v snahe nastoliť rovnovážnu flóru. Zároveň môžu pozitívne ovplyvniť imunitnú odpoveď pacienta s CDI. V tomto smere sa ako sľubné ukázali Saccharomyces boulardii a Lactobacilli, najmä v profylaxii vzniku CDI u pacientov užívajúcich antibiotiká. Probiotiká sa zatiaľ neuplatnili v primárnej liečbe CDI [7].
Intravenózny imunoglobulín a monoklonálne protilátky sa skúšali s rôznym efektom najmä pri liečbe rekurentných a ťažkých CDI.
Vakcinácia aktívnou očkovacou látkou je zatiaľ v štádiu klinického skúšania a svoje uplatnenie by mala tiež nájsť v prevencii rekurencie CDI. Počítačovo simulovaný ekonomický model očkovania priniesol priaznivé výsledky z hľadiska pomeru cost-benefit [7].
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 3. 7. 2012
Přijato: 1. 9. 2012
doc. MUDr. Marian Bátovský, CSc., mim. prof. SZU
Gastroenterologická klinika SZU a UNB
UN sv. Cyrila a Metoda
Antolská 11, 851 07 Bratislava
batovsky@pe.unb.sk
Sources
1. Hu MY, Katchar K, Kyne L et al. Prospective derivation and validation of a clinical prediction rule for recurrent Clostridium difficile infection. Gastroenteroogy 2009; 136(4): 1206–1214.
2. Stokowski LA, McDonald LC. Refining our approach to Clostridium difficile prevention. http://www.medscape.com.
3. Khanna S, Pardi D, Aronson SI et al. The epidemiology of community-acquired Clostridium difficile infection: a population-based study. Am J Gastroenterol 2012; 107(1): 89–95.
4. Garcia A. A perspective on community-acquired C. difficile infection. http://www.medscape.com.
5. Loo VG, Poirier L, Miller MA. A predominantly clonal multi-institutional outbreak of Clostridium difficile-associated diarrhea with high morbidity and mortality. N J Engl Med 2005, 353(23): 2433–2441.
6. Louie TJ, Miller MA, Mullane KM et al. Fidaxomicin versus vancomycin for Clostridium difficile infection. N Engl J Med 2011; 364(5): 422–431.
7. Lo Vecchio A, Zacur G. Clostrium difficile infection. An update on epidemiology, risk factors, and therapeutic options. Curr Opin Gastroenterol 2012; 28(1): 1–9.
8. Zuger A. Does recurrent Clostridium difficile infection mean reinfection or relapse? http://www.medscape.com/viewarticle/756741
9. Johnson DA. PPIS and C.difficile: putting the risk in perspective. http://www.medscape.com.
10. Riggs MM, Sethi AK, Zaberski TF. Asymptomatic carriers are a potential source for transmission of epidemic and nonepidemic Clostridium difficile strains among log-term care facility residents. Clin Infect Dis 2007; 45(8): 992–998.
11. Cohen SH, Gerding DN, Johnson S et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the Society for healthcare epidemiology of America (SHEA) and the Infectious diseases society of America (IDSA). Infect Control Hosp Epidemiol 2010; 31(5): 5–29.
12. Crobach MJT, Dekkers OM, Wilcox MH et al. European society of clinical microbiology and infectious diseases: Data review and recommendations for diagnosing Clostridium difficile-infection (CDI). Clin Microbiol Infect 2009; 15(12): 1053–1066.
13. Bauer MP, Kuijper EJ, van Dissel JT. ESCMID: Treatment guidance document for Clostrium difficile infection. Clin Microbiol Infect 2009; 15(12): 1067–1079.
14. Ananthakrishnan AN, Guzman-Perez R, Gainer V et al. Predictors of severe outcomes associated with Clostridium difficile infection in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2012; 35(7): 789–795.
15. Neal MD, Alverdy JC, Hall DE et al. Diverting loop ileostomy and colonic lavage: an alternative to totalabdominal colectomy for the treatment of severe, complicated Clostridium difficile associated disease. Ann Surg 2011; 254(3): 423–429.
16. Cornely OA, Crook DW, Esposito R et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, non-inferiority, randomized controlled trial. www.thelancet.com/infection. DOI:10.1016/S1473-3099 /11/70374-7.
17. Johnson DA. C.difficile:new therapy for a dangerous disease? http://www.medscape.com/.
18. Auwaerter PG. Fidaxomicin: new drug for Clostridium difficile – where will it fit? http://www.medscape.com.
19. Grens K. Fecal transplant by enema works for Stubborn C. difficile. Ann Intern Med; http://bit.ly/xtXkDN.
20. Harding A. Turmeric enema may equal vancomycin for C. difficile colitis. http://www.medscape.com.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology

2012 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Kongresový podzim
- Idiopatické střevní záněty v Karlových Varech 2012
- Report from 7th CEURGEM (Central European Gastroenterology Meeting)
- Ohlédnutí za UEGW 2012: Evropská gastroenterologická federace je úspěšný projekt
- OESO – 11th world conference, COMO, Italy, September 1–4th 2012
- EURO-NOTES 2012, August 4–6th 2012, Prague
- VI. beskydský endoskopický workshop
- Epidemiológia infekcie Helicobacter pylori infection v Slovenskej republike
- Clostridium difficile – narastajúca hrozba?
- Změny tělesné hmotnosti a stravovacích zvyklostí obézních pacientů po tubulizaci žaludku – pilotní studie
- Vybrané gastrointestinálne choroby a nutričné poruchy asociované s osteoporózou
- Somatostatin a jeho využití
- Rozšíří golimumab spektrum anti-TNF léčiv pro idiopatické střevní záněty?
- Porovnání tolerance a kvality přípravy střeva před kolonoskopií pomocí pikosulfát/citrátu hořečnatého nebo polyetylenglykolu v různém dávkování
- První „POEM“ (perorální endoskopická myotomie) v České republice
- Spontánny intramurálny hematóm tenkého čreva ako komplikácia antikoagulačnej liečby
- Vzácné mykotické komplikace po transplantaci jater
- Večer s géniem
- 30 rokov od prvej endoskopickej papilosfinkterotómie na území vtedajšieho Československa
- Omeprazol
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Somatostatin a jeho využití
- Omeprazol
- Clostridium difficile – narastajúca hrozba?
- Vybrané gastrointestinálne choroby a nutričné poruchy asociované s osteoporózou
