Experimentální elektrogastrografie
Experimental electrogastrography
Surface electrogastrography (EGG) is a non-invasive method of recording gastric myoelectrical activity from cutaneous leads placed over the stomach. Our group set up and worked out the methods for EGG in experimental pigs. The dominant frequency in pigs is fully comparable with that found in humans. EGG in experimental pigs is feasible. Experimental EGG is an important basis for further preclinical projects in pharmacology and toxicology.
Key words:
electrogastrography – experimental pig – preclinical studies – Sus scrofa f. domestica
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
16. 5. 2014
Accepted:
6. 6. 2014
Authors:
J. Bureš 1; I. Tachecí 1; J. Květina 1; M. Pavlík 2; M. Kuneš 3; K. Musílek 3; D. Jun 3; J. Žďárová Karasová 3; T. Douda 1; S. Rejchrt 1; K. Kuča 3; M. Kopáčová 1
Authors‘ workplace:
II. interní gastroenterologická klinika LF UK a FN Hradec Králové
1; Centrum pokročilých studií, Fakulta vojenského zdravotnictví, Univerzita obrany, Hradec Králové
2; Centrum biomedicínského výzkumu, FN Hradec Králové
3
Published in:
Gastroent Hepatol 2014; 68(3): 237-242
Category:
Important Anniversary: Original Article
Práce je věnována památce prof. MUDr. Zdeňka Mařatky, DrSc. u příležitosti 100. výročí jeho narození.
Overview
Transkutánní elektrogastrografie (EGG) je neinvazivní vyšetření myoelektrické aktivity žaludku pomocí elektrod umístěných na kůži epigastria. Naše skupina vypracovala metodiku EGG u experimentálního prasete. Dominantní frekvence EGG prasete je plně srovnatelná s člověkem. Experimentální EGG proto představuje důležitou metodu pro preklinické farmakologické a toxikologické studie.
Klíčová slova:
elektrogastrografie – experimentální prase – preklinické studie – Sus scrofa f. domestica
Prof. MUDr. Zdeněk Mařatka, DrSc., FCMA
Významným způsobem ovlivnil několik generací gastroenterologů nejen u nás, ale i v zahraničí. Jeho zásadní mezinárodní přínos je především v terminologii digestivní endoskopie, ve správném klinickém pojetí funkční dyspepsie a ve výzkumu idiopatických střevních zánětů. Z jeho gastroenterologické školy vyšly nejméně dvě generace žáků a pokračovatelů. Je třeba připomenout, že prof. Mařatka věnoval velkou pozornost také experimentální vědecké a výzkumné práci [1]. Prof. Mařatka strávil dva roky (1947–1948) na pracovišti slavného gastrointestinálního fyziologa, prof. A. C. Ivyho (University of Illinois, Chicago).
Experimentální výzkum prof. Mařatky byl zaměřen především na význam bakterií tlustého střeva v etiopatogenezi idiopatických střevních zánětů. Jeho dvojsložková hypotéza patogeneze ulcerózní proktokolitidy je aktuální i dnes [2]. Jedním z pojítek experimentálního výzkumu a funkční dyspepsie u lidí je elektrogastrografie.
Elektrogastrografie
Transkutánní elektrogastrografie (EGG) je neinvazivní metoda záznamu myoelektrické aktivity žaludku pomocí elektrod umístěných na kůži v epigastriu. Žaludeční pacemaker je u člověka lokalizován na velké kurvatuře v horní třetině žaludečního těla. Základní elektrická rytmická automaticita je zajištěna tzv. pomalými gastrickými vlnami (electrical control activity), jejich normální frekvence je tři cykly za minutu. Kromě pomalých vln se na zajištění správné myoelektrické kontroly žaludku podílejí ještě vrcholové potenciály (electrical response activity), které jsou nezbytné pro správnou koordinovanou kontraktilitu žaludečního antra [3–7].
Vedle myoelektrické činnosti žaludku hodnocené pomocí EGG je další důležitou fyziologickou aktivitou gastrická motorická funkce. Neinvazivním vyšetřením této funkce jsou testy evakuace žaludku [8]. U zdravého člověka spolu EGG a gastrické evakuační testy navzájem dobře korelují [9].
V klinické medicíně se v současné době EGG využívá především v diabetologii (k diagnostice gastroparézy), u funkční dyspepsie, k objektivnímu posouzení efektu prokinetik a k vyšetření některých kinetóz. Charakteristické EGG nálezy jsou také např. u mentální anorexie, intestinální pseudoobstrukce a řady dalších stavů [3–7,10–15]. V minulosti byly problémy EGG v nízké reprodukovatelnosti vyšetření, časové náročnosti vyhodnocení a v obtížném odstraňování pohybových a dechových artefaktů, které záznam zkreslovaly. Po několika desetiletích skepse prožívá nyní EGG jakousi „renesanci“ obnovení zájmu o toto vyšetření, a to jak díky zdokonalení přístrojového vybavení, tak i díky možnostem počítačového zpracování a vyhodnocení EGG záznamu.
Experimentální elektrogastrografie
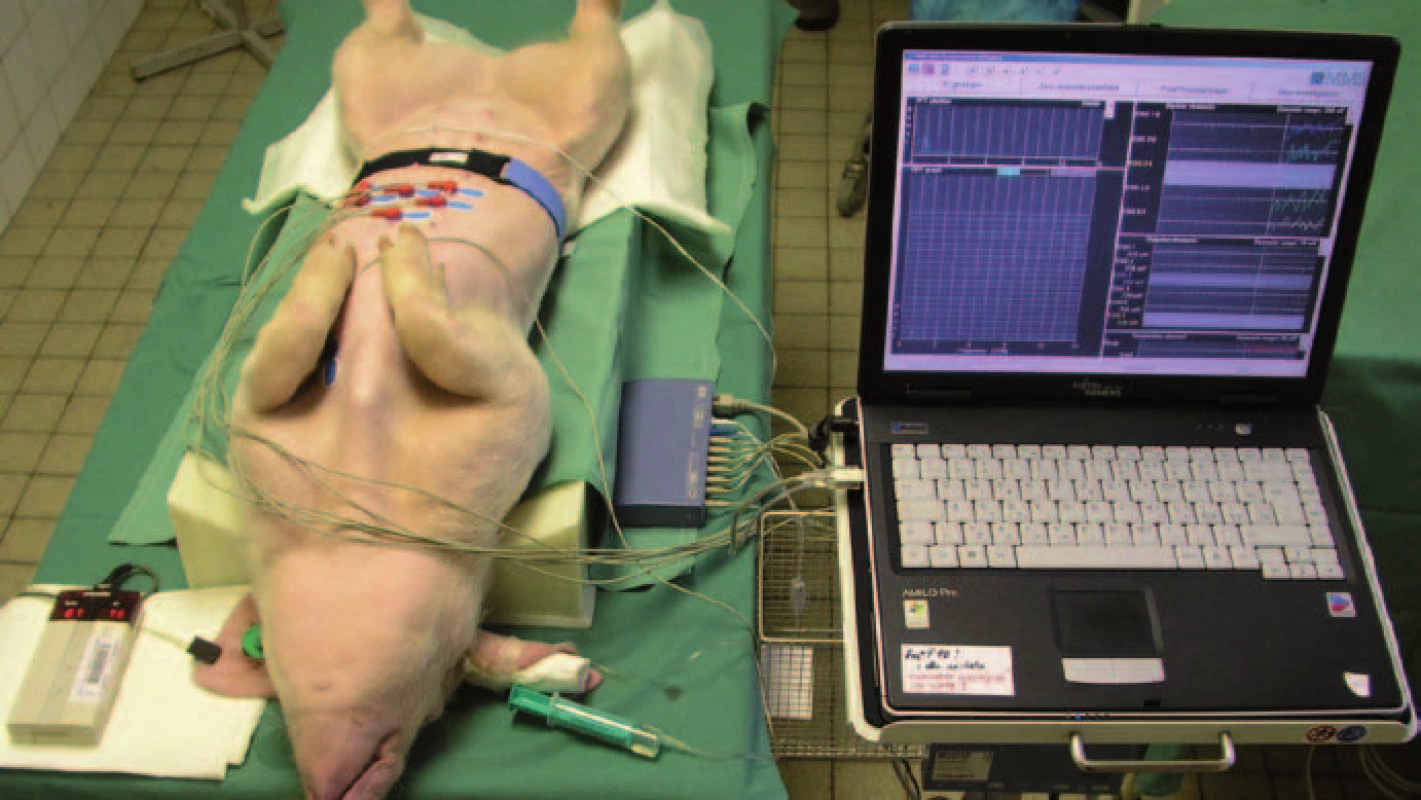
Naše skupina vypracovala a postupně zdokonalovala metodiku EGG u experimentálního prasete [16–19]. Prase domácí (Sus scrofa f. domestica) má celou řadu velmi podobných gastrointestinálních a metabolických funkcí jako člověk, a proto je vhodné pro preklinické testování a výzkum v mnoha oblastech [20–22]. Zdokonalení experimentální EGG spočívalo jak v přístrojové, tak i v metodické části. Současné zařízení snímá EGG záznam pomocí sedmi svodů (oproti původním třem) a umožňuje identifikovat dvojice elektrod s nejlepším signálem. To je velmi důležité např. při zátěžovém objemovém vodním testu, kdy se objem a poloha žaludku v průběhu vyšetření mění. EGG zařízení má dále abdominální pás, který umožňuje registrovat (a automaticky eliminovat) dechové a pohybové artefakty (obr. 1, 2).
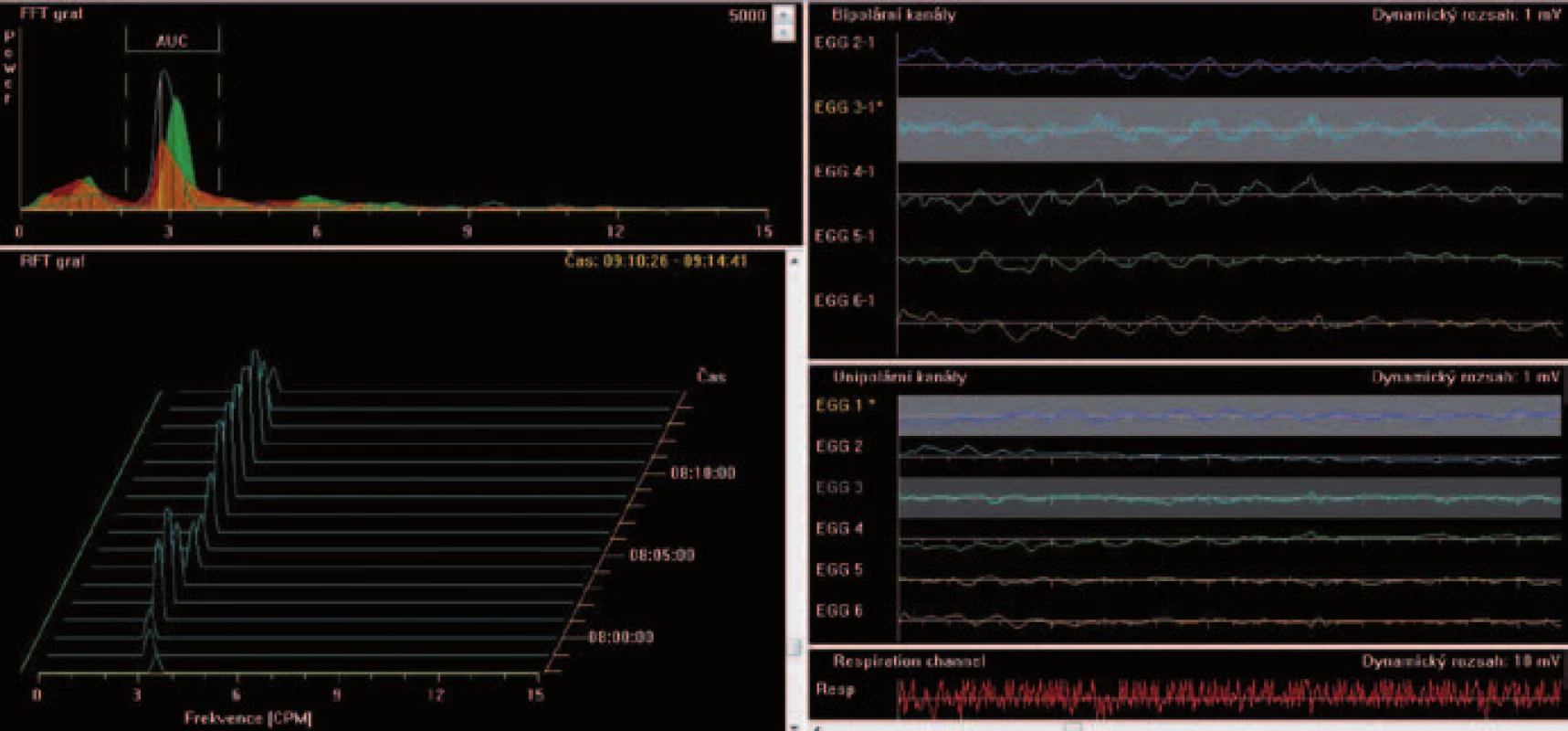
Hodnocení EGG záznamu využívá spektrální analýzu založenou na Fourierově transformaci a dále stanovení plochy amplitud (power) (obr. 3, 4). V humánní medicíně se standardně využívá procentuální vyjádření zastoupení určitého rytmu (dominantní frekvence) z celkového časového úseku, tedy normální rytmus tří cyklů za minutu (2,5–3,5 cyklů za 1 min), bradygastrie (< 2,5 cykly za 1 min), tachygastrie (3,5–10 cyklů za 1 min) a/nebo duodenální aktivita (> 10 cyklů za 1 min). V experimentální EGG stanovujeme průměrné dominantní frekvence v jednominutových intervalech. To umožňuje jednak detailnější hodnocení a jednak korelaci s dalšími ukazateli (např. farmakokinetikou léčiva). V humánní medicíně se k hodnocení EGG dále využívá myoelektrická odpověď na příjem potravy, a to jako poměr jednotlivých ploch amplitud postprandiálně a nalačno (power ratio). V experimentální EGG používáme poměr plochy amplitud záznamu po intervenci a bazální klidové EGG. Moderní počítačové programy jsou schopny eliminovat pohybové a dechové artefakty.
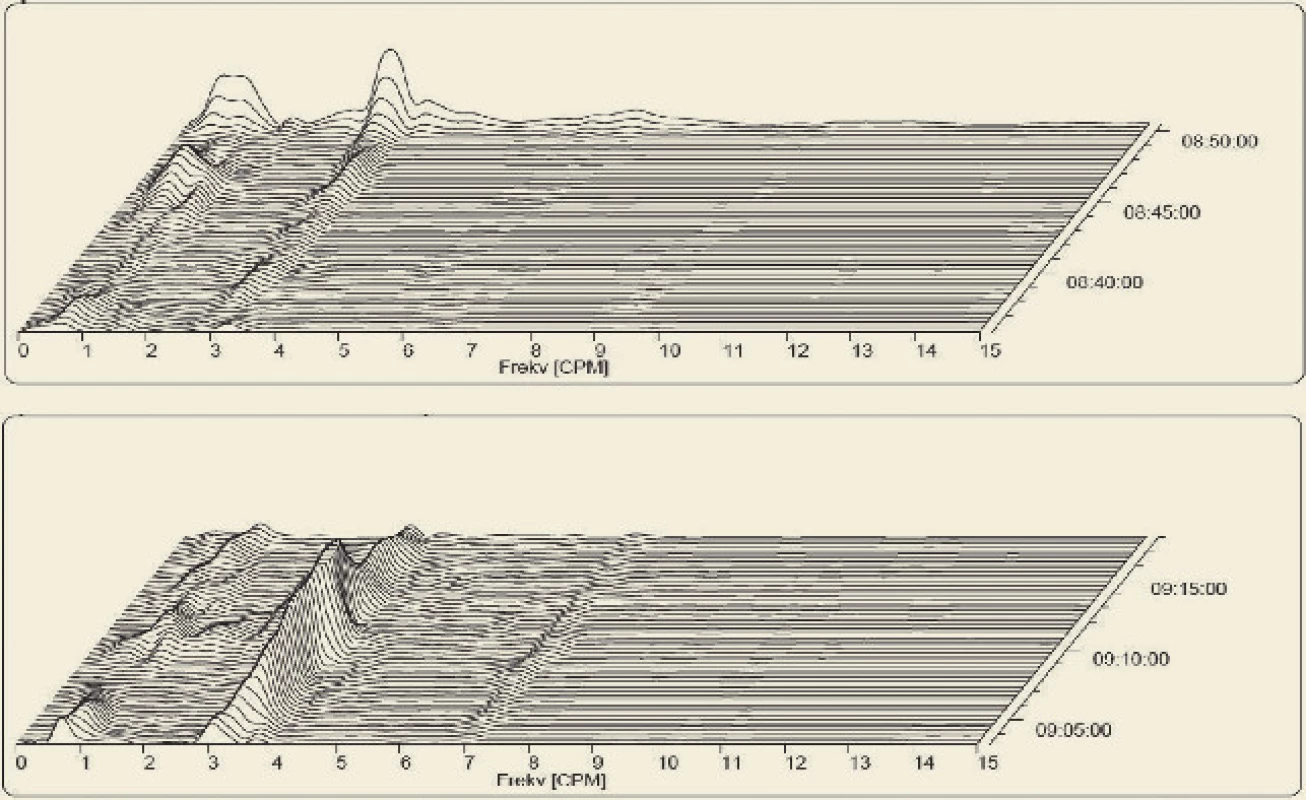
V našich studiích jsme prokázali, že klidová dominantní frekvence EGG experimentálního prasete je plně srovnatelná s EGG člověka [4,16,19]. To umožňuje rozsáhlé využití v preklinických studiích funkčních, farmakologických a toxikologických.
Vliv celkové anestezie
Pro některé farmakologické a toxikologické studie je třeba zaznamenávat EGG dlouhodobě, až osm hodin. Experimentální EGG je třeba u prasat provádět vždy v celkové anestezii [23]. Cílem jedné z našich studií bylo zjistit, jak celková anestezie ovlivňuje EGG. U identické skupiny zvířat jsme postupně testovali thiopental, izofluran, oxid dusný a kombinaci izofluranu a oxidu dusného. Efekt všech anestetik na EGG byl malý, jako nejvhodnější se z tohoto aspektu jeví thiopental, jehož efekt byl minimální [19].
Zátěžový vodní test
V humánní medicíně je EGG po vypití standardního objemu vody důležitým testem pro funkční dyspeptický syndrom horního typu [24,25]. Prase je schopno v jedné porci přijmout výrazně větší objem potravy ve srovnání s člověkem. Na rozdíl od člověka má pylorickou svalovou řasu (torus pyloricus), která ovlivňuje evakuaci žaludku prasete [26,27]. Proto bylo třeba zátěžový vodní test u experimentálního prasete provádět s většími objemy tekutin. Při různých objemech instilovaných do žaludku prasete gastrickou sondou nedošlo k významnějším změnám dominantní frekvence. Při analýze plochy amplitud došlo k nejrychlejšímu vzestupu (již v prvních 15 min) po instilaci 500 ml vody. Po aplikaci 1 000 ml bylo maxima dosaženo v druhém 15minutovém intervalu, po instilaci 1 500 ml vody bylo maxima dosaženo po 60 min. Po všech třech různých objemech došlo následně k významnému poklesu (na hodnoty nižší než byly bazální) a k finálnímu vyrovnání po 255 min (graf 1–3). Můžeme tedy konstatovat, že zátěžový vodní test je možno provádět i u experimentálního prasete se zohledněním různých objemů [28].



Efekt prokinetik
Itoprid je dopaminový D2 antagonista s inhibiční acetylcholinesterázovou aktivitou. Při standardním dávkování (3 mg/kg) jsme u experimentálního prasete neprokázali významnější ovlivnění EGG itopridem [16].
Erytromycin je nejsilnější známé prokinetikum zvyšující na EGG jak dominantní frekvenci, tak i amplitudy [16,17,29]. Důležité je studium efektu erytromycinu zejména u stavů s významnou žaludeční motorickou dysfunkcí. V humánní medicíně je to především diabetická gastroparéza. V experimentálním modelu idiopatického střevního zánětu pomocí DSS (dextransodiumsulfát) jsme prokázali gastrickou motorickou poruchu. Intragastrické podání erytromycinu následně zvýšilo u experimentálního prasete dominantní frekvenci [29].
Inhibitory, modulátory a reaktivátory acetylcholinesterázy
Spektrum použití látek zasahujících do cholinergního mediátorového systému se pohybuje od intoxikací organofosforovými sloučeninami přes vegetativní dystonie centrální (např. parkinsonizmus) a periferní (myasthenia gravis, glaukom) až po onemocnění typu Alzheimerovy demence. Interakční mechanizmy jednotlivých působků se odehrávají buď přímo na receptorové (efektorové) úrovni, nebo nepřímo prostřednictvím zásahu do biosyntézy a biodegradace mediátoru (acetylcholinu). Celosvětově je vyvíjeno velké úsilí na hledání nových látek aplikovatelných pro terapii výše uvedených stavů. U řady potenciálně úspěšných nových léčiv této skupiny jsou limitem závažné nežádoucí vedlejší účinky, především gastrointestinální a hepatální. Většina nežádoucích vedlejších účinků léčiv a toxických látek na trávicí ústrojí se projeví gastrointestinální motorickou dysfunkcí. Vzhledem k tomu, že reaktivátory acetylcholinesterázy nelze z etických důvodů testovat na zdravých dobrovolnících, je preklinické testování zásadně důležité pro budoucí humánní použití v případě kritických katastrofických situací (průmyslové otravy organofosfáty, toxické předávkování inhibitory acetylcholinesterázy, teroristický útok nervově paralytickými látkami aj.). V iniciální fázi našeho rozsáhlého projektu řešícího tuto problematiku jsme testovali efekt atropinu, paraoxonu a reaktivátoru acetylcholinesterázy oximu HI-6 [30–32].
U identické skupiny zvířat jsme v náhodném pořadí postupně (s jednotýdenními odstupy) podali 1,5 mg, 3 mg a 4,5 mg atropinu i.m., což odpovídalo dávce 0,05, 0,1 a 0,15 mg/kg hmotnosti. Dominantní frekvence se významně nezměnila. Došlo však k signifikantním změnám amplitud. Po dávkách 1,5 a 3 mg došlo k dvojvrcholovému vzestupu hodnot plochy amplitud, zatímco po dávce atropinu 4,5 mg i.m. (odpovídající 10 mg atropinu pro 70kilového člověka) došlo k postupnému setrvalému poklesu hodnot (graf 4–6) [32]. První dva tvary odpovídají dvojkompartmentovému modelu eliminační kinetiky atropinu. Maximální plazmatická koncentrace atropinu je dosažena za 3–5 min po i.m. podání, eliminační poločas atropinu je 2–3 hod pro člověka a 3–4 hod pro experimentální prase [33]. Vysvětlení odlišného EGG vzoru po vyšší dávce atropinu je třeba hledat v dávkově závislém ovlivnění presynaptických muskarinových receptorů a následné parasympatické odpovědi [34].



V dalším projektu jsme 10 min po podání paraoxonu (1,5 g i.m.) podali oxim HI-6 DMS (1,5 g i.m.). Před podáním paraoxonu a po něm a následně 90 min po podání HI-6 jsme sledovali EGG. Reaktivátor acetylcholinesterázy HI-6 signifikantně blokoval gastrický efekt paraoxonu [31].
Závěr
EGG u experimentálního prasete je důležitou neinvazivní metodou k výzkumu myoelektrické aktivity žaludku. EGG prasete je v základních parametrech plně srovnatelné s EGG člověka. Experimentální EGG tak představuje důležitou metodu pro preklinické farmakologické a toxikologické studie.
Další rozsáhlá literatura u autorů.
Práce vznikla v rámci řešení grantu IGA NT/14270-3.
Část této práce byla prezentována na Americkém gastroenterologickém kongresu Digestive Disease Week 2014 (Chicago, IL, USA; 3.–6. května 2014).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 16. 5. 2014
Přijato: 6. 6. 2014
prof. MUDr. Jan Bureš, CSc., FCMA
II. interní gastroenterologická klinika LF UK a FN Hradec Králové
Sokolská 581, 500 05 Hradec Královébures@lfhk.cuni.cz
Sources
1. Fixa B. Happy ninetieth to Professor Zdeněk Mařatka, M.D., D.Sc. Folia Gastroenterol Hepatol 2004; 2(2): 59–61.
2. Mařatka Z. The role of intestinal bacterial flora in the pathogenesis of inflammatory bowel diseases. A two-component hypothesis. Folia Gastroenterol Hepatol 2003; 1(1): 6–11.
3. Chen JZ, McCallum RW (eds). Electrogastrography: principles and applications. New York: Raven Press 1994.
4. Parkman HP, Hasler WL, Barnett JL et al. Electrogastrography: a document prepared by the gastric section of the American Motility Society Clinical GI Motility Testing Task Force. Neurogastroenterol Motil 2003; 15(2): 89–102.
5. Koch KL, Stern RM. Handbook of electrogastrography. Oxford: Oxford University Press 2004.
6. Yin J, Chen JD. Electrogastrography: methodology, validation and applications. J Neurogastroenterol Motil 2013; 19(1): 5–17. doi: 10.5056/jnm.2013.19.1.5.
7. Murakami H, Matsumoto H, Ueno D et al. Current status of multichannel electrogastrography and examples of its use. J Smooth Muscle Res 2013; 49 : 78–88.
8. Bureš J, Kopáčová M, Voříšek V et al. Stanovení rychlosti evakuace žaludku pomocí dechového testu s 13C-oktanovou kyselinou. Metodika testu pro dospělé a výsledky vyšetření zdravých dobrovolníků. Čas Lék Čes 2005; 144(3): 18–22.
9. Bureš J, Kopáčová M, Voříšek V et al. Correlation of electrogastrography and gastric emptying rate estimated by 13C-octanoic acid breath test in healthy volunteers. Folia Gastroenterol Hepatol 2007; 5(1): 5–11.
10. Dolina J, Dítě P, Přecechtělová M et al. 24hodinová pH-metrie a elektrogastrografie u nemocných s chronickou pankreatitidou. Čes a Slov Gastroent 1999; 53(6): 183–186.
11. Dolina J, Vlčková P, Hep A et al. Diabetická gastroparéza – využití elektrogastrografie. Diabetologie 2006; 9(2): 75–78.
12. Gürlich R, Maruna P, Frasko R. Transcutaneous electrogastrography in the perioperative period in patients undergoing laparoscopic cholecystectomy and laparoscopic non-adjustable gastric banding. Obes Surg 2003; 13(5): 714–720.
13. Bures J, Kabelac K, Kopacova M et al. Electrogastrography in patients with Roux-en-Y reconstruction after previous Billroth gastrectomy. Hepatogastroenterology 2008; 55(85): 1492–1496.
14. Frasko R, Maruna P, Gurlich R et al. Transcutaneous electrogastrography in patients with ileus. Relations to interleukin-1beta, interleukin-6, procalcitonin and C-reactive protein. Eur Surg Res 2008; 41(2): 197–202. doi: 10.1159/000134918.
15. Maruna P, Frasko R, Lindner J. Disturbances of gastric electrical control activity after laparotomic cholecystectomy are related to interleukin-6 concentrations. Eur Surg Res 2009; 43(4): 317–324. doi: 10.1159/000235569.
16. Varayil JE, Ali SM, Tacheci I et al. Electrogastrography in experimental pigs. Methodical design and initial experience. Folia Gastroenterol Hepatol 2009; 7(3–4): 98–104.
17. Květina J, Varayil JE, Ali SM et al. Preclinical electrogastrography in experimental pigs. Interdiscip Toxicol 2010; 3(2): 53–58. doi: 10.2478/v10102-010-0011-5.
18. Ali SM, Varayil JE, Tachecí I et al. Electrogastrography in experimental pigs. The power analysis. Gastroent Hepatol 2011; 65(6): 325–330.
19. Tachecí I, Květina J, Kuneš M et al. The effect of general anaesthesia on gastric myoelectric activity in experimental pigs. BMC Gastroenterol 2013; 13 : 48. doi: 10.1186/1471-230X-13-48.
20. Kararli TT. Comparison of the gastrointestinal anatomy, physiology, and biochemistry of humans and commonly used laboratory animals. Biopharm Drug Dispos 1995; 16(5): 351–380.
21. Swindle MM (ed.). Swine in the laboratory: surgery, anesthesia, imaging, and experimental techniques. 2. ed. London: CRC Press 2007.
22. Suenderhauf C, Parrott N. A physiologically based pharmacokinetic model of the minipig: data compilation and model implementation. Pharm Res 2013; 30(1): 1–15. doi: 10.1007/s11095-012-0911-5.
23. Explanatory report on the European convention for the protection of vertebrate animals used for experimental and other scientific purposes (ETS 123). Strasbourg: Council of Europe 2009.
24. Jones MP, Hoffman S, Shah D et al. The water load test: observations from healthy controls and patients with functional dyspepsia. Am J Physiol Gastrointest Liver Physiol 2003; 284(6): G896–G904.
25. Chen CL, Hu CT, Lin HH et al. Clinical utility of electrogastrography and the water load test in patients with upper gastrointestinal symptoms. J Smooth Muscle Res 2006; 42(5): 149–157.
26. Kopacova M, Tacheci I, Kvetina J et al. Wireless video capsule enteroscopy in preclinical studies: methodical design of its applicability in experimental pigs. Dig Dis Sci 2010; 55(3): 626–630. doi: 10.1007//s10620-009-0779-3.
27. Tacheci I, Kvetina J, Bures J et al. Wireless capsule endoscopy in enteropathy induced by nonsteroidal anti-inflammatory drugs in pigs. Dig Dis Sci 2010; 55(9): 2471–2477. doi: 10.1007/s10620-009-1066-z.
28. Tacheci I, Kvetina J, Kunes M et al. Effect of different volume challenge on the gastric myoelectric activity in experimental pigs. UEG Journal 2013; 1 (Suppl 1): A400.
29. Tacheci I, Kvetina J, Kunes M et al. Electrogastrography in experimental pigs: the influence of gastrointestinal injury induced by dextran sodium sulphate on porcine gastric erythromycin-stimulated myoelectric activity. Neuro Endocrinol Lett 2011; 32 (Suppl 1): 131–136.
30. Zdarova Karasova J, Zemek F et al. Intravenous application of HI-6 salts (dichloride and dimethansulphonate) in pigs: comparison with pharmacokinetics profile after intramuscular administration. Neuro Endocrinol Lett 2013; 34 (Suppl 2): 74–78.
31. Bures J, Kvetina J, Pavlik M et al. Impact of paraoxon followed by acetylcholinesterase reactivator HI-6 on gastric myoelectric activity in experimental pigs. Neuro Endocrinol Lett 2013; 34 (Suppl 2): 79–83.
32. Bures J, Kvetina J, Pavlik M et al. Effect of different doses of atropine on the gastric myoelectric activity in experimental pigs. Gastroenterology 2014; 146 (5 Suppl): S267.
33. International programme on chemical safety evaluation. Antidotes for poisoning by organophosphorus pesticides. Monograph on Atropine. Geneva: World Health Organisation 2002. [online]. Available from: http://www.inchem.org/documents//antidote/antidote/atropine.htm#8.0.
34. Brown JH, Taylor P. Muscarinic receptor agonists and antagonists. In: Brunton L, Lazo JS, KL Parker KL (eds). Goodman & Gilman’s Pharmacological Basis of Therapeutics. 11. ed. New York: McGraw Hill 2006.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2014 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Neobvyklá komplikace ERCP
- Profesor Zdeněk Mařatka
- 100 let od narození profesora Zdeňka Mařatky
- Ideo centisimi
- Porovnání účinnosti kolonické kapslové endoskopie a kolonoskopie v detekci polypů a karcinomů tlustého střeva a konečníku – multicentrická, prospektivní, cross-over studie
- Perspektivy biologické léčby u idiopatických střevních zánětů
- Rifaximin v léčbě gastrointestinálních onemocnění
- Experimentální elektrogastrografie
- Akútne krvácanie do horného gastrointestinálneho traktu – zriedkavá manifestácia adenokarcinómu pankreasu
- Rostliny v terapii idiopatických střevních zánětů
- 4th Prague endoscopic day and 15th endoscopic day IKEM
- 87th congress of Japan Gastroenterological Endoscopy Society, Fukuoka, 15.–17. 5. 2014, Japan
- XVIIIth gastroenterology and hepatology days in Hradec Králové and VIIIth international endoscopic workshop
- Looking back at the 10th Congress EAGEN Postgraduate School in Prague
- Golimumab – nové biologikum v léčbě ulcerózní kolitidy
- K odchodu pana prof. MUDr. Bohumila Fixy, DrSc.
- Citrafleet® – jednoduchá a efektivní příprava tlustého střeva před vyšetřením
- Digestivní endoskopie
- Vodou asistovaná kolonoskopie
- Srovnání dietních návyků pacientů s kolorektálními neoplaziemi a jejich příbuzných prvního stupně
- Kombinovaná endoskopická a laparoskopická terapie akutního krvácení z žaludečních metastáz renálního karcinomu – videokazuistika
- Bezbolestná kolonoskopie
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Rifaximin v léčbě gastrointestinálních onemocnění
- Citrafleet® – jednoduchá a efektivní příprava tlustého střeva před vyšetřením
- Akútne krvácanie do horného gastrointestinálneho traktu – zriedkavá manifestácia adenokarcinómu pankreasu
- Neobvyklá komplikace ERCP
