Závažné život ohrozujúce parazitárne ochorenie pečene komplikované disemináciou do pľúc
Severe life-threatening parasitic liver disease complicated by dissemination to the lungs
Alveococcosis is a life threatening tissue parasitosis caused by the larvae of Echinococcus multilocularis, also termed taenia. It results in helminthozoonosis, a parasitosis in which the parasite is transmitted from animals to humans, and where humans act as the accidental hosts. The primary location of the parasite is in the liver, but in rare cases, this can lead to secondary dissemination and the formation of a secondary form of alveococcosis, which most commonly occurs in the lungs and brain. In this case report, we present a case of a 21-year-old patient with alveolar echinococcosis of the liver, complicated by secondary formation of pulmonary lesions. We emphasize the need for a thorough examination of the lungs and the CNS using imaging methods in patients suspected of suffering from alveococcosis.
Key words:
Echinococcus multilocularis – alveolar echinococcosis of the liver – pulmonary echinococcosis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
18. 10. 2015
Accepted:
20. 11. 2015
Authors:
R. Rosoľanka 1
; D. Antolová 2; E. Nováková 3; V. Bartošová 1
Authors‘ workplace:
Klinika infektológie a cestovnej medicíny JLF UK a UN Martin, Slovenská republika
1; Parazitologický ústav, Slovenská akadémia vied, Košice, Slovenská republika
2; Ústav mikrobiológie a imunológie, JLF UK v Martine, Slovenská republika
3
Published in:
Gastroent Hepatol 2016; 70(2): 145-149
Category:
Hepatology: Case Report
doi:
https://doi.org/10.14735/amgh2016csgh.info05
Overview
Alveokokóza je život ohrozujúca tkanivová parazitóza spôsobená larválnym štádiom pásomnice Echinococcus multilocularis. Môžeme ju zaradiť medzi helmitozoonózy, tzn. parazitózy prenosné zo zvieraťa na človeka, kde človek hrá úlohu akcidentálneho hostiteľa. Primárna lokalizácia parazita je výlučne v pečeni, pričom v ojedinelých prípadoch môže dôjsť k sekundárnej diseminácii z primárneho ložiska v pečeni a vzniku sekundárnej formy alveokokózy. Sekundárna forma alveokokózy sa najčastejšie vyskytuje v pľúcach a mozgu. Kazuistika prezentuje 21-ročného pacienta s alveolárnou echinokokózou pečene komplikovanou sekundárnou pľúcnou formou alveokokózy. Autori zdôrazňujú potrebu dôkladného vyšetrenia pľúc a CNS zobrazovacími vyšetreniami.
Kľúčové slová:
Echinococcus multilocularis – alveolárna echinokokóza pečene – pľúcna echinokokóza
Úvod
Alveolárnu echinokokózu (alveokokózu; AE) spôsobuje larválne štádium (metacestóda) parazita Echinococcus multilocularis (EM) syn. Echinococcus alveolaris, ktorá je tiež známa pod názvom pásomnica líščia. Ide o závažné parazitárne ochorenie človeka charakterizované infiltratívnym až deštruktívnym rastom pripomínajúcim malígne nádorové ochorenie. Neliečené alebo nesprávne liečené končí obvykle v priebehu 10–15 rokov smrťou hostiteľa [1 – 3].
EM je rozšírený u mäsožravých zvierat (najčastejšie líšky hrdzavé) na severnej pologuli. Jedná sa predovšetkým o oblasti strednej Európy, veľkej časti severnej a centrálnej Eurázie a Severnej Ameriky [4]. V posledných rokoch je badateľná expanzia parazita v Európe. Spočiatku geografická distribúcia EM zahŕňala regióny Európy ako Rakúsko, Švajčiarsko, Francúzsko, Nemecko, Lichtenštajnsko, Luxembursko, Pobaltské krajiny, Belgicko, Holandsko, severné Taliansko, Poľsko, Česko, Slovensko, severnú časť Maďarska a Slovinsko. Slovensko sa v súčasnosti považuje za vysoko endemickú oblasť výskytu EM u líšok hrdzavých (najmä jeho severné regióny). Zamorenosť líščej populácie EM sa napr. v Prešovskom kraji pohybuje na úrovni 38,5 % a v Žilinskom kraji je to až 47,7 % [5]. Prvé prípady AE v Slovenskej republike boli zaznamenané v roku 2000, do roku 2005 [6] bolo na Klinike infektológie a cestovnej medicíny v Martine evidovaných päť pacientov. V súčasnosti na našom pracovisku evidujeme už 31 pacientov nakazených AE, pričom je na celom území Slovenska doteraz hlásených 42 prípadov ochorenia.
Lokalizácia parazita je takmer výlučne v pečeni, a to viac ako v 95 % prípadov. Ochorenie sa môže per kontinuitatem alebo metastaticky krvnou a lymfatickou cestou rozšíriť do pľúc, mozgu, kostí alebo sleziny [2,6,7]. Postihnutie pľúc je ojedinelé a zatiaľ sa vyskytlo len v kombinácii s nálezom v pečeni. V našom súbore sa nachádzajú dvaja pacienti s kombináciou pečeňovej a pľúcnej formy AE. Kazuistiku prezentujeme pre zaujímavý a pomerne zdĺhavý diferenciálne diagnostický postup u mladého pacienta (21 rokov) mužského pohlavia v snahe zdôrazniť možnosť postihnutia viacerých orgánov parazitom a potrebu ich vyšetrenia aj pri jasnom a potvrdenom náleze v pečeni.
Kazuistika
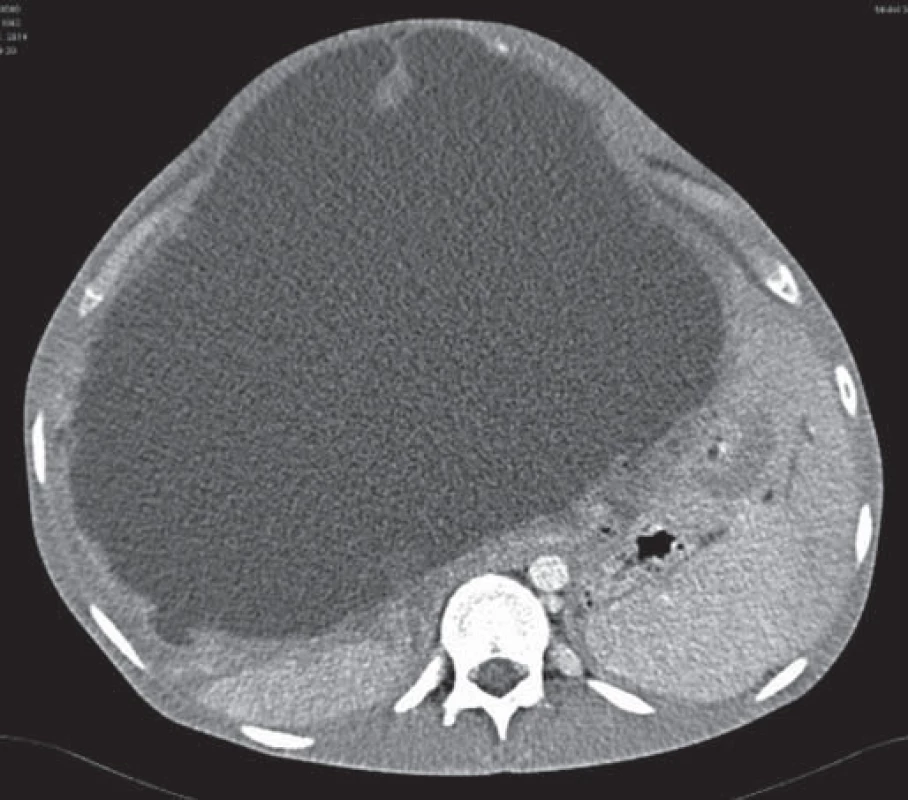
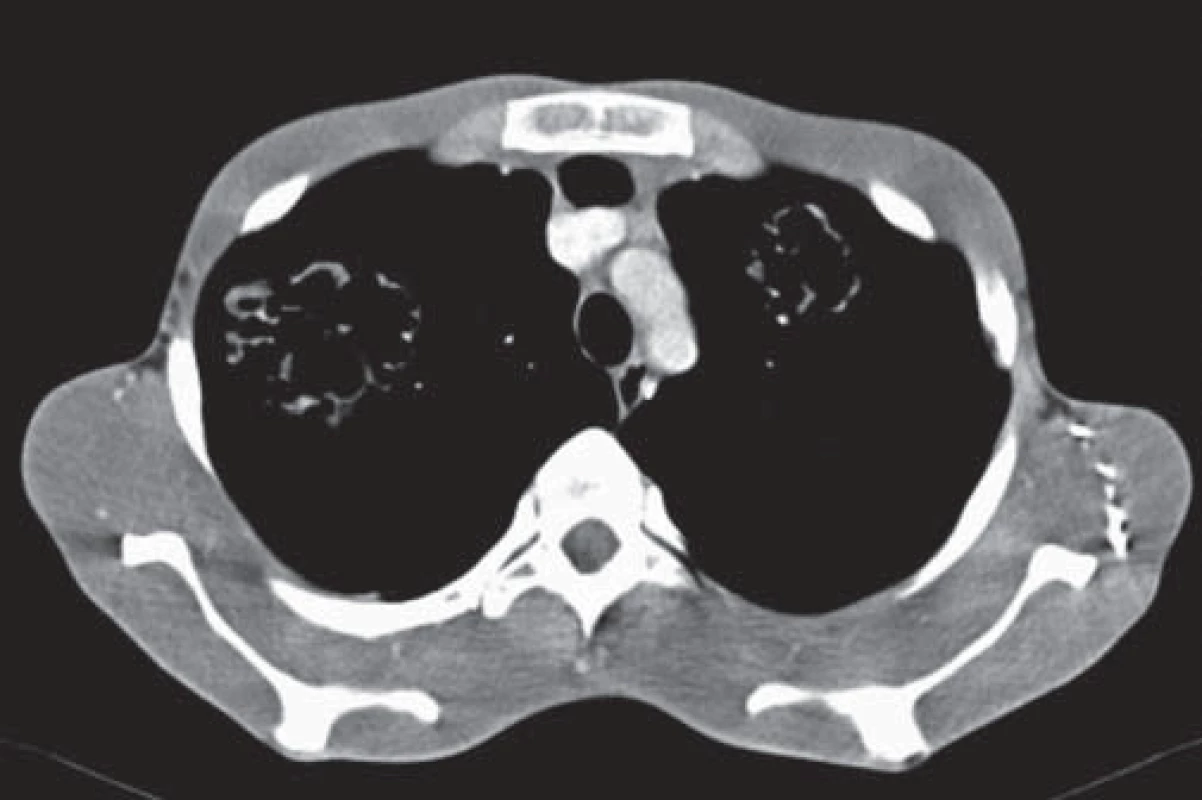
Od roku 2012 je v dispenzári Kliniky infektológie a cestovnej medicíny UN Martin 21-ročný pacient s potvrdenou AE pečene. Zdravotné problémy pacienta začali už v roku 2008. Trpel intermitentnými bolesťami brucha, nauzeou, vracaním a opakovanými infektami horných dýchacích ciest. Pri laboratórnych vyšetreniach bola zaznamenaná elevácia γ-glutamyltransferázy, neskôr aj alkalickej fosfatázy, anémia ľahkého stupňa a elevácia hladín IgG a IgE. Sonografické vyšetrenie ukázalo početné multicystické ložiská v pečeni. Pri ďalšom diferenciálnom diagnostickom procese nedošlo k uspokojivému stanoveniu diagnózy a pacient bol len v sledovaní svojím praktickým lekárom. V roku 2012 došlo k náhlemu zhoršeniu klinického stavu v zmysle narastania rezistencie v oblasti heparu s vyklenutím abdomenu a ascitom. Pacient bol akútne hospitalizovaný na chirurgickej klinike v spádovej nemocnici, kde doplnené CT vyšetrenie abdomenu vykazovalo objemnú hypodenznú expanziu v pečeňovom parenchýme. V spádovej nemocnici bola vykonaná revízia heparu s evakuáciou a sutúrou cystického ložiska s odobraním perioperačnej biopsie. V bioptickom materiáli boli zachytené súčasti parazita a prvýkrát od roku 2008 bolo vyslovené podozrenie na parazitárne postihnutie pečene. Pacient bol po prepustení odoslaný na Kliniku infektológie a cestovnej medicíny UN Martin, kde v spolupráci s Parazitologickým ústavom Slovenskej akadémie vied v Košiciach bola sérologicky dokázaná AE pečene spôsobená pásomnicou EM. Pacient bol zaradený do dispenzára našej kliniky s odporúčaním antiparazitárnej konzervatívnej liečby mebendazolom (MBZ). Od roku 2012 sa na pravidelné kontroly na našom ani na inom pracovisku nedostavoval. V priebehu roka 2013 – 2014 došlo k zhoršovaniu klinického stavu s nárastom expanzie parazitárneho ložiska v pečeni, zväčšovaniu brušnej dutiny a ascitu. Tlakom parazitárnej cysty došlo k útlaku hepatálneho tkaniva spolu s cievami a okolitými orgánmi (obr. 1). Pacient bol akútne hospitalizovaný na I. chirurgickej klinike UN Martin, kde podstúpil ľavostrannú hepatektómiu s radikálnym odstránením parazitárneho ložiska. Pri cielenom odoberaní anamnézy pacient udával už asi dva roky (od roku 2012) trvajúci intermitentný kašeľ, občasne s hemoptýzou, a sťaženie dýchania. Počas hospitalizácie bolo realizované CT vyšetrenie hrudníka s nálezom ložísk lamelárnej štruktúry bilaterálne v pľúcach (obr. 2). Stav bol zhodnotený ako sekundárna forma AE, diseminovaná z primárneho ložiska v pečeni. Konzultovaný hrudníkový chirurg pre riziko ďalšej diseminácie operáciu neindikoval a odporučil pokračovať v plne vyťaženej konzervatívnej liečbe. Pacient bol v celkovo zlepšenom zdravotnom stave po 20 dňoch hospitalizácie prepustený do ambulantnej starostlivosti s pokračovaním dispenzarizácie na Klinike infektológie a cestovnej medicíny UN Martin.
Diskusia
Koncom minulého storočia sa na území Slovenskej republiky diagnostikovali v detskej aj v dospelej populácii [8] len bežné, geopoliticky sa vyskytujúce parazity. V tomto období významne poklesol aj výskyt importovaných parazitóz, okrem malárie, ktorá sa ojedinele vyskytuje aj naďalej [9–11].
V roku 2000 bola na území Slovenska diagnostikovaná nová nozologická jednotka parazitárnej etiológie – AE. AE môžeme zaradiť medzi helmitozoonózu, tzn. parazitózu prenosnú zo zvieraťa (najčastejšie líška hrdzavá) na človeka, kde človek hrá úlohu medzihostiteľa. Všetky cicavce vrátane človeka, u ktorých dochádza k vývoji echinokokových metacestód, môžeme označiť za medzihostiteľov alebo intemediárnych hostiteľov. Ochorenie postihuje ľudí bez rozdielu pohlavia a veku (častejšie však vyššie vekové skupiny) a neliečené alebo nesprávne liečené usmrcuje do 10–15 rokov od stanovenia diagnózy [1 – 3,6]. Incidencia tohto ochorenia aj naďalej stúpa, pričom medikamentózna profylaxia zatiaľ neexistuje a ani jej nie je venovaná dostatočná vedecká pozornosť.
Diagnostika ochorenia je pomerne zdĺhava (nedostatočná informovanosť odbornej lekárskej verejnosti, nešpecifické nálezy na zobrazovacích vyšetreniach, neznalosť interpretácie sérologických vyšetrení často s falošne pozitívnymi alebo falošne negatívnymi výsledkami) a ekonomicky náročná. Diagnóza AE je považovaná za potvrdenú v prípade, že boli splnené minimálne dva z nasledujúcich štyroch kritérií (tab. 1). Sérologické vyšetrenia je vždy nevyhnutné interpretovať spolu so zobrazovacími vyšetreniami, dôkladnou epidemiologickou anamnézou (kontakt s líškami hrdzavými, časté požívanie lesných plodov, ktoré môžu byť kontaminované zvieracími fekáliami pri veľkej incidencii EM v populácii líšok v danej oblasti), a preto pri falošne negatívnych záchytoch v sérodiagnostike je stále nutné na parazitárnu etiológiu postihnutia pečene myslieť a smerovať pacienta na príslušné chirurgické pracovisko. Tam sa môže uskutočniť bioptizácia ložiska, event. priamo resekcia ložiska s následnou diagnostikou resekčného materiálu polymerázovou reťazovou reakciou (PCR).
![Diagnostické kritéria alveolárnej echinokokózy dle [12].
Tab. 1. Diagnostic criteria for alveolar echinococcosis according to [12].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f7a3a0321f7f607de1cdd9b11688a3a5.png)
U nášho pacienta bola diagnóza AE pečene stanovená až v roku 2012. Prvotne vyslovená diagnóza v roku 2008 bola multicystická lézia pečene benígneho charakteru (pri negativite onkomarkerov a rádiologickom závere, ktorý nesvedčil pre typické tumorózne postihnutie pečene, avšak bez akéhokoľvek bioptického dôkazu). Sérologická diagnostika ako neinvazívna vyšetrovacia metodika je preto vhodná nielen pri včasnej detekcii infekcie, ale aj pri dlhodobom sledovaní pacientov po chirurgickom zákroku a počas užívania chemoterapie. Pri tomto vyšetrení je využívaný ELISA (enzyme-linked immunosorbent assay) test spolu s komerčne dostupnými špecifickými EM antigénmi. V súčasnosti sa najviac využívajú a zároveň sú aj odporúčané druhovo-špecifické antigény Em2+ a Em18 získané z metacestód EM. Špecifické IgG4 protilátky sú vhodné indikátory pri monitoringu AE a korelujú s aktivitou ochorenia. Výška titrov protilátok poukazuje na antigénnu aktivitu parazitárnej stimulácie napr. po chirurgickom zákroku a chemoterapii. Naopak zníženie protilátkových titrov ukazuje na zníženie parazitárnej aktivity, teda na remisiu ochorenia alebo dokonca na odumretie parazita [6,13].
Terapiu AE môžeme rozdeliť na chirurgickú a konzervatívnu (najčastejšia je ich kombinácia). Chirurgické riešenie AE vyžaduje špecializovaný a dobre trénovaný chirurgický tým. Operácia bola dlho považovaná za prvú voľbu v liečbe všetkých prípadov AE spolu s cieľom potvrdenia klinickej diagnózy chirurgickou biopsiou. Chirurgický postup vedie k úplnému alebo parciálnemu odstráneniu parazitárnej lézie a k redukcii parazitárnej masy alebo ako paliatívny postup pri biliárnej alebo vaskulárnej obštrukcii.
Pri chirurgickom riešení AE boli vykonané všetky typy hepatektómií. Podobne ako pri nádoroch aj pri AE sa stretávame s asi 2cm ochranným lémom, kedy sa odporúča spolu s parazitárnou masou odstrániť aj okolité zdravé tkanivo. V niektorých závažných prípadoch a pri život ohrozujúcich komplikáciách je namieste transplantácia pečene. Na druhej strane je transplantácia pečene spojená s vysokým rizikom rekurencie, dokonca až progresie ochorenia v extrahepatálnych lokalizáciách pri umelo navodenej imunosupresii. Z tohto dôvodu nie je odporúčaná transplantácia pečene u pacientov so sekundárnou AE a metastázami v extrahepatálnej lokalizácií [14–16]. V konzervatívnej liečbe sa používajú antiparazitárne látky benzimidazolového typu – MBZ a albendazol (ABZ). Obidva prípravky boli vytvorené na liečbu nekomplikovaných intestinálnych infekcií helmitmi u ľudí a domestifikovaných zvierat. Medzi mnohými benzoimidazoly, ktoré boli testované proti larválnym metacestódam, iba MBZ ako prvý, a potom ABZ sú považované za dostatočne účinné v experimentálnych modeloch, tak aj relevantné v klinických situáciách. Na použitie proti larválnym metacestódam EM musia byť dávky MBZ a ABZ výrazne zvýšené, kedže sa jedná o tkanivovú parazitózu. Akceptovaná dĺžka liečby MBZ je dva roky po radikálnom chirurgickom zákroku alebo aj do konca života pri iných situáciách [2,14]. Odporúčané dávkovanie MBZ sa pohybuje v rozmedzí 40–50 mg/kg. Kedže sa však jedná o pomerne agresívnu látku pri spomenutom dávkovaní s množstvom nežiaducich účinkov, z nich najzávažnejšie sú pancytopénia a hepatotoxicita, u nášho pacienta sme zvolili redukovanú počiatočnú dávku v množstve 1 g/24 hod s pravidelným monitorovaním hepatálnych parametrov a krvného obrazu. Neskôr sme dávku postupne navýšili až na 40 mg/ kg. Pacient sa však na pravidelné kontroly nedostavoval a priznal, že nami odporúčanú antiparazitárnu liečbu neužíval. Po radikálnom chirurgickom zákroku v roku 2014 bol pacient opätovne nastavený na liečbu v odporúčanom dávkovaní, ktorú bude možné redukovať s odstupom času na základe zhodnotenia kontrolných sérologických a zobrazovacích vyšetrení. Medzi ďalšiu dôležitú otázku, ktorú je nutné zodpovedať, je, či parazitárna pečeňová lézia je vôbec viabilná, a teda môže svojim ďalším, aj keď pomalým rastom naďalej ohrozovať pacientov život, a či je vôbec možné u pacientov so závažnými formami AE liečbu niekedy počas života ukončiť. Ako sľubná metóda sa zatiaľ ukazuje pozitrónová emisná tomografia s využitím fluorodeoxyglukózy, ktorá umožňuje zhodnotiť glukózový metabolizmus v hepatálnej lézii, keďže glukóza je primárna energetická substancia pre endoparazitické helmity [13]. V súčasnosti sa uvažuje aj o ďalších alternatívnych liekoch zo skupiny imunomodulancií alebo interferónov. Práve pri experimentálnom podávaní IFN-α2a sa u laboratórnych zvierat, ktoré boli umelo nainfikované AE, zaznamenala výrazná redukcia parazitárnych lézií v pečeni. Tieto pozorovania zatiaľ neviedli ku klinickým skúškam [17].
Pľúcna lokalizácia AE je v našom súbore pacientov zatiaľ zriedkavá. Nadruhej strane je nevyhnutné myslieť na možnosť vzniku a existencie sekundárnej pľúcnej formy pri tejto závažnej parazitóze. Naši pacienti neboli indikovaní k operačnému riešeniu pľúcnych ložísk, a preto potrebné skúsenosti s chirurgickou intervenciou pľúcnej lokalizácie AE doteraz nemáme.
Záver
Prípady AE pečene boli formou kazuistík v strednej Európe publikované len ojedinele. Postupne ako sa počty chorých zvyšovali, stúpali aj skúsenosti autorov s touto parazitózou. Záverom autori odporúčajú a zdôrazňujú pri potvrdenej diagnóze AE pečene potrebu doplnenia zobrazovacích vyšetrení (RTG, CT, MR) so zameraním na pľúca a CNS, pre riziko diseminácie súčastí parazita z primárneho ložiska v pečeni do iných tkanív a orgánov so vznikom tzv. sekundárnej formy AE. Kontrolné zobrazovacie vyšetrenie pľúc a mozgu odporúčame doplniť taktiež pri invazívnej chirurgickej intervencii s odstupom jedneho mesiaca pre možnosť iatrogénnej diseminácie AE.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 18. 10. 2015
Přijato: 20. 11. 2015
MUDr. Robert Rosoľanka
Klinika infektológie a cestovnej medicíny
JLF UK a UN Martin
Kollárova 2
036 59 Martin
Slovenská republika
robert.rosolanka@centrum.sk
Sources
1. Vaništa J. Echinokokóza (hydatidóza) cystická. In: Beneš J et al (ed). Infekční lekárství. Praha: Galén 2009 : 359–360.
2. Eckhert J, Schantz PM, Gasser RB et al. Geographic distribution and prevalence. In: Eckert J (eds). WHO/OIE manual on echinococcosis in humans and animals: a public health problem of global concern. Paris: WHO 2001 : 100–142.
3. Antolová D, Miterpáková M, Škútová M et al. Echinococcus multilocularis na Slovensku – aktuálna situácia. Infovet 2015; 21(6): 245–249.
4. Eckhert J, Deplazes P. Biological, epidemiological, and clinical aspects of echinococcosis, a zoonosis of increasing concern. Clin Microbiol Rev 2004; 17(1): 107–135.
5. Antolová D, Meterpáková M, Radoňák J et al Alveolar echinococcosis in a highly endemic area of northern Slovakia between 2000 and 2013. Eurosurveillance 2014; 19(34): 20882.
6. Kinčeková J, Dubinský P, Dvorožňáková Eet al. Diagnostika a výskyt alveolárnej echinokózy na Slovensku. Ces Slov Gastroent Hepatol 2005; 59(1): 11–16.
7. Vaništa J. Klinický obraz a léčení alveokokózy. Epidemiol Mikrobiol Imunol 1997; 46(4): 166–167.
8. Szilágyiová M, Michal L, Škračiková J. Výskyt črevných parazitov u detí a dospelých osôb pred odchodom a po návrate zo zahraničia. Slovenský lekár 1992; 2(6–7): 16–20.
9. Šimeková K, Hudečková H. Malária importovaná do Slovenskej republiky zo stredoafrickej republiky. Interná Med 2006; 6(1): 25–27.
10. Šimeková K, Vestenická G, Hudečková H. Ďalší prípad tropickej malárie importovanej do SR. Interná Med 2008; 8(7–8): 417–418.
11. Svihrová V, Szilagyiová M, Krkoska Det al. Analysis of the direct and indirect costs of treatment of imported malaria in the Slovak Republic. Rev Soc Bras Med Trop 2009; 42(4): 377–380.
12. Kern P. Clinical features and treatment of alveolar echinococcosis. Curr Opin Infect Dis 2010, 23(5): 505–512. doi: 10.1097/QCO.0b013e32833d7516.
13. Kinčeková J, Hrčková G, Auer H et al. Clinical and serological study of human alveolar echinococcosis in Slovakia in relation to the outcome of chemotherapy. Helmithologia 2006; 43(4): 213–219. doi: 10.2478/s11687-006-0040-y.
14. Vuitton DA, Bresson-Hadni S. Alveolar echinococcosis: evaluation of therapeutic strategies. Expert Opinion on Orphan Drugs 2014; 2(1): 67–86.
15. Koch S, Bresson-Hadni S, Miguet JPet al. Experience of liver transplantation for incurable alveolar echinococcosis: a 45-case European collaborative report. Transplantation 2003; 75(6): 856–863.
16. Laca L, Olejnik J, Vician M et al. The effects of occlusive techniques on the short-term prognosis after liver resections. Hepatogastroenterology 2006; 53(70): 576–579.
17. Godot V, Harraga S, Podoprigora G et al. IFN alpha-2a protects mice against a helminth infection of the liver and modulates immune responses. Gastroenterology 2003; 124(5): 1441–1450.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2016 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Hepatologie
- Chronicky zvýšená aktivita pečeňových enzýmov
- Metody neinvazivního stanovení pokročilosti jaterní fibrózy
- Krvácení z varixů – pohled na terapii po Bavenu VI
- Infekcie pri cirhóze pečene – naše skúsenosti
- Makro-AST jako příčina izolované chronicky zvýšené aktivity AST – popis dvou případů
- Granulomatózní hepatitida jako vzácná terapeutická komplikace
- Závažné život ohrozujúce parazitárne ochorenie pečene komplikované disemináciou do pľúc
- Sartanová enteropatie – kazuistika a přehled literatury
- Úloha vápnika a vitamínu D při prevencii kolorektálneho karcinómu
- 11th Congress of ECCO, Amsterdam, The Netherlands
-
XX. hradecké gastroenterologické a hepatologické dny
a X. mezinárodní endoskopický workshop - Výběr z mezinárodních časopisů
- Eziclen® – spolehlivý prostředek k očištění střeva před koloskopickým vyšetřením
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Eziclen® – spolehlivý prostředek k očištění střeva před koloskopickým vyšetřením
- Chronicky zvýšená aktivita pečeňových enzýmov
- Metody neinvazivního stanovení pokročilosti jaterní fibrózy
- Makro-AST jako příčina izolované chronicky zvýšené aktivity AST – popis dvou případů
