Ložiskové zánětlivé procesy jater
Focal inflammatory liver lesions
Focal inflammatory liver lesions are a heterogeneous group of diseases that involve both infectious and non-infectious inflammatory processes. The most frequent type of infectious inflammatory hepatic lesions are abscesses of different origins (pyogenic, amoebic, fungal), followed by parasitic liver cysts and, rarely, by tuberculosis of the liver. Non-infectious inflammatory processes include sarcoidosis of the liver and hepatic inflammatory pseudotumors. This article reviews the etiopathogenesis, clinical manifestations, diagnosis, and therapy of particular focal hepatic inflammatory processes.
Conflict of Interest: The authors declare that the article/manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in the published article/manuscript.
Dedication: The article/manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Keywords:
echinococcosis – focal liver lesion – liver abscess – amoebic abscess
:
Frýba V.
; Ulrych J.
; Kristianová H.; Krška Z.
:
I. chirurgická klinika 1. LF UK a VFN v Praze
:
Gastroent Hepatol 2019; 73(6): 501-508
:
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amgh2019501
Ložiskové zánětlivé procesy jater jsou heterogenní skupinou onemocnění, zahrnující infekční ložiskové procesy, jako jsou abscesy jater nejrůznějšího původu (pyogenní, amébové, mykotické), parazitární jaterní cysty a vzácně se vyskytující tuberkulózu jater. Dále do této skupiny onemocnění patří i neinfekční zánětlivé procesy, jako je sarkoidóza jater a zánětlivý jaterní pseudotumor. Autoři prezentují souhrnné sdělení zabývající se touto problematikou a rozebírají etiopatogenezi, klinický obraz, diagnostiku a léčbu jednotlivých onemocnění.
Klíčová slova:
echinokokóza – ložisková léze jater – absces jater – amébový absces
Úvod
Ložiskové zánětlivé procesy jater jsou heterogenní skupinou onemocnění, zahrnující jak infekční (jaterní abscesy, parazitární cysty, tuberkulóza jater), tak neinfekční (sarkoidóza, zánětlivý pseudotumor) zánětlivé procesy (tab. 1). Nejčastěji se setkáme s jaterními abscesy, mezi kterými jednoznačně převažují abscesy pyogenní, tedy bakteriální, dále mohou být abscesy amébové a mykotické. Mezi pyogenními abscesy v současnosti převažují abscesy cholangiogenní. Amébovou etiologii abscesu je třeba zvažovat u osob s cestovatelskou anamnézou v tropických oblastech a negativní kultivací z abscesu. Mykotické (kandidové) abscesy jsou vzácné až raritní onemocnění postihující imunokompromitované pacienty. Specifickým typem jaterního abscesu je aktinomykóza jater, se kterou se lze vzácně setkat jako s komplikací u pacientů se zánětlivým břišním postižením a u žen s dlouhodobě zavedeným nitroděložním tělískem (IUD – intrauterine device). Parazitární (echinokokové) cysty jater jsou infekce postihující vzácně člověka jako náhodného mezihostitele, typický je dlouhý asymptomatický průběh, v etiologii ložiskových procesů je třeba parazitární cystu zvažovat, protože neléčená má fatální průběh. Mezi granulomatózní zánětlivé procesy v játrech patří tuberkulóza a sarkoidóza. Tuberkulóza je i v našich podmínkách aktuální vzhledem k migraci obyvatel z endemických oblastí a vzrůstající rezistenci antituberkulotik. Zánětlivý pseudotumor je vzácná léze jater nejasného původu s typickou morfologií tvořenou vřetenovitými myofibroblasty se zánětlivou infiltrací. Ve většině případů má benigní povahu.
Tab. 1. Classification of focal inflammatory liver lesions.
Abscesy
Jaterní absces je možno definovat jako ohraničené zánětlivé ložisko v játrech, často vyplněné hnisem. Je běžným typem viscerálního abscesu, etiologická agens mohou být bakterie, houby nebo améby. V rozvinutých zemích tvoří asi 75–85 % jaterních abscesů abscesy pyogenní, tedy bakteriální. Pyogenní absces je definován přítomností pyogenní membrány. Jedná se o potenciálně život ohrožující onemocnění, ačkoli mortalita pyogenních abscesů v poslední dekádě klesla z původních 11–31 % na 2–12 % [1,2]. Odhadovaná roční incidence pyogenních jaterních abscesů je podle populačních studií 2,3–17,6/100 tisíc obyvatel [3], vyšší věk a mužské pohlaví patří mezi významné rizikové faktory. Podle Kanadské populační studie byly další rizikové faktory transplantace jater, diabetes, abúzus alkoholu a malignita v anamnéze [4].
Z hlediska etiologie můžeme pyogenní jaterní abscesy rozdělit do 6 skupin: cholangiogenní, portální, arteriální, potraumatické, pooperační a kryptogenní [1]. K biliárním příčinám patří benigní i maligní obstrukce žlučových cest s následnou ascendentní cholangoitidou, instrumentální endoskopické či perkutánní výkony na žlučových cestách, dále mohou jaterní abscesy vznikat i přímým přestupem zánětu u těžké cholecystitidy. Portální abscesy jsou v současnosti zastoupeny méně, vyvolávající příčinou je pokročilá nitrobřišní infekce jako akutní apendicitida nebo divertikulitida. Mezi nejčastější příčiny hematogenních arteriálních abscesů patří bakteriální endokarditida a angiografické instrumentace, dále i intravenózní aplikace nejrůznějších farmak. Potraumatické abscesy vznikají infekcí hematomu nebo bilomu vzniklého následkem tupého nebo penetrujícího poranění jater. Abscesy po jaterních resekcích a ablacích jaterních tumorů byly tradičně řazeny do předchozí skupiny, jedná se ale o nozokomiální nákazy a vzhledem k častějšímu výskytu multirezistentních kmenů je třeba je považovat za samostatnou skupinu. Poměrně velká část abscesů (18–66 %) je kryptogenní [5], tedy dostupnými diagnostickými prostředky nebylo možno příčinu zjistit.
Mezi nejčastější příznaky onemocnění patří horečka a třesavka, bolesti v pravém horním kvadrantu břicha, nauzea, vyčerpanost. Poměrně často je pacient vyšetřován pro horečku nejasného origa. Laboratorně dominuje hypalbuminemie, elevace jaterních enzymů a leukocytóza. Dále je typická elevace C-reaktivního proteinu (CRP) a prokalcitoninu. Ze zobrazovacích metod se může uplatnit rentgen srdce a plic, který někdy ukáže elevaci bránice, infiltraci dolních laloků plic a fluidotorax, prostý snímek nemá velký diagnostický význam, někdy může ukázat hydroaerický útvar nebo plyn v portě, dominující vyšetření jsou ultrasonografie (USG) a CT břicha [6]. Spíše výjimečně se v diagnosticky obtížných případech uplatní pozitronová emisní tomografie (PET) CT, magnetická rezonance (MR) jater, event. magnetická rezonanční cholangiopankreatografie (MRCP).
Mikrobiální agens jaterních abscesů se liší podle jejich etiologie i geograficky. Jako etiologické agens do poloviny 80. let 20. století dominovala Escherichia coli (EC), často jako součást polymikrobiálních nálezů, v posledních 3 dekádách se stále více uplatňuje Klebsiella pneumoniae (KP), tento trend platí zejména pro asijské země a data z Tchaj-wanu a Koreji naznačují, že by se mohlo jednat o endemické onemocnění způsobené invazivním kmenem KP s kapsulárním K1 podtypem [7]. I v dalších zemích jako USA, Velká Británie, Španělsko či Austrálie je pozorována vzrůstající incidence pyogenních abscesů způsobených KP [8]. Klinické symptomy se u obou typů prakticky neliší, ale etiologicky bývající abscesy u KP často kryptogenní, zatímco u EC jsou většinou podmíněny biliárním onemocněním, nitrobřišní infekcí či malignitou. Na rozdíl od ostatních abscesů dochází u KP nezřídka k hematogenní diseminaci infekce [9]. V západních sestavách dominuje EC následovaná KP, Enterococcus spp. a Streptococcus spp. Podle rozsáhlé metaanalýzy čínských autorů se etiologicky uplatňují nejčastěji gramnegativní bakterie Klebsiella spp. (54 %), Escherichia spp. (29 %), Enterobacter spp. (9 %), Proteus spp. (6 %) a Pseudomonas spp. (5 %). Z grampozitivních mikrobů Staphylococcus spp. (13 %), Streptococcus spp. (8 %) a Enterococcus spp. (7 %) [10]. I přes pokrok v mikrobiologické technice se u části jaterních abscesů nedaří izolovat původce. Podle studie Chemalyho et al byla senzitivita kultivace grampozitivních koků z abscesu 90 %, gramnegativních tyček 60 %, ale senzitivita G+ koků a G– tyček v hemokultuře pouze 30, resp. 39 %. [11]. Podle další recentní studie není rozdíl v prognóze vč. mortality, rekurence a počtu metastatických ložisek pacientů s jaterními abscesy a vykultivovaným původcem a abscesy bez průkazu původce, ve druhé skupině byla pouze delší hospitalizace [3]. Prognóza pacientů s jaterními abscesy, jejichž původcem je EC a KP, se neliší [11,12].
Principem léčby jaterních abscesů je drenáž a systémová antimikrobiální léčba. Preferovanou a optimální metodou drenáže jaterních abscesů je CT, event. USG navigovaná perkutánní drenáž ložiska. Perkutánní drenáž slouží k evakuaci hnisu a dále může být využita i k proplachům abscesového ložiska antiseptiky. V případě cholangiogenních jaterních abscesů má nezastupitelnou úlohu v léčbě endoskopická retrográdní cholangiopankreatografie (ERCP). Endoskopické techniky snižují tlakový gradient mezi žlučovodem a duodenem, který je normálně zajištěn Oddiho svěračem. Díky tomu dochází k dekompresi žlučovodu a snadnějšímu zhojení abscesu. Vnitřní drenáž se uplatňuje u benigních i maligních stenóz hepatocholedochu, dále v případě litiázy žlučových cest (spolu s extrakcí konkrementů). Druhou, i když vzácnou situací, kdy v léčbě jaterních abscesů hraje ERCP klíčovou roli, je přítomnost žlučové příměsi v drénu po zavedení perkutánní drenáže. Po zavedení vnitřního stentu, event. nazobiliární drenáže, dochází poměrně rychle k uzávěru píštěle mezi abscesovou dutinou a intrahepatálním žlučovodem [13]. Systémová antimikrobiální léčba je zaměřena na G– tyčky, G+ koky a anaeroby. Empiricky jsou většinou doporučovány cefalosporiny třetí generace v kombinaci s metronidazolem nebo β-laktamy s inhibitory β-laktamázy, podle výsledků kultivace a citlivosti je pak léčba změněna na cílenou. Výhoda cefalosporinů jako léku první volby v léčbě jaterních abscesů je však sporná, nemají lepší průnik do jaterní tkáně než širokospektré peniciliny, navíc jsou vysokými induktory širokospektré β-laktamázy (ESBL – extended spectrum β-lactamase) pozitivity, proto někteří autoři preferují právě širokospektré peniciliny s inhibitory β-laktamázy (piperacilin/tazobaktam) nebo tigecyklin [14]. Pouze malé abscesy je možno řešit samotnou antibiotickou terapií bez perkutánní drenáže. Ačkoli perkutánní miniinvazivní drenáž nahradila otevřenou chirurgickou drenáž pyogenních abscesů, otevřená drenáž má stále v několika indikacích nezastupitelné místo. Jednak v případě, že hustý hnis a tkáňový detritus není možno aspirovat, dále u pacientů, kde není možno perkutánní drenáž provést (vícečetné abscesy, multilokulární absces, absces v levém laloku jater), třetí skupinou indikací k otevřené drenáži jsou komplikace abscesu, jako je trvající septický stav i přes perkutánní drenáž a antibiotickou terapii, perforace abscesu a pacient vyžadující chirurgickou revizi žlučových cest nebo cholecystektomii [15]. Procento chirurgických revizí pro pyogenní jaterní abscesy v různých sestavách výrazně kolísá (7–58 %). Ve výjimečných případech může být indikována jaterní resekce k odstranění abscesového ložiska [16]. Tato situace může nastat zejména v případě suspekce na nekrotický abscedovaný tumor nebo rozsáhlý absces, který destruuje velkou část jaterního parenchymu.
Specifické typy jaterních abscesů
Mykotické abscesy
Kandidový jaterní absces je vzácné onemocnění, většina dokumentovaných případů byli nemocní s hematologickou malignitou v období prolongované neutropenie [17]. U těchto pacientů se většinou jedná o manifestaci systémové kandidiózy a mortalita je vysoká. Kandidový absces může být rovněž způsoben fungemií z portální žíly či ascendentní infekcí biliárního stromu při biliárních onemocněních, u takových pacientů nebývá systémová kandidemie [18]. Nejčastější původce je Candida albicans, u 50 % pacientů je ale negativní hemokultura. Morfologicky se kandidové jaterní postižení nejčastěji projevuje jako granulomy nebo mikroabscesy. Rizikovými faktory jsou malignity, zejména hematologické, transplantovaní pacienti, diabetici, dlouhodobá antibiotická léčba. Diagnóza mykotického jaterního abscesu by měla být zvažována u všech imunokompromitovaných pacientů s nejasnými febriliemi a/nebo s elevací alkalické fosfatázy (ALP) a bilirubinu [19]. Léčba spočívá v dlouhodobé cílené léčbě antimykotiky (flukonazol, amfotericin B). Pokud je jaterní absces doprovázen biliárním onemocněním jako kandidová cholecystidida nebo stenóza žlučovodu, je nezbytná sanace zdroje – endoskopická drenáž žlučovodu, cholecystektomie nebo cholecystostomie.
Amébové abscesy
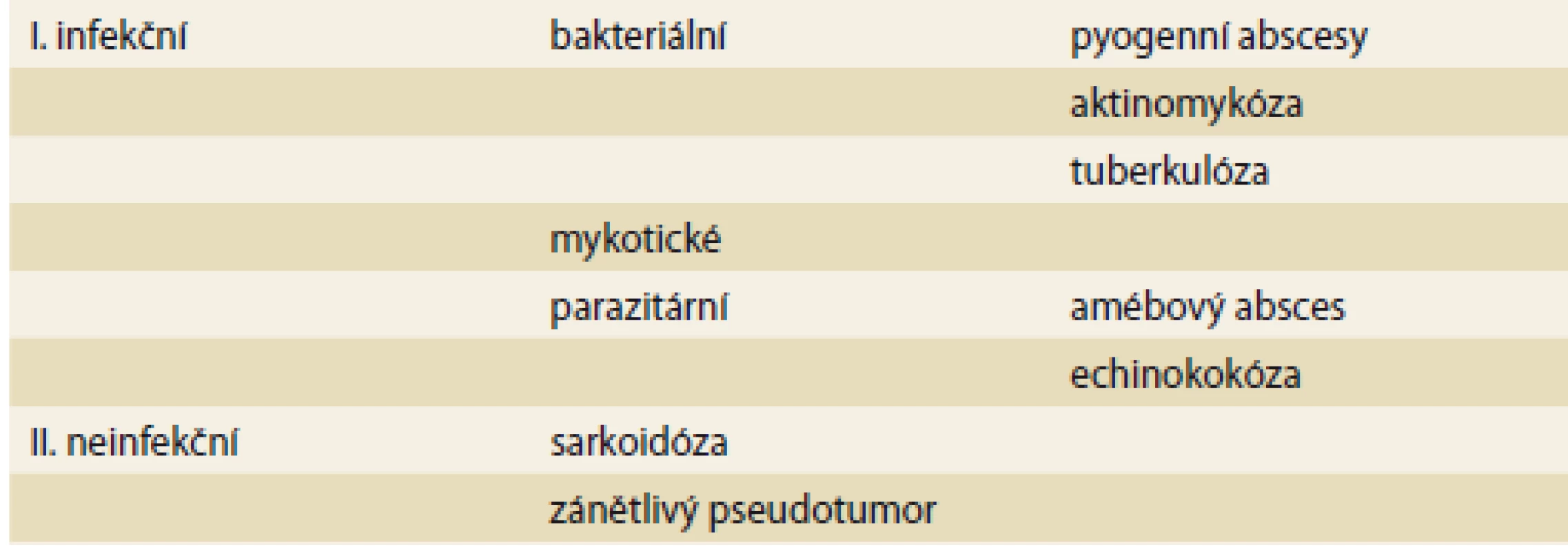
Amébový jaterní absces je nejběžnější extraintestinální manifestací parazitárního protozoálního onemocnění, jehož původcem je Entamoeba histolytica – tento prvok je kosmopolitní, vyskytuje se ale zejména v tropických oblastech, v mírném pásu se téměř vždy jedná o importované nákazy [20]. Přenáší se alimentárně fekálně kontaminovanou vodou a potravinami. Po požití putují amébové cysty zažívacím traktem, v tenkém střevě jsou uvolněny trofozoity, které se poté cestou portální žíly dostanou do jater, kde se vyvine absces. Ostatní orgány (plíce, mozek, slezina, kůže, pohlavní orgány) jsou postiženy vzácně. Amébové abscesy tvoří v rozvinutých zemích až 10 % jaterních abscesů a celosvětově je amébový jaterní absces vůbec nejčastější [21]. Pacienti mohou mít horečku a bolesti v pravém horním kvadrantu břicha, příznaky amébové kolitidy, zvláště průjem, nejsou ale vyjádřeny až v 90 % případů [20]. Na amébovou etiologii abscesu je třeba myslet v případě negativní kultivace z abscesu. V diagnostice mohou být využity i monoklonální protilátky proti proteinovému antigenu v krvi nebo stolici. Protilátky jsou přítomny asi u 80 % pacientů v akutní fázi, po týdnu v 90 % případů a přetrvávají asi u 10 % pacientů. Po 7 dnech trvání infekce negativní sérologické testy svědčí proti diagnóze invazivní amebiázy. Amébové abscesy se nejčastěji vyskytují v zadních segmentech pravého laloku jater a měří většinou mezi 4 a 10 cm. Typicky bývají solitární, oválné nebo okrouhlé, uložené subkapsulárně. Až v 25 % případů ale mohou být vícečetné a výjimečně iminovat solidní masu [6]. Léčba je založena na nitroimidazolových preparátech (metronidazol). Po antimikrobiální terapii je doporučováno podání orálního endoluminálně působícího léku, např. diloxanid nebo paromomycin, který eradikuje zbylé odolné cysty z lumen střeva. Perkutánní drenáž je doporučována, pokud přetrvává diagnostická nejistota – nedošlo k ústupu příznaků po 48–72 hod po podání antimikrobiální terapie, u velkých abscesů, abscesů levého laloku poblíž perikardu, v těhotenství (obr. 1). Obsah abscesu mívá načervenalou barvu charakteru ančovičkové pasty. Chirurgická léčba je rezervována pro závažné komplikace.
Fig. 1. CT scan – amoebic liver abscess successfully treated with percutaneous drainage and systemic antimicrobial therapy
Jaterní aktinomykóza
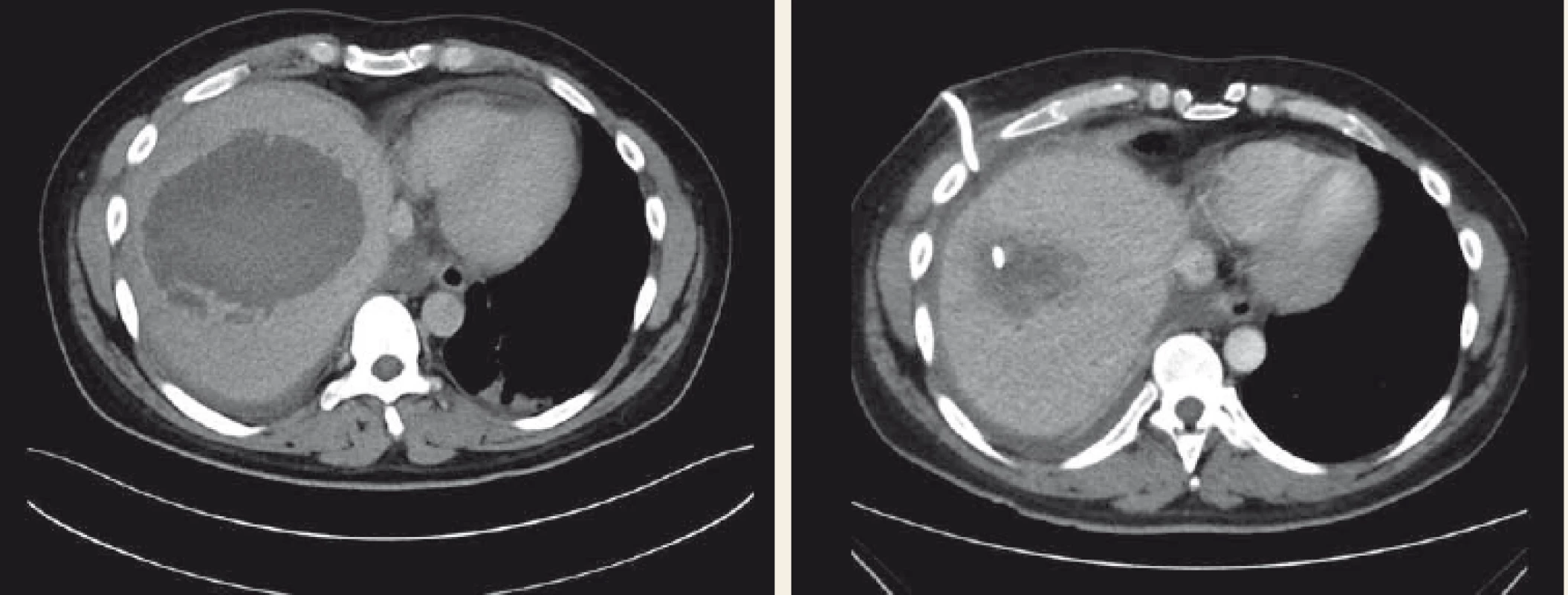
Aktinomykóza je v rozvinutých zemích relativně vzácné onemocnění, vyšší výskyt je pozorován v jihovýchodní Asii. Onemocnění je způsobeno G+ anaerobní tyčkou, která je běžně součástí flóry dutiny ústní, zažívacího traktu a ženského pohlavního traktu. Jedná se o oportunního patogena, nejčastější je Actinomyces israelii. Při poruše slizniční nebo kožní bariéry dojde ke vzplanutí onemocnění. Formy onemocnění jsou cervikofaciální (50–65 %), abdominální (10–20 %), torakální a kožní. U břišní formy je nejčastěji postižen apendix a ileocekální oblast. Častěji jsou postiženi muži, přítomnost IUD je rizikový faktor u žen [22]. U 15 % břišních forem je přítomno jaterní postižení, játra jsou postižena u 5 % všech aktinomykóz [23]. K šíření infekce do jater dochází přímo nebo hematogenně cestou vena portae. Pokud není zdroj infekce nalezen, pak se onemocnění nazývá primární (izolovaná) aktinomykóza jater [23]. Diagnostika je velmi obtížná vzhledem k nespecifickým příznakům a obtížnému průkazu agens, jen v 10 % případů se zdaří předoperačně. Klinický obraz často připomíná malignitu [24], zánětlivé onemocnění břicha nebo náhlou příhodu břišní. U jaterní aktinomykózy se typicky jedná o subakutní či chronické postižení, mezi nejčastější příznaky patří horečka, úbytek na váze, anemizace, leukocytóza. Na CT vyšetření se nejčastěji aktinomykóza jater projeví jako solitární hypodenzní ložisko, pravý lalok je postižen 4× častěji než levý. V diagnostice většinou nestačí laboratorní nález a zobrazovací metody, CT nález často iminuje maligní tumor či jaterní absces. Diagnóza je většinou stanovena na základě perkutánní biopsie či drenáže, event. histologickém vyšetření vzorku po resekci. Základem léčby je dlouhodobá antibiotická terapie (3–12 měsíců), lékem první volby je penicilin, dále je možno použít aminopeniciliny, klindamicin a doxycyklin [25] (obr. 2).
Fig. 2. CT scan – hepatic actinomycosis completely cured with 6 months’ clindamycin therapy
Parazitární cysty jater
Echinokokóza (hydatidóza) je zoonóza způsobená larválním stadiem tasemnic z rodu Echinococcus. Jsou známy čtyři druhy echinokoka, které jsou původci jaterních onemocnění u člověka. Zdaleka nejčastější jsou Echinococcus granulosus (EG) způsobující cystickou formu a Echinococcus multilocularis (EM), který je původcem alveolární echinokokózy [26]. Infekce EG se vyskytuje celosvětově zejména v pasteveckých oblastech, naproti tomu EM je vázán na severní polokouli. Dospělá tasemnice žije ve střevech psa a dalších masožravců, vajíčka tasemnice se pak stolicí dostávají do prostředí. Lidé a býložravci jsou náhodní mezihostitelé po požití těchto vajíček. Ve střevě dochází k uvolnění larev (metacestodi), které penetrují sliznici, dostávají se do portálního řečiště a do jater, kde buď hynou, nebo se opouzdří a rostou, nebo projdou a usídlí se v jiných orgánech. Pro všechny formy onemocnění je typický velmi pomalý růst larev. Tento pomalý růst je příčinou dlouhé inkubační doby a zpočátku asymptomatického průběhu [26,27].
Cystická echinokokóza
Za tvorbu hydatidních cyst v játrech (cca 60–70 %) a v plicích (20–30 %) je zodpovědný EG, ostatní orgány jsou postiženy vzácně. Hydatidní cysty jsou sférické, tekutinou vyplněné útvary, skládají se z vnitřní buněčné (germinální) vrstvy a vnější acelulární vrstvy. Parazitární cysty se zvětšují a tvoří granulomatózní hostitelskou reakci v okolí tak, že se kolem vytvoří fibrózní vrstva (pericysta). Při intraabdominální lokalizaci se s postupným narůstáním velikosti cysty začínají objevovat nespecifické obtíže jako nevolnost, ztráta chuti k jídlu, hubnutí, pocity tlaku v břiše, bolesti, později ikterus. Diagnóza je stanovena na základě klinických symptomů, zobrazovacích metod a sérologie. Laboratorně je jako u ostatních parazitárních onemocněních typická eozinofilie. Léčba při postižení jater závisí na uložení, velikosti a počtu cyst. Možnosti jsou chirurgická léčba, perkutánní drenáž a instilace skolocidního roztoku. Pro chirurgickou léčbu je důležité, zda cysta dosahuje povrchu jater nebo je uložena intraparenchymatózně. Doporučovaným výkonem u povrchově uložených cyst je prostá cystektomie. U velkých cyst je někdy možné provést resekci jater. V zemích s častým výskytem onemocnění jsou také používány laparoskopické přístupy – cystotomie a parciální cystotomie s drenáží [28]. Dalším možným postupem je perkutánní punkční léčba pod kontrolou USG nebo CT s evakuací obsahu a instilací skolocidního roztoku. Tento přístup je ale zatížen vyšším rizikem toxoalergické nebo až těžké smrtící anafylaktické reakce způsobené vylitím roztoku do peritoneální dutiny.
Alveolární echinokokóza
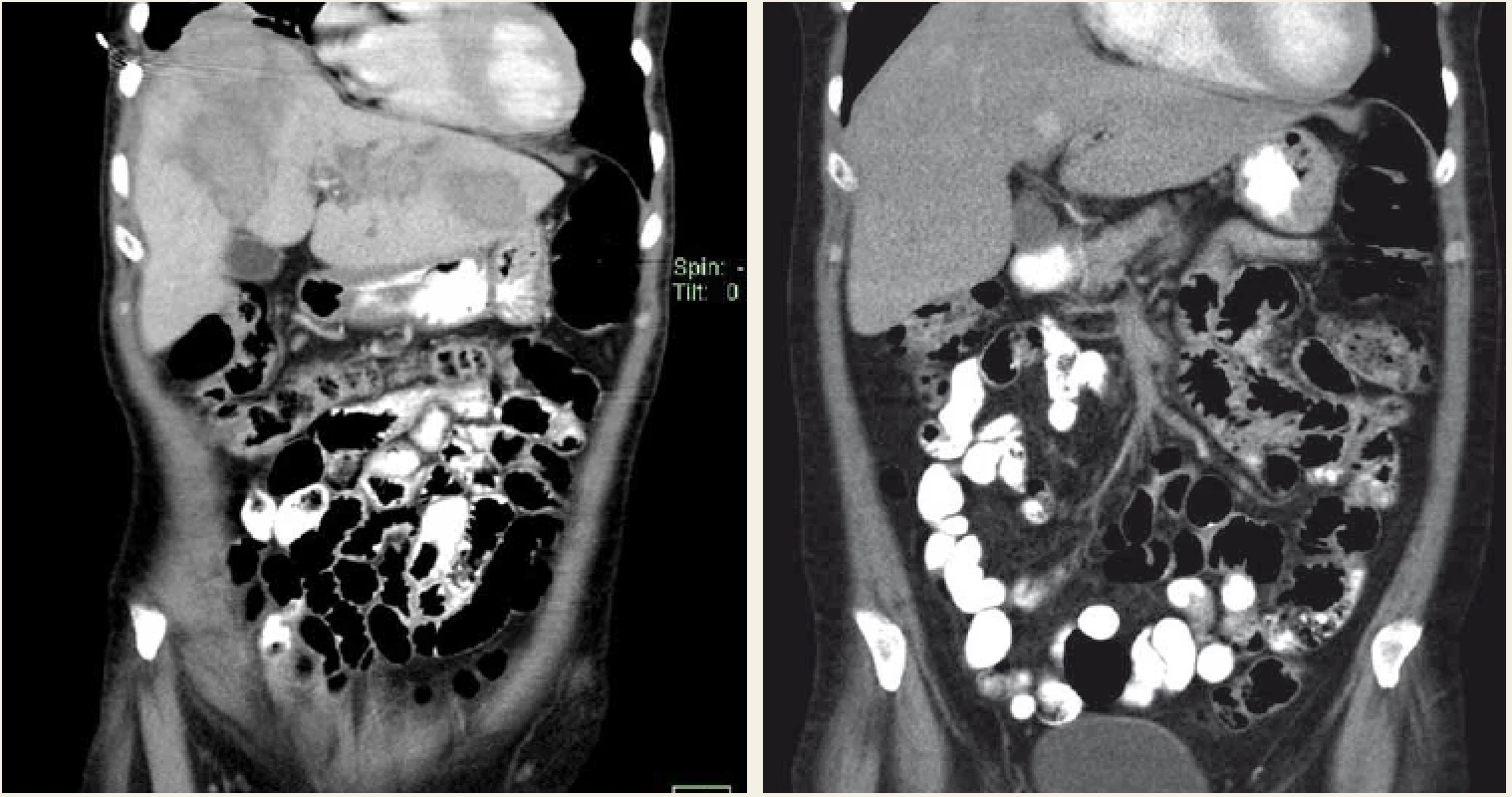
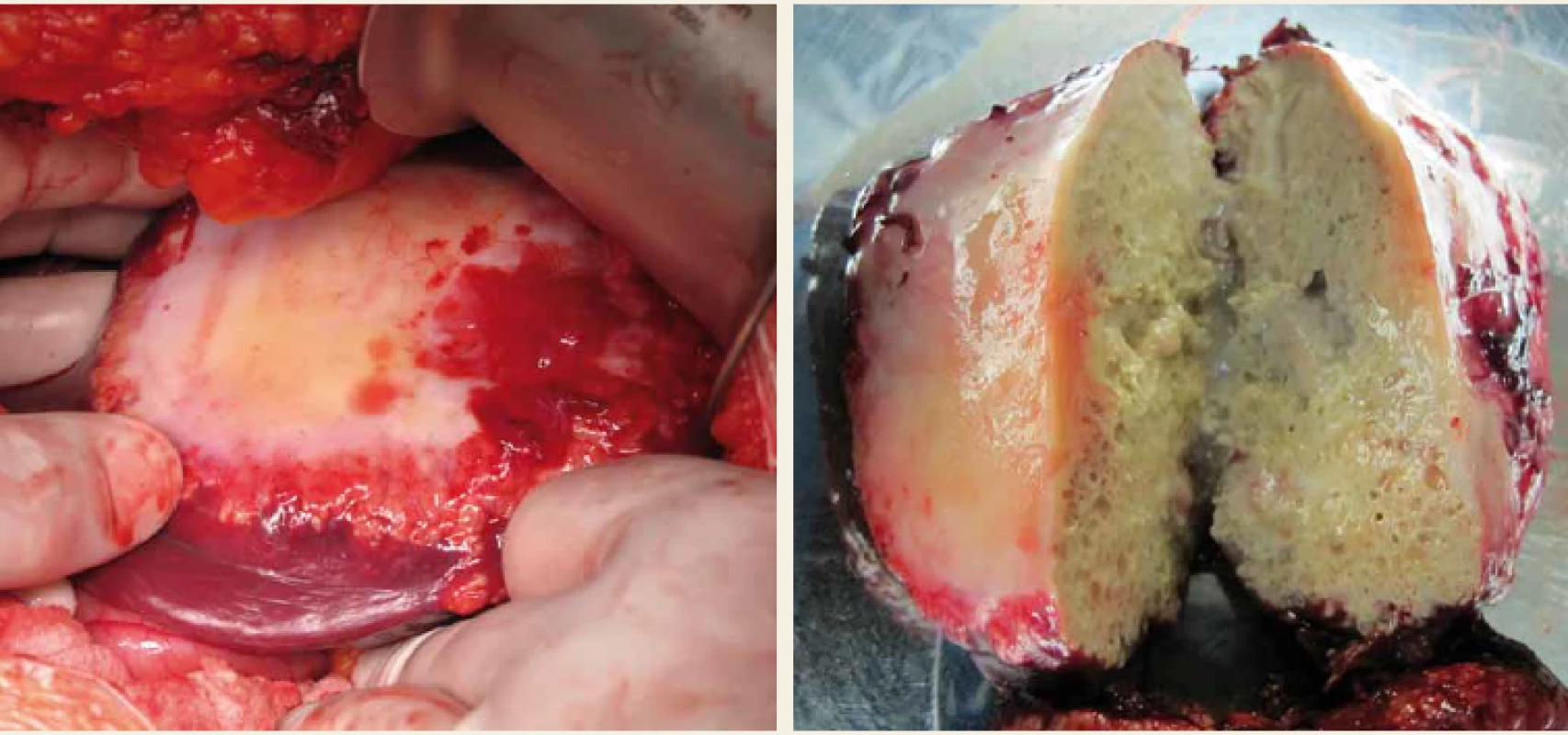
Alveolární echinokokóza (AE) postihuje v 99 % případů játra. Parazit netvoří solitární cystu, ale díky exogennímu pučení difuzně prorůstá do okolní tkáně. Svým chováním imituje nádorové bujení, krevním či lymfatickým řečištěm je schopen metastazovat do vzdálených orgánů. V chronické fázi infekce jsou postiženy jak přilehlé, tak vzdálené orgány. Neléčená echinokokóza končí smrtelně [27]. Klinicky jsou nejčastějším projevem bolesti v nadbřišku, dyspepsie, hepatosplenomegalie, někdy i hmatná rezistence v břiše, asi v 1/3 případů ikterus. Diagnóza AE se opírá o anamnézu, klinické údaje, výsledky laboratorních vyšetření, zobrazovací metody a sérologii. Zobrazovacími metodami se prokáží ložiska s nepravidelnými okraji, v jejichž středu lze zaznamenat nekrotický proces a kalcifikace. Histologie prokáže ostrůvky parazitů obklopené laminární membránou. Podezření na AE vyslovíme na základě výsledků zobrazovacích metod (USG, CT, MR, PET CT) či sérologických vyšetření (Elisa, Westernblot). Konečná diagnóza je stanovena na základě pozitivních výsledků z obou typů vyšetření nebo pozitivního výsledku získaného jednou z uvedených metod a současně potvrzené histopatologicky či molekulárně biologicky (polymerázová řetězová reakce (PCR – polymerase chain reaction)). V našich podmínkách se jedná o vzácné onemocnění, v posledních letech je diagnostikováno průměrně 2–7 pacientů/rok [28]. Vzhledem k tomu, že není k dispozici parazitocidní, ale pouze parazitostatická farmakoterapie (albendazol), charakter těchto ložisek předurčuje, že stejně jako u maligních nádorů je jedinou kurativní léčbou radikální chirurgické odstranění ložisek. Cílem chirurgické terapie je vždy kompletní odstranění neporušeného parazitárního útvaru s bezpečným lemem 2 cm zdravého jaterního parenchymu [27,29]. Kurativní operační řešení je indikováno tehdy, pokud je možná úplná resekce všech jaterních ložisek s bezpečným lemem a v případě, že nejsou přítomna neresekovatelná ložiska v jiných orgánech či extrahepatálních tkáních (obr. 3). Je možná i paliativní chirurgická léčba, jejímž cílem je potvrzení diagnózy, drenáž nekrotické dutiny, která je často přítomna v centru ložiska a zvyšuje možnost bakteriální superinfekce, redukci parazitní hmoty a snížení rizika biliární nebo cévní obstrukce. Paliativní resekce bývá také doporučena ke zvýšení efektu medikamentózní antiparazitární terapie. Terapie albendazolem je obvykle zahájena po diagnóze alveolární echinokokózy. Doporučená délka léčby po radikální resekci ložisek je 2 roky [30]. Jinak neřešitelné život ohrožující komplikace, jako je těžká jaterní insuficience, end stage liver disease, chronická cholestáza, sekundární biliární cirhóza a portální hypertenze s krvácením do gastrointestinálního traktu, jsou indikací k transplantaci jater.
Fig. 3. Parasitic cyst of the left liver lobe; intraoperative finding and resected cyst
Jaterní tuberkulóza
Tuberkulóza je i v rozvinutých zemích stále aktuální problém kvůli imigraci obyvatel z endemických oblastí, vyšší prevalenci imunosuprimovaných a multirezistenci Mycobacterium tuberculosis vůči antituberkulotikům. Břišní tuberkulóza je vzácnou formou mezi různými extrapulmonálními manifestacemi, tuberkulóza jater pak raritní manifestací extrapulmonální tuberkulózy [31]. Většinou je asociována s infekčními fokusy v dutině břišní nebo plicích, do jater se šíří hematogenně cestou arteria hepatica nebo vena portae nebo lymfogenně. Tuberkulóza jater běžně postihuje parenchym jater, někdy i biliární strom. Jaterní tuberkulóza se manifestuje třemi způsoby:
- Miliární hematogenní diseminace z plic cestou hepatické arterie je považována za nejčastější typ.
- Tuberkulóza biliárního stromu, která může mít různé příznaky, nejběžnější je triáda horečka, ikterus, kalcifikace v játrech. Ikterus je kvůli intra-nebo extrahepatálním strikturám, lymfadenopatii a hepatikolitiáze.
- Nodulární jaterní tuberkulóza (jaterní tuberkulom) je nejvzácnější a prakticky všechny publikované případy jsou ve formě jednotlivých kazuistik [32,33].
Klinická manifestace je nespecifická, nejběžnější symptomy jsou bolest v pravém horním břišním kvadrantu, horečka, anorexie a úbytek na váze. Hepatomegalie s izolovanou elevací ALP je popisována asi ve 2/3 případů, častá je i elevace transamináz, anémie a zvýšená sedimentace. Zobrazovací metody hrají stěžejní roli v diagnostice i následném managementu jaterního postižení. Základní vyšetření je USG, zásadní je CT, jaterní tuberkulom je většinou dobře ohraničená léze s periferním enhancementem. U mikronodulárních lézí diferenciální diagnostika zahrnuje metastázy, lymfom, leukemii, sarkoidózu a fungální infekce, u makronodulární formy onemocnění imituje pyogenní absces, metastázu nebo primární jaterní tumor. Diagnóza je většinou stanovena na základě biopsie jaterní, kde jsou nalezeny granulomy s typickými kaseózními nekrózami spolu se známým tuberkulózním postižením plic nebo jiného orgánu. Přínosná může být PCR k přímému průkazu mykobakterií. Jaterní tuberkulóza je léčena jako jiné extrapulmonální formy, dlouhodobá (6–9 měsíců) léčba standardními antituberkulotiky je základním kamenem léčby. Kumulativní mortalita jaterní tuberkulózy je 15–42 % [33].
Sarkoidóza jater
Sarkoidóza je systémové granulomatózní zánětlivé onemocnění neznámé etiologie. Může postihovat jakýkoli orgán, nejčastěji jsou postiženy plíce, lymfatický systém a játra. Játra jsou postižena u 6–11,5 % pacientů, vzácně bez přítomného plicního postižení [34]. Jaterní postižení je nejčastěji klinicky němé, v 5–30 % případů se projevuje bolestmi břicha, ikterem, nauzeou, zvracením a hepatosplenomegalií, v závažných případech se projevuje cholestázou, cirhózou jater, portální hypertenzí až jaterním selháním [35]. U pacientů se symptomatickou sarkoidózou jater je doporučována jaterní biopsie, cílem je vyloučení granulomatózních procesů jiného origa, jako je fungální infekce, tuberkulóza, lymfomy, primární biliární cholangoitida a polékové reakce. Základem léčby je dlouhodobá kortikoterapie. Kennedy udává kompletní odpověď na léčbu u třetiny pacientů, parciální odpověď ve třetině případů, třetina nereagovala na léčbu [36]. Ve výjimečných případech těžkého postižení je možná transplantace jater, je však riziko rekurence nemoci ve štěpu.
Zánětlivý pseudotumor jater (zánětlivý myofibroblastický tumor, pseudosarkomatoidní fibroblastický tumor)
Zánětlivý myofibroblastický tumor jater je vzácná jaterní léze nejasné etiologie i chování. Jako možné etiopatogenetické faktory jsou udávány infekce, cévní onemocnění, pyleflebitida po apendicitidě, Epstein-Barrové virus a autoimunitní onemocnění. Poprvé byl popsán v roce 1953 Packem a Bakerem [37]. V posledních letech se ukazuje, že se jedná o heterogenní onemocnění s podobnou histologickou strukturou tvořenou fibrózní tkání a vřetenovitými myofibroblasty se zánětlivou infiltrací. Chromozomální translokace vedoucí k aktivaci ALK (anaplastic lymphoma kinase) tyrozinové kinázy může být detekována u cca 50 % myofibroblastických tumorů, zvláště u mladých pacientů. Biologické chování je většinou benigní, ve vzácných případech jsou popisovány lokální rekurence [38], zcela výjimečně vzdálené metastazování a sarkomatoidní transformace, což naznačuje jistý maligní potenciál těchto tumorů, na druhou stranu je vzácně možná i spontánní regrese [39]. Nejčastěji se vyskytuje u dětí a adolescentů, vzácně se ale může vyskytnout i v seniu [40]. Může se vyskytnout téměř ve všech orgánech a tkáních, nejčastěji v plicích a orbitě. Klinická manifestace u jaterních pseudotumorů je různorodá, často je přítomna horečka, bolesti břicha, úbytek na váze, v některých případech jsou tumory asymptomatické. Laboratorní testy jsou normální či nespecifické s leukocytózou, anémií a elevací CRP. Radiologická diagnostika je rovněž obtížná, protože nejsou žádné specifické rysy zánětlivého pseudotumoru. Sonograficky je léze většinou hypoechogenní a heterogenní, častěji lokalizována v pravém laloku. Při CT vyšetření je léze většinou hypodenzní. V diagnostice se uplatňuje i MR a kontrastní USG, která umožňuje sledování perfuze tkáně a mikrocirkulace v lézi v reálném čase, a může tak diagnostice velmi pomoci. V diferenciální diagnostice je třeba zejména odlišit maligní tumory jako hepatocelurální karcinom, jaterní metastázy a intrahepatální cholangiocelulární karcinom, dále i adenom jater, u tumorů s centrální nekrózou je možná záměna za pyogenní absces, často je indikací k chirurgické léčbě nejasná ložisková léze jater. Léčba spočívá v kompletní resekci tumoru do zdravé tkáně. Ve velkých sestavách pacientů resekovaných pro jaterní tumory představuje zánětlivý pseudotumor necelé 1 % [41].
Závěr
Ložiskové zánětlivé procesy jater představují heterogenní skupinu onemocnění, s jejímiž zástupci se ale můžeme setkat v každodenní praxi. Většina z těchto procesů jsou cystické léze, zejména jaterní abscesy. V případě celkových známek zánětu by měla být diagnostika zaměřena tímto směrem. Prvním krokem je pečlivá anamnéza pacienta vč. cestovatelské, protože již v této fázi může vést diagnostická úvaha klinika správným směrem. Po prvotní laboratorní a zobrazovací diagnostice je indikována CT či USG navigovaná punkce a drenáž. Slouží jednak k získání materiálu na kultivaci a zároveň se jedná o terapeutickou modalitu. Klíčová je role ERCP v léčbě biliárních abscesů, které jsou nejčastější.
Další ložiskové zánětlivé léze jsou výrazně vzácnější až raritní, k diagnóze většinou vede složitější diagnostický proces zahrnující podrobnější laboratorní diagnostiku (sérologie, PCR) a sofistikovanější zobrazovací metody, jako je MR, MRCP, PET CT. V léčbě se uplatňují miniinvazivní přístupy (CT či USG navigované drenáže, endoskopické metody), chirurgická léčba je rezervována pro závažné komplikace a vzácná onemocnění, jako jsou parazitární cysty a zánětlivý jaterní pseudotumor.
Doručeno:: 21. 9. 2019
Přijato: 17. 11. 2019
MUDr. Vladimír Frýba
I. chirurgická klinika 1. LF UK a VFN v Praze
U Nemocnice 499/2
128 08 Praha 2
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení.
Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Sources
1. Rahimian J, Wilson T, Oram V et al. Pyogenic liver abscess: recent trends in etiology and mortality. Clin Infect Dis 2004; 39 (11): 1654–1659. doi: 10.1086/425616.
2. Meddings L, Myers RP, Hubbard J et al. A population-based study of pyogenic liver abscesses in the United States: incidence, mortality, and temporal trends. Am J Gastroenterol 2010; 105 (1): 117–124. doi: 10.1038/ajg.2009.614.
3. Yoon JH, Kim YJ, Kim SI. Prognosis of liver abscess with no identified organism. BMC Infect Dis 2019; 19 (1): 488. doi: 10.1186/s128 79-019-4131-z.
4. Kaplan GG, Gregson DB, Laupland KB. Population-based study of the epidemiology of and the risk factors for pyogenic liver abscess. Clin Gastroenterol Hepatol 2004; 2 (11): 1032–1038. doi: 10.1016/s1542-3565 (04) 00459-8.
5. Longworth S, Han J. Pyogenic liver abscess. Clin Liver Dis (Hoboken) 2015; 6 (2): 51–54. doi: 10.1002/cld.487.
6. Barosa R, Pinto J, Caldeira A et al. Modern role of clinical ultrasound in liver abscess and echinococcosis. J Med Ultrason (2001) 2017; 44 (3): 239–245. doi: 10.1007/s10396-016-0765-2.
7. Tsai FC, Huang YT, Chang LY et al. Pyogenic liver abscess as endemic disease, Taiwan. Emerg Infect Dis 2008; 14 (10): 1592–1600. doi: 10.3201/eid1410.071254.
8. Moore R, O’Shea D, Geoghegan T et al. Community-acquired Klebsiella pneumoniae liver abscess: an emerging infection in Ireland and Europe. Infection 2013; 41 (3): 681–686. doi: 10.1007/s15010-013-0408-0.
9. Fazili T, Sharngoe C, Endy T et al. Klebsiella pneumoniae liver abscess: an emerging disease. Am J Med Sci 2016; 351 (3): 297–304. doi: 10.1016/j.amjms.2015.12.018.
10. Luo M, Yang XX, Tan B et al. Distribution of common pathogens in patients with pyogenic liver abscess in China: a meta-analysis. Eur J Clin Microbiol Infect Dis 2016; 35 (10): 1557–1565. doi: 10.1007/s10096-016-2712-y.
11. Chemaly RF, Hall GS, Keys TF et al. Microbiol-ogy of liver abscesses and the predictive value of abscess gram stain and associated blood cultures. Diagn Microbiol Infect Dis 2003; 46 (4): 245–248. doi: 10.1016/s0732-8893 (03) 00088-9.
12. Shelat VG, Wang Q, Chia CL et al. Patients with culture negative pyogenic liver abscess have the same outcomes compared to those with Klebsiella pneumoniae pyogenic liver abscess. Hepatobiliary Pancreat Dis Int 2016; 15 (5): 504–511. doi: 10.1016/s1499-3872 (16) 60127-3.
13. Sharma BC, Garg V, Reddy R. Endoscopic management of liver abscess with biliary communication. Dig Dis Sci 2012; 57 (2): 524–527. doi: 10.1007/s10620-011-1872-y.
14. Gürlich R, Adámková V, Ulrych J et al. Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS. Rozhl Chir 2014; 93 (6): 322–349.
15. Liu Y, Wang JY, Jiang W. An increasing prominent disease of Klebsiella pneumoniae liver abscess: etiology, diagnosis, and treatment. Gastroenterol Res Pract 2013; 258514. doi: 10.1155/2013/258514.
16. Pais-Costa SR, Araujo SLM, Figueiredo VN. Hepatectomy for pyogenic liver abscess treatment: exception approach? Arq Bras Cir Dig 2018; 31 (3): e1394. doi: 10.1590/0102-672020180001e1394.
17. Thaler M, Pastakia B, Shawker TH et al. Hepatic candidiasis in cancer patients: the evolving picture of the syndrome. Ann Intern Med 1988; 108 (1): 88–100. doi: 10.7326/0003-4819-108-1-88.
18. Hasan S, Fearn R. Fungal liver abscess in an immunocompetent patient who underwent repeated ERCPs and subtotal cholecystectomy. BMJ Case Rep 2018; bcr-2017-222013. doi: 10.1136/bcr-2017-222013.
19. Sallah S. Hepatosplenic candidiasis in patients with acute leukemia: increasingly encountered complication. Anticancer Res 1999; 19 (1B): 757–760.
20. Haque R, Huston CD, Hughes M et al. Amebiasis. N Engl J Med 2003; 348 (16): 1565–1573. doi: 10.1056/NEJMra022710.
21. Skappak C, Akierman S, Belga S et al. Invasive amoebiasis: a review of Entamoeba infections highlighted with case reports. Can J Gastroenterol Hepatol 2014; 28 (7): 355–3559. doi: 10.1155/2014/745130.
22. Sharma M, Briski LE, Khatib R. Hepatic actinomycosis: an overview of salient features and outcome of therapy. Scand J Infect Dis 2002; 34 (5): 386–391. doi: 10.1080/00365540110080304.
23. Yang XX, Lin JM, Xu KJ et al. Hepatic actinomycosis: report of one case and analysis of 32 previously reported cases. World J Gastroenterol 2014; 20 (43): 16372–16376. doi: 10.3748/ wjg.v20.i43.16372.
24. Yang SS, Im YC. Severe abdominopelvic actinomycosis with colon perforation and hepatic involvement mimicking advanced sigmoid colon cancer with hepatic metastasis: a case study. BMC Surg 2018; 18 (1): 51. doi: 10.1186/s12893-018-0386-3.
25. Uehara Y, Takahashi T, Yagoshi M et al. Liver abscess of Actinomyces israelii in a hemodialysis patient: case report and review of the literature. Intern Med 2010; 49 (18): 2017–2020.
26. Nunnari G, Pinzone MR, Gruttadauria S et al. Hepatic echinococcosis: clinical and therapeutic aspects. World J Gastroenterol 2012; 18 (13): 1448–1458. doi: 10.3748/wjg.v18.i13. 1448.
27. Brunetti E, Kern P, Vuitton DA et al. Expert consensus for the diagnosis and treatment of cystic and alveolar echinococcosis in humans. Acta Trop 2010; 114 (1): 1–16. doi: 10.1016/ j.actatropica.2009.11.001.
28. Jabbour N, Shirazi, SK, Genyk Y et al. Surgical management of complicated hydatid disease of the liver. Am Surg 2002; 68 (11): 984–988.
29. Kristianova H, Kolarova L, Krska Z et al. Surgical treatment of alveolar echinococcosis: a single centre experience and systematic review of the literature. Rozhl Chir 2019; 98 (4): 167–173.
30. Kolářová L, Matějů J, Honzáková L et al. Humánní alveolární echinokokóza a přehled výskytu tasemnic Echinococcus multilocularis u zvířat v České republice. Epidemiol Mikrobiol Imunul 2017; 66 (4): 163−172.
31. Walls T, Shingadia D. The epidemiology of tuberculosis in Europe. Arch Dis Child 2007; 92 (8): 726–729. doi: 10.1136/adc.2006.102889.
32. Pribula V, Bodnár J, Vrzgula A. Tuberkulóza pečene – kazuistika. Rozhl Chir 2018; 97 (8): 394–398.
33. Kharrasse G, Soufi M, Berekhli H et al. Primary tuberculoma of the liver: a case report and literature review. Pan Afr Med J 2014; 19: 321. doi: 10.11604/pamj.2014.19.321.5107.
34. Ungprasert P, Crowson CS, Simonetto DA et al. Clinical characteristics and outcome of hepatic sarcoidosis: a population-based study 1976–2013. Am J Gastroenterol 2017; 112 (10): 1556–1563. doi: 10.1038/ajg.2017.231.
35. Ibrahim AM, Bhandari B, Soriano PK et al. Hepatic involvement in systemic sarcoidosis. Am J Case Rep 2018; 19: 1212–1215. doi: 10.12659/AJCR.910600.
36. Kennedy PT, Zakaria N, Modawi SB et al. Natural history of hepatic sarcoidosis and its response to treatment. Eur J Gastroenterol Hepatol 2006; 18 (7): 721–726. doi: 10.1097/01.meg.0000223911.85739.38.
37. Pack GT, Baker HW. Total right hepatic lobec-tomy: report of a case. Ann Surg 1953; 138 (2): 253–258. doi: 10.1097/00000658-195308000-00012.
38. Chang SD, Scali EP, Abrahams Z et al. Inflammatory pseudotumor of the liver: a rare case of recurrence following surgical resection. J Radiol Case Rep 2014; 8 (3): 23–30. doi: 10.3941/jrcr.v8i3.1459.
39. Biecker E, Zimmermann A, Dufour JF. Spontaneous regression of an inflammatory pseudotumor of the liver. Z Gastroenterol 2003; 41 (10): 991–994. doi: 10.1055/s-2003-42928.
40. Gleason BC, Hornick JL. Inflammatory myofibroblastic tumours: where are we now? J Clin Pathol 2008; 61 (4): 428–437. doi: 10.1136/jcp.2007.049387.
41. Torzilli G, Inoue K, Midorikawa Y et al. Inflammatory pseudotumors of the liver: prevalence and clinical impact in surgical patients. Hepatogastroenterology 2001; 48 (40): 1118–1123.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2019 Issue 6
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Current Insights into the Antispasmodic and Analgesic Effects of Metamizole on the Gastrointestinal Tract
- Obstacle Called Vasospasm: Which Solution Is Most Effective in Microsurgery and How to Pharmacologically Assist It?
- Spasmolytic Effect of Metamizole
Most read in this issue
- Focal inflammatory liver lesions
- CDED diet in induction therapy of Crohn’s disease
- Vitamin D – substitution after malabsorption operations
- Allogeneic, mesenchymal stem cells (ALOFISEL) are effective in eradicating complex peri-anal fistulas in Crohn’s disease
