Switch z originálního na biosimilární adalimumab SB-5 u nemocných s Crohnovou chorobou – dlouhodobé výsledky
Switch from original to biosimilar adalimumab SB-5 in patients with Crohn‘s disease – long-term results
Background and aims: Originator-adalimumab, an established treatment for patients with Crohn‘s disease (CD) showed no difference in efficacy or adverse events vs the adalimumab biosimilar SB5 (SB5-adalimumab) over 10 weeks of treatment. To understand the long-term efficacy of SB5-adalimumab in CD, patients who switched from originator-adalimumab to SB5-adalimumab were compared to a cohort who remained on originator-adalimumab over a follow up of 104 weeks. Methods: In this analysis, data on patients ≥18 years and diagnosed with CD treated at the IBD ISCARE centre were collected prospectively between July 2018 and January 2021. Clinical disease activity as measured by Harvey-Bradshaw index (HBI) at Week 52 was the primary outcome, while C-reactive protein (CRP), faecal calprotectin (FC), adalimumab trough levels in Weeks 10, 26, 52, 78, and 104, adverse events leading to therapy withdrawal, and persistence on treatment were secondary outcomes. To ensure comparable treatment cohorts, patients were propensity score matched (PSM) for age, gender, diagnosis, and disease activity. Results: A total of 54 patients were matched according to the given criteria in each group. At Week 52, the mean [SD] HBI score was 3.2 (2.5) in the originator-adalimumab group and 4.0 (3.6) in SB5-adalimumab patients (difference [95% CI] –0.78 [–2.8, 1.3]). Similarly, no clinically significant differences in CRP, FC, or trough levels were noted between originator-adalimumab and SB5-adalimumab cohorts through Week 52. The Kaplan-Meier estimates (95% CI) of patients remaining on treatment for the originator-adalimumab vs SB5-adalimumab cohorts were 0.870 (0.785–0.965) vs 0.648 (0.533–0.789) at Week 52. Conclusions: These long-term study results in CD patients after a non-medical switch from originator-adalimumab to SB5-adalimumab showed that the biosimilar SB5 had similar therapeutic effects as originator-adalimumab in terms of clinical disease activity, biological parameters, and pharmacokinetics profile at the primary endpoint of 52 weeks, as well as 104 weeks. Differences in persistence were not clinically driven. Persistence on treatment was lower in patients treated with biosimilar adalimumab SB-5.
Keywords:
biosimilar adalimumab SB-5 – inflammatory bowel disease – Crohn‘s disease– biological therapy
Authors:
Lukáš M.; Kolář M.; Reissigová J.; Černá K.; Machková N.; Hrubá V.; Vašátko M.; Ďuricová D.
Authors‘ workplace:
Klinické a výzkumné centrum pro střevní záněty, Klinické centrum ISCARE a. s. a 1. LF UK v Praze
Published in:
Gastroent Hepatol 2021; 75(3): 242-251
Category:
Original Article
doi:
https://doi.org/10.48095/ccgh2021242
Overview
Cíle studie: Originální adalimumab je zavedenou terapií Crohnovy nemoci, biosimilární adalimumab SB-5 se ukázal být v krátkodobé 10týdenní studii stejně efektivní a bezpečný jako originální produkt. Cílem studie bylo porovnat účinnost a bezpečnost léčby biosimilárním adalimumabem SB-5 po převedení z originálního léčiva v dlouhodobém sledování trvajícím 104 týdnů. Metody: Observační a retrospektivní analýza nemocných s Crohnovou chorobou, starších 18 let, kteří byli léčeni v Klinickém centru ISCARE a.s. a jejichž data o efektivitě a bezpečnosti léčby byla uvedena v CREdIT registru. Primárním cílem bylo zjištění klinické efektivity léčby biosimilárním adalimumabem SB-5 a originálním adalimumabem vyjádřené pomocí Hervey-Bradshowa indexu v týdnu 52. Sekundárními cíli bylo zjištění hodnot CRP, fekálního kalprotektinu a plazmatické hladiny adalimumabu v týdnech 10, 26, 52, 78 a 104 a výskyt nežádoucích účinků a perzistence na léčbě. K lepšímu posouzení efektů léčby byly vytvořeny dvě kohorty pacientů na základě „propensity score matching“ pro pohlaví, věk, lokalizaci nemoci a aktivitu choroby. Výsledky: Celkem 54 pacientů v každé kohortě bylo spárováno podle uvedených kritérií. V týdnu 52 byla průměrná hodnota HB skóre v kohortě léčené originálním adalimumabem 3,2; v kohortě na biosimilárním adalimumabu SB-5 4,0 [rozdíl (95% CI) –0,78 (–2,8; 1,3)]. Podobně klinicky nevýznamné rozdíly byly zjištěny v hodnotách C-reaktivního proteinu (CRP), fekálního kalprotektinu a v průměrné údolní koncentraci adalimumabu mezi oběma kohortami v týdnu 52. Kaplan-Meierova analýza potvrdila v týdnu 52 významně lepší perzistenci na léčbě u originálního přípravku v porovnání s biosimilárním adalimumabem SB-5 0,870 (0,785–0,965) vs. 0,648 (0,533–0,789). Závěr: Dlouhodobé výsledky nemedicínsky indukovaného „switche“ z originálního na biosimilární adalimumab SB-5 potvrdily stejnou terapeutickou efektivitu biosimilárního adalimumabu SB-5 vyjádřenou podobně kontrolovanou klinickou aktivitou Crohnovy nemoci, biologickými parametry a farmakokinetickým profilem v týdnu 52 a v týdnu 104, jako měl originální adlimumab. Byla zjištěna nižší perzistence na léčbě u biosimilárního adlaimumabu SB-5.
Klíčová slova:
biosimilární adalimumab SB-5 – idiopatické střevní záněty – Crohnova nemoc – biologická léčba
Úvod
Adalimumab je rekombinantní, plně humánní imunoglubulin G1, monoklonální protilátka zaměřená proti lidskému tumor nekrotizujícímu faktoru alfa (TNFá), který byl uveden do klinické praxe v roce 2002 nejprve pro léčbu revmatoidní artritidy a později pro ostatní autoimunitní choroby, včetně Crohnovy nemoci (CD; 2006) a ulcerózní kolitidy (UC; 2012). V roce 2018 došlo k exspiraci ochranného patentu originálního adalimumabu a poté se v roce 2019 objevila řada biosimilárních adalimumabů. Adalimumab SB-5 (Imraldi® / Hadlima®; Samsung Bioepis) je jedním se zavedených biosimilárních adalimumabů na evropském trhu [1–5].
Adalimumab SB-5 byl povolen evropskou agenturou pro kontrolu léčiv (EMA) k užívání v klinické praxi ve všech indikacích originálního přípravku koncem roku 2018. Toto rozhodnutí bylo postaveno na vysoké podobnosti s originálním produktem s ohledem na chemickou strukturu, fyzikálně-chemické vlastnosti léčiva, farmakokinetické vlastnosti, farmakodynamický účinek, imunogenicitu léčiva, klinickou účinnost a bezpečnost [6–8].
Průkaz podobné účinnosti a bezpečnosti SB-5 a originálního adalimumabu byl podán na základě výsledků kontrolované klinické zkoušky fáze 3 klinického hodnocení u nemocných s revmatoidní artritidou [9–11]. Přímá data od pacientů s idiopatickými střevními záněty (IBD) jsou velmi omezená. Retrospektivní analýza pacientů exponovaných terapií adalimumabem SB-5 z českého registru nemocných na biologické léčbě (CREdIT) ukázal, že tzv. switch z originálního na SB-5 je z krátkodobého pohledu efektivní a není spojen s nežádoucími účinky nebo nižší účinností [12,13]. Dlouhodobá data ohledně účinnosti a bezpečnosti po provedení „switche“ nejsou zatím příliš dostupná.
Primárním cílem studie bylo zjistit účinnost adalimumabu SB-5 u nemocných s CD v týdnu 52 po převedení z originálního produktu. Dalším cílem bylo zjistit klinickou aktivitu nemoci, hodnoty laboratorních parametrů ve 104. týdnu po provedení „switche“ a také posoudit výskyt závažných nežádoucích účinků, které vedly k předčasnému vyřazení pacientů ze studie.
Soubor pacientů
Klinické a výzkumné centrum pro idiopatické střevní záněty ISCARE a.s. je zaměřeno na diagnostiku, léčbu a dlouhodobé sledování pacientů s UC a CD. Nemocní, kteří mají zavedenou biologickou terapii, mají uvedeny údaje o předcházející léčbě, aktivitě a fenotypu nemoci a některé vybrané laboratorní parametry v CREdIT registru. CREdIT registr je multicentrickým projektem, který byl uveden do činnosti březnu 2016 a do současné doby zahrnuje téměř 6 000 nemocných na biologické a inovativní terapii. Jeho hlavním smyslem je monitorovat efektivitu a bezpečnost podávané biologické léčby. Údaje od nemocných, kteří byli léčeni originálním preparátem nebo biosimilárním adalimumabem SB-5 v Klinickém centru ISCARE, byla prospektivně zaznamenávaná do registru od 18. července 2019 do 2. února 2021 a poté byla z tohoto registru extrahována a retrospektivně analyzována.
V týdnu 0 po zahájení léčby adalimumabem SB-5 („switch“) dostali pacienti s CD lék k vlastní aplikaci na dobu 2–3 měsíců. V týdnu 10 a v týdnu 26 od zavedení léčby SB-5 byla provedena pravidelná kontrola pacientů s ohledem na efektivitu léčby a výskyt nežádoucích účinků.
Pacienti
Do studie byli zařazeni všichni pacienti na léčbě originálním adalimumabem, kteří měli diagnózu CD a byli starší 18 let. Hlavním kritériem byla udržovací terapie originálním adalimumabem v intervalu delším než 3 měsíce před plánovaným „switchem“ na biosimilární SB-5. V týdnu 0 (okamžik „switche“) byli nemocní převedeni z nemedicínských důvodů z originálního na biosimilární adalimumab na SB-5, nebo pokračovali v zavedené léčbě originálním léčivem. Rozhodnutí o převedení, nebo setrvání na originálním léčivu byl proveden náhodně a byl v kompetenci ošetřujícího lékaře. Většina nemocných byla „switchována“ v období říjen–prosinec 2018. Skupina nemocných, kteří zůstali na původním originálním produktu, sloužila jako komparátor ke skupině nemocných převedených z originálního na biosimilární adalimumab SB-5. V obou kohortách byla udržovací terapie ve standardním dávkování 40 mg s.c. 1x za 2 týdny.
Hodnocení
Primárním cílem hodnocení bylo posoudit aktivitu CD v obou kohortách v týdnu 52 na základě Harvey-Bradshawova (H-B) indexu. Sekundárními cíli bylo posoudit změny v hodnotách C-reaktivního proteinu (CRP), fekálního kalprotektinu (FC) a plazmatické hladiny adalimumabu v týdnech 10, 26, 52; výskyt nežádoucích účinků a všech událostí, které vedly k předčasnému ukončení pacientů ve studii. Důvody pro ukončení léčby a eventuální následná biologická léčba byly rovněž zaznamenávány a hodnoceny v týdnech 26, 52, 78 a 104. H-B index byl vypočítáván specializovanými sestrami (IBD sestry) během pravidelných návštěv pacientů v centru. Koncentrace CRP byla detekována imunofelemetricky, koncentrace FC fluoroimunoanalýzou. Plazmatická hladina adalimumabu byla stanovena v obou kohortách užitím ImmunoGuide® kitu (AybayTech Biotechnology, Ankara, Turecko).
Párování a statistická analýza
S cílem přesnějšího srovnání byly obě kohorty pacientů spárovány 1 : 1, probandi ze „switchované“ kohorty byli ke kontrolám na originálním preparátu přiřazeni tak, že vytvořili páry odpovídající podle čtyř hlavních kritérií: věkem, pohlavím, lokalizací a aktivitou nemoci [14]. Jestliže jeden pacient z kohorty musel být vyřazen, pak také odpovídající pacient z páru byl vyřazen. Porovnávané hodnoty byly statisticky hodnoceny Wilcoxonovým testem a McNemarovým chí-kvadrát testem. Byly rovněž vytvořeny Kaplan-Maierovy křivky k posouzení pravděpodobnosti udržení pacientů na léčbě a k testování potenciálních rozdílů mezi oběma kohortami. Kontinuální hodnoty byly referovány jako průměry s 95% konfidenčním intervalem, směrodatnou odchylkou, mediánem a s 25. a 75. percentilem. Kategorická data sumarizovala absolutní výskyt (frekvenci) a podíl (procenta), data byla analyzována pomocí R-softwaru (verze 4.0.3).
Analýza dat získaných z CREdIT registru byla hodnocena na základě etických principů odpovídajících helsinské deklaraci; projekt byl povolen lokální etickou komisí v Klinickém centru ISCARE a.s.
Výsledky
Charakteristika souboru
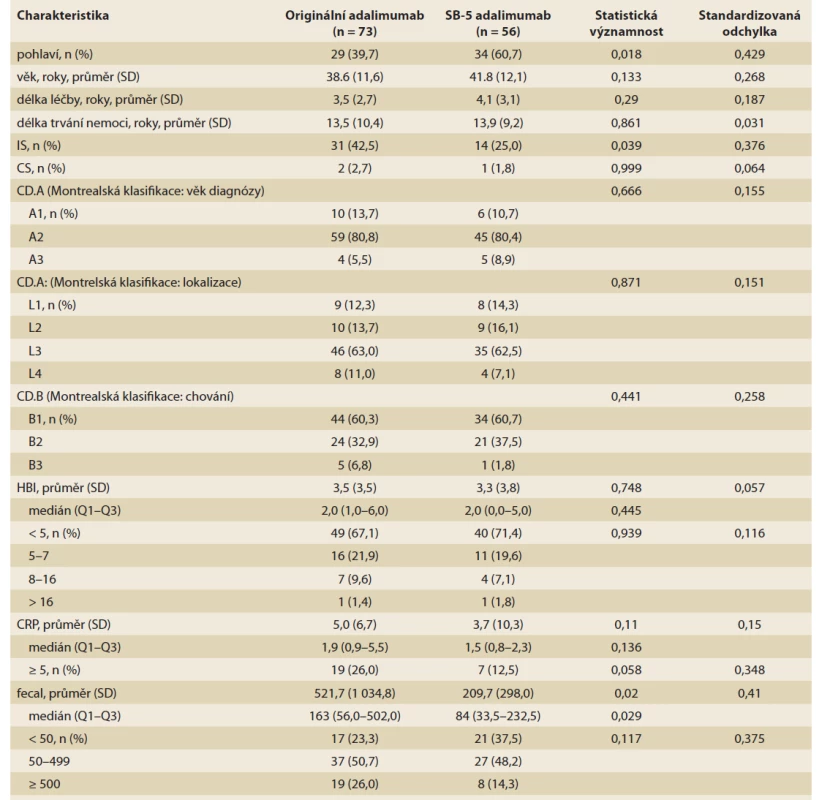
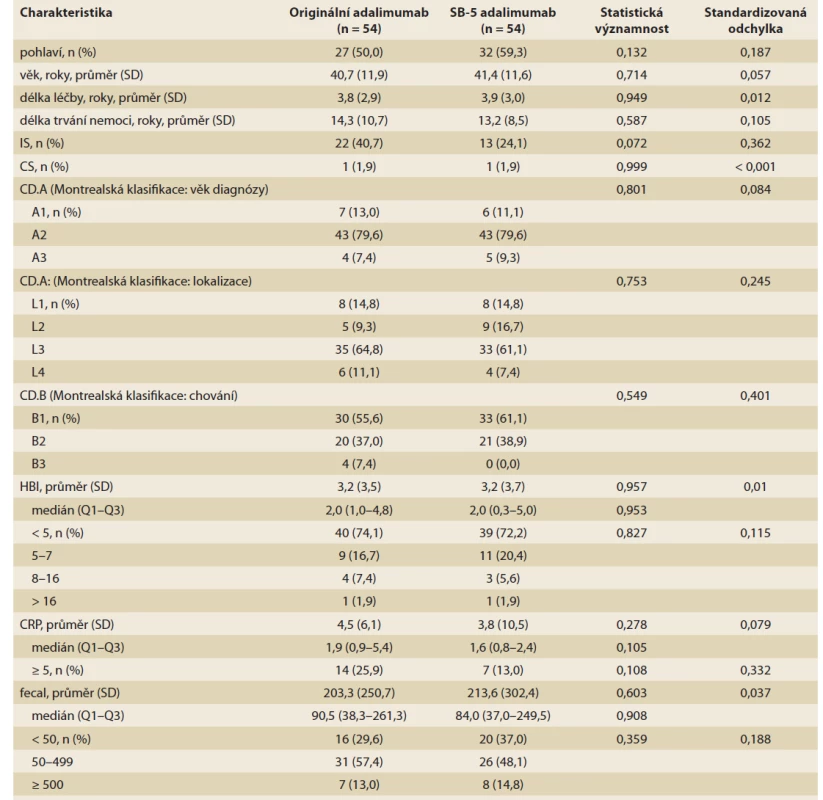
Z celkem 207 IBD pacientů léčených originálním adalimumabem splňovalo základní vstupní kritéria: 175 (84,5 %) z nich mělo diagnózu CD a 129 mělo dostatečná data vhodná pro analýzu (tab. 1). Z těchto pacientů 73 (41,7 % ze 175) bylo „switchováno“ na adalimumab SB-5 a dále pak sledováno po dobu 104 týdnů od listopadu 2018 do ledna 2021. Zbývajících 101 (57,7 %) pacientů pokračovalo v léčbě s originálním adalimumabem. Z pacientů obou kohort (73 „switchované“ a 101 kontrolní) bylo vytvořeno celkem 54 párů z každé kohorty, které byly srovnatelné věkem, pohlavím, lokalizací a aktivitou CD (tab. 2, graf 1).
Tab. 1. Demographic and baseline clinical data of patients before switching from baseline to biosimal for adalimumab SB-5.
Tab. 2. Demographic and baseline clinical data of patients after switching from original to biosimal for adalimumab SB-5
paired based on propensity score matching.
Graph 1. Flow chart of cohorts of patients included in the study.

Perzistence na léčbě
Kaplan-Meierova analýza ukázala následující hodnoty u pacientů, kteří zůstali na léčbě originálním adalimumabem vs. biosimilárním adalimumabem SB-5 v týdnu 52 : 0,870 (95% CI 0,785––0,965) vs. 0,648 (95% CI 0,533–0,789) a v týdnu 104 : 0,852 (95% CI 0,762–0,952) vs. 0,500 (95% CI 0,383–0,653). Perzistence na léčbě SB-5 byla statisticky signifikantně nižší v porovnání s originálním adalimumabem (log-rank p-value < 0,001) (obr. 1). V týdnu 26 byli dva pacienti vyřazeni z léčby originálním adalimumabem a šest pacientů bylo ukončeno ve „switchované“ kohortě. V týdnu 52 bylo sedm pacientů ukončeno na originálním preparátu a devatenáct nemocných bylo ukončeno ve „switchované“ kohortě.
Fig. 1. Development of HBI score over time (PS matched).
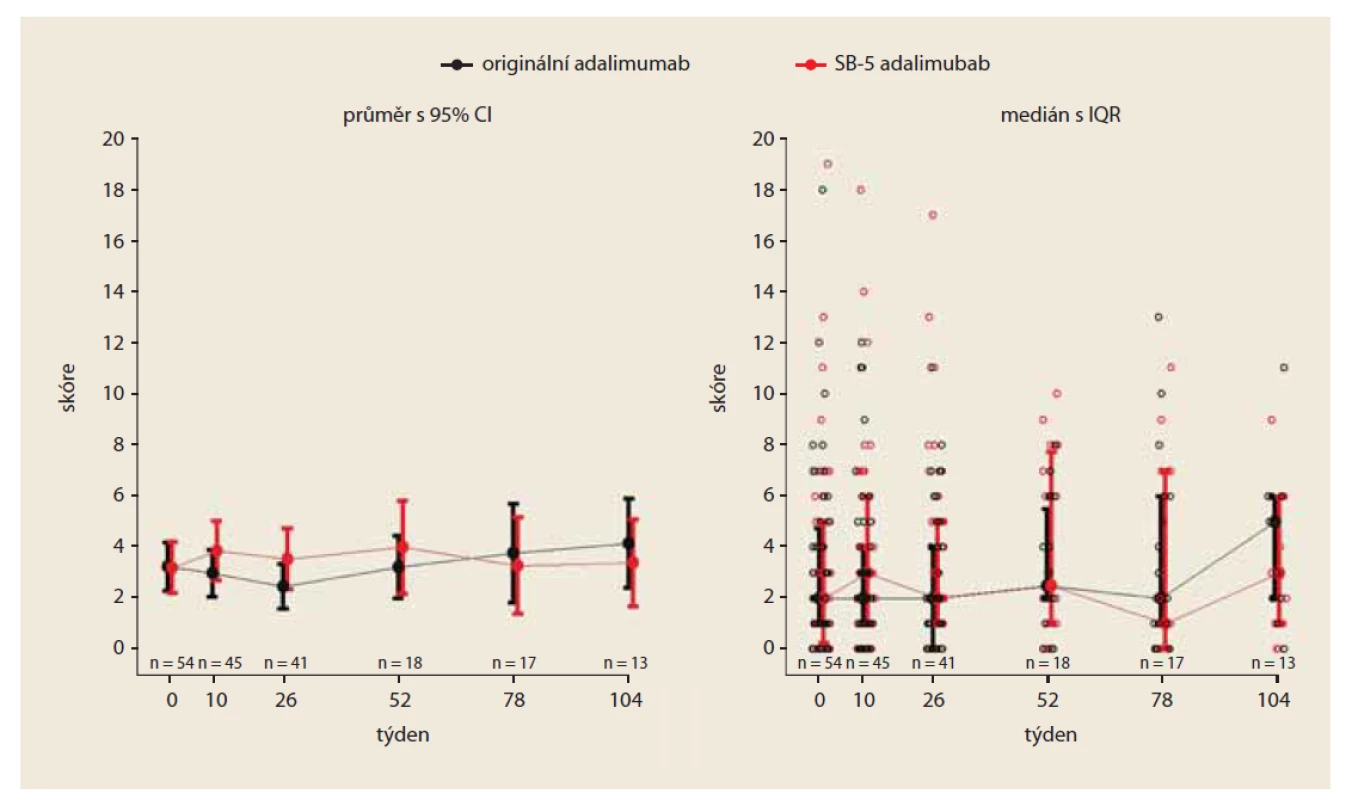
Aktivita nemoci – HBI
V týdnu 0 byla průměrná hodnota HBI v kohortě na originálním preparátu 3,2 a ve „switchované“ kohortě 3,2; rozdíly mezi kohortami byly minimální (95% CI 0,04 (–1,3; 1,4)) (obr. 1). V týdnu 26 byla průměrná hodnota HBI v kohortě s originálním lékem 2,5 a ve „switchované“ větvi 3,5; diference mezi kohortami byla (95% CI) –1,1 (–2,6; 0,5). V týdnu 52 byla průměrná hodnota HBI skóre v kohortě s originálním léčivem 3,2 a 4,0 ve „switchované“ kohortě; diference mezi kohortami –0,78 (–2,8; 1,3). V obou kohortách byla hodnota HBI < 5 a svědčila pro setrvalou klinickou remisi CD. Rozdíly v průměrných hodnotách HBI nebyly z klinického pohledu významné.
Aktivita nemoci – CRP
V týdnu 0 byla průměrná hodnota CRP 4,5 mg/ l v originální kohortě a 3,8 mg/ l u „switchovaných“ pacientů, diference mezi kohortami byla (95% CI) 0,68 (–2,8; 4,1). V týdnu 26 byla průměrná hodnota 3,0 mg/ l v originální větvi a 4,8 mg/ l u „switchovaných“ pacientů; diference mezi kohortami byla (95% CI) –1,7 (–3,6; 0,2). V týdnu 52 byla průměrná hodnota CRP 2,9 mg/ l v originální kohortě a 2,8 mg/ l u „switchovaných“ pacientů (diference mezi oběma kohortami byla (95% CI) 0,09 (–1,6; 1,7). Rozdíly mezi průměrnými hodnotami CRP v týdnu 52 nebyly statisticky signifikantní (obr. 2).
Fig. 2. Development of the average value of CRP (PS matched).
Aktivita nemoci – FC
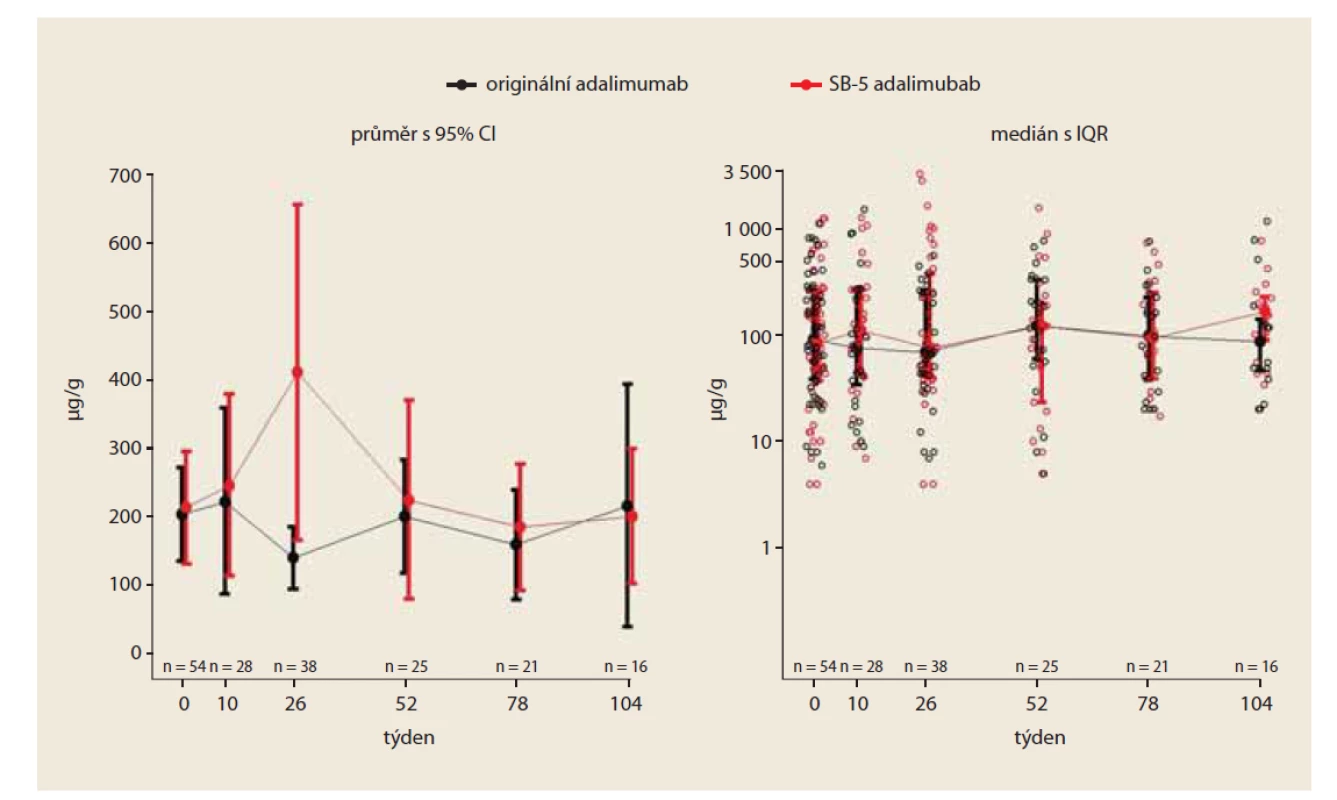
V týdnu 0 byla průměrná hodnota FC velmi podobná v obou skupinách; v kohortě s originálním léčivem byla 203 μg/ g a 214 μg/ g ve „switchované“ skupině; rozdíl byl (95% CI) –10 μg/ g (–105; 84). V týdnu 26 byla průměrná hodnota FC 140 μg/ g u originálního preparátu a 410 μg/ g u „switchovaných“ pacientů; rozdíl mezi skupinami byl statisticky signifikantní (95% CI) –271 (–504; –36). V týdnu 52 byla průměrná hodnota FC 201 μg/ g v kohortě s originálním léčivem a 224 μg/ g u „switchovaných“ pacientů; rozdíl byl (95% CI) –24 μg/ g (–177; 130). V týdnu 52 byly zjištěny nesignifikantní rozdíly mezi oběma skupinami (obr. 3).
Fig. 3. Development of fecal calprotectin value over time (PS matched).
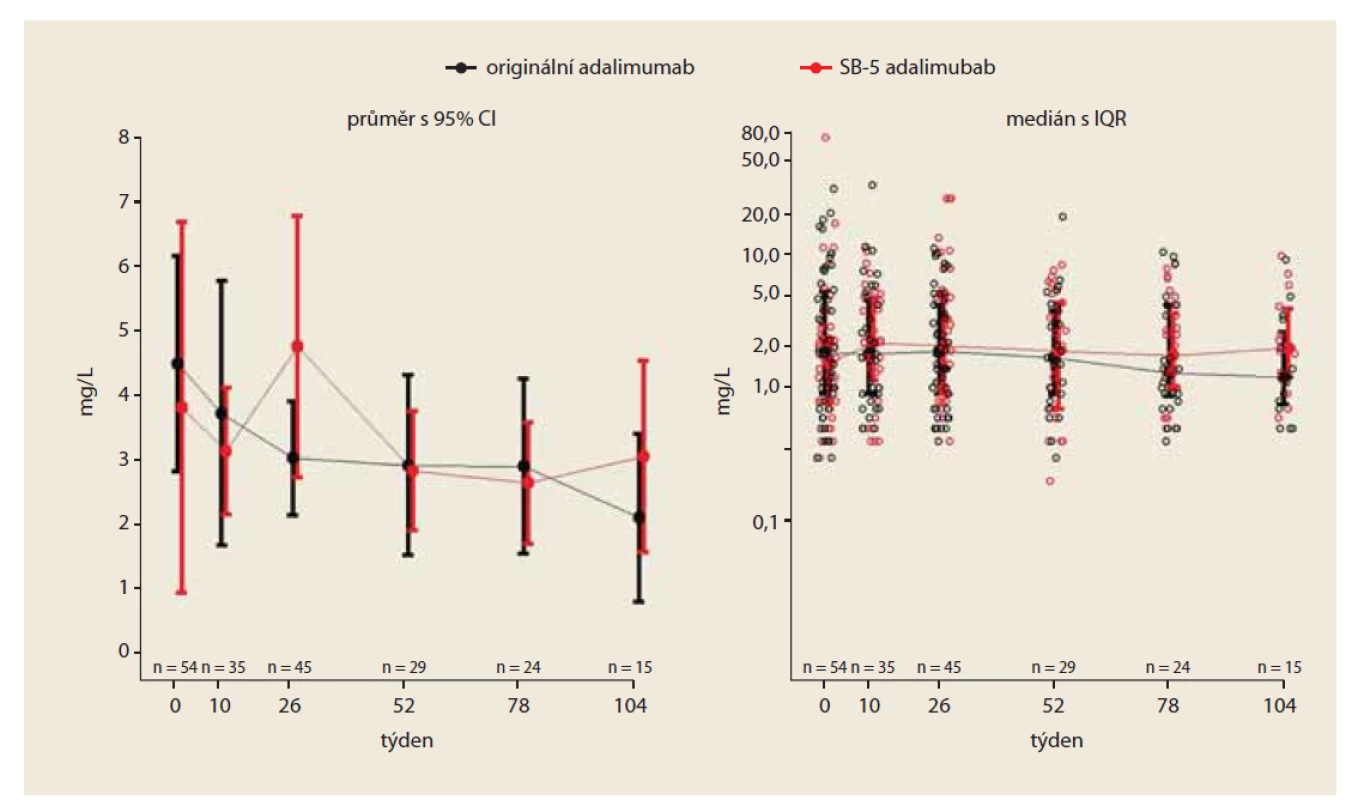
Plazmatická hladina adalimumabu (trough level)
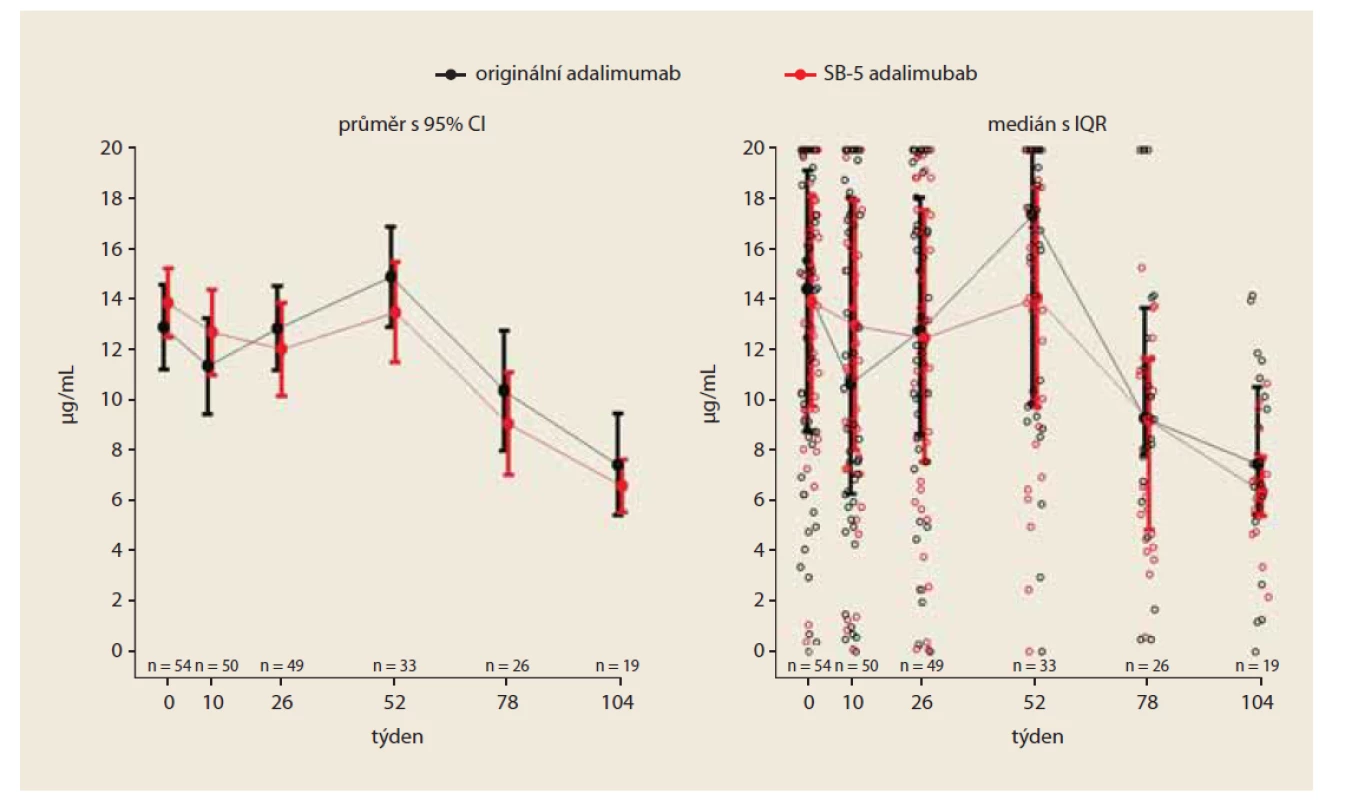
V týdnu 0 byla průměrná hodnota sérové hladiny adalimumabu velmi podobná v obou skupinách: 12,9 μg/ ml v kohortě léčené originálním přípravkem a 13,9 μg/ ml ve „switchované“ kohortě; rozdíl mezi kohortami byl (95% CI) –0,96 μg/ ml (–3,3; 1,3). V týdnu 26 byla průměrná hodnota trough level 12,9 μg/ ml v kohortě s originálním preparátem a 12,1 μg/ ml ve „switchované“ kohortě; diference mezi kohortami byla (95% CI) 0,82 μg/ ml (–1,7; 3,4). V týdnu 52 byla průměrná hodnota trough level 14,9 μg/ ml ve skupině léčené originálním léčivem a 13,5 μg/ ml ve „switchované“ kohortě; rozdíl byl (95% CI) 1,41 μg/ ml (–1,0; 3,8). V týdnu 52 nebyly zjištěny statisticky signifikantní rozdíly v plazmatické koncentraci adalimumabu mezi oběma kohortami (obr. 4).
Fig. 4. Development of adalimumab plasma concentrations (PS matched).
Graph 2. Perzistence of treatment (PS matched).

Důvody pro předčasné ukončení léčby
V průběhu 104. týdnu trvající studie, ve které byl užit model „propensity score matching“, bylo v kohortě léčené biosimilárním adalimumabem SB-5 ukončeno 27 (50 %) pacientů: z toho 23 (43 %) nemocných pro nežádoucí účinek léčby, 2 pacienti (4 %) pro ztrátu odpovědi a 1 (2 %) nemocný se ztratil ze sledování. V kohortě s originálním adalimumabem přerušilo předčasně léčbu 8 (15 %) pacientů, z toho 3 nemocní (6 %) z důvodů vedlejších efektů terapie, 3 pacienti (6 %) pro ztrátu terapeutické odpovědi, 1 (2 %) pacient se ztratil ze sledování a 1 (2 %) pacient odmítl dále pokračovat v léčbě. Celkem 23 pacientů na léčbě adalimumabem SB-5 mělo nějaké vedlejší efekty terapie, jež vedly k ukončení léčby. U 16 (30 %) z nich se jednalo o lokální bolestivost v místě vpichu; u 4 nemocných (7 %) o kožní (psoriasiformní) změny, 1 (2 %) pacient měl celkovou závažnější infekci vyžadující podání antibiotik a 2 (4 %) pacienti se spontánně rozhodli v další léčbě s tímto preparátem nepokračovat. Nemocní, kteří měli kožní vedlejší efekty léčby nebo celkovou infekci, byli převedeni na terapii ustekinumabem, zatímco nemocní s lokální reakcí nebo bolestivostí v místě vpichu byli převedeni zpět na originální preparát. Z 9 pacientů z kohorty léčené originálním adalimumabem vedly u 3 nemocných (6 %) kožní (psoriasiformní) nežádoucí účinky k předčasnému ukončení léčby, další terapie spočívala v podávání ustekinumabu. Ze 3 pacientů (6 %), jež vykazovali druhotnou ztrátu terapeutické odpovědi, byli 2 z nich převedeni na infliximab a 1 na ustekinumab. Jeden nemocný vyššího věku byl převeden na terapii vedolizumabem z obavy ze systémových vedlejších účinků léčby.
Diskuze
Důkazy o stejné účinnosti a bezpečnosti biosimilárního adalimumabu SB-5 v porovnání s originálním adalimumabem pocházejí především od pacientů s revmatoidní artritidou. Na rozdíl od nich jsou data z reálné klinické praxe u nemocných IBD stále velmi omezeně dostupná [9,15]. Dlouhodobé zkušenosti s ohledem na klinickou účinnost, imunogenicitu a bezpečnost mají pro klinika velkou důležitost [16–19].
V této studii byly vytvořeny dvě kohorty nemocných a byla využita data uvedená v pacientském registru CREdIT. Tyto dvě kohorty pacientů z Klinického centra ISCARE a.s. sloužily k porovnání účinnosti a bezpečnosti terapie s biosimilárním adalimumabem SB-5 a s originálním adalimumabem u nemocných s CD. Pacienti zařazení do obou kohort byli spárováni na základě „propensity score matching“ tak, aby byli odpovídající ve čtyřech sledovaných parametrech: pohlavím, věkem, lokalizací choroby a aktivitou CD v době zahájení studie („base line“). Důvodem bylo vytvořit dvě velmi podobné a srovnatelné skupiny nemocných a minimalizovat chybné závěry. V této dlouhodobé observační studii s primárním cílem v 52. týdnu se ukázalo, že nemedicínsky indukovaný „switch“ nemocných s CD z originálního na biosimilární adalimumab SB-5 nevedl k významným změnám v klinické aktivitě nemoci vyjádřené pomocí H-B indexu, nedošlo ke zvýšení sledovaných biologických parametrů (CRP/ Fc), ani ke změnám v plazmatických koncentracích účinné látky. Podobná průměrná koncentrace „trough level“ adalimumabu v obou kohortách svědčí pro identickou biologickou dostupnost originálního a biosimilárního adalimumabu. Zajímavý byl nález změn průměrných koncentrací adalimumabu v obou kohortách v intervalu mezi 10. a 26. týdnem sledování, který měl tvar písmene U. Nejpravděpodobnějším vysvětlením je využití jiné laboratoře k detekci adalimumabu v tomto časovém úseku.
Průběžné výsledky studie PROPER ukázaly, že pacienti s IBD léčení biosimilárním adalimumabem SB-5 nemají v porovnání s pacienty na originálním adalimumabu odlišné parametry účinnosti až do 24. týdne léčby [20]. V roční studii nemocných s IBD, kteří byli od počátku léčeni adalimumabem SB-5 jako první biologickou léčbou s malou kohortou nemocných „switchovaných“ z originálního na biosimilární SB-5, měli srovnatelný počet remisí v obou porovnávaných skupinách [21]
V námi prezentované studii byla zjištěna nižší perzistence na léčbě biosimilárním adalimumabem SB-5, a to od 26. týdne a setrvale v týdnu 52 i v týdnu 104. V průběhu léčby nebyly zjištěny změny v perzistenci na léčbě před týdnem 26, ve kterém byla uskutečněna pravidelná kontrola pacientů, kteří byli dotazováni, zda chtějí setrvat na léčbě, nebo se chtějí vrátit k původní terapii s originálním produktem. Domníváme se, že vysvětlení spočívá v nocebo efektu, což je situace, při které negativní vnímání a očekávaní ze strany pacienta má negativní dopad na výsledek léčby [22]. Nocebo efekt u pacientů, kteří podstoupili nemedicínsky indukovaný „switch“ léčby z originálního léčiva na biosimilární, byl odpovědný za předčasné ukončení terapie. K minimalizaci vlivu nocebo efektu je potřeba multidisciplinární přístup a podrobná edukace pacientů a středně zdravotního personálu před zavedením nové terapie [23]. Ve skupině nemocných, kteří byli indikováni ke změně léčby z originálního na biosimilární adalimumab SB-5, vedla nedostatečná edukace nemocných k nepřiměřeným obavám z nižší účinnosti nebo z vyšších vedlejších účinků léčby a způsobila, že někteří pacienti se rozhodli ukončit léčbu. Pacienti s nemedicínsky indukovaným „switchem“ reprezentují zvláště citlivou populaci na nocebo efekt léčby. I přes nižší perzistenci na léčbě biosimilárním adalimumabem SB-5 nebyly nalezeny žádné rozdíly s ohledem na efektivitu terapie, farmakokinetiku a imunogenicitu léčby. Způsob podání obou léků byl odlišný a mohl se také významně podílet na nižší perzistenci na léčbě biosimilárním adalimumabem SB-5. Většina nemocných léčená originálním adalimumabem aplikovala léčivo předplněnou injekční stříkačkou, zatímco nemocní „switchovaní“ na biosimilární produkt dostávali lék formou předplněného pera. Více než třetina nemocných (37 %) na biosimilárním adalimumabu SB-5 byla ukončena ve studii z důvodů lokální iritace kůže po vpichu nebo vznikem bolestí v místě vpichu [9]. Většina z těchto nemocných se vrátila zpět k podávání originálního adalimumabu.
Tato studie má několik významných limitací. Jedná se o observační a retrospektivní hodnocení, které využilo data uvedená v CREdIT registru, bohužel u některých pacientů nebyla kompletní data dostupná a počet spárovaných pacientů v obou kohortách byl relativně malý. Protože před zahájením studie nebyla vytvořena statistická kalkulace, jak velký pacientský vzorek musí být do studie zařazen, je pravděpodobné, že uvedený soubor nemocných nemusel zachytit významné diference v obou kohortách. Tzv. propensity score matching přístup je doporučován, když je počet kontrol 3–4× vyšší než sledovaných případů, bohužel v naší studii byl poměr cca 1,3 kontrolních pacientů na jednoho sledovaného nemocného.
Závěr
Výsledky této dlouhodobé studie u nemocných s CD, u kterých došlo k nemedicínskému „switchi“ z originálního na biosimilární adalimumab SB-5, ukázaly, že tato léčba má stejnou terapeutickou účinnost vyjádřenou klinickým parametrem H-B indexem, biologickými ukazateli (CRP/ FC) a má shodný farmakokinetický profil v týdnu 52 v porovnání s originálním léčivem. Perzistence na léčbě adalimumabem SB-5 byla významně nižší v porovnání s originální látkou, nejspíše z důvodu tzv. nocebo efektu. Multidisciplinární přístup a pečlivá edukace pacientů a středně zdravotního personálu zvláště u nemocných s nemedicínsky indukovaným „switchem“ může zvýšit perzistenci na léčbě.
Doručeno/Submitted: 14. 6. 2021
Přijato/Accepted: 18. 6. 2021
prof. MU Dr. Milan Lukáš, CSc., AGAF
Klinické a výzkumné centrum pro střevní záněty
Klinické centrum ISCARE a.s. a 1. LF UK v Praze
Českomoravská 19
190 00 Praha 9
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašuji, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Conflict of Interest: The authors declare that the article/manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/manuscript has not been published or is currently being submitted for another review. The authors agree to publish their names and e-mails in the published article/manuscript.
Dedication: The article/manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Sources
1. Bioepis S. Imraldi summary of product characteritics. 2020 [online]. Available from: https:/ / www.ema.europa.eu/ en/ documents/ product-information/ imraldi-epar-product-information_en.pdf.
2. Bioepis S. HADLIMA product information. 2020 [online]. Available from: https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ label/ 2019/ 761059s000lbl.pdf.
3. Argollo M, Fiorino G, Gilardi D et al. Biosimilars of adalimumab in inflammatory bowel disease: are we ready for that? Curr Pharm Des 2019; 25(1): 7–12. doi: 10.2174/ 1381612825666312113610.
4. European Medicines Agency. Guideline on similar biological medicinal products. 2014 [online]. Available from: https:/ / www.ema.europa.eu/ en/ documents/ scientific-guideline/ guide-line-similar-biological-medicinal-products-rev1_en.pdf.
5. (FDA) UFaDA. Scientific considerations in demonstrating biosimilarity to a reference product. 2015 [online]. Available from: https:/ / www.fda.gov/ regulatory-information/ search-fda-guidance-documents/ scientific-considerations-demonstrating-biosimilarity-reference-productDemonstrating Biosimilarity to a Reference Product | FDA.
6. Lee JJ, Yang J, Lee C et al. Demonstration of functional similarity of a biosimilar adalimumab SB5 to Humira®. Biologicals 2019; 58 : 7–15. doi: 10.1016/ j.biologicals.2018.12.002.
7. Lee N, Lee JJ, Yang H et al. Evaluation of similar quality attribute characteristics in SB5 and reference product of adalimumab. MAbs 2019; 11(1): 129–144. doi: 10.1080/ 19420862.2018.1530920.
8. Shin D, Lee Y, Kim H et al. A randomized phase Icomparative pharmacokinetic study comparing SB5 with reference adalimumab in healthy volunteers. J Clin Pharm Ther 2017; 42(6): 672–678. doi: 10.1111/ jcpt.12583.
9. Weinblatt ME, Baranauskaite A, Niebrzydowski J et al. Phase III randomized study of SB5, an adalimumab biosimilar, versus reference adalimumab in patients with moderate-to-severe rheumatoid arthritis. Arthritis Rheumatol 2018; 70(1): 40–48. doi: 10.1002/ art.40336.
10. AbbVie. Humira summary of product characteristics. 2020 [online]. Available from: https:/ / www.ema.europa.eu/ en/ documents/ product-information/ humira-epar-product-information_en.pdf.
11. AbbVie. Humira prescribing information. 2020 [online]. Available from: https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ label/ 2008/ 125057s0110lbl.pdf.
12. Lukas M, Malickova K, Kolar M et al. Switching from originator-adalimumab to the biosimilar SB5 in patients with inflammatory bowel disease: short-term experience from a single tertiary clinical centre. J Crohns Colitis 2020; 14(7): 915–919. doi: 10.1093/ ecco-jcc/ jjaa001.
13. European Medicines Agency. ENCePP guide on methodological standards in pharmacoepidemiology. 2020 [online]. Available from: http:/ / www.encepp.eu/ standards_and_guidances/ methodologicalGuide.shtml.
14. Parsons L. Reducing bias in a propensity score matched-pair sample using greedy matching techniques. 26th Annual SAS Users Group International Conference; 22–25 April 2001. USA: CA, Long Beach: 214–226.
15. Di Cesare A, Tronconi G, Fastame TM et al. SB5 adalimumab biosimilar in the treatment of psoriasis and psoriatic arthritis. Dermatol Ther 2020; 33(3): e13435. doi: 10.1111/ dth.13435.
16. Dragoni G, Pieraccini A, Bagnoli S et al. P620 Maintenance of clinical remission with SB5 biosimilar after switch from adalimumab originator: real-life experience of a tertiary referral centre. J Crohns Colitis 2020; 14(Suppl 1): S515. doi: 10.1093/ ecco-jcc/ jjz203.748.
17. Padilla Suarez C, Webb K, Persad N et al. P473 Long-term follow-up of switching from original adalimumab to adalimumab biosimilar: real-world data in IBD. J Crohns Colitis 2020; 14(Suppl 1): S416. doi: 10.1093/ ecco-jcc/ jjz203.602.
18. Young D, Freudensprung U, Harris C et al. P616 IBD reference and biosimilar adalimumab CroSS over study (iBaSS): design considerations and methodology. J Crohns Colitis 2020; 14(Suppl 1): S513. doi: 10.1093/ ecco-jcc/ jjz203.744.
19. Rosembert D, Malaviya A, How J et al. P505 Different failure rates after non-medical switching of 744 patients from adalimumab originator to 2 different adalimumab biosimilars at Cambridge University Hospitals, UK: real-world experience. J Crohns Colitis 2020; 14(Suppl 1): S438–S439. doi: 10.1093/ ecco-jcc/ jjz203.634.
20. Müller-Ladner U, Gaffney K, Jadon D et al. The PROPER study: results of the first interim analysis of a pan-EU real-world study of SB5 biosimilar following transition from reference adalimumab in patients with rheumatoid arthritis, axial spondyloarthritis or psoriatic arthritis. Ann Rheum Dis 2020; 79 : 1454–1455. doi: 10.1136/ annrheumdis-2020-eular.5429.
21. Tapete G, Bertani L, Pieraccini A et al. Effectiveness and safety of nonmedical switch from adalimumab originator to SB5 biosimilar in patients with inflammatory bowel diseases: twelve-month follow-up from the TABLET registry. Inflamm Bowel Dis 2021; izab027. doi: 10.1093/ ibd/ izab027.
22. Pouillon L, Danese S, Hart A et al. Consensus report: clinical recommendations for the prevention and management of the nocebo effect in biosimilar-treated IBD patients. Aliment Pharmacol Ther 2019; 49(9): 1181–1187. doi: 10.1111/ apt.15223.
23. D‘Amico F, Pouillon L, Argollo M et al. Multidisciplinary management of the nocebo effect in biosimilar-treated IBD patients: results of a workshop from the NOCE-BIO consensus group. Dig Liver Dis 2020; 52(2): 138–142. doi: 10.1016/ j.dld.2019.11.004.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2021 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Editorial
- Kvíz z klinické praxe
- Současné postavení endoskopické transmurální resekce v léčbě kolorektálních neoplazií
- Pětiletá zkušenost s hybridní ERCP technikou s krátkým vodičem
- Závažné krvácanie ako komplikácia endoskopickej choledocho-duodenálnej drenáže prostredníctvom lumen apozičného stentu (Hot-Axios) v riešení distálnej stenózy ductus choledochus pri adenokarcinóme hlavy pankreasu
- Endoskopická léčba obezity
- Endoskopická a medikamentózní terapie cévních ektázií žaludečního antra (GAVE): série kazuistik a přehled metod
- Anální intraepiteliální neoplazie a HD anoskopie
- Zriedkavá príčina dysfágie u dospelých
- Neskorý vznik tenzného pneumoperitonea cez brušnú stenu po zavedení PEG-J
- Switch z originálního na biosimilární adalimumab SB-5 u nemocných s Crohnovou chorobou – dlouhodobé výsledky
- Teduglutid v liečbe syndrómu krátkeho čreva pri Crohnovej chorobe
- Laparoskopické riešenie kongenitálnej paraezofageálnej hernie u 18-mesačnej pacientky – kazuistika a prehľad literatúry
- Telemedicína je víc než „lékař na telefonu“
- Endoskopie a endoterapie u IBD, ISCARE 26.2.2021
- Výběr z mezinárodních časopisů
- Správná odpověď na předchozí kvíz Neklasifikovatelný idiopatický střevní zánět postihující tlusté střevo (IBD-unclassified)
- Erratum
- Kreditovaný autodidaktický test: digestivní endoskopie
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Anální intraepiteliální neoplazie a HD anoskopie
- Endoskopická léčba obezity
- Teduglutid v liečbe syndrómu krátkeho čreva pri Crohnovej chorobe
- Zriedkavá príčina dysfágie u dospelých
