Parkinsonova choroba a postihnutie GITu
Parkinson‘s disease and GIT involvement
Involvement of the upper part of the gastrointestinal tract in patients with Parkinson disease is reported less frequently than the involvement of the lower part. Its clinical impact is, however, substantial because dysphagic symptoms considerably decrease the quality of life and may lead to life threatening complications. Even though the clinical symptoms related to esophageal motility disorders as a result of Parkinson disease are more common in the advanced stages of the disease, these could be diagnosed much earlier using high resolution manometry. The authors describe the basic principles of diagnostic management of dysphagia in patients with Parkinson disease and in the clinical part they present an analysis of their patient cohort. They found out that nonspecific and diverse motility disorders are present in most patients, even without dysphagic symptoms. In the experimental part, we outlined new possibilities for diagnostic procedures using the most up-to-date methods for the detection of pathological forms of alpha-synuclein and advanced microscopic methods.
Keywords:
esophageal motility disorders – manometry – Parkinson disease – alpha-synuclein – FLIM analysis – immunohistochemistry
Authors:
Ďuriček M. 1; Trančíková Krá Ová A. 2; Harsányiová J. 3; Kašovič P. 4; Grofik M. 4; P. Bánovčin Jr. 1
Authors‘ workplace:
Interná klinika gastroenterologická JLF UK a UN Martin, 2 Biomedicínske centrum Martin, JLF UK v Bratislave, 3 Ústav patologickej fyziológie, JLF UK v Bratislave, 4 Neurologická klinika JLF UK a UN Martin
1
Published in:
Gastroent Hepatol 2021; 75(4): 291-297
Category:
doi:
https://doi.org/10.48095/ccgh2021291
Overview
Postihnutie hornej časti tráviaceho traktu u pacientov s Parkinsonovou chorobou sa v literatúre zmieňuje menej často než postihnutie jeho dolnej časti. Jeho klinický význam je ale značný, pretože dysfágické ťažkosti významne znižujú kvalitu života pacientov a môžu viesť k život ohrozujúcim komplikáciám. Napriek tomu, že klinické ťažkosti sa spájajú skôr s pokročilejšími štádiami ochorenia, poruchy motility pažeráka ako dôsledok Parkinsonovej choroby možno pomocou pažerákovej manometrie s vysokým rozlíšením zachytiť oveľa skôr. Autori v článku popisujú základné princípy diagnostického manažmentu dysfágie u pacientov s Parkinsonovou chorobou a v klinickej časti prezentujú analýzu vlastného súboru pacientov. Zistili, že nešpecifické a rôznorodé poruchy motility sú prítomné u väčšiny pacientov aj v neprítomnosti dysfágických symptómov. V experimentálnej časti sme načrtli nové možnosti diagnostických postupov pomocou najmodernejších metodík detekcie patologických foriem alfa-synukleínu a pokročilých mikroskopických metód.
Klíčová slova:
poruchy motility pažeráka – manometria – Parkinsonova choroba – alfa-synukleín – FLIM analýza – imunohistochémia
Klinický úvod
Gastrointestinálne prejavy sú u pacientov s Parkinsonovou chorobou (Parkinson’s disease – PD) veľmi časté. Hoci je symptomatológia súvisiaca s postihnutím dolnej časti tráviaceho traktu preštudovaná lepšie, dysfágia ako prejav postihnutia horného GITu je klinicky relevantný symptóm, ktorý signifikantne znižuje kvalitu života pacientov s PD. Ťažkosti s prehĺtaním uvádza 10–80 % pacientov s PD, obvykle v neskorších štádiách ochorenia. Napriek tomu sa často podhodnocuje.
V rámci PD ide častejšie o orofaryngálnu, než pažerákovú dysfágiu, hoci tieto môžu koincidovať a vzájomne potencovať svoje prejavy. Klinicky zjavná dysfágia, ktorú pacienti pociťujú a referujú, sa spája s pokročilejšími štádiami ochorenia (v priemere 10 rokov od nástupu motorických symptómov) [1]. Špecializované vyšetrovacie metodiky ako videofluoroskopia a zhodnotenie prehĺtania flexibilným endoskopom (fibreoptic endoscopic evaluation of swallowing – FEES) v prípade orofaryngálnej dysfágie či pažeráková manometria s vysokým rozlíšením (high resolution manometry – HRM) ale detegujú poruchu u viac než polovice asymptomatických pacientov. Metaanalýza ukázala, že prevalencia orofaryngálnej dysfágie bola 35 % v prípade, že ju referoval pacient, ale až 82 % v prípade, že sa stanovuje objektívnymi meraniami [2].
Orofaryngálna dysfágia vedie k nedostatočnému príjmu medikácie, malnutrícii, dehydratácii a aspiračným príhodám s následnou pneumóniou, ktorá je hlavnou príčinou smrti u pacientov s PD [1]. Navyše, afektívne symptómy ako strach či depresia sú častejšie u pacientov s dysfágiou ako u pacientov bez dysfágie.
Keďže pacienti často nereflektujú a nereferujú svoju prehĺtaciu poruchu, je potrebné po nej cielene pátrať. Jednoduchým skríningovým vyšetrením sú dotazníky. U pacientov s PD sa používa Dotazník poruchy prehĺtania (Swallowing Disturbance Questionnaire – SDQ) a Mníchovský dysfágický test (Munich dysphagia test – Parkinson’s disease – MDT-PD) [1].
Na priame zhodnotenie orofaryngálnej dysfágie slúži videofluoroskopia a FEES. Pri videofluoroskopii sa podáva pacientom bolus jedla značený kontrastnou látkou (bárium), na RTG sa sleduje jeho prechod z ústnej dutiny cez hltan do pažeráka. Počas FEES sa flexibilný endoskop zavedie cez nos do hypofaryngu a pod optickou kontrolou sa hodnotí faryngálna časť prehĺtania tekutín a tuhej stravy rôznej konzistencie. HRM umožňuje zhodnotiť peristaltiku pažeráka. Jej klinický význam spočíva predovšetkým v zhodnotení pažerákovej dysfágie nakoľko umožní detegovať poruchy pažerákovej peristaltiky či poruchy relaxácie dolného pažerákového zvierača. Hoci je užitočnou metodikou na zhodnotenie pažerákovej dysfágie, je potrebné upozorniť na dva aspekty – 1. aj dysfágia, ktorá sa javí ako orofaryngálna, môže byť dôsledkom poruchy pažerákovej motility; a 2. HRM s impedanciou, ktorá okrem tlakových pomerov v hypofaryngu počas prehĺtacieho aktu umožňuje sledovať prechod tekutého bolusu, sa v budúcnosti pravdepodobne stane metodikou voľby pri zhodnotení orofaryngálnej dysfágie.
HR manometria u pacientov s PD – analýza súboru
V čase od 10/2014 do 10/2018 sme analyzovali poruchy motility pažeráka u pacientov s Parkinsonovou chorobou. Jednalo sa o pacientov hospitalizovaných na Neurologickej klinike JLF UK a UNM na účely zhodnotenia stavu pri zvažovanej hlbokej mozgovej stimulácie (deep brain stimulation – DBS). Pacientom sa nezisťovala prítomnosť dysfágie cielenými dotazníkmi, iba v rámci štandardného anamnestického zhodnocovania. Ani jeden pacient nereferoval ťažkosti imponujúce ako orofaryngálna alebo ezofágová dysfágia.
Realizovala sa HR manometria s vysokým rozlíšením (Manoscan 360, modul A120 Given Imaging). Katéter sa zavádzal transnazálne po celonočnom lačnení, vyšetrenie sa realizovalo v polohe v ľahu. Po zavedení nasledovala 5-min. adaptačná fáza. Zrealizovalo sa štandardné meranie pozostávajúce z 10 hltov vody s objemom 5 ml, po ktorých nasledoval tzv. multiple rapid swallow test, po ktorom sa zaznamenal pokojový stav pažeráka (bez hltov) v trvaní 30 sekúnd. Namerané údaje sa hodnotili pomocou softvéru ManoView (Given Imaging). Hodnotili sa štandardné manometrické parametre – integrovaný relaxačný tlak dolného pažerákového zvierača (lower esophageal sphincter – LES) (integrated relaxation pressure – IRP), konvenčne definovaný ako najnižší tlak LES v čase 4 spojitých alebo nespojitých sekúnd v rámci 10-sekundového časového okna po prehltnutí, distálny kontraktilný integrál (DCI) a distálna latencia (DL). Panezofágová presurizácia sa hodnotila na 30-mmHg izobarickej kontúre. Manometrické nálezy sa klasifikovali s použitím Chicagskej klasifikácie v3.0.
HR manometria sa zrealizovala 10 pacientom (7 mužov a 3 ženy). Priemerný vek v čase vyšetrovania bol 55,6 (41–70) rokov. Priemerné trvanie ochorenia do vyšetrenia bolo 6,8 (2–10) rokov, všetci pacienti boli v štádiu 2 (Hoehn-Yahr). Merania sa v záujme zaistenia spolupráce pri vyšetrení realizovali v „on“ stave, t.j. bez vysadenia liečby levodopou, všetci pacienti boli bez DBS. Tolerancia vyšetrenia bola u všetkých pacientov dobrá. Podľa Chicagskej klasifikácie v3.0 malo normálnu motilitu pažeráka 50 % (5 pacientov). U 20 % pacientov sa zistila hranične zvýšená hodnota integrovaného relaxačného tlaku (medián IRP 15,1 u 2 pacientov), spĺňajú arbitrárne kritériá pre výtokovú obštrukciu. U týchto pacientov ale neboli prítomné manometrické známky kompartmentovej presurizácie, resp. impaktácie bolusu. Z hľadiska kontraktility malo 30 % pacientov (3 pacienti) neefektívnu motilitu pažeráka (stanovenú ako ≥ 50 % neefektívnych hltov s DCI < 450 mmHg/cm/s). Títo pacienti mali 100 %, resp. 70 % neefektívnych hltov. U jedného pacienta sme nedetegovali žiadne známky propulzívnej peristaltiky. Namiesto nej bola prítomná panezofágová presurizácia v 20 % hltov (obr. 1b). Takýto nález je vysoko sugestívny pre achaláziu, u pacienta bol ale normálny relaxačný tlak LES (10,1 mmHg).
Okrem štandardných parametrov sme sa pri analýze manometrických záznamov zamerali aj na črty, ktoré sa nezmieňujú v Chicagskej klasifikácii motilitných porúch, ale môžu byť relevantné v kontexte špecifík Parkinsonovej choroby. Jedná sa o cyklické krátkodobé zvyšovanie tlaku horného pažerákového zvierača (upper esophageal sphincter – UES), ktorý sme zaznamenali u 60 % pacientov (obr. 1d). Ďalej sme sa zamerali na prítomnosť nepropulzívnych (simultánnych) kontrakcií, ktoré sme zaznamenali u 20 % pacientov (obr. 1a). Analyzovali sme aj motilitnú odpoveď na multiple rapid swallow test. U všetkých pacientov došlo k normálnej relaxácii LES. Peristaltická vlna normálnej kontraktility a načasovania bola ale prítomná len u 20 % pacientov. U 40 % pacientov bola prítomná presurizácia, či už panezofágová (10 %) alebo postupujúca od UES do strednej tretiny pažeráka (30 %) (obr. 1c). Predčasná kontrakcia bola prítomná u 30 % pacientov, oneskorená u 10 % pacientov, kontraktilita nebola prítomná rovnako u 10 % pacientov.
Fig. 1. Motility disorders in patients with PD. a) Simultaneous (non-propagating) contractions in the distal esophagus (*).
b) Panesophageal pressurization on the 30-mmHg isobaric contour; typical for achalasia (→) , however, normal LES relaxation
pressure (*). c) Multiple rapid swallows with pressurization from the UES to the mid esophagus (**), followed by panesophageal
pressurization (*). d) Normal propagating peristalsis (→) and cyclic hyperrensive UES (*), with maximum pressure of
as much as 250 mmHg.
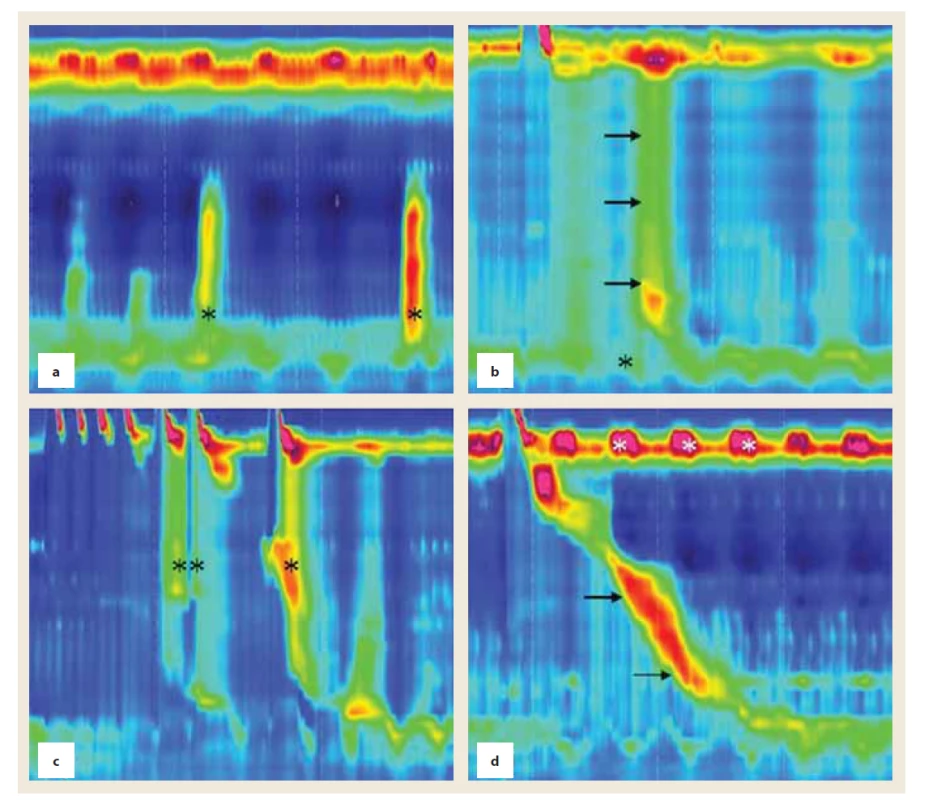
Poruchy motility pažeráka u pacientov s PD
Z analýzy nášho súboru vyplýva, že 1. prevalencia motilitných porúch je u PD pacientov bez dysfágie vysoká; 2. motilitné poruchy sú rôznorodé a nešpecifické (slabá peristaltika aj simultánne kontrakcie); 3. sú prítomné určité manometrické rysy mimo štandardnej (Chicagskej) klasifikácie motilitných porúch (cyklický hypertonus UES, simultánne kontrakcie distálneho pažeráka). Vzhľadom na nízky počet probandov nie je možné zhodnotenie súvislosti charakteru motilitnej poruchy s klinickými rysmi PD.
Napriek pomerne vysokej prevalencii dysfágie u PD nie je k dispozícii dostatok kvalitných dát zameraných na poruchy motility pažeráka. Autorom článku sú známe tri štúdie, ktoré používali HRM na zhodnotenie pažerákovej motility u pacietov s PD. Jedna z nich je retrospektívnou analýzou a zahŕňa pacientov s rôznymi štádiami PD, nie cielene selektovaných na základe dysfágických symptómov (išlo teda o pacientov bez dysfágie aj s dysfágiou) [1]. Autori analýzou 65 pacientov zistili, že poruchy motility tela pažeráka sú časté (takmer u 1/3 pacientov), a že s progresiou ochorenia sa zvyšuje intrabolusový tlak (intrabolus pressure – IBP). Najčastejšími nálezmi boli hypotenzná peristaltika (nízka sila kontrakcie) a nárast počtu pažerákových spazmov (predčasne načasovaných kontrakcií po prehltnutí). Abnormality aspoň jedného parametra na HRM sa ale nachádzali u 95 % vyšetrovaných pacientov. Tieto pozorovania sú v súlade s našími (vysoká prevalencia motilitnej poruchy v našom súbore, nízka kontraktilita u 30 % pacientov).
Druhá štúdia mala prospektívny charakter, a jej cieľom bolo objektívne popísať dysfágiu a pažerákové symptómy u 33 pacientov s PD (selektovaná skupina pacientov s pažerákovými symptómami) [3]. Zistilo sa, že dysfágia s asociovaným úbytkom hmotnosti bola pomerne častá (62 % pacientov), ale nekoreluje so závažnosťou PD ani dĺžkou jej trvania. Aj v tejto štúdii boli poruchy motility časté, pričom sa prekrývali poruchy pažerákovej peristaltiky (neefektívna motilita a spazmy) aj poruchy relaxácie LES (EGJ výtoková obštrukcia). Detegované poruchy motility ale nekorelovali s dysfágickou symptomatológiou. Výsledky tejto štúdie taktiež neodporujú našim záverom, a to napriek tomu, že v tejto štúdii išlo výlučne o pacientov s dysfágiou (na rozdiel od nášho súboru). V našom súbore sme tiež zaznamenali neefektívnu motilitu (viď vyššie), spazmy aj výtokovú obštrukciu (u 20 % pacientov).
Tretia štúdia sa zaoberala vplyvom hlbokej stimulácie mozgu (deep brain stimulation – DBS) na motilitu pažeráka. Nepreukázala klinicky signifikantné zlepšenie dysfunkcie prehĺtania po DBS [4].
Súčasný stupeň poznania neumožňuje ustanoviť priamu klinickú implikáciu zistenia poruchy pažerákovej motility. Štandardné parametre, ktoré sa používajú na hodnotenie HRM (relaxačný tlak LES, sila kontrakcie a načasovanie kontrakcie), pravdepodobne nebudú môcť s dostatočnou presnosťou identifikovať postihnutie pažeráka ako priamy dôsledok PD, keďže prevalencia ľahkých porúch motility je pomerne vysoká aj u zdravej populácie (bez PD). Nie je predpoklad, že na základe zistenej poruchy bude možné v blízkej budúcnosti odporučiť cielenú terapiu dysfágie v skupine pacientov s PD. Najaktuálnejšie dáta ale naznačujú hlavne patofyziologický význam motilitných porúch pri PD. Ich pravdepodobnou príčinou je spomalená a abnormálna aktivácia excitačných cholinergických neurónov v hladkom svalstve pažeráka.
Patomechanizmus a úloha alfa-synukleínu v rozvoji dysfágie
Na molekulárnej úrovni je PD charakterizovaná prítomnosťou intraneuronálnych cytoplazmatických eozinofilných proteínových inklúzií, Lewyho teliesok (LB) a Lewyho neuritov (LN) v neurónoch nielen centrálneho, ale aj enterického nervového systému (ENS). Ich hlavným komponentom je (okrem iných proteínov), patologicky agregovaný alfa-synukleín (a-Syn) [5,6], malý (140 aa) cytoplazmatický proteín, vysoko exprimovaný v mozgu (1 % celkového proteínu). Jeho presná funkcia nie je úplne objasnená, predpokladá sa, jeho úloha pri regulácii transdukcie synaptických vezikúl. Fyziologické konformácie a-Syn zahŕňajú hlavne stabilné monoméry alebo zložené tetraméry. Vyššie štruktúry, ako sú oligoméry, protofibrily a fibrily, typicky fosforylované na seríne 129 (p-a-Syn), predstavujú patologické konforméry spojené s rozvojom neurodegeneratívnych ochorení, vrátane PD [5,6]. Výskyt týchto patologických konformérov a-Syn sa pozoroval nielen v CNS, ale aj v ENS. Tieto zistenia sú v súlade s hypotézou prezentovanou uz na začiatku 21. storočia, ale stále platnou, že rozvoj PD sa iniciuje v ENS a následne progreduje do CNS prostredníctvom anatomických spojení týchto systémov [7].
V jednej štúdii sa autori zamerali na podrobnú analýzu p-a-Syn v tkanivách tráviaceho traktu nielen u pacientov s PD (n = 17), ale aj s Alzheimerovou chorobou (n = 19), demenciou s LB (DLB, n = 9) v porovnaní so zdravými jedincami (n = 23). Analýza potvrdila prítomnosť p-a-Syn nielen u pacientov s PD, ale aj u pacientov s inými neurodegeneratívnymi ochoreniami. Čo sa týka distribúcie týchto patologických foriem, najvyššia incidencia sa zistila v submandibulárnej žľaze a dolnej časti pažeráka, pričom sa ich koncentrácia znižovala smerom k distálnej časti tráviaceho traktu. Zaujímavé bolo, že p-a-Syn-pozitívne inklúzie neboli prítomné v horných 2/3 pažeráka [8].
V podobnej štúdii autori analyzovali prítomnosť a-Syn-pozitívnych inklúzií v tkanivách CNS a ENS od pacientov s PD (n = 10), DLB (n = 5) a ďalších (n = 13) vrátane atypického parkinsonizmu a demencie bez LB (n = 13). Prítomnosť a-Syn-pozitívnych inklúzií potvrdili vo všetkých PD a DLB vzorkách, na rozdiel od atypickej formy parkinsonizmu a demencie bez LB [9]. Prítomnosť agregovaných foriem a-Syn sa potvrdila vo všetkých tkanivách tráviaceho traktu, ale aj v nadobličkách, srdci, sympatických gangliách, v n. vagus a urogenitálnom trakte s typickou rostrokaudálnou distribúciou. Distálny pažerák a žalúdok obsahovali najviac pozorovaných agregátov a-Syn, zatiaľ čo konečník najmenej [8–10], čo naznačuje priamu súvislosť medzi pozorovanými poruchami pažeráka a rozvojom PD. Dokonca jedna z prvých analýz patologického a-Syn v orgánoch tráviaceho traktu, z roku 1984, poukázala priamo na prítomnosť agregovaného a-Syn v pažeráku u pacienta s rozvinutou PD [11], čo môže súvisieť s prítomnosťou LB alebo s degeneráciou neurónov v Auerbachovom myenterickom plexe dolného pažeráka [12].
V ďalšej štúdii autori analyzovali prítomnosť p-a-Syn vo vzorkách hltana pacientov s potvrdenou PD (n = 10) a zdravých jedincov (n = 4). Na rozdiel od predchádzajúcich štúdií, v rámci skupiny PD pacientov sa zamerali aj na pacientov s diagnostikovanou dysfágiou a pacientov bez prítomnej dysfágie. U všetkých PD pacientov bez ohľadu na diagnostikovanú dysfágiu, na rozdiel od zdravých jedincov, potvrdili v axónoch senzorických nervov prítomnosť týchto p-a-Syn-pozitívnych inklúzií. Pri detailnejšej analýze však zistili, že pacienti s dysfágiou vykazovali viac p-a-Syn-pozitívnych vlákien ako pacienti s PD bez diagnostikovanej dysfágie. Tieto výsledky preto naznačujú, že senzorické nervy hltanu sú primárne postihnuté PD patológiou, ktorá môže súvisieť s následnou senzibilizáciou hltanového tkaniva, prítomnosťou edému a ďalším vývojom dysfágie u pacientov s PD [13].
Vačšina doteraz publikovaných analýz sa však opiera hlavne o imunohistochemickú detekciu LB a agregovaného a-Syn. Ďalším problémom je, že väčšina štúdií pri svojich analýzach využíva najmä protilátky proti celkovému a-Syn, a nie protilátky proti formám asociovaných s PD. Navyše, v poslednej dobe sa ukazuje, že tieto metódy nie sú dostatočne senzitívne, ani špecifické pre skoré odhalenie ochorenia. Práve odhalenie skorých štádií PD je pre manažment choroby a zlepšenie kvality života pacienta kľúčové. Posledné štúdie čoraz viac poukazujú na nevyhnutnosť využívania kombinácie viacerých klinických a analytických metodík [14], a zároveň optimalizácie doteraz používaných analýz.
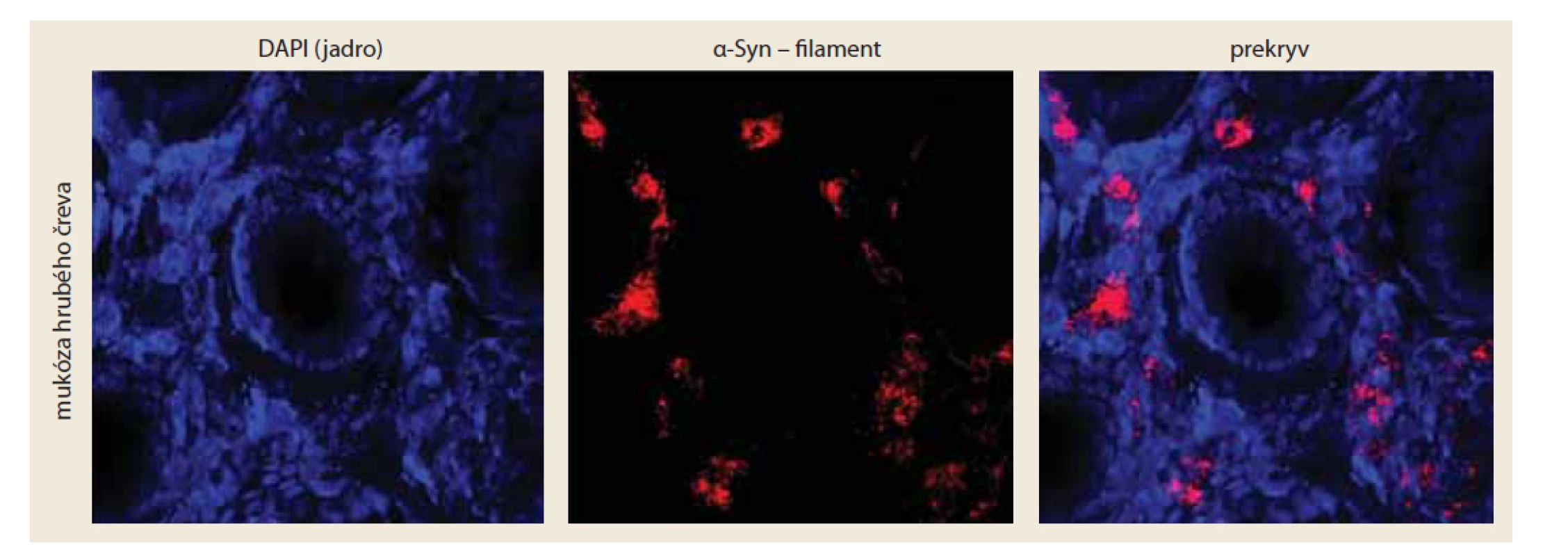
Základnou nevýhodou konvenčnej histologickej analýze mikrosekcií je fakt, že sa tkanivo neanalyzuje komplexne ako väčší celok, čo môže viesť k strate dôležitých informácií. Tieto limity možno prekonať pomocou imunohistochemického farbenia a analýzy celistvých tkanív, keďže poskytuje možnosť vizualizácie a analýzy komplexnej informácie o jednotlivých vrstvách tkanív, o ich inervácii, vaskularizácii, a tým aj o prebiehajúcich fyziologických a patofyziologických procesoch [15,16]. Zvýšenie senzitivity imunohistochemického farbenia je možné dosiahnuť napríklad pomocou amplifikácie molekuly fluoroforu [15]. V prípade zvýšenia špecificity, neustály vývoj nám poskytuje široké spektrum moderných protilátok schopných detegovať okrem posttranslačných modifikácií prítomných pri patologických procesoch, napríklad aj konformačné zmeny charakteristické pre formy a-Syn asociované s PD. Práve tieto protilátky proti širšiemu spektru rôznych foriem a-Syn majú potenciál odhaliť patologické procesy asociované s a-Syn už v prodromálnom štádiu ochorenia (obr. 2) [17].
Fig. 2. Detection of pathological forms of α-Syn in wholemount colon biopsies in a patient with PD. Pathological forms of α-
-Syn were detected using conformation-specific antibodies against the filament form of α-Syn (red). Cell nuclei (blue) represent
cells in the colon mucosa.
Nádejnými v odhaľovaní skorých štádií ochorenia sa javia aj sofistikované zobrazovacie a analytické metódy, ako napríklad FLIM (Fluorescence Lifetime Imaging) analýza. Táto metóda je v porovnaní s imunohistochemickými alebo biochemickými metódami výrazne senzitívnejšia. Kým klasická imunohistochemická detekcia je založená na kvantitatívnej analýze, FLIM mikroskopia sa zameriava na zaznamenávanie životnosti fluorescencie emitovanej endogénnym alebo exogénnym fluoroforom (protilátka alebo fluorescenčná próba) v testovanej vzorke, a teda na kvalitatívnu analýzu. Životnosť fluorescencie daného fluoroforu je výrazne ovplyvnená prostredím, ktoré daný fluorofór obklopuje, ale aj konformačnými zmenami detegovaného proteínu. Potenciál FLIM mikroskopie bol naznačený už pri štúdiu patologických foriem a-Syn pomocou tioflavínu T a S v rekombinantných systémoch [18] a v bunkových modeloch [19].
V našich štúdiách sme použili kombináciu FLIM mikroskopie a analýzy celistvých tkanív pri detekcii skorých štádií PD na rotenónom-indukovanom myšom modeli. V tomto modeli dochádza prioritne k tvorbe patologických a-Syn agregátov v tkanivách tráviaceho traktu a až neskôr sa táto patológia šíri do CNS. Po 8 týždňoch aplikácie rotenónu, sme pomocou tioflavínu S, detekovali v mukozálnej a submukozálnej vrstve hrubého čreva proteínové agregáty (obr. 3 vľavo). Tieto štruktúry však neboli detekovateľné pomocou protilátok a klasického imunohistochemického farbenia. Navyše, FLIM analýza odhalila posun v životnosti fluorescencie emitovej tioflavínom S, ktorý zodpovedal predchádzajúcim štúdiám na rekombinantných a bunkových modeloch (obr. 3 vpravo).
Fig. 3. FLIM analysis of the colon in a rotenone-induced mouse model of PD. Protein aggregates positive for thioflavin S were
detected in colon tissues only in mice after application of rotenone. We did not detect these thioflavin S-positive structures in
the control samples (left). FLIM analysis confirmed a shift in the lifetime of thioflavin S, which corresponds to the results obtained
on in vitro systems.
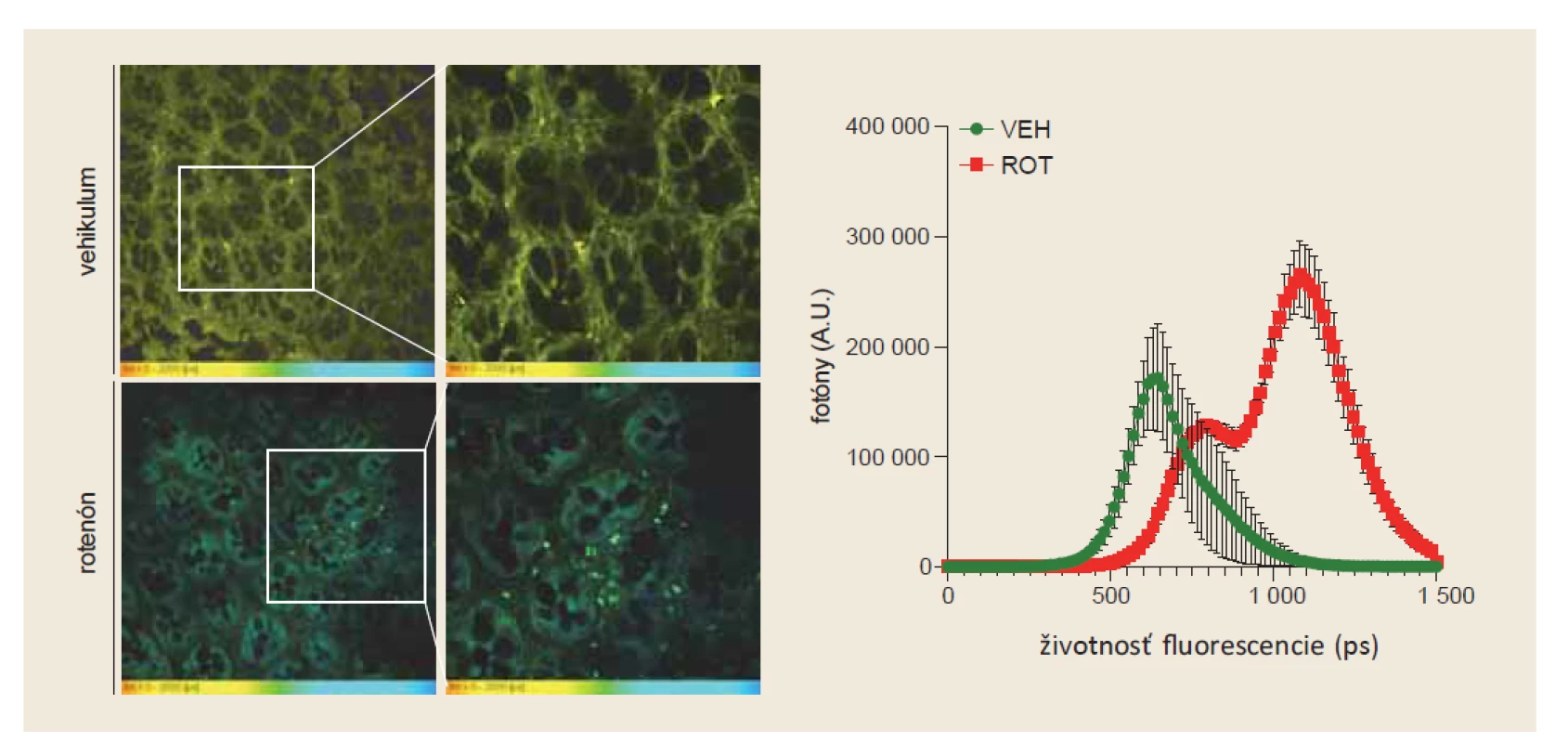
Ako bolo spomínané vyššie, patologické, agregované formy a-Syn sú prítomné vo všetkých tkanivách tráviaceho traktu s typickou rotrokaudálnou distribúciou. Poruchy funkcie pažeráka sú jedným z prvých príznakov PD a rozvojom samotného ochorenia. Práve z tohto dôvodu sú tieto výsledky zaujímavé, pričom poukazujú na vysoký potenciál FLIM mikroskopie, pri odhaľovaní skorých štádií PD.
Doručené/Submitted: 4. 7. 2021
Prijaté/Accepted: 12. 7. 2021
MUDr. Peter Bánovčin, PhD.
Interná klinika gastroenterologická
JLF UK a UN Martin
Kollárova 2
036 01 Martin
Konflikt záujmov: Autori deklarujú, že text článku zodpovedá etickým štandardom, bola dodržaná anonymita pacientov, a vyhlasujú, že v súvislosti s predmetom článku nemajú finančné, poradenské ani iné komerčné záujmy.
Publikačná etika: Príspevok nebol doteraz publikovaný ani nie je v súčasnosti zaslaný do iného časopisu na posúdenie. Autori súhlasia s uverejnením svojho mena a e-mailového kontaktu v publikovanom texte.
Dedikácia: Práca bola podporená grantom VEGA 1/ 0371/ 21.
Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do biomedicínskych časopisov.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in the published article/ manuscript.
Dedication: The work was supported by the grant VEGA 1/ 0371/ 21.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Sources
1. Suttrup I, Suttrup J, Suntrup-Krueger S et al. Esophageal dysfunction in different stages of Parkinson‘s disease. Neurogastroenterol Motil 2017; 29 (1). doi: 10.1111/nmo.12915.
2. Kalf JG, de Swart BJ, Bloem BR et al. Prevalence of oropharyngeal dysphagia in Parkinson‘s disease: a meta-analysis. Parkinsonism Relat Disord 2012; 18 (4): 311–315. doi: 10.1016/j.parkreldis.2011.11.006.
3. Su A, Gandhy R, Barlow C et al. Clinical and manometric characteristics of patients with Parkinson‘s disease and esophageal symptoms. Dis Esophagus 2017; 30 (4): 1–6. doi: 10.1093/ dote/dow038.
4. Derrey S, Chastan N, Maltete D et al. Impact of deep brain stimulation on pharyngo-esophageal motility: a randomized cross-over study. Neurogastroenterol Motil 2015; 27 (9): 1214–1222. doi: 10.1111/nmo.12607.
5. Lashuel HA, Overk CR, Oueslati A et al. The many faces of alpha-synuclein: from structure and toxicity to therapeutic target. Nat Rev Neurosci 2013; 14 (1): 38–48. doi: 10.1038/nrn3406.
6. Oueslati A. Implication of alpha-synuclein phosphorylation at S129 in synucleinopathies: what have we learned in the last decade? J Parkinsons Dis 2016; 6 (1): 39–51. doi: 10.3233/JPD-160779.
7. Braak H, Rüb U, Gai WP et al. Idiopathic Parkinson‘s disease: possible routes by which vulnerable neuronal types may be subject to neuroinvasion by an unknown pathogen. J Neural Transm (Vienna) 2003; 110 (5): 517–536. doi: 10.1007/s00702-002-0808-2.
8. Beach TG, Adler CH, Sue LI et al. Multi-organ distribution of phosphorylated alpha-synuclein histopathology in subjects with Lewy body disorders. Acta Neuropathol 2010; 119 (6): 689–702. doi: 10.1007/s00401-010-0664-3.
9. Gelpi E, Navarro-Otano J, Tolosa E et al. Multiple organ involvement by alpha-synuclein pathology in Lewy body disorders. Mov Disord 2014; 29 (8): 1010–1018. doi: 10.1002/mds.25776.
10. Wakabayashi K, Takahashi H, Takeda S et al. Lewy bodies in the enteric nervous system in Parkinson‘s disease. Arch Histol Cytol 1989; 52 (Suppl): 191–194. doi: 10.1679/aohc.52.suppl_191.
11. Qualman SJ, Haupt HM, Yang P et al. Esophageal Lewy bodies associated with ganglion cell loss in achalasia. Similarity to Parkinson‘s disease. Gastroenterology 1984; 87 (4): 848–856.
12. Wakabayashi K, Takahashi H, Takeda S et al. Parkinson‘s disease: the presence of Lewy bodies in Auerbach‘s and Meissner‘s plexuses. Acta neuropathol 1988; 76 (3): 217–221. doi: 10.1007/bf00687767.
13. Mu L, Sobotka S, Chen J et al. Parkinson disease affects peripheral sensory nerves in the pharynx. J Neuropathol Exp Neurol 2013; 72 (7): 614–623. doi: 10.1097/NEN.0b013e3182965886.
14. Fenyi A, Leclair-Visonneau L, Clairembault T et al. Detection of alpha-synuclein aggregates in gastrointestinal biopsies by protein misfolding cyclic amplification. Neurobiol Dis 2019; 129 : 38–43. doi: 10.1016/j.nbd.2019.05.002.
15. Harsanyiova J, Ru F, Zatko T et al. Vagus nerves provide a robust afferent innerva - tion of the mucosa throughout the body of the esophagus in the mouse. Dysphagia 2020; 35 (3): 471–478. doi: 10.1007/s00455-019-10051-8.
16. Wang L, Magen I, Yuan PQ et al. Mice overexpressing wild-type human alpha-synuclein display alterations in colonic myenteric ganglia and defecation. Neurogastroenterol Motil 2012; 24 (9): e425–436. doi: 10.1111/j.1365-2982.2012.01974.x.
17. Fricova D, Harsanyiova J, Kralova Trancikova A. Alpha-synuclein in the gastrointestinal tract as a potential biomarker for early detection of Parkinson‘s disease. Int J Mol Sci 2020; 21 (22): 8666. doi: 10.3390/ijms21228666.
18. Plotegher N, Stringari C, Jahid S et al. NADH fluorescence lifetime is an endogenous reporter of alpha-synuclein aggregation in live cells. FASEB J 2015; 29 (6): 2484–2494. doi: 10.1096/fj.14-260281.
19. Pokusa M, Kráľová Trančíková A. FLIM analysis of intracellular markers associated with the development of Parkinson‘s disease in cellular model. Physiol Res 2018; 67 (Suppl 4): S673–S683. doi: 10.33549/physiolres.934054.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2021 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Parkinsonova choroba a postihnutie GITu
- Heydeho syndróm
- Cytomegalovirová enteritida jako neobvyklý zdroj krvácení do gastrointestinálního traktu
- Význam sarkopenie a myosteatózy u kandidátů transplantace jater na peritransplantační průběh a přežívání pacientů a štěpů
- Endoscopic management of ampullary tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline and Endoscopic management of superficial nonampullary duodenal tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline
- Neobvyklý případ systémové AA amyloidózy
- Vitamín D a nealkoholová steatóza pečene u detí
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Aktualita z kongresu EASL-ILC: pokroky v poznání a léčbě primární biliární cholangitidy
- Výběr z mezinárodních časopisů
- Správná odpověď na předchozí kvíz Dlouhodobé bolesti břicha
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Sérové protilátky proti laminarinu u kolorektálního karcinomu: prospektivní pilotní studie
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Heydeho syndróm
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Vitamín D a nealkoholová steatóza pečene u detí
