Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
Authors:
Bortlík- M. 1 4; Ďuricová D. 5; Hrdlička L. 6; Matějková P. 6; Novotný A. 7; Drastich P. 8; Mandys V. 9; Mináriková P. 2; Pipek B. 10; Kajzrlíková Mikoviny I. 11; Nedbalová L. 12; Koželuhová J. 13; Machková N. 5; Zbořil V. 14; Prokopová L. 14; Kohout P. 15; Šerclová Z. 16; Vašátko M. 8; Douda T. 17; Stehlík J. 18; Mareš K. 19; Lukáš M. 5
Authors‘ workplace:
Gastroenterologické oddělení, Nemocnice České Budějovice, a. s.
1; Interní klinika 1. LF UK a ÚVN Praha
2; Ústav farmakologie, 1. LF UK, Praha
3; Zdravotně sociální fakulta, Jihočeská univerzita v Českých Budějovicích
4; Klinické a výzkumné centrum pro střevní záněty, Klinické centrum ISCARE a. s. a 1. LF UK v Praze
5; ResTrial GastroEndo s. r. o., Praha
6; IV. interní klinika 1. LF UK a VFN v Praze
7; Klinika hepatogastroenterologie, IKEM, Praha
8; Oddělení patologie, FN Královské Vinohrady, Praha
9; Centrum péče o zažívací trakt, Nemocnice AGEL Ostrava-Vítkovice a. s.
10; Beskydské Gastrocentrum, Interní oddělení, Nemocnice ve Frýdku-Místku, p. o.
11; Oddělení gastroenterologie, Krajská nemocnice Liberec, a. s.
12; Oddělení gastroenterologie, I. interní klinika FN Plzeň
13; Interní gastroenterologická klinika LF MU a FN Brno
14; Interní klinika 3. LF UK a FTN, Praha
15; Chirurgické oddělení, Nemocnice Hořovice
16; II. interní klinika LF UK a FN Hradec Králové
17; Oddělení gastroenterologie, Krajská zdravotní, a. s. – Masarykova nemocnice v Ústí nad Labem, o. z.
18; Oddělení gastroenterologie, Nemocnice Na Homolce, Praha
19
Published in:
Gastroent Hepatol 2022; 76(1): 13-28
Category:
doi:
https://doi.org/10.48095/ccgh202213
Úvod
Ulcerózní kolitida (UC) je chronické zánětlivé onemocnění postihující tlusté střevo v různém rozsahu od konečníku orálním směrem. Jeho příčina není známa, a většina pacientů proto vyžaduje dlouhodobou, mnohdy celoživotní medikamentózní léčbu a trvalé sledování. Cílem léčby je potlačení symp - tomů, eliminace zánětlivé aktivity ve sliznici střeva a normalizace kvality života postiženého jedince [1].
Výskyt UC v České republice stoupá, podobně jako je tomu v případě Crohnovy choroby [2]. Ačkoli statistická data neprokazují zvýšenou úmrtnost pacientů s UC, jde o onemocnění závažné [3]. V závislosti na aktivitě zánětu, efektivitě a toleranci léčby, délce trvání nemoci a výskytu komplikací ovlivňuje UC rodinný, profesní, partnerský i sociální život pacientů. Včasná a správná diagnostika tohoto onemocnění je proto nezbytným základem pro podání účinné léčby a snížení rizika dlouhodobých nepříznivých důsledků nemoci pro život pacientů.
V České republice je diagnostika a léčba UC v rukou specialistů – gastroenterologů. Od roku 1996 působí v rámci České gastroenterologické společnosti Pracovní skupina pro idiopatické střevní záněty (PS IBD), mezi jejíž dlouhodobé aktivity patří příprava doporučených postupů pro různé oblasti IBD. Většina z nich byla dosud věnována buď konkrétní skupině medikamentů používaných v léčbě střevních zánětů, nebo léčbě chirurgické. Ve shodě s aktuálním přístupem většiny odborných společností (ECCO, AGA) se však domníváme, že pro lékaře v běžné klinické praxi je výhodnější celkový pohled na dané onemocnění z hlediska jeho diagnostiky i léčby.
Problematika IBD doznala v posledních 20–30 letech významných změn, které se týkají především léčby těchto onemocnění [4]. Konvenční medikamentózní léčba je stále základem terapie u většiny pacientů s UC, tito nemocní proto obvykle zůstávají v péči ambulantních gastroenterologů. Těžší či komplikovaný průběh UC vede zpravidla k odeslání pacienta do specializovaného centra pro biologickou a inovativní léčbu IBD. Těchto pracovišť je v ČR již více než 30 a jejich počet dále narůstá. Je tedy zřejmé, že péči o pacienty s UC zajišťuje početná skupina lékařů, jejichž zkušenosti a erudice mohou být značně odlišné. Cílem předkládaných doporučení je tuto heterogenitu minimalizovat a nabídnout klinikům návod na diagnostický a léčebný postup u pacientů s UC odpovídající současnému stupni poznání.
Metodika
Při přípravě tohoto materiálu jsme postupovali podobně jako u předchozích doporučení: problematika byla rozdělena do několika okruhů, které byly zpracovány určenými členy Pracovní skupiny IBD. Ti vypracovali návrhy jednotlivých doporučení, které byly posléze diskutovány na jednáních Pracovní skupiny v červnu 2021 formou videokonference a prezenční formou v září 2021. Jednotlivé body doporučení byly přijímány jako konsenzuální stanovisko po schválení více než 70 % účastníků. V případě nedostatečného souhlasu pokračovala diskuze a příslušné stanovisko bylo upraveno tak, aby bylo dosaženo alespoň 70% shody. Pokud takové shody dosaženo nebylo, stanovisko bylo vyřazeno nebo nahrazeno novým. Při zpracování textu byla úroveň důkazů (EL – evidence level) v jednotlivých stanoviscích posouzena podle aktuální verze oxfordského Centra pro evidence-based medicine (OCEBM) z roku 2011 [5].
Vzhledem k tomu, že ve druhé polovině roku 2021 schválila Evropská léková agentura (EMA) dva nové léky pro terapii UC (ozanimod a filgotinib), byly oba zařazeny do těchto doporučení navzdory tomu, že v době vydání pro ně nejsou stanoveny indikační a úhradové podmínky Státním ústavem pro kontrolu léčiv. Ve stejné situaci se v době publikace těchto doporučení nachází ustekinumab. Ve všech případech ovšem platí, že takový lék je možno podat po schválení revizním lékařem příslušné zdravotní pojišťovny (dle § 16 zákona o veřejném zdravotním pojištění).
V důsledku velmi rychlého vývoje v oblasti idiopatických střevních zánětů se mohou některá předkládaná stanoviska v době jejich vydání již mírně odlišovat od aktuálního stavu poznání. Přesto věříme, že tato doporučení tvoří ucelený přehled o současných možnostech diagnostiky a léčby UC, který je v souladu s doporučeními publikovanými a prezentovanými v posledních letech na mezinárodních i domácích odborných fórech.
1. Diagnostika, diferenciální diagnostika a klasifikace
Symptomy
Stanovisko 1
Typickými symptomy aktivní UC jsou krvácení z konečníku, tenesmy, urgentní stolice a průjem. Časté jsou bolesti břicha, noční symptomy a únava. Intenzita obtíží obvykle koreluje s aktivitou a rozsahem zánětu ve střevě. U menší části pacientů se objevují mimostřevní projevy – axiální nebo periferní artropatie, episkleritida, uveitida, nodózní erytém nebo pyoderma gangrenosum. Nejzávažnější koincidující chorobou je primární sklerozující cholangitida (PSC) [EL5].
Ulcerózní kolitida je chronické zánětlivé onemocnění tlustého střeva, které postihuje stejně obě pohlaví a všechny věkové kategorie, nejčastěji je však diagnostikováno ve věku 20–40 let. V období aktivity jsou typickými symptomy krvácení z konečníku, tenesmy a průjem, intenzita průjmu obvykle souvisí s rozsahem zánětlivého postižení střeva. V klidové fázi (remisi) je pacient zpravidla bez obtíží, u části pacientů však mohou přetrvávat střevní symptomy (průjem, břišní diskomfort) i při absenci zánětlivé aktivity ve střevě. U pacientů s proktitidou malého rozsahu se může objevit zácpa. V 15 % případů je prvním projevem akutní těžká ataka UC projevující se bolestmi břicha, frekventní krvavou stolicí, horečkou a tachykardií. U většiny pacientů s UC je korelace mezi intenzitou obtíží a aktivitou zánětu velmi dobrá [6].
U 10–20 % pacientů s UC se objevují mimostřevní projevy zánětu. Nejčastěji jde o artritidu periferních kloubů (typ I – pauciartikulární, asymetrické postižení velkých kloubů akutní synovitidou, souvisí s aktivitou UC; typ II – polyartikulární, symetrické postižení malých kloubů ruky, nesouvisí s aktivitou UC) nebo axiální spondylartritidu. Kožní projevy v podobě nodózního erytému nebo pyoderma gangrenosum a projevy oční – episkleritida nebo závažnější uveitida jsou méně časté. Výskyt mimostřevních projevů je u pacientů s UC méně častý ve srovnání s Crohnovou chorobou, jejich přítomnost je obvykle signálem závažnějšího průběhu střevního zánětu [7]. Z prognostického hlediska je nejzávažnější koincidující chorobou PSC, která je významným rizikovým faktorem pro vznik cholangiokarcinomu a kolorektálního karcinomu [8].
Diagnostika
Stanovisko 2
Ke stanovení diagnózy UC je nezbytné zhodnotit anamnestické údaje a provést endoskopické vyšetření celého tlustého střeva s odběrem bioptických vzorků k histologickému vyšetření. Důležité je vyloučení infekční příčiny, změn vyvolaných léky, ischemií střeva nebo předchozím ozařováním. Vždy je nutno zvážit diagnózu Crohnovy choroby (CN). Iniciální laboratorní vyšetření krve a stolice je zaměřeno na posouzení zánětlivé aktivity, přítomnosti komplikací a důsledků zánětu na celkový stav pacienta [EL5].
Pro diagnózu UC je nezbytné posoudit nejen výše uvedené symptomy střevního zánětu, ale i další anamnestické údaje. Nejvýznamnějším rizikovým faktorem pro vznik UC je rodinná anamnéza IBD, zejména u prvostupňových příbuzných [9]. Je třeba odebrat cestovatelskou anamnézu, zjistit užívání léků v předchorobí (včetně volně prodejných, např. nesteroidních antirevmatik – NSA), zvážit možnost sexuálně přenosné infekce a změn vyvolaných přítomností divertiklů (tzv. segmentární kolitida asociovaná s divertikulózou – SCAD). U pacientů s předchozí aktinoterapií v oblasti malé pánve je častým projevem rektální krvácení. Riziko vzniku UC je mírně zvýšeno po ukončení kouření [10], naopak předchozí appendektomie pro appendicitidu se zdá být protektivní [11].
Laboratorní vyšetření v době diagnózy musí zahrnovat krevní obraz, základní biochemické parametry (minerály, ureu, kreatinin, transaminázy, alkalickou fosfatázu, gamaglutamyltransferázu, hladinu feritinu, C-reaktivní protein – CRP), vyšetření stolice (mikrobiologické kultivační vyšetření, fekální kalprotektin, antigen a toxin Clostridium difficile). Rutinní sérologické vyšetření perinukleárních protilátek proti cytoplazmě neutrofilů (pANCA) nebo protilátek proti Saccharomyces cerevisiae (ASCA) není pro diagnózu UC nezbytné, má okrajový význam v diferenciální diagnostice UC a CN [12].
Endoskopický obraz
Stanovisko 3
Pro diagnózu UC svědčí kontinuální zánětlivé změny na sliznici tlustého střeva od rekta orálním směrem, hranice mezi zánětlivou a normální sliznicí je obvykle ostrá. Charakteristickým nálezem je redukce až ztráta slizniční cévní kresby, erytém, hypersekrece hlenu, zvýšená kontaktní krvácivost přecházející v krvácivost spontánní, rozvoj drobných erozí a postupně i větších povrchových vředů [EL2].
Koloskopie je nejdůležitější vyšetření v diagnostice UC. Přestože diagnózu UC může odhalit i částečná koloskopie, pouze totální koloskopie může ověřit rozsah zánětu a posoudit případné změny v orální části tračníku a v terminálním ileu, které by mohly svědčit pro jiné onemocnění (např. CN). U dospělých pacientů s UC začínají zánětlivé změny již v anorektálním spojení, absence zánětu v rektu je vzácným nálezem, který je častější u dětí [13]. Velmi často se naopak setkáváme s nálezem periapendikulárního zánětlivého infiltrátu u pacientů s levostrannou UC [14], v praxi je tento nález často mylně interpretován jako projev CN. U léčených pacientů dochází k hojení zánětlivých změn, které se mohou stát diskontinuálními a vést rovněž k záměně s CN. V případě endoskopického nálezu stenózy je u pacientů s UC vždy nutno zvážit možnost neoplazie [15].
Histologický obraz
Stanovisko 4
Pro histologický obraz UC je typická bazální plazmocytóza, smíšený zánětlivý infiltrát v lamina propria mucosae (lymfocyty, plazmatické buňky, neutrofily), tzv. kryptitida a kryptové abscesy. Destrukce architektoniky slizničních krypt a deplece pohárkových buněk jsou projevem chronického zánětu a mohou přetrvávat i ve fázi remise [EL2].
Histologické vyšetření je důležitou součástí diagnostiky UC, jeho výsledek je však třeba hodnotit v kontextu ostatních nálezů a informací o pacientovi. Ke vstupnímu vyšetření by měly být odebrány vždy dva vzorky z jednotlivých etáží tlustého střeva a z terminálního ilea separátně do samostatných zkumavek [16]. Patolog by měl být informován o endoskopické aktivitě a lokalizaci každého vzorku, délce trvání nemoci a podávané léčbě. Typickým a časným histologickým nálezem je u pacientů s UC bazální plazmocytóza – přítomnost plazmatických buněk mezi bazemi krypt a slizniční svalovinou. Zánětlivý infiltrát následně postihuje sliznici v celé šíři, má smíšený charakter (lymfocyty, plazmatické buňky, neutrofily), zřídka zasahuje do povrchové vrstvy submukózy. Aktivitu zánětu vyjadřuje přítomnost neutrofilních leukocytů mezi epiteliálními buňkami krypt (tzv. kryptitida), popřípadě v lumen krypt (kryptové abscesy). Změny v architektonice krypt (nepravidelný průběh, větvení) jsou projevem chronického zánětu a jsou obvykle přítomny i ve stadiu klidovém (remise). Deplece pohárkových buněk a úbytek hlenu jsou nespecifickým, nicméně pomocným histologickým nálezem. S ohledem na důkazy o prospěšném vlivu histologického zhojení na další průběh UC považujeme za vhodné vyjadřovat histologický nález pomocí validovaného skóre (např. IBD-DCA nebo Nancy index) [16].
Klasifikace UC podle rozsahu
Stanovisko 5
Rozsah UC je definován jako maximální makroskopický rozsah zánětu verifikovaný koloskopickým vyšetřením. Podle rozsahu klasifikujeme UC jako proktitidu, levostrannou UC a extenzivní UC [EL5].
Pro stanovení rozsahu UC je nezbytné provedení totální koloskopie. Hranicí mezi proktitidou a levostrannou UC je vzdálenost 15 cm od anorektálního přechodu, levostranná kolitida nepřesahuje slezinné ohbí tračníku. Pokud zánětlivé změny dosahují orálně nad lienální flexuru, hovoříme o extenzivní UC. U třetiny až poloviny pacientů dochází v průběhu života k rozšíření zánětu na větší část tlustého střeva, tato extenze je významně častější u pacientů s počátkem nemoci v mladém věku [17].
Zhodnocení rozsahu UC má vliv na volbu léku i strategii léčby. Současně je důležitým faktorem pro rozhodnutí o zahájení dispenzárních koloskopických kontrol, které provádíme pouze u pacientů s levostrannou nebo extenzivní UC. U pacientů s proktitidou není riziko kolorektální neoplazie zvýšeno oproti běžné populaci [18].
Klasifikace UC podle aktivity
Stanovisko 6
Klinická a endoskopická klasifikace ovlivňují léčbu a sledování pacienta s UC [EL1]. V klinické praxi je vhodné používání endoskopického Mayo skóre, z klinických skórovacích systémů pak celkové nebo parciální Mayo skóre. U pacientů s vysokou aktivitou nebo fulminantním průběhem UC je vhodný index Truelova a Wittse nebo jeho modifikace – Montrealská klasifikace [EL5].
Vzhledem k tomu, že klinické projevy UC jsou relativně uniformní, jejich uspořádání do relevantního a klinicky využitelného skóre je podstatně jednodušší, než je tomu v případě CN. Nejen v klinických studiích, ale i v běžné klinické praxi je vhodným nástrojem endoskopické Mayo skóre, které je zároveň součástí celkového Mayo skóre [19]. Předností tohoto endoskopického indexu je jednoduchost a relativně nízká intra - a interindividuální variabilita, jeho nevýhodou je fakt, že nezohledňuje rozsah zánětu ve střevě. V kombinaci s klasifikací UC podle rozsahu je tato nevýhoda minimalizována. Novější alternativou endoskopického skóre je Ulcerative Colitis Endoscopic Index of Severity (UCEIS) [20]. Popisuje tři základní charakteristiky zánětu ve střevě – cévní kresbu, krvácení a přítomnost vředů nebo erozí. Tento index dobře koreluje s klinickými projevy a je validován, nicméně jde o index kompozitní a vyžaduje kalkulaci, byť poměrně triviální. Z tohoto důvodu je jeho implementace do běžné praxe obtížnější a většina pracovišť nadále využívá endoskopické Mayo skóre (tab. 1).
Tab. 1. Total Mayo score.
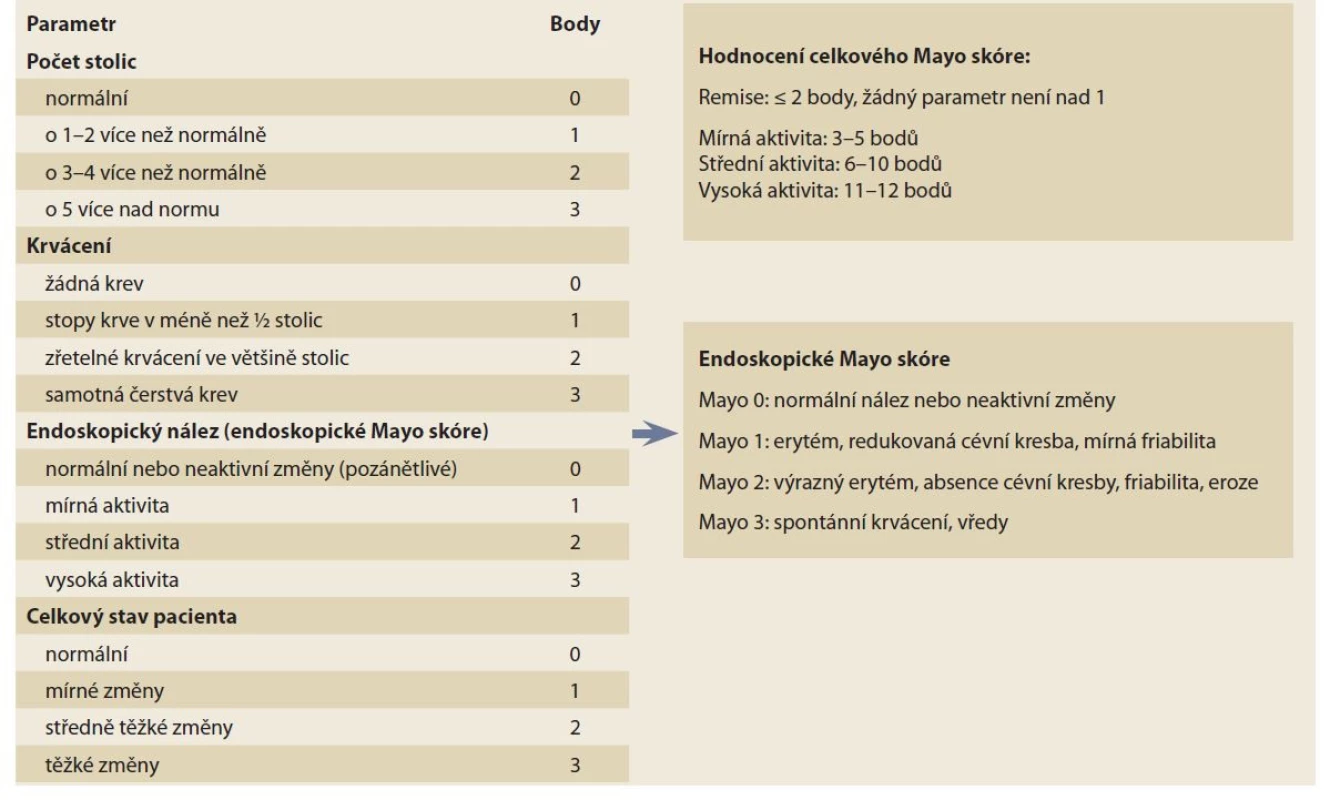
U pacientů s vysokou aktivitou UC je typická symptomatologie (krvavý průjem) doprovázená systémovou zánětlivou reakcí organizmu. Tento fakt dobře zohledňuje index Truelova a Wittse (tab. 2), který je vhodným nástrojem pro diagnostiku akutní těžké ataky UC [21]. Splnění podmínek – šest a více krvavých stolic denně – spolu s nejméně jedním parametrem systémového zánětu odpovídá diagnóze těžké ataky UC s nutností hospitalizace a zahájením tzv. záchranné terapie.
Tab. 2. Modified criteria for ASUC
diagnostics acording to Truelove
and Witts.

Biomarkery
Stanovisko 7
Klasické biochemické a hematologické markery zánětlivé aktivity (CRP, leukocyty) jsou u mírné a střední aktivity UC málo senzitivní, vhodné jsou v monitoraci akutní těžké ataky UC [EL5]. Koncentrace fekálního kalprotektinu dobře koreluje s endoskopickým nálezem a je také vhodným prediktorem hrozícího relapsu u pacienta v remisi [EL3].
Role biomarkerů v hodnocení zánětlivé aktivity UC je odlišná od CN. Až polovina pacientů s aktivní UC nemá zvýšené hladiny CRP, jehož senzitivita a negativní prediktivní hodnota jsou proto u pacientů s UC nízké [22]. Významnou roli má CRP pouze u pacientů s akutní těžkou atakou UC, obvykle nahrazuje hodnotu sedimentace erytrocytů v indexu Truelova a Wittse.
Fekální kalprotektin je vysoce senzitivním ukazatelem zánětlivé aktivity v tlustém střevu [23]. Je vhodný k iniciálnímu odlišení zánětlivého onemocnění a nezánětlivých chorob, např. dráždivého tračníku. Velmi dobře koreluje s endoskopickým nálezem, může být použit pro neinvazivní monitoring UC. Současně se ukázalo, že může být využíván i jako prediktor relapsu UC u nemocných v remisi. Vzestup hladiny kalprotektinu může předcházet až 2 měsíce klinický relaps zánětu.
2. Medikamentózní léčba
Terapeutické cíle
Stanovisko 8
U pacientů s UC je krátkodobým terapeutickým cílem symptomatická odpověď, střednědobým cílem je klinická remise a normalizace biomarkerů a dlouhodobým cílem je zhojení sliznice, normalizace kvality života a eliminace invalidity. Uvedených cílů by mělo být dosaženo bez dlouhodobé léčby systémovými kortikoidy [EL4].
Medikamentózní léčba je základem terapie UC. Jejím cílem je trvalá a hluboká (kompletní) remise, optimální kvalita života a minimalizace rizika invalidity. Terapeutické cíle ovšem musí reflektovat délku léčby, v tomto ohledu mezinárodní konsorcium STRIDE aktualizovalo své doporučení týkající se cílů léčby IBD z roku 2015 (STRIDE II) [24]. Součástí tohoto doporučení je také předpokládaná doba nezbytná k dosažení konkrétních terapeutických cílů pro jednotlivé lékové skupiny používané u pacientů s UC.
K dosažení terapeutických cílů je u většiny pacientů nezbytná trvalá medikamentózní léčba. Ukončení (přerušení) udržovací léčby lze zvážit v individuálních případech (lehký průběh, hluboká remise > 2 roky, proktitida-levostranná UC) [25]. I poté je vhodné pokračovat v klinických a laboratorních (fekální kalprotektin) kontrolách v intervalu 6–12 měsíců.
Zatímco pro CRP platí, že cílem léčby je normalizace tohoto biomarkeru, v případě fekálního kalprotektinu ukázala řada studií, že k normalizaci na hodnoty odpovídající zdravé populaci často nedochází ani při dosažení kompletního slizničního zhojení. Hranice „normy“ fekálního kalprotektinu se u pacientů s IBD pohybuje v rozmezí od 50 do 250 µg/g stolice [26]. Otevřenou otázkou zůstává také endoskopická remise, za kterou je mnoha autory považována kategorie 1 endoskopického Mayo skóre. Ta nicméně odpovídá minimálním zánětlivým změnám a „skutečnou“ remisi představuje pouze kategorie Mayo 0 [24,27]. Pro fekální kalprotektin i endoskopický nález ovšem platí, že v klinické praxi je často důležitější dynamika nálezu než absolutní hodnota biomarkeru nebo endoskopického nálezu.
a) Indukční léčba
Proktitida
Stanovisko 9
Topická forma mesalazinu ve formě čípku v dávce 1 g denně je první linií léčby proktitidy. Při nedostatečné terapeutické odpovědi je indikována léčba kombinací topického mesalazinu v dávce 1 g denně s perorálním mesalazinem v dávce 4 g denně, event. s topickými nebo systémovými kortikoidy [EL2].
Lokální mesalazin je účinnější než perorálně podávané aminosalicyláty nebo lokální kortikoidy [EL1].
Refrakterní proktitida je definována jako zánět neodpovídající na plnou dávku perorálních systémových kortikoidů. Další léčebnou možností jsou intravenózní kortikoidy, nebo biologika (preferenčně infliximab) [EL4].
Topický mesalazin je první linií léčby proktitidy. Čípky jsou vhodnější než nálevy, protože lépe distribuují léčivo na místo zánětu, léčba je tedy efektivnější a jsou pacienty lépe tolerovány. Topická léčba mesalazinem v dávce nad 1 g denně není spojena s vyšší účinností. Dávka 1× denně je stejně účinná jako rozdělená dávka, zvyšuje však adherenci pacientů k léčbě [28,29]. Topicky podávané aminosalicyláty jsou u proktitidy účinnější než perorálně podávané aminosalicyláty [30].
Kombinace perorální a topické formy mesalazinu je účinnější než samotná topická léčba a je indikována u pacientů s nedostatečnou terapeutickou odpovědí na lokální terapii [31]. Kombinace nebo střídání topického mesalazinu a topických steroidů je možností volby při selhání výše uvedené kombinované terapie.
Lokální mesalazin je účinnější než lokální kortikosteroidy v dosažení klinické, endoskopické a histologické remise [32]. Proto by lokální kortikosteroidy měly být podávány pacientům, kteří mají nedostatečnou odpověď na mesalazin nebo danou topickou léčbu netolerují.
Levostranná a extenzivní UC
Stanovisko 10
Mírná až středně aktivní UC by měla být léčena kombinovanou léčbou aminosalicylátovým klyzmatem v dávce ≥ 1 g/den v kombinaci s perorálním mesalazinem ≥ 4 g/den. Budesonid MMX 9 mg/den lze zvážit u pacientů s mírnou až středně aktivní UC, kteří netolerují terapii aminosalicyláty nebo při ní relabují [EL2].
Kombinovaná léčba je účinnější než samotná perorální nebo lokální léčba aminosalicyláty nebo kortikoidy. Podávání mesalazinu v jedné denní dávce je stejně účinné ve srovnání s rozděleným dávkováním [EL1].
Systémové kortikosteroidy v dávce 1 mg prednisonu/1 kg hmotnosti jsou vhodné u pacientů se středně těžkou až těžkou aktivitou a u pacientů s mírnou aktivitou, kteří nereagují na léčbu mesalazinem nebo budesonidem MMX [EL1].
Kombinovaná perorální a topická léčba mesalazinem je léčbou první linie pro mírně až středně aktivní levostrannou a extenzivní UC. Kombinovanou léčbou je dosaženo časnější remise ve srovnání se samostatně podávaným mesalazinem [33].
Perorálně podávaný mesalazin není účinnější než perorální sulfasalazin, mesalazin je ale pacienty lépe tolerován. Není rozdíl v účinnosti mesalazinu podávaného jednou denně nebo ve více denních dávkách, jedna denní dávka však zlepšuje adherenci pacientů k léčbě [34]. Subanalýza randomizované studie navíc prokazuje vyšší účinnost granulátu mesalazinu podávaného v dávce 3 g jednou denně vs. dávka 3 x 1 g [35]. Dávky > 2 g denně vedou k remisi časněji než dávky nižší, pacienti se středně aktivním onemocněním mohou profitovat z dávky 4–4,8 g/den [36]. Metaanalýza několika studií prokazuje vyšší účinnost mesalazinu ve formě perorálního granulátu ve srovnání s tabletami s pH dependentním obalem [37].
U pacientů, u nichž je léčba mesalazinem neúčinná, je indikován MMX budesonid v dávce 9 mg denně, opět v kombinaci s rektální formou mesalazinu. Pokud nedojde k odpovědi na tuto léčbu během 2–4 týdnů, jsou indikovány systémové kortikosteroidy – prednison 1 mg/kg denně (nebo ekvivalent). Stejná léčba, tedy prednison 1 mg/kg denně, je nutná v terapii vysoce aktivní UC. Postupná redukce systémových kortikosteroidů začíná po 1–2 týdnech od zahájení léčby v závislosti na odpovědi, celková délka podávání by neměla překračovat dobu 3–4 měsíců.
Kortikodependence nebo neúčinnost systémových kortikosteroidů jsou indikací k podání biologické léčby, tofacitinibu, ozanimodu nebo filgotinibu [38–40].
Kortikodependentní UC
Stanovisko 11
Pacienti s kortikodependentním průběhem nemoci by měli být léčeni thiopuriny [EL2], anti-TNFa preparáty (infliximab preferenčně v kombinaci s thiopuriny) [EL1], vedolizumabem, tofacitinibem, ustekinumabem, ozanimodem nebo filgotinibem [EL3]. V případě selhání léčby následuje léčba druhé linie jiným anti-TNFa preparátem, vedolizumabem, tofacitinibem, ustekinumabem, ozanimodem nebo filgotinibem, event. je třeba zvážit kolektomii [EL5].
Za kortikodependentní považujeme takový průběh onemocnění, kdy dávku prednisonu nelze snížit < 10 mg/den během 3 měsíců od zahájení léčby nebo dojde k relapsu UC do 3 měsíců od ukončení léčby systémovými kortikoidy [41]. Azathioprin je v této situaci lékem volby, pokud jej pacient toleruje a není kontraindikován. Léčba systémovým kortikoidem a azathioprinem se musí překrývat do doby nástupu účinku azathioprinu (3–6 měsíců). Remise bez kortikoidů je při léčbě azathioprinem popisována v 55 %, 52 % a 45 % v 12., 24. a 36. týdnu [42].
Všechny dostupné anti-TNFa preparáty jsou efektivní v dosažení a udržení remise bez kortikosteroidů u pacientů, kteří v úvodu kortikosteroidy dostávali [43]. Obdobné výsledky byly potvrzeny i u druhé generace biologik – vedolizumabu a ustekinumabu [44,45], stejně jako v případě malé molekuly – tofacitinibu [46]. Nejnovějšími léky schválenými Evropskou lékovou agenturou pro léčbu UC jsou ozanimod, agonista receptoru pro sfingosin-1-fosfát (S1P), který sekvestruje aktivované lymfocyty v lymfatických uzlinách mimo oblast zánětu [47], a filgotinib [48], selektivní inhibitor Janusovy kinázy 1 (JAK-1). Porovnání účinnosti jednotlivých biologik a malých molekul je možné pouze formou tzv. síťové metaanalýzy, nebo observačních kohortových studií s použitím tzv. „propensity score matching“ studijních populací, přímé srovnávací studie (tzv. head-to-head studie) chybí. Výjimkou je studie Varsity, která porovnávala efektivitu vedolizumabu a adalimumabu u pacientů se středně a vysoce aktivní UC [49]. Vedolizumab byl efektivnější v dosažení klinické remise a endoskopického zlepšení po 1 roce léčby, hodnocení klinické remise bez kortikoidů vyznělo lépe pro adalimumab.
Kortikorefrakterní UC
Stanovisko 12
U pacientů s aktivní UC refrakterní na perorální kortikosteroidy je nutno vyloučit infekční komplikace (cytomegalovirus a Clostridium difficile) [EL5]. V další léčbě jsou vhodné intravenózně podávané kortikosteroidy nebo anti-TNFa preparáty, vedolizumab, tofacitinib, ustekinumab, ozanimod nebo filgotinib [EL3]. Druhá léčebná linie zahrnuje jiný anti-TNFa preparát, vedolizumab, tofacitinib, ustekinumab, ozanimod nebo filgotinib. Měli bychom zvažovat i kolektomii [EL5].
U pacientů s aktivní UC refrakterní na perorální kortikosteroidy bychom měli vyloučit především infekční komplikace – cytomegalovirovou (CMV) infekci a infekci Cl. difficile. K detekci CMV slouží běžný bioptický vzorek fixovaný ve formolu, ideálně odebraný z okraje vředu [50].
U pacientů refrakterních k perorálním kortikosteroidům je možnost podání intravenózních kortikosteroidů. Nevýhodou je nutnost hospitalizace a vznik časné kortikodependence téměř u poloviny pacientů [51].
Všechny anti-TNFa preparáty, vedolizumab, ustekinumab a tofacitinib prokázaly benefit u pacientů užívajících v úvodu kortikosteroidy. Stejně tomu bylo ve studiích s novými perorálními léky – ozanimodem a filgotinibem. Všechny studie zahrnovaly též pacienty refrakterní na kortikosteroidy, ovšem nebylo vždy možné odlišit, kteří pacienti byli kortikodependentní a kteří refrakterní [43–48].
UC refrakterní na imunosupresiva (včetně intolerance)
Stanovisko 13
Pacienti s aktivní UC refrakterní na thiopurinová imunosupresiva nebo ti, kteří thiopuriny netolerují, by měli být léčeni anti-TNFa preparáty ([EL1], vedolizumabem, tofacitinibem, ustekinumabem, ozanimodem nebo filgotinibem [EL3]. Druhá léčebná linie zahrnuje jiný anti-TNFa preparát, vedolizumab, tofacitinib, ustekinumab, ozanimod nebo filgotinib. Měli bychom zvažovat i kolektomii [EL5].
Neúčinnost nebo intolerance thiopurinů je u pacientů s UC jednou z hlavních indikací k podání biologické léčby nebo inovativních malých molekul [38,43]. Infliximab, adalimumab, golimumab, vedolizumab i ustekinumab prokázaly efektivitu u pacientů refrakterních na thiopuriny. Lze použít i tofacitinib, ozanimod nebo filgotinib [43–48].
b) Udržovací léčba
Aminosalicyláty
Stanovisko 14
Aminosalicyláty jsou vhodné k udržovací léčbě u pacientů s mírnou a středně těžkou UC, u nichž byla remise navozena aminosalicyláty, budesonidem a výjimečně i systémovými kortikoidy (první ataka, dlouhý interval mezi relapsy) [EL1]. Rektální formy jsou vhodné u distálních forem UC při dobré toleranci léčby, kombinovaná léčba mesalazinem (orální a rektální) je vhodná při nedostatečném efektu monoterapie [EL1].
Optimální dávka mesalazinu v udržovací léčbě je 2 g denně nebo více v jedné denní dávce. U pacientů s častými relapsy (> 3/rok) a extenzivní UC mohou být efektivnější vyšší dávky. Minimální udržovací dávka rektální formy mesalazinu jsou 3 g týdně [EL1].
Data z Cochranovy databáze ukazují, že udržovací léčba perorálními aminosalicyláty snižuje riziko relapsu přibližně o 30 % oproti placebu [52]. Rovněž rektální forma mesalazinu je účinná v udržovací léčbě proktitidy nebo proktosigmoiditidy. Efektivita udržovací léčby může být významně snížena non-adherencí pacienta, její hodnocení je proto nutnou součástí léčebného režimu. Podávání léku v jedné dávce zlepšuje adherenci ve srovnání s více denními dávkami, současně je bezpečné a účinné. Při udržovací léčbě 5-ASA je doporučena kontrola renálních funkcí 1× ročně [53].
Thiopuriny
Stanovisko 15
Indikací k podávání thiopurinů je intolerance nebo nedostatečný efekt aminosalicylátů [EL5] v udržovací léčbě UC a kortikodependence [EL2]. Výjimečně jsou thiopuriny vhodné k udržení remise navozené cyklosporinem [EL3]. Doporučená dávka je 2–2,5 mg/kg AZA a 1–1,5 mg/kg 6-MP. Thiopuriny nejsou vhodné u pacientů starších 60 let, nemocných s anamnézou malignity a pacientů EBV (virus Epsteina a Barrové) negativních, zejména mladých mužů [EL5].
Azathioprin je efektivní v udržovací léčbě UC u pacientů kortikodependentních i pacientů netolerujících mesalazin; relativní riziko pro udržení remise je 1,59 ve srovnání s placebem [1]. Thiopuriny nemají žádný efekt v indukční fázi léčby, vzhledem k pomalému nástupu jejich účinku je proto nezbytné jejich současné podávání s účinnou indukční léčbou do doby nástupu jejich účinku. Thiopuriny zvyšují riziko lymfoproliferativních onemocnění (zejména non-hodgkinských lymfomů), nejvyšší absolutní riziko je u pacientů starších 65 let [54] Vzhledem k potřebě jejich dlouhodobého podávání nedoporučujeme zahajovat léčbu u pacientů ve věku 60 let a starších. Ukončení léčby thiopuriny u pacientů, kteří dosáhnou věku 60 let, je třeba zvážit individuálně, riziko relapsu v následujících 5 letech se pohybuje kolem 30 % [55]. Thiopuriny zvyšují také riziko nemelanomových nádorů kůže, proto jsou u těchto pacientů doporučeny pravidelné dermatologické kontroly. Podání thiopurinů není vhodné u mladých mužů EBV séronegativních z důvodu zvýšeného rizika tzv. postmononucleosis lymfomu [56].
Probiotika
Stanovisko 16
Probiotická léčba E. coli kmen Nissle 1917 je vhodná jako udržovací terapie u pacientů s lehkou formou UC, kteří netolerují aminosalicyláty. Doporučená dávka je 200 mg denně [EL2].
Randomizované, kontrolované studie prokázaly, že probiotikum E. coli kmen Nissle 1917 není v udržovací léčbě lehké formy UC méně účinný ve srovnání s mesalazinem [57–59]. Tato léčba je proto indikována u pacientů, kteří v této indikaci netolerují perorální formu mesalazinu.
Biologická a inovativní léčba
Stanovisko 17
Udržovací léčba anti-TNF protilátkami, vedolizumabem, ustekinumabem, tofacitinibem, ozanimodem nebo filgotinibem je vhodná u pacientů, u nichž byla odpověď nebo remise navozena příslušným lékem [EL2].
Pro všechna biologika i malé molekuly používané v terapii UC platí, že pacienti, kteří odpoví na indukční fázi léčby, by měli pokračovat v udržovací léčbě stejným lékem. Data vycházejí především z randomizovaných, kontrolovaných studií, ale i z velkého počtu kohortových studií [1,43–48].
Vzhledem k omezenému počtu biologik a inovativních léků pro terapii UC je nezbytné maximálně využít potenciál každého použitého léku dříve, než dojde ke změně léčby. Nejčastějším způsobem optimalizace léčby je její intenzifikace, k níž, v závislosti na konkrétní situaci, přistupujeme u třetiny až poloviny léčených [60].
Protilátky proti TNF
Stanovisko 18
Základní dávkovací schémata pro anti-TNF protilátky jsou vhodná při dosažení remise indukční léčbou. Pokud není dosaženo remise nebo v případě sekundární ztráty odpovědi, je vhodná intenzifikace léčby nebo změna léku. V případě anti-TNF protilátek je vhodné v takové situaci využít farmakokinetických parametrů (hladina léku, přítomnost protilátek) [EL5].
Randomizované kontrolované studie i studie kohortové potvrzují účinnost infliximabu, adalimumabu i golimumabu v udržovací léčbě UC. Metaanalýza deseti kontrolovaných, randomizovaných studií prokázala účinnost anti-TNF protilátek v udržení klinické remise, klinické remise bez kortikosteroidů a zlepšení kvality života pacientů s UC [1]. Při udržovací léčbě infliximabem je možno zvážit změnu z intravenózní formy na subkutánní infliximab.
Množství retrospektivních studií potvrzuje vztah mezi hladinou biologika (anti-TNF protilátky) a klinickým efektem u pacientů s UC [61]. Přestože mezinárodní odborné společnosti nejsou ve svých doporučeních jednotné, převažující odborný názor akceptuje farmakokinetické monitorování jako efektivní nástroj při léčbě UC. Doporučujeme proto, aby všechna pracoviště, kde jsou podávány anti-TNF protilátky pacientům s UC, měla možnost měřit hladiny léčiv, případně koncentrace protilátek proti nim v séru. Na základě aktuálního konsenzu skupiny odborníků [61] doporučujeme stanovit hladiny anti-TNF protilátek, případně protilátek proti lékům v těchto situacích:
u respondérů na konci indukční fáze;
alespoň 1x v průběhu udržovací léčby;
v případě primární neodpovídavosti;
u pacientů se sekundární ztrátou odpovědi.
V případě infliximabu by minimální koncentrace v týdnu 6 měla dosáhnout 15–20 µg/ml, v týdnu 14 a během udržovací léčby 5–10 µg/ml. U pacientů s aktivní UC bychom neměli léčbu infliximabem ukončit, dokud nedosáhneme intenzifikací hladiny 10–15 µg/ml. Intenzifikace zahrnuje zkrácení intervalu až na 4 týdny a zvýšení dávky až na 10 mg/kg [61].
Minimální koncentrace adalimumabu v týdnu 4 a v průběhu udržovací léčby by měla být 8–12 µg/ml. U pacientů s aktivní UC by léčba neměla být ukončena, dokud nedosáhneme intenzifikací hladiny 10–15 µg/ml. Intenzifikace zahrnuje zkrácení intervalu na 1 týden, případně navýšení dávky na 80 mg v intervalu 2 týdnů [61].
Antiintegriny, antiinterleukiny, malé molekuly
Stanovisko 19
Udržovací léčba vedolizumabem, ustekinumabem, tofacitinibem, ozanimodem a filgotinibem je vhodná při dosažení odpovědi nebo remise indukční léčbou [EL2]. V případě ztráty odpovědi je vhodná intenzifikace léčby vedolizumabem a tofacitinibem. Při léčbě ustekinumabem lze v takové situaci zvážit intenzifikaci nebo opakování indukční dávky [EL5]. V případě ozanimodu a filgotinibu nejsou dosud k dispozici data týkající se případné intenzifikace.
Stejně jako v případě anti-TNF protilátek také pro vedolizumab, ustekinumab, tofacitinib, ozanimod a filgotinib platí, že při dosažení pozitivní odpovědi na indukční léčbu je vhodné pokračovat v udržovací terapii stejným lékem. Potvrzují to randomizované kontrolované studie i studie kohortové [1,43–48]. V udržovací léčbě vedolizumabem je možno zvážit změnu na subkutánní vedolizumab.
Ve srovnání s anti-TNF protilátkami je k dispozici jen omezené množství dat týkajících se farmakokinetického monitorování. Z tohoto důvodu je vhodné u pacientů se sekundární ztrátou odpovědi zvážit možnost intenzifikace léčebného režimu vedolizumabu, ustekinumabu a tofacitinibu bez ohledu na hladiny léčiv v séru [61]. V případě ozanimodu a filgotinibu není k dispozici dostatek dat.
V případě vedolizumabu je možno při ztrátě odpovědi zkrátit aplikační interval až na 4 týdny [62], při léčbě tofacitinibem pak navýšit dávku na 2 x 10 mg p. o. [63]. Při léčbě ustekinumabem omezená data potvrzují příznivý efekt intenzifikace léčby v podobě zkrácení intervalu na 4–6 týdnů, případně v kombinaci s reindukční dávkou i.v. Tento efekt je výraznější u pacientů se sekundární ztrátou odpovědi ve srovnání s pacienty s nedostatečným efektem indukční léčby [64]. Ozanimod a filgotinib jsou nové léky a spolehlivá data opravňující k intenzifikaci léčby zatím nejsou k dispozici.
Telemedicína
Stanovisko 20
Při dlouhodobém sledování a léčbě pacientů s UC je vhodné využít nástrojů telemedicínského monitoringu [EL4].
Všeobecná dostupnost elektronických komunikačních prostředků vedla k intenzivnímu výzkumu možností telemedicíny v populaci pacientů s IBD. Řada studií prokazuje, že tento způsob sledování je bezpečný, efektivní a ekonomicky přínosný [65,66]. Optimální postavení telemedicíny v systému péče o pacienty s UC bude vyžadovat další výzkum a vývoj příslušných aplikací. V případě dostupnosti ověřeného a zdravotnickým systémem akceptovaného nástroje (aplikace) doporučujeme využití telemedicíny zejména u pacientů s mírným a středně těžkým průběhem UC.
Duální terapie
Stanovisko 21
Duální terapie dvěma biologickými léky nebo kombinací JAK inhibitoru s biologikem je v ojedinělých případech variantou medikamentózní léčby UC u pacientů neodpovídajících veškerou dostupnou biologickou či inovativní léčbu v monoterapii [EL5].
Duální terapií rozumíme současné použití dvou biologik nebo biologika a malé molekuly (např. tofacitinibu). V klinické praxi je nejčastějším důvodem ke zvážení takové léčby aktivní střevní zánět nebo závažné mimostřevní projevy nereagující na jinou monoterapii. Vychází z představy vzájemně se doplňujícího mechanizmu účinku, který pokryje širší spektrum patogenetických mechanizmů, než je tomu při použití jednoho léku.
Recentní metaanalýza 30 kohortových studií a kazuistických sérií (pacienti s UC tvořili čtvrtinu pacientů) potvrdila dosažení klinické remise u 59 % a endoskopické remise u 34 % pacientů, většího efektu bylo dosaženo u pacientů léčených pro mimostřevní projevy IBD [67]. Nežádoucí účinky se vyskytly u 31 % a závažné nežádoucí účinky u 6,5 % pacientů. Nejčastější byly kombinace vedolizumabu s anti-TNF protilátkou nebo ustekinumabem. Recentní česká práce zahrnula celkem 25 pacientů s IBD, 8 z nich s UC [68]. Účinnost duální léčby byla zřetelně vyšší právě ve skupině pacientů s UC, ve 30. týdnu odpovědělo 80 % léčených. Cena léčby ovšem dosahovala 5–8násobku terapie samotnou anti-TNF protilátkou. Duální léčbu lze v současnosti považovat za výjimečnou variantu medikamentózní léčby u pacientů neodpovídajících na veškerou dostupnou biologickou či inovativní léčbu v monoterapii.
3. Dispenzarizace pacientů
Indikace k dispenzarizaci
Stanovisko 22
Pacienti s levostrannou a extenzivní UC mají vyšší riziko vzniku kolorektálního karcinomu. Rizikovými faktory jsou délka trvání UC, rozsah postižení, přítomnost chronických zánětlivých a morfologických změn (stenóza, tubulární tračník), koincidující primární sklerozující cholangitida a rodinná anamnéza KRK [EL2]. Dispenzární program je vhodné zahájit 8 let od začátku symptomů onemocnění [EL5].
Zvýšené riziko kolorektální neoplazie je všeobecně známým faktem u pacientů s levostrannou a extenzivní UC, naproti tomu pacienti s proktitidou zvýšené riziko nemají. Hlavní rizikové faktory – délka trvání a rozsah UC, těžké morfologické změny jako projev dlouhodobě perzistující aktivity zánětu, primární sklerozující cholangitida a rodinná anamnéza kolorektálního karcinomu, zejména v prvním stupni příbuzenství a u osoby mladší 50 let, jsou jednoznačným důvodem k zařazení do dispenzárního programu prevence kolorektální neoplazie. Pacient by měl být do tohoto programu zařazen 8 let od vzniku prvních symptomů onemocnění, nikoli od data stanovení diagnózy [6,56].
Způsob provádění dispenzárních kontrol
Stanovisko 23
Základem je koloskopické vyšetření přístrojem s vysokým rozlišením s využitím chromoendoskopie, event. virtuální chromoendoskopie [EL3]. Dysplastické léze dělíme na endoskopicky viditelné (polypoidní a nepolypoidní) a endoskopicky neviditelné (detekce v náhodné biopsii). Pokud je léze endoskopicky kompletně odstranitelná, lze pokračovat v dispenzárních koloskopiích, pokud odstranitelná není, je indikována kolektomie [EL5]. Dispenzární koloskopie by měla být prováděna v době endoskopické remise zánětu a na adekvátně vybavených endoskopických pracovištích se zkušeností s tímto programem [EL5].
Koloskop s vysokým rozlišením spolu s klasickou nebo virtuální chromoendoskopií jsou základní nástroje k provádění dispenzárních kontrol. Možnost využít pro dispenzární program i virtuální chromoendoskopii (Narrow Band Imaging, i-Scan, FICE) ukázala recentní metaanalýza, v níž nebyl zjištěn rozdíl mezi klasickou chromoendoskopií s využitím indigokarmínu nebo metylenové modři a různými nástroji virtuální chromoendoskopie [69]. Přestože někteří autoři doporučují kombinovat cílené biopsie s náhodnými biopsiemi ve čtyřech kvadrantech u vysokorizikových pacientů (např. s koincidující PSC), ve shodě s doporučením ECCO považujeme za dostačující bioptické vyšetření viditelných lézí [6].
Mezinárodní konsenzus SCENIC upravil dříve nepřehlednou klasifikaci dysplastických lézí, které nyní dělíme na dva základní typy: endoskopicky viditelné a neviditelné, u prvního typu dále rozlišujeme léze polypoidní a nepolypoidní [70]. Terapie spočívá v endoskopické resekci léze; je-li kompletní, může pacient pokračovat v endoskopických kontrolách, inkompletní resekce léze s jakýmkoli stupněm dysplazie by měla vést k chirurgické léčbě.
Dispenzární koloskopie by měly být prováděny v době endoskopické remise, kdy je minimalizováno riziko záměny neoplastických a zánětlivých změn, a to v následujících intervalech:
1 rok: pacienti s koincidující PSC, slizniční dysplazií v posledních 5 letech, extenzivní UC se strukturálními změnami a rodinnou anamnézou kolorektálního karcinomu (KRK) u prvostupňového příbuzného mladšího 50 let;
2–3 roky: pacienti s extenzivní UC s převažující mírnou nebo střední aktivitou, pozánětlivými polypy nebo příbuzenství osoby s KRK ve věku nad 50 let;
5 let: ostatní pacienti, kteří nemají žádný z výše uvedených rizikových faktorů [71].
U všech pacientů s levostrannou a extenzivní UC je vhodné využít chemopreventivního efektu mesalazinu. Minimální dávka účinná v chemoprevenci je 1,2 g denně [6].
4. Speciální situace
4.1. Gravidita a laktace
a) Diagnostika a monitoring UC v graviditě a laktaci
Stanovisko 24
Kombinace klinického vyšetření lékařem a stanovení hodnoty FC je vhodná metoda monitorování aktivity UC v graviditě. Abdominální ultrasonografie a magnetická rezonance bez intravenózního gadolinia jsou nejbezpečnější zobrazovací techniky pro diagnostiku u těhotných žen, u nichž je známa nebo suspektní diagnóza IBD, bez ohledu na trimestr [EL5].
Endoskopie prováděná v graviditě je považována za bezpečnou. Vyšetření by mělo být provedeno pouze tehdy, pokud existuje jasná indikace a výsledek vyšetření je nezbytný pro další terapeutický postup. Flexibilní sigmoidoskopie bez přípravy je preferována a je možno ji provádět v jakémkoli trimestru, optimálně v poloze na levém boku a po konzultaci s porodníkem. Periprocedurálně je třeba monitorovat přítomnost srdečních ozev plodu [EL5].
K event. analgosedaci je třeba použít léky, které mají prokázanou bezpečnost v graviditě s použitím minimální dávky, která dosáhne dostatečného účinku [EL5].
S ohledem na průměrný věk pacientek s IBD je gravidita v této skupině častou situací. UC samotná nesnižuje fertilitu pacientek, snížena může být jejich fekundita v důsledku adhezí po předchozích chirurgických výkonech (např. konstrukce ileálního pouche). Fertilita však zůstává obvykle zachována, početí je možné např. formou asistované reprodukce. Pacientky s UC by měly graviditu plánovat, v době koncepce by měla být pacientka ve stadiu remise UC. Pokud je střevní zánět v době početí aktivní, zvyšuje se riziko nepříznivého průběhu a výsledku gravidity. U malé části pacientek se UC manifestuje v graviditě poprvé, často v podobě těžké akutní ataky [72].
Při sledování gravidních pacientek s UC preferujeme neinvazivní metody – klinické vyšetření, stanovení koncentrace fekálního kalprotektinu, případně břišní ultrazvuk. Endoskopické vyšetření by mělo být prováděno pouze v případě, že jeho výsledek může významným způsobem ovlivnit další léčbu pacientky. Optimální metodou je flexibilní sigmoidoskopie tenkým endoskopem (pediatrický koloskop, gastroskop), prováděná u pacientky ležící na levém boku [73–75]. Je-li nutná totální koloskopie, je vhodná konzultace porodníka a přítomnost anesteziologa k zajištění bezpečné sedace pacientky.
b) Medikamentózní léčba UC v graviditě a laktaci
Stanovisko 25
Efektivní udržovací léčba UC před koncepcí by měla pokračovat i v průběhu gravidity, její ukončení nebo redukce může vést k relapsu nemoci. Akutní relaps UC v graviditě představuje vysoké riziko pro vývoj gravidity a plodu a je třeba ho adekvátně a bez odkladu léčit [EL3]. Většina léků užívaných k léčbě UC představuje nízké riziko pro průběh gravidity. V případě akutního relapsu UC jsou doporučovány 5-ASA nebo kortikosteroidy, v indikovaných případech anti-TNF preparáty [EL3].
Pokud pacientka otěhotní v průběhu terapie anti-TNF protilátkou, je doporučeno pokračovat v této léčbě po celou dobu gravidity. V určitých případech (plná remise onemocnění, nízké riziko relapsu) lze zvážit přerušení biologické léčby na konci druhého, nebo počátkem třetího trimestru a terapii obnovit po porodu [EL3].
Přestože medikamentózní léčba UC není spojena se závažným rizikem nežádoucích účinků pro plod nebo pro matku, má diagnóza střevního zánětu negativní vliv na reprodukční chování pacientů [76]. U pacientek s UC není gravidita důvodem k redukci nebo vysazení efektivní a dobře tolerované medikamentózní léčby. Takový postup zvyšuje riziko relapsu UC, a tím i riziko nepříznivého průběhu a výsledku gravidity (předčasný porod, nízká porodní hmotnost novorozence). Pokud dojde během těhotenství k relapsu UC, léčba by měla být stejná jako u negravidních pacientek – u lehké formy podáváme mesalazin, včetně kombinace s rektální formou, pokud ji pacientka toleruje. V ostatních případech obvykle volíme systémové kortikoidy v obvyklém dávkování, event. biologika – preferenčně infliximab. Dostupná data nesvědčí pro nepříznivý vliv anti-TNF protilátek na průběh gravidity nebo zdravotní stav novorozence [72,77].
Pacientky dlouhodobě léčené anti-TNF protilátkami by měly v graviditě v této léčbě pokračovat minimálně do konce druhého trimestru (týden 24–26), kdy je možno zvážit přerušení léčby u pacientek ve stabilizovaném stavu bez zvýšeného rizika relapsu. U pacientek s projevy aktivity UC nebo rizikem relapsu UC (např. při relapsu v předchozí graviditě) je vhodné léčbu anti-TNF protilátkami nepřerušovat [78].
Stanovisko 26
Data o léčbě vedolizumabem, ustekinumabem a tofacitinibem v průběhu těhotenství jsou omezená, v případě ozanimodu a filgotinibu chybí. Léčba vedolizumabem a ustekinumabem se v průběhu gravidity řídí stejnými pravidly jako léčba anti-TNF protilátkami. Léčba tofacitinibem není v graviditě doporučena, před jejím ukončením je však vždy nutno zvážit potenciální přínos a riziko pro matku a plod [EL3].
Léčba UC v průběhu laktace preparáty 5-ASA, kortikosteroidy, thiopuriny, anti-TNF, vedolizumabem či ustekinumabem představuje nízké riziko pro kojené děti [EL3]. Při léčbě tofacitinibem se kojení nedoporučuje [EL5]. Pro ozanimod a filgotinib nejsou potřebná data.
Vakcinace živými vakcínami u dětí exponovaných intrauterinně monoklonálním protilátkám (anti-TNF, vedolizumab, ustekinumab) by měla být odložena do doby vymizení léku z oběhu dítěte nebo do minimálního věku 6 měsíců. Vakcinace neživými vakcínami omezena není [EL5].
Data o léčbě antiintegrinovými a antiinterleukinovými protilátkami v graviditě jsou ve srovnání s informacemi o anti-TNF protilátkách omezená. Dosud publikované studie nicméně svědčí pro dobrou bezpečnost vedolizumabu i ustekinumabu pro matku i plod, bez zvýšeného výskytu komplikací u novorozenců. V případě ustekinumabu se zdá, že jeho farmakokinetika se neliší od anti-TNF protilátek – koncentrace ustekinumabu v krvi novorozence převyšuje koncentraci v krvi matky. Důvodem je aktivní transport léku proti koncentračnímu spádu ve třetím trimestru gravidity. Farmakokinetika vedolizumabu se však pravděpodobně liší a koncentrace léku v krvi novorozence jsou nižší než koncentrace v krvi matky [79]. Pro oba léky proto platí v graviditě stejná pravidla jako pro anti-TNF protilátky.
Ačkoli léčba tofacitinem není v graviditě vhodná vzhledem k nedostatku bezpečnostních dat, před jeho případným vysazením je nutno pečlivě zvážit potenciální benefit a riziko pro matku a plod. Současná data jsou omezena na kazuistické případy [80,81], poškození plodu však zatím popsáno nebylo. Na rozdíl od monoklonálních protilátek není léčba tofacitinem vhodná ani při kojení z důvodu vylučování léku do mateřského mléka.
Vakcinace dětí živými vakcínami je možná po vymizení léku, kterým byly léčeny matky v době těhotenství. V naprosté většině případů se tak stane do 6–9 měsíců od porodu. Alternativou je stanovení hladiny léku v krvi dítěte [72]. Neživé vakcíny lze podat bez omezení.
4.2. Vyšší věk
Stanovisko 27
Charakteristickým rysem UC diagnostikované ve vyšším věku (> 60 let) je mírnější průběh onemocnění a převážně levostranné postižení. Efektivita medikamentózní léčby se podstatně neliší od účinnosti u mladších pacientů, zvýšený důraz je kladen na prevenci nežádoucích účinků [EL5].
Podíl pacientů s IBD ve věku nad 60 let na celkové IBD populaci narůstá a v současnosti tvoří 25–30 %. Pacienti, u nichž byl střevní zánět diagnostikován v pokročilém věku, se vyznačují celkově mírnějším průběhem s převahou levostranné UC. Dalším specifikem této populace pacientů je širší diferenciální diagnostika a zvýšené riziko nežádoucích účinků léčby – zejména infekčních komplikací a malignit. Zvýšenou pozornost je proto třeba věnovat správné vakcinaci a screeningu nádorů [82,83].
Účinnost medikamentózní léčby není u starších pacientů s UC zásadně změněna. V terapii UC by měl dominovat mesalazin v obvyklém dávkování, je však třeba zohlednit často obtížnější aplikaci rektálních forem léků a riziko neúmyslné nonadherence z důvodu prostého zapomínání. Léčba systémovými kortikoidy je spojena s vyššími riziky ve srovnání s mladší populací, nezbytná je prevence osteoporózy a dalších komplikací (hypertenze, diabetes). Nevhodná jsou thiopurinová imunosupresiva z důvodu zvýšeného rizika lymfomů. Vyšší riziko komplikací, zejména infekčních, je spojeno i s aplikací protilátek proti TNF [82,83]. Vhodnou variantou může být vedolizumab nebo ustekinumab. Tofacitinib není vhodný u starších pacientů z důvodu zvýšeného rizika infekčních komplikací (Herpes zoster). V případě ozanimodu a filgotinibu nejsou potřebná data.
4.3. Léčba pacientů s anamnézou malignity
Stanovisko 28
Pacienti s osobní anamnézou malignity mají, bez ohledu na typ léčby, zvýšené riziko další malignity v podobě recidivy původní malignity anebo vzniku malignity de novo [EL2].
Aminosalicyláty, topické kortikosteroidy a krátkodobě podávané systémové kortikosteroidy jsou bezpečné u pacientů s předchozí malignitou [EL3]. Thiopuriny nejsou vhodné pro pacienty s anamnézou hematologické malignity, nemelanomového karcinomu kůže, karcinomu močových cest a případně HPV asociovaného karcinomu děložního čípku, a to s ohledem na jejich zvýšené riziko indukce těchto malignit. Z téhož důvodu by se neměla zahajovat anti-TNF terapie u pacientů s předchozím maligním melanomem, nevyjasněné je zatím riziko lymfomů [EL5].
Za bezpečnou léčbu u pacientů s UC a osobní anamnézou malignity lze považovat aminosalicyláty, topické a pravděpodobně i systémové kortikosteroidy při krátkodobém užívání [56]. V případě nutnosti imunosupresivní nebo biologické terapie je nutno zohlednit aktuální stav onkologického onemocnění, typ předchozí malignity a interval od ukončení onkologické léčby. Vždy je vhodná konzultace s onkologem. Preferována je monoterapie oproti kombinované imunosupresivní léčbě [56].
S ohledem na potenciál některých preparátů indukovat vznik specifického typu malignity je vhodné nezahajovat tuto léčbu u pacientů s určitým typem předchozí malignity. Jedná se o thiopuriny u pacientů s anamnézou hematologické malignity (lymfo - a myeloproliferativní), nemelanomového karcinomu kůže, karcinomu močových cest a HPV asociovaného karcinomu děložního čípku. Anti-TNF terapie není vhodná pro jedince s předchozím maligním melanomem; v případě lymfomu nejsou dosavadní data jednoznačná [56].
Na základě výsledků studií transplantovaných pacientů se z důvodu vysokého rizika recidivy malignity doporučuje oddálit zahájení imunosupresivní anebo systémové biologické terapie minimálně po dobu 2 let od ukončení onkologické léčby. U malignit se středním a vysokým rizikem recidivy je doporučený interval až 5 let. Preferována je monoterapie oproti kombinované imunosupresivně-biologické léčbě [84,85].
Vedolizumab se, s ohledem na jeho selektivní působení v trávicí trubici, zdá být z hlediska bezpečnosti optimálním biologickým preparátem u pacientů s maligním onemocněním mimo střevní trakt. V tomto případě není pravděpodobně nutná ani doporučovaná latentní doba od ukončení onkologické léčby.
Stanovisko 29
V případě potřeby pokračovat po diagnóze malignity v systémové imunosupresivní anebo biologické léčbě z důvodu IBD je vždy doporučena konzultace onkologa. U vedolizumabu lze vzhledem k absenci systémového efektu předpokládat dobrou bezpečnost i po diagnóze onkologického onemocnění lokalizovaného mimo gastrointestinální trakt [EL5].
Pokud dojde k relapsu IBD v průběhu onkologické léčby, jsou preferovaným lékem kortikosteroidy nebo vedolizumab, podle klinické situace. Nasazení systémové imunosupresivní anebo biologické léčby je nutno konzultovat s onkologem [EL5].
Onkologická léčba může vést jak k navození a udržení remise IBD u pacientů s aktivním střevní zánětem, tak i k relapsu nebo zhoršení IBD [EL5].
Po diagnóze malignity je doporučeno vysadit systémovou imunosupresivní anebo biologickou terapii. Pokračování v této léčbě lze zvážit u solidních nádorů, u kterých bylo možné kurativní chirurgické řešení bez nutnosti chemoterapie anebo radioterapie. Jinak je nutná konzultace onkologa [56,86].
Pokud dojde k relapsu IBD v průběhu onkologické léčby nebo je onemocnění aktivní již v době diagnózy malignity a je nutno zahájit imunosupresivní terapii, jsou preferovanou léčbou kortikosteroidy. U malignit lokalizovaných mimo gastrointestinální trakt je z hlediska bezpečnosti optimálním preparátem vedolizumab, a to z důvodu selektivního účinku v trávicím traktu. U střevních malignit je bezpečnost vedolizumabu s ohledem na jeho mechanizmus účinku nejasná. V případě neefektivity nebo intolerance předchozí terapie a potřeby systémově působící biologické léčby je nutná konzultace onkologa. Léčba thiopuriny není obecně vhodná u pacientů léčených chemoterapií, a to z důvodu možné myelosuprese vyvolané těmito preparáty [87].
4.4. Ileální pouch, komplikace a jejich léčba
Stanovisko 30
Pacienti s ileopouch-anální anastomózou (IPAA) by měli být sledováni na specializovaném pracovišti s adekvátními zkušenostmi [EL4].
Zánětlivé komplikace ileálního pouche zahrnují pouchitidu a cuffitidu, mezi nezánětlivé komplikace patří septické projevy (leak, absces, sinus), mechanické poruchy pouche, poruchy funkční a neoplazie [EL3]. Nejčastější příčinou selhání pouche jsou komplikace septické [EL3]. Pro zachování pouche je důležitá jejich včasná identifikace a diagnostika a adekvátní léčba.
Komplikace u pacientů po proktokolektomii s konstrukcí ileálního pouche zahrnují změny zánětlivé, chirurgické (septické), mechanické a funkční. Jejich výskyt je závislý na řadě faktorů, zejména na správné indikaci a technickém provedení výkonu, je významně nižší na pracovištích s vyšší frekvencí výkonů [6]. Nejčastější příčinou selhání pouche jsou septické komplikace – anastomotický leak, absces, sinus. Tyto komplikace se vyskytují přibližně u 10 % pacientů [88]. V případě časné septické komplikace je vhodné provedení ileostomie, drenáže, případně resutury defektu transanálním přístupem. Léčba pozdních komplikací zahrnuje drenáže abscesů a píštělí, dilatace případné stenózy, plastiku píštěle, event. ileostomii. Krajním řešením je reoperace s vytvořením nového pouche nebo exstirpace pouche s ponecháním ileostomie.
Stanovisko 31
Diagnóza pouchitidy je založena na přítomnosti symptomů a endoskopickém a histologickém nálezu [EL3]. Základem léčby akutní pouchitidy jsou antibiotika (ciprofloxacin a/nebo metronidazol), chronická pouchitida vyžaduje dlouhodobou léčbu antibiotiky, budesonidem nebo biologiky. Lékem první volby je v takovém případě infliximab, event. adalimumab [EL3].
Pouchitida se projevuje zvýšenou frekvencí řídkých stolic, tenesmy, inkontinencí, křečovitými bolestmi, teplotou a někdy i artralgiemi. Diagnostikujeme ji endoskopicky a histologicky. Lékem první volby je perorální ciprofloxacin v dávce 500 mg 2x denně minimálně po dobu 2 týdnů. Při nedostatečném účinku je vhodné přidat metronidazol 2 x 500 mg, při jeho intoleranci lze připravit magistraliter čípek s metronidazolem. Variantou metronidazolu může být rifaximin. V dalším kroku lze podat perorální budesonid, případně budesonid ve formě rektální pěny. Pouchitidu refrakterní na konvenční terapii léčíme biologiky, lékem první volby je infliximab. U pacientů se zvýšeným rizikem pouchitidy (těžký průběh UC, PSC) nebo po prodělané akutní atace lze doporučit probiotický koktejl VSL#3 k prevenci pouchitidy. Jen výjimečně je pouchitida příčinou selhání pouche s nutností reoperace nebo exstirpace pouche [89].
5. Akutní těžká ataka, fulminantní UC, toxické megakolon
Diagnostika akutní těžké ataky UC (ASUC)
Stanovisko 32
Těžká ataka je definována podle kritérií Truelova a Wittse a zahrnuje přítomnost těchto symptomů: šest a více krvavých stolic denně a alespoň jeden projev systémové zánětlivé reakce (tachykardie > 90/min, teplota > 37,8 °C, Hgb < 105 g/l, CRP > 30 mg/l) [EL3].
Známky těžké zánětlivé reakce (systémové toxicity) zahrnují přítomnost tachykardie (> 90/min), anemii (hemoglobin < 105 g/l), zvýšenou tělesnou teplotu (T > 37,8 °C), zvýšenou hodnotu sedimentace červených krvinek (> 30 mm/1 hod) nebo nověji zvýšenou hodnotou CRP (> 30 mg/l). S narůstajícím počtem znaků systémové zánětlivé reakce progresivně narůstá riziko kolektomie. V případě jednoho systémového znaku dosahuje riziko kolektomie 11 %, jsou-li přítomna všechna čtyři kritéria, přesahuje riziko akutního chirurgického zákroku v následujících šesti týdnech 40 % [90,91].
Průběh ASUC je spojen s vysokým rizikem závažných a život ohrožujících komplikací, jako je toxické megakolon (paralytický ileus na tlustém střevě), perforace tlustého střeva se sterkorální peritonitidou, masivní krvácení nebo sepse s multiorgánovým selháním. Dalším významným rizikem jsou tromboembolické komplikace. Urgentně nebo akutně provedené chirurgické výkony spočívající v provedení kolektomie nebo proktokolektomie jsou rovněž spojeny s významnou pooperační morbiditou a nezanedbatelnou mortalitou v porovnání s elektivními nebo odloženými chirurgickými výkony. Metaanalýza zahrnujících celkem 17 studií publikovaných od roku 1990 do roku 2014 na více než 65 000 nemocných s UC z 15 zemí světa ukázala, že časná pooperační mortalita je u urgentně provedených operací mnohonásobně vyšší v porovnání s výkony elektivními nebo odloženými (5,3 vs. 0,7 %) [92]. U nemocných s UC nebylo patrno snížení mortality v průběhu sledovaného období (24 let), a to i přes významné pokroky v medikamentózní terapii a při nových možnostech intenzivní péče. Na rozdíl od pacientů s UC se pooperační mortalita u nemocných s CN v posledních letech významně snížila.
Léčba akutní těžké ataky UC
Stanovisko 33
Základem léčby je hospitalizace a podání intravenózních kortikoidů (metylprednisolon 1 mg/kg). Součástí léčby je úprava vnitřního prostředí, anemie, profylaxe tromboembolických komplikací a výživa, zpravidla enterální formou. Je nutno vyloučit a monitorovat potenciální komplikace onemocnění (infekce, toxické megakolon) [EL2].
V randomizované, placebem kontrolované studii u nemocných s ASUC bylo potvrzeno, že podávání kortikoidů intravenózně významně snižuje mortalitu a je spojeno se zvýšením počtu dosažených remisí [93].
Pokud nedojde k odpovědi na léčbu mezi 3. a 5. dnem od zahájení, je indikována druhá linie medikamentózní léčby, lékem volby je infliximab nebo cyklosporin A v dávce 2 mg/kg. V případě infliximabu je nutno zvážit podání intenzifikovaného režimu od počátku léčby (10 mg/kg). Není-li odpověď ani na druhou linii léčby, je nutno zvážit chirurgické řešení. Podání cyklosporinu je vhodné pouze na pracovištích s adekvátní zkušeností a možností monitorace hladiny léku, v případě příznivé odpovědi může pokračovat léčba thiopuriny, vedolizumabem, nebo ustekinumabem. Léčba musí být od počátku konzultována se zkušeným kolorektálním chirurgem [94].
6. Vakcinace a prevence infekčních komplikací
Riziko infekčních komplikací
Stanovisko 34
Pacienti s UC léčení imunosupresivně působícími léky, ve vyšším věku (> 50 let), s malnutricí a předchozí anamnézou infekčních komplikací jsou ve zvýšeném riziku infekčních komplikací [EL2]. U všech pacientů s UC je nutno odebrat podrobnou anamnézu týkající se prodělaných infekčních onemocnění a předchozí vakcinace. U všech pacientů s UC by mělo být při stanovení diagnózy provedeno laboratorní vyšetření zaměřené na hepatitidu A, B a C a na infekce Varicella zoster, HIV, EBV, CMV a virus spalniček [EL5].
Rizikové faktory pro vznik závažných infekcí zahrnují faktory pacienta dané jeho věkem, malnutricí a přidruženými nemocemi a faktory zevní, mezi něž patří použité imunosupresivní léky nebo jejich kombinace (thiopuriny, anti-TNF protilátky a kortikoidy) a rizikové kontakty. Největší riziko pro vznik infekcí představuje současné podávání kortikoidů, thiopurinů a anti-TNF protilátek. Podávání jednoho z nich zvyšuje riziko infekce trojnásobně, kombinace všech uvedených skupin léčiv téměř 15násobně [95].
Vakcinace pacientů s UC
Stanovisko 35
Pacienti by měli být pravidelně očkováni proti chřipce, doporučena je vakcinace proti Str. pneumoniae, SARS-CoV-2 a lidskému papilomaviru [EL5]. V případě potřeby (séronegativita) je vhodná vakcinace proti hepatitidě B a varicella zoster viru. Podání živých vakcín není vhodné při probíhající imunosupresivní léčbě, v období 3 týdnů před jejím zahájením a 1–3 měsíců po jejím ukončení, dle typu preparátu. Podání neživých vakcín není limitováno. V případě dostupné metody je vhodné sérologicky ověřit účinnost vakcinace [EL5].
Reaktivace viru hepatitidy B je možná u nemocných s UC na imunosupresivní terapii. Všichni pacienti s UC by proto měli být očkováni proti infekci virem hepatitidy B a sérologická postvakcinační odpověď by měla být monitorována stanovením titru protilátek.
U všech pacientů s UC by měla být zjištěna přítomnost protilátek proti dalším virovým infekcím, jako je EBV a Herpes zoster. V případě nízkých titrů protilátek proti infekci varicella zoster je doporučeno podání rekombinantní vakcíny nebo aplikace živé vakcíny, která však může být aplikována nejpozději 3 týdny před zahájením a nejdříve 3 měsíce po ukončení imunosupresivní terapie [95].
Pravidelná každoroční vakcinace proti chřipce je důležitým preventivním opatřením. První volbou je aplikace trivalentní nebo kvadruvalentní inaktivované vakcíny proti chřipce, kterou je možno využít také u pacientů na již probíhající imunosupresivní terapii. Očkování proti SARS-CoV-2 je jednoznačně doporučováno u všech IBD nemocných bez ohledu na probíhající medikamentózní terapii. Je třeba mít na paměti, že tvorba protilátek je u nemocných na imunosupresivní terapii v porovnání se zdravou populací snížena a rychleji také dochází k vymizení vytvořených protilátek. Tzv. mRNA vakcíny jsou s ohledem na tvorbu anti-SARS-Cov-2 protilátek efektivnější než rekombinantní adenovektorové vakcíny [96].
Očkování proti pneumokoku (Streptococcus pneumonie) patří do základního vakcinačního schématu všech nemocných s UC. Doporučeno je podat první dávku 13valentní vakcínou a přeočkovat po 8 týdnech 23valentní vakcínou [96].
U všech mladých mužů a žen ve věku 11–14 let je doporučeno provést vakcinaci proti lidskému papilomaviru [96].
Doručeno/Submitted: 23. 2. 2022
Přijato/Accepted: 24. 2. 2022
doc. MUDr. Martin Bortlík, Ph.D.
Gastroenterologické oddělení
Nemocnice České Budějovice, a. s.
B. Němcové 585/54
370 01 České Budějovice
Sources
1. Raine T, Bonovas S, Burisch J et al. ECCO guidelines on therapeutics in ulcerative colitis: medical treatment. J Crohns Colitis 2022; 16 (1): 2–17. doi: 10.1093/ecco-jcc/jjab178.
2. Lukáš M, Dušek L. Idiopatické střevní záněty ve statistických ukazatelích a analýzách. In: Lukáš M et al (eds). Idiopatické střevní záněty – nové trendy a mezioborové souvislosti. Praha: Grada Publishing, a. s. 2020.
3. Jess T, Gamborg M, Munkholm P et al. Overall and cause-specific mortality in ulcerative colitis: meta-analysis of population-based inception cohort studies. Am J Gastroenterol 2007; 102 (3): 609–617. doi: 10.1111/j.1572-0241.010 00.x.
4. Bortlík M. Vývoj léčby idiopatických střevních zánětů v posledních 20 letech. Gastroent Hepatol 2015; 69 (4): 341–350.
5. OCEMB levels of evidence working group. The Oxford 2011 levels of evidence: Oxford centre for evidence-based medicine. 2014 [online]. Available from: https: //www.cebm.net/wp-content/uploads/2014/06/CEBM-Levels-of-Evidence-2.1.pdf.
6. Magro F, Gionchetti P, Eliakim R et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 1: definitions, diagnosis, extra-intestinal manifestations, pregnancy, cancer surveillance, surgery, and ileo-anal pouch disorders. J Crohns Colitis 2017; 11 (6): 649–670. doi: 10.1093/ecco-jcc/jjx008.
7. Vavricka SR, Brun L, Ballabeni P et al. Frequency and risk factors for extraintestinal manifestations in the Swiss inflammatory bowel disease cohort. Am J Gastroenterol 2011; 106 : 110–119. doi: 10.1038/ajg.2010.343.
8. Bajer L, Kamenář D, Sticová E et al. Idiopatický střevní zánět u pacientů s primární sklerozující cholangitidou – samostatný fenotyp IBD. Gastroent Hepatol 2014; 68 (1): 24–35.
9. Moller FT, Andersen V, Wohlfahrt J et al. Familial risk of inflammatory bowel disease: a population-based cohort study 1977–2011. Am J Gastroenterol 2015; 110 (4): 564–571. doi: 10.1038/ajg.2015.50.
10. To N, Ford AC, Gracie DJ. Systematic review with meta-analysis: the effect of tobacco smoking on the natural history of ulcerative colitis. Aliment Pharmacol Ther 2016; 44 (2): 117–126. doi: 10.1111/apt.13663.
11. Radford-Smith GL, Edwards JE, Purdie DM et al. Protective role of appendicectomy on onset and severity of ulcerative colitis and Crohn’s disease. Gut 2002; 51 (6): 808–813. doi: 10.1136/gut.51.6.808.
12. Sandborn WJ. Serologic markers in inflammatory bowel disease: state of the art. Rev Gastroenterol Disord 2004; 4 (4): 167–174.
13. Rajwal SR, Puntis JW, McClean P et al. Endoscopic rectal sparing in children with untreated ulcerative colitis. J Pediatr Gastroenterol Nutr 2004; 38 (1): 66–69. doi: 10.1097/00005176-20 0401000-00015.
14. Park SH, Loftus EV Jr, Yang SK. Appendiceal skip inflammation and ulcerative colitis. Dig Dis Sci 2014; 59 (9): 2050–2057. doi: 10.1007/s10620-014-3129-z.
15. Rutter MD, Saunders BP, Wilkinson KH et al. Cancer surveillance in longstanding ulcerative colitis: endoscopic appearances help predict cancer risk. Gut 2004; 53 (12): 1813–1816. doi: 10.1136/gut.2003.038505.
16. Lang-Schwarz C, Angeloni M, Agaimy A et al. Validation of the ‚Inflammatory Bowel Disease-Distribution, Chronicity, Activity [IBD-DCA] score‘ for ulcerative colitis and Crohn’s Disease. J Crohns Colitis 2021; 15 (10): 1621–1630. doi: 10.1093/ecco-jcc/jjab055.
17. Gower-Rousseau C, Dauchet L, Vernier-Massouille G et al. The natural history of pediatric ulcerative colitis: a population-based cohort study. Am J Gastroenterol 2009; 104 (8): 2080–2088. doi: 10.1038/ajg.2009.177.
18. Katsanos KH, Vermeire S, Christodoulou DK et al. EC-IBD Study Group. Dysplasia and cancer in inflammatory bowel disease 10 years after diagnosis: results of a population-based European collaborative follow-up study. Digestion 2007; 75 (2–3): 113–121. doi: 10.1159/000104731.
19. D’Haens G, Sandborn WJ, Feagan BG et al. A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis. Gastroenterology 2007; 132 (2): 763–786. doi: 10.1053/j.gastro. 2006.12.038.
20. Travis SP, Schnell D, Krzeski P et al. Developing an instrument to assess the endoscopic severity of ulcerative colitis: the Ulcerative Colitis Endoscopic Index of Severity (UCEIS). Gut 2012; 61 (4): 535–542. doi: 10.1136/gutjnl-2011-300486.
21. Truelove SC, Jewell DP. Intensive intravenous regimen for severe attacks of ulcerative colitis. Lancet 1974; 1 (7866): 1067–1070. doi: 10.1016/s0140-6736 (74) 90552-2.
22. Vermeire S, Van Assche G, Rutgeerts P. Laboratory markers in IBD: useful, magic, or unnecessary toys? Gut 2006; 55 (3): 426–431. doi: 10.1136/gut.2005.069476.
23. Lin JF, Chen JM, Zuo JH et al. Meta-analysis: fecal calprotectin for assessment of inflammatory bowel disease activity. Inflamm Bowel Dis 2014; 20 (8): 1407–1415. doi: 10.1097/MIB.000 0000000000057.
24. Turner D, Ricciuto A, Lewis A et al. STRIDE-II: an update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology 2021; 160 (5): 1570–1583. doi: 10.1053/j.gastro.2020.12.031.
25. Doherty G, Katsanos KH, Burisch J et al. European Crohn‘s and colitis organisation topical review on treatment withdrawal (‚exit strategies‘) in inflammatory bowel disease. J Crohns Colitis 2018; 12 (1): 17–31. doi: 10.1093/ecco-jcc/ jjx101.
26. Dulai PS, Battat R, Barsky M et al. Incorporating fecal calprotectin into clinical practice for patients with moderate-to-severely active ulcerative colitis treated with biologics or small-molecule inhibitors. Am J Gastroenterol 2020; 115 (6): 885–894. doi: 10.14309/ajg.0000000000000596.
27. Wetwittayakhlang P, Lontai L, Gonczi L et al. Treatment targets in ulcerative colitis: is it time for all in, including histology? J Clin Med 2021; 10 (23): 5551. doi: 10.3390/jcm10235551.
28. Andus T, Kocjan A, Müser M et al. Clinical trial: a novel high-dose 1 g mesalamine suppository (Salofalk) once daily is as efficacious as a 500 - mg suppository thrice daily in active ulcerative proctitis. Inflamm Bowel Dis 2010; 16 (11): 1947–1956. doi: 10.1002/ibd.21258.
29. Lamet M. A multicenter, randomized study to evaluate the efficacy and safety of mesalamine suppositories 1 g at bedtime and 500 mg Twice daily in patients with active mild-to-moderate ulcerative proctitis. Dig Dis Sci 2011; 56 (2): 513–522. doi: 10.1007/s10620-010-1334-y.
30. Gionchetti P, Rizzello F, Venturi A et al. Comparison of oral with rectal mesalazine in the treatment of ulcerative proctitis. Dis Colon Rectum 1998; 41 (1): 93–97. doi: 10.1007/ BF02236902.
31. Ng SC. Management of ulcerative colitis. In: Hart AL, Ng SC (eds). Inflammatory bowel disease: an evidence-based practical guide. Malta: Gutenberg Press Ltd 2012 : 5–12.
32. Marshall JK, Irvine EJ. Rectal corticosteroids versus alternative treatments in ulcerative colitis: a meta-analysis. Gut 1997; 40 (6): 775–781. doi: 10.1136/gut.40.6.775.
33. Ford AC, Khan KJ, Achkar JP et al. Efficacy of oral vs. topical, or combined oral and topical 5-aminosalicylates, in Ulcerative Colitis: systematic review and meta-analysis. Am J Gastroenterol 2012; 107 (2): 167–176. doi: 10.1038/ajg.2011.410.
34. Feagan BG, MacDonald JK. Once daily oral mesalamine compared to conventional dosing for induction and maintenance of remission in ulcerative colitis: a systematic review and meta-analysis. Inflamm Bowel Dis 2012; 18 (9): 1785–1794. doi: 10.1002/ibd.23024.
35. Kruis W, Kiudelis G, Rácz I et al. Once daily versus three times daily mesalazine granules in active ulcerative colitis: a double-blind, double-dummy, randomised, non-inferiority trial. Gut 2009; 58 (2): 233–240. doi: 10.1136/gut.2008.154302.
36. Ford AC, Achkar JP, Khan KJ et al. Efficacy of 5-aminosalicylates in ulcerative colitis: systematic review and meta-analysis. Am J Gastroenterol 2011; 106 (4): 601–616. doi: 10.1038/ajg. 2011.67.
37. Leifeld L, Pfützer R, Morgenstern J et al. Mesalazine granules are superior to Eudragit-L-coated mesalazine tablets for induction of remission in distal ulcerative colitis – a pooled analysis. Aliment Pharmacol Ther 2011; 34 (9): 1115–1122. doi: 10.1111/j.1365-2036.2011.04840.x.
38. Bortlík M, Ďuricová D, Douda T et al. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: čtvrté, aktualizované vydání. Gastroent Hepatol 2019; 73 (1): 11–24. doi: 10.14735/amgh201911.
39. European Medicines Agency. Zeposia. 2022 [online]. Available from: https: //www.ema.europa.eu/en/documents/product-information/zeposia-epar-product-information_en.pdf
40. European Medicines Agency. Jyseleca. 2022 [online]. Available from: https: //www.ema.europa.eu/en/documents/product-information/jyseleca-epar-product-information_ en.pdf.
41. Stange EF, Travis SP, Vermeire S et al. European evidence-based consensus on the diagnosis and management of ulcerative colitis: definitions and diagnosis. J Crohns Colitis 2008; 2 (1): 1–23. doi: 10.1016/j.crohns.2007.11.001.
42. Chebli LA, Chaves LD, Pimentel FF et al. Azathioprine maintains long-term steroid-free remission through 3 years in patients with steroid-dependent ulcerative colitis. Inflamm Bowel Dis 2010; 16 (4): 613–619. doi: 10.1002/ibd.21083.
43. Harbord M, Eliakim R, Bettenworth D et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 2: current management. J Crohns Colitis 2017; 11 (7): 769–784. doi: 10.1093/ecco-jcc/jjx009.
44. Feagan BG, Rutgeerts P, Sands BE et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369 (8): 699–710. doi: 10.1056/NEJMoa1215734.
45. Sands BE, Sandborn WJ, Panaccione R et al. Ustekinumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2019; 381 (13): 1201–1214. doi: 10.1056/ NEJMoa 1900750.
46. Sandborn WJ, Su C, Panes J. Tofacitinib as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2017; 377 (5): 496–497. doi: 10.1056/NEJMc1707500.
47. Sanborn WJ, Feagan B, D’Haens G et al. Ozanimod as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2021; 385 (14): 1280–1291. doi: 10.1056/NEJMoa2033617.
48. Feagan BG, Danese S, Loftus EV Jr et al. Filgotinib as induction and maintenance therapy for ulcerative colitis (SELECTION): a phase 2b/3 double-blind, randomised, placebo-controlled trial. Lancet 2021; 397 (10292): 2372–2384. doi: 10.1016/S0140-6736 (21) 00666-8.
49. Sands B, Peyrin-Biroulet L, Loftus EV Jr et al. Vedolizumab versus Adalimumab for moderate-to-severe ulcerative colitis. N Engl J Med 2019; 381 (13): 1215–1226. doi: 10.1056/ NEJMoa1905725.
50. Jena A, Mishra S, Singh AK et al. Cytomegalovirus in ulcerative colitis: an evidence-based approach to diagnosis and treatment. Expert Rev Gastroenterol Hepatol 2022; 16 (2): 109–120. doi: 10.1080/17474124.2022.2032662.
51. Llaó J, Naves JE, Ruiz-Cerulla A et al. Intravenous corticosteroids in moderately active ulcerative colitis refractory to oral corticosteroids. J Crohns Colitis 2014; 8 (11): 1523–1528. doi: 10.1016/j.crohns.2014.06.010.
52. Murray A, Nguyen TM, Parker CE et al. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2020; 8 (8): CD000544. doi: 10.1002/14651858.CD000544.pub5.
53. Prokopová L, Ďuricová D, Bortlík et al. Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty. Gastroent Hepatol 2012; 66 (5): 391–400.
54. Beaugerie L, Brousse N, Bouvier AM et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet 2009; 374 (9701): 1617–1625. doi: 10.1016/S0140-6736 (09) 61302-7.
55. Jorissen C, Verstockt B, Schils N et al. Long-term clinical outcome after thiopurine discontinuation in elderly IBD patients. Scand J Gastroenterol 2021; 56 (11): 1323–1327. doi: 10.1080/00365521.2021.1965207.
56. Annese V, Beaugerie L, Egan L et al. European evidence-based consensus: inflammatory bowel disease and malignancies. J Crohns Colitis 2015; 9 (11): 945–965. doi: 10.1093/ecco-jcc/jjv141.
57. Kruis W, Schütz E, Fric P et al. Double-blind comparison of an oral Escherichia coli preparation and mesalazine in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther 1997; 11 (5): 8535–8538. doi: 10.1046/ j.1365-2036.1997.00225.x.
58. Rembacken BJ, Snelling AM, Hawkey PM et al. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial. Lancet 1999; 354 (9179): 635–639. doi: 10.1016/s0140-6736 (98) 06343-0.
59. Kruis W, Fric P, Pokrotnieks J et al. Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine. Gut 2004; 53 (11): 1617–1623. doi: 10.1136/gut.2003.037747.
60. Institut biostatistiky a analýz. CREDIT. 2021 [online]. Available from: https: //credit.registry.cz/res/file/credit/iba1062_vyrocni_zprava_5.0_15mar2021.pdf.
61. Papamichael K, Cheifetz AS, Melmed GY et al. Appropriate therapeutic drug monitoring of biologic agents for patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2019; 17 (9): 1655–1668. doi: 10.1016/ j.cgh.2019.03.037.
62. Ungar B, Malickova K, Hanžel J et al. Dose optimisation for Loss of Response to Vedolizumab-Pharmacokinetics and Immune Mechanisms. J Crohns Colitis 2021; 15 (10): 1707–1719. doi: 10.1093/ecco-jcc/jjab067.
63. European Medicines Agency. Xeljanz. 2022 [online]. Available from: https: //www.ema.europa.eu/en/ documents/product-information/xeljanz-epar-product-information_en.pdf.
64. Dalal RS, Esckilsen S, Barnes EL et al. Predictors and outcomes of Ustekinumab dose intensification in ulcerative colitis: a multicenter cohort study. Clin Gastroenterol Hepatol 2021; S1542-3565 (21) 00338-4. doi: 10.1016/ j.cgh.2021.03.028.
65. Malíčková K, Pešinová V, Bortlík M et al. Telemedicína a idiopatické střevní záněty – výsledky pilotního projektu IBD Asistent. Gastroent Hepatol 2020; 74 (1): 18–27. doi: 10.14735/ amgh202018.
66. de Jong MJ, Boonen A, van der Meulen-de Jong AE et al. Cost-effectiveness of telemedicine-directed specialized vs standard care for patients with inflammatory bowel diseases in a randomized trial. Clin Gastroenterol Hepatol 2020; 18 (8): 1744–1752. doi: 10.1016/j.cgh.2020.04.038.
67. Ahmed W, Galati J, Kumar A et al. Dual biologic or small molecule therapy for treatment of inflammatory bowel disease: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2022; 20 (3): e361–e379. doi: 10.1016/j.cgh.2021.03.034.
68. Lukáš M, Kolář M, Vašátko M et al. Dual biological or small molecule treatment in inflammatory bowel diseases: data from clinical practice. Crohn’s Colitis Congress (virtual), January 20–22, 2022, Las Vegas, USA.
69. El-Dallal M, Chen Y, Lin Q et al. Meta-analysis of virtual-based chromoendoscopy compared with dye-spraying chromoendoscopy standard and high-definition white light endoscopy in patients with inflammatory bowel disease at increased risk of colon cancer. Inflamm Bowel Dis 2020; 26 (9): 1319–1329. doi: 10.1093/ibd/izaa011.
70. Laine L, Kaltenbach T, Barkun A et al. SCENIC international consensus statement on surveillance and management of dysplasia in inflammatory bowel disease. Gastroenterology 2015; 148 (3): 639–651. doi: 10.1053/j.gastro.2015.01.031.
71. Annese V, Daperno M, Rutter MD et al. European Crohn’s and Colitis Organisation. European evidence-based consensus for endoscopy in inflammatory bowel disease. J Crohns Colitis 2013; 7 (12): 982–1018. doi: 10.1016/j.crohns.2013.09.016.
72. van der Woude CJ, Ardizzone S, Bengtson MB et al. The second European evidenced-based consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9 (2): 107–124. doi: 10.1093/ecco-jcc/jju 006.
73. Cappell MS. Risks versus benefits of gastrointestinal endoscopy during pregnancy. Nat Rev Gastroenterol Hepatol 2011; 8 (11): 610–634. doi: 10.1038/nrgastro.2011.162.
74. Ko MS, Rudrapatna VA, Avila P et al. Safety of flexible sigmoidoscopy in pregnant patients with known or suspected inflammatory bowel disease. Dig Dis Sci 2020; 65 (10): 2979–2985. doi: 10.1007/s10620-020-06122-8.
75. de Lima A, Zelinkova Z, van der Woude CJ. A prospective study of the safety of lower gastrointestinal endoscopy during pregnancy in patients with inflammatory bowel disease. J Crohns Colitis 2015; 9 (7): 519–524. doi: 10.1093/ecco-jcc/jjv079.
76. Ďuricová D, Krátká Z, Bortlík M et al. Idiopatické střevní záněty mají negativní dopad na reprodukční chování pacientů: první multicentrický průzkum v České republice. Gastroent Hepatol 2021; 75 (1): 12–19. doi: 10.48 095/ccgh202112.
77. Duricova D, Dvorakova E, Hradsky O et al. Safety of anti-TNF-alpha therapy during pregnancy on long-term outcome of exposed children: a controlled, multicenter observation. Inflamm Bowel Dis 2019; 25 (4): 789–796. doi: 10.1093/ibd/izy294.
78. Mahadevan U, Long MD, Kane SV et al. Pregnancy and neonatal outcomes after fetal exposure to biologics and thiopurines among women with inflammatory bowel disease. Gastroenterology 2021; 160 (4): 1131–1139. doi: 10.1053/j.gastro.2020.11.038.
79. Mitrova K, Pipek B, Bortlik M et al. Differences in the placental pharmacokinetics of vedolizumab and ustekinumab during pregnancy in women with inflammatory bowel disease: a prospective multicentre study. Therap Adv Gastroenterol 2021; 14 : 17562848211032790. doi: 10.1177/17562848211032790.
80. Mahadevan U, Dubinsky MC, Su C et al. Outcomes of pregnancies with maternal/Paternal exposure in the tofacitinib safety databases for ulcerative colitis. Inflamm Bowel Dis 2018; 24 (12): 2494–2500. doi: 10.1093/ibd/izy160.
81. Fernández-Sánchez M, Ribes-Artero H, Fernández-Sánchez M et al. Fetal exposure to tofacitinib during the first trimester: a healthy newborn case report. Birth Defects Res 2021; 113 (17): 1275–1279. doi: 10.1002/bdr2.1942.
82. LeBlanc JF, Wiseman D, Lakatos PL et al. Elderly patients with inflammatory bowel disease: updated review of the therapeutic landscape. World J Gastroenterol 2019; 25 (30): 4158–4171. doi: 10.3748/wjg.v25.i30.4158.
83. Sturm A, Maaser C, Mendall M et al. European Crohn’s and colitis organisation topical review on IBD in the elderly. J Crohns Colitis 2017; 11 (3): 263–273. doi: 10.1093/ecco-jcc/jjw188.
84. Beaugerie L, Carrat F, Colombel JF et al. Risk of new or recurrent cancer under immunosuppressive therapy in patients with IBD and previous cancer. Gut 2014; 63 (9): 1416–1423. doi: 10.1136/gutjnl-2013-305763.
85. Beaugerie L, Kirchgesner J. Balancing benefit vs risk of immunosuppressive therapy for individual patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2019; 17 (3): 370–379. doi: 10.1016/j.cgh.2018.07.013.
86. Khoury W, Lavery IC, Kiran RP. Effects of chronic immunosuppression on long-term oncologic outcomes for colorectal cancer patients undergoing surgery. Ann Surg 2011; 253 (2): 323–327. doi: 10.1097/SLA.0b013e3181fc9d36.
87. Ďuricová D, Lukáš M. Který typ biologické léčby zvolit u pacientů s idiopatickými střevními záněty? Remedia 2019; 29 : 67–71.
88. Alsafi Z, Snell A, Segal JP. Prevalence of ‚pouch failure‘ of the ileoanal pouch in ulcerative colitis: a systematic review and meta-analysis. Int J Colorectal Dis 2022; 37 (2): 357–364. doi: 10.1007/s00384-021-04067-6.
89. Shen B, Kochhar GS, Rubin DT et al. Treatment of pouchitis, Crohn‘s disease, cuffitis, and other inflammatory disorders of the pouch: consensus guidelines from the International Ileal Pouch Consortium. Lancet Gastroenterol Hepatol 2022; 7 (1): 69–95. doi: 10.1016/S2468-1253 (21) 00214-4.
90. Truelove SC, Witts LJ. Cortisone in ulcerative colitis: final report on a therapeutic trial. Br Med J 1955; 2 (4947): 1041–1048. doi: 10.1136/bmj.2.4947.1041.
91. Dinesen LC, Walsh AJ, Nedeljkovic Protic M et al. The pattern of severe ulcerative colitis. J Crohns Colitis 2017; 4 : 431–434.
92. Singh S, Al-Darmaki A, Frolkis AD et al. Postoperative mortality among patients with inflammatory bowel diseases: a systematic review and meta-analysis of populations based studies. Gastroenterology 2015; 149 (4): 928–937. doi: 10.1053/j.gastro.2015.06.001.
93. Turner D, Walsh CM, Steinhart AH et al. Response to corticosteroids in severe ulcerative colitis: a systematic review of the literature and a meta-regression. Clin Gastroent Hepatol 2007; 5 (1): 103–110. doi: 10.1016/j.cgh.2006.09.033.
94. Spinelli A, Bonovas S, Burisch J et al. ECCO guidelines on therapeutics in ulcerative colitis: surgical treatment. J Crohns Colitis 2022; 16 (2): 179–189. doi: 10.1093/ecco-jcc/jjab177.
95. Kucharzik T, Ellul P, Greuter T el al. ECCO guidelines for prevention, diagnoses and management of infections in inflammatory bowel disease. J Crohns Colitis 2021; 15 (6): 879–913. doi: 10.1093/ecco-jcc/jjab052.
96. Lukáš M, Malíčková K. Epidemická infekční onemocnění a idiopatické střevní záněty. In: Lukáš M et al (eds). Idiopatické střevní záněty – nové trendy a mezioborové souvislosti. Praha: Grada Publishing, a. s. 2020.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology

2022 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Perspective year 2022
- Be optimistic!
- Kvíz z klinické praxe
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
- Complicated course of Crohn’s disease of the small intestine in the patient in the eighth decade of life
- Point-of-care method for measuring infliximab and adalimumab trough levels in inflammatory bowel disease patients on biologic therapy
- Biosimilar treatment in paediatric gastroenterology – current view
- Safety of vedolizumab and ustekinumab in the treatment of pregnant women with inflammatory bowel disease – a multicentre retrospective-prospective observational study
- Remsima SC 120 mg – a new generation of biosimilar drugs
- The importance of home parenteral nutrition in clinical practice – own experience from our workplace
- Desmoid fibromatosis – a rare mesenteric tumor
- The selection from international journals
- Odešla mimořádná osobnost české gastroenterologie – Ivo Skála (17. 12. 1933 – 10. 2. 2022)
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: IBD
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Desmoid fibromatosis – a rare mesenteric tumor
- Remsima SC 120 mg – a new generation of biosimilar drugs
- The importance of home parenteral nutrition in clinical practice – own experience from our workplace
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy

