Tuberkulóza – stále aktuální problém
Tuberculosis – still a health problem
Tuberculosis is still a major health problem, especially in developing countries. Nearly 2 million people die from tuberculosis each year. Extremely drug-resistant and multidrug-resistant tuberculosis strains present serious problems for the efficient control of this disease. Conventional methods for the identification of M. tuberculosis and detection of drug-resistance are slow and cumbersome. Determination of the genome sequence of M. tuberculosis has facilitated the development of new molecular assays. These new methods can be performed rapidly and offer high sensitivities and specificities. They can also be used for the detection of drug resistance. This review describes the current possibilities for the laboratory diagnosis of tuberculosis.
Key words:
tuberculosis, laboratory diagnosis, interferon gamma.
Authors:
P. Čermák 1; M. Havelková 2
Authors‘ workplace:
Fakultní Thomayerova nemocnice s poliklinikou, Praha
Oddělení klinické mikrobiologie
Primář: doc. MUDr. Pavel Čermák, CSc.
1. lékařská fakulta Univerzity Karlovy v Praze
Ústav klinické biochemie a laboratorní diagnostiky
Přednosta: prof. MUDr. Tomáš Zima,
1; Státní zdravotní ústav, Praha
Národní referenční laboratoř pro mykobakterie
Ředitel: MUDr. Milan Bořek
2
Published in:
Prakt. Lék. 2009; 89(12): 692-697
Category:
Diagnostis
Overview
Tuberkulóza je stále prezentována jako největší zdravotnický problém, zejména v rozvojových zemích. Ročně zabíjí téměř dva miliony lidí. Multirezistentní a vysoce rezistentní kmeny tuberkulózy představují závažné problémy pro účinnou kontrolu tohoto onemocnění. Konvenční metody pro identifikaci M. tuberculosis a určení rezistence na antituberkulotika jsou pomalé a těžkopádné. Poznání genomu M. tuberculosis umožnilo rozvoj nových molekulárně biologických metod. Tyto nové metody jsou rychlé s vysokou senzitivitou a specifikou, je možné je využít i pro stanovení rezistence na antituberkulotika. V článku jsou popsány laboratorní možnosti diagnostiky tuberkulózy.
Klíčová slova:
tuberkulóza, laboratorní diagnostika, interferon gama.
Úvod
Již pouhé slovo tuberkulóza vyvolává ve většině lidí bez rozdílu, zda se jedná o laiky nebo zdravotníky, značnou pozornost. Důvodem jsou pravděpodobně negativní zkušenosti s tímto onemocněním ještě z dob nedávno minulých. Občanům rozvinutých zemí, mezi které můžeme počítat i Českou republiku, by se mohlo na první pohled zdát, že tuberkulóza představuje okrajový, v podstatě již vyřešený problém. Podíváme-li se na tu to tématiku z celosvětového hlediska, dostaneme obraz, který se zásadním způsobem liší.
Epidemiologie tuberkulózy
Podle odhadů je tuberkulózou infikována třetina světové populace lidí (27), ročně je zaznamenáno 8,3 milionu nových případů (7). Denně zemře na tuberkulózu 6 000 lidí (23), což představuje 1,8 milionu úmrtí za rok. Tato čísla jsou prezentována ve většině recentních publikací o tuberkulóze, a je nutné si uvědomit, že jde o odhad. V řadě případů nejsou přesná čísla známa, zejména v případě zemí třetího světa.
V současné době je největší incidence výskytu onemocnění způsobených M. tuberculosis v subsaharské Africe. Dále jsou nejvíce postiženy Čína, Mongolsko, Indie, Rusko a bývalé republiky Sovětského svazu. V posledně jmenovaných zemích došlo v letech 1990–2000 k největšímu nárůstu onemocnění a v současné době je incidence 3x větší než v roce 1960 (16).
V případě tuberkulózy je incidence onemocnění ovlivněna, kromě vlastností vyvolávajícího původce, dalšími faktory. Roli hraje rozdílná, geneticky podmíněná vnímavost. Je známo, že například indiáni jsou oproti bělochům méně odolní k tomuto onemocnění. Mezi další faktory patří úroveň zdravotní péče v jednotlivých zemích, existence a účinnost cílených programů kontroly nad tuberkulózou a v neposlední řadě sociálně ekonomické podmínky.
Výskyt tuberkulózy ve sledovaných zemích koreluje i s ekonomickým rozvojem. S růstem životní úrovně obyvatelstva klesá incidence onemocnění (42).
Problematika rezistentních kmenů na antituberkulotika
Specifickým problémem současné doby je stoupající rezistence na antituberkulotika a šíření multirezistntních a vysoce rezistentních kmenů M. tuberculosis. Za multirezistentní (MDR–TB = multidrug resistant tuberculosis) jsou považovány kmeny, které jsou rezistentní minimálně na
- isoniazid (INH), a
- rifampicin (RIF)
ze základní řady antituberkulotik.
Zkratkou XDR-TB (extensively drug-resistant tuberculosis) jsou označovány kmeny rezistentní na
- INH,
- RIF,
- fluorochinolony, a
- minimálně jeden injekční lék z druhé řady antituberkulotik (amikacin, kanamycin, capreomycin).
Situace v podstatě kopíruje vývoj rezistence na antibiotika u nespecifické bakteriální flóry s odstupem čtyřiceti let. Nabízí se tak analogie k rychlosti růstu, která je u mykobakterií rovněž přibližně čtyřicetkrát pomalejší. Jestliže bylo v roce 2000 evidováno na celém světě 273 000 výskytů MDR-TB, v roce 2004 to bylo již 424 000, což představovalo 4,3 % všech nových a v minulosti léčených případů tuberkulózy. V tom samém roce bylo zachyceno 181 408 případů MDR-TB u pacientů v minulosti léčených pro TBC onemocnění. Největší výskyt MDR-TB je v Asii, Indii, Latinské Americe, Africe a na Středním východě. Ruská federace společně s Indií a Čínou představují 62 % všech případů MDR-TB (46).
Podle výsledků nadnárodní studie probíhající v letech 2000–2004 bylo ze 17 960 izolátů 19,9 % MDR-TB z nichž 9,9 % splňovalo kritéria pro XDR-TB (36). XDR-TB kmeny tuberkulózy byly izolovány v řadě zemí včetně České republiky. Jejich zachycení je ale spíše projevem úrovně laboratorní diagnostiky než vlastním rozšířením těchto kmenů.
V průmyslově vyspělých zemích je výskyt rezistentních kmenů spojován s migrací obyvatelstva z méně vyvinutých zemí. Například v USA bylo 80 % izolátů MDR-TB od ilegálních přistěhovalců z Mexika (16). V Evropě mají největší problémy s rezistentními kmeny tuberkulózy pobaltské státy, nejnižší výskyt je ve Skandinávii. Příčinou selekce rezistentních kmenů je neadekvátní terapie, přerušení nebo předčasné ukončení terapie. Vzhledem k několikaměsíční délce terapie se tyto problémy prezentují zejména v rozvojových zemích a tam, kde se z nějakých důvodů neuplatňuje nebo zhroutil systém dohledu nad tuberkulózou – například v zemích bývalého Sovětského svazu. Rezistentní kmeny se vyskytují dvakrát častěji u pacientů, kteří již byli na tuberkulózu léčeni (43).
V posledních letech nabývá tuberkulóza na významu ve spojení s HIV pozitivitou. U těchto pacientů je rovněž vyšší výskyt rezistentních kmenů. Podle údajů WHO byl v Litvě v letech 2001–2005 výskyt multirezistentních kmenů u HIV pozitivních 26,4 % oproti 14,8 % v případě ostatní populace. Podobné výsledky byly v roce 2006 v oblasti Doněck na Ukrajině (44).
Výskyt tuberkulózy v České republice
Situace v České republice je z hlediska výskytu tuberkulózy velice příznivá. V posledních patnácti letech klesla celková prevalence tuberkulózy ze 14,58 (počet případů na 100 000 obyvatel) na 6,12 v roce 2007. Podobně klesla prevalence mikroskopicky pozitivních případů ze 6,15 v roce 1990 na 1,94 v roce 2007 (13). Velmi nízký výskyt je zejména u dětí. V naší republice byl zaznamenán rovněž stoupající podíl cizinců z východní Evropy a z Asie.
Získávání statistických údajů o tuberkulóze je dosti obtížná a i v zemích s dobře fungujícím systémem dohledu dosti zdlouhavá záležitost. Jedním z důvodů je časově náročné klasické kultivační vyšetření. Aktuální stav tedy můžeme pouze odhadovat na základě údajů starých většinou minimálně jeden rok. Údaje z mnoha rozvojových zemí zejména v Africe a v Asii nejsou dostupné.
V České republice jsou dva systémy evidence tuberkulózy. Povinností každého lékaře je hlásit každou diagnózu tuberkulózy prostřednictvím krajského ftizeologa do registru TBC. Kromě toho je zde ještě laboratorní systém ISBT (informační systém bacilární tuberkulózy), kdy je každá laboratoř provádějící diagnostiku tuberkulózy povinna hlásit každý pozitivní nález prostřednictvím krajské laboratoře do Státního zdravotního ústavu v Praze. Výsledky těchto dvou systémů se navzájem porovnávají a na jejich základě provádí hygienická služba preventivní opatření.
Mykobakterie a jejich vlastnosti
Původce tuberkulózy Mycobacterium tuberculosis objevil v roce 1882 německý lékař Robert Koch. Za svoji práci v této oblasti mu byla v roce 1905 udělena Nobelova cena. V současné době obsahuje rod Mycobacterium již více než 100 jednotlivých druhů. Jejich počet se vlivem genetických metod neustále mění a rozšiřuje. Pro člověka jsou primárně patogenní druhy zahrnované do skupiny M. tuberculosis komplex:
- M. tuberculosis,
- M. bovis,
- M. bovis BCG,
- M. africanum,
- M. microti,
- M. canetti,
- M. pinnipedii,
- M. caprae, a
- M. leprae.
Mykobakterie se běžně vyskytují v našem zevním prostředí, v přírodě, jejich hostiteli jsou různí živočichové. Některé druhy jako M. kansasii, M. avium, M. intracelulare, M. fortuitum, M. marinum, M. ulcerans se řadí mezi podmíněné patogeny. U oslabených nebo jinak predisponovaných pacientů mohou být původcem onemocnění, kterým se souhrnně říká mykobakteriózy.
Genetické studie ukazují na to, že druhy zahrnované pod M. tuberculosis komplex jsou relativně mladé a vyvinuly se před 20 000–35 000 lety ze společného předka nazvaného M. prototuberculosis (2). Původně bylo M. tuberculosis považováno za druh, který se vyvinul adaptací z M. bovis, rozbor genomu ale ukázal, že se jedná o samostatný druh primárně patogenní pro člověka (6). Kmeny M. tuberculosis se fylogeneticky vyvíjely a adaptovaly na člověka v různých regionech, což má za následek rozdílnou vnímavost jednotlivých lidských populací k infekci (10).
Mykobakterie se liší od ostatních bakterií především složením buněčné stěny, která byla studována zejména v šedesátých letech minulého století a v posledních letech se opět stává objektem zvýšeného zájmu. Obsahuje lipidovou vrstvu tvořenou mykolovými kyselinami, které jsou navázány na vrstvu arabinogalaktanu. Buněčná stěna obsahuje další složky jako jsou:
- dimykolát threalózy,
- lipoarabinomaman,
- ftiocerodimykocerozát,
- 17 kDa glykoprotein, a
- sulfolipidy.
Tyto složky jsou v současné době považovány za faktory virulence (20). Mykobakterie neprodukují žádný toxin, nebo alespoň nebyl dosud objeven. Jejich patogenní účinky se tedy připisují pouze složkám buněčné stěny. To je i příčinou naprosto odlišných mechanismů imunitní odpovědi v průběhu infekčního procesu.
Mykobakterie jsou typickým intracelulárním parazitem. Jejich intracelulární přežívání a množení je dáno schopností uniknout před destrukcí lysozomálními enzymy a reaktivními produkty kyslíku a dusíku. Jsou schopny zablokovat fúzi fagozómů s lysozómy a omezit zpracování a prezentaci antigenů T lymfocytům. Tyto vlastnosti jsou podmíněny existencí systémů kontrolujících intracelulární expresi specifických genů regulujících odpověď M. tubeculosis na fagocytózu (8). Porovnáváním geonomu virulentních kmenů a atenuovaného kmene M. bovis BCG byly objeveny tři oblasti kódující faktory virulence, nazývané RD (region of diference) (6).
Významnou roli má lokus RD1 s geny kódujícími produkci řady sekrečních proteinů (ESAT-6, CFP-10, PE35, EspA), které jsou secernovány do buněčné stěny a na povrch mykobakteriální buňky. Regulační systémy obsažené v RD1 umožňují množení mykobakterií v infikovaném makrofágu a jejich pronikání do dalších mikrofágů nahromaděných v okolí. Tento mechanismus šíření se uplatňuje v počátečních stádiích infekce (12).
Imunita vůči mykobakteriální infekci
Obranná reakce na infekci mykobakteriemi je mimořádně komplexní a podílejí se na ni jak fyziologické obranné bariéry, mechanismy nespecifické i specifické imunity, tak i faktory přirozené genetické rezistence. Při nejčastější formě vstupu M. tuberculosis do organismu dýchacími cestami je většina těchto ataků likvidována faktory specifické a nespecifické imunity na površích dýchacích cest (45). Adherující mykobakteriální buňky jsou velmi rychle fagocytovány plicními makrofágy. Dle současných poznatků má i nespecifická imunita schopnost rozpoznávat „nebezpečné vzory“, které pro ni představují v případě povrchových struktur M. tuberculosis lipoarabinomanan a muramylpeptid.
Zásadní roli v této nespecifické imunitní reakci hrají buňky monocyto-makrofágového systému. Na povrchu těchto buněk je paradoxně přítomna řada receptorů, které usnadňují průnik mykobakterií do nitra makrofágu – collectiny, povrchový protein A, membránový protein CD-14, receptory pro FC fragment imunoglobulinů, „scavenger“ receptory a Toll-like receptory. Na tomto ději se rovněž podílí aktivace komplementu povrchovými mykobakteriálními strukturami, která umožní vazbu mykobakterií na receptory pro komplement (CR-1, CR-2, CR-3 a CR-4).
Po fagocytóze mykobakterií dochází k výrazné produkci pluripotentních cytokinů, které způsobují diferenciaci TH0 lymfocytů do TH1 a TH2 subsetů T lymfocytárního systému. Kromě cytokinů se na tomto procesu podílejí další faktory jako například kostimulační molekuly. Vyzrávání TH1 T lymfocytů s cytotoxickými účinky potencuje zejména IL12 a IL 18 (1). Tyto lymfocyty jsou pro obranu proti infekci velmi důležité, protože produkují cytokiny (INFγγ, TNFαα) zpětně aktivující makrofágy. Fagocytované mykobakterie jsou usmrcovány pouze těmito „aktivovanými makrofágy“. INFγγ a TNFαα stimulují tvorbu NADPH oxidázy a reaktivních produktů dusíkového metabolismu, čímž výrazně zvyšují cidní aktivitu makrofágů. Tato aktivita je naopak tlumena cytokiny (IL-10, IL-4, TGFββ) produkovanými TH2 T lymfocyty a subsetem T lymfocytů označovaným jako Tc3.
Pro úspěšnost procesu má zásadní význam transportní membránový protein asociovaný s membránou fagozomu a regulující pravděpodobně vytvoření fagozosmu. Je kódován skupinou genů Nramp-1 a má zřejmě podstatnou roli v geneticky podmíněné rezistenci vůči mykobakteriím (18).
Aktivovaný makrofág je zdrojem prozánětlivých a chemotakticky aktivních cytokinů, které jsou zodpovědné za tvorbu granulomu. Do protektivní imunitní odpovědi se zapojuje specifická, buňkami zprostředkovaná imunita. Její aktivace je zajištěna makrofágy prostřednictvím cytokinů, které jednak zesilují vyzrávání T lymfocytů, jednak mění jejich povrchové vlastnosti tak, aby mohly cíleně migrovat do míst s probíhající infekcí. U člověka představují největší část této populace fenotypově CD4-/CD8 - lymfocyty.
Buňkami zprostředkovaná imunita se plně rozvíjí po cca 3 týdnech od začátku infekce. Její působení je ale spojeno jak s eliminací mykobakteriální infekce, tak s poškozením infikovaných tkání cytotoxickou reakcí v průběhu imunitní odpovědi. Uzdravení nemocného je spojeno s vyváženou a dobře časovanou aktivitou subsetů TH1 a TH2 T lymfocytů (3). Protilátky, které se v průběhu mykobakteriální infekce rovněž vytvářejí, nemají projektivní charakter.
Při setkání mykobakterie s makroorganismem mohou nastat v zásadě čtyři situace:
V případě dostatečně účinné imunitní odpovědi dojde k rychlému usmrcení všech fagocytovaných buněk, aniž by došlo k manifestním projevům infekce a k onemocnění.
Při nedostatečně účinné imunitní odpovědi dojde k množení mykobakterií uvnitř makrofágů, šíření infekce a k manifestaci onemocnění.
Pokud je imunitní odpověď pouze částečně účinná, není organismus schopen eliminovat mykobakterie. Dochází k lokalizované infekci a ke vzniku primárního komplexu. Nedochází k manifestaci onemocnění a pacient rovněž není infekční.
V případě oslabení imunity z různých příčin může dojít k reaktivaci infekčního procesu a rozvoji onemocnění.
Laboratorní diagnostika
V diagnostice tuberkulózy hrají důležitou roli laboratorní vyšetření, která prodělala v posledních letech bouřlivý vývoj. V zásadě je lze rozdělit na přímé diagnostické metody, jimiž se prokazuje přítomnost živé mykobakterie nebo její části – např. nukleové kyseliny – a nepřímé metody, detekující patofyziologickou reakci makroorganismu na přítomnost mykobakterie. Většinou se jedná o aktivaci imunitního systému.
Přímý průkaz mykobakterií je v současné době možné provádět mikroskopicky, kultivačně a průkazem nukleových kyselin. Rutinní diagnostické laboratoře v podstatě kombinují jednotlivé metody s cílem poskytnout optimální kompromis mezi odbornými požadavky na diagnostiku a náklady na toto vyšetření.
Mikroskopické vyšetření
Standardně se provádí u všech typů vzorků biologického materiálu s výjimkou výtěru (laryngální výtěr popřípadě jiné stěry). V praxi se standardně používá Ziehl-Neelsenovo barvení nebo fluorescenční barvení. Obě metodiky dávají přibližně shodné výsledky, a je zajímavé, že přes veškeré vědeckotechnické pokroky zatím není v praxi k dispozici zobrazovací technika, která by poskytovala výrazně lepší výsledky. Nevýhodou mikroskopie je velmi nízká senzitivita i specifita. Pro pozitivní výsledek je nutná koncentrace mykobakterií alespoň 1 000 bb/ml ve vyšetřovaném vzorku. V závislosti na podmínkách se mikroskopicky zachytí 20 až 40 % pozitivních vzorků. Výhodou je rychlost vyšetření a nízká cena.
Klasická kultivace
Rovněž se standardně provádí u všech typů vzorků. Používají se současně tekuté a pevné (v Čechách nejčastěji vaječné) kultivační půdy. Základním problémem je dlouhá replikační doba mykobakterií (24 hodin oproti 30 minutám u enterobakterií). Základní doba kultivace je šest týdnů, řada laboratoří sice vydá výsledky, ale pokračuje v kultivaci ještě dalších tři až šest týdnů. Není výjimkou, že jsou pomalu rostoucí kmeny M. tuberculosis diagnostikovány až devátý týden.
Klasická kultivace je stále považována za zlatý standard, je vysoce senzitivní, cenově rovněž vychází přijatelně.
Metabolické metody – „rychlá kultivace“
V principu se jedná o kultivaci v tekuté kultivační půdě. Růst mykobakterií je detekován senzorem, který reaguje na změny koncentrace kyslíku nebo oxidu uhličitého v kultivační půdě, způsobené metabolismem bakterií. Rychlost detekce závisí na množství bakteriálních buněk přítomných ve vzorku a na jejich metabolické aktivitě. Průměrná doba detekce pozitivního vzorku je 13–14 dní, v případě masivního vylučování mykobakterií může být i pouhé dva dny. Tuto metodiku lze využít i pro stanovení citlivosti na antituberkulotika, konečný výsledek včetně citlivosti je pak laboratoř schopna poskytnout během tří týdnů.
Výrobci používají vysoce kvalitní kultivační půdy, což se odráží ve vysoké senzitivitě metody, která často převyšuje klasickou kultivaci zejména v laboratořích, které si samy připravují kultivační půdy. Metabolické metody jsou už rozšířeny i v České republice, nevýhodou je jejich vyšší cena.
Bakteriofágový test
V posledních letech byla vyvinuta relativně jednoduchá a cenově přístupná kultivační technika využívající bakteriofága specifického pro M. tuberculosis (22, 24). Tímto bakteriofágem je infikován zkoumaný vzorek biologického materiálu, který je poté naočkován na kultivační půdu společně s bakterií, kterou tento bakteriofág lyzuje. Obsahuje-li vzorek živé mykobakterie, bakteriofág se v nich pomnoží a poté lyzuje citlivé bakterie v okolí. Přítomnost mykobakterií se projeví jako zóny inhibice růstu. Metodiku lze využít i pro stanovení citlivosti na antituberkulotika (43). Výhodou je rovněž rychlost detekce.
Průkaz nukleové kyseliny
Využití genetických metod má dlouhou historii. Pro průkaz mykobakterií se tyto metody přímo nabízejí pro svoji rychlost a cílené vyšetření. Prakticky všechny metodiky, které byly v této oblasti vyvinuty, byly zároveň vyzkoušeny jak pro identifikaci mykobakterií, tak i pro jejich průkaz přímo v klinickém vzorku.
Nejenom laboratoře v České republice, ale i v jiných rozvinutých zemích velmi často požívají tak zvané „home made“ nebo „in house“ metodiky. Jde buď o klasickou PCR nebo novější varianty této techniky, v poslední době velmi často o „real time“ PCR. V principu si laboratoř sestaví vlastní reakci na základě komerčně dostupných komponent. Výhodou je podstatně nižší cena vyšetření, nevýhodou obtíže s certifikací metody a validací výsledků.
V současné době je k dispozici řada komerčně dostupných diagnostických souprav poskytujících validní výsledky. Po metodické stránce využívají techniku PCR, často ve velmi složité, sofistikované formě. Problémem detekce M. tubeculosis je neexistence vhodné sondy specifické pouze pro tento druh. Používaná sonda je společná pro všechny species zahrnuté pod M. tuberculosis komplex. V případě nakultivovaného kmene je nutné dourčení některým z klasických identifikačních testů. Pokud se nejedná o M. tuberculosis, jsou dostupné sondy na další mykobakterie (M. bovis BCG, M. kansasii, M. avium a další, popřípadě sonda pro rod Mycobacterium). Problém provedení několika amplifikačních reakcí najednou řeší multiplex PCR.
Poněkud jinou cestou jdou metody založené na dvou, po sobě jdoucích postupech. V prvém se amplifikuje kromě vlastní sondy ještě další část genomu. Většinou se využívají oblasti 16S – 23S rRNA, které umožňují dosáhnout vyšší citlivosti reakce, protože bakteriální buňka obsahuje podstatně více RNA. Namnožená nukleová kyselina je ve druhém kroku identifikována pomocí hybridizace se specifickou sondou, popřípadě dalšími metodami, jako jsou štěpení endonukleázami a identifikace na základě štěpných produktů, microarray (v podstatě hybridizační reakce s velkým množstvím sond navázaných na speciálním nosiči) nebo sekvenací (stanovení pořadí bází).
V praxi se nejlépe uplatnily „stripové“ metody, kdy jsou specifické hybridizační DNA sondy fixovány na plastovém proužku. Vlastní detekce je kolorimetrická a celý proces je možné automatizovat. V jednom vyšetření je možné detekovat spektrum až několika desítek mykobakterií. Pro přímou detekci mykobakterií z biologického vzorku je nutné zpravidla použít jiné diagnostické soupravy než pro identifikaci vykultivovaných bakterií. V obou případech je senzitivita těchto metod vyšší než 85 % a specifita se blíží 100 % (9, 41, 35, 34).
Významnou roli lze od genetických metod očekávat v oblasti stanovení citlivosti na antituberkulotika. Na rozdíl od enterobakterií nebo stafylokoků, kde jsou za rezistenci k jednomu typu antibiotik často zodpovědné různé mechanismy kódované navzájem přenosnými geny (např. různé typy betalaktamáz), je situace u mykobakterií podstatně jednodušší. V současné době jsou známy geny rezistence M. tuberculosis na základní antituberkulotika, fluorochinolony a některá další antituberkulotika druhé řady. Stripové metody umožňují vedle identifikace mykobakterie detekovat rezistenci na isoniazid a rifampicin, popřípadě na další antituberkulotika (37, 40, 14).
Pro detekci šíření tuberkulózy jsou velmi důležité molekulárně epidemiologické metody, často nazývané „fingerprinting“ metody (19). Jsou schopné s vysokou přesností rozlišit jednotlivé kmeny M. tuberculosis. Za zlatý standard je považována metoda RFLP (restriction fragment length polymorphism) využívající polymorfie lokusu IS6110 (25). Další metody jako spoligotypizace nebo MIRU-VNTR využívají rozdílných počtů opakujících se sekvencí bází.
Amplifikační metody jsou známé svojí obrovskou citlivostí. Jsou schopné detekovat řádově jednotky molekul nukleových kyselin. Tato vlastnost je v praktickém využití poněkud omezena technickými problémy a v některých případech je dokonce i kontraproduktivní. V případě práce s namnoženými mykobakteriemi jsou jejich výsledky prakticky stoprocentní. Poněkud jiná je situace v případě zpracování klinického vzorku. Je nutné počítat s malým procentem falešně negativních výsledků (do 5 % – pozorování autora), které je způsobeno přítomností inhibitorů polymerázové reakce ve vzorku, nebo problémy při zpracování vzorku.
Některé vzorky (např. sputa) se velmi obtížně homogenizují. Na rozdíl od kultivace, kdy se použije celý objem vorku, pro genetickou detekci se odebírá malé množství, které v případě nízkého vylučování mykobakterií nemusí obsahovat hledanou nukleovou kyselinu. Opačně zase může amplifikace zachytit nukleovou kyselinu nemající vztah k infekci mykobakteriemi (kontaminace prostředí).
Detekce aktivace imunitního systému
V současné době prodělala nepřímá detekce onemocnění tuberkulózou obrovský vývojový skok způsobený poznatky v oblasti genomu M. tuberculosis a objevem proteinů specifických pouze pro tento druh. Obecně se těmto nepřímým metodikám říká cytokinové testy a slouží k detekci latentní tuberkulózy. V principu jde o stimulaci imunitního systému antigeny mykobakterií a následnou detekci produkce cytokinů nebo akumulace monocyto-makrofágových buněk a T lymfocytů. Aktivace imunitního systému, zejména TH1 subsetu lymfocytů, nastává velmi rychle po infekci mykobykteriemi a je přítomna po celé latentní období. Oproti tomu aktivní vylučování mykobakterií pacientem, stejně jako případný vzestup protilátek nastává až s manifestací onemocnění. Cytokinové testy tedy umožňují detekci latentní formy tuberkulózy.
Kožní tuberkulinový test (TT)
Je nejstarším testem používaným v moderní medicíně, známým rovněž pod názvem „Mantoux“. K intradermální stimulaci se používá PDP (protein-purified derivate) z Calmette-Guérinova bacilu (BCG). Obsahuje směs více než 200 antigenů, které se ale vyskytují i u řady dalších mykokterií (15). To je příčinou velmi nízké specifity i senzitivity tohoto testu (33).
Produkce interferonu γ (INFγγ)
Na rozdíl od tuberkulinového testu jsou využívány antigeny ESAT-6 a CFP-10 kódované v lokusu RD1. Jsou specifické pro skupinu M. tuberculosis komplex. V případě onemocnění tuberkulózou produkují efektorové buňky INFγγ již během několika hodin po stimulaci těmito antigeny, zatímco v případě paměťových T lymfocytů je tato odezva až po 24 hodinách. Tímto způsobem je možné odlišit aktuální infekci od proběhlého onemocnění. Reakce se provádí in vitro ve vzorku odebrané krve, vlastní průkaz produkce INFγγ je pomocí ELISA metodiky.
V současné době jsou k dispozici dva komerčně vyráběné testy. V praxi je nejvíce používaný QuantiFERON-TB Gold (Cellestis Ltd, Australia). Pomocí techniky ELISPOT (enzyme-linked immunospot assay) je možné kvantifikovat množství aktivovaných T lymfocytů. Tento test je ale technicky náročnější (T-SPOT.TB, Oxford Immunotec, Oxford, UK).
V posledních letech byla publikována řada studií porovnávajících cytokinové testy s kožním testem. Metaanalýzy těchto prací jednoznačně ukazují na lepší výsledky cytokinových testů (5, 28). Diagnostika latentní turkulózy pomocí těchto testů ale závisí na klinické formě onemocnění a na expozici tuberkulózou. Například u extrapulmonální tuberkulózy byly výsledky cytokinových testů lepší v zemích s nízkou prevalencí TBC, v zemích s vysokou prevalencí byly shodné s TT.
Pro naši populaci je podstatné, že cytokinové testy vykazují výrazně lepší výsledky oproti TT u pacientů imunizovaných BCG vakcínou (4). U imunokompromitovaných a HIV pozitivních pacientů vykazují rovněž méně falešně negativních výsledků. Výsledek u těchto pacientů je ale závislý na množství T lymfocytů v krvi pacienta.
Speciální diagnostické postupy
Laboratorní diagnostika tuberkulózy má svá specifika. Klasická kultivace je kromě časového faktoru technologicky náročná, moderní metody využívají složitou a drahou techniku. I ve vyspělých zemích je náročné vybudovat dobře fungující laboratoř pro diagnostiku mykobakterií. Paradoxně země, kde je nejvyšší prevalence tuberkulózy, patří mezi ty nejchudší a i klasické kultivační metody jsou pro ně často příliš drahé. To vede k vývoji specifických postupů s cílem zachytit pokud možno nejmenšími náklady co největší počet případů latentní a rozvinuté tuberkulózy, MDR-TB a XDR-TB. Základem je mikroskopické vyšetření. V případě negativního výsledku je doplněno krevními cytokinovými testy nebo kultivací v tekuté půdě v mikrodestičce s průkazem živých mykobakteriálních buněk speciálním barvením (Alamar Blue Assay) (29).
Interpretace laboratorních výsledků
Pro laboratorní diagnostiku tuberkulózy je v současné době dostupná řada různých metod. Každá má své limity a pro stanovení diagnózy je velmi důležitá správná interpretace jejich výsledků. Do klasického schématu laboratorního vyšetření materiálu (obr. 1) dnes patří i genetické metody. Vzhledem k odlišné technologii se často provádějí v jiné laboratoři než klasická kultivace, což může být zdrojem problémů s interpretací výsledku.
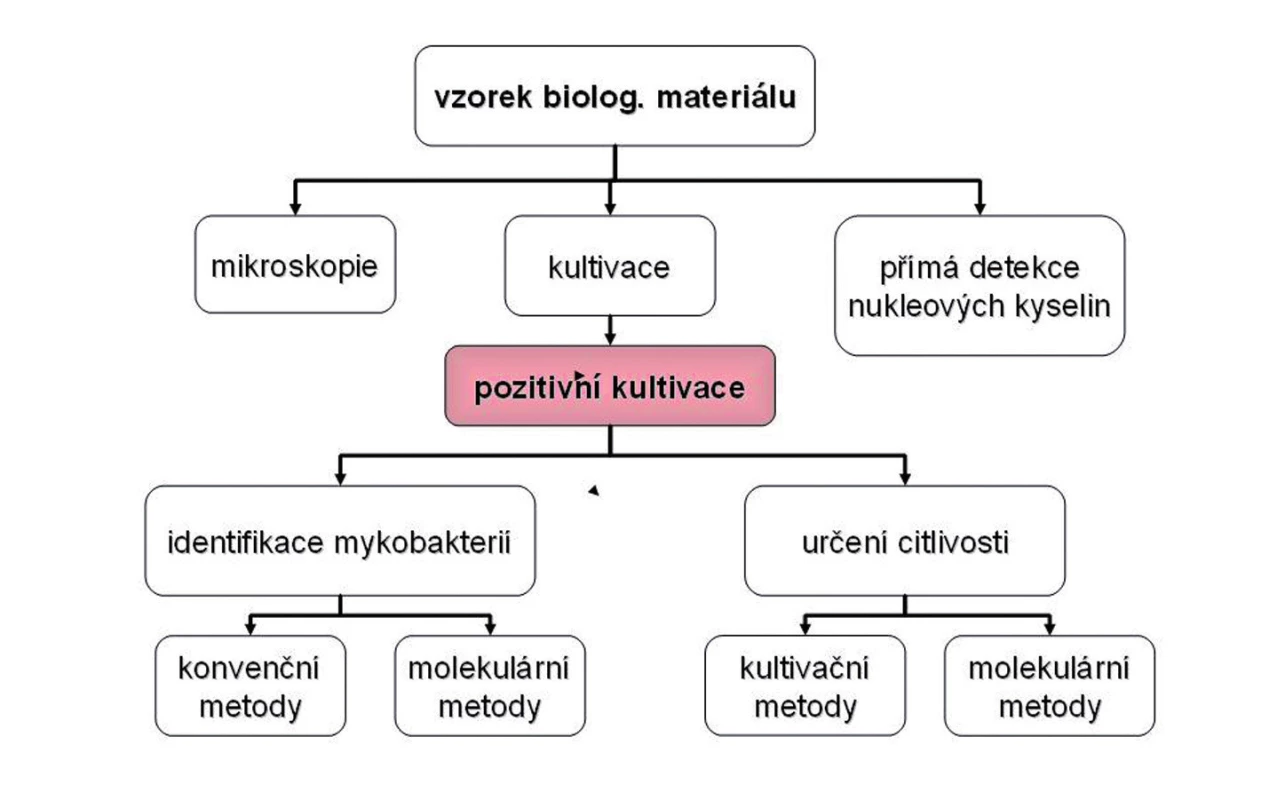
Co nám výsledky jednotlivých metod říkají:
Mikroskopie vzorku:
nález acidorezistentních tyček je velmi suspektní pro rozvinuté onemocnění. Až na výjimky (např. M. avium-intracelulare komplex) se ale nedá určit, o jakou mykobakterii se jedná. Falešně pozitivní nález mohou rovněž způsobit jiné acidorezistentně se barvící bakterie nebo nečistoty. Negativní nález vzhledem k nízké senzitivitě metody nevylučuje onemocnění.
Kultivační vyšetření včetně metabolických metod:
pozitivní výsledek, zachycení živého M. tuberculosis byl považován za jednoznačný průkaz onemocnění. Vysoká citlivost metabolických metod může ve výjimečných situacích způsobit falešnou pozitivitu v případě, že je vzorek sputa odebrán v krátkém časovém úseku po infekci, kdy ještě nebyly všechny mykobakterie, se kterými se pacient setkal, fagocytovány a lyzovány (pozorování autora). Negativní výsledek nutně nevylučuje onemocnění, může znamenat pouze to, že v době odběru pacient žádné mykobakterie nevylučoval.
Vyšetření klinického vzorku genetickými metodami:
pozitivní výsledek znamená pouze průkaz genomu mykobakterie. Může se jednat o genom mrtvé mykobakterie, vysoká citlivost amplifikační metody umožňuje zachytit kontaminaci prostředí (pacient se mohl pohybovat v prostředí, které bylo kontaminováno jiným zdrojem). Na jednom pozitivním výsledku tohoto typu vyšetření rozhodně nelze stavět diagnózu tuberkulózy. Negativní výsledek s vysokou pravděpodobností onemocnění vylučuje.
Cytokinové testy:
výsledky kožního testu jsou v podmínkách naší prakticky stoprocentně proočkované populace problematicky hodnotitelné. Pozitivní výsledek produkce INFγγ jednoznačně hovoří pro onemocnění tuberkulózou. Negativní výsledek ji s vysokou pravděpodobností vylučuje, problémem jsou imunosuprimovaní pacienti, kterých stále přibývá.
Z výše uvedeného vyplývá, že ani jedna z laboratorních metod není sama o sobě dostačující pro stanovení diagnózy. Základem musí být komplexní vyšetření a laboratorní výsledky je bezpodmínečně nutné posuzovat v souvislosti s klinickým nálezem. Nesprávné stanovení diagnózy tuberkulóza má závažné dopady pro pacienta, v opačném případě může dojít ke společensky nebezpečnému šíření onemocnění. Z těchto důvodů je nutné kultivační a genetické vyšetření opakovat.
Základní pravidla pro odběr materiálu
Nejlepších výsledků se docílí odběrem tekutého vzorku biologického materiálu, popřípadě tkáně. Výtěrovky nejsou příliš vhodné, protože se vzorek musí před zpracováním dekontaminovat, aby se odstranila nespecifická, rychle rostoucí bakteriální příměs. Rovněž z nich nelze připravit kvalitní mikroskopický preparát. Pokud není zbytí, je nutné použít výtěrovku bez transportní půdy.
V případě plicní tuberkulózy je nejvhodnějším vzorkem správně odebrané sputum. Stále platí pravidlo minimálně tří vzorků odebraných ve třech různých dnech. To je důležité pro zachycení časného stádia onemocnění, kdy se mykobakterie vylučují v malém množství a je vhodné, aby byly ve sputu pokud možno koncentrované. Dekontaminací se totiž sníží počet životaschopných buněk přibližně o jeden řád. Velmi důležitá je dobrá spolupráce laboratoře provádějící kultivaci s genetickou laboratoří. Sputum je nutné nejprve homogenizovat, teprve poté je nejvýhodnější oddělit část pro průkaz genomu. Opačně je nebezpečí, že se oddělí část vzorku, která nebude žádné mykobykterie obsahovat.
Pro průkaz genomu v krvi se odebírá nesrážlivá krev. Hemokultivační automaty obou hlavních výrobců (Bactec, BacT/ /Alert) nabízejí možnost hemokultivace mykobakterií ve speciálních lahvičkách. Pro mykobakterie není typický septický průběh onemocnění. Výjimkou jsou imunokompromitovaní pacienti, zejména s AIDS, kde je toto vyšetření na místě.
Závěr
Laboratorní diagnostika tuberkulózy udělala značný pokrok zejména díky poznatkům na molekulární úrovni. Vedle kultivačních metod máme k dispozici genetické metody a cytokinové testy. Pro stanovení správné diagnózy ale není žádná z nich sama o sobě dostačující. Je nutné komplexní hodnocení jejich výsledků v návaznosti na klinický stav pacienta a na klinické diagnostické metody. Neméně důležitá je mezioborová spolupráce a správný odběr materiálu.
doc. MUDr. Pavel Čermák, CSc.
Oddělení klinické mikrobiologie
Fakultní Thomayerova nemocnice s poliklinikou
Vídeňská 800
140 59 Praha 4 – Krč
E-mail: pavel.cermak@ftn.cz
Sources
1. Altare, F., Durandy, A., Lammas, D. et al. Impairment of mycobacterial immunity in human interleukin-12 receptor deficiency. Science 1998, 280, p. 1432-1435.
2. Brosch, R., Gordon, S.V., Marmiesse, M. et al. A new evolutionary scenario for the Mycobacterium tuberculosis complex. Proc. Natl. Acad. Sci. U.S.A. 2002, 99, p. 3684–3689.
3. Cooper, A.M., Flynn, J.L. The protective immune response to Mycobacterium tuberculosis. Cur. Opin. Immunol. 1995, 7, p. 512-516.
4. Diel, R., Ernst, M., Doscher, G. et al. Avoiding the effect of BCG vaccination in detecting Mycobacterium tuberculosis infection with a blood test. Eur. Respir. J. 2006, 28, p. 16-23.
5. Dinnes, J., Deeks, J., Kunst, H. et al. A systematic review of rapid diagnostic tests for the detection of tuberculosis infection. Health. Technol. Asses. 2007, 11, p. 1-196.
6. Ernst, J.D., Trefeno-Nunez, G., Banaiee, N. Genomics and the evolution, pathogenesis, and diagnosis of tuberculosis. J. Clin. Invest. 2007, 117, p. 1738–1745.
7. Espinal, M.A., Simonsen, L., Laszlo, A. et al. Anti-tuberculosis drug resistance in the world, report no. 2: Prevalence and trends [on line]. 1st ed. Geneva: WHO, c. 2000 [cit. 2009-10-21]. Dostupný z WWW: <http://www.whqlibdoc.who.int/hq/2000/WHO_CDS_TB_2000.278_intro.pdf>
8. Ewann, F., Jackson, M., Pethe, K. et al. Transient requirement of the PrrA-PrrBTwo component system for early intracellular multiplication of Mycobacterium tuberculosis. Infect. Immun. 2002, 70, p. 2256-2263.
9. Franco-Alvarez de Luna, Ruiz, F., Gutierrez, J., Casal, M. Evaluation of the GenoType mycobacteria direct assay for detection of Mycobacterium tuberculosis complex and four atypical mycobacterial species in clinical samples. J. Clin. Microbiol. 2006, 44, p. 3025-3027.
10. Gagneux, S., DeRiemer, K., Van, T. Variable host-pathogen compatibility in Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U.S.A. 2006, 103, p. 2869–2873.
11. Gamboa, F., Fernandez, G., Padilla, E. et al. Comparative evaluation of initial and new versions of the Gen-Probe amplified Mycobacterium tuberculosis direct test for direct detection of Mycobacterium tuberculosis. J. Clin. Microbiol. 1998, 36, p. 684-689.
12. Gao, L.Y., Guo, S., McLaughlin, B. et al. A mycobacterial virulence gene cluster extending RD1 is required for cytolysis, bacterial spreading and ESAT-6 secretion. Mol. Microbiol. 2004, 53, s. 1677–1693.
13. Havelková, M., Šimáková, T., Príkazský, V. Výroční zpráva o mykobykteriologické diagnostice v České republice v roce 2007. [on line]. 2008-12-3 [cit. 2009-10-21]. Dostupný na WWW: <http://www.szu.cz/tema/prevence/vyrocni-zprava-o-mykobykteriologicke-diagnostice-v-ceske.html>
14. Hillemann, D., Rusch-Gerdes, S., Richter, E. Evaluation of the GenoType MTBDRplus assay for rifampin and isoniazid susceptibility testing of Mycobacterium tuberculosis strains and clinical specimens. J. Clin. Microbiol. 2007, 45, p. 2635–2640.
15. Huebner, R.E., Schein, M.F., Bass, J.B. Jr. The tuberculin skin test. Clin. Infect. Dis. 1993, 17, p. 968–975.
16. International Consortium on Tuberculosis. Why study tuberculosis? [on line]. 2008 [cit. 2009-10-21]. Dostupný na WWW: <http:// www2.ku.edu/~lba/Test/TB/ICTM.html>
17. Kamerbeek, J., Schouls, L., Kolk, A., et al. Simultaneous detection and strain differentiation of Mycobacterium tuberculosis for diagnosis and epidemiology. J. Clin. Microbiol. 1997, 35, p. 907–914.
18. Kim, J.H., Lee, S.Y., Sin, C. et al. NRAMP1 genetics polymorphisms as a risk factor oftuberculous pleurisy. Int. J. Tuberc. Lung. Dis. 2003, 7, p. 370-375.
19. Lemaitre, N., Sougakoff, W., Truffot-Pernot, C. et al. Use of DNA fingerprinting for primary surveillance of nosocomial tuberculosis in a large urban hospital: detection of outbreaks in homeless people and migrant workers. Int. J. Tuberc. Lung. Dis. 1998, 2, p. 390–396.
20. Macela, A. a kol. Infekční choroby a intracelulární parazitismus bakterií. 1. vyd. Praha: Grada, 2006. 216 s. ISBN 80-247-0664-4.
21. Marais, B.J., Brittle, W., Painczyk, K. et al. Use of light-emitting diode fluorescence microscopy to detect acid-fast bacilli in sputum. Clin. Infect. Dis. 2008, 47, p. 203-207.
22. Mole, R.J., Maskell, T.W.O. Phage as a diagnostic - the use of phage in TB diagnosis. J. Chem. Technol. Biotechnol. 2001, 76, p. 683–688.
23. Moorem D., Mendoza, D., Gilman, R.H. et al. Tuberculosis Working Group in Peru. Microscopic observation drug susceptibility assay, a rapid, reliable diagnostic test for multidrug-resistant tuberculosis suitable for use in resource-poor settings. J. Clin. Microbiol. 2004, 42, p. 4432–4437.
24. Muzaffar, R., Batool, S., Aziz, F. et al. Evaluation of the FASTPlaqueTB assay for direct detection of Mycobacterium tuberculosis in sputum specimens. Int. J. Tuberc. Lung. Dis. 2002, 6, p. 635–640.
24. Neonakis, I.K., Gitti, Z., Krambovitis, E., Spandidos, E.A. Molecular diagnostic tools in mycobacteriology. J. Microbiol. Methods 2008, 75, p. 1-11.
25. Oelemann, M.C., Diel, R., Vatin, V. et al. Assessment of an optimized mycobacterial interspersed repetitiveunit-variable-number tandem-repeat typing system combined with spoligotyping for population-based molecular epidemiology studies of tuberculosis. J. Clin. Microbiol. 2007, 45, p. 691–697.
26. Pai, M., Kalantri, S., Heda, K. New tools and emerging technologies for the diagnosis of tuberculosis: Part I. Latent tuberculosis. Expert. Rev. Mol. Diagn. 2006, 6, p. 413-422.
27. Pai, M., Zwerling, A., Menzies, D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann. Intern. Med. 2008, 149, p. 177-184.
28. Palomino, J., Martin, A., Von Groll, A., Portaels, F. Rapid culture-based methods for drug-resistance detection in Mycobacterium tuberculosis. J. Microbiol. Methods 2008, 75, p. 161-166.
29. Piersimoni, C., Scaparo, C., Piccoli, P. et al. Performance assessment of two commercial amplification assays for direct detection of Mycobacterium tuberculosis complex from respiratory and extrapulmonary specimens. J. Clin. Microbiol. 2002, 40, p. 4138-4142.
30. Piersimoni, C. Scaparo, C. Relevance of commercial amplification methods for direct detection of Mycobacterium tuberculosis complex in clinical samples. J. Clin. Microbiol. 2003, 41, p. 5355-5365.
31. Richardson, E.T., Samson, D., Banaei, N. Rapid Identification of Mycobacterium tuberculosis and nontuberculous mycobacteria by multiplex, real-time PCR. J. Clin. Microbiol. 2009, 47, p. 1497-1502.
32. Richeldi, L. An update on the diagnosis of tuberculosis infection. Am. J. Respir. Crit. Care. Med. 2006, 174, p. 736-742.
33. Richter, E., Rusch-Gerdes, S., Hillemann, D. Evaluation of the GenoType Mycobacterium assay for identification of mycobacterial species from cultures. J. Clin. Microbiol. 2006, 44, p. 1769–1775.
34. Russo, C., Tortoli, E., Menichella, D. Evaluation of the new GenoType Mycobacterium assay for identification of mycobacterial species. J. Clin. Microbiol. 2006, 44, p. 334–339.
35. Shah, N.S., Wright, A., Bai, G.H. et al. Worldwide emergence of extensively drug-resistant tuberculosis. Emerg. Infect. Dis. 2008, 13, p. 380-387.
36. Sharma, M., Sethi, S., Mishra, B. et al. Rapid detection of mutations in rpoB gene of rifampicin resistant Mycobacterium tuberculosis strains by line probe assay. Indian J. Med. Res. 2003, 117, p. 76–80.
37. Shenai, S., Rodrigues, C., Mehta, A. Rapid speciation of 15 clinically relevant mycobacteria with simultaneous detection of resistance to rifampin, isoniazid, and streptomycin in Mycobacterium tuberculosis complex. Int. J. Infect. Dis. 2009, 13, p. 46-58.
38. Soini, H., Musser, J.M. Molecular diagnostic of mycobacteria. Clin. Chem. 2001, 47, p. 809-814.
39. Tortoli, E., Marcelli, F. Use of the INNO LiPA Rif.TB for detection of Mycobacterium tuberculosis DNA directly in clinical specimens and for simultaneous determination of rifampin susceptibility. Eur. J. Clin. Microbiol. Infect. Dis. 2007, 26, p. 51–55.
40. Tortoli, E., Mariottini, A., Mazzarelli, G. Evaluation of INNO-LiPA MYCOBACTERIA v2: improved reverse hybridization multiple DNA probe assay for mycobacterial identification. J. Clin. Microbiol. 2003, 41, p. 4418–4420.
41. vanHelden, P.D. The economic divide and tuberculosis. Tuberculosis is not just a medical problem, but also a problem of social inequality and poverty. ENBO Rep. 2003, 4, Spec., S24-S28.
42. Wilson, S.M., al-Suwaidi, Z., McNerney, R. et al. Evaluation of a new rapid bacteriophage-based method for the drug susceptibility testing of Mycobacterium tuberculosis. Nat. Med. 1997, 3, p. 465–468.
43. Wrigtt, A., Zignol, M. Anti-tuberculosis drug resistance in the world: fourth global report [on line]. 1st ed. Genova: WHO, c. 2008 [cit. 2009-10-21]. Dostupný z WWW: <http://www.whqlibdoc. who.int/hq/2008/WHO_CDS_TB_2008.394_eng. pdf>
44. Zhang, P., Summer, W.R., Bagby, G.J., Nelson, S. Innate immunity and pulmonary host defense. Immunol. Rev. 2000, 173, p. 39-51.
45. Zignol, M., Hosseini, M.S., Wright, A. et al. Global influence of multi-drug resistant tuberculosis. J. Infect. Dis. 2006, 194, p. 479-485.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2009 Issue 12
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
-
All articles in this issue
- Možnosti a potřeba hodnocení nosní průchodnosti v oboru nemoci z povolání
- Kouření, závislost na tabáku a současné možnosti léčby
- Pozitivní myšlení, pozitivní motivace, suportivní psychoterapie a lékařská praxe
- Jedovaté ryby – hrozby teplých moří
- Komplikovaná akutní rinosinusitida
- Tuberkulóza – stále aktuální problém
- Význam funkčních testů v diagnostice subklinických forem nedostatečnosti nadledvin – nové možnosti
- Prognostické faktory úspěšnosti extrakorporální litotrypse
- Spokojenost pacientů s poskytovanou péčí: metody a jejich použití
- General Practitioner
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Jedovaté ryby – hrozby teplých moří
- Význam funkčních testů v diagnostice subklinických forem nedostatečnosti nadledvin – nové možnosti
- Komplikovaná akutní rinosinusitida
- Možnosti a potřeba hodnocení nosní průchodnosti v oboru nemoci z povolání
