Mikrobióm, respiračné alergie a perspektíva liečby
Microbiome, respiratory allergy, and a perspective of treatment
At present, many scientific institutions focus their attention on microbiome and its influence on human health. It is assumed that changes in microbiome are also responsible for pathogenesis of respiratory diseases (COPD, cystic fibrosis), as well as for pathogenesis of respiratory allergies (rhinitis, asthma). Micro-world regulates the homeostasis by (1) immunologic, (2) metabolic mechanisms and by (3) control chronic inflammatory processes.
Contemporary knowledge on dysbiosis in chronic diseases opens new perspectives for treatment by modulation of altered state. Schemes target the dysbiotic microflora as potential option for such treatment. Probiotics, prebiotics, combinatory approaches and perspectively gut microbiota transplantation are considered.
The main aim of the review is to show the new perspectives of respiratory disease control, especially respiratory allergies by the regulation of the microbiome and the homeostatic processes in the human body.
Keywords:
microbiome – allergy – respiratory organs – treatment
:
N. Lukán 1; A. Chmelárová 2
:
IV. interná klinika UPJŠ LF a UNLP, Košice
Prednosta: prof. MUDr. Ivan Tkáč, CSc.
1; Ústav experimentálnej medicíny UPJŠ LF Košice
Prednosta: MVDr. Alojz Bomba, DrSc.
2
:
Prakt. Lék. 2015; 95(3): 110-113
:
Of different specialties
Mikrobióm a jeho vplyv na ľudský organizmus je v súčasnosti stredobodom pozornosti výskumov mnohých vedeckých inštitúcií. Predpokladá sa, že zmeny mikrobiómu zohrávajú významnú úlohu aj v patogenéze chorôb dýchacích orgánov (chronická obštrukčná bronchopulmonálna choroba, cystická fibróza) nevynímajúc respiračné alergie (rinitída, astma). Mikrobiálne prostredie organizmu ovplyvňuje homeostázu niekoľkými spôsobmi, a to: 1. imunologickými mechanizmami, 2. re-guláciou systémových metabolických procesov a 3. reguláciou mechanizmov chronického zápalu.
Súčasné poznatky o vplyve mikroenvironmentu a jeho dysbióze pri chronických chorobách otvárajú nové perspektívy liečby korekciou alterovaných pomerov. Postupy sú zamerané na moduláciu mikroflóry ako potenciálnej liečby chronických chorôb. Skúšajú sa podávať probiotiká, prebiotiká, ich kombinácia, respektíve sa do budúcnosti uvažuje o kompletnej transplantácii črevného mikrobiómu.
Cieľom príspevku je na základe súčasných vedomostí o mikrobióme dýchacích orgánov poukázať na nové možnosti, ako ovplyvňovaním rovnováhy mikrosveta a makroorganizmu bude možné v budúcnosti kontrolovať respiračné zdravie, osobitne alergie dýchacích orgánov.
Klúčové slová:
mikrobióm – alergia – dýchacie orgány – liečba
ÚVOD
V posledných desaťročiach štatistiky svetovej zdravotníckej organizácie upozorňujú na enormný nárast civilizačných chorôb. Okrem kardiovaskulárnych, onkologických, reumatických a metabolických chorôb patria tu v neposlednom rade i choroby alergické. Alergia je imunologicky definovaná ako stav precitlivenosti spôsobený IgE mechanizmom a postihuje v rôznych formách asi 1/5 všetkých obyvateľov zemegule. Najvýznamnejšou skupinou alergických chorôb sú alergie dýchacích orgánov, a to rinosinusitída a priedušková astma. Respiračné alergie patria medzi neprenosné choroby, pri ktorých chronický zápal spôsobuje opuch sliznice, zúženie dýchacích ciest, a tým obmedzenie transportu vzduchu do alveolov. Samotnou astmou trpí v súčasnosti približne 235 miliónov ľudí, nevynímajúc detskú populáciu. Aj keď respiračné alergie majú relatívne nízku mortalitu zo všetkých civilizačných chorôb, na druhej strane prinášajú zvýšené náklady na zdravotnícku starostlivosť. Priedušková astma má vysoký podiel na opakovaných návštevách pohotovosti, prípadne na akútnych hospitalizáciách (najmä v detskom veku). V konečnom dôsledku respiračné alergie spôsobujú svojim nositeľom zníženie kvality života zvýšením únavy, nedostatkom spánku a obmedzovaním fyzických aktivít, ako aj častými absenciami v škole, či v práci (2).
Príčiny, ktoré spúšťajú a udržiavajú chronický zápalový proces respiračných alergií, nie sú dodnes plne vysvetlené. Predpokladá sa kombinácia významnej genetickej predispozície s nepriaznivými faktormi životného prostredia. Ide najmä o inhaláciu alergénov a cudzorodých častíc, ktoré vyvolávajú vlastnú alergickú reakciu, resp. priamo dráždia dýchacie cesty. Medzi inhalačné spúšťače patria peľové/plesňové/roztočové aeroalergény, srsť domácich miláčikov, vdychované chemické látky najmä v pracovnom prostredí, výfukové plyny, tabakový dym. Častým spúšťačom býva infekcia, najčastejšie vírusová (zo skupiny rinovírusov) a infekcia atypickými patogénmi (Chlamydia pneumoniae). Reaktivitu dýchacích ciest môžu však iniciovať aj iné podnety, a to stres, emócie, chladný vzduch, fyzická námaha, prípadne farmakoterapia (salicyláty, betablokátory, psychofarmaká, antihypertenzíva).
MIKROBIÓM, MYKOBIÓM A VIRÓM
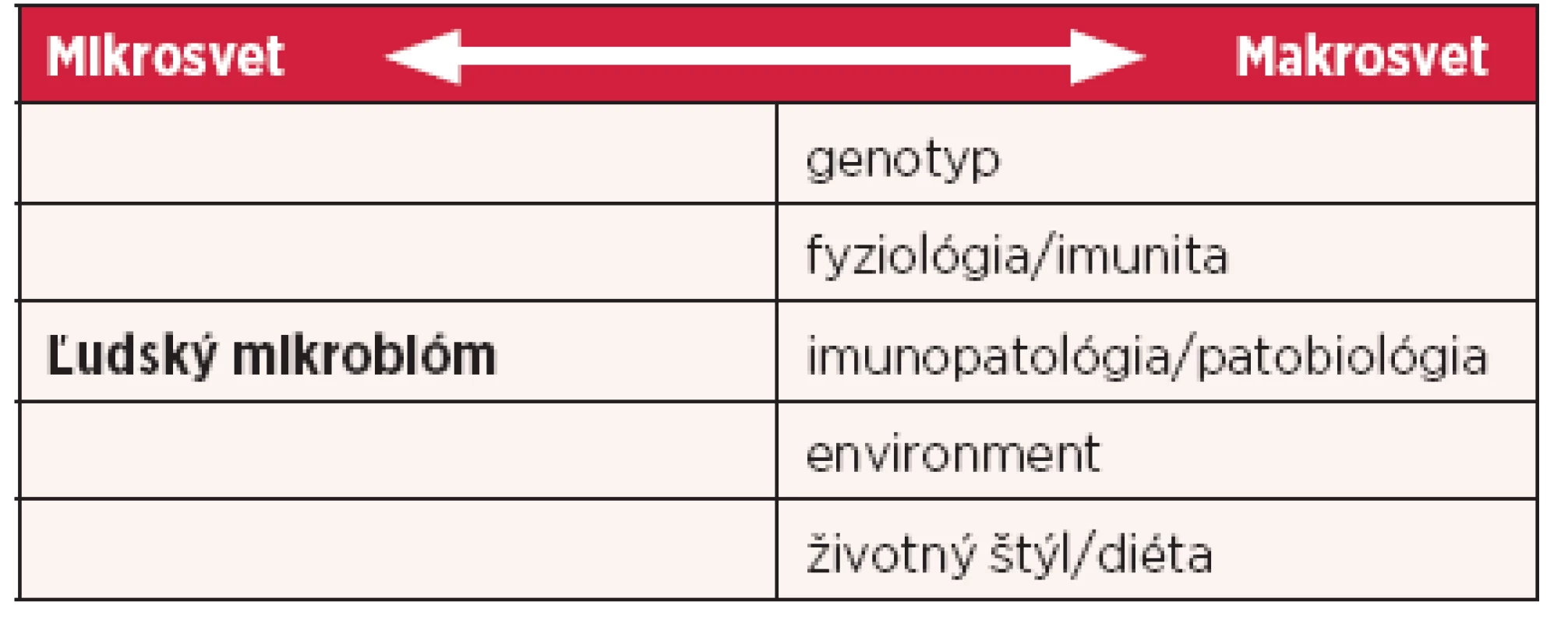
V posledných rokoch sa okrem vyššie spomínaných príčin začína zdôrazňovať vplyv mikrobiálneho osídlenia organizmu v regulácii fyziologických, ako aj patologických procesov – mikrobióm. Ľudský mikrobióm je definovaný ako ekologické spoločenstvo komenzálnych a patogénnych mikroorganizmov, ktoré pokrývajú telesné povrchy a v harmonickej symbióze sa podieľajú na homeostatickej regulácii (tab. 1). Nerovnováha medzi procesmi hostiteľa a mikrobiómom môže spôsobiť vznik choroby. Ľudský mikrobióm obsahuje približne 10-krát viac buniek mikroorganizmov, ako je počet buniek ľudského tela (19). Vzhľadom na nízku hmotnosť mikroorganizmov však celková masa ľudského mikrobiómu predstavuje iba 1–2 kg celkovej telesnej hmotnosti človeka. Mikrobióm zohráva významnú úlohu v patológii mnohých autoimunitných (chronické zápalové ochorenia čriev, reumatoidná artritída), metabolických (diabetes, obezita), neurologických (multiplexná skleróza), nádorových chorôb, ale aj chorôb dýchacích orgánov (astma, chronická obštrukčná bronchopulmonálna choroba, cystická fibróza).
Donedávna sa predpokladalo, že v pľúcach je sterilné prostredie, avšak výsledky štúdie Erb-Downwarda a spolupracovníkov (7) potvrdili existenciu tzv. „core airway microbiota“ (základný mikrobióm dýchacích ciest), ktorý je zhodný u zdravej populácie a líši sa od mikrobiómu pacientov pri rôznych chronických chorobách. Staršie techniky neumožňovali vykultivovať špecifickú flóru distálnych oddielov dýchacích orgánov. Získané kultivácie boli identické s nálezmi z horných dýchacích orgánov, preto sa predpokladalo, že ide o kontamináciu, zhodnú flóru, respektíve, že alveoly sú primárne sterilné. Až špeciálne techniky použitím DNA analýz vzoriek dobrovoľníkov (11) umožnili v pľúcach identifikovať 128 rôznych kmeňov baktérií, pričom na každom štvorcovom cm pľúc sa nachádza asi 2000 rozličných rodov mikroorganizmov (10), ktoré sa líšia od mikrobiómu nosa, prinosových dutín a hltana (graf 1).

Okrem mikrobiómu kolonizuje sliznice aj mykobióm a viróm. Doterajšie výskumy venujú zatiaľ malú pozor-nosť týmto neopomenuteľným členom ekosystému nášho tela. Mykobióm sa javí variabilnejší oproti mikrobiómu a ovplyvňuje aj aktivitu imunitného systému hostiteľa. Intenzívnejšie podlieha vplyvom stravovacích zvyklostí, zmenám environmentu a významnú úlohu zohráva aj pri reštitúcii bakteriálneho osídlenia po antibiotickej liečbe.
Viróm, ktorý je vysoko špecifický a relatívne stabilný pre hostiteľa (1) sa taktiež podieľa na sliznicových regulačných mechanizmoch. Napríklad infekcia rinovírusmi spôsobuje zmnoženie kmeňov Haemophilus influenzae v teréne mikro-biómu u pacientov s chronickou obštrukčnou bronchopulmonálnou chorobou (CHOCHP), pričom podobný nárast sa nezaznamenáva u zdravej populácie. Preto sa javí, že infekcia rinovírusmi alteruje mikrobióm dolných dýchacích orgánov a je dôvodom sekundárnych bakteriálnych infektov (14). Vírusové infekcie sú často primárnou príčinou exacerbácií astmy a chronickej obštrukčnej bronchopulmonálnej choroby. 60–85% všetkých exacerbácií „wheezingu“ (piskotov) a záchvatov astmy je spôsobených práve rinovírusmi. Asociácia infekcie rinovírusmi a exacerbácie prieduškovej astmy je významným dôvodom pre preventívnu liečbu (6) a pre opatrenia v zmysle aktívnej imunizácie (napr. očkovanie proti chrípke). Sezóna respiračných infekcií býva u bežnej populácie spojená so zimným obdobím a podobne je to aj u prevažnej väčšiny exacerbácií astmy a CHOCHP. Predpokladá sa, že individuálna špecificita virómu jednotlivca je príčinou variability exacerbácií a priebehu chronicity pľúcnych chorôb (14).
MIKROBIÓM A IMUNOLÓGIA RESPIRAČNÝCH ALERGIÍ
Počas vývoja plodu zohráva transplacentárna expozícia mikrobiómu matky úlohu pri včasnom dozrievaní imunokompetentných buniek plodu. Vlastný mikrobióm sa v dýchacích orgánoch vyvíja bezprostredne po pôrode, pričom vzájomné ovplyvňovanie črevnej mikroflóry a mikroflóry dýchacích orgánov je spôsobené mikroaspiráciou častíc potravy a druhým smerom počas epizód kašľa a aktivitou mukociliárneho transportu za súčasnej deglutinácie tracheálneho obsahu. Táto novo vznikajúca kolonizácia čreva a dýchacích orgánov má dôležitú úlohu pre vznik rovnováhy Th1/Th2 imunitných mechanizmov.
Podľa hygienickej teórie vzniku alergie je dnes už úplne zrejmé, že izolácia novorodencov z prirodzeného mikrobiálneho prostredia má za následok zvýšený nárast alergických chorôb z dôvodu nedostatočných včasných imunologických podnetov mikroenvironmentu. Aj primerane dlhé dojčenie a vhodná strava sa spolupodieľajú na rovnováhe Th1/Th2 imunitného profilu. Významné objasnenie týchto vzťahov priniesla veľká prierezová štúdia PARSIFAL realizovaná v rokoch 2000–2002 v Rakúsku, Nemecku, Švédsku, Holandsku a Švajčiarsku, do ktorej bolo zahrnutých 8000 detí z farmárskeho a nefarmárskeho (priemyselného) prostredia. Porovnávaním týchto dvoch odlišných prostredí, v ktorých sa deti narodili a vyrastali, sa zistilo, že imunitné podnety „farmárskeho“ mikroprostredia majú preventívny vplyv na rozvoj alergie, ako aj znižujú riziko ďalšej alergénovej senzitizácie (18). Hygienickú teóriu potvrdila okrem iných i nedávna experimentálna štúdia Herbsta et al. (9), ktorá ukázala, že včasná prítomnosť komenzálnej bakteriálnej flóry je rozhodujúca pre normálne dozrievanie a rekruitment imunitných buniek pri kontrole alergického zápalu v dýchacích orgánoch.
Všeobecne povedané, mikrobiálne prostredie organizmu ovplyvňuje imunitný systém tromi cestami (14):
- priamy mechanizmus: Mikroorganizmy regulujú dozrievanie buniek imunitného systému v pľúcach. Kolonizácia sliznice mikróbmi vzniká krátko po pôrode, a tým poskytuje nevyhnutné informácie pre dozrievanie regulačných mechanizmov imunity (T-reg. lymfocyty). Antigén prezentujúce bunky vyžadujú lokálny mikrobióm pre vytvorenie schopnosti tolerovať aeroalergény v budúcnosti (potlačením popôrodnej Th2 dominancie).
- nepriamy mechanizmus: Mikroorganizmy v iných orgánoch (predovšetkým v čreve) ovplyvňujú systémový metabolóm. Črevná mikroflóra umožňuje vstrebávanie mastných kyselín s krátkym reťazcom, ktoré ovplyvňujú hematopoézu v kostnej dreni, a tak nepriamo zvyšujú ochranný účinok namierený proti alergickému zápalu. Pri takto modulovanej hematopoéze novo vzniknuté dendritické bunky v dýchacích orgánoch nie sú schopné aktivovať Th2 mechanizmy, a tým potláčať alergickú zápalovú odpoveď.
- mechanizmus chronického zápalu: Environmentálne vplyvy (fajčenie, polutanty, alergény) spôsobujú poškodenie sliznice a následnú zmenu mikrobiómu (dysbióza). Dysbióza umožňuje pomnoženie patogénnych kmeňov, čím sa aktivuje zápalová odpoveď. Dochádza ku ďalšej zmene mikrobiómu a aktivácii imunitných (celulárnych, humorálnych) zápalových mechanizmov. Úlohu zohrávajú Th17 lymfocyty s fenotypovou dominanciou neutrofilového zápalu. Vzniká tak bludný kruh progresie zápalu/choroby, bez tendencie ku konsolidácii stavu (ťažko liečiteľná astma, astma/CHOCHP prekryvný syndróm, recidivujúca nosová polypóza).
BUDÚCNOSŤ TERAPIE
Doterajšie terapeutické postupy sú zamerané na kontrolu chronického zápalu podávaním protizápalovej liečby (kortikosteroidy), liečby zlepšujúcej ventiláciu (bronchodilatátory, dekongestíva), liečby ovplyvňujúcej alergické mechanizmy (antihistaminiká, antileukotriény, alergénová imunoterapia). V prípadoch infekčnej exacerbácie sa indikuje liečba antibiotikami. Súčasné poznatky o vplyve mikroenvironmentu a jeho dysbióze pri chronických chorobách otvárajú nové perspektívy liečby korekciou alterovaných pomerov. Postupy sú zamerané na moduláciu črevnej mikroflóry ako potenciálnej liečby chronických chorôb. Skúšajú sa podávať probiotiká, prebiotiká, ich kombinácia, respektíve sa do budúcnosti uvažuje o kompletnej transplantácii črevného mikrobiómu (8). Jednoznačné závery o tom, či úprava črevnej mikroflóry ovplyvní aj mikroflóru dýchacích orgánov, doposiaľ neexistujú. Nembrini a spolupracovníci (16) priamou inokuláciou baktérii do dýchacích ciest v experimentálnom modeli potvrdili ochranný účinok takejto „liečby“ cestou imunomodulácie dendritických buniek a pomocných T-lymfocytov v prieduškách.
Probiotiká sú živé organizmy pridávané do potravín, ktoré priaznivo ovplyvňujú zdravie konzumenta úpravou rovnováhy jeho črevnej mikroflóry. Užívajú sa ako výživový doplnok najčastejšie perorálne vo forme lyofilizovaných kapsúl, najmä rodov Lactobacillus a Bifidobacteria. Skúšajú sa aj iné formy podania, a to lokálne do dýchacích ciest (predovšetkým na sliznicu nosa) a vaginálne. Klinické sledovania s probiotikami v oblasti respirológie sa zameriavajú na ovplyvnenie alergického zápalu. Lactobacily podané pred peľovou sezónou redukujú začervenanie a opuch sliznice nosa (17), znižujú hladinu alergén-špecifického IgE (12). Podávanie probiotík pri liečbe astmy však vykazuje rozporuplné výsledky. Zatiaľ čo niektorí autori uvádzajú pozitívny účinok podávania lactobacilov, a to najmä u detskej populácie, iní autori tento účinok popierajú. Ako je z uvedeného zrejmé, dodnes nie je jednoznačne zodpovedaná otázka podávania probiotík na zabránenie rozvoja alergického pochodu. Metaanalýza 25 randomizovaných štúdií s 1599 pacientmi s diagnózou atopickej dermatitídy (13) odporučila probiotiká ako liek voľby u stredne ťažkej a ťažkej atopickej dermatitídy u detí (1–18 rokov) a dospelých, avšak nepotvrdila priaznivý účinok podávania probiotík u novorodencov. Iná metaanalýza (3), ktorá hodnotila 20 randomizovaných štúdií s 4866 deťmi s diagnózou prieduškovej astmy, nepotvrdila ochrannú úlohu užívania probiotík v perinatálnom období, teda v primárnej prevencii tejto diagnózy. V závere autori odporučili realizovať ďalšie výskumy zamerané na presne určenú úlohu probiotík v prevencií detskej astmy. Metaanalýza Elazaba et al. (5) zostavená z 25 randomizovaných štúdií s 4013 detskými atopickými pacientami zhodnotila, že prenatálne a/alebo včasné podávanie probiotík novorodencom redukuje riziko atopickej senzibilizácie a znižuje hodnotu celkového IgE v hodnotených súboroch, ale neznižuje riziko vzniku prieduškovej astmy.
Okrem probiotík sa skúma aj terapeutické podávanie prebiotík (nestráviteľných zložiek potravy – vlákniny), ktoré selektívne stimulujú rast a aktivitu črevnej mikroflóry. Prebiotiká sa môžu podávať izolovane, ale aj v kombinácií s probiotikami. Synbiotiká sú synergickou kombináciou probiotík a prebiotík (vlákniny). Ich vlastnosti sa vzájomne dopĺňajú a posilňujú. Štúdia de Kivita a spolupracovníkov (4) potvrdila, že synbiotický postup môže byť efektívnejší v prevencii alergického zápalu než izolované podávanie probiotík a vlákniny. Tento účinok sa predpokladá na základe vzostupu sérového galektínu-9, ktorý tlmí degranuláciu mastocytov, a tým klinickú manifestáciu respiračných príznakov alergických pacientov.
ZÁVER
Súčasné vedomosti o ľudskom mikrobióme, osobitne mikrobióme dýchacích orgánov sú sľubné a naznačujú cestu, ako ovplyvňovaním rovnováhy mikrosveta a makroorganizmu bude možné v budúcnosti regulovať respiračné zdravie ako aj terapeutické postupy pri kontrole chronického zápalu. Stále však zostáva mnoho nezodpovedaného a je potrebné realizovať ďalšie rozsiahle experimentálne, ale aj klinické výskumy v oblasti imunológie a respirológie, aby bolo možné jednoznačne zodpovedať principiálne otázky týkajúce sa liečebného využitia mikrobiómu človeka v každodennej praxi.
Práca je publikovaná s podporou grantu „Probiotické mikroorganizmy a bioaktívne látky naturálneho pôvodu pre zdravšiu populáciu Slovenska (PROBIO)“ v rámci operačného programu Výskum a vývoj OPVaV-2009/2.2/04-SORO, ITMS: 26220220104.
Stret záujmov: žiadny.
ADRESA PRO KORESPONDENCI:
MUDr. Norbert Lukán, PhD.
IV. interná klinika UPJŠ LF a UNLP
Rastislavova 43, 041 90 Košice, SR
e-mail: norbertlukan@gmail.com
Sources
1. Abeles SR, Robles-Sikisaka R, Ly M, et al. Human oral viruses are personal, persistent and gender-consistent. ISME J 2014; 8(9): 1753–1767.
2. WHO. Asthma. WHO Fact sheet N°307 (update Nov 2013). Dostupný na: http://www.who.int/mediacentre/factsheets/fs307/en/.
3. Azad MB, Coneys JG, Kozyrskyj AL, et al. Probiotic supplementation during pregnancy or infancy for the prevention of asthma and wheeze: systematic review and meta-analysis. Allergy Asthma Clin Immunol 2014; 10(Suppl 1): A25.
4. de Kivit S, Saeland E, Kraneveld AD, et al. Galectin-9 induced by dietary synbiotics is involved in suppression of allergic symptoms in mice and humans. Allergy 2012; 67(3): 343–352.
5. Elazab N, Mendy A, Gasana J, et al. Probiotic administration in early life, atopy, and asthma: a meta-analysis of clinical trials. Pediatrics 2013; 132(3): e666–e676.
6. Emuzyte R, Firantiene R, Petraityte R, Sasnauskas K. Human rhinoviruses, allergy, and asthma: a clinical approach. Medicina (Kaunas) 2009; 45(11): 839–847.
7. Erb-Downward JR, Thompson DL, Han MK, et al. Analysis of the lung microbiome in the „healthy“ smoker and in COPD. PLoS One 2011; 6(2): e16384.
8. Gollwitzer ES, Marsland BJ. Microbiota abnormalities in inflammatory airway diseases - potential for therapy. Pharmacol Ther 2014; 141(1): 32–39.
9. Herbst T, Sichelstiel A, Schär C, et al. Dysregulation of allergic airway inflammation in the absence of microbial colonization. Am J Respir Crit Care Med 2011; 184(2): 198–205.
10. Hilty M, Burke C, Pedro H, et al. Disordered microbial communities in asthmatic airways. PLoS One 2010; 5(1): e8578.
11. Charlson ES, Bittinger K, Chen J, et al. Assessing bacterial populations in the lung by replicate analysis of samples from the upper and lower respiratory tracts. PLoS One 2012; 7(9): e42786.
12. Ivory K, Chambers SJ, Pin C, Prieto E, et al. Oral delivery of Lactobacillus casei Shirota modifies allergen-induced immune responses in allergic rhinitis. Clin Exp Allergy 2008; 38(8): 1282–1289.
13. Kim SO, Ah YM, Yu YM, et al. Effects of probiotics for the treatment of atopic dermatitis: a meta-analysis of randomized controlled trials. Ann Allergy Asthma Immunol 2014; 113(2): 217–226.
14. Marsland BJ, Gollwitzer ES. Host-microorganism interactions in lung diseases. Nat Rev Immunol 2014; 14(12): 827–835.
15. Molyneaux PL, Mallia P, Cox MJ, et al. Outgrowth of the bacterial airway microbiome after rhinovirus exacerbation of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013; 188(10): 1224–1231.
16. Nembrini C, Sichelstiel A, Kisielow J, et al. Bacterial-induced protection against allergic inflammation through a multicomponent immunoregulatory mechanism. Thorax 2011; 66(9): 755–763.
17. Ouwehand AC, Nermes M, Collado MC, et al. Specific probiotics alleviate allergic rhinitis during the birch pollen season. World J Gastroenterol 2009 15(26): 3261–3268.
18. Schram D, Doekes G, Boeve M, et al. PARSIFAL Study Group. Bacterial and fungal components in house dust of farm children, Rudolf Steiner school children and reference children - the PARSIFAL Study. Allergy 2005; 60(5): 611–618.
19. Turnbaugh PJ, Ley RE, Hamady M, et al. The human microbiome project: exploring the microbial part of ourselves in a changing world. Nature 2007; 449(7164): 804–810.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2015 Issue 3
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
-
All articles in this issue
- Occupational diseases reported in the Czech Republic in 2014
- Health services research as scientific discipline in the Czech Republic and Slovakia
- Comparison of risks from smoking cigarettes and water pipe
- Reliability of clinical indicators of neonatal sepsis
- Aortic dissection in routine practice
- Sexual dysfunctions following sphincter-preserving rectal resection
- Microbiome, respiratory allergy, and a perspective of treatment
- General Practitioner
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Comparison of risks from smoking cigarettes and water pipe
- Aortic dissection in routine practice
- Reliability of clinical indicators of neonatal sepsis
- Microbiome, respiratory allergy, and a perspective of treatment
