Sepse a septický šok u onkologických a imunokompromitovaných pacientů – diagnostika, terapie
Sepsis and the septic shock in oncological or other immunocompromised patients
Sepsis and the septic shock and the up to date knowledge about them represent a marked drifting for diagnostics and the treatment of this complications. Their application in patients with the oncological disease or the other immunocompromised patients represents further extension in the specific group of patients with several unique properties. In despite of the improving results in the oncological treatment there are only few reports in literature about this group of patients and this one is steadily growing due to the progressive improving of the supportive care in oncology. This group of patients with the febrile neutropenia and the sepsis (the most frequent complication) request the special focus of general practitioners and the internists because these ones are with these patients in contact as a first. They have to master the basal image about the specialties of this patient group. In our article we analyze this group of patients with focus on antibiotics in febrilie neutropenia and sepsis and on the other supportive care in the immunocopromised patients.
Key words:
sepsis – septic shock – febrilie neutropenia – immunocompromised patient
Authors:
M. Navrátil; M. Tomíška; Z. Kořístek; J. Vorlíček; J. Mayer
Authors‘ workplace:
Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc.
Published in:
Vnitř Lék 2010; 56(6): 557-569
Category:
65th Birthday - Petr Svacina, MD
Overview
Současné poznatky o sepsi a septickém šoku představují výrazný posun pro diagnostiku a léčbu těchto komplikací. Jejich aplikace pro pacienty s nádorovým onemocněním nebo jinak imunokompromitované pacienty představuje další rozšíření o specifickou skupinu pacientů s některými zvláštními charakteristikami. V literatuře není zatím tato skupina pacientů nějak široce rozebírána, ač s postupujícími lepšícími se výsledky onkologické terapie se tato skupina pacientů nadále rozrůstá, a to hlavně díky dnes již velmi dobré podpůrné péči v onkologii. Skupina těchto pacientů, u nichž je febrilní neutropenie a sepse velmi častou komplikací, vyžaduje zvláštní pozornost a lékaři prvního kontaktu (lékaři praktičtí a internisté) by měli mít alespoň bazální představu o tom, jaká specifika s sebou tato skupina pacientů nese. V článku rozebíráme právě specifika této skupiny pacientů se zaměřením na antibiotickou terapii febrilní neutropenie a sepse a další podpůrnou terapii u těchto pacientů.
Klíčová slova:
sepse – septický šok – febrilní neutropenie – imunokompromitovaný pacient
Úvod a definice
Nádorové onemocnění je u většiny pacientů provázeno narušením imunity. Nejvýraznější poruchu obranyschopnosti mají nemocní s hematologickým maligním onemocněním, o něco méně výrazná porucha je přítomna u nemocných se solidními nádory. Porucha imunity závisí na stavu základní nádorové choroby. S vysokým rizikem infekčních komplikací je třeba počítat především u nemocných, u nichž se nedaří nádorové onemocnění zvládnout, tedy u nemocných s progredující chorobou. Porucha imunity může v průběhu onkologické léčby vést k řadě komplikací, s nimiž je nutno předem počítat. Především se jedná o zvýšené riziko infekčních komplikací, a to včetně oportunních infekcí. Na poruše imunity se však může podílet i samotná onkologická léčba, především chemoterapie. Většina používaných cytostatických režimů může vést k nežádoucímu přechodnému útlumu kostní dřeně. V závislosti na dávkách cytostatik je to charakteristické zejména pro režimy s velkým myelotoxickým účinkem. Na druhé straně je však třeba zdůraznit, že dřeňový útlum může výjimečně následovat i po chemoterapii, která obvykle není příliš myelotoxická. Pro konkrétního pacienta to znamená, že pravděpodobnost závažné leukopenie po chemoterapii může být větší či menší, ale ve většině případů nelze dopředu tvrdit, že chemoterapie leukopenii nezpůsobí. Je to dáno skutečností, že myelosupresivní účinek chemoterapie závisí na konkrétní situaci daného pacienta, hlavně na individuálním geneticky podmíněném metabolizmu cytostatika, funkci orgánů a tkání, zúčastněných na metabolizmu a vylučování cytostatika a rezervě krvetvorných buněk kostní dřeně. Znamená to, že u jednotlivých nemocných může chemoterapie způsobit neočekávanou myelotoxicitu s hlubokou neutropenií a neočekávaným vznikem závažné infekce, která může mít i život ohrožující průběh. Proto je na zodpovědnosti každého lékaře, který podává chemoterapii, počítat s možností nežádoucích účinků a zabezpečit kvalifikovanou léčbu případných infekčních komplikací. Stejně tak je povinností každého lékaře, který přichází k nemocnému léčenému chemoterapií, myslet na uvedené souvislosti. Riziko závažného útlumu kostní dřeně se přitom týká nejen nemocných s protinádorovou chemoterapií, ale potenciálně také nemocných s imunosupresivní léčbou pomocí malých dávek cytostatik a imunosupresiv. Riziko infekčních komplikací je možné u konkrétního pacienta odhadovat také na základě znalosti průběhu předchozích infekcí. Významným faktorem je tolerance minulých cyklů chemoterapie a délka útlumů krvetvorby po protinádorové léčbě v posledním období. Riziko vzniku infekce narůstá také při současné léčbě imunosupresivy včetně kortikosteroidů. Imunita onkologického pacienta může být dále snížena vlivem proteinoenergetické malnutrice nebo působením přidružených chorob, jako je cukrovka nebo řada jiných chronických onemocnění. Zvláštností léčby onkologických nemocných je, že při neutropenii nemusí být přítomny klasické známky zánětu, a to jak klinické, tak např. i radiologické. Nezřídka je jediným projevem závažné infekce horečka, jindy mohou být přítomny pouze nespecifické projevy nebo známky zhoršení celkového stavu pacienta. Při léčbě těchto nemocných je velmi důležité brát do úvahy i fakt, že rozvoj infekce neutropenických nemocných může být neočekávaně rychlý až dramatický, takže klinický stav se může zhoršovat i v hodinách. Proto je nezbytné, aby u každého onkologického pacienta s významnou neutropenií (neutrofily < 1,0 × 109/ l) bylo postupováno s velkou rozhodností a aby byla neprodleně provedena potřebná diagnostická i léčebná opatření (graf 1).

Sepse představuje excesivní, generalizovaně neboli systémově probíhající zánětlivou reakci, která je iniciována infekčním agens, které však není nutné k udržování dalšího průběhu. Definice sepse vyžaduje tedy jak přítomnost mikrobiálního původce, tak jím vyvolanou systémovou zánětlivou reakci organizmu. V současnosti je nejvíce používána definice sepse dle Consensus Conference of American College of Chest Physicians and American Society of Critical Care Medicine – ACCP/ ASCM. Definici uvádí tab. 1.

Septický šok je stav, kdy stav pacienta splňuje obecnou definici šoku – dodávka kyslíku pro všechny buňky organizmu vázne a vyvíjí se tkáňová hypoxie. To má za následek vytvoření multiorgánového selhání. Termín „septický“ pojmenovává příčinu šoku – systémovou infekci. Septický šok se od sepse liší hypotonií refrakterní na substituci tekutin. Septický šok má výrazně horší prognózu než sepse. U neutropenických nemocných nelze použít kritéria leukocytózy nebo posunu doleva (nad 10 % nezralých neutrofilů), které je obsaženo v definici ACCP/ ASCM. Ostatní kritéria však mohou být splněna i u neutropenického pacienta. Je nutno zdůraznit, že v případě neutropenie dostačuje ke stanovení septického stavu již samotné podezření na přítomnost infekčního agens, pokud jsou přítomny systémové příznaky sepse. Jde o takzvanou leukocytopenickou sepsi.
Syndrom systémové zánětlivé odpovědi (SIRS – systemic inflammatory response syndrome) je pro tento účel definován splněním nejméně 2 ze 4 kritérií uvedených v tab. 1. Systémová zánětlivá odpověď je univerzální reakcí organizmu na řadu inzultů infekční i neinfekční povahy, která může být přítomna i při neinfekčním poškození tkání, jako je tomu u popálenin, úrazů nebo pankreatitidy. Pokud je příčinou systémové zánětlivé reakce infekce, je tato systémová reakce zahájena invazí mikroorganizmů, ale jejich další přítomnost při progresi sepse nemusí být nezbytná.
Patofyziologie sepse a septického šoku
Zásadním patofyziologickým dějem při sepsi je explozivní aktivace humorální kaskády následovaná odpovědí řady imunitních buněk a endotelií mikrocirkulace. Tuto aktivaci způsobuje endotoxin gramnegativních bakterií. Je to lipopolysacharid buněčné stěny gramnegativních bakterií obsahující lipid A, který aktivuje imunokompetentní buňky, dominantně monocyty a makrofágy. Výsledkem je uvolnění proinflamatorních cytokinů (tumor necrosis factor, interleukin‑1, - 6, - 8) s aktivací sekundárních mediátorů. Exotoxiny grampozitivních a gramnegativních bakterií a peptidoglykany aktivují cirkulující leukocyty a navozují systémovou zánětlivou reakci. Většina iniciálních mediátorů systémové zánětlivé reakce jsou prozánětlivé cytokiny, které mohou být produkovány jednak monocyty a makrofágy, ale také řadou dalších imunitních buněk. Následně se uvolňují další mediátory, zejména produkty enzymatické cesty cyklooxygenázy a lipooxygenázy, prostaglandiny a leukotrieny, jak znázorňuje graf 2. Lokální zánět a určitý stupeň systémové odpovědi včetně teploty a třesavky jsou pro zvládnutí infekce výhodné. Cytokiny tedy mají při sepsi i příznivé účinky. Pokud však v systémové cirkulaci přetrvávají jejich vysoké hladiny, mohou cytokiny vyvolat systémovou zánětlivou reakci, která je pak pro organizmus zbytečně zatěžující a vede k jeho vyčerpání, imunologické anergii a smrti. Současně s prozánětlivou je aktivována také protizánětlivá cesta, představovaná IL‑4, IL‑10 a transformujícím růstovým faktorem TGF‑β (transforming growth factor - β). Ta, jak je níže uvedeno, může nakonec převládnout a způsobit imunologickou anergii. Intracelulárně je hlavním faktorem prozánětlivé odpovědi nukleární faktor κB (NF - κB), regulační protein lokalizovaný v cytosolu, který po aktivaci proniká do buněčného jádra na svůj receptor a stimuluje syntézu mRNA genů kódujících prozánětlivé cytokiny. Současně má buňka k dispozici také protizánětlivý systém, který je tvořen tzv. proteiny tepelného šoku (heat shock protein), které představují univerzální obranný mechanizmus.

Nemocní s protrahovanou sepsí nesou rysy imunosuprese se zhoršením prezentace antigenu monocytárními buňkami, nejsou schopni potlačit infekci a predisponují vedle již přítomné infekce k dalším nozokomiálním nákazám. Přetrvávající sepse je charakterizována změnou od prozánětlivé odpovědi k imunologicky anergnímu stavu, což se projevuje poklesem počtu cirkulujících lymfocytů a úbytkem CD4+ lymfocytů, B‑lymfocytů a dendritických buněk. Proč dochází u některých nemocných při sepsi k selhávání orgánů a ke smrti, není dosud jasné. Roli může hrát genetický polymorfizmus imunitních funkcí. Chybění zjevné reakce akutní fáze může být provázeno vyšší mortalitou a může odrážet anergní fázi sepse. Většina úmrtí nastává během protrahovaného stavu se sníženou imunitní odpovědí. Vývoj aktivity imunitní odpovědi během sepse znázorňuje graf 3.

S výše popsanými změnami je spojeno narušení endoteliální bariéry (capillary leakage), která umožňuje přestup toxinů i bakterií do oběhu. Změny v mikrocirkulaci jsou označovány jako perfusions mismatch. Tím je míněno, že perfuze orgánů není řízena jejich potřebou, ale dochází na jedné straně z hlediska organizmu k nesmyslné vazodilataci a jinde zase k nesmyslné vazokonstrikci, které způsobuje nedostatečné zásobení na této cirkulaci závislých buněk. Vazokonstrikce může nastat vlivem prozánětlivých cytokinů (tromboxanů, leukotrienů, kyslíkových radikálů). Vazodilatace je zase důsledkem vazodilatačního působení prostanoidů a excesivně tvořeného oxidu dusnatého. Prozánětlivé cytokiny zvyšují aktivitu enzymu s názvem indukovatelná syntetáza oxidu dusnatého (inducible nitric oxide synthase – iNOS), pod jehož vlivem je v endoteliích mikrocirkulace syntetizováno velké množství přímého vazodilatátoru oxidu dusnatého, dříve známého jako endoteliální relaxační faktor. V první fázi šoku má převahu vazodilatace, což způsobí relativní hypovolemii v cévním řečišti. Tyto změny, způsobující pokles systémové cévní rezistence, se iniciálně projevují vazodilatací kožních cév, hypotenzí, tachykardií a zvýšeným srdečním výdejem s obrazem tzv. „teplého šoku“ (hyperdynamická fáze šoku). Dochází k patologické redistribuci krve v mikrocirkulaci, snižuje se extrakce kyslíku tkáněmi a může stoupat hladina laktátu v krvi. S postupem procesu se vlivem cytokinů zvyšuje permeabilita kapilár a malých žil, dochází k úniku tekutin do intersticia a k hypovolemii. Výsledkem je relativní a absolutní deficit více litrů intravaskulárního objemu. S další progresí šoku se rozvíjí vazokonstrikce v kůži a splanchniku, systémová cévní rezistence se normalizuje nebo i zvyšuje, srdeční výdej klesá a nastupuje „studený šok“ (hypodynamická fáze šoku). Iniciální fáze šoku je charakterizována spíše nízkým srdečním výdejem a nízkými plnicími tlaky. Hyperdynamický stav je často zjevný až v průběhu hydratace. I když v počáteční fázi septického šoku srdeční minutový objem neklesá, je přítomna dysfunkce srdečního svalu s poklesem kontraktility myokardu, s dilatací obou komor a sníženou ejekční frakcí. Z hlediska perfuzního tlaku je hypotenze při septickém šoku lépe charakterizována pomocí středního arteriálního tlaku (< 65 – 70 mm Hg) než podle systolického tlaku. Měření saturace hemoglobinu kyslíkem ve smíšené žilní krvi (krev z pravé srdeční komory nebo z kmene a. pulmonalis) může u pacientů se sepsí ukazovat nadnormální hodnoty (SvO2 > 70 – 75 %) v důsledku nerovnoměrné distribuce krve, a tím i poklesu extrakce kyslíku periferními tkáněmi. Výrazný pokles hodnot SvO2 se obvykle dostavuje krátce před poklesem spotřeby kyslíku ve tkáních, a proto je signálem k rychlé intervenci se snahou obnovit dodávku kyslíku do tkání.
Metabolické změny u sepse zahrnují posun k anaerobnímu metabolizmu, provázený zvýšenou produkcí laktátu. Zvýšená hladina laktátu v mnoha případech neodpovídá tkáňové hypoxii, ale spíše selhání buněčného metabolizmu v některých tkáních, přičemž se na ní podílí i snížený metabolizmus laktátu v dysfunkčních játrech, neboť vznik laktátové acidózy závisí nejen na produkci, ale také na utilizaci laktátu v játrech. Glukoneogeneze v játrech narůstá a dochází k rozvoji inzulinorezistence. Hladina glykemie je často zvýšená již na počátku sepse. Dochází k nárůstu lipolýzy se zvýšenou mobilizací tuků, takže se zvyšují hladiny mastných kyselin. Ketogeneze však zůstává nízká vzhledem k hyperinzulinemii, tuky nejsou utilizovány, zvyšuje se triglyceridemie a rozvíjí se jaterní steatóza. Poškození jater, provázející sepsi a šok, se projeví vzestupem jaterních enzymů. Pro sepsi je velmi charakteristickým nálezem katabolizmus endogenních bílkovin se zvýšenou produkcí močoviny. Současně je zvýšena syntéza bílkovin akutní fáze. Vzestup celotělového obratu bílkovin je provázen vysokým energetickým výdejem, který je také pro sepsi velmi charakteristickým nálezem. Popsané metabolické změny jsou udržovány jednak účinkem prozánětlivých cytokinů, jednak také hormonálním prostředím s aktivací osy hypofýza - nadledvina. Neadekvátní perfuze tkání s hypoxií je předpovědním faktorem multiorgánové dysfunkce. Regionální perfuze je většinou hodnocena pouze podle ukazatelů orgánové funkce (tab. 2).
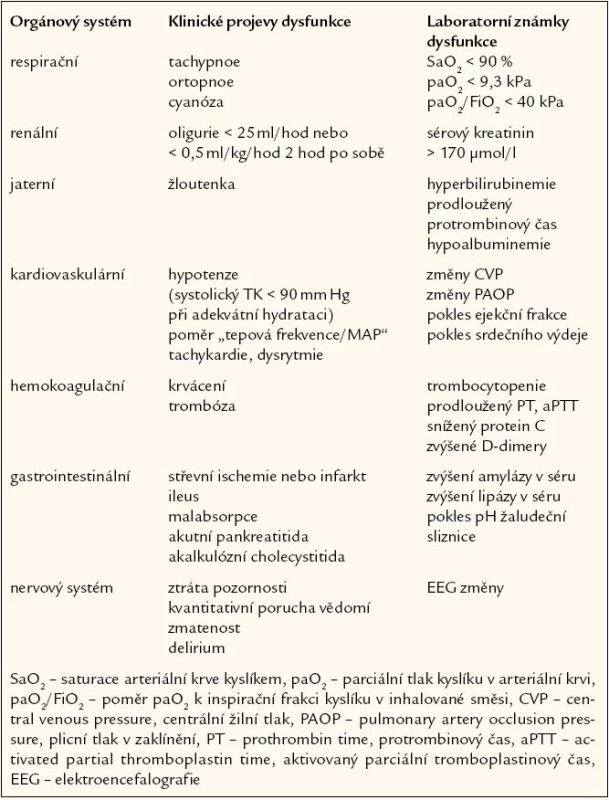
Respirační dysfunkce doprovází sepsijako kontinuální proces od subklinické formy až po nejzávažnější respirační komplikaci sepse, syndrom de-chové tísně dospělých (adult respiratory distress syndrome – ARDS), kterýpředstavuje těžkou formu akutního poškození plic (acute lung injury – ALI). Sepse tvoří až 40 % všech případů akutního poškození plic a naopak, ARDS se vyvíjí u 25 – 42 % pacientů se sepsí. K respiračnímu selhání vede nejčastěji infekce plicní nebo abdominální. Hlavním nálezem je zánětlivé postižení alveolárního epitelu s přítomností neutrofilů a makrofágů v alveolární tekutině, které produkují zánětlivé mediátory a reaktivní formy kyslíku, takže postupně dochází ke ztrátě surfaktantu. V plazmě perzistuje zvýšení prozánětlivých cytokinů. Výsledkem ALI/ ARDS je nárůst pravolevých plicních zkratů z obvyklých hodnot do 5 % na hodnoty, které mohou přesáhnout 25 %. Tyto zkraty jsou způsobeny přetrvávající perfuzí neventilovaných postižených alveolů, protože v neventilovaných oblastech plic selhává obvyklá hypoxická plicní vazokonstrikce. Výsledkem je vedle hypoxemie také snížená plicní poddajnost a zvýšená dechová práce nemocného. Při déletrvajícím postižení plic se v postižených alveolech a drobných dýchacích cestách rozvíjí proliferace vaziva. Proto rozlišujeme 3 fáze vývoje ALI/ ARDS: časná exsudativní fáze (den 1 – 5), fibroproliferativní fáze (den 6 – 10) a fibrotická fáze po 10. dnu. Prognóza ALI/ ARDS je vážná, nicméně dříve vysoká mortalita (60 – 70 %) se v posledním desetiletí snížila na 40 %. Je třeba zdůraznit, že smrt v důsledku refrakterního respiračního selhání je neobvyklá, a že většina úmrtí je způsobena nezvládnutou sepsí nebo multiorgánovou dysfunkcí. Částečné zlepšení prognózy nemocných s respiračním selháním u sepse je dáno zlepšením léčby sepse.
Klinický a laboratorní obraz sepse
Klasickým příznakem sepse je horečkavyšší než 38 °C, v typickém případě předcházená zimnicí a třesavkou. Menšíčást nemocných nemá při sepsi horečku,ale naopak teplotu nižší než 36 °C, hypotermii. Na sepsi je vždy nutno myslet u pacienta, u něhož se v souvislosti s horečkou nebo hypotermií objeví nevysvětlená tachykardie či tachypnoe. Hypotenze je pro sepsi patognomonická. Nemusí být však přítomna ihned od začátku. V počáteční fázi může být relativní hypovolemie kompenzována hyperkinetickou cirkulací v důsledku sympatoadrenální kontraregulace, a proto nemusí být přítomna hypotenze. Často lze zjistit patologickou hodnotu tzv. šokového indexu (poměr počtu tepů za minutu/ hodnota systolického krevního tlaku v mm Hg), tedy hodnotu vyšší než 1,0. Podobný význam má srdeční frekvence vztažená na hodnotu středního arteriálního tlaku. Teprve při rozvoji septického šoku se stává hypotenze plně manifestní. Zvýšená srdeční frekvence je způsobena sympatoadrenální kontraregulací a provází všechny typy šoku. Kůže je v počáteční fázi sepse i na periferii teplá, dobře prokrvená a suchá. Teprve později, v hypodynamické fázi šoku, se kůže stává chladnou, vlhkou a cyanotickou jako výraz vazokonstrikce. Mramorované zbarvení kůže svědčí pro závažnou regionální hypoperfuzi. Produkce moče před zahájením hydratace často klesá pod 20 – 30 ml/ hod (oligurii). Zhoršení mentálních schopností, delirium až koma jsou mnohdy časným symptomem systémové zánětlivé reakce. Mechanizmus vzniku této septické encefalopatie není stále dopodrobna objasněn, ví se, že nesouvisí s hepatální či renální poruchou či hypotenzí. Předpokládá se, že septická encefalopatie je důsledkem působení zánětlivých mediátorů na CNS nebo cytotoxickou odpovědí mozku na přítomnost těchto mediátorů. Frekvence septické encefalopatie je udávána s velkým rozptylem 8 – 70 % a znamená špatnou prognózu. Ve studii, v níž byl vyhodnocován stupeň encefalopatie a APACHE II skóre, bylo prokázáno, že čím závažnější postižení CNS dle Glasgow Coma Scale, tím vyšší mortalita. Určitý postup zaznamenala diagnostika, která metodou EEG umí tuto poruchu detekovat s vysokou senzitivitou. Subjektivní zhodnocení míry narušení mentálního stavu lékařem je důležitou informací o závažnosti infekce. Porucha perfuze žaludku a střev se projeví obleněním peristaltiky, meteorizmem až subileózním stavem. Hyperventilace (zvýšená dechová frekvence provázená sníženým parciálním tlakem CO2) je jednak reaktivním důsledkem metabolické acidózy, ale podílí se na ní i narušená výměna plynů v plíci (šoková plíce). Poškození plic je jedním z častých projevů šoku. Porucha hemokoagulace se může projevit jak trombotickými, tak krvácivými projevy. Při diseminované intravaskulární koagulopatii můžeme zjistit známky kožního a slizničního krvácení.
V laboratorním obraze většinou zjistíme vedle leukocytózy nebo leukopenie vzestup hladin proteinů akutní fáze. Další laboratorní změny odpovídají postižení jednotlivých orgánů při sepsi. C - reaktivní protein (CRP) je běžně sledovaným ukazatelem systémové bakteriální infekce, při níž se jeho hladiny zvyšují na desetinásobek až stonásobek normálních hodnot. Jeho hladiny jsou však vysoké také při SIRS nemikrobiálního původu. Lepším ukazatelem sepse je hladina prokalcitoninu, i když je velmi málo známo o jeho zdroji a funkci u septických nemocných. Hodnoty CRP vyšší než 50 mg/ l a prokalcitoninu vyšší než 1,5 ng/ ml vykazují při diagnostice sepse vysokou senzitivitu (98,5 – 100 %), ale nižší specificitu (72 – 75 %). Hyperglykemie může být nespecifickou a nevýraznou známkou sepse již na jejím počátku. Zvýšený katabolizmus endogenních bílkovin se laboratorně projeví vysokým odpadem dusíku v moči za časový interval 24 hod (více než 15 g/ den).
Diagnóza infekčního agens při sepsi a při febrilní neutropenii
Odběry hemokultur a další kultivace materiálu ze suspektního ložiska se provádí před podáním antibiotika nejlépe hned při vzestupu teploty. V případě již antibioticky léčeného pacienta je optimální odběr krátce před podáním další dávky léku. Doporučeným způsobem odběru je čerstvá venepunkce po předchozí dezinfekci kůže alkoholovou a následně jodovou dezinfekční látkou, kterou je třeba nechat zaschnout a ošetřené místo již nekontaminovat palpací. Krev odebraná z centrálního žilního katétru má významně vyšší pravděpodobnost kontaminace bakteriální flórou. Optimálním postupem je současný odběr krve jak z centrálního žilního katétru, tak z periferní žíly. Výjimečně lze v případě nedostupnosti periferní žíly použít odběr z periferního katétru za přísného dodržení sterilní techniky. U každého pacienta je doporučeno odebrat 2 sady hemokultur. Protože interval mezi odběry není zásadní, je v těžkém stavu pacienta přípustný i odběr obou vzorků v minimálním časovém odstupu. Pokud to stav nemocného dovoluje, je doporučen druhý odběr za 30 – 60 min po prvním vzorku. Velmi důležité je odebrat minimálně 10 ml krve, lépe však větší množství, až 30 ml na jeden vzorek. Pro úspěšnou kultivaci krve je totiž požadována přítomnost nejméně tří kolonie tvořících jednotek. U dospělých je při bakteriemii často jejich koncentrace nižší než jeden živý mikroorganizmus na ml krve a někdy je dokonce přítomen jediný živý mikroorganizmus na 10 ml krve. Standardním postupem je odběr dvou vzorků, a to na aerobní a anaerobní kultivaci. Protože anaerobní bakterie tvoří méně než 5 % všech záchytů, je při nedostatečném množství odebraného materiálu možné kultivovat pouze aerobně. Při anaerobním způsobu však vyrostou i některé fakultativně anaerobní bakterie, které jinak rostou aerobně.
Pokud je podezření na orgánovou či tkáňovou infekci, je nutno provést cílený odběr, v případě potíží i s pomocí chirurga, který zároveň provede drenáž případného abscesu.
Interpretace jediného záchytu v hemokultuře je obtížná, protože frekvence kontaminace se vyskytuje i při pečlivém odběru u 1 – 4,5 % případů. Vysoký patognomonický význam má izolace Neisseria meningitis, Streptococcus pneumoniae, Haemophillus influenzae typu B, Listeria monocytogenes nebo i Salmonella sp. Pozitivní hemokultura může být interpretována různým způsobem (tab. 3).
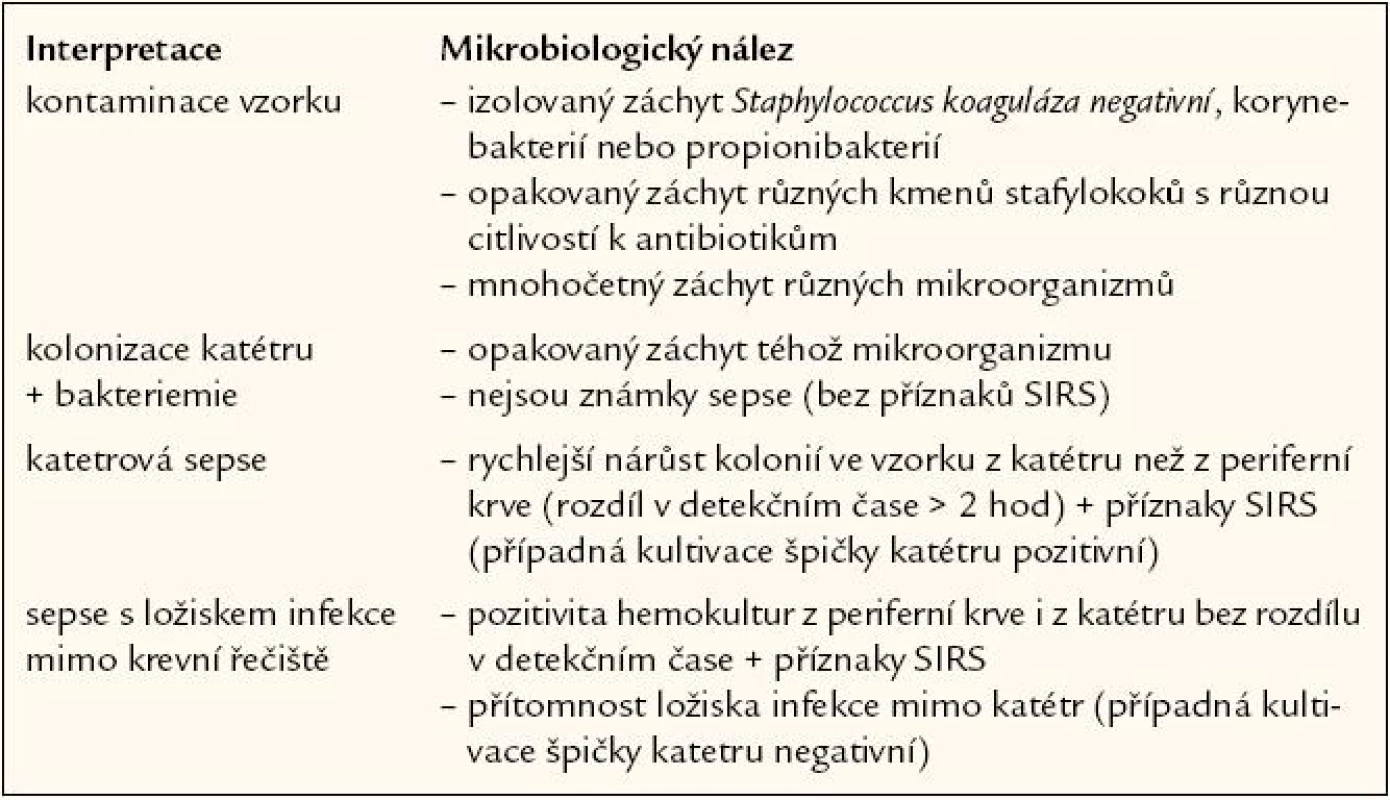
Pátrání po zdroji infekce je zcela zásadní součástí diagnostiky sepse, protože bezprostředně souvisí s léčebným úsilím o eliminaci tohoto zdroje. Nejčastějším zdrojem sepse a příčinou febrilní neutropenie je dnes infekce v oblasti plic. U časné infekce vznikající do 48 hod po operaci uvažujeme hlavně o přítomnosti virulentních mikroorganizmů, jako jsou zlaté stafylokoky, některé druhy streptokoků a klostridia. Pozdní pooperační infekce se objevují nejčastěji mezi 4. a 6. dnem a bývají smíšeného původu. Při podezření na infekci v oblasti centrálního nervového systému je nezbytné biochemické, mikrobiologické a cytologické vyšetření likvoru. Vyšetření očního pozadí může upozornit na systémovou kvasinkovou infekci. Infekce v břišní oblasti je ve většině případů signalizována klinickými příznaky a laboratorními známkami. Nemocní udávají bolesti břicha, průjem nebo bolest v okolí konečníku. Velmi důležité je klinické vyšetření přes konečník a palpace perianální oblasti. Při bolesti v pravém horním kvadrantu břicha upozorní na možnou infekci podjaterní krajiny laboratorní nárůst transamináz nebo bilirubinu. Velmi závažná, potenciálně život ohrožující je neutropenická enterokolitida. Projevuje se horečkou, průjmem a bolestmi břicha, které mohou být lokalizovány v pravém podbřišku, a imitovat tak apendicitidu (typhlitis). Vyskytuje se především u nemocných s leukemií a neutropenií po intenzivní cytotoxické léčbě. Snadno dochází k rozvoji sepse. Akalkulózní cholecystitida je jako zdroj sepse pravděpodobně podhodnocována. Přispívajícím faktorem pro její vznik mohou být vysoké dávky opioidů. U tlumených nemocných nemusí být přítomna bolest v příslušné krajině a jedinou známkou zůstává zvýšení obstrukčních jaterních enzymů, především alkalické fosfatázy. Skrytým zdrojem sepse může být sinusitida, zejména u nemocných ventilovaných cestou nazotracheální kanyly, nebo u jedinců se zavedenou nazogastrickou sondou. Paranazální dutiny se u neutropenie mohou stát ložiskem infekce při vzplanutí předcházejícího chronického zánětu nebo při snížení průchodnosti nosní dutiny po chemoterapii. Klinicky může být přítomna palpační citlivost v oblasti maxilárních sinů, periorbitální celulitida, jednostranné slzení oka nebo ulcerace v nosní dutině. Potvrzení diagnózy přináší CT vyšetření paranazálních dutin a antrální punkce s odběrem materiálu na kultivaci. Protože sinusitida je predilekčním místem pro vláknité plísně, je často nezbytný i bioptický odběr na histologický průkaz mykotické infekce. Močovou infekci jako zdroj sepse je možno předpokládat u nemocných po instrumentálních výkonech na močových cestách a při zavedeném permanentním katétru. Většinou jde o nozokomiální infekci způsobenou gramnegativními tyčkami nebo enterokoky. Diagnosticky je však nutno odlišit pouhou mikrobiální kolonizaci močového katétru, která je mnohem častější než skutečná uroinfekce nebo urosepse. Dutina ústní a jícen představují možné místo infekce zvláště u nemocných s mukozitidou po chemoterapii. Etiologicky se zde vedle bakterií uplatňují viry nebo kvasinky. Virová infekce je suspektní při nálezu vezikulárních ložisek na sliznicích.
Další laboratorní diagnostika u nemocného s febrilní neutropenií
- informace o počtu krvinek (krevní obraz s absolutním počtem leukocytů a neutrofilů) a dále o nutnosti transfuzí erytrocytů nebo trombocytů
- informace o funkci jater (jaterní enzymy bilirubin, LD)
- informace o funkci ledvin (urea, krea-tinin, kyselina močová, ionty, di-uréza, případně sledování hmotnosti nemocného)
- informace o změnách koagulace (aPTT, Quick, D‑dimery, případně AT - III)
- informace o parametrech zánětu (CRP, prokalcitonin)
- v případě sepse opakované vyšetření laktátu v arteriální krvi
- informace o hladině imunoglobulinů (IgG) u pacientů s podezřením na jejich nedostatek pro zvážení jejich substituce
- u pacientů léčených nefrotoxickýmiléky (např. aminoglykosidy) je vhodnésledování plazmatických koncentrací, obzvláště, pokud je přítomna renální insuficience; problém však tkví v tom, že tyto analýzy nejsou vždy dostupné
- v případě nefrotoxických léků se doporučuje vyšetřování kreatininové clearence a úprava dávek léků dle clearence
Diagnostické postupy po 72 – 96 hod léčby bez léčebné odpovědi
Doporučují se zopakovat všechny diagnostické postupy výše uvedené. V případě, že snímek plic byl negativní, doporučuje se provést:
- high resolution CT plic (HRCT)
- abdominální ultrazvukové vyšetření
Léčba sepse
Dle výše uvedené patogeneze septického šoku je cílem léčby:
- odstranění mikrobiální příčiny šoku
- symptomatická léčba poruchy cirkulace, profylaxe a léčba orgánového poškození a všeho, co s tím souvisí (graf 4)
- případné chirurgické ošetření ložiska infekce, je‑li nutné

Současně s okamžitým zahájením antimikrobiální léčby a včasnou sanací infekčního ložiska je nutné zajištění optimální dodávky kyslíku do tkání a podpora či náhrada selhávajících orgánových funkcí.
Antibiotická léčba se mírně liší dletoho, zda je, či není přítomna neutro-penie. V těchto život ohrožujících případech je vždy vhodná (ne‑li přímo nutná) konzultace se specialisty v antibiotickém středisku. Obecně lze doporučit u neutropenického pacienta hemodynamicky stabilního v empirické terapii kombinaci cefalosporinu IV. generace (např. cefepime) a aminoglykosidu (amikacin, gentamicin). U hemodynamicky nestabilního či již v septickém šoku pak kombinace karbapenemu a vancomycinu. Dle výsledků mikrobiologických pak úprava dle citlivosti získaných kmenů bakterií.
Agresivní infuzní hydratace je iniciálním léčebným krokem. Protože potřeba tekutin u septického šoku je těžko zjistitelná, měl by být proveden test s rychlým podáním infuze 250 – 2 000 ml během 1. hod (nebo 20 – 30 ml/ kg během 30 min) a jeho výsledek zhodnocen podle klinických ukazatelů (arteriálního krevního tlaku, srdeční frekvence, diurézy, centrálního žilního tlaku nebo okluzního tlaku v plícnici, mentálního stavu). Pro iniciální hydrataci je často nutné během prvních 24 hod použít až 10 l krystaloidních roztoků. Krystaloidní i koloidní roztoky upravují tkáňovou perfuzi podobným způsobem. Krystaloidy jsou obvykle první volbou, i když je při jejich použití nutno dodat větší objem tekutin a k úpravě dochází o něco později, neboť jejich distribuční objem je nejen intravaskulární, ale i extracelulární prostor. Jeden litr fyziologického roztoku zvětší intravaskulární objem pouze o 200 – 300 ml. Koloidní roztoky vedou k větší expanzi intravaskulárního objemu a jejich denní množství je limitováno, mimo jiné také pro negativní vliv na hemokoagulaci. Hydroxyetylškrob je syntetický koloidní roztok, který vedle efektu hydratace může u septického šoku s výhodou snížit aktivaci endoteliálních buněk. Agregované větvené molekuly hydroxyetylškrobu mohou utěsňovat mezery mezi endoteliemi mikrocirkulace, a snižovat tak propustnost kapilár. Vzdor těmto předpokladům však dosud nebyl prokázán vliv na celkový výsledek léčby septického šoku. Při léčbě hydroxyetylškrobem je nutno počítat s možností snížení aktivity některých koagulačních faktorů a s prodloužením protrombinového času. Potenciální nevýhodou albuminu je jeho transkapilární únik do intersticia a do plicních alveolů. Čerstvě zmražená plazma je indikována pouze u krvácejících nemocných s koagulopatií. Navzdory velkému množství prací věnujících se rozdílům mezi krystaloidními a koloidními roztoky je tato otázka stále otevřená. Přes teoretické výhody koloidních roztoků ukazují některé práce při jejich použití na poněkud vyšší mortalitu, a to i u albuminu. Koloidní roztoky by mohly být vhodné u nemocných s výraznou hypoalbuminemií (< 20 g/ l), při těžké hypotenzi nebo i při selhání ledvin. Dostatečná hydratace s diurézou vyšší než 50 ml/ hod je také profylaxí poškození ledvin v rámci septického šoku.
Centrální žilní tlak je standardním, nejlépe dostupným, ale někdy špatným ukazatelem intravaskulárního objemu. U kriticky nemocných se sepsí není doporučen jako vodítko k náhradě tekutin.
Hodnocení tlaků v malém krevním oběhu pomocí plicního katétru umožňuje měření okluzního tlaku ve větvi plícnice (pulmonary artery occlusion pressure – PAOP) a tím i hodnocení plnicího tlaku levé srdeční síně. Přestože navíc umožňuje měřením srdečního výdeje stanovit optimální úroveň hydratace, nepřináší rutinní monitorování hemodynamiky v malém krevním oběhu zřetelné zlepšení celkového výsledku léčby u nemocných se sepsí.
Novým, jednodušším způsobem monitorování je kontinuální hodnocení minutového srdečního výdeje z tvaru pulzové křivky snímané pomocí arteriálního katétru, a to na základě opakované kalibrace systému transpulmonální termodilucí (tzv. systém PiCCO). V tomto případě není nutná pravostranná srdeční katetrizace, ale postačuje pouze současné použití arteriálního a žilního katétru. Systém navíc umožňuje hodnocení intravaskulárního nitrohrudního objemu a extravaskulární plicní vody.
Při anémii je u těžké sepse obvykle doporučeno podat transfuzi erytrocytární masy při poklesu hladiny hemoglobinu pod 70 – 80 g/ l, zatímco u septického šoku je minimální tolerovatelná hladina hemoglobinu hůře dokumentována, většina odborníků však doporučuje korekci již při poklesu pod 90 – 100 g/ l. Ačkoliv velmi nízká hodnota SvO2, EKG známky ischemie nebo výrazná tachykardie mohou podporovat rozhodnutí o udržování vyšší hladiny hemoglobinu, neprokázaly klinické studie u septických nemocných lepší výsledky léčby při udržování hladiny hemoglobinu nad 100 g/ l proti hladinám nad 70 g/ l. Déle skladovaná erytrocytární masa je přitom méně účinná než čerstvá.
Pokud hydratační test nevede k adekvátnímu zvýšení středního arteriálního tlaku a ústupu známek porušené orgánové perfuze, mělo by být zahájeno podávání vazopresorických léků. Terapie vazopresory je indikována také jako přechodná léčba u těžké život ohrožující hypotenze, i když centrální žilní tlak není zvýšený. Protože měření arteriálního krevního tlaku pomocí manžety je u šokového stavu často nespolehlivé a nepřesné, měli by být nemocní monitorováni kontinuálně invazivně pomocí arteriálního katétru, a to zejména pokud dostávají vazopresory (tab. 4). Většinou je žádoucí dosáhnout zvýšení středního arteriálního tlaku nad 60 – 65 mm Hg, přičemž závisí na premorbidních hodnotách tlaku. U starších nemocných je obvykle požadovaná hodnota vyšší. Střední arteriální tlak by měl být udržován na minimální úrovni dostačující k udržení diurézy, což však u některých nemocných může být až 75 mm Hg. K zahájení léčby je doporučován noradrenalin. Dopamin a dobutamin mají jen omezené indikace. Blokáda syntézy oxidu dusnatého byla klinicky testována, ale neosvědčila se.
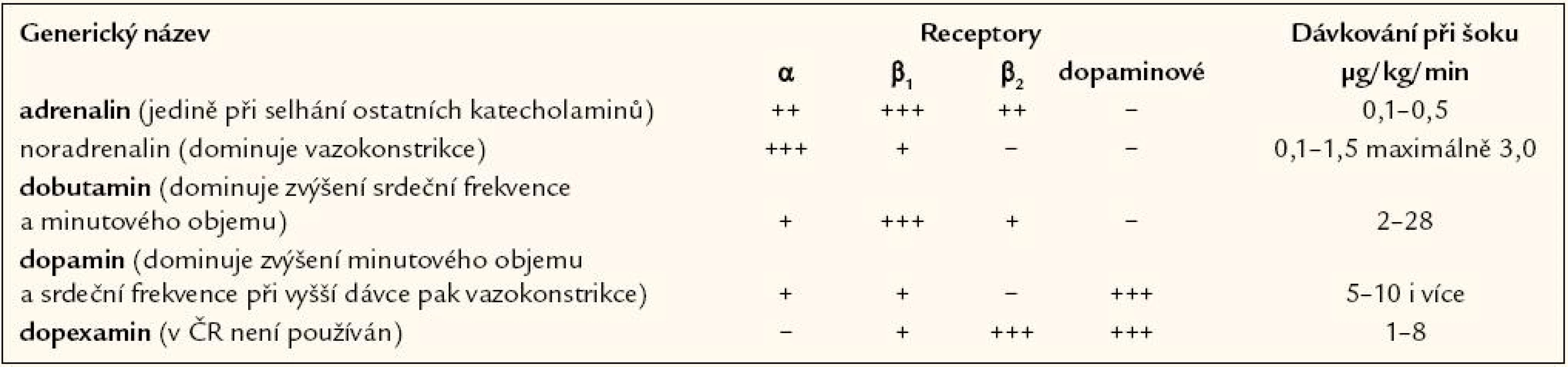
U nemocných se septickým šokem s nedostatečnou hemodynamickou odpovědí na vazopresorické aminy je nutno brát do úvahy možnost skryté insuficience kůry nadledvin. Incidence této poruchy u nemocných s těžkou sepsí je odhadována až na 50 %, a to na základě laboratorního testování vzestupu hladin endogenního kortisolu po krátkodobém podání adrenokortikotropního hormonu. Exogenní podání zvýšené, tzv. stresové dávky (200 – 300 mg/ 24 hod hydrokortisonu) nemocným se septickým šokem vede během několika hodin k rychlému zlepšení hemodynamických ukazatelů.
Oxygenoterapie s podáváním kyslíku nosními brýlemi nebo maskou je indikována při poklesu saturace hemoglobinu kyslíkem pod 90 %, což přibližně odpovídá parciálnímu tlaku kyslíku v artérii pod 8 kPa. Cílem je zabránit vzniku hypoxemické tkáňové hypoxie. Zásadním přístupem je snaha o zajištění horních dýchacích cest a včasná indikace ventilační podpory. Neinvazivní ventilace pozitivním tlakem aplikovaným maskou není u ALI/ ARDS dostatečně účinná a v žádném případě by neměla vést k odkladu řízené ventilace. Cílem včasného zahájení řízené ventilace je předejít komplikacím spojeným s hypoxemií a zabránit svalovému vyčerpání a dechové zástavě. Indikací k zahájení řízené ventilace je závažná hypoxemie neupravující se adekvátní oxygenoterapií, tachypnoe (> 35 – 40 dechů/ min), selhávání respiračního svalstva projevující se zapojením pomocných dýchacích svalů a alterace vědomí.
Profylaxí vzniku šokové ledviny je udržení diurézy vyšší než 50 ml/ hod pomocí dostatečné hydratace, případně diuretik. Akutní selhání ledvin vyžadující hemodialýzu se vyvíjí pouze u 5 % nemocných s těžkou sepsí, je však závažnou komplikací s mortalitou konstantně převyšující 50 %. Jedním z cílů léčby sepse proto je prevence této komplikace pomocí včasné úpravy hemodynamických parametrů, s cílem udržet diurézu za každou jednotlivou hodinu nad 0,5 ml/ kg tělesné hmotnosti. Nízké dávky dopaminu (< 5 μg/ ml/ min) krátkodobě zvyšují diurézu u neoligurických nemocných se sepsí, avšak beze změny v glomerulární filtraci. Nebylo prokázáno zvýšení průtoku krve ledvinami ani snížení výskytu selhání ledvin nebo potřeby hemodialýzy a nedošlo ani ke zlepšení přežívaní nemocných. Rutinní podávání nízkých dávek dopaminu s cílem ochrany ledvinných funkcí dnes není doporučeno. Pokud u nemocného přetrvává oligurie přes optimální hemodynamickou podporu a podávání diuretik, je nutno zvážit zahájení buď intermitentní hemodialýzy, nebo kontinuální renální náhrady. Protože klasická intermitentní hemodialýza je spojena s hypotenzí až u 30 % léčených, jsou dnes u septických pacientů s oběhovou nestabilitou preferovány metody kontinuální renální náhrady. Kontinuální veno‑venózní hemofiltrace (CVVH) s použitím peristaltické pumpy může konvektivním způsobem odstranit z těla středně velké molekuly látek (15 000 – 50 000 Da), jakými jsou mimo jiné cytokiny a jiné zánětlivé mediátory, a navíc lze použitím ultrafiltrace dosáhnout i negativní bilance tekutin. Výhodou této metody jsou hemodynamická stabilita nemocného a lepší metabolická kontrola vnitřního prostředí. Protože efekt odstranění cytokinů na příznivý výsledek léčby těžké sepse nebyl prokázán, jsou kontinuální eliminační metody při sepsi indikovány především u renálního selhávání (tab. 5).

Stran profylaxe a poruch krevního srážení se v profylaxi používá nízkomolekulární heparin a případně mechanické pomůcky, zejména pneumatická komprese dolních končetin. Při léčbě již klinické manifestní DIK se používá dále koncentrát antitrombinu III k substituci při jeho poklesu. Použití aktivovaného proteinu C je limitováno na těžké meningokokové sepse s DIK.
Sepse je charakterizována zvýšeným energetickým výdejem, katabolizmem endogenních bílkovin a tuků, negativní dusíkovou bilancí, hyperglykemií, rezistencí k inzulinu a rychlým rozvojem proteino - energetické malnutrice. Metabolizmus nemocného se nedokáže adaptovat na hladovění, a tím ani šetřit energií a živinami. Je dobře dokumentováno, že špatný nutriční stav znamená v průměru horší celkový výsledek léčby kriticky nemocných. Nutriční podpora septických nemocných je proto všeobecně přijata jako standardní léčebný postup. V iniciální fázi sepse v období oběhové nestability není nutriční podpora pro nemocného zásadní a může představovat neúčelnou metabolickou zátěž. Zahájení plné nutriční podpory přichází do úvahy až po úpravě krevního tlaku a obnovení tkáňové perfuze. I potom však u septických nemocných pozorujeme sníženou odpověď na umělou klinickou výživu. Preferujeme enterální výživu a v případech, kdy ji nelze použít, tak výživu parenterální. Zásadní charakteristikou složení umělé klinické výživy nemocných v sepsi je relativně omezený přívod energie a vysoký přívod bílkovin (aminokyselin). Jedná se o stresový poměr hlavních živin, kdy je na každý gram přijatého dusíku dodáváno relativně menší množství nebílkovinné energie (300 – 400 np - kJ/ 1g N, proti obvyklému poměru 625 np ‑ kJ/ 1 g N) (tab. 6). Cílem nutriční podpory v iniciální fázi sepse je co nejvíce zbrzdit katabolizmus endogenních bílkovin, nikoliv však za každou cenu vyrovnat bilanci energie či dusíku. Nadměrný přívod energie v období stresu představuje metabolickou zátěž s vysokým rizikem komplikací, zejména při parenterální výživě. Zvláště vysoký přívod tuků ve fázi aktivity volných forem kyslíku je rizikem vzniku lipoperoxidace a dalšího poškození tkání. Metabolickou přeměnou nadbytečně přiváděných n ‑ 6 polynesaturovaných mastných kyselin vzniká imunosupresivní prostaglandin E2 s nárůstem výskytu infekčních komplikací, opět především při parenterální výživě. V průběhu nutriční podpory je nezbytná důsledná kontrola glykemického profilu u všech nemocných nezávisle na tom, zda mají diabetes, nebo nikoliv. Hyperglykemie přináší riziko narušení leukocytárních imunitních funkcí, což je možno dokumentovat zhoršením fagocytózy. Intenzivní léčba inzulinem s cílem udržení hladiny glykemie v rozmezí normálních hodnot (4,4 – 6,1 mmol/ l) vede u kriticky nemocných pacientů k nižší morbiditě i mortalitě proti tradičnímu přístupu kontroly glykemie do 11 mmol/ l. Dochází k významné redukci septických epizod, přičemž nemocní s bakteriemií mají nižší mortalitu s obrazem multiorgánové dysfunkce.

Výjimečnou indikací pro intravenóznípodání polyvalentních imunoglobulinů se stávají pouze onemocnění pravidelně provázená nízkými hladinami funkčních protilátek, jako jsou mnohočetný myelom a chronická lymfatická leukemie nebo i jiné lymfoproliferativní choroby. V takovém případě je při vzniku sepse léčba vhodná u nemocných se sérovou hladinou IgG pod 5 g/ l, a to v substituční dávce 0,4 g nativní kompletní molekuly imunoglobulinu na kg tělesné hmotnosti. U nemocných se sérovým monoklonálním proteinem ve třídě IgG odhadujeme nedostatek funkčních IgG spíše podle nálezu nízkých hladin IgA či IgM. Leukocytární růstové faktory mohou být přínosem pouze pro nemocné se sepsí při neutropenii.
Profylaxe stresových vředů je dnes doporučena u kriticky nemocných, u nichž vede k významnému snížení epizod krvácení. Velkou část nemocných sledovaných v klinických studiích přitom tvoří septičtí pacienti. Rizikovou podskupinou jsou především nemocní s umělou plicní ventilací, s dlouhodobou hypotenzí a pacienti s koagulopatií. Standardně jsou dnes používány inhibitory protonové pumpy. Nezdá se, že by zvýšení žaludečního pH představovalo vyšší riziko mikrobiální kolonizace žaludku a následné komplikující pneumonie.
MUDr. Milan Navrátil
www.fnbrno.cz
e‑mail: milan.navratil@fnbrno.cz
Doručeno do redakce: 7. 5. 2010
Sources
1. Antonelli M, Azoulay E, Bonten M et al. Year in review in Intensive Care Medicine, 2008: I. Brain injury and neurology, renal failure and endocrinology, metabolism and nutrition, sepsis, infections and pneumonia. Intensive Care Med 2009; 35 : 30 – 44.
2. Antonelli M, Azoulay E, Bonten M et al. Year in review in Intensive Care Medicine, 2007. II. Haemodynamics, pneumonia, infections and sepsis, invasive and non‑invasive mechanical ventilation, acute respiratory distress syndrome. Intensive Care Med 2008; 34 : 405 – 422.
3. Antonelli M, Azoulay E, Bonten M et al. Year in review in Intensive Care Medicine 2009: I. Pneumonia and infections, sepsis, outcome, acute renal failure and acid base, nutrition and glycaemic control. Intensive Care Med 2010; 36 : 196 – 209.
4. Bagshaw SM, Bellomo R. Early diagnosis of acute kidney injury. Curr Opin Crit Care 2007; 13 : 638 – 644.
5. Bagshaw SM, Bellomo R. The influence of volume management on outcome. Curr Opin Crit Care 2007; 13 : 541 – 548.
6. Boyd JH, Walley KR. Is there a role for sodium bicarbonate in treating lactic acidosis from shock? Curr Opin Crit Care 2008; 14 : 379 – 383.
7. Camporota L, Wyncoll D. Practical aspects of treatment with drotrecogin alfa (activated). Crit Care 2007; 11 (Suppl 5): S7.
8. Canabal JM, Kramer DJ. Management of sepsis in patients with liver failure. Curr Opin Crit Care 2008; 14 : 189 – 197.
9. Casserly B, Read R, Levy MM. Hemodynamic monitoring in sepsis. Crit Care Clin 2009; 25 : 803 – 823.
10. Zanotti Cavazzoni SL, Dellinger RP. Hemodynamic optimization of sepsis‑induced tissue hypoperfusion. Crit Care 2006; 10 (Suppl 3): S2.
11. Cheng AC, Stephens DP, Currie BJ. Granulocyte ‑ colony stimulating factor (G‑CSF) as an adjunct to antibiotics in the treatment of pneumonia in adults. Cochrane Database Syst Rev 2007; 2: CD004400.
12. Christaki E, Opal SM. Is the mortality rate for septic shock really decreasing? Curr Opin Crit Care 2008; 14 : 580 – 586.
13. Cinel I, Opal SM. Molecular biology of inflammation and sepsis: a primer. Crit Care Med 2009; 37 : 291 – 304.
14. Claessens YE, Dhainaut JF. Diagnosis and treatment of severe sepsis. Crit Care 2007; 11 (Suppl 5): S2.
15. Dellinger RP, Levy MM, Carlet JM et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Intensive Care Med 2008; 34 : 17 – 60.
16. Dellinger RP, Levy MM, Carlet JM et al. Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med 2008; 36 : 296 – 327.
17. Doig GS, Heighes PT, Simpson F et al. Early enteral nutrition, provided within 24 h of injury or intensive care unit admission, significantly reduces mortality in critically ill patients: a meta‑analysis of randomised controlled trials. Intensive Care Med 2009; 35 : 2018 – 2027.
18. Downar J, Lapinsky SE. Pro/ con debate: should synthetic colloids be used in patients with septic shock? Crit Care 2009; 13 : 203.
19. Fortin CF, McDonald PP, Fülöp T et al. Sepsis, leukocytes, and nitric oxide (NO): an intricate affair. Shock 2010; 33 : 344 – 352.
20. Frank AJ, Thompson BT. Pharmacological treatments for acute respiratory distress syndrome. Curr Opin Crit Care 2010; 16 : 62 – 68.
21. Funk D, Sebat F, Kumar A. A systems approach to the early recognition and rapid administration of best practice therapy in sepsis and septic shock. Curr Opin Crit Care 2009; 15 : 301 – 307.
22. Gao H, Evans TW, Finney SJ. Bench ‑ to ‑ bedside review: Sepsis, severe sepsis and septic shock – does the nature of the infecting organism matter? Crit Care 2008; 12 : 213.
23. Gottschlich B, Koch T. Nutritional support of intensive care patients. Anasthesiol Intensiv Med 2008; 49 : 318.
24. Groeneveld AB, Molenaar N, Beishuizen B. Should we abandon corticosteroids during septic shock? No. Curr Opin Crit Care 2008; 14 : 384 – 389.
25. Hausfater P. Procalcitonin measurement in adult clinical practice. Rev Med Interne 2007; 28 : 296 – 305.
26. Heller AR, Ragaller M. Intestinal malfunction in the ICU. Anasthesiol Intensiv Med 2008; 49 : 20.
27. Hollenberg SM. Inotrope and vasopressor therapy of septic shock. Crit Care Clin 2009; 25 : 781 – 802.
28. Hollenberg SM, Cinel I. Bench ‑ to ‑ bedside review: nitric oxide in critical illness – update 2008. Critl Care 2009; 13 : 218.
29. Holmes CL, Walley KR. Vasoactive drugs for vasodilatory shock in ICU. Curr Opin Crit Care 2009; 15 : 398 – 402.
30. Khan S, Trof RJ, Groeneveld AB. Transpulmonary dilution ‑ derived extravascular lung water as a measure of lung edema. Curr Opin Crit Care 2007; 13 : 303 – 307.
31. Klastersky J. Empirical treatment of sepsis in neutropenic patients. Hosp Med 2001; 62 : 101 – 103.
32. Klastersky J, Paesmans M. Risk‑adapted strategy for the management of febrile neutropenia in cancer patients. Support Care Cancer 2007; 15 : 477 – 482.
33. Kollef MH, Micek ST. Using protocols to improve patient outcomes in the intensive care unit: focus on mechanical ventilation and sepsis. Semin Respir Crit Care Med 2010; 31 : 19 – 30.
34. Lange M, Ertmer C, Westphal M. Vasopressin vs. terlipressin in the treatment of cardiovascular failure in sepsis. Intensive Care Med 2008; 34 : 821 – 832.
35. Laterre PF. Clinical trials in severe sepsis with drotrecogin alfa (activated). Crit Care 2007; 11 (Suppl 5): S5.
36. Leaver SK, Finney SJ, Burke ‑ Gaffney A et al. Sepsis since the discovery of Toll‑like receptors: disease concepts and therapeutic opportunities. Crit Care Med 2007; 35 : 1404 – 1410.
37. Levi M. Disseminated intravascular coagulation. Crit Care Med 2007; 35 : 2191 – 2195.
38. Levi M, Opal SM. Coagulation abnormalities in critically ill patients. Crit Care 2006; 10 : 222.
39. Levi M, van der Poll T. Recombinant human activated protein C: current insights into its mechanism of action. Crit Care 2007; 11 (Suppl 5): S3.
40. Levi M, van der Poll T. Inflammation and coagulation. Crit Care Med 2010; 38 (Suppl 2): S26 – S34.
41. Levy B. Bench ‑ to ‑ bedside review: Is there a place for epinephrine in septic shock? Crit Care 2005; 9 : 561 – 565.
42. Levy B. Lactate and shock state: the metabolic view. Curr Opin Crit Care 2006; 12 : 315 – 321.
43. Lortholary O, Lefort A, Tod M et al. Pharmacodynamics and pharmacokinetics of antibacterial drugs in the management of febrile neutropenia. Lancet Infect Dis 2008; 8 : 612 – 620.
44. Lundy DJ, Trzeciak S. Microcirculatory dysfunction in sepsis. Crit Care Clin 2009; 25 : 721 – 731.
45. Magder S. Bench ‑ to ‑ bedside review: ventilatory abnormalities in sepsis. Crit Care 2009; 13 : 202.
46. Marik PE, Pastores SM, Annane D et al. Recommendations for the diagnosis and management of corticosteroid insufficiency in critically ill adult patients: consensus statements from an international task force by the American College of Critical Care Medicine. Crit Care Med 2008; 36 : 1937 – 1949.
47. Marik PE, Zaloga GP. Immunonutrition in critically ill patients: a systematic review and analysis of the literature. Intensive Care Med 2008; 34 : 1980 – 1990.
48. Marshall JC, Reinhart K. International Sepsis Forum. Biomarkers of sepsis. Crit Care Med 2009; 37 : 2290 – 2298.
49. Mendes AV, Sapolnik R, Mendonça N. New guidelines for the clinical management of febrile neutropenia and sepsis in pediatric oncology patients. J Pediatr 2007; 83 (Suppl 2): S54 – S63.
50. Napolitano LM, Kurek S, Luchette FA et al. Clinical practice guideline: red blood cell transfusion in adult trauma and critical care. Crit Care Med 2009; 37 : 3124 – 3157.
51. Nobre V, Sarasin FP, Pugin J. Prompt antibiotic administration and goal ‑ directed hemodynamic support in patients with severe sepses and septic shock. Curr Opin Crit Care 2007; 13 : 586 – 591.
52. Opal SM, LaRosa SP. Year in review 2008: Critical Care – sepsis. Critical Care 2009; 13 : 224.
53. Ragaller M, Fritzsche K, Sengebusch K et al. Treatment of sepsis – what is indispensable? Anasthesiol Intensiv Med 2009; 50 : 654.
54. Roche AM, James MF. Colloids and crystalloids: does it matter to the kidney? Curr Opin Crit Care 2009; 15 : 520 – 524.
55. Rodloff AC, Goldstein EJ, Torres A. Two decades of imipenem therapy. J Antimicrob Chemother 2006; 58 : 916 – 929.
56. Rodríguez ‑ Baño J. Selection of empiric therapy in patients with catheter‑related infections. Clin Microbiol Infect 2002; 8 : 275 – 281.
57. Ronco C, Tetta C. Extracorporal blood purification: more than diffusion and convection. Does this help? Curr Opin Crit Care 2007; 13 : 662 – 667.
58. Rudiger A, Singer M. Mechanisms of sepsis‑induced cardiac dysfunction. Crit Care Med 2007; 35 : 1599 – 1608.
59. Sandrock CE, Albertson TE. Controversies in the treatment of sepsis. Semin Respir Crit Care Med 2010; 31 : 66 – 78.
60. Sevransky J. Clinical assessment of hemodynamically unstable patients. Curr Opin Crit Care 2009; 15 : 234 – 238.
61. Sevransky JE, Nour S, Susla GM et al. Hemodynamic goals in randomized clinical trials in patients with sepsis: a systematic review of the literature. Crit Care 2007; 11: R67.
62. Sharma AC. Sepsis‑induced myocardial dysfunction. Shock 2007; 28 : 265 – 269.
63. Siami S, Annane D, Sharshar T. The encephalopathy in sepsis. Crit Care Clin 2008; 24 : 67 – 82.
64. Singer P, Shapiro H, Theilla M et al. Anti‑inflammatory properties of omega ‑ 3 fatty acids in critical illness: novel mechanisms and an integrative perspective. Intensive Care Med 2008; 34 : 1580 – 1592.
65. Singh S, Evans TW. Organ dysfunction during sepsis. Intensive Care Med 2006; 32 : 349 – 360.
66. Stevens RD, Dowdy DW, Michaels RK et al. Neuromuscular dysfunction acquired in critical illness: a systematic review. Intensive Care Med 2007; 33 : 1876 – 1891.
67. Sutherland AM, Walley KR. Bench ‑ to ‑ bedside review: Association of genetic variation with sepsis. Crit Care 2009; 13 : 210.
68. Thirumala R, Ramaswamy M, Chawla S. Diagnosis and management of infectious complications in critically Ill patients with cancer. Crit Care Clin 2010; 26 : 59 – 91.
69. van Haren FM, Sleigh JW, Pickkers P et al. Gastrointestinal perfusion in septic shock. Anaesth Intensive Care 2007; 35 : 679 – 694.
70. Vriesendorp TM, DeVries JH, Hoekstra JB. Hypoglycemia and strict glycemic control in critically ill patients. Curr Opin Crit Care 2008; 14 : 397 – 402.
71. Westphal M, Van Aken H, Rehberg S et al. All colloids are not the same. Anasthesiol Intensiv Med 2009; 50 : 378 – 381.
72. Wiedermann CJ. Clinical review: molecular mechanisms underlying the role of antithrombin in sepsis. Crit Care 2006; 10 : 209.
73. Zarychanski R, Ariano RE, Paunovic B et al. Historical perspectives in critical care medicine: blood transfusion, intravenous fluids, inotropes/ vasopressors, and antibiotics. Crit Care Clin 2009; 25 : 201 – 220.
74. Zimmerman JJ. A history of adjunctive glucocorticoid treatment for pediatric sepsis: moving beyond steroid pulp fiction toward evidence‑based medicine. Pediatr Crit Care Med 2007; 8 : 530 – 539.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2010 Issue 6
-
All articles in this issue
- Plicní hypertenze – neobvyklá komplikace syndromu bakteriálního přerůstání – editorial
- Existuje diurnální variabilita big endotelinu a NT‑proBNP u nemocných s těžkým chronickým srdečním selháním?
- Normalizovaný smoothness index a parametrický populační RDH index telmisartanu u pacientů s čerstvě zjištěnou hypertenzí a metabolickým syndromem
- Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k 1. čtvrtletí roku 2010
- Plicní hypertenze – neobvyklá komplikace hemolýzy a syndromu bakteriálního přerůstání
-
Hyperlipoproteinemie a dyslipoproteinemie I.
Klasifikace, diagnostika, kardiovaskulární, kardiometabolické a reziduální riziko - Registr BRNO 2: farmakoterapie po infarktu myokardu
- Odlišné průběhy recidivující anebo multisystémové formy histiocytózy z Langerhansových buněk u dospělých osob – popis 22 případů z jednoho pracoviště
- Sepse a septický šok u onkologických a imunokompromitovaných pacientů – diagnostika, terapie
- Psychologický náhled na problémy onkologických pacientů a ošetřujícího týmu
- Preventivní podání antibiotik a probiotik u těžké akutní pankreatitidy
- Přínos jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu
- Příspěvek k hodnocení sérových hladin vybraných biologických působků u monoklonální gamapatie nejistého významu a v jednotlivých klinických stadiích mnohočetného myelomu
- Kontinuálne monitorovanie tkanivovej glukózy
- Význam senzitivity baroreflexu pre stratifikáciu kardiovaskulárneho rizika u hypertonikov
- Prevencia a liečba končatinovocievnej ischemickej choroby
- Zmeny v lipoproteínovom spektre pri končatinovo- cievnej ischemickej chorobe
- Vysoké školy musí mít nejen kvalitní výuku, ale také účinnou kontrolu kvality znalostí a schopností studentů (produktů) vysoké školy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Sepse a septický šok u onkologických a imunokompromitovaných pacientů – diagnostika, terapie
-
Hyperlipoproteinemie a dyslipoproteinemie I.
Klasifikace, diagnostika, kardiovaskulární, kardiometabolické a reziduální riziko - Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k 1. čtvrtletí roku 2010
- Odlišné průběhy recidivující anebo multisystémové formy histiocytózy z Langerhansových buněk u dospělých osob – popis 22 případů z jednoho pracoviště
