Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
How to avoid the mistake in diagnosing incipient critical disorder of haemostasis in an out-patient clinic
Critical disorders of haemostasis occur mostly in hospitalized patients; they are usually associated with a serious illness. However, a patient with an early phase of such disorder can visit the office of the general practitioner, hematologist or internist. Every patient with newly emerging bleeding symptoms should be thoroughly investigated with the aim of early detecting of developing critical disorder of haemostasis. The disseminated intravascular coagulation, microangiopathic hemolytic anemia (thrombotic thrombocytopenic purpura, hemolytic-uremic syndrome, pre-eclampsia, HELLP syndrome and catastrophic antiphospholipid syndrome), acute leukemia and heparin induced thrombocytopenia are the most important emergent haemostasis disturbances. In patients suffering from these disorders the bleeding tendency is often combined with thrombotic process affecting dominantly the microcirculation. Severe bleeding can be caused also by overdose of anticoagulants or by acquired inhibitors of coagulation factors.
Key words:
bleeding – thrombosis – microangiopathic hemolytic anemia – acute leukemia – heparin induced thrombocytopenia
Authors:
P. Kessler
Authors‘ workplace:
Oddělení hematologie a transfuziologie Nemocnice Pelhřimov, p. o., přednosta prim. MUDr. Petr Kessler
Published in:
Vnitř Lék 2012; 58(7 a 8): 141-145
Category:
60th Birthday prof. MUDr. Miroslav Penka, CSc.
Overview
Kritické poruchy hemostázy se vyskytují nejčastěji u hospitalizovaných pacientů, obvykle bývají spojeny se závažným onemocněním. Pacient v časné fázi takové poruchy však může navštívit ambulanci praktického lékaře, hematologa nebo internisty. Každý pacient s nově se objevivšími krvácivými příznaky by měl být podrobně vyšetřen s cílem včasné detekce vyvíjející se kritické poruchy hemostázy. Diseminovaná intravaskulární koagulace, mikroangiopatické hemolytické anémie (trombotická trombocytopenická purpura, hemolyticko-uremický syndrom, preeklampsie, HELLP syndrom a katastrofický antifosfolipidový syndrom), akutní leukemie a heparinem indukovaná trombocytopenie jsou nejvýznamnější emergentní poruchy hemostázy. U pacientů s těmito poruchami je sklon ke krvácení často kombinován s trombotickým procesem postihujícím dominantně mikrocirkulaci. Těžké krvácení může být též způsobeno předávkováním antikoagulancií nebo získanými inhibitory koagulačních faktorů.
Klíčová slova:
krvácení – trombóza – mikroangiopatická hemolytická anémie – akutní leukemie – heparinem indukovaná trombocytopenie
Úvod
K zajištění efektivní hemostázy je nutná souhra cévní stěny, krevních destiček a plazmatických koagulačních faktorů. Narušení integrity cévní stěny, trombocytopenie nebo trombocytopatie a kritické snížení plazmatických koagulačních faktorů mohou vést ke krvácení. Existují vrozené i získané poruchy každé ze jmenovaných složek, získané poruchy jsou často kombinované, s postižením více komponent. Zatímco závažné vrozené poruchy hemostázy bývají diagnostikovány už v dětském věku, lehčí vrozené poruchy, z nichž nejčastější je 1. typ von Willebrandovy choroby, se někdy manifestují až v dospělosti v souvislosti se zvýšenými nároky na hemostázu (porod, trauma, operace).
Krvácivé projevy, které přivedou pacienta do ambulance praktického lékaře, internisty nebo hematologa, bývají podmíněny buď lokální příčinou, nebo získanou systémovou poruchou hemostázy. Masivní krvácení z lokální příčiny ovšem často vede k sekundární systémové koagulopatii.
Zatímco v případě masivního krvácení je úkolem ambulantního lékaře lokální stavění krvácení, zajištění žilního přístupu a přivolání záchranné služby, v případě ostatních krvácivých projevů vystupuje do popředí diferenciální diagnostika zahrnující vyloučení závažných systémových poruch hemostázy. O systémové poruše hemostázy je nutno uvažovat v případě spontánních krvácivých projevů nebo protrahovaného krvácení po banálním traumatu nebo operačním výkonu.
Anamnéza
V anamnéze zjišťujeme výskyt krvácivých onemocnění v rodině i v osobním předchorobí. Zajímá nás dlouhodobá i aktuální medikace, abúzus alkoholu, prodělaná interkurentní onemocnění nebo očkování krátce před začátkem krvácivých příznaků, celkové příznaky svědčící pro jaterní chorobu, systémové autoimunitní onemocnění, nádor či infekci, důležitá je lokalizace krvácivých projevů a jejich charakter, dynamika rozvoje příznaků. Ptáme se na přítomnost hemoptýzy, hematurie, melény, hematemezy, menoragie či metroragie, na diurézu, horečku.
Fyzikální vyšetření
Při fyzikálním vyšetření se soustředíme na vlastní krvácivé projevy a na příznaky chorob, které mohou být příčinou krvácení. Zajímají nás neurologické příznaky, známky sepse, známky počínajícího šoku, velikost a konzistence jater, splenomegalie, lymfadenomegalie.
Laboratorní vyšetření
U pacientů s podezřením na systémovou poruchu hemostázy je nutno provést základní laboratorní vyšetření zahrnující krevní obraz s diferenciálem, mikroskopické vyšetření nátěru periferní krve na sklíčko a základní koagulační testy, ke kterým patří aktivovaný parciální tromboplastinový čas (APTT), protrombinový test (PT), fibrinogen, trombinový čas a čas euglobulinové lýzy. Při klinicky zjevné krvácivé poruše a normálních nálezech uvedených vyšetření je třeba doplnit vyšetření primární hemostázy.
Dále provádíme biochemické vyšetření zaměřené na hemolýzu [laktát dehydrogenáza (LDH), haptoglobin], sepsi (CRP, procalcitonin), jaterní testy a vyšetření renálních funkcí. Zjištěné odchylky pak upřesní směr další diferenciálně diagnostické rozvahy.
Trombocytopenie
Trombocytopenie je definována jako snížení počtu krevních destiček v periferní krvi pod dolní hranici referenčního rozmezí (většinou 140–150 × 109/l), podle nové definice imunitní trombocytopenie (ITP) je za trombocytopenii považován pokles počtu trombocytů pod hranici 100 × 109/l [1]. Může být způsobena poruchou tvorby trombocytů, jejich urychlenou destrukcí či konzumpcí nebo sekvestrací (většinou ve slezině) či naředěním.
Riziko krvácení stoupá s klesajícím počtem trombocytů, s věkem, s přítomností souběžné koagulopatie a se současnou trombocytopatií, která je nejčastěji rovněž získaná, např. při užívání acetylsalicylové kyseliny (ASA) nebo nesteroidních antirevmatik (NSAID). Záleží také na velikosti a stáří krevních destiček – mladší trombocyty jsou větší a mají vyšší hemostatický potenciál. U pacientů s akutní leukemií stoupá riziko významného krvácení s klesajícím počtem trombocytů a se zvyšující se teplotou, přičemž mírné krvácení je známkou zvýšeného rizika velkého krvácení v následujícím dni [2]. Pokud nejsou přítomny další faktory zvyšující riziko krvácení, je počet trombocytů nad 50 × 109/l považovaný za dostatečný pro běžné chirurgické výkony nebo spontánní porod. Ke spontánním krvácivým projevům dochází až při poklesu trombocytů pod 20–30 × 109/l. K závažnému krvácení zpravidla dochází při kombinaci těžké trombocytopenie s dalšími poruchami hemostázy, nejčastěji při současné sepsi. Velké spontánní krvácení je vzácné, pokud počet trombocytů nepoklesne pod 5 × 109/l [3].
Izolovaná trombocytopenie
Izolovaná trombocytopenie manifestující se v dospělém věku je podmíněna nejčastěji imunitními mechanizmy – imunitní trombocytopenie (ITP). Její patogeneze je velmi heterogenní, uplatňovat se může řada mechanizmů [4]. Většina pacientů s ITP je asymptomatická, nicméně, u osob s dlouhodobě perzistující trombocytopenií s počtem trombocytů pod 30 × 109/l je riziko fatálního krvácení nezanedbatelné – 0,4, 1,2, a 13 příhod na 100 pacientů/let ve věkových kategoriích pod 40, 40–60 a nad 60 let [5].
Přestože ITP je v klinické praxi nejčastější příčinou spontánních krvácivých projevů, většinou jde o petechie nebo slizniční krvácení nepředstavující bezprostřední ohrožení pacienta.
Trombocytopenie jako projev život ohrožujícího onemocnění
Diseminovaná intravaskulární koagulace (DIC), trombotické mikroangiopatie (TMA), akutní leukemie a heparinem indukovaná trombocytopenie (HIT) představují méně časté příčiny trombocytopenie, jde však o život ohrožující stavy vyžadující co nejrychlejší diagnostiku a zahájení terapie. Proto na ně musíme v diferenciální diagnostice trombocytopenií vždy prioritně myslet.
Diseminovaná intravaskulární koagulace
DIC je charakterizována generalizovanou aktivací hemostázy, trombózou v mikrocirkulaci (nezřídka dochází k trombóze i ve větších cévách), vedoucí ke konzumpci koagulačních faktorů a krevních destiček, selhání regulačních mechanizmů (pokles inhibitorů koagulace a endoteliální dysfunkce) s následnou ischemií tkání, která může mít za následek multiorgánové selhání [6]. DIC provází jiné závažné stavy (porodnické komplikace, sepse, polytrauma, maligní nádory atd.), na ambulanci takový pacient zavítá málokdy, v úvahu přichází například perakutní sepse u splenektomovaného pacienta [7] nebo meningokoková sepse či leptospiróza [8], vzácně může být krvácení při DIC prvním projevem nádorového onemocnění.
Trombotické mikroangiopatie
TMA jsou charakterizovány mikrotrombotizací v drobných cévách, která vede ke spotřebě a destrukci trombocytů a k mechanickému poškození erytrocytů „prodírajících se“ mezi fibrinovými vlákny [9]. I když jde o generalizovanou poruchu, v klinickém obrazu kromě krvácivých projevů vystupují i různé lokalizované projevy ischemie tkání v predilekčních lokalizacích podle konkrétního typu choroby. Mezi TMA řadíme především trombotickou trombocytopenickou purpuru (TTP), dále hemolyticko-uremický syndrom (HUS), preeklampsii, HELLP syndrom a katastrofický antifosfolipidový syndrom.
Nejvýznamnějšími laboratorními nálezy jsou přítomnost erytrocytárních fragmentů – schistocytů – (nejvýraznější u pacientů s TTP) [10] a výrazné známky hemolýzy – elevace LDH a snížená hladina haptoglobinu. Často se setkáme se známkami renální insuficience (HUS, TTP), u pacientek s HELLP syndromem je typická elevace jaterních enzymů. Všechna tato vyšetření provedeme vždy, i když u gravidních myslíme především na preeklampsii a HELLP syndrom, u dětí po prodělaném infektu na HUS a u pacientů s jakýmikoli neurologickými projevy nebo s horečkou na TTP [11].
Akutní leukemie
Akutní leukemie se mohou manifestovat krvácivými projevy při trombocytopenii – většinou petechiemi nebo slizničním krvácením. Iniciálními příznaky mohou být také infekce, nespecifické příznaky anemického syndromu nebo bolesti v kostech. Při vyšetření krevního obrazu často dominuje leukocytóza, může však být i leukopenie, často je přítomna anémie a trombocytopenie. Vstupně však může být přítomna i pancytopenie, někdy s dominující trombocytopenií, zejména u akutní promyelocytární leukemie, kde bývá přítomna komplexní koagulopatie [12]. Při morfologickém hodnocení nátěru na sklíčku jsou při akutní leukemii většinou patrny blastické elementy, což vede k rychlému vyslovení podezření na tuto diagnózu. Někdy je však blastických elementů v periferní krvi málo, v případě akutní promyelocytární leukemie mohou být přítomny i jen zcela ojedinělé promyelocyty.
Heparinem indukovaná trombocytopenie
HIT vzniká u pacientů léčených heparinem nebo nízkomolekulárními hepariny v důsledku tvorby protilátek proti komplexu heparin-PF4 [13]. Kromě trombocytopenie pacienta ohrožují zejména trombotické komplikace, neboť protilátky proti komplexu heparin-PF4 aktivují trombocyty, významnou roli hrají i z takto aktivovaných destiček uvolněné mikropartikule [14]. K rozvoji HIT dochází většinou mezi 5.–10. dnem od zahájení léčby heparinem, v případě nedávné léčby heparinem se může HIT rozvinout podstatně rychleji [15]. Vzácně byl pozorován opožděný rozvoj HIT. Na HIT je třeba myslet vždy při poklesu trombocytů během léčby heparinem nebo nízkomolekulárním heparinem (LMWH) nebo při vzniku nové trombózy u pacienta léčeného heparinem nebo LMWH. Je třeba vyhodnotit nejprve klinickou pravděpodobnost (tab. 1) [16].
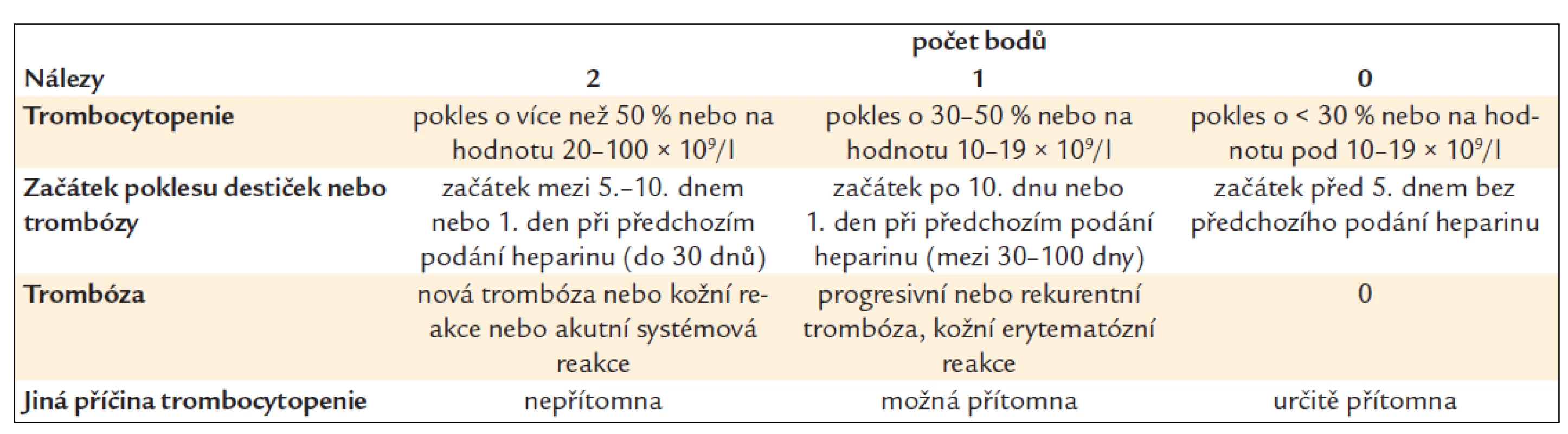
Pravděpodobnost HIT je vysoká při skóre 6–8, střední při skóre 4–5 a nízká při skóre 0–3.
Pokud je pravděpodobnost střední nebo vysoká, měla by být okamžitě přerušena léčba heparinem nebo LMWH a pacient by měl být konzultován s hematologickým centrem ohledně další diagnostiky a léčby. Pak je nutno provést laboratorní vyšetření zahrnující stanovení protilátky proti komplexu heparin/PF4 a funkční test, nejlépe serotonin release assay [16], a při potvrzení diagnózy zahájit alternativní antikoagulační léčbu.
Katastrofický antifosfolipidový syndrom
Katastrofický antifosfolipidový syndrom je charakterizován mnohočetnými trombózami v mikrocirkulaci, často i trombózami ve větších cévách, krvácivé projevy jsou spíše vzácné. Většinou se rychle rozvíjí vícečetné orgánové selhání a mortalita se blíží 50 % [17].
Krvácivé stavy podmíněné inhibitory koagulačních faktorů
Závažné krvácivé stavy, naštěstí vzácné, jsou podmíněny většinou autoprotilátkami zaměřenými proti koagulačním faktorům, které tyto faktory inhibují. Nejčastěji se vyskytuje získaná hemofilie A, protilátka proti faktoru V, proti faktoru X, někdy je výskyt protilátek kombinovaný, někdy asociovaný s antifosfolipidovými protilátkami.
Získaná hemofilie A
Získaná hemofilie A je vzácná porucha, její incidence je asi 1–1,5 na milion obyvatel ročně. Je způsobena blokující protilátkou proti faktoru VIII; v asi 1/2 případů je onemocnění sekundární při malignitě, systémové autoimunitní chorobě nebo graviditě. Klinicky se manifestuje nejčastěji krvácením do kůže, měkkých tkání nebo svalů, případně protrahovaným krvácením po chirurgickém výkonu. Na rozdíl od vrozené hemofilie A nebývá časté krvácení do kloubů. Při běžném koagulačním vyšetření zjišťujeme podobně jako u hemofilie A prodloužené aPTT, ve směsném testu nedochází ke korekci prodlouženého aPTT po přidání normální plazmy a inkubaci. Při podrobnějším vyšetření pak prokazujeme sníženou aktivitu faktoru VIII. Myslíme na ni vždy při nově vzniklých spontánních krvácivých projevech a izolovaném prodloužení APTT [18].
Získaná von Willebrandova choroba
Získaná von Willebrandova choroba se stejně jako vrozená forma manifestuje nejčastěji kožním nebo slizničním krvácením, případně protrahovaným krvácením po chirurgickém výkonu. Jde o autoimunitní onemocnění asociované často s lymfoproliferací, myeloproliferací, solidním nádorem nebo autoimunitní chorobou. Byly ale popsány případy spojené s hypotyreózou, diabetem, užíváním některých léků. V laboratorním obraze se setkáváme často s prodlouženým APTT, není to však podmínkou, někdy je zachycena pouze snížená aktivita von Willebrandova faktoru [19].
Získaná deficience faktoru V
Získaná deficience faktoru V bývá popisována nejčastěji po použití hovězího trombinu při stavění krvácení v chirurgii, ale může být též asociovaná s amyloidózou, nádorovým onemocněním, jaterní cirhózou, autoimunitní chorobou. Může být asymptomatická, ale může se manifestovat i závažným krvácením, a to spontánním, např. hematurií nebo pooperačním [20].
Získaná deficience faktoru X
Získaná deficience faktoru X bývá zjišťována při AL-amyloidóze a významně se podílí na genezi krvácivých komplikací u tohoto onemocnění. V laboratorních testech bývá patrné prodloužení PT [21].
Antikoagulans heparinové povahy
Vzácnou příčinou získaného krvácivého stavu je antikoagulans heparinové povahy, většinou asociované s maligním onemocněním, u nás Chrobák et al popsali heparinové antikoagulans asociované s Wegenerovou granulomatózou. V základním koagulačním vyšetření dominuje prodloužené APTT a trombinový čas, prodloužení trombinového času je korigovatelné protaminem nebo toluidinovou modří stejně jako prodloužení způsobené heparinem [22].
Polékové kritické poruchy hemostázy
Při léčbě antitrombotiky může dojít ke kritické poruše hemostázy buď v důsledku jejich náhodného, nebo úmyslného předávkování nebo v důsledku ovlivnění farmakokinetiky [23]. K předávkování LMWH může dojít při renální insuficienci, je možno ho prokázat vyšetřením aktivity anti-Xa. K předávkování warfarinu může dojít v důsledku lékových interakcí, nejnebezpečnější jsou v tomto ohledu inhibitory cytochromu P450 2C9 (amiodaron, kotrimoxazol, azolová antimykotika, metronidazol, ornidazol, capecitabin). Dalšími příčinami předávkování warfarinu mohou být interkurentní onemocnění, zejména pokud jsou provázena horečkou, průjmem nebo výrazným omezením příjmu potravy. Laboratorně je možno předávkování warfarinu prokázat vyšetřením INR.
Předávkování nových antitrombotik lze očekávat méně často než v případě warfarinu, protože jejich farmakokinetika je podstatně méně variabilní.
Předávkování dabigatranu se může vyskytnout u pacientů s renální insuficiencí nebo léčených současně inhibitory P-glykoproteinu (azolová antimykotika, amiodaron, verapamil). Na předávkování nás může upozornit prodloužení APTT na více než trojnásobek a neměřitelný trombinový čas. K dispozici je test založený na trombinovém času vyšetřovaném s ředěnou plazmou (dTT).
Při léčbě rivaroxabanem a apixabanem hrozí předávkování při interakci s léky, které současně inhibují P-glykoprotein a cytochrom P450 3A4 (azolová antimykotika, inhibitory proteáz HIV). V běžných koagulačních testech (APTT, PT) se předávkování projeví prodloužením, toto je však nespecifické, zásadní je test anti-Xa aktivity, na němž je také založeno specifické stanovení hladiny rivaroxabanu.
Závěr
Zdaleka ne každý lokalizovaný nebo generalizovaný krvácivý projev je známkou kritické poruchy hemostázy, u každého pacienta s poprvé zaznamenanými krvácivými projevy by však mělo být neodkladně provedeno důkladné komplexní vyšetření zaměřené na odhalení takovéto poruchy.
prim. MUDr. Petr Kessler
www.hospital-pe.cz
e-mail: pkessler@hospital-pe.cz
Doručeno do redakce: 19. 5. 2012
Sources
1. Rodeghiero F, Stasi R, Gernsheimer T et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group. Blood 2009; 113 : 2386–2393.
2. Webert K, Cook RJ, Sigouin CS et al. The risk of bleeding in thrombocytopenic patients with acute myeloid leukemia. Haematologica 2006; 91 : 1530–1537.
3. Slichter SJ. Relationship between platelet count and bleeding risk in thrombocytopenic patients. Transfus Med Rev 2004; 18 : 153–167.
4. Cines DB, Bussel JB, Liebman HA et al. The ITP syndrome: pathogenic and clinical diversity. Blood 2009; 113 : 6511–6521.
5. Cohen YC, Djulbegovic B, Shamai-Lubovitz O et al. The bleeding risk and natural history of idiopathic thrombocytopenic purpura in patients with persistently low platelet counts. Arch Intern Med 2000; 160 : 1630–1638.
6. Kitchens CS. Thrombocytopenia and thrombosis in disseminated intravascular coagulation (DIC). Hematology Am Soc Hematol Educ Program 2009; 20 : 240–246.
7. Okabayashi T, Hanazaki K. Overwhelming postsplenectomy infection syndrome in adults – a clinically preventable disease. World J Gastroenterol 2008; 14 : 176–179.
8. Wagenaar JF, Goris MG, Partiningrum DL et al. Coagulation disorders in patients with severe leptospirosis are associated with severe bleeding and mortality. Trop Med Int Health 2010; 15 : 152–159.
9. Moake J. Thrombotic thrombocytopenia purpura (TTP) and other thrombotic microangiopathies. Best Pract Res Clin Haematol 2009; 22 : 567–576.
10. Burns ER, Lou Y, Pathak A. Morphologic diagnosis of thrombotic thrombocytopenic purpura. Am J Hematol 2004; 75 : 18–21.
11. Tsai HM. Thrombotic thrombocytopenic purpura: a thrombotic disorder caused by ADAMTS13 deficiency. Hematol Oncol Clin North Am 2007; 21 : 609–632.
12. Kořístek Z, Žák P. Koagulopatie a diferenciační syndrom: hlavní komplikace úvodní léčby akutní promyelocytární leukemie. Vnitř Lék 2008; 54 : 745–750.
13. Warkentin TE. Think of HIT. Hematology Am Soc Hematol Educ Program 2006; 18 : 408–414.
14. Warkentin TE, Sheppard JI. Generation of platelet-derived microparticles and procoagulant activity by heparin-induced thrombocytopenia IgG/serum and other IgG platelet agonists: a comparison with standard platelet agonists. Platelets 1999; 10 : 319–326.
15. Lubenow N, Kempf R, Eichner A et al. Heparin-Induced Thrombocytopenia: temporal pattern of thrombocytopenia in relation to initial use or re-exposure to heparin. Chest 2002; 122 : 37–42.
16. Ortel TL. Heparin-induced thrombocytopenia: when a low platelet count is a mandate for anticoagulation. Hematology Am Soc Hematol Educ Program 2009 : 225–232.
17. Cervera R, Bucciarelli S, Plasín MA et al. Catastrophic Antiphospholipid Syndrome(CAPS) Registry Project Group (European Forum On Antiphospholipid Antibodies). Catastrophic antiphospholipid syndrome (CAPS): descriptive analysis of a series of 280 patients from the “CAPS Registry”. J Autoimmun 2009; 32 : 240–245.
18. Shetty S, Bhave M, Ghosh K. Acquired hemophilia A: Diagnosis, aetiology, clinical spectrum and treatment options. Autoimmun Rev 2010; 10 : 311–316.
19. Kumar S, Pruthi RK, Nichols WL. Acquired von Willebrand disease. Mayo Clin Proc 2002; 77 : 181–187.
20. Wiwanitkit V. Spectrum of bleeding in acquired factor V inhibitor: a summary of 33 cases. Clin Appl Thromb Hemost 2006; 12 : 485–488.
21. Thompson CA, Kyle R, Gertz M et al. Systemic AL amyloidosis with acquired factor X deficiency: A study of perioperative bleeding risk and treatment outcomes in 60 patients. Am J Hematol 2010; 85 : 171–173.
22. Chrobák L, Rozsíval V, Herout V. Heparinové antikoagulans u pacienta s Wegenerovou granulomatózou. Bratisl Lek Listy 1990; 91 : 396–398.
23. Gumulec J, Kessler P, Procházka V et al. Krvácivé komplikace antikoagulační léčby. Vnitř Lék 2009; 55 : 277–289.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue 7 a 8
-
All articles in this issue
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Chronický zánět a metabolický syndrom
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Získaná hemofilie A
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Trojkombinační léčba chronické hepatitidy C
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
