Nové antibiotiká: potrebujeme nové molekuly, alebo nové stratégie?
New antibiotics: do we need new molecules or new strategies?
Even though the situation in the field of research and development of new antimicrobial agents is not ideal, the years of stagnation, especially among anti-gramnegative agents, seem to be over. During the years 2011–2012 we have witnessed a movement towards a development of some new antibiotic agents not only with anti-grampositive activity but with anti-gramnegative too, as well as new antituberculotics and antifungals. Here we present some of these new antiinfectives, presented in conferences during the last year, of which many are being shifted to the level of clinical trials of phase II–III, while others are in stage of preclinical studies.
Keywords:
antibiotics – antimycotics – antituberculotics
Authors:
Vladimír Krčméry 1,2; Naďa Kulková 3
Authors‘ workplace:
Slovenský tropický inštitút, VŠ zdravotníctva a sociálnej práce Sv. Alžbety, Bratislava, Slovenská republika, vedúci pracovník prof. MUDr. Vladimír Krčméry, Dr. Sc., FRCP, FACP.
1; Mikrobiologický ústav LF UK a UN Bratislava, Slovenská republika, vedúci prof. MUDr. Vladimír Krčméry, DrSc., FRCP, FACP
2; Laboratórium molekulárnej mikrobiológie - spoločné výskumné pracovisko FZaSP TU a VŠ ZaSP sv. Alžbety, Bratislava, Slovenská republika, vedúci prof. MUDr. Vladimír Krčméry, Dr. Sc., FRCP, FACP
3
Published in:
Vnitř Lék 2014; 60(Suppl 2): 40-45
Category:
70th Birthday - prof. MUDr. Jiří Vorlíček, CSc.
Overview
Hoci situácia v oblasti výskumu a vývoja nových antimikróbnych látok nie je ideálna, zdá sa, že roky stagnácie, a to predovšetkým v oblasti látok s anti-gramnegatívnou aktivitou, sú preč. Počas obdobia rokov 2011–2012 sme sa stali svedkami postupu v oblasti vývoja niektorých nových antibiotík, nielen s anti-grampozitívnym, ale aj anti-gramnegatívnym účinkom, ako aj nových antituberkulotík a antifungálnych látok. V tomto krátkom prehľadovom článku uvádzame najnovšie poznatky o nových antiinfektívach, ktoré boli prezentované na konferenciách v uplynulom roku. Z týchto molekúl sa mnohé nachádzajú už vo fázach II–III klinického skúšania, kým iné sú v na začiatku procesu klinického skúšania a v predklinickom štádiu.
Kľúčové slová:
antibiotikum – antimykotikum – antituberkulotikum
Úvod
Po rokoch stagnácie v oblasti vývoja nových antibiotík sa situácia v posledných 2 rokoch začína meniť k lepšiemu. Bolo vyvinutých viacero nových molekúl aktívnych proti grampozitívnym species, ako aj proti gramnegatívom, tuberkulóze a fungálnym patogénom. Avšak, situácia je o niečo lepšia hlavne oblasti vývoja nových anti-grampozitívnych látok, kým nových anti-gramnegatívnych agens je menej. Aj preto zostávajú infekcie spôsobené multirezistentnými (MDR), extenzívne rezistentnými (XDR), či dokonca panrezistentnými gramnegatívnymi baktériami (GNB) naďalej významnými hrozbami pre zdravotnícky systém. V tomto článku uvádzame prehľad najnovších známych molekúl, prezentovaných na konferenciách v roku 2012. Patria sem nové látky zo skupín betalaktámov, inhibítory betalaktamáz, peptidy s antibiotickou aktivitou, chinolóny, nechinolónové inhibítory gyrázy, karbapenémy a ich kombinácie, aminoglykozidy, antituberkulotiká, nové echinokandíny ako aj nové kombinácie už známych liečiv a novinky v prístupe k antimikróbnej terapii.
Anti-grampozitívne látky
Táto skupina antibiotík patrí medzi tie s najrýchlejším rozvojom, pričom ide hlavne látky aktívne proti Staphylococcus aureus citlivým na meticilín (MSSA), meticilín rezistentným Staphylococcus aureus (MRSA), vankomycin-rezistentným a stredne citlivým Staphylococcus aureus (VRSA, VISA a hVISA), vankomycín-rezistentným enterokokom (VRE) a penicilín-rezistentným Streptococcus pneumoniae (PRSP).
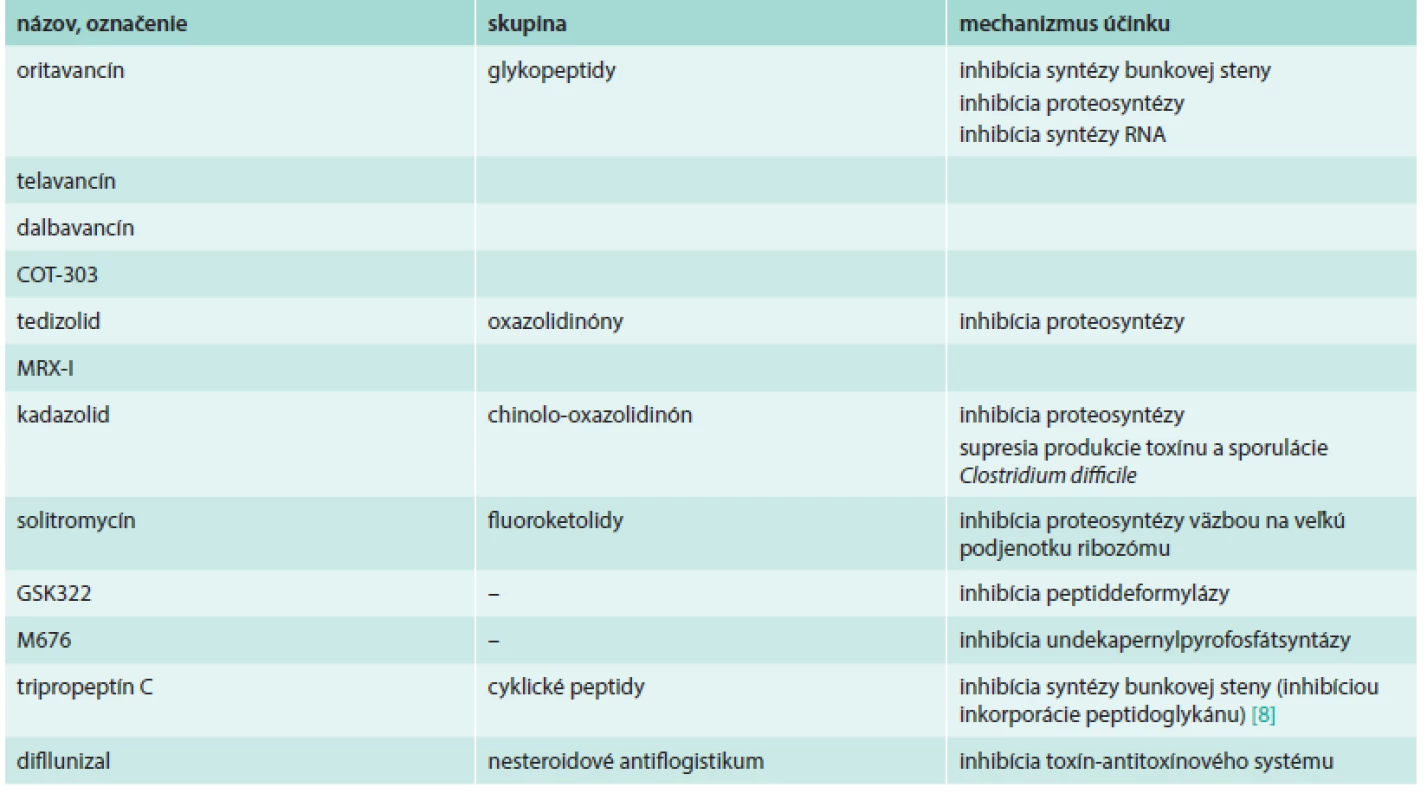
Niektoré z týchto molekúl, ako sú glykopeptidy oritavancín, telavancín a dalbavancín, ktoré sú vo vývoji už dlhší čas, sú v súčasnosti v III. fáze klinického skúšania. Tieto antibiotiká sú aktívne proti MRSA a VRSA rovnako ako aj proti iným MDR grampozitívom. Mechanizmus účinku týchto látok spočíva v inhibícii syntézy bunkovej steny (všetky tri), ale aj narúšaní integrity bunkových membrán (len telavancín a oritavancín) a v inhibícii syntézy RNA (len oritavancín). Enterokoky rezistentné na vankomycín s fenotypom VanA sú však voči dalbavancínu a telavancínu rezistentné. Vzhľadom na biologické polčasy týchto molekúl je možné ich podanie 1-krát počas liečby (oritavancin) alebo 1-krát týždenne (dalbavancín), avšak telavancín je potrebné podávať 1-krát denne. Všetky 3 látky sú vhodnou alternatívou pre liečbu komplikovaných infekcií kože a mäkkých tkanív (cSSTI), predovšetkým v tých prípadoch, kde liečba vakomycínom bola neefektívna alebo ekonomicky nevýhodná, napr. následkom zníženej citlivosti etiologického agens na vankomycín alebo pri výskyte nežiaducich účinkov [28,34].
Tedizolid fosfát (TR-701) je nové oxazolidinónové antibiotikum, fungujúce ako prekurzor (prodrug) s aktivitou proti Staphylococcus aureus. Nedávno boli uverejnené výsledky randomizovaného, dvojito zaslepeného trialu fázy II klinického skúšania, ktorý sledoval účinnosť rôznych dávok (200–400 mg) podávaných orálne raz denne počas 5–7 dní u pacientov s cSSTI. Štúdia preukázala výbornú potenciálnu in vitro aktivitu tedizolidu proti grampozitívnym kokom, vrátane MRSA, ako aj jeho 4-násobne vyššiu účinnosť v porovnaní s linezolidom. Všetky dávkovania preukázali výbornú mikrobiologickú a klinickú efektivitu proti MRSA ako aj MSSA [13,24].
Solitromycín (SOL, CEM-101) je nový fluoroketolid s upravenou antimikróbnou aktivitou. Táto látka sa viaže na veľkú podjednotku bakteriálneho ribozómu, a inhibuje tak proteosyntézu. Tak ako iné ketolidy zabraňuje tvorbe kompletného ribozómu inhibíciou spájania malej a veľkej podjednotky. Solitromycín sa ukázal byť vysoko aktívny, pričom jeho inhibičné koncentrácie (IC50) sú porovnateľné s telitromycínom a sú signifikantne nižšie než IC50 azitromycínu a klaritromycínu [27]. Pereira et al predstavili aj nový spôsob syntézy solitromycínu z molekuly pikromycínu (pikro-CEM-101), prirodzene sa vyskytujúceho ketolidu. Hlavným rozdielom medzi týmito molekulami je absencia 6-OMe a C-10 metylových skupín, ktoré sa nachádzajú aj u klaritromycínu a iných makrolidov. Molekulárne experimenty preukázali, že takáto štruktúra molekuly sa viaže na ribozóm preferenčne. Pri mikrobiologických testoch sa však preukázalo, že pikro-CEM-101 je menej aktívny v inhibícii mikrobiálneho rastu [23].
GSK322 je antibakteriálna látka s úplne novým mechanizmom účinku, ktorá sa v súčasnosti nachádza vo fáze I klinického skúšania. GSK322 inhibuje peptid deformylázu, z hľadiska vývoja antibakteriálnych látok zatiaľ nepreskúmaný cieľ. GSK322 vykazuje in vitro aktivitu proti MDR patogénom spôsobujúcim respiračné infekcie a infekcie kože, vrátane infekcií spôsobených MRSA [20].
Kadazolid (cadazolid) je nové antibiotikum vo vývoji pre liečbu infekcií spôsobených Clostridium difficile. V klinickej štúdii sa ukázal ako dobre tolerovaný u dospelých mužov užívajúcich dávku do 3 000 mg 2-krát denne počas 10 dní. Systémová expozícia bola malá, väčšina účinnej látky prestupuje črevom a nachádza sa v nezmenenej podobe v stolici. Dosahované boli dostatočne vysoké koncentrácie v hrubom čreve [4].
Miesel et al testovali novú látku M676 – inhibítor undekaprenyl pyrofosfát syntázy (UPPS), aby stanovili možné terapeutické kombinácie. Zistili, že M676, okrem toho, že samotný inhibuje rast MRSA izolátov, aj scitlivuje tieto bunky voči imipenému. Bola preukázaná in vitro synergia M676 s karbapenémami, penicilínmi a cefalosporínmi. Model stafylokokovej infekcie myší taktiež preukázal výraznú redukciu počtu CFU (kolónie tvoriace bunky – colony forming units) a to až 4-násobnú pri použití s imipenémom. Pri experimentoch boli objavené aj mutanty so zníženou citlivosťou, u ktorých bola zistená mutácie v géne uppS [16].
MRX-I je nové antibiotikum zo skupiny oxazolidinónov s vylepšeným bezpečnostným profilom a vykazuje potenciálnu aktivitu voči viacerým MDR grampozitívnym species. Zhu et al preukázali, že MRX-I je účinný nielen proti MRSA, ale aj proti klinickým izolátom meticilín-rezistentných Staphylococcus epidermidis (MRSE), VRE a PRSP [38].
COT-303 je nový glykozylovaný glykopeptid s aktivitou proti grampozitívnym species s rôznymi rezistotypmi. V testoch efektivity sa preukázala unikátna baktericídna aktivita COT-303. Okrem toho má COT-303 aj zaujímavý dlhotrvajúci postantibiotický efekt a menej častú selekciu rezistencie u izolátov MRSA. Preto sa môže stať zaujímavým kandidátom pre liečbu grampozitívnych infekcií [15].
Tripropeptín C (TPPC) je cyklický lipodepsipeptid produkovaný Lysobacter sp., ktorý má potenciálnu antibakteriálnu aktivitu proti MRSA a VRE. U TPPC bola preukázaná in vivo vynikajúca terapeutická efektivita na modeli myšej septikémie po intravenóznom podaní. Rozpustnosť tejto látky vo vode je veľmi zlá (500 µg/ml), avšak Hirosawa et al úspešne uskutočnili viaceré modifikácie tak, aby túto prekážku prekonali, a tak získali vo vode rozpustný TPPC s vynikajúcou in vitro aj in vivo antibakteriálnou účinnosťou [10].
Zaujímavý prístup bol prezentovaný Shohamom et al, ktorí sa zamerali na syntézu inhibítorov toxín-antitoxínového systému. Operón stafylokokového doplnkového génového regulátora agr zabezpečuje kontrolu expresie faktorov virulencie pomocou dvojkomponentového systému pozostávajúceho z AgrC histidínkinázy a samotného regulátora AgrA. Fosforylácia AgrA spúšťa expresiu napr. α-toxínu, ako aj iných faktorov virulencie. Blokádou miesta fosforylácie sa zabráni tvorbe toxínu. Vyššie spomínaným tímom bolo vyvinutých viacero molekúl s takouto aktivitou, pričom najúčinnejšia z nich inhibovala hemolýzu o viac než 95 % pri koncentrácii 1 mg/ml, a to bez ovplyvnenia bakteriálneho rastu. Tieto látky, vzhľadom na homológie agr systémov u grampozitívnych baktérií, inhibovali hemolýzu aj u Streptococcus pyogenes. Jedna z aktívnych látok z tejto skupiny je diflunizal (DIF), čo je dlho známa látka, nesteroidové antiflogistikum, ktoré tak predstavuje typický príklad nového použitia pre staré liečivo. Inhibítory bakteriálnych toxínov by mohli mať profylaktické použitie, príp. v antibiotickej terapii ako adjuvans pri ochoreniach spôsobených toxínmi grampozitívnych species [31].
Prehľad uvedených látok uvádza tab. 1.
Anti-gramnegatívne látky
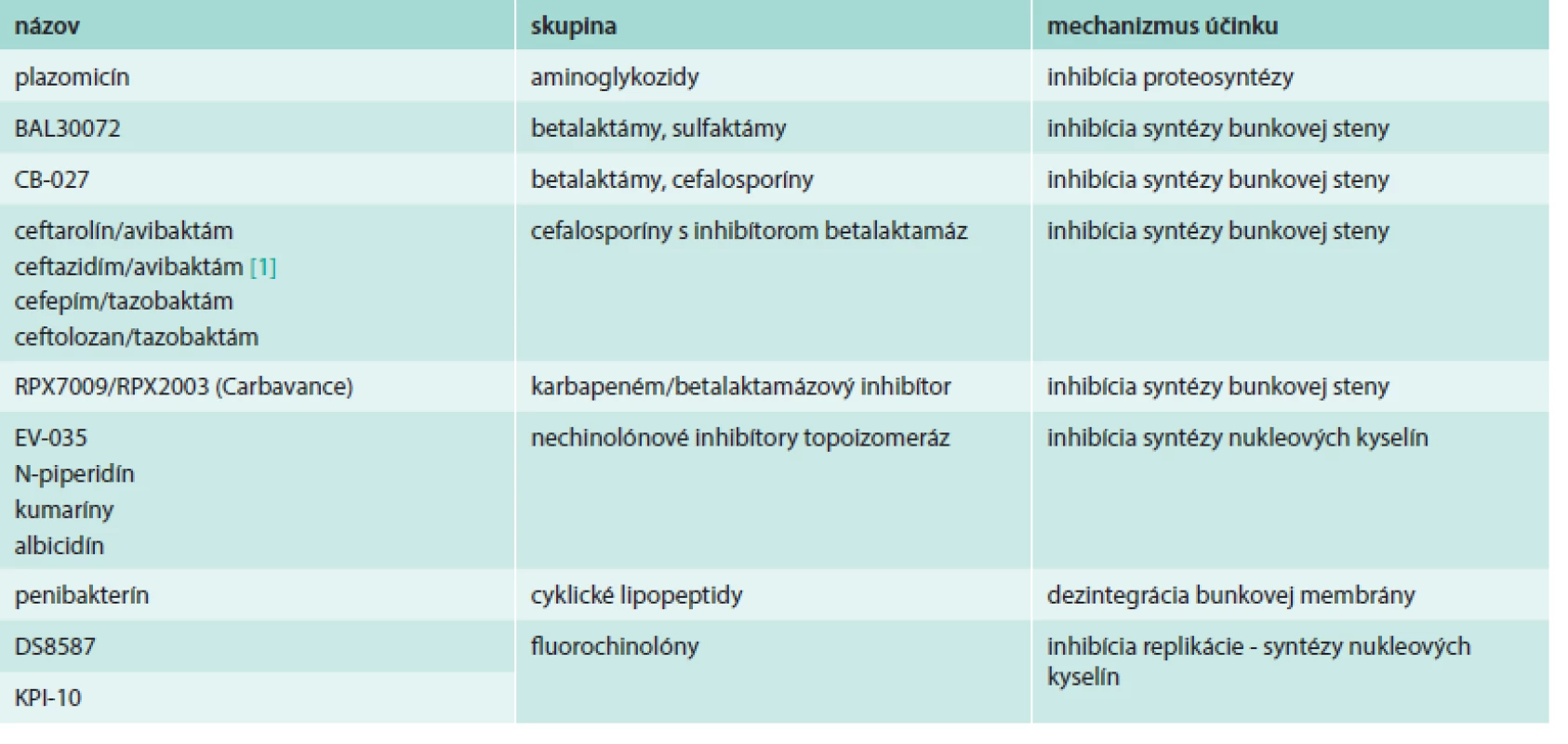
Plazomicín (predtým ACHN-490) je aminoglykozid budúcej generácie, syntetizovaný zo sisomicínu. Plazomicín inhibuje bakteriálnu proteosyntézu a táto inhibícia je závislá od dávky. Je účinný okrem gramnegatívov aj proti grampozitívnym patogénom, a to aj takým, ktoré produkujú aminoglykozidy modifikujúce enzýmy. Bohužiaľ, tak ako aj iné staršie aminoglykozidy na parenterálne podanie, plazomicín je deaktivovaný metyltransferázami u producentských rezistentných kmeňov. V in vitro testoch bola preukázaná jeho synergistická aktivita proti MRSA, hVISA, VRSA, aj Pseudomonas aeruginosa, v kombináciách s cefepímom, doripenémom, imipenémom a piperacilínom-tazobaktámom [35].
BAL30072 je nové betalaktámové antibiotkum, konkrétne zo skupiny sulfaktámov. Je účinné proti klinicky významným gramnegatívnym patogénom s betalaktámovou rezistenciou. U BAL30072 bola preukázaná aktivita proti multirezistentným Pseudomonas aeruginosa a Acinetobacter sp., a to aj takým, ktoré produkovali karbapenemázy [21].
CB-027 je širokospektrálne cefalosporínové antibiotikum, s aktivitou voči grampozitívnym i gramnegatívnym species, vrátane MRSA a Pseudomonas aeruginosa. Zhang et al zhodnotili in vivo efektivitu CB-027 na modeli myšej septikémie, infekcie pľúc a stehna spôsobených MRSA, ceftazidím-rezistentnými Pseudomonas aeruginosa a Klebsiela pneumoniae. Preukázali, že voči týmto patogénom je uvedená molekula vysoko účinná [36].
RPX7009 (v kombinácii s RPX2003; komerčne Carbavance) je betalaktamázový inhibítor, obsahujúci bór, ktorý inaktivuje aj serínové karbapenemázy. Vyvíjaný je spolu s karbapenémom RPX2003. V testoch bola preukázaná aktivita oboch látok voči patogénom z Enterobacteriaceae, a to aj producentom serínových karbapenemáz, napr. KPC [14].
EV-035 patrí do novej skupiny antibiotík fungujúcich ako inhibítory bakteriálnej topoizomerázy s iným mechanizmom účinku ako chinolóny, a teda pokrýva aj patogény s rezistenciou voči chinolónom resp. fluorochinolónom. Bola preukázaná jeho aktivita proti chinolón-rezistentným species Staphylococcus, Enterococcus, Pseudomonas a Burkholderia. Táto skupina topoizo-merázových inhibítorov práve vstupuje do predklinického skúšania, ako antibiotiká na orálne podanie [9].
Okrem EV-035 boli uvedené aj ďalšie skupiny látok, ktoré fungujú ako inhibítory topoizomeráz, a to sú N-piperidín [25], kumaríny (tiazolidinóny), simocyklinón [22] a albicidín [33].
Penibakterín je novoobjavené lipopeptidové antibiotikum produkované Paenibacillus sp. Molekula pozostáva z cyklicky usporiadaného peptidu zloženého z 13 aminokyselín spojeného s acylovým reťazcom v polohe C15. Štúdia Huanga et al ukázala potenciálnu aktivitu penibaktrínu proti gramnegatívnym, ale aj grampozitívnym druhom vrátane Escherichia coli O157:H7, Salmonella typhimurium, Listeria monocytogenes a MRSA [11].
DS8587 je fluorochinolón s účinkom voči grampozitívnym i gramnegatívnym patogénom, predovšetkým stafylokokom, streptokokom, enterokokom, Escherichia coli, Acinetobacter baumanii a anaeróbom, ale aj neobvyklým species. Vďaka svojim vlastnostiam sa môže stať fluorochinolónom novej generácie, vhodným pre liečbu nemocničných i komunitných infekcií [37].
KPI-10 je taktiež nový fluorochinolón vyvíjaný pre liečbu komplikovaných závažných infekcií spôsobených gramnegatívnymi i grampozitívnymi species. In vitro bola preukázaná účinnosť voči MDR patogénom, a to aj takým, ktoré sú momentálne voči fluorochinolónom rezistentné. Stanovenia MIC90 preukázali, že ide o najúčinnejší fluorochinolón proti enterickým Escherichia coli a Klebsiela pneumoniae, ako aj proti celej skupine Enterobacteriaceae a bola aj účinnejší ako iné fluorochinolóny proti Acinetobacter baumanii [5].
Predstavená bola aj celá séria kombinácií cefalosporínov s inhibítormi betalaktamáz s aktivitou proti gramnegatívnym patogénom, a to ceftarolín/avibaktám (NXL 104) [26], ceftazidím/avibaktám [1], cefepím/tazobaktám [29], ceftolozan/tazobaktám [17], ktoré všetky preukázali výbornú aktivitu voči betalaktamázy produkujúcim gramnegatívom, vrátane Acinetobacter sp., Pseudomonas aeruginosa, ESBL-producentom, NDM-1 producentom a OXA-48 producentom.
Prehľad látok s účinnosťou proti gramnegatívnym patogénom uvádza tab. 2.
Antituberkulotiká
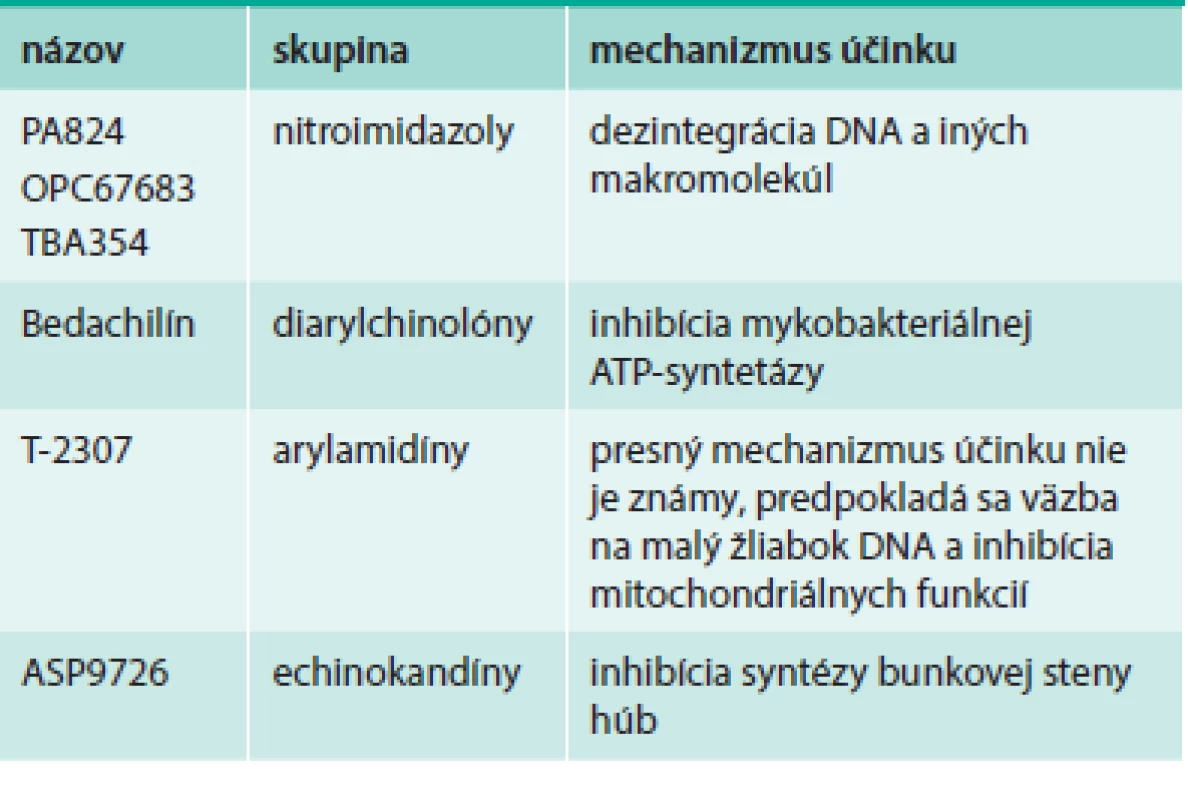
Nitroimidazoly sú nová skupina antituberkulotík, ktoré sú vhodné na liečbu citlivých i rezistentných kmeňov Mycobacterium tuberculosis. U PA824 bola preukázaná výborná účinnosť v kombinovanej terapii s moxifloxacínom a pyrazinamidom proti citlivej aj MDR tuberkulóze [6]. Prvé 2 látky zo skupiny, PA-824 a OPC67683 (nitroimidazoly 1. generácie), sa už nachádzajú dlhšie v klinickom skúšaní, zároveň sú vo vývine novšie molekuly s upravenými vlastnosťami. TBA354 (2. generácia) je účinnejší voči Mycobacterium tuberculosis in vitro, ako aj na modeli tuberkulózy myší. Účinnosť je zachovaná aj pri monoterapii, ako aj pri kombinovanej terapii s moxifloxacínom a pyrazinamidom. V predklinickom skúšaní má TBA354 dobrý farmakokinetický profil, po orálnom podaní sú dosahované požadované koncentrácie. Na základe toho sa predpokladá podanie 1-krát denne v nízkych dávkach [32].
Bedachilín (BED, predtým TMC207; komerčne Sirturo) bola po dlhom čase prvá látka s antimykobakteriálnym účinkom. Patrí do skupiny diarylchinolónov – inhibítorov mykobakteriálnej ATP-syntetázy, ide teda o úplne nový mechanizmus účinku antituberkulotík. Klinické skúšania preukázali, že ide o bezpečný liek pre liečbu MDR a XDR tuberkulózy [3]. Po absolvovaní klinického skúšania bol v roku 2012 prihlásený na registráciu v USA a v Európe a bol v novembri roku 2012 odporúčaný na zrýchlený FDA registračný proces. Dňa 2. januára 2013 bol FDA schválený na liečbu multirezistetnej tuberkulózy, predávaný bude spoločnosťou Janssen pod názvom Sirturo a dostupný bude na trhu pravdepodobne od druhého kvartálu. Ide o prvé nové schválené antituberkulotikum od roku 1998 (rifapentín). Podobne ako iné antituberkulotiká, musí byť podávaný v kombinácii s cieľom prevencie selekcie rezistentných kmeňov. Liečebný cyklus trvá 24 týždňov, počas prvých 2 týždňov sa podáva v dávke 400 mg/deň a potom 200 mg 3-krát týždenne s minimálne 48-hodinovým rozstupom [12]. Dáta o použití u pacientov s koinfekciou HIV zatiaľ nie sú známe, uskutočnená bola len štúdia o interakcii s efavirenzom, ktorá neukázala žiadne významné interakcie [7].
Antifungálne látky
V klinickom skúšaní sa nachádza nová antifungálna látka T-2307 patriaca do skupiny arylamidínov. Má široké spektrum účinku proti rezistentným hubám vrátane Candida sp., Cryptococcus neoformans a Aspergillus sp. T-2307 je významne in vitro i in vivo účinnejší ako mikafungín a amfotericín B proti kandidózam a amfotericín proti kryptokokóze, a porovnateľne účinný ako mikafungín a amfotericín proti aspergilóze. Predklinické skúšanie ukázalo, že bude zrejme vhodný na injekčné podanie [18,30].
Nové echinokandíny sú vyvíjané hlavne pre liečbu infekcií, echinokandíny prvej generácie nie sú postačujúce – infekcie spôsobené Candida parapsilosis, inými rezistentnými Candida sp. a Aspergillus sp. Morikawa et al prezentovali nové antimykotikum – druhogeneračný echinokandín ASP9726. Ide o chemickú modifikáciu prirodzeného produktu a táto látka bola objavená novým skríningovým postupom – sledovaním maximálneho inhibičného efektu na hýfy Aspergillus fumigatus (Emax) [19].
Prehľad antituberkulotík a antifungálnych látok uvádza tab. 3.
prof. MUDr. Vladimír Krčméry, Dr.Sc., FRSP, FACP
igor.kmit@szu.sk, tropicteam@gmail.com
Slovenský tropický inštitút VŠ zdravotníctva a sociálnej práce Sv. Alžbety, BratislavaMikrobiologický ústav LF UK a UN Bratislava Slovenská republika
www.szu.sk
Doručeno do redakce 17. 10. 2014
Přijato po recenzi 2. 10. 2014
Sources
1. Aktaş Z, Kayacan C, Oncul O. In vitro activity of avibactam (NXL104) in combination with β-lactams against Gram-negative bacteria, including OXA-48 β-lactamase-producing Klebsiella pneumoniae. Int J Antimicrob Agents 2012; 39(1): 86–89.
2. Andries K. Bedaquiline (TMC207), a first-in-class drug candidate for MDR TB. In Abstracts of the 22nd European Congress of Clinical Microbiology and Infectious Diseases. London, United Kingdom. March 31-April 3, 2012. Clin Microbiol Infect 2012; 18(Suppl 3): 1–902.
3. Andries K, Verhasselt P, Guillemont J et al. A diarylquinoline drug active on the ATP synthase of Mycobacterium tuberculosis. Science 2005; 307(5707): 223–227.
4. Baldoni D, Gutierrez M, Dingemanse J et al. Cadazolid, a Novel Antibiotic with Potent Activity against Clostridium difficile: Safety, Tolerability, and Pharmacokinetics in Healthy Subjects following Single and Multiple Oral Doses. In American Society of Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
5. Deane J, Simenauer A, Ge Y et al. In Vitro Activity of KPI-10 Against Clinically Important Gram - Negative Bacteria. In A. S. for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
6. Diacon AH, Dawson R, von Groote-Bidlingmaier F et al. 14-day bactericidal activity of PA-824, bedaquiline, pyrazinamide, and moxifloxacin combinations: a randomised trial. Lancet 2012; 380(9846): 986–993.
7. Dooley K, Park J Jr, Swindells S et al. A Phase I, Safety, Tolerability, and Pharmacokinetic Interaction of Single-Dose TMC207 and Efavirenz in Healthy Volunteers. 4th International Workshop on Clinical Parmacology of TB Drugs. Chicago: AIDS Clinical Trials Group 2011.
8. Hashizume H, Sawa R, Harada S et al. Tripropeptin C blocks the lipid cycle of cell wall biosynthesis by complex formation with undecaprenyl pyrophosphate. Antimicrob Agents Chemother 2011; 55(8): 3821–3828.
9. Heim J, Roussel P, Milligan D et al. Ev-035 : Novel 2-pyridone Based Topoisomerase Inhibitors with Broad-spectrum Activity Against MDR Pathogens Including Quinolone Resistance. In American Society for Microbiology (Ed), 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
10. Hirosawa S, Hashizume H, Kobayashi Y et al. In Vitro Antimicrobial Activity and in vivo Efficacy in a Mouse Staphylococcal-Septicemia Model of Water-soluble Tripropeptin C Analogs. In A. S. for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
11. Huang E, Guo Y, Yousef A Antimicrobial Spectrum and Biosynthesis of the New Lipopeptide Antibiotic, Paenibacterin. In A. S. for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
12. Janssen Therapeutics Sirturo: Prescribing information. Janssen Therapeutics, Division of Janssen Products, LP Titusville, NJ 08560, Janssen Products, LP 2012.
13. Lepak AJ, Marchillo K, Pichereau S et al. Comparative pharmacodynamics of the new oxazolidinone tedizolid phosphate and linezolid in a neutropenic murine Staphylococcus aureus pneumonia model. Antimicrob Agents Chemother 2012; 56(11): 5916–5922.
14. Lomovskaya O, King P, Sun D et al. Microbiological Characterization of Beta-Lactamase Inhibitor RPX7009. In A. S. of Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
15. Maki H, Nakai H, Hori T et al. COT-303 , A Novel Glycosylated Glycopeptide : I. In vitro Activity Against Gram-positive Bacteria. In A. S. for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
16. Miesel L, Baysarowich J, Caron A et al. M676 , a Putative Inhibitor of Undecaprenyl Pyrophosphate Synthase , Synergizes with β-lactam Antibiotics Against MRSA. In American Society for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Washington DC: Omnipress.
17. Miller B, Hershberger E, Benziger D et al. Pharmacokinetics and safety of intravenous ceftolozane-tazobactam in healthy adult subjects following single and multiple ascending doses. Antimicrob Agents Chemother2012; 56(6): 3086–3091.
18. Mitsuyama J, Nomura N, Hashimoto K et al. In vitro and in vivo antifungal activities of T-2307, a novel arylamidine. Antimicrob Agents Chemother 2008; 52(4): 1318–1324.
19. Morikawa H, Okada A, Tomishima M et al. ASP9726, A Unique 2nd Generation Echinocandin (2) – Synthesis and In Vitro Activity. In A. S. for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
20. Naderer O, Jones L, Zhu J et al. A-1276 Intravenous (IV) First Time in Human Safety and Pharmacokinetics of GSK1322322 (GSK322), a Peptide Deformylase Inhibitor Antibacterial. In American Society for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
21. Page MGP, Dantier C, Desarbre E. In vitro properties of BAL30072, a novel siderophore sulfactam with activity against multiresistant gram-negative bacilli. Antimicrob Agents Chemother 2010; 54(6): 2291–2302.
22. Patel D, Patel R, Kumari P et al. Microwave-assisted synthesis of coumarin based 1,3,5-triazinyl piperazines and piperidines and their antimicrobial activities. Acta Pol Pharm 2012; 69(5): 879–991.
23. Pereira D, Li J, Fernandes P et al. Pikromycin Derivative of Solithromycin : Discussion of Activity. In American Society for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
24. Prokocimer P, Bien P, Deanda C et al. In vitro activity and microbiological efficacy of tedizolid (TR-700) against Gram-positive clinical isolates from a phase 2 study of oral tedizolid phosphate (TR-701) in patients with complicated skin and skin structure infections. Antimicrob Agents Chemother 2012; 56(9): 4608–4613.
25. Reck F, Alm RA, Brassil P et al. Novel N-linked aminopiperidine inhibitors of bacterial topoisomerase type II with reduced pK(a): antibacterial agents with an improved safety profile. J Med Chem 2012; 55(15): 6916–6933.
26. Riccobene TA, Su SF, Rank D A single - and multiple-dose study to determine the safety, tolerability, and pharmacokinetics of ceftaroline fosamil in combination with avibactam in healthy subjects. Antimicrob Agents Chemother. 2013; 57(3): 1496–1504.
27. Rodgers W, Frazier AD, Champney WS. Solithromycin Inhibition of Protein Synthesis and Ribosome Biogenesis in Staphylococus aureus, Streptococcus pneumoniae, and Haemophilus influenzae. Antimicrob Agents Chemother 2013; 57(4):1632–1637.
28. Rubinstein E. New antibiotics 2012. Abstract & Poster Book – 3rd Southeast European Conference on Chemotherapy and Infection. In SEEC (Ed). 3rd Southeast European Conference on Chemotherapy and Infection 2012. Dubrovnik, Croatia.
29. Sharma S, Gupta A, Arora A. Cefepime Tazobactam: A new β lactam/ β lactamase inhibitor combination against ESBL producing gram negative bacill. Int J Pharm Biomed Sci 2012, 3(2), 35–38.
30. Shibata T, Takahashi T, Yamada E et al. T-2307 causes collapse of mitochondrial membrane potential in yeast. Antimicrob Agents Chemother 2012; 56(11): 5892–5897.
31. Shoham M, Yu G, Truitt B et al. Antivirulence Agents Against MRSA and Streptococcus pyogenes. In American Society for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
32. Upton AM TBA-354: A Next generatioin nitroimidazole for treatment of drug sensitive and drug resistant tuberculosis. In A. S. for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
33. Vivien E, Pitorre D, Cociancich S et al. Heterologous production of albicidin: a promising approach to overproducing and characterizing this potent inhibitor of DNA gyrase. Antimicrob Agents Chemother 2007; 51(4): 1549–1552.
34. Zhanel GG, Calic D, Schweizer F et al. New lipoglycopeptides: a comparative review of dalbavancin, oritavancin and telavancin. Drugs 2010; 70(7): 859–886.
35. Zhanel GG, Lawson CD, Zelenitsky S et al. Comparison of the next-generation aminoglycoside plazomicin to gentamicin, tobramycin and amikacin. Expert Rev Anti Infect Ther 2012; 10(4): 459–473.
36. Zhang S, Mortin L, Chuong C et al. In vivo Efficacy of CB-027 against Methicillin-Resistant Staphylococcus aureus, and Ceftazidime-Resistant Infections in Mice. In A. S. of Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
37. Zhu D, Kurosaka Y, Hoshino K DS-8587, A New Generation of Broad Spectrum Quinolone : In Vitro Antibacterial Activities Against Chinese Clinical Isolates. In A. S. for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy 2012. Omnipress: Washington DC.
38. Zhu DM, Wang W, Huang Y et al. Antibacterial spectrum of oxazolidinone MRX-I: Potent activity against multidrug-resistant Gram-positive pathogens. In American Society for Microbiology (Ed). 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC) 2012. Omnipress: Washington DC.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2014 Issue Suppl 2
-
All articles in this issue
- Testikulární zhoubné nádory – jsme snad u konce cesty?
- Dispenzarizace nemocných po léčbě karcinomu prsu, kolorekta a prostaty
- Diferenciální diagnostika eozinofilie
- Klinické hodnocení nových léčiv u vzácných diagnóz v onkologii – současná situace v Evropě a u nás
- Paliativní péče a chronické srdeční selhání
- Vývoj a současná funkčnost informační základny české onkologické péče
- O bolesti trochu jinak
- Nové antibiotiká: potrebujeme nové molekuly, alebo nové stratégie?
- Geriatrický nemocný v onkologii
- Nové náhledy na roli lidského papilomaviru v léčbě nádorů hlavy a krku
- Ph-negativní myeloproliferativní onemocnění s trombocytemií ve světle účinku léčby přípravkem Thromboreductin® v datech registru ke konci roku 2013
- Diabetes mellitus a zhoubné nádory
- Paliativní medicína a dobrá smrt
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Diferenciální diagnostika eozinofilie
- Paliativní medicína a dobrá smrt
- Dispenzarizace nemocných po léčbě karcinomu prsu, kolorekta a prostaty
- Ph-negativní myeloproliferativní onemocnění s trombocytemií ve světle účinku léčby přípravkem Thromboreductin® v datech registru ke konci roku 2013
