Role zánětu a imunity u aterosklerózy a možné způsoby jejich ovlivnění
Role of inflammation and imunity in atherosclerosis and possible ways of their control
Atherosclerosis and its clinical manifestations are characterised by ongoing arterial wall inflammation. Innate and adaptive imunity patterns are involved in all stages of atherosclerosis. Intensity of inflammation, more advanced proatherogenic imunity activity enhance development of cardiovascular (CV) disease. Efforts to control inflammation and imune proatherogenic patterns face considerable problems, but recent clinical studies offer promissing results. Statins have antiinflammatory effect, but PCSK9 monoclonal antibodies not. SGLT2 inhibitors (gliflozins) have a proven antiinflammatory effect and this might partly explain their protective CV effect. Recent clinical studies, COLCOT with colchicine and CANTOS with cinakinumab decreased inflammatory activity, CV mortality and incidence of defined CV endpoints. Other approaches to control inflammation in atherosclerosis are considered, namely blocation of proatherogenic cytokins by specific antibodies and intervention of metabolism of inflammatory cells. Vaccination against PCSK9 is being developed. Further studies may aim on active IL-1beta – IL-6 axis blocation nad on blocation of proatherogenic cytosins. Patients with signs of persistent inflammation, with specified inflammatory stage and with atherosclerotic leasion more precisely defined will be included.
Keywords:
Atherosclerosis – cardiovascular diseases – inflammation and imunity influencing – inflammation and imunity in atherosclerosis
Authors:
Jan Bruthans
Authors‘ workplace:
Centrum kardiovaskulární prevence 1. LF UK a Thomayerovy fakultní nemocnice, Praha
Published in:
Vnitř Lék 2021; 67(5): 304-308
Category:
Review Articles
Overview
Aterosklerózu a její klinické projevy charakterizuje pokračující zánět cévní stěny. Vrozené (inátní) a adaptivní imunitní mechanismy se uplatňují ve všech fázích aterosklerózy. Tíže zánětu, respektive pokročilejší proaterogenní imunitní aktivita zhoršují průběh kardiovaskulárních (KV) onemocnění. Snahy potlačit zánět a imunitní proaterogenní mechanismy se potýkají s řadou problémů, ale několik klinických studií již dosáhlo pozitivních výsledků. Podávání statinů má protizánětlivý efekt, naopak PCSK9 monoklonální protilátky protizánětlivý efekt nemají. Také SGLT2 inhibitory (glifloziny) mají prokázaný protizánětlivý účinek, což by částečně vysvětlovalo jejich protektivní KV efekt. Recentní studie COLCOT s kolchicinem a CANTOS s canakinumabem (monoklonální protilátka proti interleukinu 1beta) snížily zánětlivou aktivitu a KV mortalitu i incidenci jednotlivých KV endpointů. Jsou zvažovány i další cesty ovlivnění zánětu u aterosklerózy, např. blokace proaterogenních chemokinů specifickými protilátkami nebo intervence metabolismu zánětlivých buněk. Je vyvíjena vakcína proti PCSK9. Další studie se zřejmě zaměří na blokaci osy aktivní IL-1beta – IL-6, blokaci proaterogenních cytokinů a bude preferováno zařazení pacientů se známkami perzistujícího zánětu, s určením zánětlivé fáze a s přesným popisem aterosklerotické léze.
Klíčová slova:
ateroskleróza – kardiovaskulární onemocnění – ovlivnění zánětu a imunity – zánět a imunita u aterosklerózy
Úvod
Ateroskleróza a její klinické projevy, původně považované za projev a následky téměř výlučné poruchy metabolismu a ukládání lipidů v cévní stěně velkých a středních tepen (N. N. Aničkov), jsou provázeny a charakterizovány i pokračujícím zánětem cévní stěny (R. Virchow, R. Ross). Genomové studie, in vivo zobrazovací metody, transgenetické studie na myších, ale i observační populační a klinické intervenční studie prokázaly fundamentální roli zánětu, resp. vrozených (innate) a adaptivních imunitních mechanismů ve všech fázích aterosklerózy – od jejího vzniku, v její progresi a finálně při jejích trombotických komplikacích (1–4).
Elevace zánětlivých markerů predikuje horší průběh akutního koronárního syndromu nezávisle na míře ischemického poškození myokardu. Chronický zánět i mírného stupně (např. dle elevace hladin C reaktivního proteinu měřeného vysoce senzitivní metodou (dále hs-CRP) prospektivně zvyšuje riziko aterosklerotických komplikací a doplňuje prognostickou informaci tradičních rizikových faktorů. Zánět a elevace zánětlivých markerů doprovází také srdeční selhání a jejich zvýšení je spojeno s horší prognózou (5–7). Některé léčebné postupy redukující zánět prokazatelně v recentních studiích kardiovaskulární riziko snižují, jejich popis a hodnocení je hlavním předmětem tohoto sdělení. Popis zánětlivých a imunitních patofyziologických procesů je pouze ilustrativní a vzhledem ke složitosti problematiky a často i rozpornosti a neurčitosti dosavadních poznatků nutně fragmentární. Mnoho imunologických studií, vycházejících často ze studií na pokusných zvířatech, ve snaze zdůraznit význam zjištěných nálezů, dochází k pleiotropii výkladu a klinicky nejednoznačným závěrům. Pro klinika jsou pak základním vodítkem výsledky klinických studií, ty se však dosud zásadněji nepromítly do klinických doporučení.
Zánět a imunitní procesy, jejich markery, vztah k metabolismu lipidů
Zánětlivé procesy a imunitní odpověď organismu představují nesmírně složitý, mnohotvárný a dynamický systém. Do jisté míry lze odlišit primární (adaptivní imunitní) odpověď, kterou organismus odpovídá na setkání s novou noxou (příkladem může být vakcinace) a rozvinutou vrozenou (inátní) autoimunní odpověď, která je v procesu aterogeneze zásadní. Vedle akcelerace aterogeneze mohou některé adaptivní a inátní imunitní mechanismy, respektive jejich fáze, aterogenezi naopak brzdit. Vývoj od adaptivní imunitní reakce k proaterogenním autoimunitním procesům probíhá cestou tvorby specifických protilátek proti antigenům a cestou diferenciace původně ateroprotektivních T regulativních buněk, které dále aktivují B buňky (posun od B1 k B2) nebo se transformují v efektorové T buňky s posunem k tvorbě prozánětlivých cytokinů (2).
Cytokiny jsou menší signální proteiny, účastnící se imunitní odpovědi. Jsou produkovány buňkami imunitního systému (makrofágy, T lymfocyty atp.), navozují např. rychlé dělení a diferenciaci určitých typů buněk, které se účastní boje proti patogenům, případně další rysy imunitní obrany. Existují i membránové formy některých cytokinů. Ty jsou zakotveny v cytoplazmatické membráně. Za membránové cytokiny můžeme považovat i některé signalizační povrchové proteiny. Membránové cytokiny působí na rozdíl od ostatních výrazně lokálně. Specifické cytokiny mohou být ateroprotektivní (IL 4, IL10) nebo proaterogenní (IL1, IL2, IL6, IL 18, TNF). Aterogenní pláty, makrofágy, tuková tkáň, ischemické poškození myokardu a další výrazně potencují tvorbu proaterogenních cytokinů.
Míru a průběh zánětu posuzujeme podle hodnot zánětlivých markerů. Nejčastěji používaným je zřejmě hs-CRP, reaktant akutní fáze a nespecifický marker zánětu. Jeho vzestup signalizuje progresi zánětu, pokles regresi, jeho přímé ovlivnění ale průběh zánětu nemění. Zvýšené hodnoty hs-CRP korelují s přítomností metabolického syndromu, inzulinové rezistence, endoteliální dysfunkce a zhoršenou fibrinolýzou (8, 9). Myeloperoxidáza je markerem zánětu a oxidativních procesů, které mohou vést k nestabilitě aterosklerotického plátu a provázejí remodelaci levé komory srdeční. Lp-LPA2 je enzym produkovaný zánětlivými buňkami (makrofágy), pomáhá hydrolyzovat oxidované fosfolipidy v LDL částicích a je specifickým markerem cévního zánětu. Koreluje se zvýšeným rizikem ICHS a CMP. Pozornost se v poslední době soustředí i na další skupinu zánětlivých markerů – na proinflamační cytokiny jako IL-1, IL-6, IL 17 A, tumor necrosis faktor alfa. Jejich zvýšené hodnoty jsou spojeny s vyšší prevalencí a horším průběhem aterosklerotických kardiovaskulárních onemocnění. Starší markery zánětu, jako např. sedimentace erytrocytů (FW) či leukocytóza/zvýšení počtu neutrofilů nejsou v souvislosti s chronickým cévním zánětem používány.
Akumulace a oxidativní modifikace LDL částic v intimě cévní stěny iniciuje řadu zánětlivých procesů (Obr. 1) s další imunitní reakcí. Oxidované LDL částice jsou pohlcován makrofágy, které se mění v pěnové buňky, oxidované fosfolipidy indukují zánět arteriální stěny vazbou na TLRs (toll like receptors, ze skupiny pattern recognition receptors) a spouštějí imunitní proinflamační signalizaci. Dochází k aktivaci myeloidních buněk, proliferaci makrofágů, infiltraci B a T buněk (nositelů prozánětlivých cytokinů atd). Intracelulární krystaly cholesterolu dále aktivují imunitní reakce: subset inflammasome NLRP3, exprimují se proinflamatorní cytokiny, pro-IL (interleukin)-1beta a pro-IL-18 se štěpí do aktivní formy. Postupně vzniká populace nestabilních aterosklerotických plátů, nejen jako důsledek akumulace a transformace lipidů, ale i uvedených zánětlivých a imunitních dějů (10).
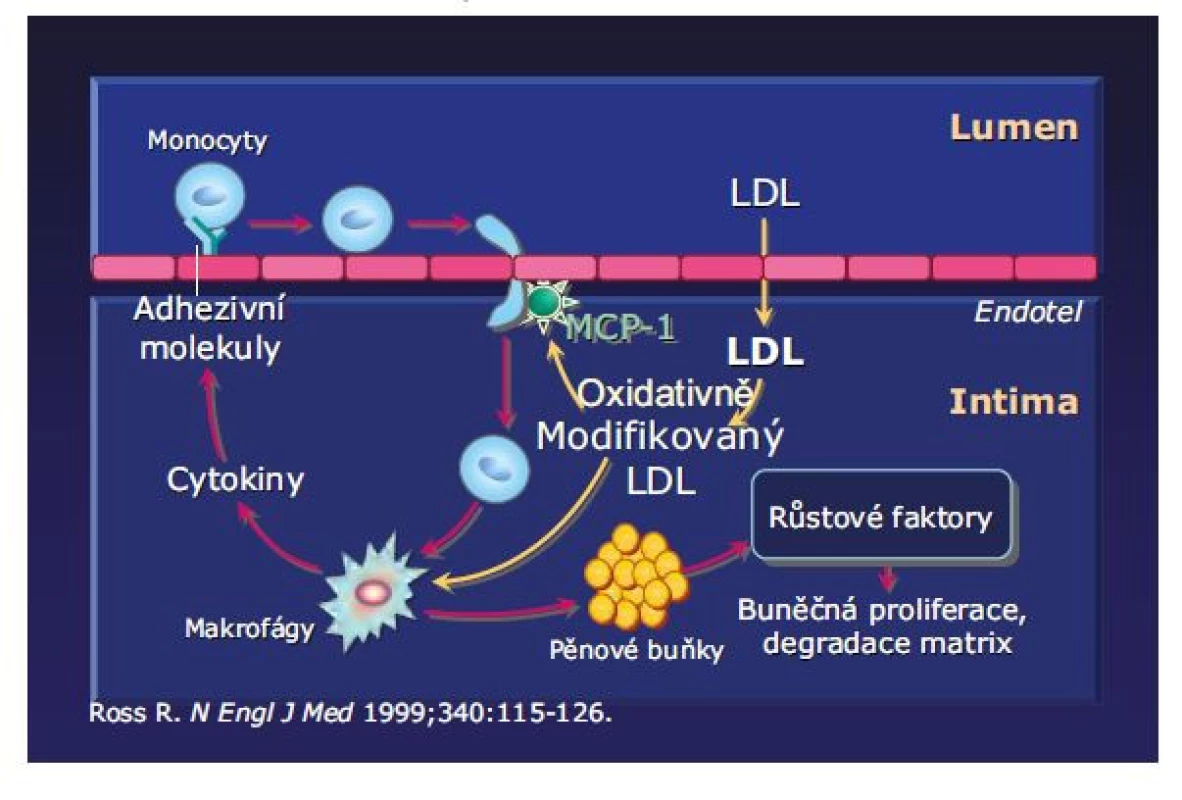
Existují ale i mechanismy, kterými zánět potencuje dyslipidemii (Obr. 2). Zánět prostřednictvím cytokinů (vrozená, inátní imunita) zvyšuje sterol regulatory element-binding proteiny (SREBPs), což jsou transkripční faktory kontrolující expresi více než 30 genů regulujících biosyntézu cholesterolu, mastných kyselin, triacylglycerolů a fosfolipidů a tvorbu VLDL v hepatocytech. V játrech SREBPs regulují produkci lipidů, které jsou exportovány do plazmy jako lipoproteiny a do žluči jako micely (11). Obdobně lymfotoxiny TNFSF14 (LIGHT), řazené mezi tumor nekrotizující cytokiny a vázané na lymfocyty, jsou enzymy regulující lipidový metabolismus. Zánětem vyvolaná dysregulace LIGHT na T buňkách vede ke snížení exprese jaterní lipázy, hypertriglyceridemii a hypercholesterolemii. Aktivace toll-like receptorů (TLR) – skupiny bílkovinných receptorů na povrchu cytoplazmatických membrán schopných rozeznávat cizí struktury, jež jsou součástí inátní imunitní odpovědi, snižuje reverzní transport cholesterolu. Zánětlivá dysregulace střevního mikrobiomu zvyšuje hladinu lipidů zvýšením permeability střevní bariéry a následnou aktivací biosyntézy lipidů (12).

Ovlivnění zánětu a imunitních procesů, výsledky lékových studií
Snahy pozitivně ovlivnit zánět a imunitní proaterogenní mechanismy a aplikovat je v klinické praxi jsou konfrontovány s řadou problémů. Značná část našich znalostí o dynamice imunitních procesů je odvozena ze studií na laboratorních zvířatech, převážně myších. Translace těchto poznatků do humánní medicíny často není a nemůže být jednoznačná. Komplexnost a dynamika imunitních procesů a posun imunitních reakcí od suprese k její podpoře v průběhu rozvoje aterosklerózy dále komplikuje výklad experimentu. Role jednotlivých složek: buněčných řad, imunitních proteinů, antigenů a protilátek je dynamická a v celém kontextu dosud ne zcela známá. Zásah do imunitního systému má i svá rizika – od proinfekčního po proonkogenní efekt.
Zvolených postupů i dosažených výsledků je dnes již celá řada.
a) Statiny a další hypolipidemika
Podávání statinů má prokazatelně protizánětlivý efekt a statiny s výraznějším protizánětlivým efektem (hodnoceno např podle snížení hladiny hs-CRP, např. rosuvastatin) mají i větší léčebný efekt (13). Naopak PCSK9 monoklonální protilátky, snižující LDL extrémně účinně, protizánětlivý efekt nemají (14, 15). Paradoxně tak lze očekávat, že snížení reziduálního kardiovaskulárního rizika by mohlo být u statinů vyšší než u PCSK9 monoklonálních protilátek.

b) Protizánětlivá léčba
ba) Již dříve používané protizánětlivé léky v jiných indikacích
Acetylsalicylová kyselina (ASA) má protizánětlivý efekt zejména ve vyšších dávkách (1 g/d apod.). 75–100 mg ASA denně používaná v sekundární prevenci aterosklerotických onemocnění vychází z antiagregačního efektu, ovlivnění zánětlivého aspektu aterosklerózy v humánní medicíně v prevenci používanými dávkami ASA je dosud sporné.
Relativně recentně byly publikovány některé zásadní klinické studie. Studie COLCOT (Colchicine Cardiovascular Outcomes Trial) (16) randomizovala 4 745 pacientů, maximálně 30 dní po prodělaném akutním infarktu myokardu pro léčbu 0,5 mg kolchicinu (který má prokázaný protizánětlivý efekt užívaný v jiných indikacích) proti placebu. Pacientům byla léčba podávána v průměru 23 měsíců. Primárním kompozitním cílem bylo KV úmrtí, srdeční zástava, infarkt myokardu (IM) cévní mozková příhoda (CMP) nebo urgentní hospitalizace pro anginu pectoris (AP) s následnou koronární revaskularizací. Primární kompozitní cíl prodělalo 5,5 % pacientů na kolchicinu a 7,1 % pacientů na placebu (HR 0,77 kolchicin versus placebo). Všech jednotlivých cílů dosáhli pacienti na kolchicinu méně často než na placebu, zejména CMP a AP. Colchicin snižoval hodnoty CRP, ne však signifikantně výrazněji než placebo. Nežádoucí účinky se vyskytly podobně v obou větvích studie, jen pneumonií bylo více u kolchicinu (0,9 %) než u placeba (0,4 %). Colchicin ale nesnížil proti placebu celkovou mortalitu.
Studie LoDoCo2 (17) randomizovala 5 552 pacientů se stabilní ICHS do větve léčené kolchicinem 0,5 mg/den a do větve placebové. Medián sledování byl 29 měsíců, primární kompozitní cíl bylo KV úmrtí, IM, ischemická CMP nebo koronární revaskularizace. K primárnímu kompozitnímu cíli došlo u 6,8 % pacientů na kolchicinu a u 9,6 % pacientů na placebu (HR 0,69 kolchicin versus placebo). I v této studii dosáhli pacienti na kolchicinu všech jednotlivých cílů méně často než na placebu. U pacientů na kolchicinu byla ale vyšší frekvence nekardiálních úmrtí a chybí data o výchozích hodnotách lipidů a markerů zánětlivého stavu.
Studie CIRT (18) randomizovala 4 786 pacientů s anamnézou infarktu myokardu nebo mnohočetného koronárního postižení a zároveň s diabetes mellitus nebo metabolickým syndromem, s nezvýšenými hodnotami hs-CRP, do větve, které byl podáván methotrexát (užívaný taktéž v léčbě zánětlivých onemocnění jako revmatoidní, psoriatická nebo juvenilní idiopatická arthritis), v dávce 15 mg, po 4 měsících 20 mg/d, a větve placebové, celkem 2,3 roku. Kompozitním endpointem byl nefatální IM, nefatální CMP nebo kardiovaskulární úmrtí. Obě větve se v dosažení kompozitního endpointu nelišily, methotrexátová větev vykázala nesignifikantně vyšší celkovou a KV mortalitu. Methotrexát navíc zvyšoval hodnoty jaterních enzymů, snižoval počet leukocytů a hematokrit, vykázal vyšší frekvenci kožního karcinomu (ne bazaliomu), nesnižoval hodnoty IL-1beta, IL-6 a hsCRP.
bb) Nové protilátky proti chemokinům
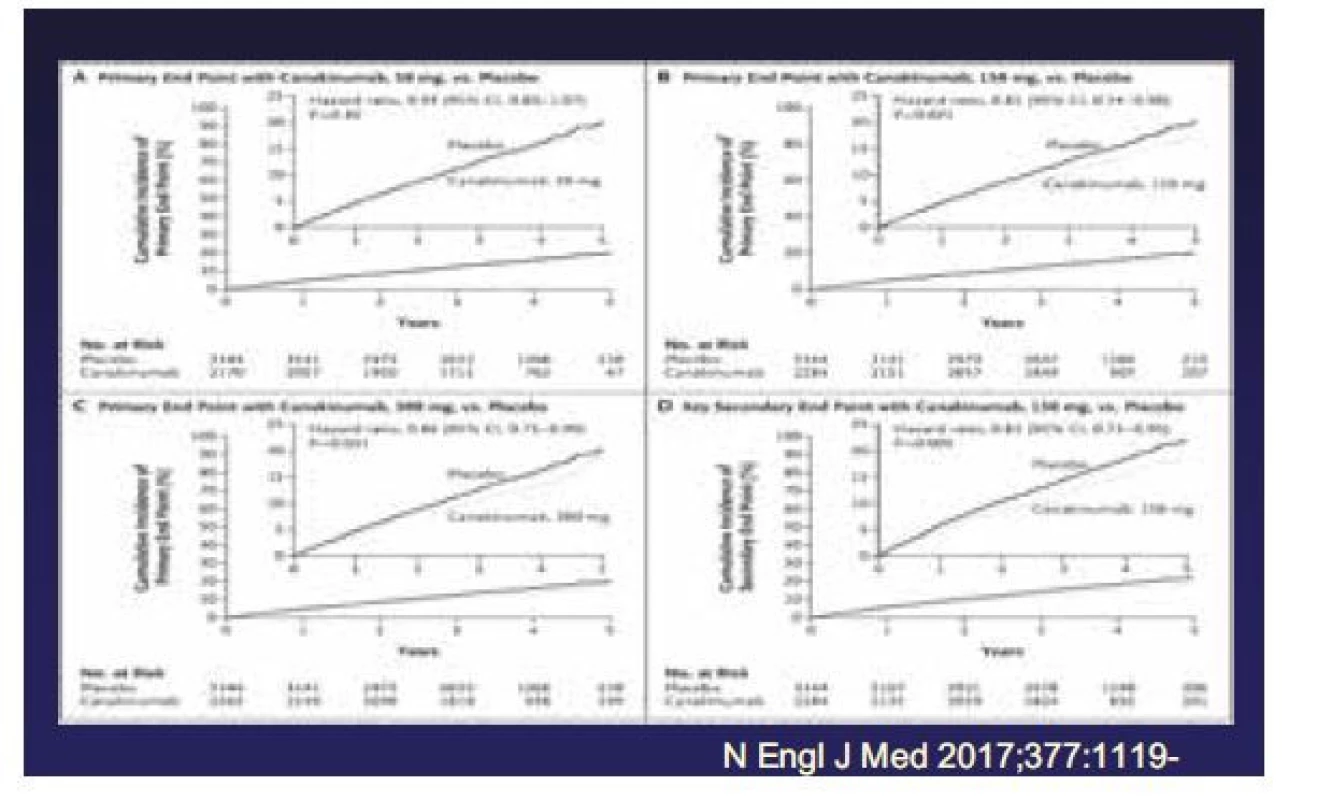
Zcela zásadní jsou výsledky studie CANTOS (19) publikované v roce 2017. Ta randomizovala 10 061 pacientů s anamnézou prodělaného infarktu myokardu a hodnotami CRP ≥ 2 mg/l a na standardní medikaci do 3 skupin pacientů, kterým byl podáván canakinumab (monoklonální protilátka proti interleukinu 1beta) v dávce 50, 150 a 300 mg subkutánně v tříměsíčních intervalech, a skupiny, které bylo injikováno placebo. Primárním složeným cílem byl nefatální IM, nefatální CMP nebo KV úmrtí. Sekundární cíl zahrnoval komponenty primárního složeného cíle a hospitalizace pro nestabilní anginu pectoris s urgentní revaskularizací. Podávání canakinumabu snížilo hodnoty CRP a interleukinu 6 v závislosti na podávané dávce, hodnoty lipidů se nezměnily. 150 a 300 mg canakinumabu snižovalo signifikantně incidenci primárního složeného cíle i sekundárního cíle, nesnížilo celkovou mortalitu, bylo spojeno s vyšší incidencí fatálních infekcí, ale se signifikantně nižší onkologickou mortalitou.
Jakkoliv není použití canakinumabu v klinické praxi předpokládáno – vzhledem k jeho vedlejším účinkům (fatální infekce), vysokým nákladům léčby a v komparaci s hypolipidemickou léčbou přeci jen menšímu efektu, výsledky studie CANTOS vedly k rozsáhlé diskuzi a úvahám o dalších cestách protizánětlivé léčby aterosklerózy. Je zdůrazňována klíčová role osy aktivní interleukin 1 beta interleukin-6, respektive aktivovaný interleukin 18 interleukin-6. Zvažován je i potenciál TNF-alfa antagonistů.
Dalším možným cílem jsou malé chemotaktické cytosiny, označované jako chemokiny, které regulují migraci a funkce mnoha imunitních buněk aktivních v progresi aterosklerózy – jejich blokace vysoce afinitními protilátkami (20) nebo disrupce jejich heterofilních interakcí (21). Buňky aktivní v adaptivní i inátní imunitě mají specifický metabolismus (glykolýza, cyklus tricarboxylové kyseliny, oxidativní fosforylace, snížená oxidace mastných kyselin a další), intervence metabolických dějů je dalším zvažovaným způsobem ovlivnění zánětlivých procesů v ateroskleróze (22).
c) Nově zaváděné léky také s protizánětlivým efektem
Recentně do léčby nejen diabetiků, ale i kardiaků zavedené SGLT2 inhibitory (glifloziny) mají také protizánětlivý účinek – blokují např. IL 1 beta sekreci cytokinu a protizánětlivé působení by se mohlo podílet na jejich protektivním kardiovaskulárním efektu. Doporučuje se jejich podávání zejména u pacientů se srdečním selháním (23).
d) Vakcinace
Snahy o vývoj vakcíny proti LDL cholesterolu jsou dlouhodobé, úporné a sofistikované. V posledních letech je to zejména vývoj vakcíny proti PCSK9 jako možný alternativní postup k podávání monoklonálních protilátek proti PCSK9 (24). V klinické praxi zatím vakcinace používána není.
Budoucí klinické studie se zřejmě zaměří na blokaci osy aktivní interleukin 1 beta – interleukin-6, respektive aktivovaný interleukin 18 – interleukin-6, blokaci vybraných proaterogenních cytokinů. Studie budou preferovat zařazení pacientů se známkami perzistujícího zánětu (nejčastěji užívaným markerem bude zřejmě hs-CRP), popřípadě s určením zánětlivé fáze (adaptivní či přesněji definované inátní imunity) a budou se snažit o přesný popis intervenované aterosklerotické léze (např. optická koherentní tomografie k posouzení vulnerabilního plátu). Komplikovanost imunitního systému si pravděpodobně vyžádá různé imunomodulační terapie, které ovlivní začátek a/nebo progresi aterosklerotického procesu, až po rupturu aterosklerotického plátu.
Závěr
Doporučení KV prevence zvýšené markery zánětu do kalkulací odhadovaného KV rizika (SCORE a další) nezařazují. Přínos zvýšených hodnot hs-CRP a dalších zánětlivých markerů k odhadu celkového KV rizika (přidány k tradičním rizikovým faktorům) považují za relativně nízký a nepovažují je za důvod k reklasifikaci míry rizika. Přetrvává názor, že jde o ukazatele nespecifické, málo přesné a terapeuticky obtížně ovlivnitelné (25, 26). Také terapeutická doporučení (AIM, srdeční selhání a další) přiznávají některým zánětlivým markerům (hs-CRP, fibrinogen) sice určitou prognostickou cenu, ale jejich rutinní prognostické použití nedoporučují. V příslušných doporučeních dosud není protizánětlivá léčba do preventivních a léčebných postupů u kardiovaskulárních onemocnění zařazena. Lze však očekávat, že s dalším pokrokem klinických studií a s účinnými léky k supresi zánětu a proaterogenních imunitních procesů bude aktivní diagnostika a léčba zánětu u osob s KV rizikem akceptována.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Jan Bruthans, CSc., FESC
Centrum kardiovaskulární prevence 1. LF UK a Thomayerovy fakultní nemocnice Praha Vídeňská 800, 140 59 Praha 4 – Krč
Cit. zkr: Vnitř Lék 2021; 67(5): 304–308
Článek přijat redakcí: 16. 4. 2021
Článek přijat po recenzích: 15. 7. 2021
Sources
1. Lutgens E, Atzler D, Döring Z et al. Immunotherapy for cardiovascular disease. Eur Heart J 2019; 40 : 3937–3946.
2. Wolf D, Ley K. Immunity nad inflammation in atherosclerosis. Circulation Research 2019; 124 : 315–327.
3. Kobiyama K, Ley K. Atherosclerosis. Circ Res 2018; 123 : 1118–1120.
4. Libby P, Loscalzo J, Ridker PM et al. Inflammation, imunity, and infection in atherothrombosis: JACC review topic of the week. J Am Coll of Cardiol 2018; 72 : 2071–2081.
5. Stone GW, Maehara A, Lansky AJ et al. A prospective natural-history study of coronary atherosclerosis. N Engl J Med 2011; 364 : 226–235.
6. Ridker PM, Rifai N, Rose L et al. Comparison of C reactive protein and low density lipoprotein cholesterol levels in the prediction of first cardiovascular events. N Engl J Med 2002; 347 : 1557–1565.
7. Lindahl B, Toss H, Siegbahn A et al. Markers of myocardial damage and inflammation in relation to long term mortality in unstable coronary disease. N Engl J Med 2000; 343 : 1139–1147.
8. Koenig W. High-sensitivity C-reactive protein and atherosclerotic disease: from improved risk prediction to risk-guided therapy. Int. J Cardiol 2013; 168 : 5126–5134.
9. Quispe R, Michos ED, Martin SS et al. High-sensitivity C-reactive protein discordance with atherogenic lipid measures and incidence of atherosclerotic cardiovascular disease in primary prevention: the ARIC study. J Am Heart Assoc 2020; 9: e013600. doi: 10.1161/ JAHA.119.013600.
10. Ross R. Atherosclerosis – aninflammatory disease. N Engl J Med 1999; 340 : 115–126.
11. Horton JD, Goldstein JL, Brown MS. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. J Clin Invest. 2002; 109 : 1125–1131.
12. Gurcel L, Abrami L, Girardin S et al. Caspase-1 activation of lipid metabolic pathways in response to bacterial pore-forming toxins promotes cell survival. Cell 2006; 126 : 1134–1145.
13. Antonopoulos AS, Margaritis M, Lee R et al. Statins as anti-inflammatory agents in atherogenesis: molekular rmechanisms and lessons from the recent clinical trials. Curr Pharm Des 2012; 18 : 1519–1530.
14. Sahebkar A, Giosia PD, Stamerra CA et al. Effect of monoclonal antibodies to PCSK9 on high sensitivity C-reactive protein levels: a metaanalysis of 16 randomised controlled treatment arms. Br J Clin Pharmacol 2016; 81(6): 1175–1190.
15. Cao YX, Li S, Liu HH, Li JJ. Impact of PCSK9 monoclonal antibodies on circulating hs-CRP levels: a systematic review and meta analysis of randomised controlled trials.
16. Tardif JC, Kouz S, Waters DD et al. Efficacy and safety of low-dose kolchicine after myocardial infarction. N Engl J Med 2019; 381 : 2497–2505.
17. Nidorf SM, Fiolet ATL, Mosterd A. Colchicine in patients with chronic coronary disease. N Engl J Med 2020; 383 : 1838–1847.
18. Ridker PM, Everett BM, Pradhan A et al. Low-dose methotrexate for the prevention of atherosclerotic events. N Engl J Med 2019; 380 : 752–762.
19. Ridker PM, Everett BM, Thuren T et al. Antiinflamatory therapy with canakinumab for atherosclerotic disease. N Engl J Med 2017; 377 : 1119–1131.
20. Abraham M, Wald H, Vanzel-Ohayon D et al. Development of novel promiscuous anti-chemokine peptibodies for treating autoimmunity and inflammation. Front Immunol Frontiers 2017; 8 : 1432.
21. Hundelshausen von P, Agten SM, Eckardt V et al. Chemokine interactome mapping enables tailored intervention in acute and chronic inflammation. Sci Transl Med 2017; 9: eaah6650.
22. O´Neill LAJ, Kishton RJ, Rathmell J. A guide to immunometabolism for immunologist. Nat Rev Immunol 2016; 16 : 553–565.
23. Mancini SJ, Boyd D, Katwan OJ et al. Canagliflozin inhibits interleukin-1beta-stimulated cytokine and chemokine secretion in vascular endothelial cells by AMP-activated protein kinase-dependent and –independent mechanism. Sci Rep 2018; 8(1): 5276.
24. Chackerian B, Remaley A. Vaccine strategies for lowering LDL by immunization against proprotein invertase subtilisin/kexin type 9. Curr Opin Lipidol 2016; 27 : 345–350.
25. Piepoli MF, Hoes AW, Agewall S et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur Heart J 2016; 37 : 2315–2381.
26. Emerging Risk Factors Collaboration, Kaptoge S, Di Angelantonio E, Pennells L et al. C-reactive protein, fibrinogen, and cardiovascular disease prediction. N Engl J Med 2012; 367 : 1310–1320.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2021 Issue 5
-
All articles in this issue
- Endokrinológia, zaostrené na osteoporózu
- Kostní nemoc při selhání ledvin – renální i non-renální komponenta
- Výskyt osteoporózy u pacientov na substitučnej liečbe hypokorticizmu u Addisonovej choroby
- Osteoporóza u mužů: podceňovaná a neléčená
- Osteoporóza u premenopauzálnych žien
- Osteoporóza u pacientov s diabetes mellitus
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Role zánětu a imunity u aterosklerózy a možné způsoby jejich ovlivnění
- Karcinoidový syndróm – diagnostika a manažment
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Osteoporóza u premenopauzálnych žien
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Karcinoidový syndróm – diagnostika a manažment
- Osteoporóza u mužů: podceňovaná a neléčená
