Antifibrotická terapie a její indikace u intersticiální plicní fibrózy
Antifibrotic therapy and its indications for interstitial pulmonary fibrosis
Idiopathic pulmonary fibrosis and chronic fibrotic interstitial lung disease with progressive phenotype are characterized by fibrotic lung parenchyma. Current antifibrotic treatment does not affect pre-existing lung parenchyma fibrosis, but prevents fibrosis progression and reduces mortality by reducing fibrotization. This work summarizes fibrotic lung processes and their treatment options.
Keywords:
idiopathic pulmonary fibrosis – nintedanib – progressive fibrosing interstitial lung diseases – pirfenidon
Authors:
Martina Doubková
Authors‘ workplace:
Klinika nemocí plicních a TBC Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity Brno
Published in:
Vnitř Lék 2022; 68(4): 212-215
Category:
Main Topic
Overview
Idiopatická plicní fibróza a chronická fibrotizující intersticiální plicní onemocnění s progredujícím fenotypem jsou charakterizovány vazivovatěním plicního parenchymu. V současné době je k dispozici antifibrotická léčba, která sice neovlivní již přítomnou fibrotizaci plicního parenchymu, ale zabraňuje její progresi v čase, zpomalí pokles plicních funkčních parametrů a snižuje mortalitu. Součástí práce je přehled fibrotizujících plicních procesů a možnosti léčby.
Klíčová slova:
idiopatická plicní fibróza – nintedanib – progredující fibrotizující intersticiální plicní nemoci – pirfenidon
Úvod
Difuzní parenchymatózní nemoci plic neboli méně přesným, ale častěji užívaným názvem intersticiální plicní procesy (IPP), jsou heterogenní skupinou převážně chronických chorob, které jsou charakterizovány různým stupněm zánětu na úrovni respiračních bronchiolů, alveolárních duktů, alveolů, plicních kapilár, plicního intersticia a/nebo různým stupněm fibrózy plicní tkáně. Plicním intersticiem rozumíme vmezeřený prostor ohraničený endoteliálními buňkami plicních kapilár a alveolárním epitelem, perilymfatické prostory a centrálněji uložené peribronchiální a peribronchiolární prostory. IPP obsahují kolem 200 nozologických jednotek. Jejich diferenciální diagnostika je široká.
Existuje velmi mnoho příčin IPP, na které můžeme cílit při léčbě. Řada těchto chorob však má neznámou etiologii. IPP dělíme na procesy známé příčiny (nemoci spojené s expozicí antigenům profesionálního, životního a domácího prostředí, poléková postižení), idiopatické intersticiální pneumonie (IIP) (včetně idiopatické plicní fibrózy), granulomatozní procesy (sarkoidózy, histiocytóza z Langerhansových buněk, granulomatóza s polyangiitidou) a jiné vzácné (lymfangioleiomyomatóza, alveolární proteinóza) (1).
Některé IPP jsou primárně fibroproliferativní onemocnění, kde opakované alveolární poškození a proliferace fibroblastů vedou k plicní fibróze, včetně idiopatické plicní fibrózy (IPF) jako nejzávažnější podjednotky idiopatických intersticiálních pneumonií patřící mezi chronické IIP. IPF je limitovaná na plíce bez mimoplicních příznaků kromě paličkovitých prstů. Je spojená s histopatologickým a/nebo radiologickým obrazem běžné intersticiální pneumonie. Etiologie je neznámá a onemocnění je komplexní, nekontrolovatelná fibroproliferace je základním patogenetickým mechanismem IPF. Klíčovou roli v patogenezi hraje poškození alveolárních epiteliálních buněk neznámou noxou a dysregulace fibroblastů. Genetické faktory a faktory zevního prostředí přispívají ke vzniku a progresi IPF. Mezi potenciální rizikové faktory jsou zvažovány kouření, chronická aspirace při gastroezofageálním refluxu, léky, vlivy zevního prostředí (zpracování dřeva, kovů), virové infekce, polymorfismy genů (1, 2, 3, 4).
Charakteristickým symptomem IPF je pomalu progredující dušnost, zejména po námaze, a kašel. Při fyzikálním vyšetření je přítomen auskultačně nad oběma plícemi pozdně exspirační krepitus připodobňovaný rozepínání suchého zipu. Plicním funkčním vyšetřením pozorujeme restriktivní ventilační poruchu se sníženou difuzní plicní kapacitou v důsledku postižení alveolokapilární membrány s poruchou výměny krevních plynů. Medián přežití se u neléčených pacientů pohybuje od 2 do 5 let od stanovení diagnózy. Příčinami úmrtí bývá nejčastěji respirační selhání u pokročilé plicní fibrózy, srdeční selhání, bronchogenní karcinom v terénu vazivovatění, plicní infekce a plicní embolie (2, 3, 4).
U jiných IPP bývá primárním patogenetickým procesem zánět, který vede k vazivovatění plicní tkáně sekundárně. V současné době se věnuje pozornost takzvaným progredujícím formám intersticiálních plicních fibróz, které mohou mít patogenetický mechanismus a klinický průběh podobný jako IPF. Jedná se zejména o pacienty se systémovým onemocněním pojiva (systémová sklerodermie, revmatoidní artritida, polymyozitida a dermatomyozitida), dále chronickou formou hypersenzitivní pneumonitidy (fibrotický fenotyp), chronickou formou sarkoidózy, idiopatickou nespecifickou intersticiální pneumonií, neklasifikovatelnou plicní fibrózou a jinými procesy vedoucími k plicní fibróze se špatnou prognózou (Obrázek 1). Bohužel zatím předpovědět progresi intersticiální plicní fibrózy neumíme a nemáme dosud k dispozici žádné dostatečně senzitivní a specifické biomarkery, které by nám byly nápomocny v predikci zhoršení fibrózy (5). U progredujících forem IPP se nám tak nabízí řada otázek v managementu péče o tyto pacienty: Jedná se u pacienta o zánětlivý/ fibrotizující proces, nebo primárně epiteliálně/fibrotický? Budeme upravovat terapii imunosupresivy, nebo budeme přidávat antifibrotika, či budeme léčit jen antifibrotiky? Jaká je optimální definice progrese? Jak identifikovat pacienty, kteří budou progredovat? Jaké jsou mechanismy progrese u progredujících plicních fibróz? Jsou to otázky, na které zatím hledáme odpovědi a u každého pacienta individuálně se snažíme zvolit co nejefektivnější způsob léčby s minimem nežádoucích účinků.
Progredující fibrotizující intersticiální plicní procesy
Nejčastějšími formami progredujících plicních fibróz v ambulancích plicních specialistů jsou IPF, intersticiální plicní postižení v rámci systémových onemocnění pojiva, fibrotické formy exogenních alergických alveolitid, idiopatické nespecifické intersticiální pneumonie a neklasifikovatelné plicní fibrózy. Progrese je definována kombinací klinických, funkčních, radiologických parametrů (Tabulka 1). Rizikovými faktory progrese jsou nález běžné intersticiální pneumonie (UIP, usual interstitial pneumonia) na HRCT hrudníku (výpočetní tomografie s vysokou rozlišovací schopností) nebo histopatologicky, rozsah voštinovité přestavby, bronchiektázií na HRCT hrudníku, nízké vstupní funkční ukazatele v době diagnózy, vyšší věk, kouření, perzistující nebo neidentifikovaný antigen vyvolávající nemoc, genetické dispozice (5, 6). Progredující fenotypy intersticiálních plicních procesů zahrnují mnoho nozologických jednotek (Obrázek 1).

Jednou z podskupin IPP jsou idiopatické intersticiální pneumonie. Nejzávažnější a nejčastější jednotkou je již zmiňovaná idiopatická plicní fibróza (IPF) (Obrázek 2). V ČR není aktuální epidemiologická situace přesně známa. Další je chronická forma, respektive fibrotická forma exogenní alergické alveolitidy. Nejčastěji se setkáváme s farmářskou plící a plící chovatelů holubů.
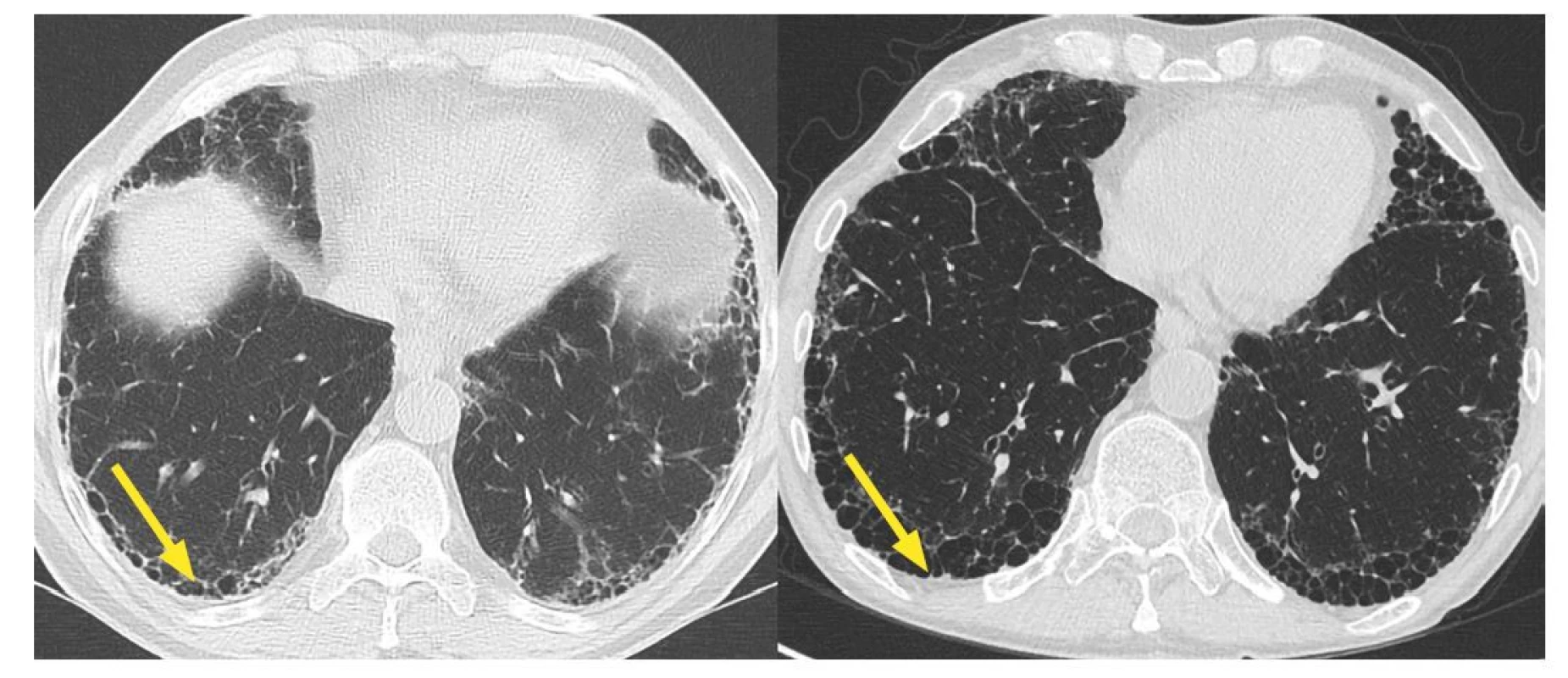
Systémová onemocnění pojiva, starším názvem kolagenózy, jsou heterogenní skupinou imunologicky podmíněných zánětlivých onemocnění projevujících se multiorgánovým postižením. Plicní postižení včetně IPP je častou příčinou smrti pacientů se SOP, zejména u revmatoidní artritidy (Obrázek 3), systémové sklerodermie (SS) a polymyozitidy/dermatomyozitidy (PM/DM), Sjögrenova syndromu (5, 6).

V roce 2013 byl zaveden termín neklasifikovatelné plicní fibrózy. Toto onemocnění nelze zařadit do žádné diagnostické kategorie, mnohdy i proto, že nemocný nemůže absolvovat všechna vyšetření například pro komorbidity nebo tíži onemocnění (1).
Nespecifická intersticiální pneumonie (NSIP) nepředstavuje jednu entitu, může být například projevem autoimunitních onemocnění nebo je idiopatická. Oproti IPF je prognóza u pacientů s iNSIP příznivější, míra přežití je obvykle vyšší (1).
IPP souvisejí s expozicemi anorganických prachů v plicích. Nejběžnější jsou azbestóza a silikóza patřící mezi pneumokoniózy. I ty mohou v čase progredovat.
Sarkoidóza je systémové granulomatózní onemocnění neznámé etiologie s plicními a mimoplicními projevy. Prognóza onemocnění je většinou příznivá. Chronický průběh jse zaznamenán u cca 30 % pacientů (7).
Terapie
Zásadním krokem v terapii IPF bylo prohlášení z roku 2015, které nedoporučovalo již imunosupresivní terapii (kortikosteroidy, jiná imunosupresiva včetně azathioprinu). Antifibrotická terapie pirfenidonem a nintedanibem byla hodnocena jako vhodná pro léčbu nemocných s IPF (3). Její účinnost byla podložena randomizovanými klinickými studiemi.
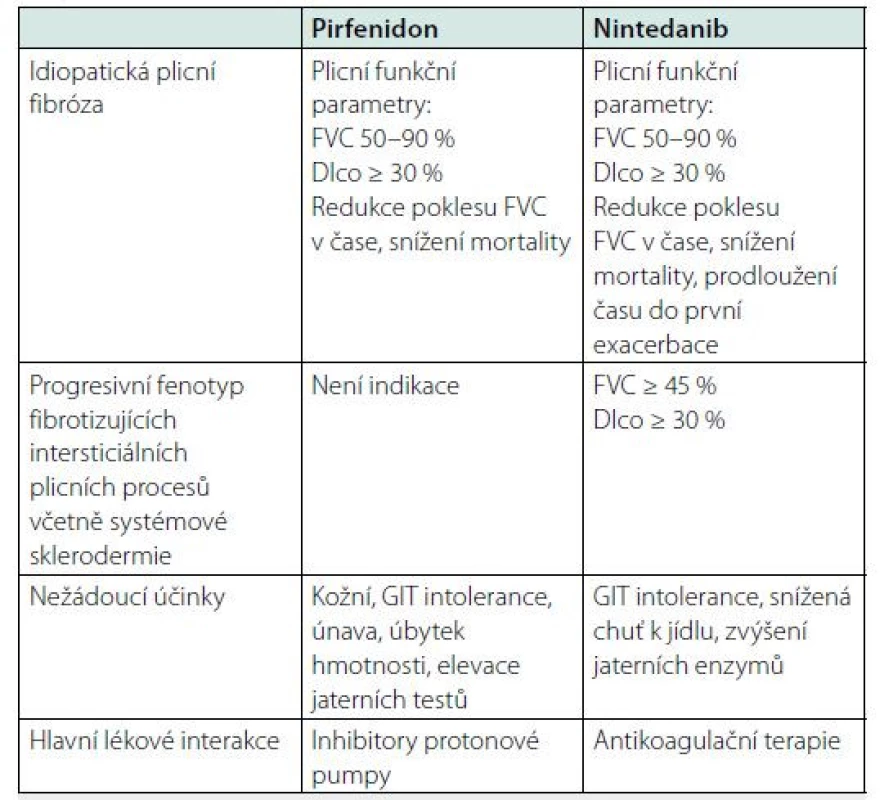
Pirfenidon (5-methyl‑l - fenyl-2-[lH]-pyridon), je v současnosti schválen a hrazen z veřejného pojištění pro léčbu IPF u pacientů s mírným až středně závažným onemocněním dle plicních funkčních parametrů. Využíván je především jeho antifibrotický účinek. Pirfenidon moduluje fibrogenní růstové faktory, čímž oslabuje proliferaci fibroblastů, diferenciaci myofibroblastů, syntézu kolagenu a fibronektinu a depozici extracelulární matrix. Tento účinek je zprostředkován potlačením TGF‑β1 (transformující růstový faktor‑β1) a dalších růstových faktorů (PDGF – plateled derived growth factor, FGF – fibroblast growth factor, IL-18 – interleukin 18). Pirfenidon také reguluje zánětlivé dráhy působením na zánětlivé buňky, produkci pro ‑ a protizánětlivých cytokinů v plicích, má antioxidační účinky (8, 9). Pacienti užívají pirfenidon perorálně a zahajují léčbu dávkováním první týden 3 × 1 kapsle (tobolka) po 267 mg, druhý týden 3 × 2, třetí týden 3 × 3, při dobré snášenlivosti je možný přechod na variantu 801 mg 1-1-1. Nejčastější nežádoucí účinky jsou gastrointestinální potíže (nauzea, nechutenství, zvýšené jaterní testy) a fotosenzitivita. Klinická účinnost léčby pirfenidonem byla prokázána v několika studiích (10, 11, 12). V ČR je hrazen u pacientů s FVC (forsírovaná vitální kapacita) mezi 50–90 % normálních hodnot a DLco (difuzní plicní kapacita) vyšší než 30 % normálních hodnot.
Nintedanib je trikinázový inhibitor cílený na receptor vaskulárního endoteliálního růstového faktoru (VEGFR – vascular endothelial growth factor), růstového faktoru fibroblastů (FGFR – fibroblast growth factor receptors) a destičkového růstového faktoru (PDGFR – platelet‑derived growth factor receptors). Nintedanib byl původně pro svůj antiangiogenní účinek zamýšlený jen pro léčbu nádorů. Účinek nintedanibu spočívá v omezení proliferace, migrace a přežívání fibroblastů a v negativním vlivu na angiogenezi (13). V ČR je hrazen u IPF pacientů s FVC 50–90 % normálních hodnot a DLco vyšší než 30 % normálních hodnot. Lék se užívá perorálně ve formě kapslí, 2 × 1 kapsle po 150 mg denně (přibližně po 12 hodinách). Při nesnášenlivosti je možné dávku snížit na 2 × 100 mg. Nejčastějšími nežádoucími účinky jsou průjmy, zvýšení jaterních enzymů. Klinická účinnost byla potvrzena v několika studiích (14, 15, 16).
Indikace a léčba antifibrotiky (pirfenidonem a nintedanibem) je vázána na Centra pro diagnostiku a léčbu intersticiálních plicních procesů. V těchto centrech je zajišťována komplexní péče o nemocné s IPP. Součástí těchto center je i multidisciplinární tým (sestává z pneumologů, radiologů, chirurgů, patologů), který hodnotí radiologické a jiné nálezy a mnohdy navrhuje optimální léčbu.
Jak již bylo zmíněno, antifibrotická léčba není indikována a hrazena jen pro pacienty s IPF. Nintedanib rozšířil na základě klinických studií své indikace i na jiná chronické fibrotizující intersticiální plicní onemocnění s progresivním fenotypem (studie s progredujícími formami plicní fibrózy, systémová sklerodermie s intersticiálním plicním postižením) (17, 18). V obou studiích byl prokázán pokles plicních funkčních ukazatelů v čase. Nutné je zmínit, že tento lék neměl léčebný efekt na mimoplicní příznaky u systémových onemocnění pojiva. Souhrnně je nintedanib hrazen pro pacienty:
• S IPF, u kterých je FVC v rozmezí 50–90 %, mají DLco větší nebo rovný 30 % a kteří dodržují zákaz kouření.
• S jinými chronickými fibrotizujícími intersticiálními plicními onemocněními s progresivním fenotypem navzdory stávajícímu individualizovanému léčebnému postupu, přičemž progresivní fenotyp je definován kombinací několika faktorů zohledňujících kliniku, funkční parametry a nález na HRCT hrudníku, viz tabulka 1. Diagnóza musí být potvrzena multidisciplinárním týmem příslušného specializovaného centra a pacienti musí mít FVC alespoň 45 % predikovaných hodnot, DLco alespoň 30 % a dominující fibrotické změny na HRCT. Nintedanib je indikován i pro pacienty s diagnózou systémové sklerodermie a intersticiálním plicním postižením. Pokud by nebyla splněna kritéria progredujícího fenotypu, pak je třeba žádat pojišťovnu o úhradu. Tabulka 2 uvádí souhrn indikací pro antifibrotickou terapii.

Závěr
Progredující formy intersticiálních plicních fibróz jsou závažné jednotky intersticiálních plicních procesů. Již existující vazivovatění plicního parenchymu je nevratnou formou plicního postižení. Antifibrotické léky správně indikované ať už samostatně (IPF), nebo v kombinaci s imunosupresivy (u ne‑IPF) mohou přispět ke zlepšení prognózy nemocných včetně zmírnění poklesu plicních funkčních parametrů v čase.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Martina Doubková, Ph.D.
Klinika nemocí plicních a TBC FN a LF MU
Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék. 2022;68(4):212-215
Článek přijat redakcí: 28. 3. 2022
Článek přijat po recenzích: 2. 5. 2022
Sources
1. Travis WD, Costabel U, Hansell DM et al. ATS/ERS Committee on Idiopathic Interstitial Pneumonias. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med. 2013;188(6):733-48.
2. Vašáková M, Šterclová M. Idiopatická plicní fibróza (Doporučený postup pro diagnózu, léčbu a sledování – 2. aktualizace). http://www.pneumologie.cz. Cited dne 11. 3. 2022.
3. Raghu G, Rochwerg B, Zhang Y et al.; American Thoracic Society; European Respiratory society; Japanese Respiratory Society; Latin American Thoracic Association. An Official ATS/ERS/ JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the 2011 Clinical Practice Guideline. Am J Respir Crit Care Med. 2015 Jul 15;192(2):e3-19. doi: 10.1164/rccm. 201506-1063ST.
4. Raghu G, Remy‑Jardin M, Myers JL et al. American Thoracic Society, European Respiratory Society, Japanese Respiratory Society, and Latin American Thoracic Society. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2018;198(5):e44-e68. doi: 10.1164/rccm.201807-1255ST.
5. Cottin V, Wollin L, Fischer A et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019;28(151):180100. doi: 10.1183/16000617.0100-2018.
6. Šterclová M. Definice progredujících fibrotizujících intersticiálních plicních procesů a přístup k nemocnému (Doporučený postup). https://www.pneumologie.cz. Navštíveno dne 11. 3. 2022.
7. Žurková M, Lošťáková V, Vašáková M et al. Sarkoidóza (Doporučený postup). https://www. pneumologie.cz. Cited dne 11. 3. 2022.
8. Takeda Y, Tsujino K, Kijima T et al. Efficacy and safety of pirfenidone for idiopathic pulmonary fibrosis. Patient Prefer Adherence. 2014;8 : 361-70. doi: 10.2147/PPA.S37233.
9. Kurita Y, Araya J, Minagawa S et al. Pirfenidone inhibits myofibroblast differentiation and lung fibrosis development during insufficient mitophagy. Respir Res. 2017;18(1):114. doi: 10.1186/s12931-017-0600-3.
10. Noble PW, Albera C, Bradford WZ et al. CAPACITY Study Group. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet. 2011;377(9779):1760-9. doi: 10.1016/S0140-6736(11)60405-4.
11. King TE Jr, Bradford WZ, Castro‑Bernardini S et al. ASCEND Study Group. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2083-92. doi: 10.1056/NEJMoa1402582.
12. Nathan SD, Albera C, Bradford WZ et al. Effect of pirfenidone on mortality: pooled analyses and meta‑analyses of clinical trials in idiopathic pulmonary fibrosis. Lancet Respir Med. 2017;5(1):33-41. doi: 10.1016/S2213-2600(16)30326-5.
13. Wollin L, Wex E, Pautsch A et al. Mode of action of nintedanib in the treatment of idiopathic pulmonary fibrosis. Eur Respir J. 2015;45(5):1434-45. doi: 10.1183/09031936.00174914.
14. Richeldi L, Costabel U, Selman M et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med. 2011;365(12):1079-87. doi: 10.1056/ NEJMoa1103690.
15. Richeldi L, du Bois RM, Raghu G et al. INPULSIS Trial Investigators. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2071-82. doi: 10.1056/NEJMoa1402584.
16. Kolb M, Richeldi L, Behr J, et al. Nintedanib in patients with idiopathic pulmonary fibrosis and preserved lung volume. Thorax. 2017;72(4):340-346. doi: 10.1136/thoraxjnl-2016-208710.
17. Flaherty KR, Wells AU, Cottin V et al. INBUILD Trial Investigators. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019;381(18):1718-1727. doi: 10.1056/NEJMoa1908681.
18. Distler O, Highland KB, Gahlemann M et al. SENSCIS Trial Investigators. Nintedanib for Systemic Sclerosis‑Associated Interstitial Lung Disease. N Engl J Med. 2019 Jun 27;380(26):2518-2528. doi: 10.1056/NEJMoa1903076.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2022 Issue 4
-
All articles in this issue
- Hlavní téma – Pneumologie
- Covid-19 a post‑ covid – Jekyll a Hyde moderní medicíny
- Antifibrotická terapie a její indikace u intersticiální plicní fibrózy
- Neo/adjuvantní imunoterapie v léčbě nemalobuněčného plicního karcinomu
- Prevencia a liečba venózneho tromboembolizmu spojeného s malignitou – interdisciplinárny konsenzus
- Akutní poškození ledvin vlivem antimikrobiální terapie
- Vývoj doporučení pro použití venofarmak v léčbě chronického žilního onemocnění – kde je jejich místo a kde jsou slabiny
- Kyselina acetylsalicylová v primární prevenci kardiovaskulárních onemocnění
- Zlepšili sme starostlivosť o pacientov s artériovou hypertenziou v roku 2021?
- Urapidil: neznámé / známé antihypertenzivum
- Hlavní teze směřování interny v příštích letech
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Vývoj doporučení pro použití venofarmak v léčbě chronického žilního onemocnění – kde je jejich místo a kde jsou slabiny
- Antifibrotická terapie a její indikace u intersticiální plicní fibrózy
- Urapidil: neznámé / známé antihypertenzivum
- Kyselina acetylsalicylová v primární prevenci kardiovaskulárních onemocnění
