Role mikroRNA u nádorů hlavy a krku se zaměřením na sinonazální karcinom
The Role of microRNA in head and neck cancer focusing on sinonasal carcinoma
MicroRNAs are small (18–25 nt) noncoding RNA molecules that are part of gene expression regulation and influence tumorigenesis. They could possibly be used as biomarkers and therapeutic targets in cancer in the future.
Head and neck cancer is the sixth most common malignancy worldwide. These also include sinonasal carcinoma, a rare disease arising in the epithelium of respiratory tract, which is very poorly studied from the molecular perspective.
MicroRNAs that have influence on pathogenesis of head and neck tumors have been divided into three categories: microRNAs associated with invasiveness and metastatic processes, microRNAs operating as oncogenes and microRNAs associated with HPV status and smoking. We expect that the described microRNAs could be part of regulatory mechanisms also in sinonasal carcinoma.
Keywords:
epigenetics, microRNAs, head and neck cancer, sinonasal carcinoma
Authors:
Ing. Helena Kovaříková; Mgr. Ph.D. Marcela Chmelařová; prof. MUDr. CSc. Vladimír Palička, Dr.h.c.
Authors‘ workplace:
Ústav klinické biochemie a diagnostiky LF UK a FN Hradec Králové: Sokolská
581
Published in:
Čas. Lék. čes. 2016; 155: 99-104
Category:
Review Articles
Overview
MikroRNA jsou malé (18–25 nt) nekódující molekuly RNA, které se účastní regulace genové exprese a mají vliv na tumorigenezi. V budoucnosti by mohly být využívány jako biomarkery a terapeutické cíle u nádorových onemocnění.
Nádory hlavy a krku jsou šestým nejčastějším maligním onemocněním na světě. Patří mezi ně i sinonazální karcinom, vzácné onemocnění objevující se v oblasti epitelu dýchacího traktu, které je z molekulárního hlediska velmi málo prostudované.
MikroRNA mající vliv na patogenezi nádorů hlavy a krku byly v rámci tohoto článku rozděleny do tří kategorií: mikroRNA související s invazivností a tvorbou metastáz, mikroRNA fungující jako onkogeny a mikroRNA asociované s HPV statutem a kouřením. Předpokládáme, že mikroRNA zařazené do těchto kategorií by mohly být součástí mechanismů regulace také u sinonazálního karcinomu.
Klíčová slova:
epigenetika, mikroRNA, nádor hlavy a krku, sinonazální karcinom
Úvod
Nádory hlavy a krku (HNC) jsou útvary vznikající v epitelové výstelce aerodigestivního traktu a zahrnují tumory rtů, ústní dutiny, nosní dutiny, vedlejších dutin nosních a slinných žláz hrtanu a hltanu. Karcinom dlaždicového epitelu hlavy a krku (HNSCC) je nejčastějším subtypem nádorů této oblasti. Tvoří více než 90 % celosvětového výskytu HNC (1).
Rizikovým faktorem výskytu těchto malignit, a to především nádorů oblasti dutiny ústní a orofaryngu, je konzumace alkoholu a tabákových výrobků. Přítomnost lidských papilomavirů (HPV) v organismu zvyšuje riziko výskytu především u orofaryngealního karcinomu. S tím souvisí fakt, že prevalence tohoto nádoru globálně roste a věková hranice vzniku tumoru klesá (2).
Rané fáze onemocnění jsou přednostně léčeny chirurgickým zákrokem nebo radioterapií, zatímco u tumorů v pokročilém stadiu je využívána kombinace chirurgického zákroku a postoperační radioterapie, eventuálně radikální chemoradioterapie s využitím cisplatiny (3). Celosvětově je každý rok nově diagnostikováno více než 550 tisíc případů HNC a přibližně 300 tisíc lidí na tyto nádory každoročně umírá. U mužů se tyto tumory vyskytují častěji než u žen, a to v poměrů 2 : 1 až 4 : 1 (4). Nejvyšší prevalence HNC je v rozvojových zemích především v jihovýchodní Asii, což je spojováno s oblíbeností konzumace betelových ořechů v tomto regionu (5). V roce 2012 bylo v České republice diagnostikováno 1554 případů nádorů hlavy a krku a 765 pacientů na toto onemocnění v roce 2012 zemřelo (6).
Karcinomy dutiny nosní a vedlejších nosních dutin (SNC) tvoří 3 % všech maligních onemocnění vyskytujících se v oblasti hlavy a krku (7). Sinonazální karcinom dlaždicového epitelu (spinocelulární karcinom, SSCC) je nejčastějším typem těchto nádorů, následovaný sinonazálním adenokarcinomem intestinálního typu (ITAC), k méně běžným subtypům patří nediferencovaný sinonazální karcinom (SNUC) a další. Incidence těchto nádorů je < 4,5 % na 1 milion, vyskytují se ve větší míře u mužů než u žen, což koresponduje s vyšším rizikem výskytu u některých profesí, a objevují se nejčastěji kolem 65. roku života. I při použití agresivní kombinované léčby je medián přežití u SNC méně než 18 měsíců a po dobu 5 let zůstává naživu pouze 20 % pacientů (2, 8). Mezi časté symptomy tohoto onemocnění patří změna ostrosti vidění, diplopie, lakrimace nebo proptóza. Dále se pak objevují nosní obstrukce, otok nosní sliznice, citlivost nosu, epistaxe, bolest hlavy nebo bolest v oblasti obličeje (9).
Nádory sinonazální oblasti se ve vyšší míře objevují u kuřáků cigaret, největší vliv má tabákový kouř na vznik karcinomu dlaždicového epitelu (10). Dlouhodobě se také zkoumá role HPV při kancerogenezi SNC. Přibližně 20−27 % pacientů s SNC je HPV-pozitivních. Důležitým faktorem se ukázal být high risk HPV (HPV-HR) typu 16, jenž byl nalezen přibližně u 90 % HPV-pozitivních SSCC. U těchto tkání byla rovněž nalezena vysoká exprese p16INK4a. Ukázalo se, že exprese p16 je spolehlivým markerem pro HPV status u SSCC, nikoliv však u ostatních subtypů nádorů této oblasti. Pacienti s HPV-pozitivním nálezem mají výrazně lepší prognózu než u HPV-negativního SNC (11−13).
Dalším rizikovým faktorem vzniku nádorů v sinonazální oblasti je profesní vystavení specifickým karcinogenním látkám. Mezi rizikové substance patří dřevěný a kožený prach, formaldehyd a další (14). Kvůli vdechování dřevěného prachu zejména z tvrdého dřeva patří mezi ohrožené profese pracovníci se dřevem (výrobci nábytku, modelů ze dřeva a tesaři). U ITAC byl objasněn jeden z mechanismů vzniku malignit tak, že vdechování dřevěného prachu z tvrdého dřeva vede k výskytu chronického zánětu, který způsobuje mutageneziTP53a kancerogenezi (15). Mezi další ohrožené profese patří pracující s kůží (výrobci bot a zaměstnanci koželužen), u nichž je rizikovým faktorem vdechování koženého prachu, dále pak osoby přítomné při elektrolytické rafinaci niklu (10).
Epigenetické modifikace DNA
Epigenetické změny jsou definovány jako dědičné změny v genové expresi, které nejsou doprovázeny změnami v sekvenci DNA. Zahrnují methylaci DNA, acetylaci histonů a posttranskripční modifikace pomocí mikroRNA (miRNA). Při methylaci DNA dochází k navázání methylové skupiny na cytosin v pozici C5 nacházející se v dinukleotidu cytosin-guanin (CpG). Methylace je uskutečňována pomocí enzymu DNA methyltransferázy, která přenáší methylovou skupinu z S-adenosyl-methioninu. Výsledkem procesu je vznik 5' methylcytosinu. Dinukleotidy CpG nejsou v genomu rozmístěny rovnoměrně, ale jsou soustředěny do oblastí se zvýšeným výskytem CpG, které jsou nazývány CpG ostrůvky. Tyto oblasti se často vyskytují v promotorových oblastech genů (16, 17).
DNA methylace je důležitá pro správný vývoj jedince, a to zejména při inaktivaci chromosomu X, imprintingu a ochraně proti transpozonům (18). Poruchy methylace jsou spojovány se vznikem různých onemocnění, zejména maligních nádorů. Při globální hypomethylaci u nádorových buněk dochází ke ztrátě methylace v repetitivních DNA sekvencích vedoucí k nestabilitě chromosomů, reaktivaci transpozonů a ztrátě imprintingu (17). Další důležitou epigenetickou modifikací při vzniku tumorů je hypermethylace CpG ostrůvků v promotorové oblasti tumorsupresorových genů, která často vede k zabránění transkripce (16). Informace o DNA methylaci, expresi genů a typech nádorů jsou sdruženy v databázi MethyCancer (19).
Změny ve struktuře chromatinu probíhají pomocí posttranslačních modifikací histonových proteinů, jako je acetylace, methylace a fosforylace. Acetylace lysinových zbytků v molekule histonů probíhá za katalýzy histon-acetyltransferáz. Tento proces vede ke změnám ve struktuře nukleosomového vlákna, což umožňuje transkripčním faktorům přístup k promotorům genových lokusů a zahájení transkripce. Acetylace je reverzibilní proces a její neutralizace probíhá pomocí enzymů histon-deacetyláz. Správná funkce posttranslačních modifikací histonových proteinů je důležitá pro vývojové procesy organismu. Deregulace acetylace je spojována s nádorovým bujením a vznikem dalších poruch (20).
Tento přehledový článek je zaměřen na jednu z nejčastěji sledovaných epigenetických alterací, a to na posttranskripční regulaci pomocí miRNA.
MikroRNA
MiRNA jsou krátké (přibližně 22 nukleotidů) nekódující molekuly RNA, které se účastní regulace genové exprese a byly poprvé objeveny při experimentech s háďátkem Caenorhabditis elegansv roce 1993 (21). Poznatky o miRNA jsou sdružovány v on-line databázi miRBase, která zahrnuje miRNA nomenklaturu, sekvence, anotace funkce a předpovědi možných cílů. V současné době je v databázi přítomno 28 645 miRNA záznamů (vydání 21), z čehož 1881 sekvencí je lidského původu (22, 23). Primární funkce miRNA je negativní regulace translace proteinů pomocí komplexu RISC tím, že se vážou ke komplementárním sekvencím na 3' UTR (nepřekládané oblasti).
Při biogenezi miRNA (viz obr. 1) vzniká nejprve primární transkript miRNA (pri-miRNA). Ten je v jádře zastřihnut pomocí komplexu ribonukleáza III enzymu Drosha a proteinu Pasha vázajícího dsRNA za vzniku prekurzorové vlásenky miRNA (pre-miRNA) o velikosti 70 nt (24). Ta je pomocí exportního faktoru Exportin-5 (Exp5) přenesena do cytoplazmy, kde dochází k sestřihu pomocí dalšího ribonukleáza III enzymu Dicer, čímž vznikne duplex miRNA o velikost 22 nt (25). Jedno z vláken duplexu se připojí ke komplexu RISC (RNA-induced silencing complex) obsahujícímu proteiny Argonaute2 (Ago2), Dicer a TRBP (transactivating response RNA-binding protein). V tomto komplexu slouží miRNA k rozpoznávání a připojení cílové mRNA při procesu RNA interference.
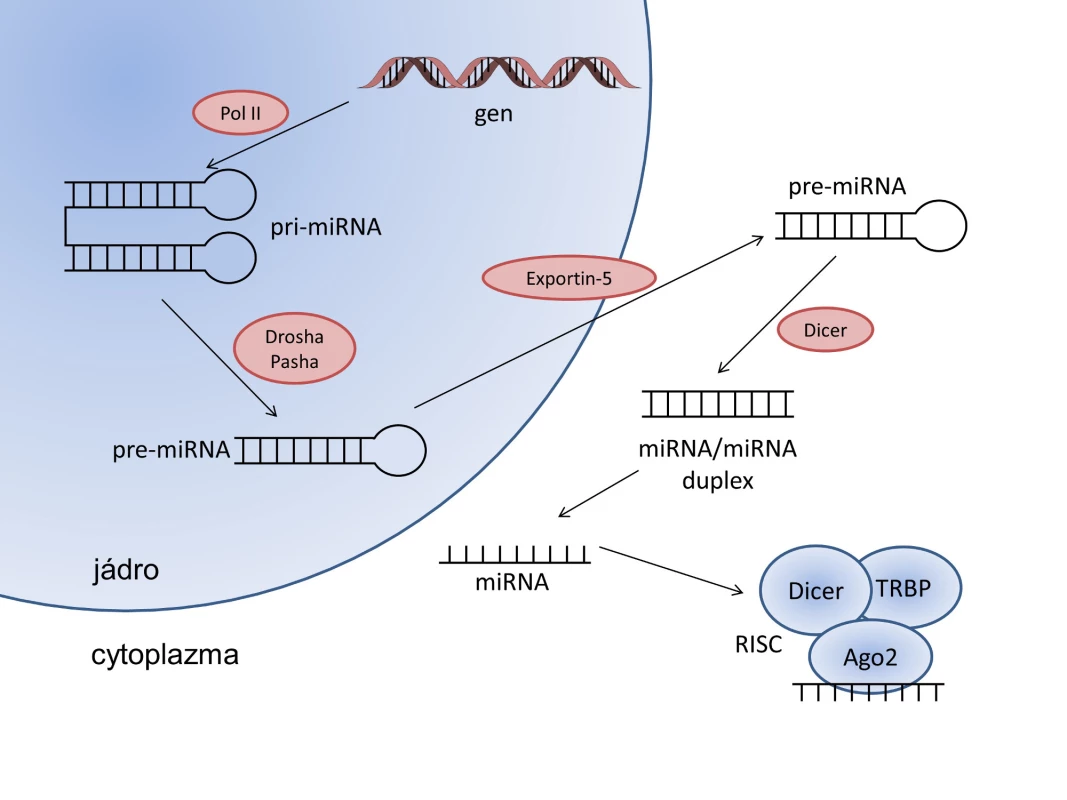
Calin et al. (26) poprvé popsali vliv miRNA na vznik rakoviny, konkrétně miR-15 a miR-16. Geny kódující tyto dvě miRNA byli lokalizovány na chromosomu 13q14. Tato oblast je deletovaná u více než 65 % pacientů s chronickou lymfocytární leukémií (CLL). Lu et al. (27) zjistili, že profil exprese miRNA se liší u různých typů nádorových onemocnění. Navíc prokázali, že profily miRNA jsou různé i mezi pacienty se stejným typem nádoru, tudíž se z nich dá odvodit původ nádoru a jeho vývoj. Zároveň pozorovali downregulaci nebo upregulaci některých miRNA v porovnání se zdravou tkání. Tato zjištění ukazují, že miRNA profilování může napomoci k přesnější diagnóze a prognóze onemocnění a lze je použít i pro diagnostiku histologicky špatně identifikovatelných nádorů.
Studiem mikroRNA u sinonazálního karcinomu se dosud zabývali pouze Ogawa et al. (28), kteří zkoumali souvislost downregulace miR-34a s rezistencí k cis-diaminodichlorplatině (CDDP). Studie ukázala, že miR-34a je důležitým markerem prognózy pro léčbu SSCC pomocí CDDP. Autoři zároveň poukazují na možnost, že na regulaci chemosenzitivity nádoru na CDDP by se mohly podílet i další miRNA.
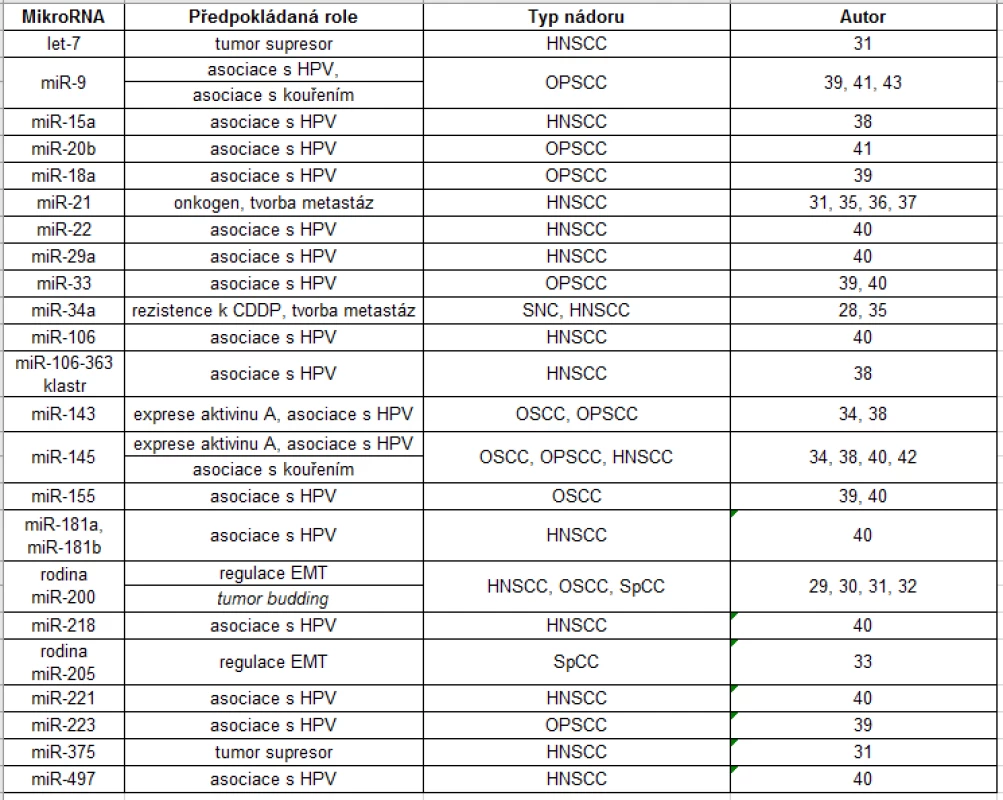
Studium miRNA u nádorů hlavy a krku se zaměřuje především na karcinom dlaždicového epitelu hlavy a krku, která je nejčastějším subtypem HNC. Mnoho vědeckých týmů se zabývá profilováním miRNA s odlišnou expresí miRNA oproti zdravé tkáni (viz tab. 1).
MikroRNA související s invazivností a tvorbou metastáz
U některých miRNA byla objevena souvislost s rychlostí růstu a rozšiřování nádorových onemocnění, a mohly by tak sloužit jako markery nádorů hlavy a krku. Patří mezi ně miRNA rodiny miR-200 (miR-200a, miR-200b, miR-200c, miR-141 a miR-429), které hrají důležitou roli při potlačování tumoru. Děje se tak pomocí regulace exprese transkripčních faktorů s motivem zinkového prstu ZEB1 a ZEB2, které jsou hlavními regulátory epitelově-mezenchymového transferu (EMT) pomocí přímého potlačení E-kadherinů. EMT je proces, při němž jsou epitelové buňky přeměněny na buňky mezenchymové, které mají schopnost migrace a invaze, což vede k procesu tvorby metastáz a zrychlenému postupu nádoru (29). Exprese některých miRNA může být ovlivněna přítomností molekuly hepatocytového růstového faktoru (HGF), což je pleiotropní molekula, která funguje jako mitogen, motogen nebo morfogen u mnoha buněk a podílí se na EMT. Susuki et al. (30) pozorovali u tkáně HNSCC downregulaci miR-200c a miR-27b po stimulaci HGF. HGF. Exprese ZEB1 byla upregulována 3 a 6 hodin po stimulaci HGF s E-kadherin (cílová molekula ZEB1) byla downregulována 8 hodin po stimulaci.
Ve tkáni nádorů dochází také k deregulaci některých mikroRNA, a to konkrétně upregulaci miR-21, miR-200c a miR-34a a naopak downregulaci miR-375. Exprese let-7a, mir-200c a miR-34a je výrazně vyšší u orofaryngeálního karcinomu než u laryngealního karcinomu. Upregulace miR-34 je spojována p16 pozitivním orofaryngeálním karcinomem (31). Jensen et al. (32) našli downregulaci miRNA rodiny miR-200 i u shluků nádorových buněk při procesu nazývaném tumor budding u karcinomu dlaždicového epitelu dutiny ústní (OSCC).
U sarkomatoidního karcinomu hlavy a krku (SpCC) dochází k výrazné downregulaci miRNA rodiny miR-200 a miR-205 v porovnání s tkání HNSCC. SpCC je smíšený nádor skládající se z SSCC a maligních vřetenovitých buněk. Tato zjištění dokazují předpokládanou roli EMT při vzniku SpCC vedoucí ke ztrátě E-kadherinů a desmosomálních kadherinů (33).
Bufalino et al. (34) detekovali u tkáně OSCC downregulaci miR-143 a miR-145 vedoucí ke zvýšené expresi aktivinu A. Přítomnost aktivinu A je u OSCC asociována s výskytem metastáz na lymfatických uzlinách, nádorovou diferenciací a kratší dobou přežití a navíc reguluje apoptózu, proliferaci a invazivnost buněk.
MikroRNA jako onkogen
MiR-21 je jedním z nejvíce prostudovaných miRNA onkogenů, jehož zvýšená exprese byla detekována nejen u HNSCC, ale i v dalších solidních nádorových tkáních (nádory plic, prsu, pankreatu, mozku, prostaty, žaludku, jater tlustého střeva a lymfomy). Yan et al. (35) ve svém výzkumu naznačují, že miR-21 se spolu s miR-34ac, p53 a NF-κB koordinovaně podílí na regulaci skupiny genů přispívajících k metastatickému procesu u HNSCC. Tyto miRNA se pomocí specifických transkripčních faktorů účastní regulace tumor supresorových genů (TP63), genů ovlivňujících progresi nádorů (ITGA5, CDKN1A) a genů ovlivňujících metastatické procesy (IL8, ICAM1). Sun et al. (36) publikovali výsledky, které potvrzují nejen vyšší expresi miR-21 u HNSCC než u zdravých epiteliálních buněk, ale také roli miR-21 při regulaci proliferace buněk u HNSCC. Děje se tak pomocí negativní regulace tumor supresorového genu PDCD4 na posttranskripční úrovni, kdy se miR-21 váže na netranslatovanou oblast na 3' konci PDCD4 mRNA. PDCD4 se na molekulární úrovni váže na eukaryotický iniciační faktor 4a (eIF4A), inhibuje ho a tím ovlivňuje translaci proteinů. Navíc PDCD4 inhibuje transaktivaci a inhibitor cyklindependentní kinázy p21.
Piao et al. (37) úspěšně demonstrovali potenciální využití kationtových nanočástic zapouzdřených s anti-miR-21 jako nového terapeutika pro léčbu HNSCC. Výsledkem léčby s anti-miR-21 byla inhibice proliferace buněk, zkrácení doby klonogenního přežití, inhbice invaze a migrace buněk a zvýšení apoptózy u HNSCC tkáně.
MikroRNA asociované s HPV statutem a kouřením
Infekce HPV je v oblasti problematiky nádorů hlavy a krku spojována především s orofaryngeálním SCC (OPSCC). HPV-pozitivních je asi 70 % OPSCC a 20–25 % všech HNSCC. Identifikace miRNA spojených s HPV-pozitivitou by mohla v budoucnu pomoci s objevením terapeutických cílů u HPV-indukovaných nádorů. Lajer et al. (38) ve své studii sledovali změny v expresi miRNA mezi HPV-pozitivní a HPV-negativní HNSCC tkání. MiRNA profil u HPV pozitivní tkáně se výrazně lišil od negativní tkáně. Identifikovali několik miRNA, které se účastní HPV patogeneze, a to miR-15a/miR-16/, miR-143/miR-145 a miR-106-363 klastr. Gao et al. (39) identifikovali 5 miRNA, které korelovaly s transkripční aktivitou HPV: miR-9, mi-31, miR-223, miR-155 a miR-18a. K dalším poznatkům dospěli Wald et al. (40), kteří hledali expresní miRNA profil u HPV16-pozitivních HNSCC buněčných linií. Identifikovali 3 miRNA, jež byly upregulované v HPV-pozitivní tkáni: miR-363, miR-497, miR-33, a 8 miRNA, které byly ve stejné tkáni downregulované: miR-155, miR-181a, miR-181b, miR-29a, miR-218, miR-22, miR-221 a miR-142-5p. Hui et al. (41) naopak asociovali s HPV/p16 statusem upregulované miRNA: miR-20b a miR-9.
Expozice látkám uvolňovaných při žvýkání nebo kouření tabáku patří k rizikovým faktorům vzniku nádorů hlavy a krku především v oblasti dutiny ústní a okolí. Ukázalo se, že tabákové výrobky mohou ovlivňovat profil exprese miRNA. Jednou z miRNA, u které dochází k downregulaci v důsledku vystavení tabáku u OSCC, je miR-145. Tato miRNA je umlčována hypermethylací a regulována proteinem p53 v důsledku expozice cigaretovému kouři (42). Nikotin naproti tomu v tkáních zvyšuje expresi miR-9, což je represor E-kadherinu, který účastní se kontroly migrace a proliferace buněk (43).
Závěr
Posttranskripční modifikace pomocí miRNA hrají důležitou roli v patogenezi různých nádorových onemocnění, a to i tumorů hlavy a krku. V různých studiích byly prokázány rozdíly v úrovni exprese jednotlivých miRNA mezi zdravou a nádorovou tkání. Nádory hlavy a krku jsou díky anatomicky komplexní stavbě oblasti a složitým vzorcům postupu nádoru obtížně léčitelné, proto je důležité hledat alternativní terapie.
MiRNA se snadno izolují z krve, ze séra nebo tkání po biopsii a nepodléhají přílišné degradaci, proto jsou vhodnými kandidáty pro využití jakožto biomarkery nejen pro nádorová, ale i pro další onemocnění. Navíc by mohly být vyvinuty specifické terapie, jejichž cílem by bylo inhibovat nebo napodobovat specifické miRNA a regulovat tak vývoj choroby.
Přestože se mnoho vědeckých týmů věnuje sledování změn v expresi miRNA u nádorů hlavy a krku, u tkání sinonazálního karcinomu byla doposud identifikována pouze jedna miRNA (mi-34a), která by mohla sloužit jako prognostický marker tohoto onemocnění. U nádorů v sinonazální oblasti by mohl být cílem výzkumu profil exprese mikroRNA souvisejících s invazivností a tvorbou metastáz, fungujících jako onkogeny a asociovaných s HPV statutem a kouřením u nádorů hlavy a krku.
Seznam zkratek
Ago2 protein Argonaute2
CDDP cis-diaminodichlorplatina
CLL chronická lymfocytová leukemie
CpG dinukleotid cytosin‑guanin
eIF4A eukaryotický iniciační faktor 4a
EMT epitelově-mezenchymový transfer
Exp5 exportin-5
HGF hepatocytový růstový faktor
HNC nádory hlavy a krku
HNSCC karcinom dlaždicového epitelu hlavy a krku
HPV lidský papilomavirus
HPV‑HR high risk lidský papilomavirus
ITAC sinonazální adenokarcinom intestinálního typu
MANEC smíšený adenoneuroendokrinní karcinom
miRNA mikroRNA
MS-MLPA methylation-specific multiplex ligation-dependent probe amplification
OPSCC orofaryngeální karcinom dlaždicového epitelu
OSCC karcinom dlaždicového epitelu dutiny ústní
pre‑miRNA prekurzorová mikroRNA
pri‑miRNA primární transkript mikroRNA
RISC RNA-induced silencing complex
SNC karcinom dutiny nosní a vedlejších dutin nosních
SNUC nediferencovaný sinonazální karcinom
SpCC sarkomatoidní karcinom hlavy a krku
SSCC sinonazální karcinom dlaždicového epitelu
TRBP transactivating response RNA-binding protein
UTR nepřekládaná oblast mRNA
Korespondenční adresa
Ing. Helena Kovaříková
Ústav klinické biochemie a diagnostiky Lékařské fakulty UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
Tel.: 495 833 864
e-mail: kovarikovahe@lfhk.cuni.cz
Sources
1. Andreghetto FM, Klingbeil MFG, Soares RM et al. Evaluation of microRNA expression in head and neck squamous cell carcinoma cell lines and in primary culture of oral keratinocytes. Einstein (São Paulo) 2011; 9(4): 442−448.
2. Van Dijk BA, Gatta G, Capocaccia R et al. Rare cancers of the head and neck area in Europe. Eur J Cancer 2012; 48(6): 783−796.
3. Sharma A, Jagadesan P, Chaudhari P et al. Six years analysis of compliance to weekly Concurrent Chemo-Radiotherapy in Head and Neck Carcinomas. Clin Otolaryngol 2015 Nov 2; doi: 10.1111/coa.12580.
4. Hashibe M, Brennan P, Chuang SC et al. Interaction between tobacco and alcohol use and the risk of head and neck cancer: pooled analysis in the International Head and Neck Cancer Epidemiology Consortium. Cancer Epidemiol Biomarkers Prev 2009; 18(2): 541−550.
5. Joshi P, Dutta S, Chaturvedi P, Nair S. Head and neck cancers in developing countries. Rambam Maimonides Med J 2014 Apr 28; 5(2): e0009; doi: 10.5041/RMMJ.10143.
6. SVOD: Epidemiologie nádorů v České republice. URL: www.svod.cz/analyse.php?modul=incmor#
7. Batsakis JG, Rice DH, Solomon AR. The pathology of head and neck tumors: squamous and mucous-gland carcinomas of the nasal cavity, paranasal sinuses, and larynx, part 6. Head Neck Surg 1980; 2(6): 497−508.
8. Cerilli LA, Holst VA, Brandwein MS et al. Sinonasal undifferentiated carcinoma: immunohistochemical profile and lack of EBV association. Am J Surg Pathol 2001; 25(2): 156−163.
9. Musy PY, Reibel JF, Levine PA. Sinonasal undifferentiated carcinoma: the search for a better outcome. Laryngoscope 2002; 112(8 Pt 1): 1450−1455.
10. t Mannetje A, Kogevinas M, Luce D et al. Sinonasal cancer, occupation, and tobacco smoking in European women and men. Am J Ind Med 1999; 36(1): 101−107.
11. Alos L, Moyano S, Nadal A et al. Human papillomaviruses are identified in a subgroup of sinonasal squamous cell carcinomas with favorable outcome. Cancer 2009; 115(12): 2701−2709.
12. Syrjanen K, Syrjanen S. Detection of human papillomavirus in sinonasal carcinoma: systematic review and meta-analysis.Hum Pathol 2013; 44(6): 983−991.
13. Laco J, Sieglova K, Vosmikova H et al. The presence of high-risk human papillomavirus (HPV) E6/E7 mRNA transcripts in a subset of sinonasal carcinomas is evidence of involvement of HPV in its etiopathogenesis. Virchows Arch 2015.
14. Mensi C, Consonni D, Sieno C et al. Sinonasal cancer and occupational exposure in a population-based registry. Int J Otolaryngol 2013 : 672621; doi: 10.1155/2013/672621.
15. Pérez-Escuredo J, Martínez JG, Vivanco B et al. Wood dust–related mutational profile of TP53 in intestinal-type sinonasal adenocarcinoma. Hum Pathol 2012; 43(11): 1894−1901.
16. Esteller M, Epigenetics in cancer. N Engl J Med 2008; 358(11): 1148−1159.
17. Laurent L, Wong E, Li G et al. Dynamic changes in the human methylome during differentiation. Genome Res 2010; 20(3): 320−331.
18. Jones PA, Baylin SB. The Epigenomics of Cancer. Cell 2007; 128(4): 683−692.
19. He X, Chang S, Zhang J et al.Methy Cancer: the database of human DNA methylation and cancer. Nucleic Acids Res 2008; 36: D836−D841.
20. Strahl BD, Allis CD. The language of covalent histone modifications. Nature 2000; 403(6765): 41−45.
21. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75(5): 843−854.
22. Homo sapiens miRNAs (1881 sequences) [GRCh38]. URL: www.mirbase.org/cgi-bin/mirna_summary.pl?org=hsa
23. Wong N, Wang X. miRDB: an online resource for microRNA target prediction and functional annotations. 2015.
24. Lee Y, Jeon K, Lee JT et al. MicroRNA maturation: stepwise processing and subcellular localization. Embo J 2002; 21(17): 4663−4670.
25. Lund E, Dahlberg JE. Substrate selectivity of exportin 5 and Dicer in the biogenesis of microRNAs. Cold Spring Harb Symp Quant Biol 2006; 71 : 59−66.
26. Calin GA, Dumitru CD, Shimizu M et al. Frequent deletions and down-regulation of micro - RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci USA 2002; 99(24): 15524−15529.
27. Lu J, Getz G, Miska EA et al. MicroRNA expression profiles classify human cancers. Nature 2005; 435(7043): 834−838.
28. Ogawa T, Saiki Y, Shiga K et al. miR-34a is downregulated in cis‑diamminedichloroplatinum treated sinonasal squamous cell carcinoma patients with poor prognosis. Cancer Science 2012; 103(9): 1737−1743.
29. Tamagawa S, Beder LB, Hotomi M et al. Role of miR-200c/miR-141 in the regulation of epithelial-mesenchymal transition and migration in head and neck squamous cell carcinoma. Int J Mol Med 2014; 33(4): 879−886.
30. Susuki D, Kimura S, Naganuma S et al. Regulation of microRNA expression by hepatocyte growth factor in human head and neck squamous cell carcinoma. Cancer Sci 2011; 102(12): 2164−2171.
31. Kalfert D, Pesta M, Kulda V et al. MicroRNA profile in site-specific head and neck squamous cell cancer. Anticancer Res 2015; 35(4): 2455−2463.
32. Jensen DH, Dabelsteen E, Specht L et al. Molecular profiling of tumour budding implicates TGFbeta-mediated epithelial-mesenchymal transition as a therapeutic target in oral squamous cell carcinoma. J Pathol 2015; 236(4): 505−516.
33. Zidar N, Bostjancic E, Gale N et al. Down-regulation of microRNAs of the miR-200 family and miR-205, and an altered expression of classic and desmosomal cadherins in spindle cell carcinoma of the head and neck-hallmark of epithelial-mesenchymal transition. Hum Pathol 2011; 42(4): 482−488.
34. Bufalino A, Cervigne NK, de Oliveira CE et al. Low miR-143/miR-145 cluster levels induce activin A overexpression in oral squamous cell carcinomas, which contributes to poor prognosis. PLoS One 2015; 10(8): e0136599.
35. Yan B, Li H, Yang X et al. Unraveling regulatory programs for NF-kappaB, p53 and microRNAs in head and neck squamous cell carcinoma. PLoS One 2013; 8(9): e73656.
36. Sun Z, Li S, Kaufman AM et al. miR-21 increases the programmed cell death 4 gene-regulated cell proliferation in head and neck squamous carcinoma cell lines. Oncol Rep 2015; 32 : 2283−2289.
37. Piao L, Zhang M, Xie X et al. Nanoparticle delivery of anti-microRNA-21 reduces the tumorigenicity of head-and-neck squamous cell carcinoma. Int J Radiat Oncol Biol Phys 2014; 88(2): 514−515.
38. Lajer CB, Garnæs E, Friis-Hansen L et al. The role of miRNAs in human papilloma virus (HPV)-associated cancers: bridging between HPV-related head and neck cancer and cervical cancer. Br J Cancer 2012; 106(9): 1526−1534.
39. Gao G, Gay HA, Chernock RD et al. A microRNA expression signature for the prognosis of oropharyngeal squamous cell carcinoma. Cancer 2013; 119(1): 72−80.
40. Wald AI, Hoskins EE, Wells SI et al. Alteration of microRNA profiles in squamous cell carcinoma of the head and neck cell lines by human papillomavirus. Head Neck 2011; 33(4): 504−512.
41. Hui AB, Lin A, Xu W et al. Potentially prognostic miRNAs in HPV-associated oropharyngeal carcinoma. Clin Cancer Res 2013; 19(8): 2154−2162.
42. Pal A, Melling G, Hinsley EE et al. Cigarette smoke condensate promotes pro-tumourigenic stromal-epithelial interactions by suppressing miR-145. J Oral Pathol Med 2013; 42(4): 309−314.
43. Yu MA, Kiang A, Wang-Rodriguez J et al. Nicotine promotes acquisition of stem cell and epithelial-to-mesenchymal properties in head and neck squamous cell carcinoma. PLoS One 2012; 7(12): e51967.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Připomenutí osobnosti profesora Bohumila Prusíka
- Úloha bilirubinu v prevenci kardiovaskulárních a nádorových onemocnění
- Desaturázy mastných kyselin: patofyziologie a klinický význam
- Hodnocení a léčba portální hypertenze
- Prevence kolorektálního karcinomu
- Vývoj znalostí o idiopatických střevních zánětech
- Realimentační syndrom
- History of the 4th Department of Internal Medicine of the First Faculty of Medicine at Charles University and the General University Hospital in Prague
- Role mikroRNA u nádorů hlavy a krku se zaměřením na sinonazální karcinom
- Česká sekce International College of Surgeons a Jubilejní světový chirurgický kongres
- Prof. Gunn − remarkable 90th birthday jubilee
- 85th anniversary of professor Eugen Strouhal
- Odešel lékař, vědec a muzikant, profesor Jiří Tichý
- Zemřel profesor František Kölbel
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hodnocení a léčba portální hypertenze
- Realimentační syndrom
- Desaturázy mastných kyselin: patofyziologie a klinický význam
- Česká sekce International College of Surgeons a Jubilejní světový chirurgický kongres
