Role umělé inteligence v časném záchytu ložiskových změn plicního parenchymu při rtg vyšetření hrudníku: zkušenosti z retrospektivních studií na české populaci
Artificial intelligence’s contribution to early pulmonary lesion detection in chest X-rays: insights from two retrospective studies on a Czech population
In recent years healthcare is undergoing significant changes due to technological innovations, with Artificial Intelligence (AI) being a key trend. Particularly in radiodiagnostics, according to studies, AI has the potential to enhance accuracy and efficiency. We focus on AI’s role in diagnosing pulmonary lesions, which could indicate lung cancer, based on chest X-rays. Despite lower sensitivity in comparison to other methods like chest CT, due to its routine use, X-rays often provide the first detection of lung lesions.
We present our deep learning-based solution aimed at improving lung lesion detection, especially during early-stage of illness. We then share results from our previous studies validating this model in two different clinical settings: a general hospital with low prevalence findings and a specialized oncology center. Based on a quantitative comparison with the conclusions of radiologists of different levels of experience, our model achieves high sensitivity, but lower specificity than comparing radiologists.
In the context of clinical requirements and AI-assisted diagnostics, the experience and clinical reasoning of the doctor play a crucial role, therefore we currently lean more towards models with higher sensitivity over specificity. Even unlikely suspicions are presented to the doctor. Based on these results, it can be expected that in the future artificial intelligence will play a key role in the field of radiology as a supporting tool for evaluating specialists. To achieve this, it is necessary to solve not only technical but also medical and regulatory aspects. It is crucial to have access to quality and reliable information not only about the benefits but also about the limitations of machine learning and AI in medicine.
Keywords:
artificial intelligence, deep learning, computer-aided diagnosis, chest X-ray, lung cancer, solitary pulmonary nodules, pulmonary masses
Authors:
Martin Černý 1,2; Daniel Kvak 1,3; Daniel Schwarz 4; Hynek Mírka 5; Jakub Dandár 1
Authors‘ workplace:
Carebot s. r. o.
1; Neurochirurgická a neuroonkologická klinika 1 LF UK a ÚVN Praha
2; Ústav simulační medicíny LF MU v Brně
3; Institut biostatistiky a analýz LF MU v Brně
4; Klinika zobrazovacích metod LF UK a FN Plzeň
5
Published in:
Čas. Lék. čes. 2023; 162: 283-289
Category:
Original Article
Overview
Zaměřujeme se na možné využití AI v rámci diagnostiky ložiskových změn plicního parenchymu, které mohou být projevem zhoubného nádoru plic, na základě skiagramu hrudníku. Ačkoliv ve srovnání s jinými metodami, především výpočetní tomografií (CT) hrudníku, tato modalita vykazuje nižší senzitivitu, vzhledem k rutinnímu provádění velmi často představuje první vyšetření, při němž jsou plicní léze zachyceny.
Prezentujeme vlastní řešení založené na metodách hlubokého učení, které má za cíl zvýšit záchyt plicních lézí především v časných fázích onemocnění. Následně uvádíme výsledky našich předchozích původních prací, které validují navržený model ve dvou odlišných klinických prostředích – v prostředí spádové nemocnice s nízkou prevalencí nálezů a v prostředí specializovaného onkologického centra. Na základě kvantitativního srovnání se závěry radiologů různých úrovní zkušeností jsme zjistili, že náš model dosahuje vysoké senzitivity, na druhou stranu byla jeho specificita nižší než u oslovených radiologů.
V kontextu klinických požadavků a diagnostiky asistované AI hraje zásadní roli zkušenost a klinické uvažování lékaře, proto se v současnosti přikláníme k modelům s vyšší senzitivitou na úkor nižší specificity. V případě suspekce, byť vyhodnocené jako nepravděpodobné, model nález raději předkládá lékaři. Na základě těchto výsledků lze očekávat, že v budoucnu bude AI hrát klíčovou roli v oblasti radiologie jako pomocný nástroj pro hodnotící specialisty. Aby k tomu mohlo dojít, je potřeba vyřešit nejen technické, ale i některé medicínské a regulatorní aspekty. Zásadní je dostupnost kvalitních a spolehlivých informací nejen o přínosech, ale také o limitacích možností strojového učení a AI v medicíně.
Klíčová slova:
umělá inteligence, hluboké učení, počítačem asistovaná diagnostika, skiagram hrudníku, nádory plic, solitární plicní uzly, plicní masy.
ÚVOD
V posledních letech zdravotnictví prochází výraznými změnami spojenými s exponenciálním růstem technologických inovací. Mezi nejvýznamnější trendy patří využití umělé inteligence (AI). Ta zásadně zasahuje do různých segmentů lékařského výzkumu, od návrhu léčiv přes robotické chirurgické zákroky až po počítačem asistovanou diagnostiku. Na základě výzkumů se zvláště v oboru radiodiagnostiky ukazuje, že AI má potenciál značně zvýšit její přesnost a efektivitu (1).
V diagnostice pomocí zobrazovacích metod vždy docházelo a dochází k chybám, jež mohou způsobit zpoždění v detekci a léčbě závažných onemocnění. Vzhledem ke komplexnosti interpretace obrazových dat je obtížné odlišit diagnostické chyby od názorové diskrepance mezi různými pozorovateli i při různých hodnocení jedním pozorovatelem. Obvykle uváděná míra diagnostických chyb dosahuje 3–5 %.
Studie naznačují, že až 22 % diagnostických chyb vznikne v souvislosti s hodnocením skiagramů hrudníku (2), jež patří mezi nejběžnější zobrazovací vyšetření. V roce 2020 bylo v Česku provedeno přibližně 2,5 milionu rtg vyšetření hrudníku, což z něj činí nejčastěji používanou radiodiagnostickou metodu hned po zubním rentgenu (3).
Přestože v naší zemi funguje od začátku roku 2022 program časného záchytu karcinomu plic pomocí low-dose CT (LDCT) u rizikové populace, právě rutinně prováděný skiagram hrudníku je často prvním vyšetřením, při němž jsou zachyceny ložiskové změny plicního parenchymu, které mohou být projevem nádorového onemocnění plic.
Epidemiologie
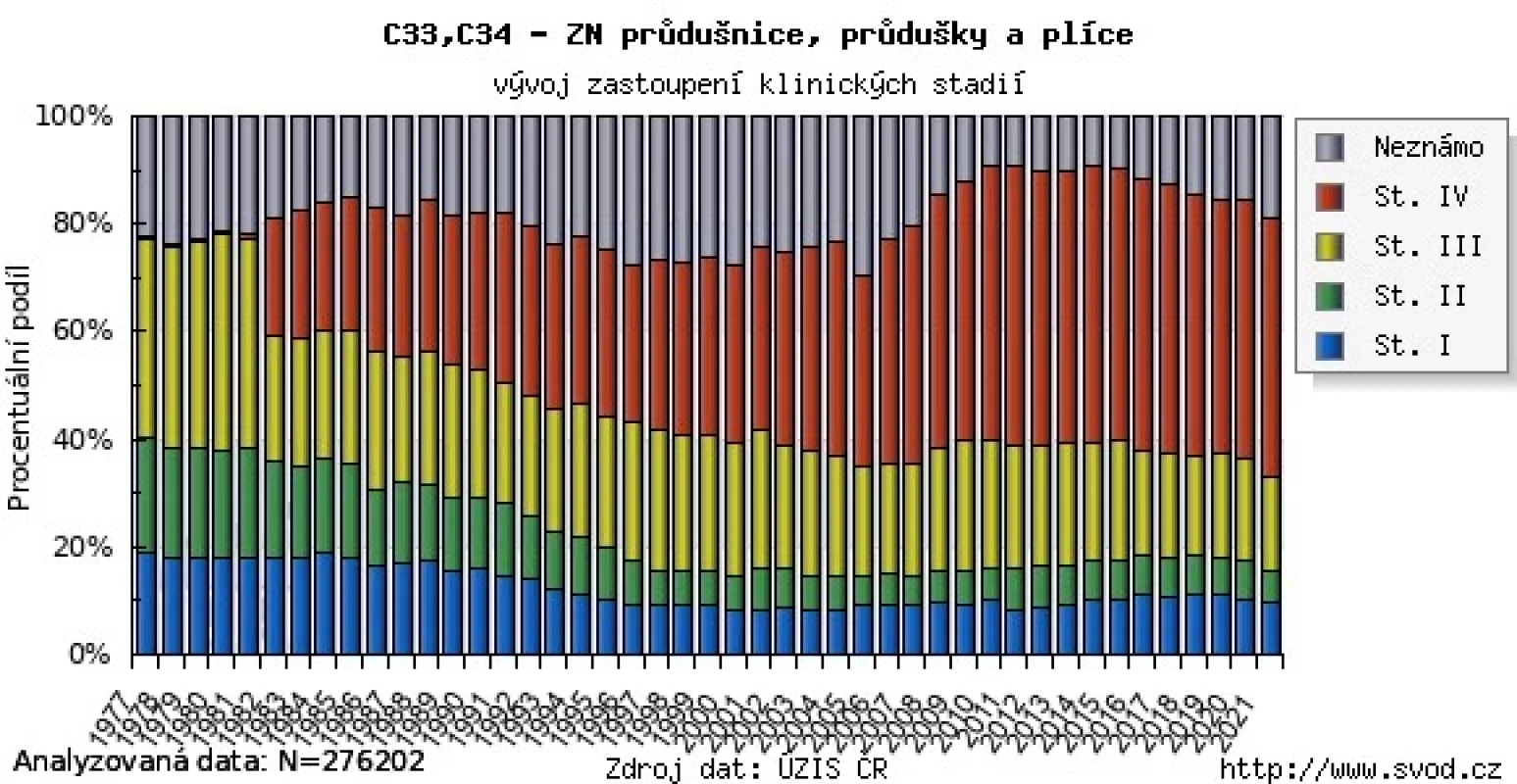
V Česku představuje karcinom plic jedno z nejčastějších onkologických onemocnění. Dle dat Národního onkologického registru (NOR) je ročně diagnostikováno cca 6700 nových případů (obr. 1) a přibližně 5300 pacientů onemocnění podlehne (4). U mužské populace je incidence i mortalita významně vyšší než u žen. Zatímco u mužů se však projevuje klesající trend v incidenci a mortalitě, u ženské populace naopak data ukazují vzrůstající trend incidence, kdy v roce 2020 byl zaznamenán její nárůst o více než 34 % ve srovnání s rokem 2011. U mužů tento nárůst činil 17 % a u žen až 67 % (4). V Česku je bohužel většina nově diagnostikovaných pacientů v pokročilém klinickém stadiu III nebo IV (5).
Nález a diagnostika
Nádory plic mají na skiagramu hrudníku nejčastěji vzhled plicního uzlu, tedy kulovitého stínu, který je ostře nebo neostře ohraničený oproti okolní tkáni. Ložiska se mohou výrazně lišit svou velikostí; obecně platí, že menší uzly jsou spíše benigní, zatímco větší spíše maligní. U uzlů menších než 4 mm je pravděpodobnost malignity < 1 %, pro 4–7 mm je to 0,9 %, pro 8–20 mm pak 18 % a pro uzly 20–30 mm již 50 % (6).
Ačkoliv je skiagram hrudníku často prvním vyšetřením, při němž jsou zachyceny ložiskové změny plicního parenchymu, senzitivita tohoto vyšetření je poměrně nízká. Velmi nízký je záchyt uzlů velikosti < 5 mm a přibližně 50 % záchyt se uvádí u uzlů velikosti 6–10 mm, mohou však být přehlédnuta i výrazně větší ložiska (7, 8, 9). Mnohem přesnější metodou je jistě výpočetní tomografie (CT), u níž senzitivita samotné vyšetřovací metody dosahuje až 95 % v případě lézí < 5 mm, odečítajícím radiologem jsou však zachyceny jen v 60–70 % případů v závislosti na velikosti uzlů, zkušenostech odečítajícího a časovém tlaku (10, 11).
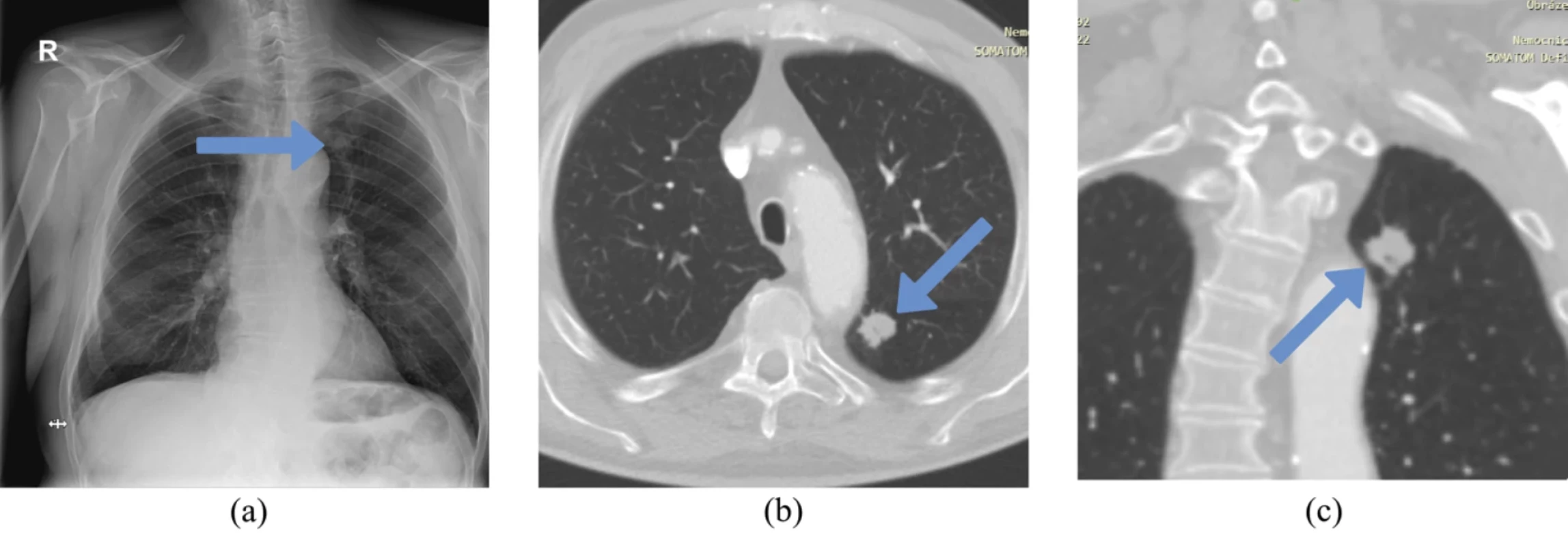
Právě časný záchyt nádoru plic v rané fázi je zásadní pro další průběh onemocnění a prognózu pacienta. Obr. 2 demonstruje případ karcinomu plic, který se na skiagramu manifestuje velmi diskrétně a je spojen s vysokým rizikem přehlédnutí. Na základě doplněného CT je pak nález mnohem jasnější.
Systémy založené na umělé inteligenci mohou významně pomoci při identifikaci a popisu plicních uzlů a nabízejí tak okamžitý druhý názor (12). Software může asistovat lékařům, zejména juniorním radiologům, při interpretaci rentgenových snímků, a výrazně tak přispět k identifikaci nádoru či jiných patologických změn. V následujícím textu navrhujeme řešení založené na metodách hlubokého učení (deep learning) a prezentujeme výsledky validace našeho řešení v prostředí běžného klinického provozu s nízkou prevalencí nálezů a v prostředí specializovaného onkologického centra.
NAVRHOVANÉ ŘEŠENÍ ZALOŽENÉ NA METODÁCH HLUBOKÉHO UČENÍ
K predikci ložiskových změn plicního parenchymu jsme navrhli model založený na metodách hlubokého učení. Náš software je schopný vyhodnocovat skiagramy hrudníku v zadopřední (PA) i předozadní (AP) projekci a slouží k automatické detekci zásadních radiologických nálezů, mezi které patří atelektáza, rozšíření srdečního stínu, pneumotorax, ložiskové změny plicního parenchymu, zastření plicní tkáně, pleurální výpotek a podkožní emfyzém. Následující text se věnuje pouze testování spolehlivosti predikce ložiskových změn.
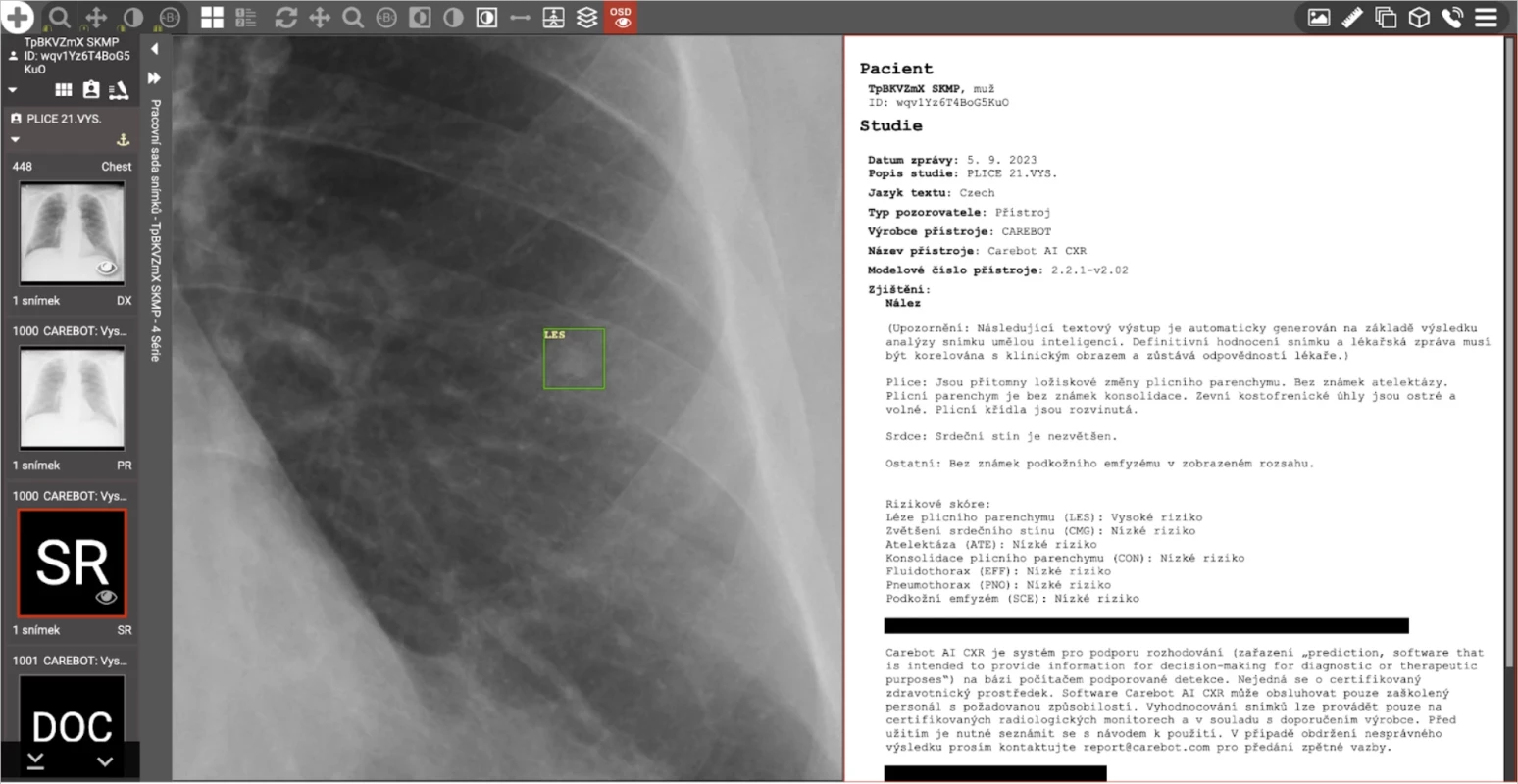
Pro snadnou integraci do procesů na radiologických pracovištích naše řešení spolupracuje s dalšími běžně užívanými periferiemi včetně protokolů DICOMweb a DICOM C-STORE, úložišť PACS a formáty DICOM SR a DICOM PR (obr. 3).
Architektura modelu
Pro identifikaci podezřelých lézí na skiagramu hrudníku je využita architektura YOLO (13). Tento přístup k detekci objektů nabízí klíčovou výhodu – schopnost přesně identifikovat i malé plicní léze, což je problematika, kde tradiční konvoluční neuronové sítě selhávají kvůli prostorovým omezením. Základní princip architektury YOLO spočívá v predikci ohraničujících rámečků (tzv. bounding boxes) pro jednotlivé třídy nálezů na základě rozpoznávání vizuálních vzorců spolu s pravděpodobností, podle čehož jsou pak vybrány nejpravděpodobnější nálezy.
Tréninková data
Při vývoji navrhovaného modelu bylo využito celkem 25 374 rentgenových snímků hrudníku v PA nebo AP projekci z klinických center v Evropě, Asii a Severní Americe. Data byla retrospektivně sesbírána společností Carebot z cílových spolupracujících pracovišť v plně anonymizované podobě. Snímky byly následně vyhodnoceny týmem 27 radiologů s praxí v rozmezí 1 až více než 10 let spolupracujících se společností Carebot.
Kompletní tréninkový dataset obsahoval 12 149 snímků s vizuálně potvrzenými patologiemi a 13 225 snímků bez abnormalit nebo s nevýznamnými patologickými nálezy. Na základě tohoto datasetu byl vytvořen prediktivní model pro detekci a lokalizaci jednotlivých patologií.
TESTOVÁNÍ AI V PROSTŘEDÍ BĚŽNÉHO KLINICKÉHO PROVOZU S NÍZKOU PREVALENCÍ NÁLEZŮ
K ověření přesnosti našeho modelu jsme využili data z běžného klinického provozu spádového pracoviště. Modely strojového učení bývají často validovány v experimentálních podmínkách vyvážených datasetů (tzn. srovnatelný poměr patologických i normálních vzorků). To však neodpovídá skutečné klinické praxi, kdy je prevalence nálezů nízká, ovšem nezachycení nálezu (falešná negativita) je mnohem závažnějším problémem než falešná pozitivita. Tomu musí odpovídat i vyvážení senzitivity a specificity daného modelu. Níže uvádíme shrnutí naší předchozí studie v recenzovaném časopisu Diagnostics (14).
Sběr dat
Do studie byli prospektivně zařazeni pacienti, kteří podstoupili rtg vyšetření hrudníku v období od 18. října do 17. listopadu 2022 na radiodiagnostickém oddělení Nemocnice Havířov. Na oddělení bylo ve výše uvedeném období provedeno celkem 1073 rentgenových snímků hrudníku. Po vyloučení snímků pacientů ve věku < 18 let, laterálních projekcí a nedostatečné technické kvality bylo identifikováno celkem 956 relevantních rtg snímků.
Popis snímků
2 zkušení lékaři (vedoucí radiodiagnostických pracovišť s více než 20letou zkušeností v oboru) zhodnotili shromážděné snímky s přihlédnutím ke klinickým informacím o pacientech a dalším výsledkům zobrazovacích metod (rtg s odstupem, CT). V 901 případech došli k diagnostické shodě, z toho v 21 z nich identifikovali 1 či více lézí plicního parenchymu (prevalence 2,3 %), zatímco 880 snímků žádné plicní léze neobsahovalo. Tato shoda byla následně považována za základní pravdu.
6 radiologů s různou úrovní zkušeností (2 absolventi, 2 lékaři s kmenem, 2 lékaři s atestací) bylo dále požádáno o popis těchto snímků. Snímky byly zároveň popsány naším prediktivním modelem.
Výsledky
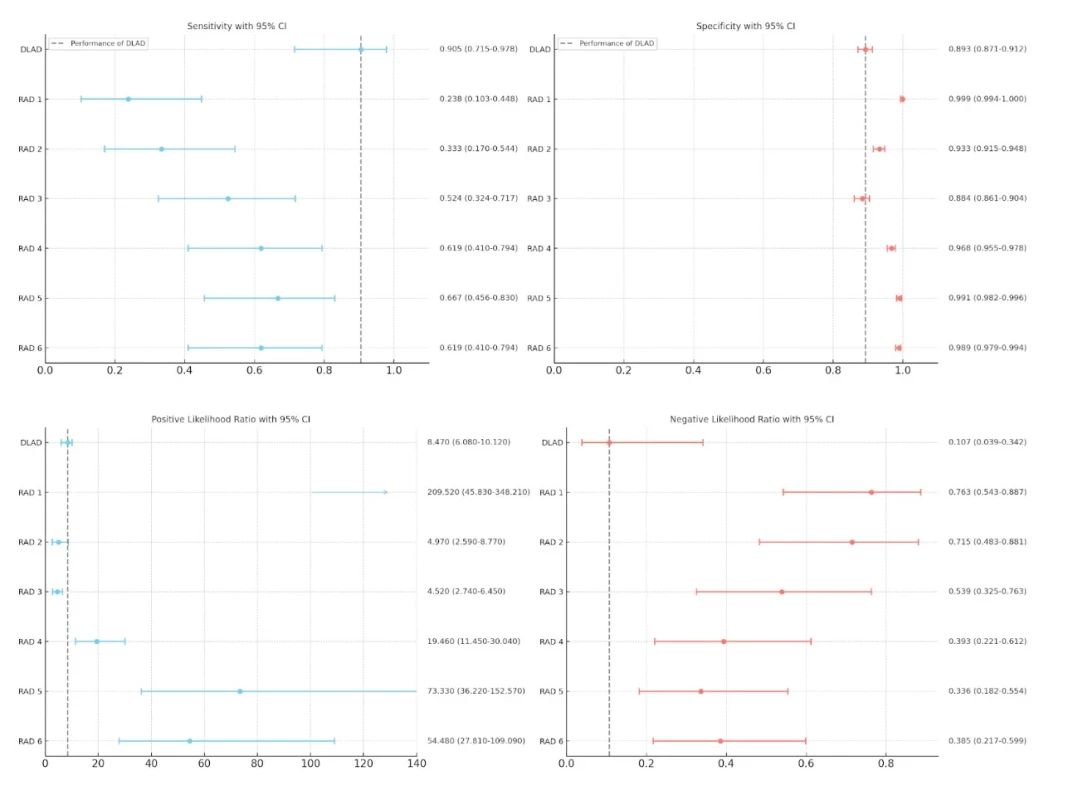
Navržený systém identifikoval ložiskové změny plicního parenchymu v 19 případech z 21 snímků s patologickým nálezem, a dosáhl tak významně vyšší senzitivity (90,5 %) než všichni popisující radiologové (RAD 1 23,8 %, p < 0,001; RAD 2 33,3 %, p < 0,001; RAD 3 52,4 %, p < 0,001; RAD 4 61,9 %, p < 0,001; RAD 5 66,7 %, p < 0,001; RAD 6 61,9 %, p < 0,001).
Systém chybně identifikoval plicní léze v 94 případech z 880 snímků s fyziologickým nálezem, a dosáhl tak významně nižší specificity (89,3 %) než 5 ze 6 popisujících radiologů (RAD 1 99,9 %, p < 0,001; RAD 2 93,3 %, p < 0,001; RAD 3 88,4 %, p = 0,685; RAD 4 96,8 %, p < 0,001; RAD 5 99,1 %, p < 0,001; RAD 6 98,9 %, p < 0,001).
Obr. 4 porovnává sledované parametry (senzitivita, specificita, pozitivní a negativní poměr pravděpodobnosti) našeho modelu a hodnotících radiologů.
TESTOVÁNÍ AI VE SPECIALIZOVANÉM ONKOLOGICKÉM CENTRU
Specifickým případem je využití umělé inteligence v prostředí specializovaného pracoviště soustřeďujícího péči o pacienty s určitým onemocněním. Vzhledem k tomu, že distribuce a charakter nálezů se může lišit od běžné populace a tréninkových dat, je třeba ověřit výsledky zvlášť i na této populaci. Následující text shrnuje naše poznatky získané na populaci pacientů specializovaného onkologického centra (15).
Sběr dat
Do studie byly retrospektivně zařazeny skiagramy hrudníku provedené od června 2020 do července 2021 v Masarykově onkologickém ústavu v Brně. Vyloučeny byly snímky pacientů ve věku < 18 let, laterální projekce a snímky nedostatečné technické kvality. Snímky byly náhodně vybrány tak, že 100 jich obsahovalo lézi plicního parenchymu, 100 obsahovalo jinou patologii a 100 bylo bez patologického nálezu.
Popis snímků
3 lékaři (vedoucí lékař radiodiagnostického pracoviště s více než 10 lety zkušeností v oboru, atestovaný radiolog s více než 5 lety zkušeností v oboru, neatestovaný radiolog s méně než 5 lety zkušeností v oboru) na shromážděných snímcích hodnotili přítomnost některé ze 12 patologií (ložiskové změny plicního parenchymu, atelektáza, rozšíření srdečního stínu, pneumothorax, zastření plicní tkáně, pleurální výpotek, podkožní emfyzém, rozšíření mediastina, pneumoperitoneum, plicní edém, rozšíření hilových struktur). V případě shody minimálně 2 ze 3 lékařů byla příslušná patologie na snímku potvrzena. Naopak absence patologie byla potvrzena při shodě všech 3 hodnotících lékařů. V případě neshody, kdy 1 lékař potvrdil patologii a 2 nepotvrdili, byl snímek z hodnocení vyřazen.
5 radiologů s různou úrovní zkušeností (2 absolventi, 1 lékař s kmenem, 2 lékaři s atestací) bylo následně požádáno o popis takto sestavených snímků. Snímky byly zároveň popsány naším prediktivním modelem.
Výsledky
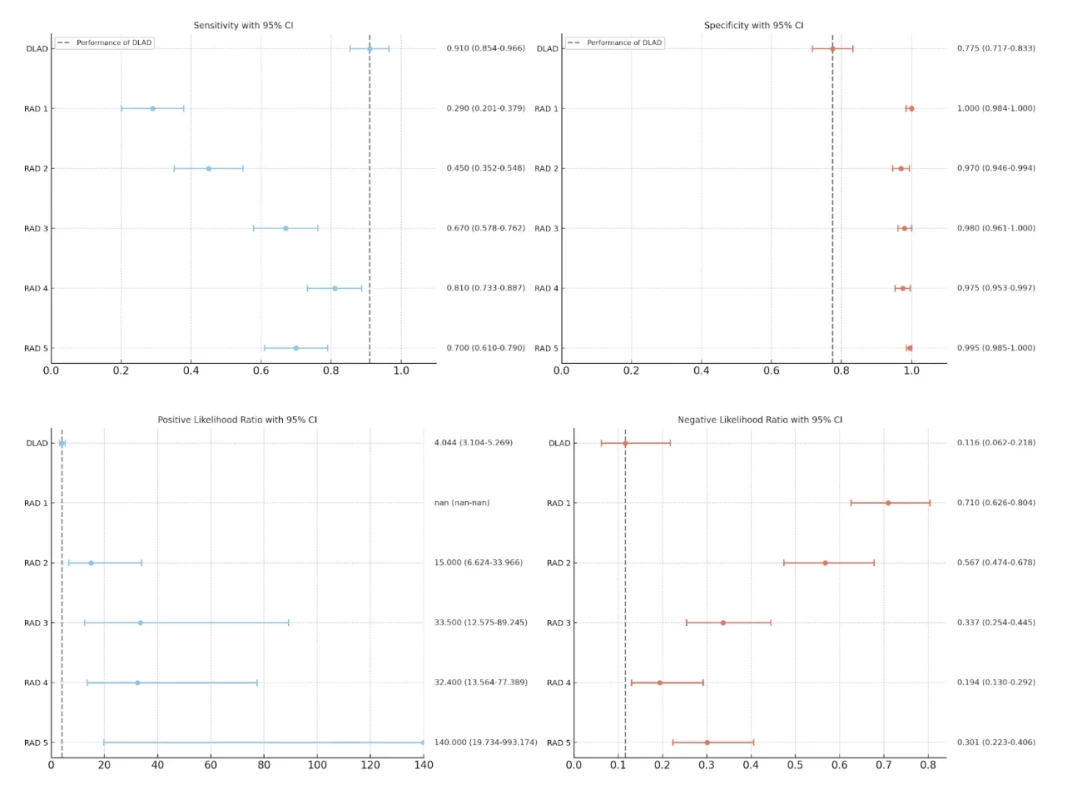
Náš systém identifikoval ložiskové změny plicního parenchymu v 91 případech, a dosáhl tak statisticky významně vyšší senzitivity (91 %) než všichni srovnávaní radiologové (RAD 1 : 29 %, p < 0,001; RAD 2 : 45 %, p < 0,001; RAD 3 : 67 %, p < 0,001; RAD 4 : 81 %, p = 0,025; RAD 5 : 70 %, p < 0,001).
Dále náš systém chybně identifikoval plicní léze v 45 případech, a dosáhl tak statisticky významně nižší specificity (89,3 %) než všichni popisující radiologové (RAD 1 : 100 %, p < 0,001; RAD 2 : 97 % p < 0,001; RAD 3 : 98 %, p < 0,001; RAD 4 : 97,5 %, p < 0,001; RAD 5 : 99,5 %, p < 0,001).
Obr. 5 porovnává sledované parametry (senzitivita, specificita, pozitivní poměr pravděpodobnosti, negativní poměr pravděpodobnosti) našeho modelu a hodnotících radiologů.
DISKUSE
Modely umělé inteligence prokazují velký potenciál v oblasti radiologie, zejména v detekci patologických nálezů. Na příkladu 2 publikovaných studií z různých klinických prostředí s odlišnými charakteristikami (14,15) jsme hodnotili přesnost našeho softwaru pro analýzu skiagramů hrudníku. V obou studiích AI model ukázal významně vyšší senzitivitu v detekci patologických nálezů v porovnání s radiology. Naopak specificita algoritmu byla v porovnání s nimi ve většině případů nižší. Z našeho pozorování vyplynulo, že jako plicní léze systém nejčastěji chybně klasifikoval různé sumace tkání, struktury plicního hilu, degenerativní změny skloubení žeber, sterna a hrudní páteře, bradavky, EKG elektrody a abnormality v tvaru srdečního stínu.
Tyto výsledky musejí být interpretovány v kontextu klinických požadavků a diagnostiky asistované AI (16). Zde je zásadní, že primární roli stále hrají zkušenosti a klinické uvažování lékaře. Ten hodnotí a interpretuje snímek na základě svého odborného úsudku s přihlédnutím k informacím získaným od umělé inteligence. Proto se v současnosti přikláníme k modelům s vyšší senzitivitou na úkor nižší specificity. V případě nejasné suspekce je tak nález raději předložen lékaři (17), ten je poučen o tomto nastavení modelu a možnosti falešně pozitivních výstupů a rozhoduje se, zda s nálezem souhlasí, či ne. Asistenční software tak vytváří určitou preselekci možných nálezů. Díky tomu je výhodné, že jsou modely hlubokého učení schopné dosahovat vysoké senzitivity oproti lékařům. Zároveň využívání algoritmů AI může zvýšit rychlost a celkovou efektivitu hodnoticího procesu, kdy potvrzení jasné léze nebo naopak odmítnutí jasně falešně pozitivního nálezu je pro hodnotícího lékaře většinou velmi jednoduché.
V publikovaných studiích jsme hodnotili pouze schopnost systému detekovat ložiskové změny plicního parenchymu. Ty mohou být projevem karcinomu plic, může se ovšem jednat i o jiné procesy, například sekundární nádory, benigní nádory nebo granulomy. Tuto komplexnost problematiky je třeba zohledňovat při vývoji systémů AI a návrhu dalších studií posuzujících jejich spolehlivost.
Na základě těchto výsledků lze očekávat, že v budoucnu bude umělá inteligence hrát klíčovou roli v oblasti radiologie jako pomocný nástroj pro hodnotící specialisty. V dlouhodobém horizontu by mohly být modely AI integrovány do klinických systémů a automaticky analyzovat snímky v reálném čase, což by mohlo přispět ke zlepšení kvality péče o pacienty i k řešení kapacitních problémů zdravotního systému (18). Aby k tomu však mohlo dojít, je nejdříve nutné adresovat nejen technické, ale i některé medicínské a regulatorní aspekty. Zásadní je dostupnost kvalitních a spolehlivých informací nejen o přínosech, ale také o limitacích možností strojového učení v medicíně (19). Věříme, že další výzkum v této oblasti nám umožní lepší využití AI, ze kterého v konečném důsledku budou profitovat pacienti i zdravotničtí profesionálové.
ZÁVĚR
V článku prezentujeme náš pohled na potenciální roli umělé inteligence v časném záchytu ložiskových změn plicního parenchymu na základě skiagramu hrudníku. Předkládáme vlastní řešení založené na metodách hlubokého učení a na 2 původních retrospektivních studiích demonstrujeme přesnost navrženého modelu. Model v obou studiích dosahuje vysoké senzitivity a nižší specificity ve srovnání s radiology. Zdůrazňujeme důležitost kombinace AI s klinickým úsudkem lékařů a potřeba dalšího výzkumu a integrace AI do klinické praxe.
Čestné prohlášení
Vznik tohoto článku a 2 původních studií, které shrnuje, byl podpořen společností Carebot, která vyvíjí hodnocený systém pro analýzu skiagramů hrudníku. Martin Černý a Daniel Kvak jsou zaměstnanci společnosti Carebot. Žádný z dalších spoluautorů nemá žádný konflikt zájmů.
Role spoluautorů
Martin Černý zpracoval většinu částí tohoto rukopisu. Daniel Kvak navrhl koncepci článku a napsal část rukopisu. Daniel Schwarz provedl výběr a vyhodnocení důležitých kvantitativních výsledků z původních studií. Hynek Mírka připomínkoval rukopis.
Adresa pro korespondenci:
MUDr. Jakub Dandár
Carebot s. r. o.
Rašínovo nábřeží 71/10, 128 00 Praha 2
e-mail: daniel.kvak@carebot.com
Sources
- Barreiro-Ares A, Morales-Santiago A, Sendra-Portero F et al. impact of the rise of artificial intelligence in radiology: What do students think? Int J Environ Res Public Health 2023; 20 (2): 1589.
- Donald J, Barnard S. Common patterns in 558 diagnostic radiology errors. J Med Imaging Radiat Oncol 2012; 56 : 173–178.
- Stručný přehled činnosti oboru radiologie a zobrazovací metody za období 2007–2020. ÚZIS, 2020. Dostupné na: www.uzis.cz/res/f/008333/nzis-rep-2020-k19-a049-radiologie-a-zobrazovaci-metody-2019.pdf
- Dušek L, Mužík J, Kubásek M a kol. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita, Brno. Dostupné na: www.svod.cz
- Májek O, Koziar Vašáková M, Čierna Peterová I a kol. Program časného záchytu karcinomu plic. PrevenceProPlice.cz. Dostupné na: www.prevenceproplice.cz
- Tang AW, Moss HA, Robertson RJ. The solitary pulmonary nodule. Eur J Radiol 2003; 45 (1): 69–77.
- Austin JH, Romney BM, Goldsmith LS. Missed bronchogenic carcinoma: radiographic findings in 27 patients with a potentially resectable lesion evident in retrospect. Radiology 1992; 182 (1): 115–122.
- Diederich S, Das M. Solitary pulmonary nodule: detection and management. Cancer Imaging 2006; 6 (Spec No A): S42–S46.
- Donald JJ, Barnard SA. Common patterns in 558 diagnostic radiology errors. J Med Imaging Radiat Oncol 2012; 56 (2): 173–178
- Diederich S, Semik M, Lentschig MG et al. Helical CT of pulmonary nodules in patients with extrathoracic malignancy: CT-surgical correlation. Am J Roentgenol 1999; 172 (2): 353–360.
- Fischbach F, Knollmann F, Griesshaber V et al. Detection of pulmonary nodules by multislice computed tomography: improved detection rate with reduced slice thickness. Eur Radiol 2003; 13 (10): 2378–2383.
- Kozuka T, Matsukubo Y, Kadoba T et al. Efficiency of a computer-aided diagnosis (CAD) system with deep learning in detection of pulmonary nodules on 1-mm-thick images of computed tomography. Jpn J Radiol 2020; 38 (11): 1052–1061.
- Redmon J, Divvala S, Girshick R et al. You only look once: unified, real-time object detection. 2016 IEEE Conference on Computer Vision and Pattern Recognition (CVPR), 2016 : 779–788.
- Kvak D, Chromcová A, Ovesná P et al. Detecting pulmonary lesions in low-prevalence real-world settings using deep learning. Lecture Notes in Electrical Engineering 2023; 4 (1): 454.
- Kvak D, Chromcová A, Hrubý R et al. Leveraging deep learning decision-support system in specialized oncology center: a multi-reader retrospective study on detection of pulmonary lesions in chest X-ray images. Diagnostics 2023; 13 (6): 1043.
- Giordano C, Brennan M, Mohamed B et al. Accessing artificial intelligence for clinical decision-making. Front Digit Health 2021; 3 : 645232.
- Shen J, Zhang CJP, Jiang B et al. Artificial intelligence versus clinicians in disease diagnosis: systematic review. JMIR Med Inform 2019; 7 (3): e10010.
- Blezek DJ, Olson-Williams L, Missert A et al. AI integration in the clinical workflow. J Digit Imaging 2021; 34 (6): 1435–1446.
- Kotter E, Ranschaert E. Challenges and solutions for introducing artificial intelligence (AI) in daily clinical workflow. Eur Radiol 2021; 31 (1): 5–7.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Úvodem
- Umělá inteligence v medicíně a zdravotnictví: Příležitost a/nebo hrozba?
- Využití umělé inteligence v zobrazovacích metodách
- Role umělé inteligence v časném záchytu ložiskových změn plicního parenchymu při rtg vyšetření hrudníku: zkušenosti z retrospektivních studií na české populaci
- Umělá inteligence ve screeningu diabetické retinopatie: od nápadu po zdravotnický prostředek v klinické praxi
- Jazykové modely mění svět akademických publikací. Je to dobře?
- Aktuální pohled na změny v reprodukčním chování v Česku
- Trendy plodnosti a potratovosti v Česku
- Změny v antikoncepčním chování populace v Česku
- Reprodukční plány žen v Česku v kontextu pozdního reprodukčního režimu a pandemie COVID-19
- Problémy s neplodností v kontextu reprodukčního stárnutí
- Věk nástupu menopauzy v závislosti na věku prvního porodu
- Otazníky a dotazníky kolem akutního klimakterického syndromu
- Praktické klinické doporučení pro perioperační péči v bariatrické chirurgii 2023
- Chirurgická a medikamentózní léčba dětské obezity
- MUDr. František Adamík – zakladatel otorinolaryngologie na Valašsku a průkopník ORL endoskopie
- Jmenování Jana Evangelisty Purkyně profesorem fyziologie ve Vratislavi
- Přehledné dějiny medicíny na českém území
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (DUBEN – ČERVEN 2024)
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Umělá inteligence v medicíně a zdravotnictví: Příležitost a/nebo hrozba?
- Trendy plodnosti a potratovosti v Česku
- Využití umělé inteligence v zobrazovacích metodách
- Otazníky a dotazníky kolem akutního klimakterického syndromu
