Přínos molekulární biologie v diagnostice a léčbě kolorektálního karcinomu – současnost a budoucnost
Contribution of Mollecular Biology to the Diagnosis and Therapy of Colorectal Carcinoma – The Present and Future
Colorectal cancer is one of the most frequent malignant disease and despite of the development of modern surgical and oncological treatment, it is still a very severe diagnosis for the patient. The survival of the patient after the radical surgery is mostly affected by the time of detection of the disease and by the selection of the appropriate oncological treatment. The effectivity of the oncological treatment depends mainly on the features of the malignant tissue. During the last decade, the importance of the molecular biology and it´s methodology have been growing for both detection of the disease and the selection of the best treatment for the individual patient. Genetic and epigenetic characteristics of the tumours helps to predict the prognosis of the disease and also select the best treatment, which extends the disease-free and overall survival of the patient. The presented review describes the most important molecular-biological characteristics with the prognostic or predictive function, which are used in the clinical practice or are in the later phase of clinical study.
Key words:
colorectal neoplasms – molecular biology methods – prognostic factors – predictive factors
Authors:
P. Pitule; V. Liška; V. Třeška; P. Novák; M. Čedíková *; M. Králíčková *
Authors‘ workplace:
Chirurgická klinika LF UK a FN v Plzni, přednosta: prof. MUDr. Vladislav Třeška, DrSc.
; Ústav histologie a embryologie LF UK v Plzni, přednostka: doc. MUDr. Jitka Kočová, CSc.
*
Published in:
Rozhl. Chir., 2011, roč. 90, č. 6, s. 315-323.
Category:
Monothematic special - Original
Overview
Kolorektální karcinom, jedno z nejčastějších maligních onemocnění, je i přes pokroky moderní chirurgické a onkologické léčby pro pacienta stále velmi závažnou diagnózou. Přežití pacienta po radikálním chirurgickém zákroku ovlivňuje zejména časnost záchytu onemocnění a výběr vhodné onkologické léčby, jejíž úspěšnost závisí především na vlastnostech samotné nádorové tkáně. V posledním desetiletí stoupá role molekulárně biologických metod v obou výše zmíněných kategoriích. Genetické a molekulárně biologické determinanty umožňují předpovědět prognózu onemocnění a rovněž napomoci ve výběru nejvhodnější léčby, která pacientovi přinese kýžený benefit v podobě prodloužení bezpříznakového a celkového přežití. Předkládaný přehledný článek popisuje nejdůležitější molekulárně-biologické znaky s prognostickým či prediktivním významem, které jsou využívané v klinické praxi nebo se nacházejí ve vysokém stupni klinické studie.
Klíčová slova:
kolorektální karcinom – molekulárně biologické metody – prognostické faktory – prediktivní faktory
ÚVOD
Kolorektální karcinom (KRCa) je jedním z nejčastějších maligních onemocnění na světě a Česká republika v jeho výskytu zaujímá přední pozici [1]. Každý rok je v České republice nově diagnostikováno v průměru 8 000 nových případů a 5 000 pacientů na tuto chorobu zemře. Nebezpečí této choroby spočívá především ve vysokém počtu případů časné recidivy a v časté tvorbě metastáz, především v játrech, kam mohou migrující nádorové buňky s metastatickým potenciálem snadno vcestovat díky mezenterickému cévnímu systému.
Hlavní úlohu v léčbě primárního KRCa i jeho jaterních metastáz má radikální chirurgický zákrok, při kterém dojde k odstranění masy nádoru. V kombinaci s chemoterapií, která snižuje riziko recidivy a eliminuje nediagnostikovatelné mikrometastázy, dochází k poklesu počtu recidiv u radikálně operovaných pacientů. Nejstarším typem chemoterapie, využívané při léčbě pokročilého karcinomu tlustého střeva, je 5-fluorouracil a jeho deriváty v kombinaci s leucovorinem. Od konce devadesátých let se do klinické praxe postupně dostávaly nové typy chemoterapeutik, například inhibitor jaderného enzymu topoisomerázy I irinotecan (Camptosar®) či platinové deriváty (oxaliplatina, Eloxatin®), které výrazně zvýšily množství pacientů pozitivně reagujících na léčbu a prodloužily bezpříznakové i celkové přežití pacientů. Poslední novinkou v oblasti léčby pacientů s KRCa jsou protilátky blokující funkci proteinů, které jsou nezbytné pro růst nádoru. V praxi jsou již používané protilátky blokující receptor epidermálního růstového faktoru (EGFR) cetuximab (Erbitux®) a panitumumab (Vectibix®) a protilátka proti vaskulárnímu-endoteliálnímu růstovému faktoru (VEGF) bevacizumab (Avastin®).
V současné době je velkým problémem zvolit nejvhodnější kombinaci chirurgické a onkologické léčby pro jednotlivého pacienta postiženého KRCa. V této souvislosti se stále častěji využívají metodiky a poznatky molekulární biologie, které přinášejí nové důležité podklady pro diagnózu, prognózu i výběr terapie, čímž pomáhají šetřit nemalé náklady, které jsou na léčbu potřebné, a především zvyšují šanci pacientů na delší bezpříznakové i celkové přežití.
V následujícím přehledovém článku autoři prezentují nejvýznamnější molekulárně biologické mechanismy, které jsou v současné době považovány za nejdůležitější pro prognózu KRCa a jsou využívány v klinické praxi nebo probíhá jejich evaluace ve vysokém stupni klinické studie.
CIRKULUJÍCÍ NÁDOROVÉ BUŇKY
V posledních letech velmi diskutovaným směrem výzkumu v diagnóze a prognóze kolorektálního karcinomu, a karcinomů obecně, je možnost detekce a charakterizace cirkulujících nádorových buněk v periferní krvi, či tumorózních buněk diseminovaných do kostní dřeně. Přestože myšlenka samotná sahá již do poloviny minulého století, až vývoj vysoce citlivých detekčních metod v posledních letech umožnil výzkum a následně i aplikaci získaných poznatků do klinické praxe. Problémem byla především velice nízká koncentrace buněk uvolněných z tumoru do krve či kostní dřeně – řádově jednotky buněk v 10 ml periferní krve. Vzorek krve musí být proto nejprve specificky obohacen o potenciální nádorové buňky a až poté analyzován. K obohacení se nejčastěji používá centrifugace v hustotním gradientu nebo sofistikovanější imunomagnetické obohacení, kdy se využívají magnetické částice konjugované s protilátkami proti proteinům, které definují nádorovou buňku (v tomto případě především proteiny typické pro epiteliální buňky, například epiteliální adhezivní povrchový protein (EpCAM)). Po zahuštění následuje samotná detekce, použít lze imunocytochemii kombinovanou s vysokorychlostní automatickou mikroskopií, kvantitativní PCR (polymerase chain reaction), FISH (fluorescence in-situ hybridisation), průtokovou cytometrii (FC, flow cytometry), či nové metody typu mikrofluidních destiček, které jsou vysoce citlivé, ale stále ve fázi vývoje [2].
Z karcinomů je nejdále rozpracováno využití cirkulujících nádorových buněk při diagnóze a prognóze onemocnění u rakoviny prsu, kde je od roku 2007 jejich detekce jako tumorového markeru zahrnuta v doporučení Americké asociace klinické onkologie (ASCO, American Society of Clinical Oncology). U kolorektálního karcinomu je situace komplikovanější, dosud provedené studie zahrnovaly většinou malé množství pacientů a velmi se lišily metodicky a to nejen typem použité detekce, ale i dobou odběru krve či kostní dřeně (preoperační, postoperační) a charakteristikami pacientů zařazenými do studie. Výsledky jednotlivých studií jsou nekonzistentní, přesto většinou přiřazují cirkulujícím či rozesetým tumorózním buňkám určitý prognostický význam. Recentní meta-analýza všech těchto studií prokázala signifikantní korelaci mezi detekcí cirkulujících kmenových buněk, špatnou prognózou onemocnění a zkráceným bezpříznakovým i celkovým přežitím.
Další výzkum je nezbytný. Analýza cirkulujících kmenových buněk, jejich počtu, ale i mutačních a expresních profilů, může přinést užitečný, v případě periferní krve i neinvazivní, nástroj pro hodnocení rizika časné recidivy a vzniku vzdálených metastáz, ale i pro průběžné sledování účinku používané léčby s možností její okamžité změny.
DETEKCE VOLNÉ DNA VE STOLICI
Vysoká incidence kolorektálního karcinomu a nemalé finanční náklady na léčbu pacientů v pokročilém stadiu onemocnění vedou ke snaze prospektivně sledovat rizikovou část populace a diagnostikovat onemocnění v jeho počáteční fázi. Jednou z nejpoužívanějších metod je detekce okultního krvácení ve stolici. Metoda je neinvazivní, levná a pacient je schopen provést si ji sám bez nutnosti návštěvy lékaře a teprve až k jejímu vyhodnocení je zapotřebí vzorek dopravit do laboratoře. Nepřináší sice vysokou senzitivitu, přesto její využití vede díky odhalení nemoci před propuknutím potíží ke snížení mortality spojené s kolorektálním karcinomem [3]. S rozvojem molekulární biologie, a především metod pro detekci mutací pomocí PCR či přímou sekvenací, se objevila možnost detekovat počínající nádory kolorekta, ale i jiných částí gastrointestinálního traktu, z volné DNA ve stolici. Význam těchto testů stále narůstá díky jejich vysoké senzitivitě, nízké ceně a využití nejen pro detekci kolorektálního karcinomu.
Významnou výhodou diagnostiky DNA tumoru oproti klasickému testování přítomnosti krve (respektive hemoglobinu) ve stolici, je schopnost odhalit nejen karcinomy, ale i jejich prekurzory, jako například adenomy. V principu lze odhalit všechny typů nádorů a premalignit, ze kterých se uvolňují buňky do intraluminálního prostoru, jelikož po těchto buňkách zůstane ve stolici částečně degradovaná DNA. Problémem první generace testů DNA ve stolici byla nižší schopnost detekce a bylo zapotřebí, aby mutaci neslo více než jedno procento všech kopií studovaného genu. Množství relevantní DNA ve stolici je přitom relativně malé – zbytky lidské DNA tvoří zhruba 0,01 % veškeré DNA ve stolici, zbytek tvoří DNA bakteriální mikroflóry. V posledních letech se objevily nové metody zvyšující analytické schopnosti testů, jako BEAMing (beads, emulsions, amplification, magnetics; metoda pojmenována po základních principech a materiálech, které využívá) a digitální křivka tání struktury DNA (DMC, digital melt curve), u kterých je zapotřebí jen více než 0,1 % mutovaných kopií charakteristických pro malignitu.
Další výhodou testování DNA je vyšší hladina detekce nádorů proximálních částí tlustého střeva, protože z nich uvolněná krev je ve stolici již téměř kompletně degradovaná a tedy nedetekovatelná klasickými testy. Nová metodika přináší navíc možnost diagnostiky dalších nádorů gastrointestinálního traktu, jejichž incidence je nižší než u kolorektálního karcinomu, a proto ve většině případů nejsou vyšetřovány při screeningových vyšetřeních a jsou diagnostikovány až jako symptomatické a tedy v pokročilém stadiu. Jen typem zvolených markerů lze časně detekovat celou řadu různých malignit a pacienty tak léčit ještě před rozvojem nemoci. To by přineslo významné snížení nákladů na péči o pacienty a zvýšení jejich celkového i bezpříznakového přežívání. Experimentálně bylo využití metod testování DNA ve stolici ověřeno například u nádorů jícnu, žaludku, slinivky a dalších [4].
Technický pokrok a stejné metodiky lze využít i pro detekci DNA neinvazivním způsobem v tělních tekutinách, například v krvi či v moči. Nové postupy již byly experimentálně ověřeny a v blízké době se očekává jejich zavedení do klinické praxe.
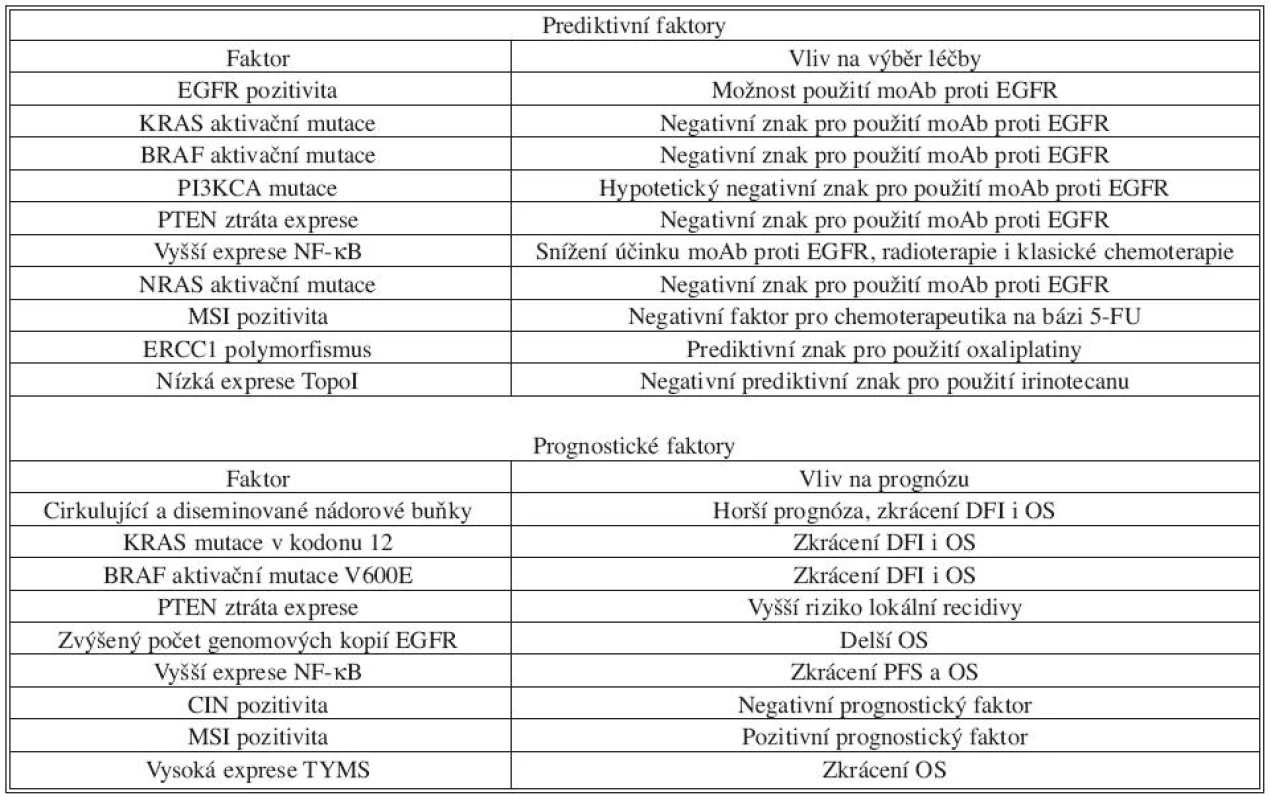
MOLEKULÁRNÍ PREDIKTIVNÍ A PROGNOSTICKÉ FAKTORY KOLOREKTÁLNÍHO KARCINOMU
Kolorektální karcinom není homogenním onemocněním. Molekulární klasifikace jednotlivých typů se stále vyvíjí a v současnosti lze rozeznat tři základní typy definované podle přítomnosti chromozomální nestability (CIN), mikrosatelitní nestability (MIN) či metylovaných CpG ostrůvků (CIMP). Každý z těchto typů má mírně odlišné klinické projevy a jinak reaguje na léčbu. Kromě rozdělení podle majoritních změn v genomu lze nalézt celou řadu pozměněných signalizačních drah a mutací v jednotlivých genech, které se vyskytují vždy jen u určitého procenta kolorektálních karcinomů [5]. Se snahou co nejvíce individualizovat léčbu je potřeba identifikovat další spolehlivé prediktivní a prognostické znaky, díky kterým by bylo možné pacientům indikovat nejvhodnější léčbu.
Prediktivní znaky jsou takové, které umožňují předpovědět efekt konkrétní léčby u individuálního pacienta. Znalost těchto znaků pomůže při výběru nejvhodnější léčby pro pacienta, který tak může být ušetřen případných nežádoucích efektů léčby, která by u něj nebyla účinná, a naopak může profitovat z časného nasazení efektivní chemoterapie či biologické léčby. Prognostické znaky naopak nejsou vázány na konkrétní typ léčby, ale poskytují informaci o prognóze onemocnění. Některé molekulární znaky mohou být jak prediktivní, tak prognostické, například přítomnost estrogenových receptorů u rakoviny prsu, ale u kolorektálního karcinomu zatím žádný znak s kombinovanou rolí identifikovaný nebyl.
Hledání a následná evaluace prognostických i prediktivních znaků je běh na dlouhou trať. V prvním kroku se kandidátní faktory většinou hledají pomocí metod molekulární biologie – měření proteinové exprese, genové exprese, hledání mutací v DNA apod. Poté většinou následují retrospektivní a prospektivní klinické zkoušky na větších skupinách pacientů, které ovšem často přinášejí nekonzistentní výsledky, například kvůli heterogenitě skupin pacientů zařazených do studií či odlišné metodice, která byla pro studium daného faktoru použita různými výzkumnými týmy. Popis v současnosti identifikovaných a nejvíce studovaných prognostických a prediktivních znaků u KRCa je uveden v následujících odstavcích.
Signalizační dráha vedoucí od receptoru epidermálního růstového faktoru
Rostoucí znalosti o biologickém chování různých typů tumorů v posledních deseti letech ukazovaly na podstatnou roli signalizačních drah vedoucích od receptorů pro růstové faktory ve vývoji a růstu různých typů tumorů. U KRCa se jedná především o receptor pro epidermální růstový faktor (EGFR), přes který buňka přijímá signály vedoucí k přežívání a k proliferaci. EGFR je transmembránový protein s intracelulární kinázovou doménou. Extracelulární oblast, ve které se nachází ligand-vazebná doména, je vhodným cílem pro vazbu specifických monoklonálních protilátek, které kompetují s ligandem o vazbu k receptoru, ale nespouštějí signalizaci a tedy přenos signálu přes daný receptor zablokují.
Popsaného mechanismu využívají dvě, v léčbě KRCa rutinně používané monoklonální protilátky proti EGFR, cetuximab (chimerická protilátka izotypu IgG1) a panitumumab (plně lidská protilátka izotypu IgG2). Nasazení těchto protilátek bylo v počátku indikováno pro pacienty s pozitivní expresí EGFR při imunohistochemickém vyšetření. Následné studie ovšem ukázaly, že v průměru pouze 10 % léčených EGFR-pozitivních pacientů reagovalo pozitivně na přidání monoklonální protilátky do léčebného režimu [6]. Předpokládaným důvodem snížené reakce některých pacientů byla mutace či jiná změna v proteinech signální dráhy EGFR, a jako hlavní kandidát se ukázal být známý onkogen KRAS (v-Ki-ras2 Kirsten rat sarcoma viral oncogene homolog). Ve velkých randomizovaných studiích, které porovnávaly účinnost léčby zavedených chemoterapeutických postupů bez a s monoklonální protilátkou (například OPUS, CRYSTAL), byla opět u řady pacientů pozitivních na expresi EGFR zaznamenána snížená nebo žádná reakce na léčbu monoklonální protilátkou. V případě panitumumabu dokonce použití protilátky u některých pacientů vedlo ke sníženému celkovému přežívání. Testování pacientů na přítomnost KRAS mutace potvrdilo, že pozitivní efekt monoklonální protilátky proti EGFR je svázán s nemutovanými alelami genu KRAS. U jedinců s mutovaným proteinem KRAS je nejčastěji postižena autoinaktivační funkce, protein je konstitutivně aktivní a k signalizaci nevyžaduje aktivaci EGFR. U pacientů s konstitutivně aktivním proteinem KRAS je tedy použití protilátky blokující EGFR bezúčelné. V současnosti je kromě proteinu KRAS studováno několik dalších proteinů v signalizační kaskádě EGFR i receptor samotný. Stručný přehled signalizačních kaskád vedoucích od EGFR je zachycen na obrázku 1.
![Přehled základních drah vedoucích od receptoru pro epidermální růstový faktor (EGFR). U kolorektálního karcinomu hrají zásadní roli při rozvoji malignity především dráhy aktivované proteiny PI3K a RAS (všechny jeho typy). Kromě PI3K a RAS signalizační kaskády jsou aktivovány i další dráhy, například dráha fosfolipázy Cγ či rodiny transkripčních faktorů STAT. Červeně označené proteiny mají potvrzený prediktivní či prognostický význam a jsou zkoumány během výběru vhodné léčby pro pacienta či předpověď závažnosti onemocnění. Žlutě označené proteiny v současnosti
využívány pro prognostické či prediktivní účely nejsou, ale po dalším ověření by jejich mutační či expresní změny mohly sloužit jako důležité faktory pro indikaci vhodné terapie. U proteinů RAS, PI3K, RAF a PTEN jsou uváděn odhadovaný procentuální podíl na rezistenci k léčbě monoklonálními protilátkami proti EGFR. Upraveno podle [20] a podle dat z internetové databáze signálních drah http://www.biocarta.com/genes/allPathways. asp; mTOR = mechanistic target of rapamycin (serine/threonine kinase); PLCγ = phospholipase C, gamma; STAT = signal transducer
and activator of transcription.
Fig. 1. Overview of the signaling cascades activated by the epidermal growth factor receptor. The major role in the development of the colorectal carcinoma play pathways activated by PI3K and RAS proteins. In addition to PI3K and RAS signalling cascades, EGFR signalling activates other
pathways like phospholipase Cγ or the family of STAT transcription factors. Red marked proteins are confirmed and used as a prognostic or predictive factors and are impotant for the selection of appropriate treatment or for the prediction of the disease outcome. Yellow marked proteins are not at present use for the prediction or prognosis, but after the future evaluation they can serve as a important factors for the selection of best treatment or for the disease prognosis. In the boxes next to the RAS, PI3K, RAF and PTEN proteins is the estimated percentage of colorectal carcinoma resistance to the anti-EGFR monoclonal antibody treatment caused by the mutation in the articular protein. Modified from [20] and from the signaling pathways database http://www.biocarta.com/genes/allPathways.asp; mTOR = mechanistic target of rapamycin (serine/threonine kinase); PLCγ = phospholipase C, gamma; STAT = signal transducer and activator of transcription.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/cae4f13f70dc348457d84d5cb9eba491.jpeg)
KRAS jako prediktivní a prognostický faktor
Aktivační mutace v protoonkogenu KRAS jsou potvrzené jako negativní prediktivní znak léčby KRCa monoklonálními protilátkami (moAb) proti EGFR. Mutace se vyskytují u zhruba 40 % pacientů s KRCa a ti tak mohou být po vyšetření na KRAS mutační profil ušetřeni potenciálně toxické a bezvýsledné léčby, která by u nich nevedla k žádnému zlepšení stavu nemoci. Negativní efekt potvrdila řada nezávislých studií. Mutace v KRAS signifikantně korelovaly s odpovědí pacientů na léčbu. Například ve studii porovnávající efekt panitumumabu v porovnání s nejlepší podpůrnou léčbou (BSC, best supportive care) u pacientů, u nichž selhalo použití klasické chemoterapie, odpovídalo na léčbu 0 % pacientů s KRAS mutacemi a 17 % pacientů bez KRAS mutace. Rozdíl byl vidět i v efektu panitumumabu u jednotlivých skupin pacientů na délku období bez progrese onemocnění – 12,3 týdnů u pacientů s nemutovaným KRAS v porovnání se 7,4 týdny u pacientů s mutací (pro srovnání, u pacientů s podpůrnou léčbou bylo období bez progrese 7,3 týdne) [7]. Podobný efekt byl pozorován i u cetuximabu.
Zatímco prediktivní role KRAS mutací byla spolehlivě potvrzena, o jeho roli jako prognostického faktoru se stále diskutuje. Velká randomizovaná studie RASCALII popsala prognostický efekt mutace v KRAS, kdy je v kodónu 12 namísto glycinu valin – takto postižení pacienti měli snížené bezpříznakové i celkové přežití. Podobného výsledku dosáhla i studie prováděná na Chirurgické klinice KN v Pardubicích, ve které autoři na skupině 76 pacientů potvrdili negativní vliv KRAS mutace na prognózu [8]. Nicméně již zmiňovaná studie vlivu panitumumabu na léčbu KRCa neobjevila žádný efekt mutace KRAS na bezpříznakové přežití u pacientů s podpůrnou léčbou [7].
BRAF jako prediktivní a prognostický faktor
I přes vyřazení pacientů s KRAS mutacemi je odpověď na léčbu moAb poměrně nízká, což svědčí o faktu, že musí existovat ještě další geny podílející se na rezistenci k léčbě moAb proti EGFR. Serin/threoninová kináza BRAF (v-raf murine sarcoma viral oncogene homolog B1) je dalším proteinem v kaskádě EGFR signalizace a aktivační mutace (V600E) v BRAF genu se vyskytuje u 10–15 % nádorů kolorekta. Vliv této mutace na rezistenci k léčbě moAb potvrdila retrospektivní studie na 113 pacientech s metastatickým KRCa léčených jednou z používaných moAb. Autoři určili stav KRAS a BRAF mutací a korelovali je s odpovědí na léčbu, bezpříznakovým a celkovým přežitím. U KRAS mutace došlo k potvrzení předchozích závěrů, u 11 pacientů s nemutovaným KRAS byla detekována mutace BRAF. Ani jeden z těchto pacientů neodpovídal na léčbu a všichni měli kratší období bez progrese onemocnění i celkové přežití. Zároveň ani jeden z pacientů odpovídajících na léčbu nenesl mutovanou BRAF alelu [9]. BRAF mutaci V600E lze tedy považovat za prediktivní vzhledem k odpovědi pacientů na léčbu moAb. Kromě prediktivní role byla k této mutaci přiřazena i role prognostického faktoru – porovnání bezpříznakového a celkového přežití mezi pacienty s mutovanou a nemutovanou alelou BRAF signifikantně prokázalo zkrácení obou parametrů u pacientů s BRAF mutací a překvapivě byly oba typy přežití ještě nižší, než u pacientů s mutací v KRAS genu. I další práce napovídají, že BRAF mutace by mohla v některých případech (například v subtypu KRCa definovaného žádnou či nízkou mikrosatelitní nestabilitou) opravdu mít prognostický význam. Přes zajímavé experimentální výsledky je potřeba prediktivní i prognostickou roli BRAF mutace ověřit při randomizovaných klinických studiích.
PI3KCA mutace a ztráta exprese PTEN jako prediktivní a prognostické faktory
Phosphatidyl-inositol-3-kináza (PI3K) tvoří druhou hlavní efektorovou větev dráhy EGFR signalizace. Jedná se o kinázu se specifitou pro lipidy a může být aktivována nejen přímo EGFR, ale také interakcí s aktivní formou proteinu KRAS. Hlavním uzlem v PI3K aktivované dráze je další kináza AKT (v-akt murine thymoma viral oncogene homolog 1), která má v buňce řadu rolí, od regulace metabolismu glukózy přes blokování funkce pro-apoptotických proteinů až k regulaci genové exprese. Aktivace dráhy obecně vede k vyššímu přežívání buňky a její větší odolnosti k nepříznivému vlivu okolí. Protein PTEN (phosphatase and tensin homolog) je hlavní negativní regulátor funkce PI3K, jedná se o fosfatázu, která je schopná defosforylovat lipidy a tím blokovat spuštění PI3K signalizační kaskády.
PI3K, konkrétně její katalytická podjednotka označovaná p100α (PIK3CA), je velmi často mutovaná v celé řadě různých typů nádorů. U kolorektálního karcinomu se mutace v PIK3CA vyskytuje zhruba v 25 % případů sporadických KRCa, častěji u žen a u nádorů proximálních oblastí tlustého střeva. Mutace vedou ke katalytické aktivitě i bez předchozí stimulace, a dochází tak k zapnutí drah pro přežívání a proliferaci buňky. Stejný výsledný efekt má i ztráta exprese proteinu PTEN, která se vyskytuje zhruba u 30 % pacientů s KRCa.
U kolorektálního karcinomu proběhlo několik studií, které se pokoušely jednotlivým mutacím PIK3CA přiřadit prognostický či prediktivní efekt, výsledky jsou ale velmi nekonzistentní. Sartore-Bianchi s kolegy ukázala, že mutace v PIK3CA vede ke zkrácení bezpříznakového přežití a pacienti s PIK3CA mutací neodpovídají na léčbu monoklonálními protilátkami cetuximabem a panitumumabem. Efekt mutace byl však pozorovatelný jen u pacientů s nemutovaným proteinem KRAS. U osob s KRAS mutací byl vliv PIK3CA mutace neznatelný [10]. Naproti tomu Prenen s kolegy nepozorovali vliv PIK3CA mutací na léčebný efekt cetuximabu (samostatně či v kombinaci s irinotecanem) u pacientů s metastatickým KRCa neodpovídajícím na léčbu irinotecanem samotným [11]. Pro PI3K je ještě zapotřebí zevrubné studium jejího vztahu ke klinickým parametrům a její použití jako prediktivního či prognostického znaku v současnosti není možné, i přes existující náznaky, že PIK3CA mutace by mohly být z prediktivního hlediska považovány za negativní faktor indikace léčby monoklonálními protilátkami proti EGFR, stejně jako v případě proteinu KRAS, a mutace PIK3CA by mohly ukazovat na snížené přežívání postižených pacientů. Ztráta exprese PTEN má poté podobné dopady, jako mutace v PIK3CA, navíc byla pozorována korelace mezi PTEN expresí a lokální recidivou KRCa. Zajímavé je, že stejně jako v případě mutací v BRAF a KRAS, jsou i mutace v PIK3CA a ztráta PTEN vzájemně výlučné. Ke spuštění onkogenní malformace buňky tedy pravděpodobně stačí jen jedna změna v dané signalizační dráze.
Prediktivní a prognostické mutace a změny v dalších genech EGFR dráhy
Kromě výše zmíněných hlavních mutací a expresních změn byly zkoumány další proteiny a jejich molekulární změny v jednotlivých úsecích EGFR signální kaskády. Výsledky různých studií stejného proteinu jsou často velmi odlišné, například z důvodu odlišných použitých experimentálních technik či malého počtu studovaných pacientů. Žádný další prediktivní či prognostický znak nebyl dodnes přesvědčivě univerzálně potvrzen. Mezi nejzajímavější studované změny patří expresní hladina EGFR, jeho ligandů (především amphiregulin a epiregulin) a efektorového transkripčního faktoru NF-κB (nuclear factor-κB), počet genomových kopií EGFR, mutace a polymorfismy v EGFR, NRAS (neuroblastoma RAS viral (v-ras) oncogene homolog) a typ heteroduplexních receptorů, které EGFR tvoří po aktivaci s dalšími členy své receptorové rodiny.
V následujícím textu jsou stručně shrnuty informace o dalších zajímavých prognostických a prediktivních znacích v EGFR signalizační kaskádě. Samotná hladina exprese EGFR nepřináší prognostickou ani prediktivní informaci. Vyšší počet genomových kopií EGFR je spojován s delším celkovým přežitím pacientů, a byla popsána i prediktivní hodnota počtu EGFR kopií pro léčbu panitumumabem v konkrétních případech KRCa [12]. Vyšší exprese NF-κB v nádoru vede ke snížené odpovědi na léčbu nejen protilátkami proti EGFR, ale také snižuje léčebný efekt radioterapie [13] a klasické chemoterapie. Na malém vzorku pacientů bylo prokázáno, že pacienti s vyšší expresí NF-κB mají kratší období do progrese tumoru a nižší celkové přežití. Mezi pacienty se zdravým typem KRAS proteinu se stále nachází celá řada těch, kteří nemají žádný benefit z léčby EGFR blokujícími protilátkami. Dodatečnou informaci u těchto pacientů kromě mutačního statutu genů PIK3CA a BRAF nese i gen pro protein NRAS, který, pokud je mutovaný, snižuje výrazně odpověď na léčbu anti-EGFR protilátkami [14].
Genetické subtypy KRCa (CIN, MSI, CIMP) a jejich prognostická hodnota
Jak již bylo zmíněno výše, kolorektální karcinom lze z genetického a epigenetického hlediska rozdělit podle tří hlavních kritérií: podle přítomnosti/nepřítomnosti chromozomální nestability (chromosomal instability, CIN), podle přítomnosti/nepřítomnosti mikrosatelitní nestability (microsatellite instability, MSI) a podle stupně metylace DNA (CpG insland methylator phenotype, CIMP). CIN se vyskytuje u 65–70 % případů KRCa a je rozpoznána jako mnohočetná změna v ploidii či struktuře chromozomů. MSI je definována jako změna v délce repetitivních sekvencí (mikrosatelitů) a vyskytuje se zhruba v 15 % případů KRCa. CIMP je často asociovaný s přítomností MSI u pacientů bez vrozené mutace v genech pro opravu DNA a je definovaný jako metylace určitého počtu analyzovaných oblastí v genomu. Zmíněné kategorie navíc vzájemnou kombinací vytvářejí další heterogenitu. Poměrné zastoupení jednotlivých typů se nachází na obrázku 2. Molekulární mechanismy jednotlivých genetických odlišností přesahují rámec tohoto článku, zájemci naleznou řadu informací v recentních souhrnných publikacích na toto téma [5].
![Poměrné zastoupení jednotlivých genetických a epigenetických subtypů KRCa. Chromozomální nestabilitu (CIN positivní) vykazuje 58 % KRCa, mikrosatelitní nestabilitu (MIN high) 18 % případů KRCa, metylaci CpG (CIMP high) ostrůvků 20 % KRCa a negativitu ve všech třech znacích 27% KRCa. Volně upraveno podle [5].
Fig. 2. Proportional representation of the genetic and epigenetic subtypes of colorectal carcinomas (CRC). Chromosomal instability (CIN positivity) is present in 58% of CRC, microsatellite instability (MIN high) in 18% of CRC, CpG island methylation (CIMP high) in 20% of CRC and 27% of CRC is negative in all three criterions. Modified from [5].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2d89a579e7221b4a537087dc8606c9ff.jpeg)
U některých ze subtypů KRCa byla popsána korelace s prognózou onemocnění či s odpovědí na určitou léčbu. Pozitivita pro CIN a MSI u nádorů byla podrobena rozsáhlým meta-analýzám a z jejich závěrů vyplývá, že pacienti s CIN pozitivním nádorem mají horší prognózu onemocnění a pacienti s MSI pozitivním KRCa naopak lepší prognózu než CIN či MSI negativní. Původní představa o vzájemné neslučitelnosti CIN a MSI byla v posledních letech zpochybněna a jelikož CIN a MSI mohou nést odlišnou prognostickou informaci, je důležité ověřit jejich vzájemnou nezávislost, aby mohly být jako jednoznačné prognostické faktory používány.
CIMP lze rozdělit na dvě skupiny jako CIMP – high a CIMP – low, podle počtu metylovaných analyzovaných oblastí. U nádorů, které jsou MSI pozitivní a mají vysoký stupeň CIMP, se lze často setkat s mutací v genu BRAF a pacienti s tímto typem nádoru mají lepší prognózu. Naproti tomu nádory s MSI negativitou a vysokým stupněm metylace v kombinaci s BRAF mutací mají prognózu horší a se zvyšujícím se stupněm metylace CpG oblastí se prognóza zhoršuje. Druhou epigenetickou změnou u KRCa bývá celková DNA hypometylace, která je často asociována s CIN pozitivitou, a bylo ukázáno, že hypometylace vede ke zhoršení prognózy.
I přes řadu jednotlivých náznaků o prognostické významnosti subtypů KRCa je potřeba prokázat podíl jednotlivých genetických a epigenetických změn na celkový dopad prognózy v rámci rozsáhlých klinických studií, které v současnosti probíhají. I proto nebyl doposud žádný z těchto znaků schválen k využití v klinické praxi.
Prediktivní význam subtypů KRCa
Každý genetický a epigenetický subtyp KRCa je asociován s celou řadou expresních či mutačních změn v jednotlivých genech. Často jsou mutací, která alteruje či ruší jejich funkci, zasaženy geny, které hrají roli při působení či odbourávání různých chemoterapeutik. Tím dochází ke změně intenzity jejich účinku, v krajních případech mohou být silně toxické či na ně rakovinné buňky mohou být rezistentní. Určení subtypu KRCa tedy může přinést důležité informace pro výběr léčby pro konkrétního pacienta.
Systém genů pro opravu nesprávného párování (mis-match repair system, MMR) bází v DNA je nezbytný pro správnou funkci chemoterapeutik typu 5-fluorouracilu (5-FU), které se inkorporují do DNA a díky nesprávnému párování dojde ke spuštění signální kaskády, která končí zastavením buněčného cyklu. MMR systém je nefunkční v případě MSI pozitivních nádorů a byl dokumentován nepříznivý efekt při podávání 5-FU pacientům s tímto subtypem KRCa ve stadiu II a III [15], u léčby pacientů po paliativní resekci KRCa ve stadiu IV byla naopak odpověď na léčbu 5-FU v kombinaci s leukovorinem lepší. Existují i data o vyšší senzitivitě MSI pozitivních pacientů k léčbě irinotecanem.
Kolorektální karcinom s chromozomální instabilitou je prediktivní pro léčbu taxany, které ovšem obecně pro léčbu KRCa nejsou vhodné, jelikož výrazně neovlivňují celkové ani bezpříznakové přežití. Pacienti s CIN pozitivním nádorem nevykazují žádné benefity z léčby těmito chemoterapeutikami. Důvodem je nepřítomnost intaktního dělícího vřeténka v aneuploidních buňkách, které je nezbytné pro senzitivitu na léčbu využívající taxany, například paclitaxel (Taxol®).
Další molekulárně-biologické změny s prognostickým či prediktivním potenciálem u KRCa
Polymorfismy v Fc gamma receptorech
Fc-γ receptory (FcγR) se podílejí na efektivitě léčby monoklonálními protilátkami izotypu IgG1 mechanismem protilátkově závislé buněčné toxicity (ADCC – antibody dependent cell cytotoxicity). Změny v FcγR, které ovlivní afinitu receptoru k Fc oblasti protilátky, tak mohou změnit účinnost imunitní reakce proti buňkám opsonizovaným protilátkami. U KRCa byly studovány dva polymorfismy s prognostickým využitím. Delší období bez progrese onemocnění (PFS) bylo více asociováno s FcγRIIa genotypy 131H/H nebo 131R/H než u varianty 131R/R, u polymorfismu 158V/V a 158 F/V nejsou výsledky jednotné [16]. Pro jednoznačné určení role jednotlivých alelických variant FcγR při prognóze odpovědi na léčbu anti-EGFR protilátkami je nutné uskutečnit rozsáhlejší prospektivní studii.
Mutace v genech pro reparaci DNA
Vrozené mutace v genech pro opravu nepřesného párování v DNA jsou příčinou Lynchova syndromu a vyskytují se rovněž u 15–20 % případů sporadického KRCa. Z prognostického hlediska jsou mutace v těchto genech často asociovány s mikrosatelitní nestabilitou a pro pacienty tyto změny znamenají výhodu delšího celkového přežití.
U jednoho z genů pracujících v dráze nukleotidové excizní opravy DNA – genu ERCC1 (excision repair cross-complementing rodent repair deficiency, complementation group 1) – byl popsán prediktivní charakter jeho polymorfismu v kodónu 118 pro odpověď na léčbu oxaliplatinou [5].
Expresní hladina topoizomerázy I
V randomizované studii FOCUS byla jako prediktivní biomarker studována expresní hladina genu TopoI. Proteinový produkt toho genu se účastní procesu stříhání dvouvláknové DNA při opravě jejích chyb a je inhibován irinotecanem. U pacientů s nízkou expresí TopoI nebylo PFS prodlouženo přidáním irinotecanu do léčebného procesu, u pacientů se střední či vysokou expresní hladinou došlo k prodloužení PFS [17].
Thymidylát syntetáza
Thymidylát syntetáza (TYMS) je hlavním cílem působení aktivního derivátu 5-FU. Bylo prokázáno, že vyšší expresní hladina TYMS koreluje s kratším celkovým přežitím pacientů. Změna exprese je zajišťována 3 mechanismy: tandemovou repeticí v promotorové oblasti TYMS genu, jednonukleotidovým polymorfismem v této repetici a inserčním/delečním polymorfismem v 3´nepřekládané oblasti. První dvě změny vedou k vyšší expresi TYMS, poslední změna vede k nižší stabilizaci TYMS mRNA a ve výsledku k nižší expresi. Identifikace všech těchto změn může být využita k prognóze zvýšeného nebezpečí recidivy u pacientů s KRCa ve stadiu II a III [18].
TP53 a APC
Gen pro TP53 (tumor protein p53) se nachází na chromozómu 17p a u KRCa dochází velice často ke ztrátě heterozygozity této oblasti. Mutace v TP53 jsou u KRCa rovněž velmi časté, ale výsledky studií hledající význam v prognóze či predikci byly nejednotné, často zřejmě díky odlišným metodickým přístupům.
Mutace jednotlivých genů ve WNT (wingless-type MMTV integration site family) signalizační dráze jsou velice častým jevem u pacientů s KRCa (až v 90 % případů [19]) a nejčastěji mutovaným zástupcem je gen APC (adenomatous polyposis coli). APC je součást komplexu degradující ß-catenin a jeho mutace vede k deregulaci buněčného cyklu. Oba tyto proteiny jsou tak často změněny po mutační či expresní stránce, že je nelze spolehlivě použít pro prognózu či predikci. Určité typy mutací v APC mohou vést k horší prognóze (především ty, které ovlivní vazebnou doménu k ß-cateninu), ale v klinické praxi není jednoduché vzhledem k velkému počtu popsaných APC mutací jednotlivé mutace přesně identifikovat. U ß-cateninu je spíše než vyšší exprese důležitá jeho lokalizace, která nese určitou prognostickou hodnotu.
Ztráta 18q
Na dlouhém raménku 18. chromozomu se nacházejí geny DCC (deleted in colorectal carcinoma), SMAD4 (SMAD family member 4) a SMAD2 (SMAD family member 2), a ztráta heterozygosity v této oblasti je velice častou cytogenetickou abnormalitou u KRCa. Existují údaje, že tato ztráta vede k horší prognóze [5]. Ani jeden z genů nebyl potvrzen jako nezávislý prognostický faktor, protože ztráta 18q je asociována s CIN pozitivitou a vliv těchto genů na prognózu tedy může být jen jedním z důsledků chromozomální nestability.
ZÁVĚR
Molekulární biologie nabízí klinickým oborům podílejícím se na komplexní léčbě KRCa nové možnosti, které mohou ovlivnit diagnostiku a léčbu tohoto onemocnění. V současné době tento obor spíše zkoumá, které z nepřeberných molekulárně biologických metod mohou skutečně a významně přispět svou prognostickou nebo prediktivní hodnotou v klinické praxi. Z uvedeného přehledového článku je zřejmé, že lze očekávat v následujícím období zvýraznění významu molekulární biologie a tím začlenění tohoto oboru mezi obory zabývající se v součinnosti diagnostikou a léčbou tohoto onemocnění.
Seznam zkratek
- 5-FU 5-fluorouracil
- ADCC antibody dependent cell cytotoxicity
- AKT v-akt murine thymoma viral oncogene homolog 1
- APC adenomatous polyposis coli
- ASCO American Society of Clinical Oncology
- BEAMing beads, emulsions, amplification, magnetics
- BRAF v-raf murine sarcoma viral oncogene homolog B1
- BSC best supportive care
- CIMP metylované CpG ostrůvky
- CIN chromozomální nestabilita
- DCC deleted in colorectal carcinoma
- DFI disease-free interval
- DMC digital melt curve
- EGFR receptor epidermálního růstového faktoru
- EpCAM epiteliální adhezivní povrchový protein
- ERCC1 excision repair cross-complementing rodent repair deficiency, complementation group 1
- FC průtoková cytometrie
- FcγR Fc-γ receptory
- FISH fluorescence in-situ hybridisation
- KRAS v-Ki-ras2 Kirsten rat sarcoma viral oncogene homolog
- KRCa kolorektální karcinom
- MIN mikrosatelitní nestabilita
- MMR mis-match repair system
- moAb monoklonální protilátka
- mTOR mechanistic target of rapamycin
- NF-κB nuclear factor-κB
- NRAS neuroblastoma RAS viral (v-ras) oncogene homolog
- OS overall survival
- PCR polymerase chain reaction
- PFS období bez progrese onemocnění
- PI3K phosphatidyl-inositol-3-kináza
- PLCγ phospholipase C, gamma
- PTEN phosphatase and tensin homolog
- SMAD2 SMAD family member 2
- SMAD4 SMAD family member 4
- STAT signal transducer and activator of transcription
- TP53 tumor protein p53
- TYMS tymidylát syntetáza
- VEGF vaskulární-endoteliální růstový faktor
- WNT wingless-type MMTV integration site family
Přehledový článek vznikl za podpory grantu MZ CR IGA 10-230.
Veškerá literatura je k dispozici u autorů.
Mgr. P. Pitule
Chirurgická
klinika LF UK a FN
Alej Svobody 80
304
60 Plzeň
Sources
1. Zavoral, M., Suchanek, S., Zavada, F., et al. Colorectal cancer screening in Europe. World J. Gastroenterol., 2009; 15(47): 5907–5915.
2. Pantel, K., Brakenhoff, R. H., Brandt, B. Detection, clinical relevance and specific biological properties of disseminating tumour cells. Nat. Rev. Cancer, 2008; 8(5): 329–340.
3. Paimela, H., Malila, N., Palva, T., et al. Early detection of colorectal cancer with faecal occult blood test screening. Br. J. Surg., 2010; 97(10): 1567–1571.
4. Ahlquist, D. A. Molecular detection of colorectal neoplasia. Gastroenterology, 2010; 138(6): 2127–2139.
5. Walther, A., Johnstone, E., Swanton, C., et al. Genetic prognostic and predictive markers in colorectal cancer. Nat. Rev. Cancer, 2009; 9(7): 489–499.
6. Cunningham, D., Humblet, Y., Siena, S., et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N. Engl. J. Med., 2004; 351(4): 337–345.
7. Amado, R. G., Wolf, M., Peeters, M., et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J. Clin. Oncol., 2008; 26(10): 1626–1634.
8. Šácha, M., Havlíček, K., Sákra, L., et al. K-ras mutation as a prognostic factor in colorectal carcinoma. Rozhl. Chir., 2008; 87(1): 32–37.
9. Di Nicolantonio, F., Martini, M., Molinari, F., et al. Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer. J. Clin. Oncol., 2008; 26(35): 5705–5712.
10. Sartore-Bianchi, A., Martini, M., Molinari, F., et al. PIK3CA mutations in colorectal cancer are associated with clinical resistance to EGFR-targeted monoclonal antibodies. Cancer Res., 2009; 69(5): 1851–1857.
11. Prenen, H., De Schutter, J., Jacobs, B., et al. PIK3CA mutations are not a major determinant of resistance to the epidermal growth factor receptor inhibitor cetuximab in metastatic colorectal cancer. Clin. Cancer Res., 2009; 15(9): 3184–3188.
12. Sartore-Bianchi, A., Moroni, M., Veronese, S., et al. Epidermal growth factor receptor gene copy number and clinical outcome of metastatic colorectal cancer treated with panitumumab. J. Clin. Oncol., 2007; 25(22): 3238–3245.
13. Vobořil, R., Weberová-Vobořilová, J., Rychterová, V., et al. [NF-kappaB, colorectal carcinoma and radiotherapy: results of a clinical and experimental study]. Rozhl Chir., 2007; 86(5): 268–272.
14. De Roock, W., Claes, B., Bernasconi, D., et al. Effects of KRAS, BRAF, NRAS, and PIK3CA mutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis. Lancet Oncol., 2010; 11(8): 753–762.
15. Sargent, D. J., Marsoni, S., Thibodeau, S. N., et al. Confirmation of deficient mismatch repair (dMMR) as a predictive marker for lack of benefit from 5-FU based chemotherapy in stage II and III colon cancer (CC): A pooled molecular reanalysis of randomized chemotherapy trials. J. Clin. Oncol., 26 : 2008 (May 20 suppl; abstr 4008).
16. Bibeau, F., Lopez-Crapez, E., Di Fiore, F., et al. Impact of Fc{gamma}RIIa-Fc{gamma}RIIIa polymorphisms and KRAS mutations on the clinical outcome of patients with metastatic colorectal cancer treated with cetuximab plus irinotecan. J. Clin. Oncol., 2009; 27(7): 1122–1129.
17. Braun, M. S., Richman, S. D., Quirke, P., et al. Predictive biomarkers of chemotherapy efficacy in colorectal cancer: results from the UK MRC FOCUS trial. J. Clin. Oncol., 2008; 26(16): 2690–2698. Erratum in: J. Clin. Oncol., 2008; 26(26): 4363.
18. Lurje, G., Manegold, P. C., Ning, Y., et al. Thymidylate synthase gene variations: predictive and prognostic markers. Mol. Cancer Ther., 2009; 8(5): 1000–1007.
19. Thorstensen, L., Lind, G. E., LŅvig, T., et al. Genetic and epigenetic changes of components affecting the WNT pathway in colorectal carcinomas stratified by microsatellite instability. Neoplasia, 2005; 7(2): 99–108.
20. Saridaki, Z., Georgoulias, V., Souglakos, J. Mechanisms of resistance to anti-EGFR monoclonal antibody treatment in metastatic colorectal cancer. World J. Gastroenterol., 2010; 16(10): 1177–1187.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2011 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Přínos molekulární biologie v diagnostice a léčbě kolorektálního karcinomu – současnost a budoucnost
- Rozdílný dopad laparoskopického a laparotomického přístupu na imunitní odpověď navozenou chirurgickým zákrokem
- Cholecystoduodenálna fistula ako dôsledok kalkulóznej cholecystitídy pacientky vysokého veku (Kazuistika)
- Minimální uzlinové postižení u karcinomu žaludku – pilotní výsledky multicentrické studie
- Výsledky léčby nemocných s toxickým megakolon
- Prínos vyšetrenia sentinelovej uzliny pri včasnom karcinóme prsníka
- Prediktivní faktory postižení nonsentinelových uzlin u karcinomu prsu – závěry české multicentrické studie sentinelových uzlin
- DCIS a biopsia sentinelovej uzliny
- 55 laparoskopických cholecystektomií jednoincizním laparoskopickým přístupem – iniciální zkušenosti
- Zlomeniny členkovej kosti u detí
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Výsledky léčby nemocných s toxickým megakolon
- DCIS a biopsia sentinelovej uzliny
- Zlomeniny členkovej kosti u detí
- Prínos vyšetrenia sentinelovej uzliny pri včasnom karcinóme prsníka
