Primární zhoubné nádory tenkého střeva
Primary malignant small bowel tumors
Introduction:
Small bowel presents 75% of the gut length and 90% of the gut surface. However, primary malignant tumors of the small bowel represent only 1–3% of all malignant gastrointestinal tumors. The aim of the present paper is to offer a current review of primary malignant small bowel tumors – their epidemiology, localization, symptoms, diagnostic and treatment options.
Methods:
The authors have performed a comprehensive review of databases Medline, Scopus and Google Scholar focusing on studies regarding small bowel cancer.
Results:
The most frequent small bowel tumors are adenocarcinoma (30–40%), neuroendocrine tumors (35–44%), lymphomas (10–20%) and gastrointestinal stromal tumors (12–18%). Symptomatology is non-specific and varies widely, which is why small bowel cancer is usually diagnosed in a locally advanced stage of the disease. Diagnosis is determined through standard methods (gastroscopy, colonoscopy, CT) and complementary special diagnostic modalities (capsule enteroscopy, enteroscopy, octreotide scan, etc.). Diagnostic process with a negative outcome frequently leads to diagnostic laparoscopy/laparotomy.
The treatment of small bowel cancer in patients operated in acute settings is done according to acute abdomen management guidelines. Elective surgery of small bowel cancer differs with respect to the tumor type. Adenocarcinomas and neuroendocrine tumors should be treated with surgical R0 resection with radical lymphadenectomy (and multivisceral resection if necessary). Patients with GIST should undergo en bloc resection with 2–3cm safety resection margins (lymphadenectomy is not necessary). Palliative resection of neuroendocrine tumors can be associated with a significant clinical effect. On the other hand, palliative resection of adenocarcinomas of GIST is not advocated.
Conclusion:
Small bowel cancer is an infrequent condition. Symptoms are non-specific; patients are often diagnosed in an advanced stage of the disease. Achieving R0 surgical resection is usually difficult due to locally advanced stage of the disease. Besides the tumor type, patients’ prognosis is influenced by very late diagnosis of the tumor.
Key words:
primary tumor – small intestine – diagnostics – treatment options – surgical resection
Authors:
P. Zonča; M. Peteja
; V. Richter; P. Vávra; P. Ihnát
Authors‘ workplace:
Chirurgická klinika, FN a LF Ostravské univerzity, Ostrava, přednosta: doc. MUDr. P. Zonča, Ph. D., FRCS
Published in:
Rozhl. Chir., 2016, roč. 95, č. 9, s. 344-349.
Category:
Review
Overview
Úvod:
Tenké střevo představuje 75 % délky trávicího traktu a 90 % celkového povrchu trávicího traktu. Přesto primární zhoubné tumory tenkého střeva představují pouze 1–3 % všech neoplazií gastrointestinálního traktu. Cílem této práce je nabídnout ucelený přehled problematiky primárních zhoubných nádorů tenkého střeva – jejich výskytu, lokalizace, symptomatologie, diagnostických postupů a terapeutických možností.
Metody:
Byl proveden průzkum literatury v databázích Medline, Scopus a Google Scholar se zaměřením na problematiku primárních zhoubných nádorů tenkého střeva.
Výsledky:
Nejčastějšími primárními zhoubnými nádory tenkého střeva jsou adenokarcinom (30–40 %), neuroendokrinní nádory (35–44 %), lymfomy (10–20 %) a gastrointestinální stromální nádory (12–18 %). Symptomatologie bývá různorodá a velmi nespecifická, proto jsou primární nádory tenkého střeva často diagnostikovány až v pokročilém stadiu onemocnění. Diagnostika se opírá o standardní metody (gastrofibroskopie, kolonoskopie a CT břicha) doplněné o speciální diagnostické modality (kapslová enteroskopie, enteroskopie, CT enteroklýza, octreotidový scan atd.). Nezřídka celkový vyšetřovací proces s negativním výsledkem končí až diagnostickou laparoskopií/laparotomií.
Léčba primárních maligních nádorů tenkého střeva, které jsou operovány akutně, probíhá v souladu se standardizovanými postupy pro náhlé příhody břišní. V případě elektivních operací vyžadují jednotlivé typy nádorů specifický přístup. Při resekci adenokarcinomů a neuroendokrinních nádorů je kladen velký důraz na dosažení R0 resekce (i za cenu multiviscerálních resekcí) včetně radikální lymfadenektomie. U pacientů s GIST je prioritou radikální en-bloc resekce s bezpečnostním lemem 2–3 cm bez nutnosti lymfadenektomie. Paliativní resekce neuroendokrinních nádorů může mít velmi dobrý klinický efekt, zatímco debulking operace adenokarcinomu či GIST nemají výraznější opodstatnění.
Závěr:
Primární zhoubné nádory tenkého střeva se vyskytují zřídka. Symptomatologie je často nespecifická a pacienti obvykle přicházejí v pokročilém stadiu nemoci s komplikací způsobenou tumorem. Exaktní předoperační diagnóza není jednoduchá, dosažení R0 resekce pro pokročilost tumoru je obtížné. Prognóza je určena nejenom biologickou povahou konkrétního tumoru, ale i pozdní diagnózou.
Klíčová slova:
primární tumor – tenké střevo – diagnostika – terapeutické možnosti – chirurgická resekce
Úvod
Primární zhoubné nádory tenkého střeva zaujímají specifické postavení mezi ostatními malignitami gastrointestinálního traktu. Jde nejenom o výskyt nádorů na tenkém střevě a spektrum typů nádorů, ale rovněž o náročnější diagnostický proces. Pro pozdní diagnostiku se častěji setkáváme s operacemi v akutním stavu a také s ne zcela jednoznačně definovanými multimodálními terapeutickými postupy. Pokud se podíváme na aktuální NCCN doporučení nebo na 22. aktualizaci Modré knihy České onkologické společnosti, tak např. léčbu adenokarcinomu tenkého střeva zde vůbec nenajdeme. Ukazuje to na nízký objem dat, který neumožňuje jednoznačně na základě principů evidence based medicine stanovit doporučenou léčbu.
Tenké střevo představuje 75 % délky trávicího traktu a 90 % celkového povrchu trávicího traktu. Přesto primární zhoubné tumory tenkého střeva představují pouze 1–3 % všech neoplazií gastrointestinálního traktu [1]. Incidence nádorů tenkého střeva se pohybuje od 0,9–1,4 /100 000 obyvatel. Incidence stoupá po 30. roku života a maximum je v období od 59 do 67 let věku [2]. Distribuce jednotlivých histologických typů se v čase mění. Aktuálně stoupá incidence neuroendokrinních nádorů. V roce 1987 byl nejčastější histologický typ zhoubného nádoru tenkého střeva dle amerických dat (Surveillance, Epidemiology, and End Results, National Cancer Institute) adenokarcinom (45 %), následovaly neuroendokrinní tumor (29 %), lymfom (16 %) a gastrointestinální stromální tumor (10 %) [3]. V roce 2000 byly již častější neuroendokrinní tumory a v období od roku 1987 do roku 2005 jejich počet stoupl z 29 % na 44 %, zatímco počet adenokarcinomů klesl z 42 % na 33 %. Počty pacientů se stromálními tumory a lymfomy zůstaly přibližně stejné [4]. Celkový počet všech typů nádorů tenkého střeva však stoupá. Terapeutické možnosti a přežití pacientů zůstaly za poslední desetiletí relativně nezměněny. Včasnější diagnostické postupy a nové terapeutické možnosti budou určitě předmětem diskuzí. Cílem této práce je přehledné zhodnocení výskytu těchto nádorů, rizikových faktorů vzniku a diagnosticko-terapeutický algoritmus.
Metody
Lokalizace tumorů
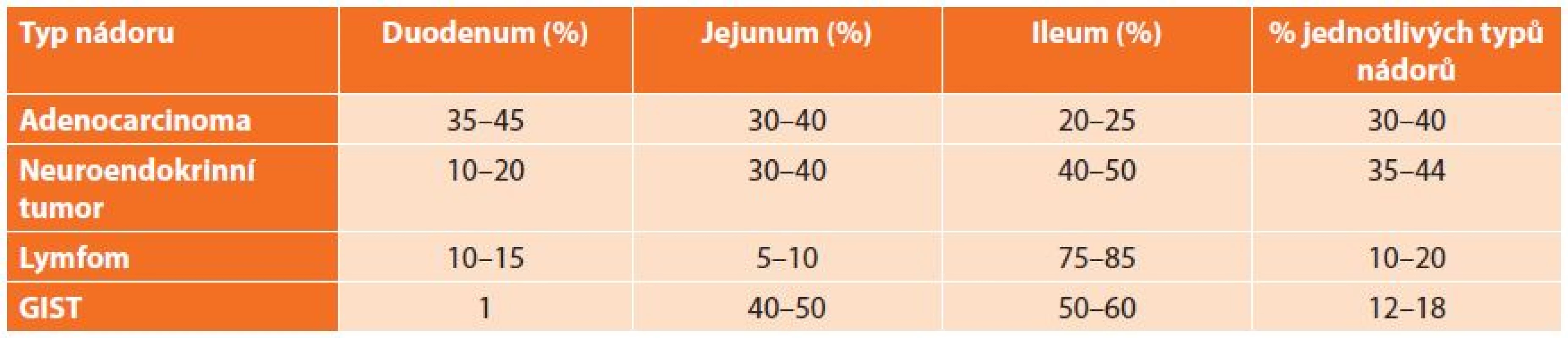
Výskyt lokalizace jednotlivých tumorů dle histologického typu v jednotlivých částech tenkého střeva se liší a je uveden v následující tabulce (Tab. 1). Obecně platí, že větší tumory se obvykle vyskytují v aborální části tenkého střeva. Orálně lokalizované tumory vedou časněji k rozvoji klinické symptomatologie na rozdíl od aborálně lokalizovaných tumorů. Neobvyklá lokalizace a mikroskopie nás nutí myslet spíše na možnost metastáz jiných zhoubných nádorů než na primární nádor tenkého střeva [5].
Adenokarcinom
Adenokarcinomy tenkého střeva vykazují obdobné histologické spektrum jako ostatní adenokarcinomy gastrointestinálního traktu. Tyto karcinomy se šíří per continuitatem, lymfogenně nebo hematogenně. Řada pacientů vzhledem k pozdnímu okamžiku diagnózy již má postižení lymfatických uzlin. Staging a grading těchto nádorů se řídí AJCC klasifikací. Rizikové faktory vzniku adenokarcinomu tenkého střeva jsou podobné jako u karcinomu tlustého střeva. Některé podmínky jsou v tenkém střevu odlišné od tlustého střeva. Celkově nižší počet adenokarcinomů ve srovnání s jinými částmi gastrointestinálního traktu souvisí s obsahem tenkého střeva. Obsah tenkého střeva je tekutý a méně irituje sliznici střeva. Rychlejší pasáž rovněž vede k nižší expozici toxických látek. Dále se udává nižší počet bakterií v tenkém střevě a s tím související nižší konverze žlučových kyselin směrem ke karcinogenním metabolitům. Dalším faktorem je vyšší obsah lymfatické tkáně ve stěně tenkého střeva a produkce IgA, intraluminální alkalické pH tenkého střeva, přítomnost enzymu benzopyrene hydroxylázy ve vyšší koncentraci než v tlustém střevě a tím efektivnější konverzi karcinogenního benzopyrenu v neškodné metabolity a rovněž přítomnost dalších enzymů v tenkém střevě [6,7].
Adenokarcinom tenkého střeva je asociován s dalšími onemocněními. Patří k nim Crohnova choroba, celiakie, familiární polypózsní syndrom, Peutz-Jeghersův syndrom a Recklinghausenova choroba, ale rovněž HNPCC. Dále byly jako rizikové faktory popsány vrozené nebo získané defekty imunity [8]. V rámci kazuistických sdělení se vyskytly rovněž adenokarcinomy v ileostomiích, pouchích nebo v Meckelově divertiklu. Další rizikové faktory typické pro vznik adenokarcinomu jsou abusus alkoholu, kouření, vysoký obsah červeného masa a polotovarů, obezita a fyzická inaktivita.
Neuroendokrinní nádory
Neuroendokrinní nádory obecně vznikají v diseminovaném neuroendokrinním systému bronchů, žaludku, střeva, pankreatu, žlučových cest, urogenitálním traktu a kůže. Produkují regulační neuropeptidy nebo hormony. Histopatologická diagnostika se řídí WHO klasifikací a ENETS konsenzem [9]. Jejich incidence je 2/100 000 v USA. Pro staging a grading se používá standardní AJCC klasifikace. Již pacienti s karcinoidy v tenkém střevu menšími než 1 cm mají vysoký počet lymfatických metastáz. Morfologická a histologická kritéria nepredikují jednoznačně chování tumoru. Na jedné straně jsou důležitá fakta, jako jsou počet mitóz, multiplicita a přítomnost karcinoidového syndromu, a na druhé straně hrají roli velikost, hloubka invaze do muscularis propria a přítomnost metastáz v lymfatických uzlinách. Tyto nádory mohou růst transmurálně invazivně a způsobovat desmoplatickou reakci s konstrikcí mezenteria a poruchou pasáže [10]. Z hlediska produkce hormonů se dělí na tumory „funkční“ a „nefunkční“.
Většina neuroendokrinních nádorů v tenkém střevě vzniká spontánně. Rizikové faktory vzniku neuroendokrinních nádorů lokalizovaných v tenkém střevě nejsou zcela jednoznačně definovány, na rozdíl např. od hereditárně vázaných MEN syndromů. Nicméně i zde můžeme identifikovat jak rizikové faktory prostředí, tak genetické faktory, které vedou ke vzniku neuroendokrinních nádorů v této lokalitě. Amin a Khazazmi referovali o riziku kouření a konzumace alkoholu se zvýšením OR o 5,8, event. 4,4 [11,12]. Stejní autoři uvádějí hereditární závislost neuroendokrinních tumorů na tenkém střevě u nordické populace vedené v databázi od roku 1950. Příbuzní prvního stupně měli 9 až 11násobné zvýšení relativního rizika vzniku nádoru. Přesná závislost na mutacích v rámci MEN1, RET, CDKN1B a NF 1 není zcela jednoznačná. Recentně byla prokázána vazba na IMPK (inositol polyphosphate multikinasa). Dále bylo poukázáno na ztrátu alely v chromozomu 18q [13]. Genetická predispozice u neuroendokrinních tumorů tenkého střeva bude muset být dále zkoumána.
Gastrointestinální stromální tumor (GIST)
Gastrointestinální stromální tumory představují nejčastější mezenchymální tumory trávicího traktu a cca 5 % všech sarkomů. Jejich celková incidence se udává 14,5/1 mil. [14]. Vznikají z mezenchymálních pluripotentních buněk, které vykazují vlastnosti intersticiálních Cajalových buněk. Používá se AJCC klasifikace. Lymfatické metastázy se objevují velmi zřídka. Většina GIST nastupuje sporadicky. Hereditární predispozice se vyskytuje zřídka. V tomto případě se jedná buď o familiární GIST s odpovídající mutací KIT nebo PDGFR-alfa genu, o GIST v rámci Carney, event. Carney Strakatis syndromu, nebo o GIST v souvislosti s neurofibomatózou 1 (morbus von Recklinghausen). Vzácně se vyskytují GIST u dětí a mladistvých (1−2 %). V tomto případě jsou častěji postiženy dívky [15]. V dětském věku se vyskytují GIST obvykle multifokálně a často se u nich dá prokázat amplifikace IGF-1 receptoru [16].
Lymfom
Extranodální lokalizace lymfomů představuje ve střední Evropě asi 40 % všech lymfomů [17]. 85 % lymfomů pochází z B buněk a 15 % z T buněk. Asi 50 % všech extranodálních lymfomů se nachází v žaludku. Specifickou skupinou jsou MALT-lymfomy (přesná klasifikace viz WHO klasifikace). Vznikají z mukózy asociované lymfatické tkáně gastrointestinálního traktu. V žaludeční lokalizaci je jednoznačná vazba k infekci bakterií Helicobacter pylori. U lymfomů lokalizovaných v tenkém střevě tato asociace není zřejmá. MALT lymfomy mají přesný imunofenotyp: SIg+, IgD-, CD5-, CD10-, CD19+, CD20+, CD22+, CD79a+, CD23-, CD43-, Cyclin D1 - [18]. Lymfomy tenkého střeva jsou asociované s celiakií a oslabením imunitního systému, jako např. při AIDS nebo po transplantacích [19]. V klasifikaci se používá Ann Arborova klasifikace.
Symptomatologie
Symptomatologie bývá často nespecifická a může se projevit celou řadou potíží. Díky nespecifičnosti a různorodosti potíží je diagnóza zhoubných nádorů tenkého střeva často opožděná, onemocnění se pak diagnostikuje v pozdním stadiu a prognóza je relativně špatná. Pacienti mají potíže jako pocity plnosti, plynatost, pocit horšího trávení. Někdy zaregistrují zvětšený obvod břicha. Může se objevit okultní krvácení s anémií. Později se dostavuje rovněž váhový úbytek. Diferenciální diagnóza zahrnuje řadu příčin bolestí břicha, jako jsou dráždivý tračník, peptická choroba, cholecystolithiasa, divertikulární choroba, endometrióza a řada dalších diagnóz. Ve velkých sériích pacientů se uvádí, že střední doba od objevení se prvních syndromů k léčbě je 7 měsíců. Tumory tenkého střeva se často nacházejí incidentálně nebo v souvislosti s komplikacemi, jako jsou např. střevní obstrukce, intususcepce, perforace či krvácení [20]. Někdy mohou primární tumory nebo jejich metastázy způsobit obstrukční ikterus.
Symptomatologie u adenokarcinomu tenkého střeva je shrnuta dle frekvence jednotlivých příznaků v následující tabulce (Tab. 2).

Pacienti s gastrointestinálním stromálním tumorem mají ve 20–50 % případů metastázy. Nejčastěji jsou v játrech nebo na peritoneu/omentu. Extraabdominální metastázy se vyskytují v méně než 10 %. Metastatické postižení plic a kostní metastázy jsou vzácné, právě tak jako postižení lymfatických uzlin jako u většiny sarkomů je relativně méně časté. GIST rostou relativně rychle, proto jejich prvním příznakem může být abdominální tlak [15,21].
Pacienti s neuroendokrinními tumory mívají často jako iniciální příznaky bolesti břicha. Tyto bývají zpočátku interpretovány jako dráždivý tračník. Popisuje se střevní ischemie v souvislosti s fibrózou mezenteria, ale také funkční při sekrečních průjmech a přerůstání bakterií ve střevě. Desmoplastická reakce může rovněž vést k hydronefróze. Neuroendokrinní tumory z hlediska produkce hormonů můžeme rozdělit na „funkční“ a „nefunkční“. Karcinoidový syndrom se vyskytuje u cca 20–30 % pacientů. Tito pacienti již mají obvykle metastázy. Flushing je častější symptom než průjem. Vyskytuje se rovněž obstrukce bronchů a kardiální potíže (Hedingerův syndrom). Obejvuje se u 25–50 % pacientů s karcinoidním syndromem. Je ukazatelem špatné prognózy. Klinicky se projevuje jako pravostranné srdeční selhávání, dilatací pravé komory nebo trikuspidální regurgitací.
Retroperitonální metastázy nebo ovariální tumory produkující tachykinin nebo serotonin mohou rovněž obejít játra a dostat se do systémového oběhu. Závažným projevem je karcinoidová krize, která se projevuje flushingem, hypotenzí nebo hypertenzí, průjmem, těžkým bronchospasmem a srdečními dysrytmiemi (22,23).
U pacientů s lymfomy se vedle gastrointestinální symptomatologie objevuje typická „B-symptomatologie“. Častěji se u těchto pacientů vyskytují perforace. Specifickou formou difuzního lymfomu tenkého střeva je imunoproliferativní onemocnění tenkého střeva (IPSID). Jedná se o tumor vycházející z B buněk. Typické jsou chronické průjmy a steatorhoea asociovaná se zvracením a křečemi břicha.
Diagnostika
Základem je pečlivá anamnéza společně s klinickým vyšetřením pacienta a základními odběry KO, koagulačních parametrů a biochemie. Již zde můžeme najít některé odchylky, jako např. sideropenickou anemii. Jako primární zobrazovací vyšetření se provádí ultrazvukové vyšetření břicha, které může při pečlivém vyšetření identifikovat tumory již od 1 cm. V případě pokročilého nálezu se pak cíleně doplňují další stagingová vyšetření.
Dále se diagnostika dělí podle naléhavosti klinických příznaků. Při neakutním stavu se pro neustávající nespecifické potíže a primární vyšetření s negativním výsledkem indikují gastrofibroskopie, kolonoskopie a CT břicha s aplikací kontrastní látky [24]. Dělá se celá paleta vyšetření k vyloučení onemocnění v rámci diferenciální diagnostiky včetně endosonografie. Provádí se pasáž gastrointestinálním traktem s vodnou kontrastní látkou, i když toto vyšetření hraje spíše okrajovou roli a preferuje se provedení CT enteroklýzy nebo MRT (Sellinck). MRT je schopno identifikovat tumory velikosti cca 15 mm. Z dalších diagnostických modalit následuje kapslová enteroskopie (rovněž identifikace tumorů velikosti cca 15 mm) nebo enteroskopie (push, double balloon) s exaktní diagnostikou intraluminálních procesů lokalizovaných v tenkém střevě.
GIST vykazují typickou heterogenitu v CT obraze, která je způsobena četnými nekrotickými okrsky [25]. Nutná je histologická verifikace. GIST jsou silně vaskularizované, proto je nutné zvážit i biopsii operační cestou. Důležité je imunohistochemické vyšetření s průkazem CD117 (KIT receptor) nebo overexpresí PDGFRA u KIT negativních nádorů. Standardem je určení mutace exonu. Jako stagingové vyšetření již vedle zmíněného CT břicha je nutné i CT hrudníku. Při podezření na multifokální proces je možné indikovat pozitronovou emisní tomografii.
U neuroendokrinních nádorů přistupují vedle radiologických technik speciální techniky nukleární medicíny. Octreotidový scan je úspěšný proporcionálně expresi somatostatinových receptorů. 85–95 % všech neuroendokrinních tumorů exprimuje somatostatinové receptory na buněčných membránách. Proto se dají diagnostikovat prostřednictvím radioaktivně značených analog somatostatinů. Senzitivita je závislá na intenzitě exprese receptorů a snižuje se přímo úměrně dediferenciaci tumoru. Tumory, které jsou primárně zobrazitelné pomocí scintigrafie octreotidovým skenem, jsou dobře diferencované – G1, G2. Pomocí 68Gallium-DOTA-TATE-PET/CT je možné dosáhnout stagingu se senzitivitou 97 %, tedy vyšší ve srovnání s Octreoscanem v kombinací s CT vyšetřením. Umožňuje identifikovat rovněž metastázy lymfatických uzlin a kostní metastázy. Je nutné zdůraznit rozdílnou afinitu radioligandů, fyzikální vlastnosti rozdílných nuklidů, rozdílné protokoly a diagnostickou senzitivitu. Pokud se použijí depotní preparáty, je doporučeno provedení diagnostiky na konci léčby. Histopatologické vyšetření s vyšetření synaptophysinu, chromograninu A a proliferační frakce s MIB1 (Ki-67). Doporučený tumorózní marker v séru je chromogranin A se senzitivitou 56–85 % a specificitou 64–96 %. Není však možné jej použít jako screeningový marker. Rovněž k základní paletě vyšetření patří určení hydroxyindoloctové kyseliny ve 24 hod. sběru moči. U pacientů s neuroendokrinním tumorem je vzhledem k možnému fibróznímu poškození srdce rovněž nutná echokardiografie [26].
U lymfomů je vedle endoskopických a zobrazovacích technik nutná exaktní histologie a provedení určení Helicobacteru pylori. V případě lokalizace v žaludku je nutná endoskopie, tato však při lokalizaci v tenkém střevě obvykle není možná. Je potřebné stagingové vyšetření s provedením CT břicha a CT hrudníku. Rovněž je potřebné vyšetření kostní dřeně, které je obligatorním vyšetřením. Rovněž je nutné vyšetření ORL, fibroskopie a kolonoskopie [18].
Celý diagnostický proces s negativním výsledkem může vyústit v diagnostickou laparoskopii/laparotomii s eventuální intraoperační enteroskopií. V akutních stavech se řídíme diagnostickým algoritmem náhlých příhod břišních.
Léčba
Léčba primárních maligních nádorů tenkého střeva se liší v závislosti na konkrétním typu tumoru a na naléhavosti stavu (NPB vs. elektivní operace). V případě akutních stavů hodnocených jako náhlá příhoda břišní se řídíme standardizovanými postupy. V případě elektivních operací vyžadují jednotlivé typy nádorů specifický přístup.
Pro léčbu adenokarcinomu platí následující zásady. Základem je dosažení R0 resekce s lymfadenekomií. Doporučuje se důkladná intraoperační revize tenkého střeva. Vzhledem k tomu, že primární operace často probíhá v akutním stavu, někteří autoři doporučují second look s radikální resekcí [27]. Asi u 50 % pacientů je možné dosáhnout R0 resekci [28]. Často se za účelem dosažení R0 resekcí provádí multiviscerální resekce. K zajištění střevní průchodnosti v paliativní situaci se mohou provést GEA nebo další typy bypassových operací. Výsledky systémové léčby nejsou zcela jednoznačné. U 68 pacientů z Mayo kliniky, kteří podstoupili kurativní resekci tenkého střeva s lymfadenektomií a následnou chemoterapii, nebyla adjuvantní léčba s výhodou. Pětileté přežití u karcinomu duodena, kdy je indikovaná duodenohemipankreatektomie, se udává v 50–60 %. V případě lokalizace na jejunu nebo ileu s pozitivními lymfatickými uzlinami je pětileté přežití méně než 15 % a v případě negativních lymfatických uzlin je pětileté přežití 50–70 % [29].
Neuroendokrinní tumory tenkého střeva často vidíme pod klinickým obrazem ileu. V důsledku metastáz do lymfatických uzlin a typické desmoplastické reakci dochází k rafii mezenteria. Důležitou zásadou je primární resekce s dosažením R0 resekce s centrální lymfadenektomií. Paliativní chirurgie má význam, i když zůstávají jaterní metastázy, a může zmírnit klinické projevy hormonálně aktivních tumorů. Nedoporučují se bypassové operace. Je doporučena profylaktická cholecystektomie, aby byla možná biologická léčba s analogy somatostatinů a rovněž lokálně ablativní zákroky, jako jsou TAE/TACE/SIRT a peptid zprostředkovaná radioreceptorová léčba (PRRT) s minimalizováním vedlejších rizik [30]. Používají se analoga somatostatinu, která u 70 % pacientů vedou k redukci symptomů. Systémová chemoterapie je málo úspěšná a nejsou k dispozici jednoznačná data pro nízkou incidenci tohoto nádoru. Hlavními prognostickými faktory jsou stadium tumoru, metastatický objem, histologická diferenciace a grade. Pětileté přežití u lokalizovaných nádorů je 100 %, v případě regionálního rozšíření 65 % a u pacientů se vzdálenými metastázami 25–35 % [31].
U pacientů s gastrointestinálními stromálními tumory je R0 resekce nejtvrdším prognostickým kritériem. Operabilní tumory mají proto být vždy odstraněny [32]. Tumory nemají pouzdro, a proto je nutné zachovat bezpečnostní lem a en-bloc resekce. Význam neoadjuvantní terapie není zcela jasný. V případě lokalizace v duodenu je indikovaná duodenohemipankreatektomie. V případě lokalizace v jejunu a ileu je doporučen 2–3cm bezpečnostní lem. Lymfadenektomie zde nehraje roli, protože se velmi zřídka objevují metastázy v lymfatických uzlinách [33,34]. Debulking operace je doporučena jen tehdy, pokud se jedná o centrálně nekrotické tumory a hrozí riziko krvácení [35]. Chirurgie je částí multimodální terapie (Glivec). Pětileté přežití se udává 60–80 %.
Lymfomy tenkého střeva jsou podstatně méně časté než lymfomy žaludku. Častěji bývají spojeny se spontánní perforací. Obvykle se jedná o pokročilé onemocnění, které není možné řešit chirurgicky. Chemo-radioterapie má horší výsledky než u žaludeční lokalizace lymfomu. Je velmi málo dat [36]. V případě stadia I-E/II-E (Ann Arbor klasifikace) je doporučena resekce. Otázkou zůstává chemoterapie. Pětileté přežití pro toto stadium je 60 %. V případě stadia III-E/IV-E (Ann Arbor klasifikace) je rovněž doporučena resekce v kombinaci s radioterapií. Pětileté přežití je však výjimečné.
Závěr
Primární zhoubné nádory tenkého střeva se vyskytují zřídka. Jedná se o nehomogenní skupinu nádorů. Symptomatologie je často nespecifická a pacienti obvykle přicházejí v pokročilém stadiu s komplikací způsobenou tumorem. Exaktní předoperační diagnóza není jednoduchá. Převládá podíl akutních operací. Pro pokročilost tumoru je obtížné dosažení R0 resekce. Prognóza je určena nejenom biologickou povahou konkrétního tumoru, ale i pozdní diagnózou.
Seznam použitých skratek
AIDS Acquired Immune Deficiency Syndrome
AJCC American Joint Committee on Cancer
CT Computed tomography
ENETS European Neuroendocrine Tumor Society
GEA Gastroenteroanastomosis
GIST Gastrointestinal stromal tumors
HNPCC Hereditary nonpolyposis colorectal cancer
IPSID Immunoproliferative small intestinal disease
MALT Mucosa associated lymphoid tissue
MEN Multiple Endocrine Neoplasia
NCCN National Comprehensive Cancer Network
PRRT Peptide Receptor Radionuclide Therapy
SIRT Selective internal radiation therapy
TAE Transcatheter arterial embolisation
TACE Transarterial Chemo Embolization
WHO World Health Organisation
Práce byla přednesena formou přednášky na Pražských chirurgických dnech 16. 5. 2016.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
Doc. MUDr. Pavel Zonča, Ph.D., FRCS
Ruskova 681
724 00 Ostrava
e-mail: pavel.zonca@fno.cz
Sources
1. DiSario JA, Burt RW, Vargas H, et al. Small bowel cancer: epidemiological and clinical charasteristics from a population-based registry. Am J Gastroenterol 1994;89 : 699–701.
2. Pennazio M, Rondonotti E, de Franchis R. Capsule endoscopy in neoplastic diseases. WJG 2008; 14 : 5245–53.
3. Weiss NS, Yang CP. Incidence of histologic types of cancer of the small intestine. J Natl Cancer Inst. 1987;78 : 65.
4. Bilimoria KY, Bentrem DJ, Wayne JD, et al. Small bowel cancer in the United States: changes in epidemiology, treatment, and survival over the last 20 years. Ann Surg 2009;249 : 63.
5. Hoffmann J, Neu B, Tympner C, et al. Dünndarmtumoren, Manual Gastrointestinale Tumoren. 8. Auflage 2010 : 131–8., Mnichov, Zuckschwerdt verlag
6. Oliverius M, Wohl R. Adenocarcinoma of the small intestine. Rozhl Chir 2003;82 : 529–32.
7. Chmátal P, Lednický L, Hájek M. Adenocarcinoma of the small intestine: a rare diagnosis. Rozhl Chir 2003;82 : 324–6.
8. Xynopoulos D, Mihas A, Paraskevas E, et al. Small bowel tumors. Annals of Gastroenterology 2002;15 : 18–35.
9. Rindi G, Kloppel G, Couvelard A, et al. TNM staging of midgut and hindgut (neuro) endocrine tumors: a consensus proposal including a grading system. Virchows Arch 2007;451 : 757–62.
10. Turan M, Karadayi K, Duman M, et al. Small bowel tumors in emergency surgery. Turkish Journal of Trauma & Emergency Surgery 2010;16 : 327–33.
11. Amin S, Warner RR, Itzkowitz SH, et al. The risk of metachronous cancers in patients with small-intestinal carcinoid tumors: a US population-based study. Endocr Relat Cancer 2012;19 : 381–7.
12. Kharazmi E, Pukkala E, Sundquist K, et al. Familial risk of small intestinal carcinoid and adenocarcinoma. Clin Gastroenterol Hepatol 2013;11 : 944–9.
13. Järhult J, Landerholm K, Falkmer S, et al. First report on metastasizing small bowel carcinoids in first-degree relatives in three generations. Neuroendocrinology 2010;91 : 318–23.
14. Nilsson B, Bümming P, Meis-Kindblom JM. Gastrointestinal stromal tumors: The incidence, prevalence, clinical course, and prognostication in the preimatinib era. Cancer 2005;103 : 821–9.
15. Pohnán R, Ryska M, Dolezel R, et al. Gastrointestinal stromal tumor – analysis of a patient group, literature overview. Rozhl Chir 2009;88 : 629–33.
16. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol 2006;23 : 70–83.
17. Dallenbach FE, Coupland SE, Stein H. Marginalzonenlymphome: extranodale vom MALT-typ, nodale und splenische. Pathologe 2000;21 : 162–77.
18. Hiller E, Ihrler R, Wilkowski R. Gastrointestinale Lymphome. Manual gastrointestinale Tumoren. 8. Auflage 2010 : 243−52.
19. Smejkal P, Pazdro A, Smejkal M, et al. Lymphoma of the small intestine. Rozhl Chir 2002;81 : 37–9.
20. Attanoos R, Williams GT. Epithelial and neuroendocrine tumors of the duodenum. Sem Diagn Pathol 1991;8 : 149–62.
21. Ihnát P, Vávra P, Zonča P. Treatment strategies for colorectal carcinoma with synchronous liver metastases: Which way to go? World J Gastroenterol 2015;21 : 7014−21.
22. Pape UF, Böhmig M, Berndt U, et al. Survival and clinical outcome of patients with neuroendocrine tumors of the gastroenteropancreatic tract in a German referral center. Ann NY Acad Sci 2004;1014 : 222–33.
23. Castillo JG, Filsoufi F, Adams DH, et al. Management of patients undergoing multivalvular surgery for carcinoid heart disease: the role of the anaesthetist. Br J Anaesth 2008;101 : 618–26.
24. Dubaj M, Bakos E, Galko J, et al. Primary tumors of the duodenum and the small intestine in our clinical study subjects over a ten-year period. Rozhl Chir 2006;85 : 90–2.
25. Burkill GJ, Badran M, Al-Muderis O, et al. Malignant gastrointestinal stromal tumor: distribution, imaging features, and pattern of metastatic spread. Radiology 2003;226 : 527–32.
26. Auernhammer CJ, Assmann G, Bartenstein P, et al. Neuroendokrine Tumoren des Gastrointestinaltraktes. Manual gastrointestinale Tumoren. 8. Auflage, Mnichov, V. Zuskschwerdt Verlag 2010;229–42.
27. Abrahamas NA, Halverson A, Fascio VW, et al. Adenocarcinoma of the small bowel. A study of 37 cases with emphasis on histologic prognostic factors. Dis Colon Rectum 2002;45 : 1496–1502.
28. Baily AA, Debinski HS, et al. Diagnosis and outcome of small bowel tumors found by capsule endoscopy: a three-center Australian experience. Am j Gastroenterol 2006;101 : 2237–43.
29. Bakaeen FG, Murr MM, Sarr MG et al. What prognostic factors are important in duodenal adenocarcinoma? Arch Surg 2000;135 : 635–41.
30. Ihnát P, Ihnát Rudinská L, Zonča P. Radiofrequency energy in surgery: state of the art. Surg Today 2014;44 : 985–91.
31. deHerder WW, O´Tolle D, Rindi G, et al. ENETS Consensus Guidelines for the Diagnosis and Treatment of Neuroendorine Gastrointestinal Tumors, 2008, Part 2 - midgut and hindgut tumors. Neuroendoscrinology 2008;87 : 1–63.
32. Pierie JP, Choundry U, Mizikansky A, et al. The effect of surgery and grade on outcome of gastrointestinal stromal tumors. Arch Surg 2001;136 : 383–9.
33. Fiala L, Šefr R, Kocáková I, et al. Treatment of gastrointestinal stromal tumors – a comprehensive view of the surgeon. Rozhl Chir 2015;94 : 189–92.
34. Ihnát P, Martínek L, Ihnát Rudinská L, et al. Circumferential resection margin in the modern treatment of rectal cancer. Rozhl Chir 2013;92 : 297–303.
35. Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastointestinal stromal tumors (GISTs): a review. Eur J Cancer 2002;38 Suppl 5.39–51.
36. Ramot B, Shahin N, Bubis JJ. Malabsorption in a lymphoma of small intestine. A study of 13 cases. Isr Med Sci 1995;1 : 221–6.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2016 Issue 9
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Primární zhoubné nádory tenkého střeva
- Krvácení po pankreatektomii (PPH), prevalence, diagnostika a řešení
- Kvalita života po extenzivních pánevních operacích
- Cirkumskriptní a difuzní peritonitis: závažné komplikace po operacích bariatrické a metabolické chirurgie, specifika při jejich diagnostice a terapii
- Synchronní kolorektální karcinom a nehodgkinský lymfom – popis dvou případů
- Corpus alienum − migrující cizí těleso
- Koincidence lymfomu tračníku a biliárního ileu – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Primární zhoubné nádory tenkého střeva
- Corpus alienum − migrující cizí těleso
- Cirkumskriptní a difuzní peritonitis: závažné komplikace po operacích bariatrické a metabolické chirurgie, specifika při jejich diagnostice a terapii
- Synchronní kolorektální karcinom a nehodgkinský lymfom – popis dvou případů
