Kardiovaskulární změny v těhotenství II
Preeklampsie a její pozdní následky pro matku a dítě
Cardiovascular changes in pregnancy II.
Preeclampsia and its long-term consequences for mother and offspring
The most often complication is preeclampsia which affects 3 % to 5 % of pregnancies and is a leading cause of maternal mortality, expecially in developing countries. Epidemiological studies have repeatedly described, that preeclampsia contributes to future cardiovascular disease. The investigation of possible mechanisms of preeclampsia may lead to new insights into the pathogenesis of cardiovascular disease in women and open the new practical goals for prevention
Key words:
cardiovascular diseases – elevated risk – epidemiologic evidence – preeclampsia – prevention – pregnancy – possible pathways
Authors:
Liana Greiffeneggová 1,2; Drahoslava Hrubá 2
Authors‘ workplace:
Katedra porodní asistence a zdravotnických záchranářů, LF MU, Brno
1; Ústav ochrany a podpory zdraví, LF MU, Brno
2
Published in:
Prakt Gyn 2016; 20(3-4): 143-146
Category:
Gynecology and Obstetrics
Overview
Preeklampsie je nejčastější komplikací, která se vyskytuje ve 3 % až 5 % těhotenství a je hlavní příčinou úmrtností matek, zejména v rozvojových zemích. Epidemiologické studie opakovaně popsaly, že preeklampsie přispívá k výskytu kardiovaskulárních onemocnění v dalším životě. Studium pravděpodobných mechanizmů preeklampsie může otevřít nové pohledy na patogenezi kardiovaskulárních nemocí žen a také nové praktické úkoly pro prevenci.
Klíčová slova:
epidemiologické důkazy – kardiovaskulární nemoci – možné mechanizmy – preeklampsie – prevence – těhotenství – zvýšené riziko
Úvod
Preeklampsie (PE) je klinický syndrom, charakterizovaný manifestací hypertenze a proteinurie v průběhu těhotenství. Hypertenze je spojena s periferní vazokonstrikcí [1], proteinurie je vyvolána renálními lézemi, při kterých zmohutní endoteliální buňky v glomerulech a v důsledku toho zmizí endoteliální perforace a sníží se glomerulární filtrace (tzv. glomerulární endotelióza) [2].
Preeklampsie se obvykle klinicky manifestuje po 34. týdnu těhotenství. Někteří odborníci rozlišují dvě formy: časnou (do 34. týdne těhotenství) a pozdní (po tomto rozhraní). Zdá se, že časná PE je z pohledu patofyziologie odlišné onemocnění (od pozdního typu se liší neutrofilními funkcemi a hladinami cytokinů) a zvyšuje riziko opakování potíží v konci těhotenství. Je také významným signálem pro predikci intrauterinní růstové retardace plodu [3].
Vzhledem k tomu, že PE je systémové vaskulární poškození, mohou být postižena játra a mozek matky. Závažnou variantou PE je HELLP syndrom s hemolýzou, zvýšením jaterních enzymů, snížením počtu krevních destiček a roztroušenou intravaskulární kolagulací. Obávanou komplikací PE je eklampsie, charakterizovaná přítomností záchvatů. Cerebrovaskulární komplikace zahrnují hemoragické mozkové cévní příhody [4].
Rizikové faktory PE
Pravděpodobně se alespoň částečně uplatňují genetické faktory; výskyt PE je vyšší u žen s rodinnou anamnézou PE, a to nejen v linii matek, ale i otců. Až 7krát častější je výskyt PE u žen v dalších těhotenstvích, pokud měly tuto komplikaci již ve své první graviditě. Riziko PE rovněž zvyšuje vícečetné těhotenství. Pravděpodobnost PE dále zvyšují matčin věk (> 40 let), její inzulinová rezistence, diabetes mellitus, obezita, hypertenze přítomná před otěhotněním, nemoci ledvin a chronický zánět [4], také početí po použití IVF – ISCI (in vitro fertilisation -intracytoplazmatická injekce spermií) [5].
Protektivní efekt má naopak kouření [6], což se nověji vysvětluje redukcí produkce anti-angiogenního faktoru sFlt-1 vlivem zvýšeného obsahu oxidu uhelnatého v krvi kuřaček [7].
Mechanizmus vzniku PE
Novější literatura pokládá PE za následek defektů placenty v důsledku endoteliální dysfunkce, která je považována za ústřední součást patofyziologie PE.
Na rozdíl od žen s fyziologickým průběhem těhotenství je u žen s pozdějším rozvojem PE hned od počátku těhotenství invaze buněk cytotrofoblastu nekompletní, buňky jsou přítomné jen v povrchové vrstvě decidua, a proto nedochází k remodelaci spirálních arterií, které zůstávají vysoce rezistentní a zúžené. Cévy izolované z měkkých tkání žen s PE nesou známky endoteliální dysfunkce s poruchou vazodilatace. K abnormálnímu vývoji placenty může přispívat i hypoxie. Tento proces je základem zhoršené prostupnosti placenty [8].
V krevním oběhu žen s PE byly nalezeny faktory vylučované poškozeným endoteliem (např. endotelin 1, fibronektin, trombomodulin a von Willebrandův faktor, což jsou markery oxidativního stresu) a rovněž zánětlivé cytokiny. Současně byly sníženy hladiny vazodilatačních faktorů (prostacyklinu a NO) [9].
Sekrece antiangiogenních faktorů (sFlt1, s-endoglinu), které jsou potentními inhibitory aktivity proangiogenních VEGF (vascular endothelial growth factor) a PIGF (placental growth factor), je zvýšená (až 4násobně) už několik týdnů před klinickou manifestací PE a přetrvává i po porodu.
Ve většině případů PE bylo možno klinickou manifestaci vysvětlit antiangiogenním účinkem sFlt1 a s-endoglinu, přičemž hodnoty faktoru sFlt1 korelují se závažností PE. Vyšetření hladin PIGF v moči, zejména nižší hodnoty v 1. trimestru, se užívá jako markeru pravděpodobnosti výskytu PE v dalším průběhu těhotenství. Za přesnější metodu pro hodnocení se pokládá vzájemný poměr pro - a antiangiogenních faktorů sFlt-/PIGF [4]. U žen s PE se začínají hladiny s-endoginu zvyšovat dříve než u fyziologických těhotenství (od 20. vs 33. týdne). Alterace proangiogenních PIGF a antiangiogenních sFlt1 a s-endoglinu narušuje formování NO a funkci cév [9].
Na rozdíl od fyziologického těhotenství je u PE zvýšená vnímavost na účinky angiotenzinu II a tento stav může přetrvávat i po porodu a v dalším životě [9].
Placenta při PE produkuje mnohem víc volných radikálů a má menší antioxidační kapacitu než normální placenta; uteroplacentární ischemie vede k zánětlivým procesům a poškození cév. V krevním oběhu se nacházejí placentální „odštěpky“ a jejich množství pozitivně koreluje s cirkulujícími hladinami sFlt1. Bohužel, dosavadní zkoumání nepřineslo pozitivní závěry, že podávání antioxidačních vitaminů (C, E) by mohlo být používáno v prevenci PE [4].
Diagnostika PE
Diagnostika PE je založena na klinických měřeních krevního tlaku (>140/90 torrů) a proteinurie (>3 g/24 hodin). Jiné specifické laboratorní testy zatím neexistují; i poměr sFlt1 a PIGF (> 85) není spolehlivý, protože některé případy PE nejsou provázeny změnami těchto faktorů. Přesto se toto laboratorní vyšetření používá stále častěji a v Německu bylo už v r. 2013 doporučeno jako standardní vyšetřovací metoda [10]. Určitým pomocným vyšetřením jsou zvýšené hladiny sérového cholesterolu a naopak snížení hodnot NO, vyšetření jaterních testů, kyseliny močové. Spíše se zdá, že by mohly odlišit diferenciální diagnózu u případů, v nichž je hypertenze nebo proteinurie přítomna z jiných důvodů (např. diabetes mellitus) [11,12]. Závažná forma PE je charakterizována vyšší hypertenzí (> 160/110 torrů), i 24hodinovou proteinurií (> 5 g), oligurií (< 500 ml/24 hod), poruchami vidění, plicním edémem, bolestmi v epigastriu, poruchami jaterních funkcí a trombocytopenií. U HELLP syndromu se zvyšují jaterní enzymy a snižuje se počet krevních destiček (< 100 000/mm3) [12].
PE jako riziko pro plod
Poškození plodů se u potomků žen s PE projevuje intrauterinní růstovou retardací, nezralostí, bronchopulmonální dysplazií; zvyšuje se také riziko perinatálního úmrtí [4].
U potomků matek s PE byly v jejich mladém věku nalezeny cévní dysfunkce v plicích i ostatních orgánech, nicméně mechanizmus vyvolávající tento fenotyp zatím známý není. Ve studii, která porovnávala tlak v pulmonální arterii a dilataci zprostředkovanou krevním proudem (flow-mediated dilatation) v a. brachialis u 13letých potomků žen s PE a s fyziologickým těhotenstvím, byly hodnoty pulmonálního tlaku v průměru o 30 % vyšší a naopak hodnoty dilatace o 30 % menší u dětí matek s PE. Pulmonální arteriální tlak se snížil po inhalaci NO, jehož účinek byl 2krát vyšší u dětí matek s PE, nicméně zůstával signifikantně nižší než u kontrolní skupiny. Je možné, že v rizikovém těhotenství došlo k remodelování plicních cévních stěn s následnými defekty v jejich struktuře. Rozdíly nebylo možno vysvětlit rozdílnou pulmonální mikrocirkulací, neboť difuzní kapacita CO byla u obou skupin stejná. Předpoklad souvislosti zvýšeného pulmonálního tlaku s PE podporuje i zjištění, že sourozenci těchto rizikových dětí, narození stejným matkám, u nichž ale těhotenství probíhalo fyziologicky, měli vaskulární funkce normální. PE může přispívat k pulmonální hypertenzi a možná i k pozdějšímu vývoji plicního edému a předčasným kardiovaskulárním onemocněním (KVO) u potomků [13]. Tyto hypotézy potvrdily už i některé epidemiologické studie popisující vyšší výskyt arteriální hypertenze a cévní mozkové příhody u potomků narozených z PE těhotenství [14,15].
Pozdní následky PE pro matky
Řada velkých retrospektivních epidemiologických studií jednoznačně demonstrovala, že ženy s anamnézou PE v těhotenství mají v dalším životě zvýšené riziko KVO [16,17]. Riziko dále zvyšuje kombinace PE s předčasným porodem [16] nebo spontánním potratem [18].
Ještě významnější jsou dlouhodobé studie prospektivní, které mohou podchytit ostatní rizikové faktory KVO a přesněji definovat příspěvek prodělané PE. První prospektivní studii publikovali v r. 1997 Hannaford et al [19], ale nepoužívali standardní definici PE a KVO.
Izraelská studie sledovala po dobu 24 až 36 let více než 37 tisíc žen (z nich 1 070 s PE) a zjistila, že relativní riziko (RR) věkově standardizované úmrtnosti je u žen s PE 2,1krát vyšší ve srovnání s kontrolním souborem (95% CI 1,8–2,5) a manifestuje se až po 20 letech po porodu. Hlavní podíl na úmrtnosti měly KVO [19].
Kalifornská studie Child Health and Development sledovala 14 403 žen (481 s PE), kterým bylo v době těhotenství v průměru 26 roků, po dobu 37 let. Riziko úmrtí na KVO bylo 2,14 (95% CI 1,29–3,57). Autoři rovněž zjistili významné rozdíly mezi následky časné a pozdní PE: ve věku 56 let přežívalo 85,9 % žen s časnou formou a 98,3 % žen s pozdní formou PE. Výsledky se nezměnily po zohlednění ostatních rizikových faktorů (hypertenze před otěhotněním, porod dítěte s intrauterinní růstovou retardací, socioekonomických faktorů, BMI, kouření) [20]. Autoři zdůrazňují, že v těhotenství je nutné diferencovat mezi PE a prostou hypertenzí bez proteinurie, která se zvýšeným rizikem KVO spojena není.
Metaanalytické zhodnocení pěti případových a 10 kohortových studií, zahrnujících 116 175 žen s PE a 2 259 576 žen s fyziologickým těhotenstvím, se zaměřilo na hodnocení prevalence různých forem KVO ve věku 56+ let; ženy s PE měly rizika zvýšená. U nemocí srdce RR 2,47 (95% CI 1,22–5,0), u cerebrovaskulárních nemocí RR 2,03 (95% CI 1,54–2,67), nemocí periferních arterií RR 1,87 (95% CI 0,94–3,73) a RR úmrtnosti na KVO 2,29 (95% CI 1,73–3,04). Studie rovněž prokázala signifikantní vztahy k závažnosti předchozí PE: u slabé formy bylo RR srdečního onemocnění 2,00, u středně silné RR 2,99 a závažné RR 5,36 [21].
Jiná metaanalýza zpracovala výsledky retrospektivních a prospektivních studií, publikované v letech 1960–2006, zahrnující celkem 3 488 160 žen, z toho téměř 200 000 s PE v anamnéze. Autoři mohli identifikovat, po jaké době se manifestuje zvýšené riziko pro různé typy KVO (tab).
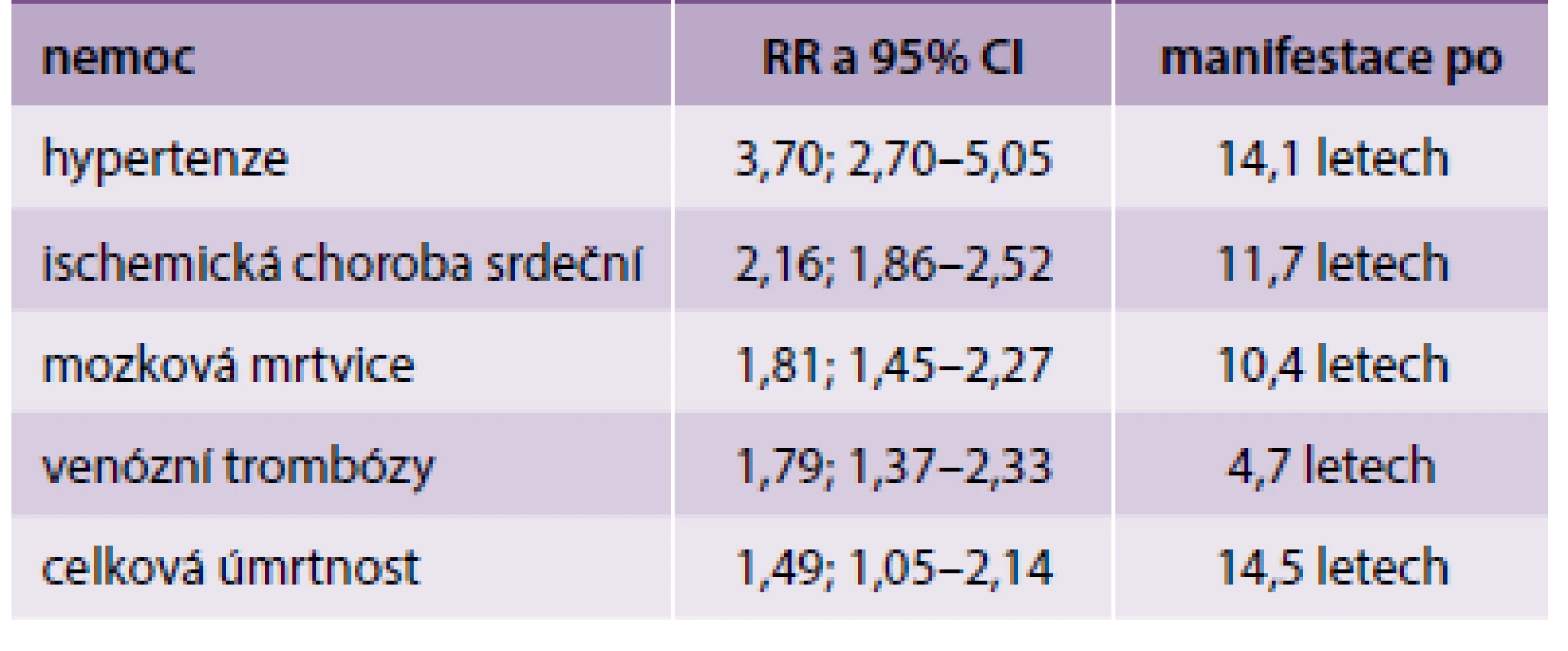
Naopak prodělaná PE nezvyšovala riziko žádného rakovinového onemocnění (včetně rakoviny prsu) během 17 let po diagnóze PE [22].
Několik desítek let trvající longitudinální prospektivní epidemiologické studie jsou vysoce náročné, nicméně na přetrvávající riziko endoteliální dysfunkce mohou upozornit i krátkodobější sledování několik měsíců po porodu. Ženy, které prodělaly PE, vykazovaly ještě po celý rok vyšší hodnoty krevního tlaku, srdeční tepové frekvence a poruchy epiteliálně závislé vazodilatace než ženy s fyziologickým těhotenstvím. Ženy po fyziologickém těhotenství měly dokonce lepší výsledky měření srdečních funkcí než ženy, které nikdy nebyly těhotné. Autoři vyslovují názor, že normální těhotenství přináší pozitivní dlouhodobý efekt na endoteliální funkce [23]. Taková prospektivní několikaměsíční sledování umožňují odhalit ženy se zvýšeným rizikem, usnadňují jejich motivaci ke změně způsobu života ve smyslu výrazné eliminace známých rizikových faktorů KVO a případně iniciují včasné zahájení adekvátní terapie.
Protože PE zahrnuje i poškození renálních funkcí, jsou cenné prospektivní studie norských autorů, kteří zjistili, že ještě 5 let po porodu přetrvává u žen s PE mikroalbuminurie a že se rovněž zvyšuje riziko závažných onemocnění ledvin (tzv. end-stage renal disease – ESRD), definovaných potřebou dlouhodobého léčení dialýzou nebo transplantace. U 477 žen z 570 000 se ESRD projevila v průměru po necelých 18 letech po 1. těhotenství a riziko souviselo s počtem těhotenství, během nichž byla PE diagnostikována: při jednom těhotenství RR 4,7 (95% CI 3,6–6,1), při dvou těhotenstvích RR 6,4 (95% CI 3,0–13,5) a při PE ve třech těhotenstvích bylo RR 15,5 (95% CI 7,8–30,8). Riziko se dále zvyšovalo, pokud PE byla spojena s předčasným porodem nebo novorozencem s intrauterinní růstovou retardací [24].
Globální dopady preeklampsie a eklampsie
Preeklampsie se vyskytuje asi u 3–5 % těhotenství a při průměrném počtu 128,9 milionů porodů (na světě) je každoročně přibližně 3,87 až 6,45 milionů těhotenství komplikováno PE. Při průměrném RR 2,33 pro pozdější výskyt KVO přispívá PE k 150 800 až 361 000 případů KVO u žen každý rok [25].
PE je příčinou úmrtí asi půl milionu těhotných matek každý rok, převážně v rozvojových zemích, v nichž se péče o těhotné nijak nezlepšuje, v záchraně životů matek a dětí není viditelný pokrok a jejich ztráty jsou pokládány za nevyhnutelnou tragédii. V Asii a Africe je úmrtnost matek 100–200krát vyšší než v Evropě a Severní Americe. Riziko úmrtí během těhotenství je v rozvojových zemích 16–69 případů/10 000 těhotenství, ve vyspělých zemích 1–2 případy/10 000 těhotenství; hlavní příčinou bývá eklampsie, jejíž rozvoj narůstá tam, kde je nízká nebo dokonce žádná prenatální péče o matku a dítě. PE a eklampsie jsou spojeny s dalšími závažnými onemocněními ledvin, jater, oběhového a dýchacího ústrojí a až s 10% indikací operativního porodu císařským řezem. Protože PE porušuje vývoj plodu a zvyšuje pravděpodobnost perinatálního úmrtí dítěte, jsou ženy vystaveny také posttraumatickému stresu a poporodním depresím. Úmrtnost novorozenců matek s PE je v rozvojových zemích třikrát vyšší než v průmyslově vyspělých státech. Děti, které přežijí, mají zvýšené riziko mozkových obrn i KVO a diabetes mellitus v pozdějším životě [25].
Ve vyspělých zemích se během 20. století pojetí péče o zdraví matek a dětí změnilo z čistě domácí záležitosti na prioritu veřejného zdraví s odpovídající odpovědností státu. Na počátku 21. století byla péče o matku a dítě povýšena do základních lidských práv a cílem je redukovat dosavadní nerovnost mezi chudými a bohatými státy i jedinci [26].
Závěr
Přes rozsáhlý výzkum věnovaný problematice preeklampsie a eklampsie, zůstává stále mnoho nejasností o etiologii a mechanizmech vzniku těchto těhotenských komplikací. Nověji se pozornost soustřeďuje na prekoncepční období, ve kterém se u žen s pozdější PE vyskytují častěji některé rizikové faktory (hypertenze, diabetes, zvýšená inzulinová rezistence, obezita, poruchy lipidového spektra, zvýšené koncentrace homocysteinu v plazmě). Je možné, že ženy, u nichž se rozvine PE, jsou vnímavé k „metabolickému stresu“, který těhotenství představuje, a že metabolické abnormality a endoteliální poškození vyústí ve větší vnímavost ke KVO v pozdějším životě. Tak může být těhotenství „stresovým testem“ pro další vývoj zdraví.
Z uvedeného vyplývá nutnost dalších preventivních opatření, na která by měla být v porodnici upozorněna žena s komplikací PE, případně ve spojení s poruchami vývoje plodu a předčasného porodu:
- seznámení ženy se zvýšeným rizikem KVO a onemocnění ledvin v horizontu příštích 15–20 let
- motivace k vyvarování se způsobu života zahrnujícího rizikové faktory (nezdravá výživa, nedostatečný pitný režim a pohybová aktivita, kouření)
- informování ošetřujícího praktického lékaře o zvýšeném riziku a doporučení sledování rizikových faktorů v rámci sekundární prevence s případným včasným zahájením odpovídající léčby
- na možnost zvýšeného rizika KVO u dítěte je třeba upozornit i praktického pediatra, který o dítě přebírá péči
Doručeno do redakce 16. 5. 2016
Přijato po recenzi 2. 9. 2016
Mgr. Liana Greiffeneggová
grei@med.muni.cz
Katedra porodní asistence a zdravotnických záchranářů LF MU,
Brno
www.med.muni.cz
Sources
1. Thadhani R, Ecker JL, Kettyle F et al. Pulse pressure and risk of preeclampsia: s prospective study. Obstet Gynecol 2001; 97(4): 515–520.
2. Stillman IE, Karumanchi SA. The glomerular injury of preeclampsa. J Am Soc Nephol 2007; 18(8): 2281–2284.
3. von Dadaelszen P, Magee LA, Roberts JM. Subclassification of preeclampsia. Hypertension in Pregnancy 2003; 22(2): 143–148.
4. Powe CE, Levine RJ, Karumanchi SA. Preeclampsia: a disease of the maternal endothelium. The role of antiangiogenic factors and implications for later cardiovascular disease. Circulation 2011; 123(24): 2856–2869. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.109.853127>.
5. Wang JX, Knottnerus AM, Schuit G et al. Surgically obtained sperm, and risk of gestational hypertenson and pre-eclampsia. Lancet 2002; 359(9307): 673–674.
6. Conde-Agudelo A, Althabe F, Belizan JM et al. Cigarette smoking during pregnancy and risk of preeclampsia: a systematic review. Am J Obstet Gynecol 1999; 181(4): 1026–1035.
7. Karumanchi SA, Levine RJ. How does smoking reduce the risk of preeclampsia? Hypertension 2010; 55(5): 1100–1101. Dostupné z DOI: <http://dx.doi.org/10.1161/HYPERTENSIONAHA.109.148973>.
8. Zhou Y, Damsky CH, Fisher SJ. Preeclampsia is associate with failure of human cytotrophoblast to mimic a vascular adhesion phenotype: ona cause of defective endovascular invasion in this syndrome? J Clin Invest 1997; 99(9): 2152–2164.
9. Sandrim VC, Palei AC, Metzger IF et al. Nitric oxide formationis inversaly related to serum levels of antiangiogenic factors solublefms-liketarosine kinase-1 and soluble andogline in preeclampsia. Hypertension 2008; 52(2): 402–407. Dostupné z DOI: <http://dx.doi.org/10.1161/HYPERTENSIONAHA.108.115006>.
10. Bálková O. Novinky v laboratorní diagnostice a predikci preeklampsie. Prakt Gyn 2014; 18(2): 127–129.
11. Powers RW, Roberts JM, Cooper KM et al. Maternal serum soluble fms-like tyrosine kinase 1 concentrations are not increased in early pregnancy and decrease more slowly postpartum in women who develop preeclampsia. Am J Obstet Gynecol 2005; 193(1): 185–191.
12. Germain AM, Romanik MC, Guerra I et al. Endothelial dysfunction: A link among preeclampsia, recurrent pregnancy loss, and future cardiovascular events? Hypertension 2007; 49(1): 90–95.
13. Jayet PY, Rimoldi SF, Stuber T et al. Pulmonary and systemic vascular dysfunction in young offspring of mothers with preeclampsia. Circulation 2010; 122(5): 488–494. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA>.
14. Vatten LJ, Romundstad PR, Holmen TL et al. Intreuterine exposure to preeclampsia and adolescent blood pressure, body size and age at menarche in female offsprings. Obstet Gynecol 2003; 101(3): 529–533.
15. Kajantie E, Eriksson JG, Osmond C et al. Preeclampsia is associated with increased risk of stroke in the adult offspring: the Helsinki birth cohort study. Stroke 2009; 40(4): 1176–1180. Dostupné z DOI: <http://dx.doi.org/10.1161/STROKEAHA.108.538025>.
16. Ray JG, VermeulenMJ, SchullMJ et al. Cardiovascular health after maternal placental syndromes (CHAMPS): population-based retrospective cohort study. Lancet 2005; 366(9499): 1797–1803.
17. Lykke JA, Langhoff-Roos J, Sibai BM et al. Hypertensive pregnancy disorders and subsequent cardiovascular morbidity and type 2 diabetes mellitus in the mother. Hypertension 2009; 53(6): 944–951. Dostupné z DOI: <http://dx.doi.org/10.1161/HYPERTENSIONAHA.109.130765>.
18. Pell JP, Smoth GC, Walsh D. Pregnancy complications and subsequent maternal cerebrovascular events: a retrospective cohort study of 119.668 births. Am J Epidemiol 2004; 159(4): 336–342.
19. Funai EF, Friedlander Y, Paltiel O et al. Long-term mortality after preeclampsia. Epidemiology 2005; 16(2): 206–215.
20. Mongraw-Chaffin ML, Cirillo PM, Cohn BA. Preeclampsia and cardiovascular disease death: prospective evidence from the Child Health and Development Studies Cohort. Hypertension 2010; 56(1): 166–171. Dostupné z DOI: <http://dx.doi.org/10.1161/HYPERTENSIONAHA.110.150078>.
21. McDonald SD, Malinowski A, Zhou Q et al. Cardiovascular sequelae of preeclampsia/eclampsia: A systematic review and meta analyses. Am Heart J 2008; 156(5): 918–930. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ahj.2008.06.042>.
22. Bellamy L, Casas J-P, Hingorani AD et al. Pre-eclampsia and risk of cardiovascular disease and cancer in later life: systematic review and meta analysis. BMJ 2007; 335(7627): 974. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.39335.385301.BE>.
23. Agatisa PK, Ness RB, Roberts JM et al. Impairment of endothelial function in women with a history of preeclampsia: an indicator of cardiovascular risk. Am J Physiol Heart Circ Physiol 2004; 286(4): H1389-H1393.
24. 24.Vikse BE, Irgens LM, Leivestad T et al. Preeclampsia and the risk of end-stage renal disease. N Engl J Med 2008; 359(8):800–809. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0706790>.
25. Duley L. The global impact of pre-eclampsia and eclampsia. Semin Perinatol 2009; 33(3): 130–137. Dostupné z DOI: <http://dx.doi.org/10.1053/j.semperi.2009.02.010>.
26. Hunt P. Maternal health and human rights. Lancet 2008; 371(9608): 203. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(08)60129–4>.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2016 Issue 3-4
-
All articles in this issue
-
Kardiovaskulární změny v těhotenství II
Preeklampsie a její pozdní následky pro matku a dítě - Konzervativní terapie kornuální gravidity s použitím metotrexátu
- Preeklampsie dnes a zítra
- Môže byť semikvantitatívne vyšetrenie glukózy v plodovej vode v gynekológii a pôrodníctve užitočné? Pilotná štúdia.
- Bezbolestný porod v roce 2016
- Strach tehotných žien
- Rehabilitace po gynekologických břišních operacích
- Vybrané psychometrické vlastnosti české verze dotazníku FACT-B (verze 4) měření kvality života u pacientek s karcinomem prsu
-
Kardiovaskulární změny v těhotenství II
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Rehabilitace po gynekologických břišních operacích
- Konzervativní terapie kornuální gravidity s použitím metotrexátu
- Preeklampsie dnes a zítra
- Bezbolestný porod v roce 2016
