CO JE NOVÉHO V HODNOCENÍ PATOLOGIE KARCINOMU PROSTATY V ROCE 2006
WHAT'S NEW IN PROSTATE CANCER PATHOLOGY ASSESMENT IN 2006
This review summarizes developments over the last year in the pathology of prostate cancer and its precursors. Issues relating to the pathology are critical in the diagnosis, management, and prognostication of prostate cancer. New data has emerged regarding the pathology of prostate cancer and its precursors. The diagnosis of prostate cancer on needle biopsy has been refined as a result of the recent discovery of AMACR, which preferentially labels adenocarcinoma of the prostate. Modifications and additions to the Gleason grading system were published based on a consensus conference of urological pathologists. Various models have been proposed using Gleason score, clinical findings, as well as measurements of tumor volume on needle biopsy to enhance the prediction in men undergoing radical prostatectomy and to predict “insignificant”. Several studies have confirmed that certain findings in radical prostatectomy are adverse, yet conflicting studies were published as to the independent prognosis of tumor volume. The risk of cancer following a diagnosis of high grade prostatic intraepithelial neoplasia (HGPIN) on needle biopsy has decreased to the point where this author does not recommend a routine repeat needle biopsy within the first year following the diagnosis of HGPIN.
KEY WORDS:
Gleason score, prostatic intraepithelial neoplasia, radical prostatectomy, margins, seminal vesicle invasion, AMACR
Authors:
Jonathan I. Epstein M. D.
Authors‘ workplace:
Oncology, The Johns Hopkins Hospital
; Baltimore, MD
; Departments of Pathology, Urology and
Published in:
Urol List 2006; 4(4): 5-9
Overview
Tento článek shrnuje vývoj v patologii karcinomu prostaty a jeho prekurzorů za poslední rok. Otázky týkající se patologie jsou velmi důležité při diagnostikování, léčbě a stanovování prognózy karcinomu prostaty. Objevily se nové údaje týkající se patologie karcinomu prostaty a jeho prekurzorů. Diagnostikování karcinomu prostaty při biopsii punkční jehlou bylo upraveno v souvislosti s nedávným objevem enzymu AMACR (α-metylacyl CoA-racemáza), jenž je specifický pro adenokarcinom prostaty. Byly publikovány úpravy a dodatky ke Gleansonovu skórovacímu systému, spočívající na konsenzu patologů v oboru urologie. Pro zlepšení predikce u mužů podstupujících radikální prostatektomii a pro predikci nesignifikantního karcinomu prostaty byly navrženy různé modely využívající Gleasonova skóre, klinických nálezů i měření objemu tumoru při biopsii punkční jehlou. Několik studií potvrdilo, že jisté nálezy při radikální prostatektomii jsou nepříznivé, ovšem co se týče nezávislé prognózy objemu tumoru, byly zatím publikovány protichůdné studie. Pravděpodobnost, že se objeví karcinom po stanovení diagnózy prostatické intraepiteliální neoplazie vyššího stupně při biopsii prováděné punkční jehlou, je tak zanedbatelné, že autor nedoporučuje rutinní opakování biopsie v 1. roce po diagnostikování intraepiteliální neoplazie vyššího stupně.
KLÍČOVÁ SLOVA:
Gleasonovo skóre, prostatická intraepiteliální neoplazie, radikální prostatektomie, okraje, invaze semenných váčků, AMACR
ÚVOD
Patologové hrají významnou roli při diagnostikování karcinomu prostaty a jeho prekurzorních lézí a mohou také, na základě informací, které jsou obsaženy ve vzorcích odebraných punkční jehlou nebo při radikální prostatektomii, pomoci stanovit prognózu. V klíčových oblastech patologie se v průběhu uplynulého roku objevily nové údaje týkající se karcinomu prostaty a jeho prekurzorů.
DIAGNÓZA KARCINOMU PROSTATY PŘI BIOPSII PUNKČNÍ JEHLOU
Negativní výsledky histologického barvení bazálních buněk jsou pomůckou při diagnostikování ohraničeného adenokarcinomu prostaty při biopsii punkční jehlou, i když karcinom nediagnostikují. V nedávné době bylo prokázáno, že AMACR je u karcinomu prostaty významně posílen [1-10]. Podle imunohistochemického vyšetření je většina karcinomů prostaty (80–100 %) pozitivní na AMACR a pozitivní výsledky barvení na AMACR mohou zvýšit jeho spolehlivost pro stanovení definitivní diagnózy maligního onemocnění. Prostatická intraepiteliální neoplazie vyššího stupně (HGPIN) a jisté „mimikry“ karcinomu se však pro tento marker mohou také jevit jako pozitivní [1,8,11]. Negativní výsledky barvení u malých podezřelých žláz nemusí stačit pro diagnostikování benigního onemocnění. Některé varianty karcinomu prostaty, které je zvláště obtížné diagnostikovat, jsou na AMACR pozitivní ještě méně často (62–77 %) [3].
Pokud se uloží více vzorků odebraných biopsií punkční jehlou, do 1 až 2 kontejnerů, mohou se smíchat a rozpadnout na fragmenty, což vede ke ztrátě povrchové oblasti tkáně při histologickém zpracování [12]. Pokud uložíme bioptické vzorky samostatně do 6 až 12 kontejnerů sníží se procento sporné diagnózy. Nejasnosti lze také omezit zasláním každého vzorku na další posouzení. 63% vzorků z této studie, jež byly diagnostikovány jako atypické a na žádost pacienta či urologa postoupeny k dalšímu posouzení, bylo poté s určitostí diagnostikováno jako benigní či maligní [13].
GLEASONŮV SKÓROVACÍ SYSTÉM
Gleansonův skórovací systém byl zaveden před téměř 40 lety a dodnes zůstává jedním z nejlepších predikátorů karcinomu prostaty. Tento systém zůstal po dlouhou dobu prakticky nezměněn, upravoval se minimálně v souvislosti s vývojem medicínské praxe. Účelem konference 2005 United States and Canadian Academy Meeting, na které se sešlo 80 patologů z oboru urologie z 20 zemí, bylo dosáhnout shody v dosud rozdílných pohledech na aplikaci Gleasonova skórovacího systému [14].
Gleasonova charakteristika
Gleason na svém systému pracoval v době, v níž se ještě nevyužívalo imunohistochemického vyšetření, tudíž některé charakteristiky, které popisuje u konkrétních grade, by v současné praxi byly hodnoceny odlišně. Na konferenci byly dohodnuty některé modifikace bodování konvenčního acinárního adenokarcinomu prostaty, což je zobrazeno v modifikovaném diagramu Gleasonova skórovacího systému (obr. 1).
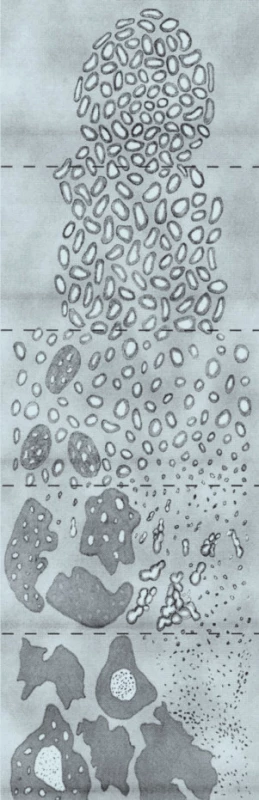
Terciární charakteristika
Původní Gleasonův systém nikdy nepočítal s přítomností více než 2 charakteristik. Schéma spíše zaznamenává nejčastější charakteristiku (primární) a charakteristiku s druhou nejvyšší prevalencí (sekundární) a obě charakteristiky pak sčítá. Součet primární a sekundární charakteristiky dává Gleasonovo skóre. Typický scénář terciárního typu při biopsii zahrnuje tumory s Gleasonovou charakteristikou 3, 4 a 5 v různém rozsahu. Patologové z oboru urologie se shodli, že při charakteristice 4 a 5 v punktátu by měly být tumory celkově klasifikovány jako tumory vyššího grade (Gleasonovo skóre 8–10). Bylo dohodnuto, že tyto tumory by neměly být při biopsii punkční jehlou hodnoceny uvedením primárních, sekundárních a terciárních charakteristik. Pokud je terapie karcinomu volena podle grade karcinomu, považují se za relevantní pouze primární a sekundární charakteristika. Nyní bylo stanoveno, že při biopsii punkční jehlou s charakteristikou 3, 4 a 5 by měly být uvedeny primární i nejvyšší grade. Následně by tedy byly tumory s Gleasonovým skóre 3 + 4 a terciárním Gleasonovou charakteristikou 5 uvedeny jako tumory s Gleasonovým skóre 3 + 5 = 8. [14]
U vzorků radikální prostatektomie by bylo zavádějící odvozovat Gleasonovo skóre přidáním nejčastější Gleasonovy charakteristiky a nejvyšší Gleasonovy charakteristiky. Například tumory s Gleasonovým skóre 4 + 3 = 7 a terciární Gleasonovou charakteristikou 5 zjištěné při prostatektomii nejsou tak agresivní jako tumory s Gleasonovým skóre 4 + 5 = 9, i když mají horší průběh než tumory s Gleasonovým skóre 4 + 3 = 7 bez terciární Gleasonovy charakteristiky 5 [15,16]. Bylo dohodnuto, že u vzorků radikální prostatektomie se určí Gleasonovo skóre v závislosti na primárních a sekundárních charakteristikách s komentářem terciární charakteristiky [14].
Určení skóre v případě, v němž je sekundární charakteristika zanedbatelná
Tato otázka nebyla v originálním Gleasonově systému zmíněna. V případě extenzivního karcinomu vyššího grade s pouze malým rozsahem karcinomu nižšího grade bylo dohodnuto, že tyto tumory budou považovány za tumory vyššího grade (Gleasonovo skóre ≥ 8). Například pokud je vzorek tkáně získaný při biopsii punkční jehlou 100% zasažený karcinomem, z 98 % Gleasonovy charakteristiky 4 a 2% Gleasonovy charakteristiky 3, bude diagnostikován jako karcinom s Gleasonovým skóre 4 + 4 = 8 (malý rozsah karcinomu nižšího grade se nezapočítá). Avšak pokud je karcinom malého rozsahu zjištěný při biopsii punkční jehlou vyššího grade, do Gleasonova skóre se započítá. Jakýkoliv rozsah tumoru vyššího grade v punktátu s největší pravděpodobností indikuje signifikantnější rozsah tumoru vyššího grade v prostatě, vzhledem k souvislosti grade a objemu a vzhledem k problémům spojeným s odebíráním vzorku punkční jehlou. Následně by byl karcinom zjištěný při biopsii punkční jehlou, jenž je zcela zasažen karcinomem, z 98 % Gleasonovy charakteristiky 3 a 2 % Gleasonovy charakteristiky 4, diagnostikován jako tumor s Gleasonovým skóre 3 + 4 = 7.
U vzorků získaných při radikální prostatektomii v podobné situaci, v níž je tumor z 98 % Gleasonovy charakteristiky 3 a 2 % charakteristiky 4, ke konsenzu nedošlo [14]. Přibližně polovina patologů z oboru urologie by diagnostikovala tyto vzorky podobným způsobem jako u tumorů zjištěných pomocí biopsie a považovala by tento případ za tumor s Gleasonovým skóre 3 + 4 = 7 bez ohledu na procentuální zastoupení Gleasonovy charakteristiky 4. Druhá polovina by považovala tyto tumory za karcinom s Gleasonovým skóre 3 + 3 = 6 s malým zastoupením charakteristiky 4. Odůvodnění druhé metody vychází z publikovaných údajů týkajících se radikální prostatektomie, karcinomy z > 95% Gleasonovou charakteristikou 3 a < 5% charakteristikou 4 mají patologická stadia, která jsou horší než samotný tumor s Gleasonovým skóre 3 + 3 = 6, avšak ne tak nepříznivá, jako u tumoru s Gleasonovým skóre 3 + 4 = 7 (u níž Gleasonova charakteristika 4 tvoří > 5 % tumor) [16].
Určování skóre samostatných uzlů ve vzorcích získaných při radikální prostatektomii
Gleason nedává návod, jak tuto situaci řešit. Účastníci konference doporučili zpracovávat vzorky získané při radikální prostatektomii systematicky, aby se dalo určit, jedná-li se o dominantní uzel nebo samostatné uzly tumoru. U každého dominantního uzlu by mělo být určeno samostatné Gleasonovo skóre [14]. Toto doporučení má největší význam u případů s karcinomem periferní zóny vyššího grade jako dominantního uzlu a u samostatných karcinomů přechodové zóny nižšího grade. Například dominantní karcinom periferní zóny s Gleasonovým skóre 4 + 4 = 8 spojený s multifokálním karcinomem přechodové zóny s tumorem s Gleasonovým skóre 2 + 2 by byl určen jako tumor s Gleasonovým skóre 4 + 2 = 6, pokud by byly všechny tumory v prostatě hodnoceny dohromady. To je přesným opakem samostatného určení dominantního uzlu a označení tumoru pacienta jako tumoru vyššího grade (Gleasonovo skóre ≥ 8) s multifokálním karcinomem nižšího grade. Není v logice věci se domnívat, že přítomnost samostatného uzlu nižšího grade by zmírnila nebezpečí karcinomu vyššího grade. Nejčastěji je dominantní uzel největším tumorem, jenž je také charakterizován nejvyšším stadiem a nejvyšším grade. Pokud se vyskytne nedominantní uzel (tj. menší) vyššího grade je třeba určit skóre i u tohoto uzlu. Tento případ však není obvyklý.
Určování skóre u samostatných vzorků s různými grade odebraných punkční jehlou
V době původních Gleasonových publikací se ještě neprováděla ani sextantová ani rozšířená biopsie punkční jehlou, a tato otázka tedy nebyla podstatná. Toto určení má velký význam v případě, kdy se 1 nebo více vzorků jeví jako jasný karcinom vyššího grade (tj. Gleasonovo skóre 4 + 4 = 8) a ostatní vzorky jako karcinom s Gleasonovou charakteristikou 3 (3 + 3 = 6, 3 + 4 = 7, 4 + 3 = 7). Jednou z možností je určit skóre u každého vzorku zvlášť a tumor s nejvyšším grade (Gleasonovo skóre 8) pak považovat za určující grade celého případu. Jiní navrhovali určit u celého případu pouze 1 skóre. Například v případě tumoru s Gleasonovým skóre 4 + 4 = 8 u 1 vzorku a s Gleasonovou charakteristikou 3 (3 + 3 = 6, 3 + 4 = 7, 4 + 3 = 7) u ostatních vzorků, by bylo celkové skóre případu 4 +3 = 7 nebo 3 + 4 = 7, podle toho, zda je predominantní charakteristika 3 nebo 4. Tento postup vychází z průměru všech punktátů a považuje je vlastně za jediný vzorek. V jediné studii zabývající se touto otázkou bylo prokázáno, že pokud má 1 vzorek Gleasonovo skóre 4 + 4 = 8 a další vzorky mají charakteristiku 3, je patologické stadium vzorků odebraných při radikální prostatektomii srovnatelné se vzorky s Gleasonovým skóre 4 + 4 = 8 odebranými punkční jehlou [17]. Následně bylo dohodnuto, že každý vzorek bude mít přiřazeno vlastní Gleasonovo skóre, pokud byly vzorky umístěny v oddělených kontejnerech nebo byly ve stejném kontejneru, ovšem urolog specifikoval jejich lokalizaci (tj. různobarevným inkoustem) [14]. Pak je zde možnost přiřadit každému vzorku individuální Gleasonovo skóre a zároveň lze určit 1 celkové skóre.
VARIANTY KARCINOMU PROSTATY
Původní Gleasonův článek a diagram neposkytují návod, jak určit skóre u různých typů karcinomu prostaty; některé varianty probírané na konferenci nebyly v době vzniku Gleasonova skórovacího systému ještě popsány. Bylo dohodnuto, že duktální adenokarcinomy by měly mít Gleasonovo skóre 4 + 4 = 8 a ponechat si diagnostický název duktální adenokarcinom pro vyjádření jeho specifických klinických a patologických vlastností [14]. Toho lze dosáhnout diagnostikováním takového tumoru jako prostatický duktální adenokarcinom (Gleasonovo skóre 4 + 4 = 8). U karcinomů z malých buněk, u nichž se jejich klinickopatologické znaky liší od znaků souvisejících s prostatickým acinárním karcinomem s Gleasonovou charakteristikou 5, by se Gleasonův grade stanovovat neměl [14].
Vývoj mimo závěry konference
Další vývoj týkající se Gleasonova skórovacího systému zahrnuje zpřesnění výpočtu Gleasonova skóre vzorků získaných extenzivní biopsií punkční jehlou ve srovnání se vzorky získanými sextantovou biopsií [18,19]. V další studii související s určováním Gleasonova skóre bylo prokázáno, že na rozdíl od pacientů užívajících agonisty LH/RH, není u pacientů užívajících finasterid účinek hormonální terapie stálý. Dále není Gleasonův grade určený u pacientů, kteří byli léčeni pomocí finasteridu, viditelně změněn či uměle zvýšen. Význam tohoto zjištění spočívá v tom, že zvýšená incidence adenokarcinomu prostaty vyššího grade zjištěná ve studii PCPT u mužů léčených finasteridem, by neměla být připisována pouze artefaktu při určování grade, přestože další vysvětlení jsou očekávána v následující studii týkající se odebírání vzorku tkáně.
NÁLEZY BIOPSIE, KTERÉ MOHOU PREDIKOVAT NÁLEZY PŘI RADIKÁLNÍ PROSTATEKTOMII
Několik statí publikovaných v roce 2004 a 2005 se snažilo predikovat přítomnost extraprostatického rozšíření do neurovaskulárního svazku, a zejména 2 studie zkoumaly extraprostatické rozšíření do neurovaskulárního svazku podle patologických nálezů na vzorcích z biopsie prostaty punkční jehlou a podle klinických nálezů. V jedné studii byl v Hopkins Hospital vytvořen algoritmus založený na hodnotě PSA v séru, Gleasonově skóre z biopsie, průměrném zasažení vzorku tumoru při biopsii, procentuálním zastoupením vzorků zasažených tumorem a digitálním rektálním vyšetření [21].
Druhá studie provedená v New York University Medical Center použila algoritmus založený na Gleasonově skóre, procentu objemu tumoru ve vzorku biopsie a perineurální invazi [22]. Ohori et al hodnotili pravděpodobnost extraprostatického rozšíření při užití PSA, klinického stadia, Gleasonova skóre z biopsie, procenta pozitivních vzorků na každé straně a procenta karcinomu ve vzorku na každé straně [23].
Dvě další studie se pokoušely předpovědět biochemickou progresi po radikální prostatektomii s použitím nálezů získaných při biopsii. V jedné studii bylo procento pozitivní biopsie spojeno s horší prognózou a v druhé byl jejich model definován kombinací koncentrace PSA v séru, Gleasonova skóre z biopsie a procenta tkáně zasažené karcinomem [24,25].
Dvě studie z nedávné doby se taktéž snažily předpovědět nesignifikantní karcinom ve vzorcích radikální prostatektomie. V modelu Washingtonské univerzity bylo nejlepším modelem predikce nesignifikantního tumoru méně než 10 % největšího procentuálního zastoupení karcinomu v jakémkoliv vzorku a Gleasonovo skóre z biopsie nižší než 7 [26]. Autoři z The Johns Hopkins Hospital, užívající údaje saturační biopsie u vzorků radikální prostatektomie, vyvinuli klasifikační pravidla biopsie vycházející z Gleasonova skóre, celkové velikosti karcinomu v milimetrech a počtu pozitivních vzorků pro predikci nesignifikantního karcinomu [27].
PROGNÓZA RADIKÁLNÍ PROSTATEKTOMIE
V uplynulém roce byly publikovány dvě protichůdné studie zabývající se otázkou, zda objem tumoru měřený ve vzorcích z radikální prostatektomie poskytuje nezávislou prognózu [28,29] - Méně kontroverzní studie, publikované v uplynulém roce, potvrdily dřívější zprávy týkající se prognostického významu pozitivních chirurgických okrajů, vaskulární invaze a rozsahu pozitivních okrajů [30-32]. V další studii, podobně jako v dřívějších publikacích, měly nálezy invaze semenných váčků spojené s negativními okraji poměrně lepší přežití specifické pro nádor a celkové přežití [33]. Dvě stati publikované v uplynulém roce prokázaly, že pozitivní okraj hrdla močového měchýře při radikální prostatektomii je nepříznivým nálezem [34,35]. Avšak izolovaný pozitivní okraj hrdla močového měchýře není co se týče prognózy ekvivalentní onemocnění T4 a je srovnatelnější s tumory invaze semenných váčků (stadium T3b) [34]. Narozdíl od biopsie punkční jehlou nemá perineurální invaze zjištěná u vzorků radikální prostatektomie prognostický význam [36]. Pomocí mikrosatelitní markerové analýzy založené na PCR jsme potvrdili, že ve většině případů tzv. mizejícího karcinomu ve vzorku radikální prostatektomie se pravděpodobně jedná o odebrání malého karcinomu, a nikoliv o záměnu vzorků [37]. K záměně vzorků však může vzácně dojít, a pokud máme karcinom vysokého grade nebo karcinom velkého rozsahu při biopsii a žádný nebo minimální karcinom ve vzorku radikální prostatektomie, je třeba ověřit identitu pacienta.
INTRAEPITELIÁLNÍ NEOPLAZIE VYŠŠÍHO GRADE (HGPIN)
První studie, zabývající se touto otázkou na počátku devadesátých let minulého století pouze u malého počtu případů, zaznamenaly po diagnostikování HGPIN 50% riziko karcinomu. Při srovnání studií z roku 2000 a pozdějších je riziko karcinomu po opakovaném provedení biopsie u benigního onemocnění 23 % a 18 % u HGPIN [38]. 9 publikací srovnávalo ve stejné studii riziko karcinomu po biopsii prováděné punkční jehlou s diagnózou HGPIN nebo benigního onemocnění, 7 studií neprokázalo žádný statisticky významný rozdíl. Zdá se, že zde nejsou žádné klinické či patologické parametry, které by pomohly identifikovat muže s HGPIN při biopsii punkční jehlou, u kterých bude při opakované biopsii pravděpodobně diagnostikován karcinom. Hlavní faktor přispívající k poklesu incidence karcinomu po diagnostikování HGPIN při biopsii punkční jehlou v současné době souvisí se zvýšením počtu odebírání vzorků biopsií punkční jehlou. Extenzivnější odebírání vzorku při 1. biopsii deteguje mnoho souvisejících karcinomů, tudíž nález pouze HGPIN často představuje pouze izolovaný HGPIN, proto nejsou při opakované biopsii detegovány další karcinomy. Autor se domnívá, že u mužů s absencí dalších klinických indikátorů karcinomu není během 1. roku po diagnostikování HGPIN nutné rutinní opakovaní biopsie punkční jehlou. Pro potvrzení toho, zda by se během několika let po diagnostikování HGPIN biopsií punkční jehlou měla biopsie opakovat, eventuálně jak často a kdy, jsou zapotřebí další studie. Dokud nebudeme mít dostatečné údaje nabízející specifická doporučení, zda biopsii opakovat do 1 roku od diagnostikování HGPIN, by se k tomuto vyšetření mělo přistupovat individuálně, podle preferencí pacienta a lékaře.
ZÁVĚR
V klíčových oblastech patologie se v průběhu uplynulého roku objevily nové údaje související s karcinomem prostaty a jeho prekurzorů, zahrnující: 1. diagnostikování karcinomu prostaty ze vzorků biopsie punkční jehlou, 2. Gleasonův skórovací systém, 3. nálezy z biopsie predikující nálezy radikální prostatektomie, 4. prognózu radikální prostatektomie a 5. prostatickou intraepiteliální neoplazii vysokého grade. Urologové by o těchto nových poznatcích měli vědět a informovat o nich i patology, pokud oni sami s výstupy nových studií obeznámeni nejsou. Jen tak mohou dosáhnout co nejlepších výsledků.
Jonathan I. Epstein, M.D.
Departments of Pathology, Urology and Oncology,
The Johns Hopkins Hospital, Baltimore, MD
Sources
1. Ananthanarayanan V, Deaton RJ, Yang XJ. Alphamethylacyl - CoA racemase (AMACR) expression in normal prostatic glands and high-grade prostatic intraepithelial neoplasia (HGPIN): association with diagnosis of prostate cancer. Prostate 2005; 63 : 341-346.
2. Beach R, Gown AM, Peralta-Venturina MN. P504S immunohistochemical detection in 405 prostatic specimens including 376 18-gauge needle biopsies. Am J Surg Pathol 2002; 26 : 1588-1596.
3. Farinola MA, Epstein JI. Utility of immunohistochemistry for alpha-methylacyl-CoA racemase in distinguishing atrophic prostate cancer from benign atrophy. Hum Pathol 2004; 35 : 1272-1278.
4. Hameed O, Sublett J, Humphrey PA. Immunohistochemical stains for p63 and alpha-methylacyl-CoA racemase, versus a cocktail comprising both, in the diagnosis of prostatic carcinoma: a comparison of the immunohistochemical staining of 430 foci in radical prostatectomy and needle biopsy tissues. Am J Surg Pathol 2005; 29 : 579-587.
5. Jiang Z, Woda BA, Wu CL. Discovery and clinical application of a novel prostate cancer marker: alphamethylacyl CoA racemase (P504S). Am J Clin Pathol 2004; 122 : 275-289.
6. Jiang Z, Iczkowski KA, Woda BA. P504S immunostaining boosts diagnostic resolution of "suspicious" foci in prostatic needle biopsy specimens. Am J Clin Pathol 2004; 121 : 99-107.
7. Kunju LP, Rubin MA, Chinnaiyan AM. Diagnostic usefulness of monoclonal antibody P504S in the workup of atypical prostatic glandular proliferations. Am J Clin Pathol 2003; 120 : 737-745.
8. Wu CL, Yang XJ, Tretiakova M. Analysis of alphamethylacyl-CoA racemase (P504S) expression in highgrade prostatic intraepithelial neoplasia. Hum Pathol 2004; 35 : 1008-1013.
9. Yang XJ, Laven B, Tretiakova M. Detection of alphamethylacyl - coenzyme A racemase in postradiation prostatic adenocarcinoma. Urology 2003; 62 : 282-286.
10. Zhou M, Aydin H, Kanane H. How often does alpha-methylacyl-CoA-racemase contribute to resolving an atypical diagnosis on prostate needle biopsy beyond that provided by basal cell markers? Am J Surg Pathol 2004; 28 : 239-243.
11. Herawi M, Kahane H, Cavallo C, Epstein JI. Risk of prostate cancer on 1 st rebiopsy within 1 year following a diagnosis of high-grade prostatic intraepithelial neoplasia (HGPIN) is related to the number of cores sampled. 2005.
12. Gupta C, Ren JZ, Wojno KJ. Individual submission and embedding of prostate biopsies decreases rates of equivocal pathology reports. Urology 2004; 63 : 83-86.
13. Chan TY, Epstein JI. Patient and urologist driven second opinion of prostate needle biopsies. 2005; 174 : 1390-1394.
14. Epstein JI, Allsbrook WC jr, Amin MB. The 2005 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. Am J Surg Pathol 2005; 29 : 1228-1242.
15. Mosse CA, Magi-Galluzzi C, Tsuzuki T. The prognostic significance of tertiary Gleason pattern 5 in radical prostatectomy specimens. Am J Surg Pathol 2004; 28 : 394-398.
16. Pan CC, Potter SR, Partin AW. The prognostic significance of tertiary Gleason patterns of higher grade in radical prostatectomy specimens: a proposal to modify the Gleason grading system. Am J Surg Pathol 2000; 24 : 563-569.
17. Kunz GM jr, Epstein JI. Should each core with prostate cancer be assigned a separate gleason score? Hum Pathol 2003; 34 : 911-914.
18. Emiliozzi P, Maymone S, Paterno A. Increased accuracy of biopsy Gleason score obtained by extended needle biopsy. J Urol 2004; 172 : 2224-2226.
19. King CR, McNeal JE, Gill H. Extended prostate biopsy scheme improves reliability of Gleason grading: implications for radiotherapy patients. Int J Radiat Oncol Biol Phys 2004; 59 : 386-391.
20. Rubin MA, Allory Y, Molinie V. Effects of long-term fmasteride treatment on prostate cancer morphology and clinical outcome. Urology 2005; 66 : 930-934.
21. Tsuzuki T, Hernandez DJ, Aydin H. Prediction of extraprostatic extension in the neurovascular bundle based on prostate needle biopsy pathology, serum prostate specific antigen and digital rectal examination. J Urol 2005; 173 : 450-453.
22. Shah O, Robbins DA, Melamed J. The New York University nerve sparing algorithm decreases the rate of positive surgical margins following radical retropubic prostatectomy. J Urol 2003; 169 : 2147-2152.
23. Ohori M, Kaftan MW, Koh H. Predicting the presence and side of extracapsular extension: a nomogram for staging prostate cancer. J Urol 2004; 171 : 1844-1849.
24. Freedland SJ, Terns MK, Csathy GS. Preoperative model for predicting prostate specific antigen recurrence after radical prostatectomy using percent of biopsy tissue with cancer, biopsy Gleason grade and serum prostate specific antigen. J Urol 2004; 171 : 2215-2220.
25. Lotan Y, Shariat SF, Khoddami SM. The percent of biopsy cores positive for cancer is a predictor of advanced pathological stage and poor clinical outcomes in patients treated with radical prostatectomy. J Urol 2004; 171 : 2209-2214.
26. Anast JW, Andriole GL, Bismar TA. Relating biopsy and clinical variables to radical prostatectomy findings: can insignificant and advanced prostate cancer be predicted in a screening population? Urology 2004; 64 : 544-550.
27. Epstein JI, Sanderson H, Carter HB. Utility of saturation biopsy to predict insignificant cancer at radical prostatectomy. Urology 2005; 66 : 356-360.
28. Kikuchi E, Scardino PT, Wheeler TM. Is tumor volume an independent prognostic factor in clinically localized prostate cancer? J Urol 2004; 172 : 508-511.
29. Ramos CG, Roehl KA, Antenor JA. Percent carcinoma in prostatectomy specimen is associated with risk of recurrence after radical prostatectomy in patients with pathologically organ confined prostate cancer. J Urol 2004; 172 : 137-140.
30. Ferrari MK, McNeal JE, Malhotra SM. Vascular invasion predicts recurrence after radical prostatectomy: stratification of risk based on pathologic variables. Urology 2004; 64 : 749-753.
31. Fromont G, Cathelineau X, Rozet F. Impact of margin size on the incidence of local residual tumor after laparoscopic radical prostatectomy. J Urol 2004; 172 : 1845-1847.
32. Swindle P, Eastham JA, Ohori M. Do margins matter? The prognostic significance of positive surgical margins in radical prostatectomy specimens. J Urol 2005; 174 : 903-907.
33. Masterson TA, Pettus JA, Middleton RG. Isolated seminal vesicle invasion imparts better outcomes after radical retropubic prostatectomy for clinically localized prostate cancer: prognostic stratification of pt3b disease by nodal and margin status. Urology 2005; 66 : 152-155.
34. Aydin H, Tsuzuki T, Hernandez D. Positive proximal (bladder neck) margin at radical prostatectomy confers greater risk of biochemical progression. Urology 2004; 64 : 551-555.
35. Poulos CK, Koch MO, Eble JN. Bladder neck invasion is an independent predictor of prostate-specific antigen recurrence. Cancer 2004; 101 : 1563-1568.
36. Ng JC, Koch MO, Daggy JK. Perineural invasion in radical prostatectomy specimens: lack of prognostic significance. J Urol 2004; 172 : 2249-2251.
37. Cao D, Hafez M, Berg K. Little or no residual prostate cancer at radical prostatectomy: vanishing cancer or switched specimen?: a microsatellite analysis of specimen identity. Am J Surg Pathol 2005; 29 : 467-473.
38. Epstein JI, Herawi M. Prostate needle biopsies containing prostatic intraepithelial neoplasia or atypical foci suspicious for carcinoma: Implications for patient care. J Urol 2005.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2006 Issue 4
-
All articles in this issue
- CO JE NOVÉHO V HODNOCENÍ PATOLOGIE KARCINOMU PROSTATY V ROCE 2006
- LYMFATICKÁ DRENÁŽ PROSTATY
- PÁNEVNÍ LYMFADENEKTOMIE U KARCINOMU PROSTATY A JEJÍ HRANICE
- PSA A VČASNÁ DETEKCE KARCINOMU PROSTATY
- PATOLOGIE PROSTATY A HLADINY ANDROGENŮ A ESTROGENŮ
- KLINICKÝ PŘÍSTUP K SUPRESI ANDROGENŮ A RADIOTERAPII ZALOŽENÝ NA DŮKAZECH U MUŽŮ S LOKÁLNĚ POKROČILÝM NEBO LOKALIZOVANÝM KARCINOMEM PROSTATY
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- PSA A VČASNÁ DETEKCE KARCINOMU PROSTATY
- PÁNEVNÍ LYMFADENEKTOMIE U KARCINOMU PROSTATY A JEJÍ HRANICE
- LYMFATICKÁ DRENÁŽ PROSTATY
- PATOLOGIE PROSTATY A HLADINY ANDROGENŮ A ESTROGENŮ
