Transrektální ultrazvukem vedené biopsie prostaty
Transrectal ultrasonography guided prostate needle biopsy
Transrectal ultrasonography guided prostate needle biopsy has become the procedure of choice for obtaining high-quality tissue cores for histopatological assessment in the patients with suspected prostate cancer. The sextant method has become widely accepted as the „gold standard“ biopsy technique. However, concern has arisen that the sextant biopsy method under-samples the prostate and may consequently fail to detect a significant proportion of clinically important tumors. It is uncertain how many biopsy cores are needed to optimize the detection of these tumors. Improved glandular coverage, by either taking more biopsies per gland and/or optimalization of the systematic biopsy scheme, should minimize sampling inaccuracy. Local anesthesia enables to make procedure almost painless and improve acceptance of particularly repeated biopsies.
Key words:
prostate cancer, prostate biopsy, transrectal ultrasonography guided biopsy
Authors:
prim. MUDr. Aleš Čermák; Prof. MUDr. Dalibor Pacík, CSc.
Authors‘ workplace:
Urologická klinika LF MU a FN Brno
Published in:
Urol List 2007; 5(4): 22-29
Overview
U pacientů s podezřením na karcinom prostaty je indikována ultrazvukem vedená biopsie prostaty k získání vzorků tkáně prostaty pro histologické vyšetření. Technika sextantové biopsie se stala zlatým standardem v diagnostice karcinomu prostaty. Ukazuje se však, že sextantová biopsie má svá omezení, protože nedeteguje určitou část signifikantních karcinomů. Optimální počet vzorků potřebných k detekci těchto nádorů není zatím znám. Strategie zvýšení počtu odebíraných vzorků a nová schémata rozmístění vzorků mohou snížit počet nesprávně negativních výsledků. Aplikace infiltrační anestezie umožňuje učinit výkon prakticky bezbolestným a zlepšit akceptování zejména opakovaných biopsií.
Klíčová slova:
karcinom prostaty, biopsie prostaty, transrektální ultrasonografická biopsie prostaty
Úvod
Karcinom prostaty (KP) představuje závažné onemocnění s narůstající incidencí a s různým výskytem v různých částech světa. V evropských zemích i na severoamerickém kontinentu je u mužů KP obvykle 2. nejčastější příčinou úmrtí způsobených zhoubným nádorem. Včasná detekce vede ke zvýšení podílu potenciálně vyléčitelného onemocnění. I když jsou některé karcinomy klinicky nevýznamné a vzhledem ke své biologické povaze se nikdy nestanou předmětem klinické pozornosti, většina z nich progreduje a při dostatečně dlouhé době očekávaného přežití většina z nich ohrožuje pacienta na životě.
U mnoha mužů je karcinom prostaty zjištěn na základě podezření vzniklého stanovením prostatického specifického antigenu (PSA), digitálním rektálním vyšetřením (DRV) a transrektální ultrasonografií (TRUS), nebo různou kombinací těchto metod. Při podezřelém nálezu je indikována biopsie. Protože diagnóza onemocnění je histopatologická, hraje v ní správně indikovaná a provedená biopsie klíčovou roli. Před zahájením jakékoli léčby karcinomu prostaty je nebytné potvrdit diagnózu histologicky nebo cytologicky [1].
Anatomie prostaty
Zonální dělení prostaty
Velmi užitečný a používaný je koncept, který formuloval McNeal: Je to zonální dělení prostaty vytvořené na základě glandulární kompozice (obr. 1). I. glandulární část tvoří 2/3 objemu prostaty II. fibromuskulární — zbývající 1/3, se skládá z fibromuskulárního stromatu. McNeal rozdělil glandulární část na periferní žlázu a centrální žlázu která obklopuje uretru.
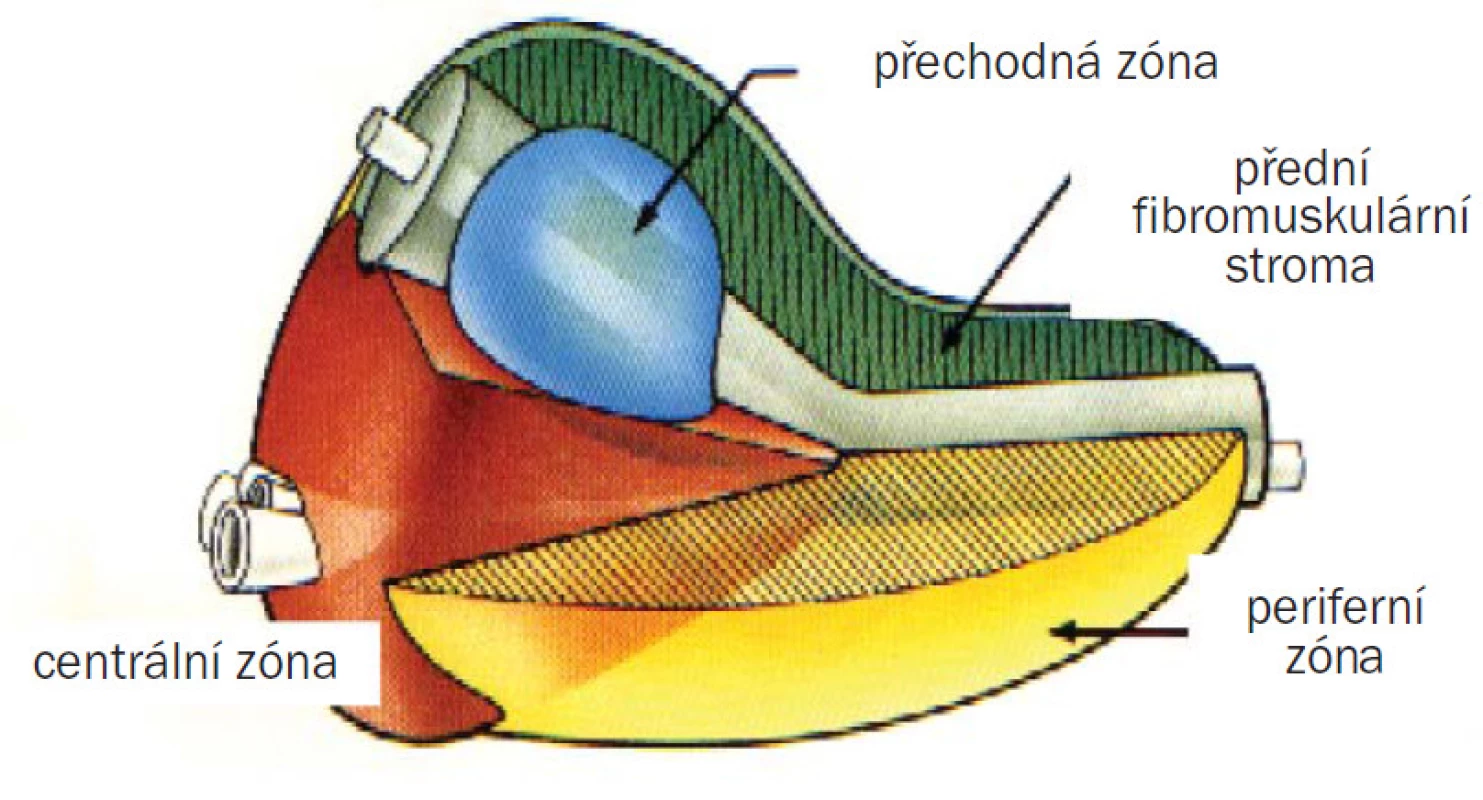
Periferní žláza se dělí na:
- periferní zónu — PZ
- centrální zónu — CZ
Centrální žlázu tvoří:
- přechodná zóna — TZ
- periuretrální glandulární tkáň — T
Periferní zóna (PZ) — největší částí prostaty — tvoří 70 % glandulární složky a začíná v ní 68 % karcinomů prostaty. Centrální zóna (CZ) tvoří 25 % glandulární části prostaty, nalézáme ji od semenného hrbolku k bázi prostaty. Periferní zóna, epitel centrální zóny a epitel semenných váčků jsou podobné, takže se předpokládá společný vznik z Wolffova vývodu. V CZ začíná asi 8 % karcinomů prostaty. Přechodná zóna (TZ) představuje 5 % glandulární komponenty prostaty a obklopuje periuretrální glandulární tkáň podél proximální části prostatické uretry a začíná v ní 24 % karcinomu prostaty (benigní hyperplazie prostaty BPH vzniká pouze v této oblasti). Fibromuskulární stroma (AF) tvoří zbývající 1/3 objemu prostaty. Obklopuje anterolaterální část prostatické uretry a sahá od apexu až k bázi prostaty. Těsně přiléhá ke glandulární části prostatya zatím není přesně známá její role při onemocnění prostaty.
Prorůstání karcinomu
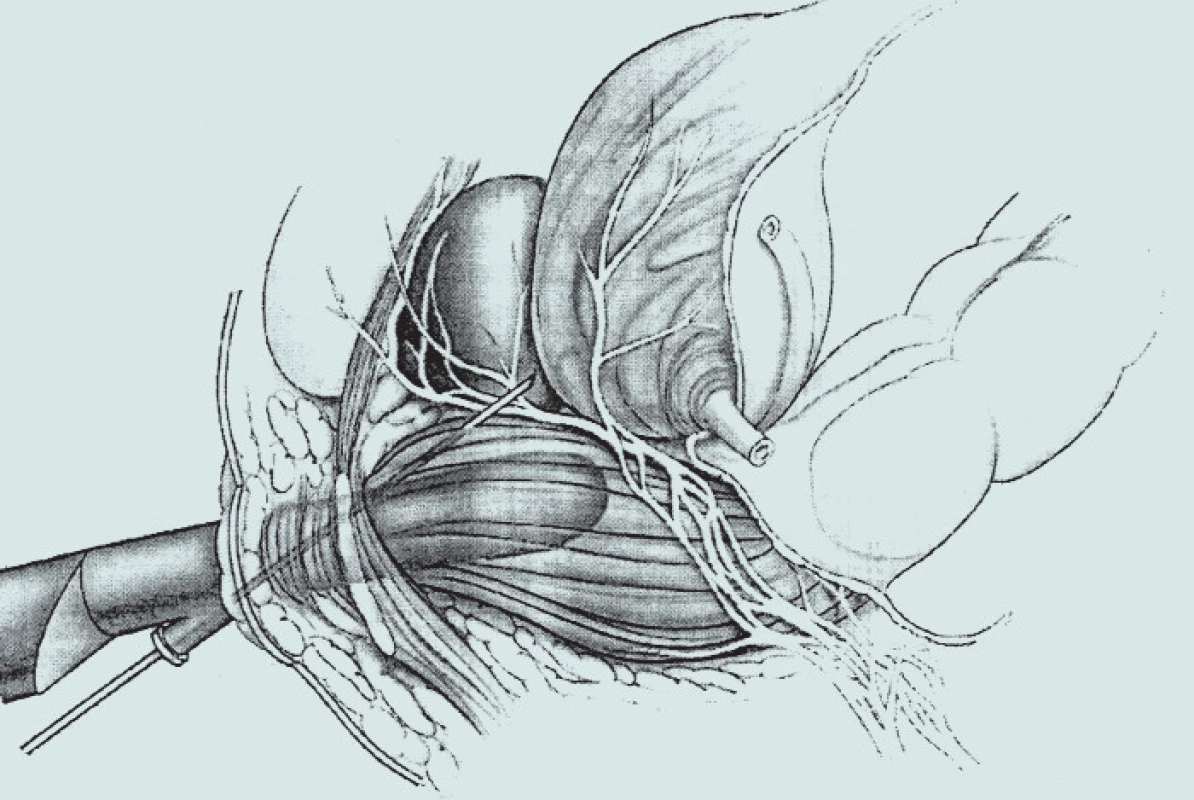
Prorůstání karcinomu záleží na jeho lokalizaci. Každá anatomická zóna má svá slabá místa, kterými nádor snadno penetruje. Slabá místa periferní zóny PZ (zejména prostatická kapsula): tumory lokalizované v periferní zóně mají tendenci se šířit podélně v subkapsulární zóně. Jakmile jejich průměr dosahuje 1,5—2 cm3, mají tendenci infiltrovat kapsulu. Prostatická kapsula je tenká v oblasti apexu a k penetraci dochází podél dolních větví neurovaskulárního svazku. Apikální léze penetrující podél neurální pochvy může přestoupit kapsulu, a to je důvod, proč můžeme po radikální prostatektomii (RAPE) nalézt pozitivní okraj, i když před tím nebyla detegována invaze do kapsuly. Slabá místa CZ: nejsnadnější šíření je podél semenných váčků s invazí do extraprostatického prostoru (obr. 2).
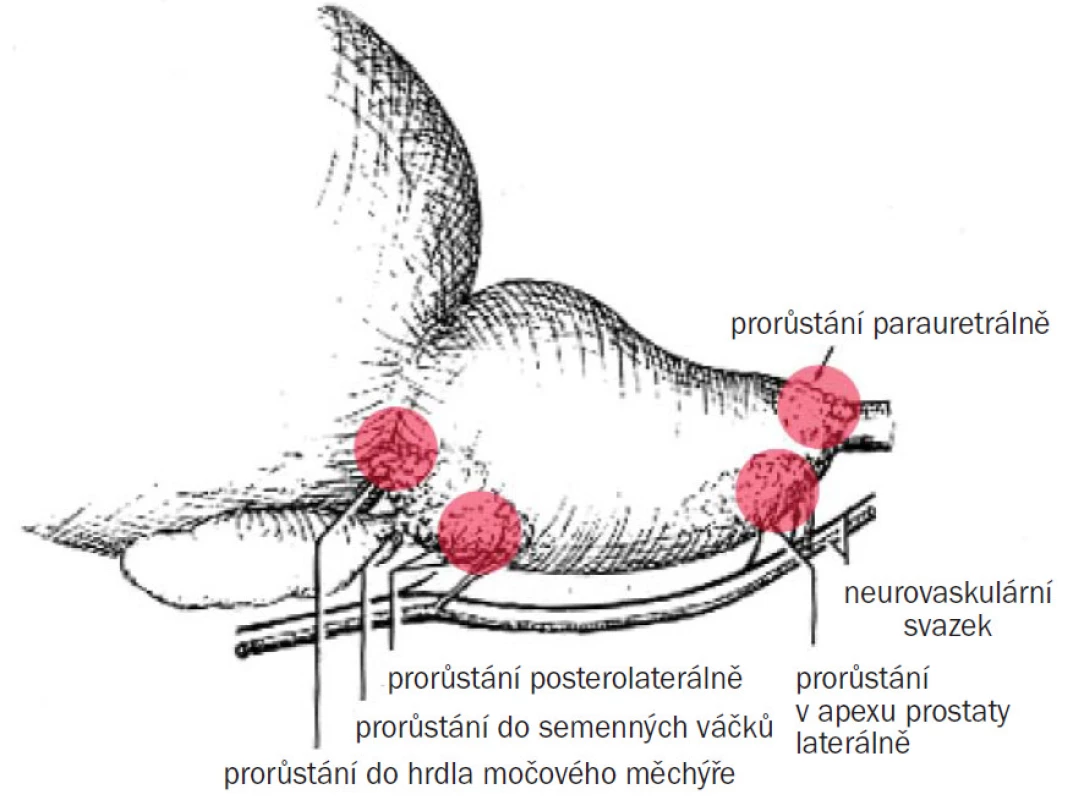
Sonografické znázornění karcinomu
V 80. letech minulého století bylo do klinické praxe zavedeno transrektální ultrazvukové vyšetření (TRUS). Pomocí transrektálně zavedené 10MHz sondy lze prostatu detailně vyšetřit s využitím dalších modalit, jako je dopplerovské mapování, použití kontrastní látky sonovue nebo 3D zobrazení prostaty.
Téměř 70 % všech karcinomů je lokalizováno v PZ. Většina těchto nádorů se nachází 3—4 mm od hraniční zóny kapsuly, a jsou tedy od určité velikosti často zjistitelné palpačně. Karcinomy v CZ a TZ (8 % resp. 24 %) jsou obvykle malé a difuzní. Zvláště nádory v TZ jsou často klasifikovány jako stadium T1a, detegované jako pozitivní histologický nález pacientů operovaných pro benigní hyperplazii prostaty. Centrální zóna je slabé místo, do kterého může infiltrovat nádor původně vznikající v periferní či přechodné zóně. Tyto centrálně se vyskytující nádory jsou velmi špatně zjistitelné ultrazvukem. Většina karcinomů vykazuje sníženou echogenitu v porovnání s normální prostatickou tkání (hypoechogenní loěisko). To je způsobeno tím, že vysoce buněčná hmota nádoru vykazuje velmi těsné mezibuněčné prostory a tvoří velmi malé vnitřní echo. Takováto ložiska jsou detegovatelná ultrazvukem, ale pozitivní histologický nález se pohybuje v rozmezí od 60—97 %. Někdy se jeví centrální část jako hypoechogenní a periferní část je hyperechogenní. Stává se to, pokud nádorové buňky na periferii infiltrují normální prostatu, ale ještě nedošlo k destrukci přilehlé benigní tkáně. Někdy je hypoechogenní ložisko přítomno, ale infiltruje celou prostatu. Jelikoě zasahuje většinu prostatické tkáně, nemusí způsobit ani výraznou asymetrii. Další komplikací při prokazování karcinomu ultrazvukem jsou malá hypoechogenní loěiska, která jsou skryta v periferní zóně, která je utlačena centrálně rostoucí benigní prostatickou hyperplazií.
Ve 30 % případů nelze karcinom sonograficky najít vůbec, protože je tzv. izoechogenní. Tyto nádory jsou často malé a roztroušené v centrální a přechodné zóně.
Hyperechogenní nádory jsou vzácné, pokud vůbec existují. (Může se jednat o Corpora amylacea nebo BPH.) Prokážeme-li karcinom, jedná se většinou o duktální karcinom, nebo nádor s invazí do kalcifikované oblasti či corpora amylacea.
Také řada normálních struktur a benigních procesů může imitovat hypoechogenní nádor. Bilaterální neurovaskulární svazky jsou hypoechogenní a můžeme je sledovat na obrazovce pomocí barevného dopplerovského mapování. Benigní hypoechogenní ložiska jsou způsobena atypickými noduly BPH, akutní i chronickou prostatitidou, atrofií, jizvou či infarktem, stejně jako organizovaným koagulem po předešlé biopsii.
Nepravidelná kontura prostaty je suspektní z expanzivního procesu, ale anterolaterální okraj (přestože je ultrazvukem lépe přehledný) není tak signifikantní jako posterolaterální prominence. Ta může často uniknout pozornosti, zvláště když během vyšetření dojde ke kompresi prostaty ultrazvukovou sondou. TRUS tak zatím slouží především k cílenému umístění bioptické jehly při systematickém odebírání vícečetných vzorků. Neméně důleěité je přesné zhodnocení velikosti tvaru, eventuálně asymetrie či infiltrace prostaty.
Transrektální biopsie prostaty pod sonografickou kontrolou prošla od doby jejího zavedení v 80. letech zajímavou historií. Počáteční problémy (diskomfort pacientů, nezkušenost urologů, neznalost zonální anatomie prostaty a lokalizace nádorů, neschopnost interpretovat ultrazvukové nálezy, fakt, že velká většina nádorů byla ve stadiu hmatného tumoru, a tudíě snadno detegovatelná biopsií pod digitální kontrolou), způsobily, že zájem o tuto techniku byl velmi chabý. Metoda používaná v současné době, tj. transrektálně kontrolovaná biopsie, znamená cílené umístění bioptické jehly do určeného místa podle předem zvolené strategie.
Systematická biopsie — random biopsie
Systematická biopsie (SBP) znamená, že odběr vzorků se provádí systematicky z předem stanovených lokalizací. Punkční jehla je naváděna pomocí TRUS. Při snaze o detekci karcinomu musíme brát v úvahu vztah mezi počtem odebraných vzorků a velikostí prostaty. Z logické úvahy vyplývá, že pokud nejsme schopni ultrazvukem přesněji detegovat nádorové ložisko, jedná se náhodný odběr.
Hlavní nález byl signifikantní rozdíl v detekci KP mezi malou a velkou prostatou. U prostat nad 50 g byl sextantovou technikou detegován KP ve 23 %, zatímco u menších prostat (pod 50 g) ve 38 % případů. Výsledky byly ještě více zvýrazněny u extrémně objemných prostat (nad 100 g) — 14 % oproti 49 % u prostat menších neě 25 g [2].
Statistika velkých čísel ukazuje, že čím je větší objem prostaty při stejném počtu vzorků, tím je nižší pravděpodobnost záchytu karcinomu. Tuto chybu se snaží korigovat různé strategie odběrů vzorků tak, aby byl vyvážený vztah mezi co možná nejvyšší úspěšností detekce nádoru za použití pouze nezbytného počtu biopsií [3].
Sextantová biopsie prostaty
Hodge [4] a Cooner [5] byli první, kteří referovali o výsledcích biopsií u 136 mužů. V jejich originálním popisu bylo odebráno 6 vzorků oboustranně parasagitálně v polovině mezi střední linií a laterálním okrajem prostaty. Vzorky byly odebírány z apexu, střední části a báze. Pro relativní snadnost a proveditelnost biopsie a její dobrou toleranci pacienty se sextantová biopsie pod sonografickou kontrolou stala zlatým standardem v diagnostice karcinomu prostaty. Ke zlepšení přispěl technický pokrok především konstrukcí transrektálních sond s vysokou rozlišovací schopností, s možností multiplanárního zobrazování a automatických bioptických mechanizmů s vystřelovací jehlou, které umoěňují snadný a přesný odběr vzorků tkáně prostaty. Znalost zonálního dělení prostaty na základě studia anatomických preparátů a důkladné zkoumání možností využití PSA a jeho frakcí umožňuje diagnostikovat velké množství karcinomů ve stadiu, kdy ještě nejsou detegovatelné při DRV.
Limitace sextantové biopsie
Ačkoli je nepochybné, že koncept systematické sextantové biopsie u pacientů s elevací PSA znamenal v 90. letech revoluci v diagnostice KP, dnes se ukazuje, že tato metodika má svá omezení. Įada autorů dokumentovala, že četnost pozitivních záchytů pomocí sextantové biopsie je kolem 25—30 % u 1. provedené biopsie. Při opakování sextantové biopsie byl záchyt větší přibližně o 20 % (opakování sextantové biopsie stejnou technikou). Důkazem podporujícím nedostatečnost sextantové biopsie jsou data získaná u pacientů vyšetřených v Memorial Sloan-Kettering Cancer Center, kteří podstoupili jako součást protokolu získání vzorků tkání před RAPE opakovanou sextantovou biopsii. Nesprávně negativní výsledek byl v této studii 20%. Podobné údaje potvrdil Catalona.
Ve studii z Johns Hopkins bylo hodnoceno 150 prostat vyšetřených po RAPE pro stadium T1c KP a bylo zjištěno, že ex vivo sextantové a TZ biopsie nediagnostikovaly karcinom ve 31 % případů [6].
Všeobecná data ukazují, že míra nesprávně negativních výsledků 1krát provedené sextantové biopsie, tak jak byla popsána v originální technice, je 20—25 %. Postupné zjišťování nedostatků v detekci KP vedlo k přepracování sextantové techniky.
Sextantová biopsie je zatížena vysokou četností falešně negativních výsledků a jako rutinní metoda je dnes jiě neakceptovatelná. [7-10].
Zlepšení bioptické techniky
Jaké jsou současné možnosti zlepšení detekce KP biopsií prostaty? Jsou to:
- změna lokalizace jednotlivých odebíraných vzorků
Stamey et al doporučili odebírání stejného počtu vzorků a změnu jejich lokalizace co nejvíce laterálně, aby bylo možno získat vzorky z periferní části prostaty (PZ) [11] (obr. 3). Racionální zdůvodnění pro toto doporučení bylo založeno na faktu, že PZ, ve které se nalézá většina karcinomů, je komprimována dorzálně a laterálně expandující tkání TZ, složené převážně z tkáně benigní prostatické hyperplazie. Očekávaný výsledek byl takový, že jehla zacílená více dorzálně a laterálně může zachytit nejen větší počet karcinomů, ale bude obsahovat i větší objem karcinomu v jednom pozitivním vzorku. Tato hypotéza byla potvrzena Terrisem et al ve srovnávací studii klasické sextantové biopsie versus laterálně zaměřené biopsie, kde laterálně zacílené biopsie odhalily 14,6 % karcinomů, které nebyly zjištěny klasickou sextantovou technikou [12]. Potvrdila to i studie z Johns Hopkins, kde nesprávně negativní výsledek byl při umístění biopsií více posterolaterálně redukován na polovinu.
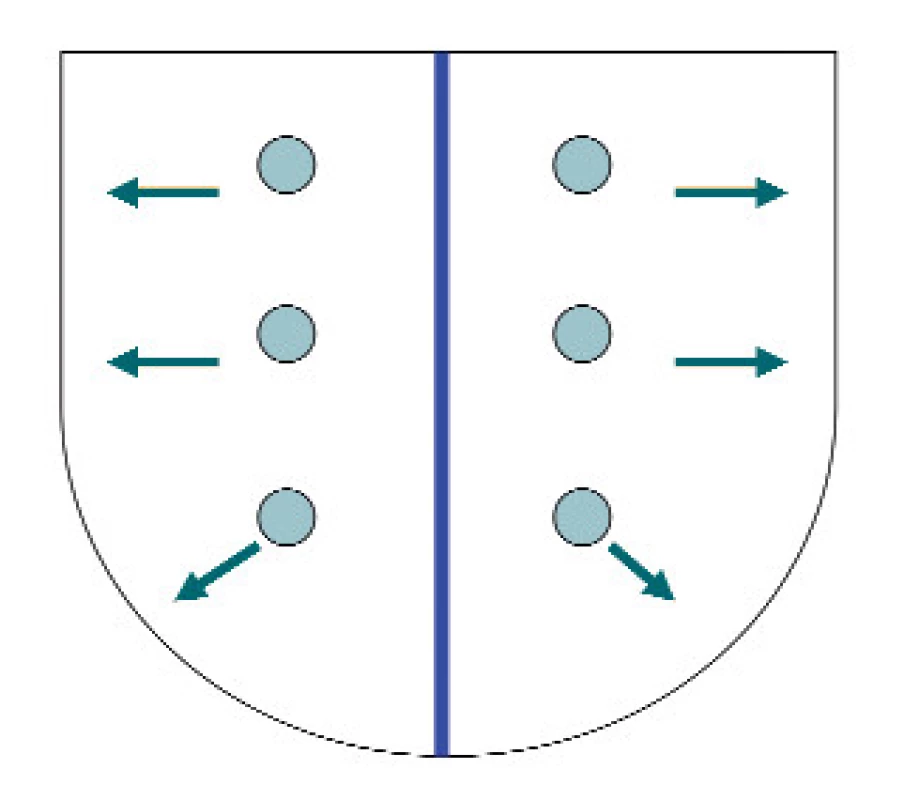
Ukazuje se, že pokud je odebíráno pouze 6 vzorků, umístění biopsií více laterálně do periferní zóny zvýší detekci KP.
- biopsie TZ
Rutinní odebírání vzorků z TZ není dostatečně výtěžné a z toho důvodu se u iniciální biopsie nedoporučuje.
- změna počtu odebíraných vzorků
Ukazuje se, že pokud je odebíráno pouze 6 vzorků, umístění biopsií více laterálně do periferní zóny zvýší detekci KP.
- zvýšení počtu vzorků, biopsie TZ
Při retrospektivním hodnocení bylo zjištěno, že lze sledovat nedostatky v detekci KP i při použití sextantové biopsie s odběrem laterálních vzorků. Zdá se, že více vzorků zvýší výtěžnost detekce KP u kterékoli 1. biopsie prostaty. Nyní stojíme před problémem určit, kolik vzorků je nutné odebrat u každého pacienta. Odpověď musí být zvažována v kontextu se zvýšenou morbiditou a diskomfortem při použití této techniky.
- změna strategie v provádění biopsií
Dříve používaní sextantová biopsie tak, jak byla popsána a publikována 1989 Hodgem a Stameyem, znamenala revoluci ve strategii biopsie a jednoznačně nahradila cílenou biopsii. V následujících letech bylo publikováno množství studií na velkých souborech pacientů s cílem zvýšit výtěžnost biopsie a vyloučit nadbytečné biopsie. Studie se zaměřují především na počet nutných vzorků z jednotlivých oblastí, počet vzorků v závislosti na velikosti prostaty, hodnotě PSA, hodnotě free/total PSA, detekci high grade PIN při 1. biopsii, indikaci opakované biopsie, počtu a lokalizaci vzorků při opakované biopsii.
Vídeňský protokol
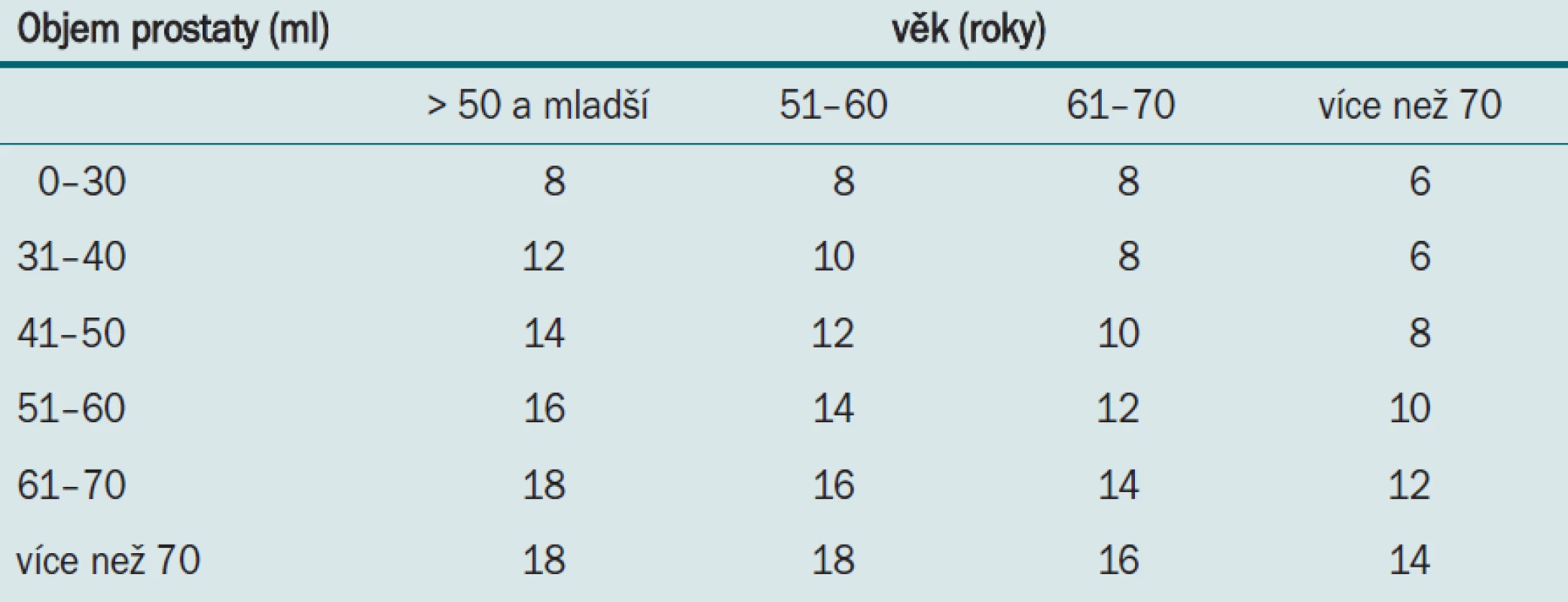
Vídeňský nomogram vypracovaný Djavanem et al nabízí jednoduché schéma pro optimální výběr počtu vzorků v závislosti na věku pacienta a celkovém objemu prostaty u PSA v rozmezí 2—10 ng/ml. Celková detekce KP je 36,7 %, což je o 66,4 % více než je referováno u klasické oktantové biopsie a systematické biopsie. Snižuje se tak počet opakovaných biopsií.
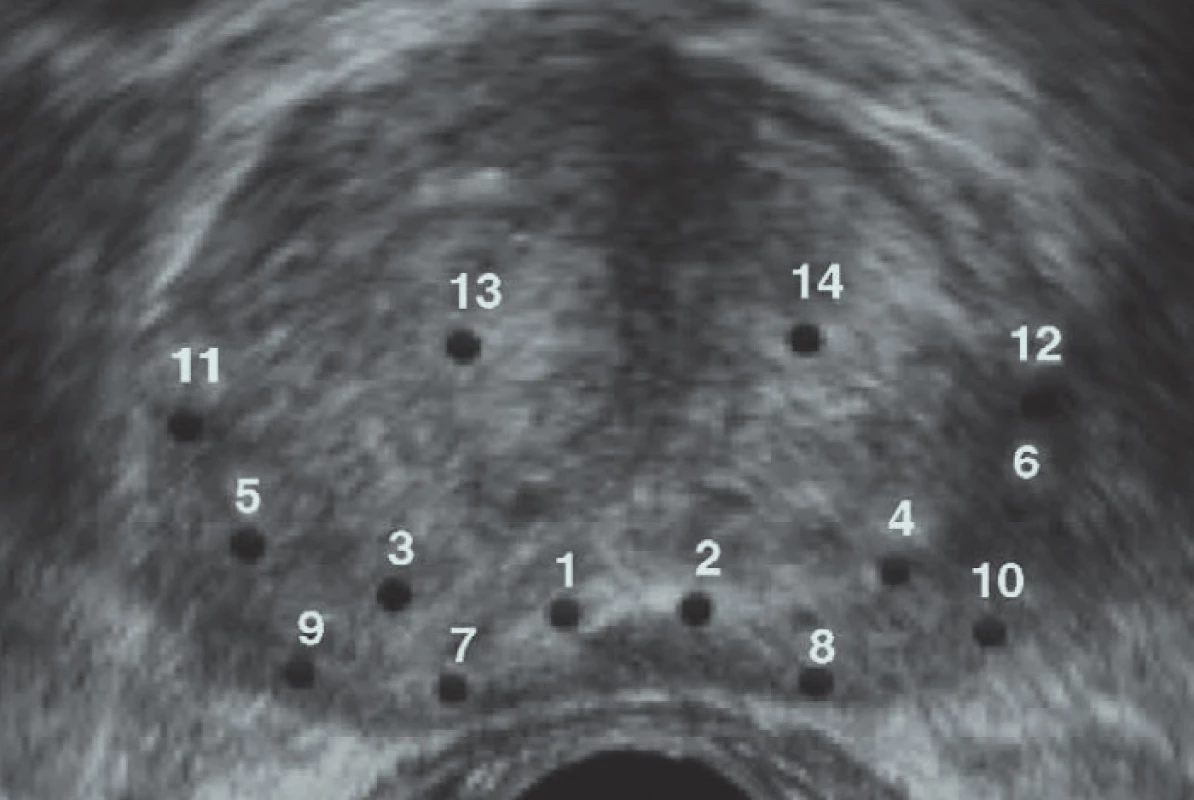
Saturační biopsie
Studie, které se zabývaly indikací k odběru vícečetných vzorků [14-45] tzv. saturační biopsií ukazují, že teprve při použití této metody bylo detegováno 30 % nádorů, které nebyly detegovány při 1. odběru, ale na které vzniklo podezření na základě vyšetření PSA. Obecně se doporučuje odběr průměrně 20 vzorků s maximem odběru z periferních oblastí prostaty. Nutno však mít na paměti, že se zvyšováním počtu vzorků se zvyšuje riziko detekce nesignifikantních karcinomů. Saturační biopsie nezvyšuje riziko krvácivých ani infekčních komplikací. Zvyšuje se bolestivý vjem pacientů, a proto je vhodné provádět vyšetření touto metodou pouze ve svodné nebo celkové anestezii. Přestože saturační biopsie zvyšuje detekci karcinomu u pacientů po předchozí negativní biopsii, není tato metoda doporučena jako metoda první volby. Doporučuje se v případech, kdy trvá podezření na nádor po první negativní 10—12jehlové biopsii [13].
Opakovaná biopsie
Při podezření na karcinom prostaty se u určitého procenta pacientů setkáváme s negativním výsledkem při přetrvávajícím, nebo dokonce narůstajícím PSA. Biopsii je vhodné opakovat s odstupem 6 měsíců v závislosti na dynamice sledovaných parametrů. Je vhodné se zaměřit na PSA, volné PSA, denzitu PSA, PSA a volné PSA z přechodné zóny.
Prostatická intraepiteliální neoplazie vysokého stupně (HG-PIN) je detegována aě v 50 % pozitivních biopsií. Ze studií vyplývá, že detekce HG-PIN je indikací k nejméně 1 rebiopsii. Pokud je při rebiopsii pro HG-PIN opět negativní nález a rebiopsie byla provedena 12 vzorky, je pravděpodobnost přítomnosti karcinomu malá. Pak je doporučeno sledování po dobu 2 let, než bude indikována další biopsie. Při změně charakteristik PSA nebo DRV je biopsie indikována dříve.
Dnes není stanoveno, kolikrát rebiopsii opakovat. Na našem pracovišti biopsii více než 5krát neopakujeme. V kaědém případě je při jakékoliv rebiospii nutné odebrat vzorky z periferní části prostaty a se zaměřením na zmnožení odběru vzorků z apexu. Pokud podezření na nádorové onemocnění trvá i po této rebiopsii, je indikována saturační biopsie.
Biopsie semenných váčků
V případě podezření na infiltraci semenných váčků lze provést cílenou biopsii. K potvrzení správného umístění jehly je nutné potvrzení přítomnosti epitelu semenného váčku v histologickém preparátu z odebraného vzorku.
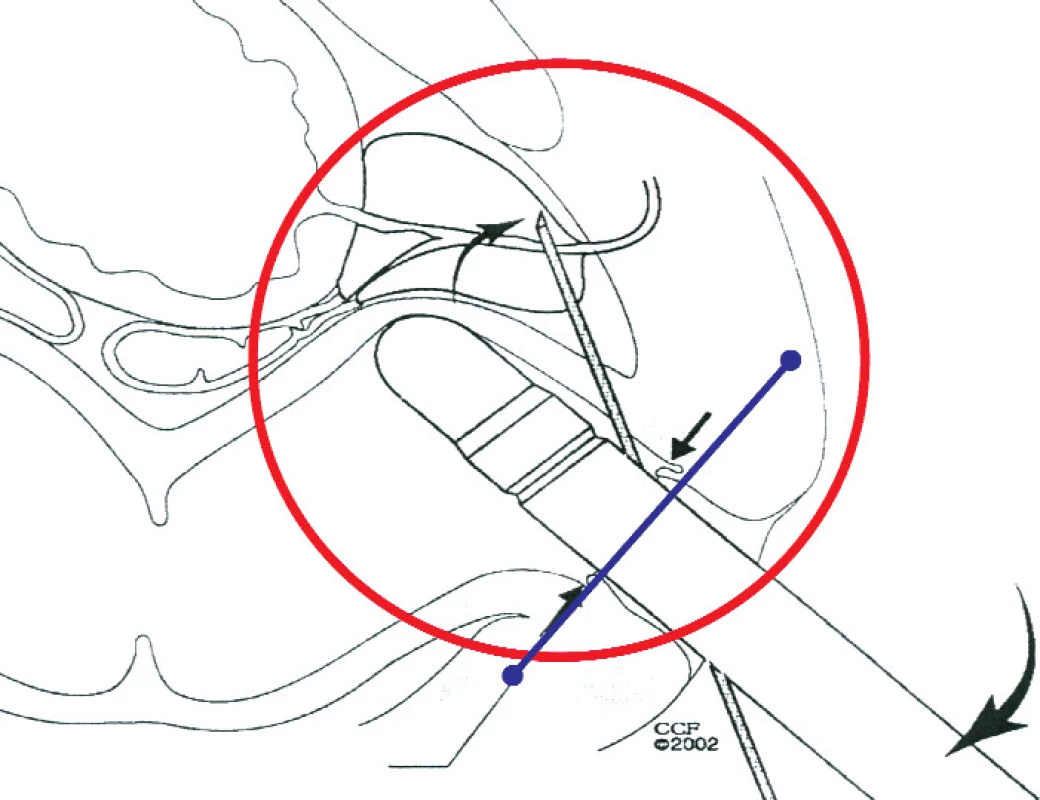
Biopsie uretrovezikální anastomózy po RAPE
Nárůst PSA po radikální prostatektomii většinou znamená recidivu onemocnění. časový odstup po operaci, stadium a histologický nález umožňují usuzovat, zda se jedná o lokální recidivu nebo metastatické postižení. K potvrzení lokální recidivy lze provést biopsii z uretrovezikální anastomózy. Ultrazvukovým vyšetřením nelze detegovat specifické změny pro nádor, ultrazvuk slouží pouze k cílenému zaměření uretrovezikální anastomózy.
Antibiotika
Protokol o užití antibiotika se liší podle jednotlivých pracovišť. Na našem pracovišti se řídíme následujícím schématem:
2 dny před biopsií pacient užívá chinolony/Nolicin tbl. 1—0—1/ a Entizol tbl. 1—1—1. U rizikových pacientů nebo u komplikací v zavedené terapii ještě pokračujeme 3 dny. U pacientů s kardiovaskulárním onemocněním (implantace artificiální chlopně, poruchy srdečního rytmu fibrilace, flutter, cévní protézy) podáváme před biopsií antibiotikum penicilinové/ ampicilinové řady + jednorázově gentamycin 240 mg. Entizol 1 den před výkonem a den po výkonu.
Antiagregancia (Acylpyrin, Anopyrin, Godasal apod) vysazujeme 10 dnů před biopsií, antikoagulancia nahrazujeme aplikací nízkomolekulárních heparinů.
Analgezie
Tak jako není dosaženo konsenzu v optimálním počtu a lokalizaci vzorků, neexistuje konsenzus ani v používání anestetik při biopsii. Biopsie prostaty bez anestezie je všeobecně vnímána jako středně nepříjemná většinou pacientů (65—90 %). Podle našich zkušeností určitá část pacientů tento výkon vnímá jako nepříjemný a bolestivý a podle údajů v literatuře by 16—20 % pacientů dalo přednost některému typu analgezie nebo anestezii [14].
V závislosti na objemu prostaty a při opakované biopsii se zvyšuje počet odebraných vzorků při biopsii. Diskomfort se zvyšuje s počtem odebíraných vzorků a opakováním biopsie (především u mladších pacientů). V některých případech je intolerance příčinou předčasného ukončení vyšetření.
Bolest pociťovaná při PBP se skládá ze 3 komponent:
- zavedení a umístění rektální sondy v konečníku,
- bolest při pronikání jehly přes stěnu rekta a
- bolest z prostatického pouzdra a stromatu.
Prostatická kapsula a prostatická tkáň jsou bohatě zásobeny autonomními vlákny. Inervace prostaty je vedena z kaudálních kořenů S2 - S5 a ze sympatických pletenců jdoucích cestou presakrálního a hypogastrického neurálního plexu. Nervová vlákna z těchto nervových plexů se větví v prostatický plexus a pak pokračují s cévním svazkem. Předpokládá se, že tato posterolaterální nervová vlákna zajišťují hlavní nervové zásobení prostaty [17-19]. Issa et al předpokládají, že bolest takto vygenerovaná je výsledkem přímého kontaktu s těmito nervy [14]. Na základě tohoto předpokladu je tu snaha o vytvoření efektivní anestezie prostřednictvím blokády periprostatických nervově cévních svazků [17,20-22].
Blokáda neurovaskulárních svazků však nezajistí dostatečnou redukci bolesti rekta spojenou se zaváděním USG sondy a bolestivosti vpichu jehly přes rektální sliznici. Řada studií snaží sledovat efekt při aplikaci lidokainového gelu intrarektálně. Issa [14] a Saad [22] dokumentovali prokazatelné snížení bolestivosti po aplikaci lidokainového gelu intrarektálně ve srovnání s placebem. Nicméně periprostatická blokáda nervových svazků zůstává neporovonatelně efektivnější metodou ke snížení dyskomfortu při PBP. Ani metoda kombinace intrarektální aplikace anestetického gelu a periprostatická nervová blokáda není nová. Obek touto kombinací dosáhl snížení bolestivého vjemu při zavedení rektální sondy i při odebírání vzorků bioptickou jehlou [23]. V této prospektivní randomizované studii pouěil k blokádě neurovaskulárního svazku lidokainu (2% 5 ml) a gelu (2% 10 ml).
Některé další studie se zaměřují na srovnání periprostatického plexu a intraprostatické anestezie. Hlavní část nervových vláken prochází na posterolaterální straně prostaty. Některá nervová vlákna ze svazků perforují pouzdro a končí v prostatě [24]. Bolestivý vjem může být způsoben přímým kontaktem jehly s těmito vlákny umístěnými ve stromatu prostaty a v pouzdru [18]. Mutaguchi et al předložili studii s kombinací intraprostatické a periprostatické anestezie [25]. Tato metoda prokázala lepší účinnost oproti ostatním metodám (samotná intraprostatická a samotná periprostatická anestezie). Navíc zajišťuje nejen dobrou anestezii v průběhu PBP, ale i 20 minut po biopsii. různé metody ani jejich kombinace nevykazovaly zvýšenou četnost výskytu komplikací.
Statistická hodnocení studií prokazují, že pro snížení bolestivého vjemu jsou účinné periprostatická a intraprostatická anestezie, zatímco povrchová slizniční anestezie a aplikace analgetik před biopsií nejsou dostatečně účinné. Pacienti, kterým byla před PBP aplikována lokální anestezie/periprostatická a intraprostatická — skupina III a IV/, udávali výrazně nižší bolestivost v průběhu výkonu v porovnaní se skupinou I. a II. (bez anestezie, aplikace tramadolu). Rozdíl byl statisticky významný, p < 0,01 (Mannův-Whitneyův U test). Mezi skupinami I a II, stejně jako mezi skupinami III a IV, nebyl statisticky významný rozdíl. Snížení bolestivého vjemu je mírně lepší u intraprostatické anestezie, ale rozdíly nejsou statisticky významné (schéma 1).

Periprostatický neurální blok i intraprostatická anestezie jsou bezpečné a efektivní metody, dobře tolerované pacientem. Obě techniky jsou srovnatelné, snižují bolestivý vjem při provádění multiplicitní biopsie prostaty. Intraprostatická anestezie navíc snižuje riziko poranění nervově-cévního svazku s následnou perineurální fibrózou. Výskyt komplikací nevykazuje statisticky významný rozdíl u žádné metody. Multiplicitní biopsie prováděná bez anestezie nebo s aplikací analgetik vykazuje významný bolestivý vjem a rozdíl oproti technikám s anestezií je statisticky významný.
Podle výsledků jsou tyto metody bezpečné a významným způsobem zlepšují komfort pacienta [15]. Metody lokální anestezie jsou jednoduché, bezpečné, jsou snadno proveditelné, neprodlužují zásadním způsobem čas výkonu a nezatěžují pracoviště zvýšenými ekonomickými náklady. Techniky nejsou zatíženy vyšší mírou komplikací ve srovnání s výkonem bez anestezie. Lokální anestezie by měla být rutinně použita u všech pacientů indikovaných k biopsii prostaty.
Odběr vzorků
Základním předpokladem stanovení správného výsledku je těsná spolupráce urologa a patologa. Urolog musí odebrat a předat vzorky tak, aby je patolog mohl správně zhodnotit. Vzorků musí být dostatečný počet a jednotlivé vzorky tkáně musí být reprezentativní. To znamená, že vzorky by měly být odebrány celou délkou zářezu bioptické jehly. Správně by každý vzorek měl být v délce 17 mm. Z důvodu minimalizace bolesti a kvality odběru se standardně užívá bioptická pistole s plášťovou jehlou 18 G. Tkáň nesmí být traumatizovaná a musí být v potřebném objemu. Proto je základním předpokladem použít pro každý odběr novou jehlu. Každý jednotlivý vzorek uložíme zvlášť, nejlépe do speciální komůrky a barvivem označíme periferní konec. Do protokolu označíme místo odběru každého vzorku.
Od patologa nutně očekáváme zhodnocení Gleasonova skóre (GS), procentuální objem karcinomu ve vyšetřovaných vzorcích a přítomnost infiltrace a prorůstání kapsuly prostaty.
Závěr
I když existuje několik technik a možností, o vhodné metodě se stále diskutuje. Je nutno zvažovat přínos konkrétní metodiky z hlediska času, aplikace, bezpečnosti a ceny na jedné straně a pacientova pohodlí na straně druhé.
Transrektální, ultrazvukem vedená sextantová biopsie znamenala revoluci v diagnostice KP, zvláště u pacientů s negativním palpačním nálezem na prostatě. Originální metodika sextantové biopsie, jak byla popsána - ve střední parasagitální linii, nepostihuje dostatečně přední a laterální oblasti prostaty. četné zkušenosti z klinických pracovišť na velkých souborech pacientů prokazují, že u mužů s normálním rektálním nálezem a PSA větším > 2 ng/ml může samotná sextantová biopsie minout aě polovinu přítomných karcinomů.
Spolu s dalším rozšiřováním zkušeností četných klinických pracovišť dochází neustále k obměnám schémat biopsií.
Rozšířená (multiplicitní) biopsie s laterálními vzorky je dnes nezbytná. Rozšířená biopsie nezvyšuje detekci nesignifikantních nádorů. Optimální počet vzorků není zatím znám stejně jako přesná strategie jejich rozmístění. Zvýšení počtu odebíraných vzorků signifikantně zvyšuje výtěžnost cílené biopsie. V současné době se doporučuje technika 8—12 vzorků. Technika je bezpečná a pacienty dobře snášená. Vzorky by měly být umístěny periferní oblasti (4 vzorky na každé straně) a zaměření by mělo být cílené na apex prostaty (obr. 7).
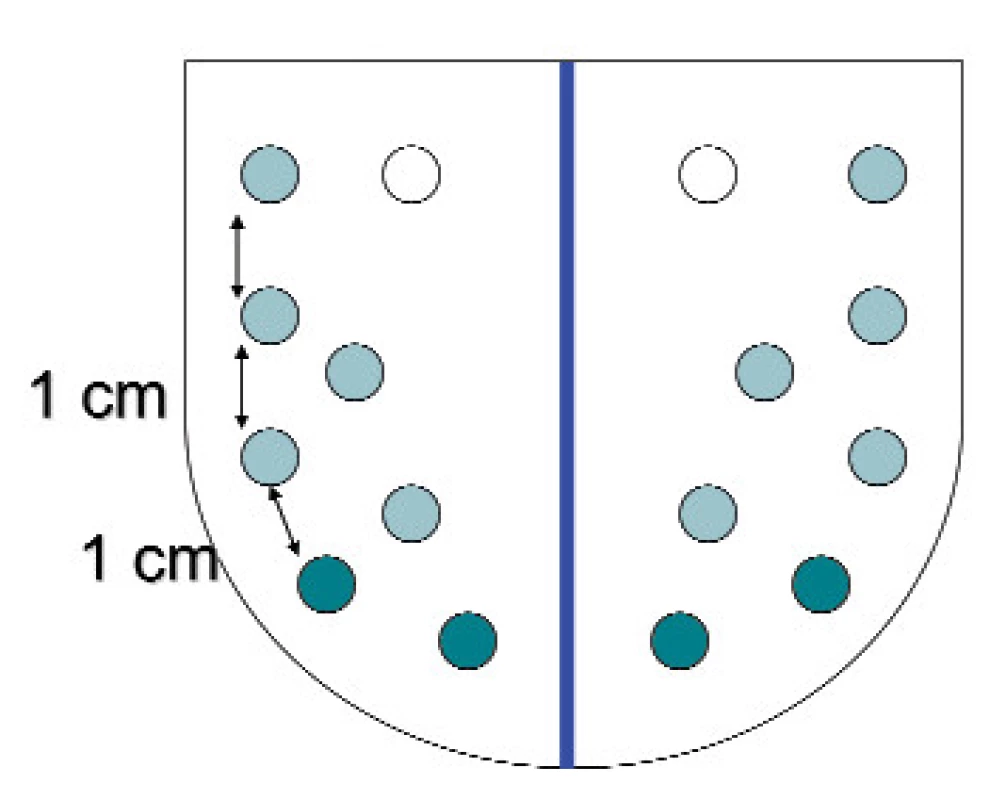
Největšího zlepšení při detekci KP je při použití této techniky dosaženo u pacientů s prostatou nad 50 g a PSA 2—10 ng/ml. Počet pozitivních vzorků další informace získané jejich exaktním zpracováním by měly být standardně zahrnuty do bioptického protokolu, aby bylo možno upřesnit rozvahu definitivního terapeutického postupu.
Vídeňský nomogram (tab. 1) umožňuje vybrat schéma v závislosti na věku pacienta a velikosti prostaty v rozmezí PSA 2—10 ng/ml. Vídeňský nomogram nejen zlepšuje optimální výběr počtu vzorků, ale také snižuje počet opakovaných biopsií a počet nadbytečných vzorků.
Opakovaná biopsie s odběrem vícečetných vzorků (10, 12 a více) je pacienty špatně snášena i tolerována. Lokální anestezie signifikantně snižuje bolestivost multiplicitní biopsie prostaty. Znalost anatomie nervového zásobení prostaty je nezbytná pro zajištění správné, účinné a nekomplikované anestezie.
Aplikace anestetického gelu intrarektálně zmírní bolestivost při biopsii minimálně. Injekce anestetika do okolí neurovaskulárního svazku významně sníží diskomfort pacienta. Periprostatická nebo intraprostatická anestezie, případně kombinace obou by měla být standardně aplikována u všech odběrů (8—12 vzorků), tedy u většiny biopsií prostaty.
U opakované biopsie (multiplicitní biopsie, saturační biopsie) by měl být vědy použit některý typ anestezie.
V případě detekce PIN III se doporučuje opakovaná biopsie. Doporučuje se multiplicitní nebo saturační biopsie + 2 vzorky z TZ.
Extenzivní odběr vzorků by měl být proveden z místa výskytu PIN III (eventuálně z ipsilaterální poloviny prostaty) [16].
prim. MUDr. Aleš Čermák
prof. MUDr. Dalibor Pacík, CSc.
Urologická klinika LF MU a FN Brno
Jihlavská 20, 625 00 Brno
acermak@fnbrno.cz
Sources
1. Dvořáček J, Babjuk M et al. Onkourologie. Praha: Galén 2005 : 275-280.
2. Uzzo RG, Wei JT, Waldbaum RS et al. The influence of prostatic size on cancer detection. Urology 1995; 46 : 831.
3. Karakiewicz PI, Bazinet M, Aprikian AG et al. Outcome of sextant biopsy according to gland volume. Urology 1997; 49 : 55-59.
4. Hodge KK, McNeal JE, Terris MK, Stamey TA. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol 1986; 142 : 71.
5. Cooner WH, Mosley BR, Rutherford CL et al. Prostate cancer detection in a clinical urological practice by ultrasonography, digital rectal examination and prostate specific antigen. J Urol 1990; 143 : 1146.
6. Epstein JI, Walsh PC, Sauvageot J, Carter HB. Use of repeat sextant and transition zone biopsies for assessing extent of prostatic cancer. J Urol 1997; 158 : 1886-1890.
7. Babian RJ, Toi A, Kamoi K et al. A comparative analysis of sextant and extended 11-core multisite directed biopsy strategy. J Urol 2000; 163 : 152-157.
8. Borboroglu PG, Comer SW, Riffenburgh RH, Amling CL. Extensive repeat transrectal ultrasound guided prostate biopsy in patients with previous benign sextant biopsies. J Urol 2000; 163 : 158-162.
9. Applewhite JC, Matala BR, McCullough DL. Results of the 5 region prostate biopsy Metod: the repeat biopsy population. J Urol 2002; 168 : 500.
10. Eskew LA, Bare RL, McCullough DL. Systematic 5 region prostate biopsy is superior to sextant method for diagnosing carcinoma of the prostate cancer. J Urol 1997; 57 : 199.
11. Stamey TA. Making the most out of six systematic sextant biopsies. Urology 1995; 45 : 2-12.
12. Terris MK, Wallen EM, Stamey TA. Comparison of mid-lobe versus lateral systematic sextant biopsies in the detection of prostate cancer. Urol Int 1997; 59 : 239-242.
13. Stehen JJ, Patel A, Schoenfield L et al. Saturation Technique does not improve cancer detection as an initial prostate biopsy strategy. J Urol 2006; 175 : 485-488.
14. Issa MM, Bux S, Chun T et al. A randomized prospective trial of intrarectal lidocaine for pain control during transrectal prostate biopsy: the Emory University experience. J Urol 2000; 164 : 397-399.
15. Soloway MS, Obek C. Periprostatic local anesthesia before ultrasound guided prostate biopsy. J Urol 2000; 163 : 172-173.
16. Kamoi K, Troncoso P, Babaian J. Strategy for repeat biopsy in patients with high grade pros-tatic intraepitelial neoplasia. J Urol 2000; 163 : 819-823.
17. Nash PA, Bruce JE, Indudhara R, Shinohara K. Transrectal ultrasound guided prostatic nerve blockade eases systematic needle biopsy of the prostate. J Urol 1996; 155(2): 607-609.
18. Hollabaugh RS Jr, Dmochowski RR, Steiner MS. Neuroanatomy of the male rhabdosphincter. Urology 1997; 49(3): 426-434.
19. Hollabaugh RS Jr, Dmochowski RR, Kneib TG, Steiner MS. Preservation of putative continence nerves during radical retropubic prostatectomy leads to more rapid return of urinary continence. Urology 1998; 51(6): 960-967.
20. Soloway MS, Obek C. Periprostatic local anesthesia before ultrasound guided prostate biopsy. J Urol 2000; 163(1): 172-173.
21. Alavi AS, Soloway MS, Vaidya A et al. Local anesthesia for ultrasound guided prostate biopsy: a prospective randomized trial comparing 2 methods. J Urol 2001; 166(4): 1343-1345.
22. Saad F, Sabbagh R, McCormack M, Peloquin F. A prospective randomized trial comparing lidocaine and lubricating gel on pain level in patients undergoing transrectal ultrasound prostate biopsy. Can J Urol 2002; 9(4): 1592-1594.
23. Obek C, Ozkan B, Tunc B et al. Comparison of 3 different methods of anesthesia before transrectal prostate biopsy: a prospective randomized trial. J Urol 2004; 172(2): 502-505.
24. Benoit G, Merlaud L, Meduri G et al. Anatomy of the prostatic nerves. Surg Radiol Anat. 1994; 16(1): 23-29.
25. Mutaguchi K, Shinohara K, Matsubara A et al. Local anesthesia during 10 core biopsy of the prostate: comparison of 2 methods. J Urol 2005 Mar; 173(3): 742-745.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2007 Issue 4
-
All articles in this issue
- EPCA a EPCA-2 jako potencionální biomarkery karcinomu prostaty
- Současné možnosti provedení nefroureterektomie
- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Transrektální ultrazvukem vedené biopsie prostaty
- Možnosti chemoterapie u pacientů s karcinomem prostaty refrakterním na hormonální léčbu
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Transrektální ultrazvukem vedené biopsie prostaty
- Současné možnosti provedení nefroureterektomie
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
