Denosumab rozšiřuje možnosti farmakoterapie kostního postižení pacientů s karcinomem prostaty
Denosumab extends the pool of pharmacotherapy options for the management of skeletal involvement in patients with prostate cancer
A high percentage of prostate cancer patients are at risk of skeletal involvement. Osteoporosis secondary to hormonal ablative therapy and skeletal adverse events as a result of metastatic bone involvement have a negative impact on the patients’ quality of life and their prognosis. Prevalence and delay of SRE must therefore be foregrounded. This article summarizes available evidence about fully-human monoclonal antibody denosumab. This agens has a novel mechanism of action, and thus extends the pool of medicaments influencing bone metabolism. This article is based on data from trials directly comparing denosumab and zoledronic acid, which represents current standard in the treatment of patients with prostate cancer with bone involvement.
Key words:
prostate cancer, denosumab, SRE, zoledronic acid, bone metastases, CTIBL
Authors:
D. Pacík
Authors‘ workplace:
Urologická klinika FN Brno
Published in:
Urol List 2012; 10(2): 11-14
Overview
Pacienti s karcinomem prostaty jsou ve vysokém procentu ohroženi postižením kostí. Sekundární osteoporóza v důsledku hormonálně ablativní terapie i kostní příhody v důsledku metastatického postižení skeletu nepříznivě ovlivňují kvalitu života pacientů i jejich prognózu. V popředí zájmu proto zůstává především prevence a oddálení SRE. Následující článek shrnuje poznatky o plně humánní monoklonální protilátce denosumabu, která představuje látku se zcela novým mechanizmem účinku, a rozšiřuje tak paletu léků ovlivňujících kostní metabolizmus. Vychází přitom z registračních studií přímo srovnávajících denosumab a kyselinu zoledronovou, představující současný standard léčby pacientů s karcinomem prostaty a kostními metastázami.
Klíčová slova:
karcinom prostaty, denosumab, SRE, kyselina zoledronová, kostní metastázy, CTIBL
Karcinom prostaty patří mezi nejčastější malignity u mužů: v roce 2008 činila hrubá incidence v ČR 103,81/100 000 osob, což v absolutních číslech představovalo 5 332 nových případů [1]. Predikce incidence na rok 2012 činí již 7 312 nově diagnostikovaných karcinomů prostaty a celkový počet přežívajících pacientů je odhadován na 42 665 případů [2]. Vysoká prevalence odráží jak nárůst počtu pacientů v časném stadiu onemocnění díky dokonalejší a dostupnější diagnostice, tak zvyšování počtu pacientů s pokročilým onemocněním v důsledku pokroků dosažených v léčbě.
POSTIŽENÍ SKELETU PŘI HORMONÁLNÍ SUPRESI
Hrozba skeletálního postižení provází pacienty s diagnózou karcinomu prostaty v celém průběhu jejich onemocnění. Základní léčebnou modalitu pro pacienty s pokročilým nebo generalizovaným onemocněním představuje hormonální léčba. Hormonální supresi můžeme navodit chirurgicky orchiektomií nebo farmakologicky podáním LHRH analog, ev. v kombinaci s antiandrogeny při maximální androgenní blokádě. Hormonálně ablativní terapie navozuje apoptózu androgen dependentních buněk zablokováním androgenních signálů a vede k prodloužení bezpříznakového i celkového přežití [3–5], současně však pacientům přináší zvýšené riziko kardiovaskulárních onemocnění, sexuální dysfunkce, ovlivnění psychiky a v neposlední řadě také úbytku kostní hmoty (CTIBL – Cancer Treatment Induced Bone Loss) [6]. Tento úbytek je důsledkem porušené rovnováhy mezi osteoformací zprostředkovanou osteoblasty a osteoresorpcí realizované prostřednictvím osteoklastů. Úbytek kostní hmoty mužů léčených androgen deprivační léčbou (ADT) dosahuje 4,6 % za rok, což představuje téměř pětinásobek ve srovnání s postmenopauzálními ženami. Akcelerovaná osteoresorpce vede u mužů s karcinomem prostaty k redukci kostní denzity (BMD) a zvýšeni rizika patologických zlomenin. Toto riziko stoupá s délkou podání ADT a s počtem jejích dávek [7,8]. Patologické fraktury zhoršují kvalitu života pacientů, zvyšují náklady na léčbu a ohrožují pacienty na životě.
POSTIŽENÍ SKELETU PŘI DISEMINACI NÁDORU DO KOSTÍ
Ještě větší měrou je skelet ohrožen v případě generalizace nádoru. Kostní metastázy jsou nalézány v autopsiích u 65–75 % pacientů s karcinomem prostaty [9]. Mohou být klinicky němé, často ale přispívají ke snížení kvality života v souvislosti s přítomností kostních komplikací, tzv. SRE (Skeletal Related Events). Jedná se o kompozitní ukazatel, který zahrnuje patologické fraktury, míšní kompresi, chirurgický zákrok na kosti a ozařování kosti. SRE je užíván v klinických studiích pro sledování účinnosti léků ovlivňujících metabolizmus kosti a byl akceptován jak FDA, tak Evropskou lékovou agenturou EMA. Jde o komplikaci spojenou se signifikantním zvýšením mortality [10,11] a nárůstem nákladovosti léčby. Z vyjmenovaných SRE se u pacientů s karcinomem prostaty vyskytují nejčastěji patologické fraktury zastoupené 22 %, paliativní radioterapie probíhá u 29 % pacientů, míšní komprese byla zaznamenána u 7 % pacientů a k některému z chirurgických zákroků na kostech bylo nutno přistoupit u 3 % pacientů [12]. Data z placebového ramene studie s bisfosfonáty ukazují, že medián přežití je u karcinomu prostaty dvojnásobný oproti mediánu doby do první SRE: zatímco medián přežití pacientů s kostními metastázami činí 21,7 měsíce, medián doby do první SRE dosahuje 10,7 měsíce [12,13]. Je tedy zřejmé, že pacienti jsou dlouhou dobu vystaveni riziku SRE. Mezi další komplikace ohrožující pacienty s kostními metastázami můžeme zařadit hyperkalcemii a algický syndrom výrazně zhoršující kvalitu života pacientů.
ROLE RANK LIGANDU V PATOGENEZI KOSTNÍHO POSTIŽENÍ A MECHANIZMUS ÚČINKU DENOSUMABU
Pro zajištění funkcí skeletu je určující rovnováha mezi osteformací a osteoresorpcí. Klíčovou roli v udržení této rovnováhy hraje RANK receptor (Receptor Activator of Nuclear Factor Kappa B), jeho ligand RANKL a osteoprotegerin (OPG). RANKL je esenciální pro vznik, funkci a přežívání osteoklastů, jediných buněk zodpovědných za osteoresorpci. RANKL zprostředkovává osteoklastům a jejich prekurzorům signály vedoucí k odbourávání kosti. Jeho účinek je za fyziologických podmínek vyrovnáván působením solubilního receptoru OPG, který vazbou na RANK ligand chrání kost před nadměrnou resorpcí.
Převaha RANK ligandu nad osteoprotegerinem je podstatou kostního postižení jak u úbytku kostní hmoty v důsledku hormonálně ablativní terapie (CTIBL), tak u metastatického postižení kostí. U CTIBL dochází ke snížené produkci osteoprotegerinu v důsledku poklesu hladiny estrogenů. Převažující RANK ligand vede ke zmnožení počtu osteoklastů jejich vyzráváním z nezralých prekurzorových buněk a inhibicí jejich apoptózy; současně zvyšuje aktivitu stávajících zralých osteoklastů. Výsledkem je akcelerovaná osteoresorpce.
V případě diseminovaného onemocnění zasahujícího skelet se uplatňuje vzájemná interakce nádorových a kostních buněk, v jejímž důsledku dochází k destrukci kosti při současné stimulaci růstu nádoru. Nejvýznamněji se na této destrukci podílí PTHrP (Parathormon Related Peptid) produkovaný nádorovými buňkami, který stimuluje tvorbu RANKL a současně vede k down regulaci osteoprotegerinu. Výsledkem je opět akcelerovaná osteoresorpce, díky níž se z kostní extracelulární matrix uvolňují růstové faktory PDGF (Platelet Derived Growth Factor), BMP (Bone Morphogenetic Proteins), TGF-b (Transforming Growth Factor beta), IGF (Insulin-like Growth Factor), FGF (Fibroblast Growth Factor ) a kalcium. Tyto růstové faktory zvyšují produkci PTHrP nebo přímo stimulují růst nádoru a stejný dopad má i zvýšená koncentrace vápenatých iontů. Vzniká začarovaný kruh kostní destrukce.
Kostní metastázy u karcinomu prostaty mají při radiodiagnostickém vyšetření osteoplastický charakter, přesto u nich byla zaznamenána akcelerovaná osteoresorpce. Ve srovnání s osteolytickými metastázami dosahovaly signifikantně zvýšených hodnot nejen marker kostní novotvorby BALP (kostní izoenzym alkalické fosfatázy), ale i marker kostního odbourávání u-NTx (močový N-telopeptid) [14].
Denosumab je plně humánní monoklonální protilátka (IgG2), která se s vysokou afinitou i specificitou váže na RANK ligand analogicky s endogenním osteoprotegerinem. Zabráněním interakce RANKL/RANK inhibuje tvorbu, funkci a životnost osteoklastů, čímž snižuje resorpci kosti a brání její destrukci. Jedná se o zcela nový mechanizmus účinku, odlišný od bisfosfonátů, s odlišným bezpečnostním profilem a způsobem podání. Na rozdíl od bisfosfonátů není denosumab vylučován ledvinami, ale je eliminován buňkami retikuloendoteliálního systému, a jeho podání není tedy limitováno renální insuficiencí [15].
LÉČBA ÚBYTKU KOSTNÍ HMOTY V DŮSLEDKU ANDROGEN DEPRIVAČNÍ LÉČBY (CTIBL)
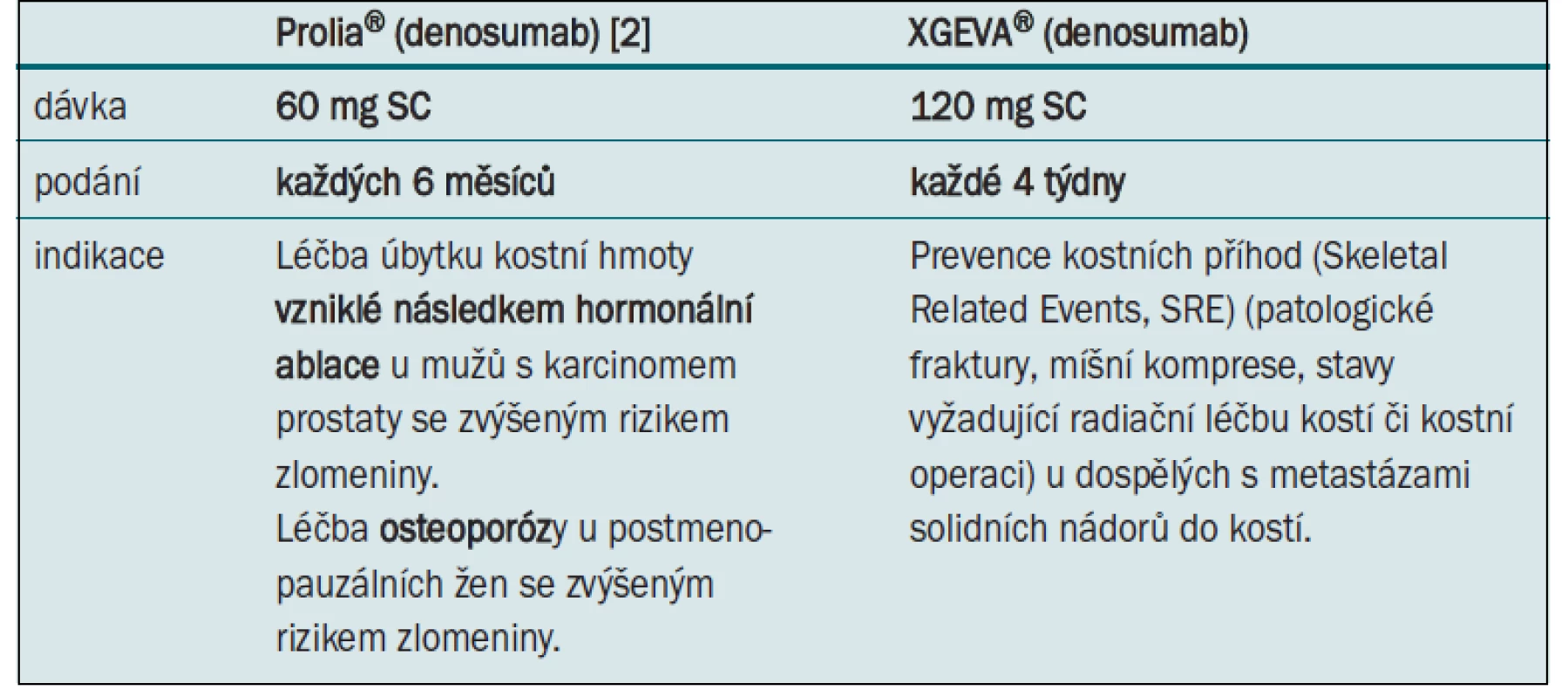
Denosumab podávaný v dávce 60 mg s.c. jednou za půl roku (Prolia) představuje první a dosud jedinou schválenou léčbu úbytku kostní hmoty vzniklé následkem hormonální ablace u mužů s karcinomem prostaty se zvýšeným rizikem zlomeniny (tab. 1). Přípravek byl v této indikaci registrován EMA i FDA na základě dvojitě zaslepeného klinického hodnocení fáze III s 1 468 pacienty, které prokázalo zvýšení BMD v oblasti bederní páteře o 5,6 %, zatímco v rameni s placebem došlo k poklesu o 1,0 %. Rozdíl byl vysoce statisticky signifikantní (p < 0,001) od prvního měsíce studie po celou dobu jejího trvání. Pro registraci v uvedené indikaci bylo především důležité statisticky signifikantní snížení incidence nových vertebrálních fraktur po 36 měsících (1,5 % denosumab vs 3,9 % placebo) (RR = 0,38; 95% CI, 0,19–0,78; p = 0,006) [16]. Nedílnou součástí léčby bylo podání kalcia a vitaminu, které je však bez léků modifikujících kostní metabolizmus samostatně nedostatečné [17].
DENOSUMAB V LÉČBĚ KOSTNÍ METASTATICKÉ CHOROBY
Přes pokroky v léčbě zůstává metastatický karcinom prostaty stále nevyléčitelným onemocněním. Cílem léčby těchto pacientů je prodloužení života při zachování jeho kvality, která je nepříznivě ovlivněna zejména kostními metastázami a jejich klinickými projevy. V popředí zájmu tak zůstává prevence a oddálení kostních příhod, tzv. SRE. Jednoznačný přínos pro pacienty s karcinomem prostaty a kostními metastázami představuje kyselina zoledronová, považovaná za současný standard léčby. I přes nesporné pokroky stále existuje potřeba efektivnější možnosti léčby, neboť u 30–39 % léčených pacientů dochází k výskytu SRE navzdory léčbě [18]. Podání zoledronátu je navíc limitováno nutností intravenózní infuze, nefrotoxicitou a reakcí akutní fáze během prvních tří dnů po podání léku.
Novou naději pro pacienty s karcinomem prostaty představuje monoklonální protilátka denosumab dávce 120 mg s.c. každé čtyři týdny (XGEVA) (tab. 1). Podkladem pro její registraci bylo klinické hodnocení fáze III, ve kterém XGEVA prokázala vyšší účinnost v prevenci kostních příhod ve srovnání s kyselinou zoledronovou. Do multicentrické randomizované dvojitě zaslepené studie bylo zařazeno 1 901 pacientů s kastračně rezistentním karcinomem prostaty. Pacienti dostávali každé čtyři týdny v jednom rameni denosumab subkutánně v dávce 120 mg a intravenózní placebo, v druhém rameni intravenózní kyselinu zoledronovou v 15minutové infuzi a subkutánní placebo. Jelikož podání kyseliny zoledronové u pacientů s clearance kreatininu není doporučeno, byli tito pacienti ze studie vyloučeni. Kromě toho nemohli být do studie zařazeni ani pacienti v minulosti léčení intravenózními bisfosfonáty. Dávkování intravenózního přípravku bylo upraveno na základě pokynů v SPC přípravku Zometa dle vstupní clearance kreatininu a následné dávkové intervaly byly upraveny dle sérového kreatininu, což vedlo k redukci dávky kyseliny zoledronové u 22,9 % pacientů a k vynechání dávky zoledronátu u 15,1 % pacientů [19]. Primárním cílem studie bylo prokázat noninferioritu denosumabu v době do první SRE v porovnání s kyselinou zoledronovou. Sekundárním cílem byla superiorita v témže parametru a v době do první a další SRE. Denosumab prokázal nejen noninferioritu, ale i superioritu prodloužením doby do první SRE o 18 % (HR: 0,82; 95% CI: 0,71–0,95; p = 0,008 pro superioritu). Medián doby do první SRE dosáhnul 20,7 měsíce u pacientů léčených denosumabem a 17,1 měsíce u pacientů léčených s kyselinou zoledronovou. V rameni s denosumabem se vyskytlo 494 mnohočetných SRE, zatímco v rameni s kyselinou zoledronovou bylo zaznamenáno 584 SRE, což znamenalo statisticky významně nižší výskyt ve prospěch denosumabu a snížení rizika vzniku první a další SRE o 18 % (RR = 0,82 (95% CI, 0,71–0,94; p = 0,008 pro superioritu)).
Podobně prodloužil denosumab dobu do 1. SRE o 18 % (HR: 0,82; 95% CI: 0,71–0,95; p = 0,01 pro superioritu; p ˂ 0,001 pro noninferioritu) ve studii fáze III se shodným uspořádáním u 2 046 pacientek s karcinomem prsu. Medián doby do první SRE nebyl v rameni s denosumabem v době analýzy dosažen, tzn. že se SRE vyskytla u méně než 50 % pacientek. V rameni pacientek léčených kyselinou zoledronovou činil medián 26,4 měsíce. Rozdíl dosáhnul statistické signifikance pro superioritu ve prospěch denosumabu.
Shodné uspořádání měla i další studie fáze III porovnávající účinnost denosumabu a kyseliny zoledronové u pacientů s ostatními solidními národy (kromě prsu a prostaty) a mnohočetným myelomem, ve které bylo zařazeno 1 776 pacientů. Denosumab prodloužil dobu do první SRE o 16 % (HR: 0,84; 95% CI: 0,71–0,98; p = 0,0007 pro noninferioritu; p = 0,06 pro superioritu po adjustaci pro multiplicitu).
V analýze podskupiny pacientů pouze se solidními nádory (tj. bez pacientů s mnohočetným myelomem) prodloužil denosumab statisticky signifikantně dobu do první SRE. Medián doby do první SRE byl o šest měsíců delší u pacientů léčených denosumabem oproti pacientům léčeným kyselinou zoledronovou a snížil riziko o 19 % (HR 0,81; p = 0,001 pro non-inferioritu; p = 0,034 pro superioritu).
Shodný design všech tří studií umožnil provést předem naplánovanou integrovanou analýzu zahrnující individuální data 5 723 pacientů. Výsledek potvrdil superioritu denosumabu ve srovnání s kyselinou zoledronovou (p ˂ 0,0001 pro superioritu). Medián doby do první SRE činil 27,6 měsíce oproti 19,4 měsíce u pacientů léčených kyselinou zoledronovou, což představuje oddálení první SRE o 8,2 měsíce a 17% snížení rizika. Denosumab byl účinnější v oddálení první kostní příhody jak u pacientů bez prevalentní SRE, tak u těch, kteří zaznamenali první SRE až v průběhu studie [20]. Přípravek XGEVA vykazuje ve srovnání s kyselinou zoledronovou významné prodloužení doby do první SRE konzistentně napříč různými typy SRE.
Nežádoucí příhody byly hlášeny v podobném procentu ve skupině léčené denosumabem (96,2 %) a ve skupině léčené kyselinou zoledronovou (96,8 %). Je nutné si uvědomit, že nežádoucí účinky odrážely i toxicitu protinádorové léčby a příznaky primárního onemocnění. Ve skupině pacientů léčených kyselinou zoledronovou byl o 2,6 % vyšší výskyt renálních nežádoucích účinků (zvýšení sérového kreatininu o 3,9 %, pokles clearance kreatininu pod 60 ml/min o 3,1 %) než ve skupině pacientů léčených denosumabem. Reakce akutní fáze se vyskytovaly častěji ve skupině pacientů léčených kyselinou zoledronovu (20,2 %) ve srovnání s pacienty léčenými denosumabem (8,7 %). Hypokalcemie byla častější u pa-cientů léčených denosumabem (9,6 %) než u pacientů léčených kyselinou zoledronovou (5,0 %). Přestože byla většinou mírná, přechodná a asymptomatická, je třeba v klinické praxi důrazně doporučit suplementaci kalciem. Osteonekróza čelisti (ONJ) se vyskytla v 1,8 % u pacientů léčených přípravkem XGEVA a v 1,3 % u pacientů léčených kyselinou zoledronovou; rozdíl nebyl statisticky signifikantní. Klinické příznaky těchto případů byly v obou léčených skupinách podobné. Mezi pacienty s potvrzenou ONJ měla většina (81 % v obou léčených skupinách) pacientů v anamnéze extrakci zubu, špatnou hygienu dutiny ústní a/nebo používání zubních náhrad. Většina pacientů byla navíc aktuálně nebo předtím léčena chemoterapií.
ZÁVĚR
Plně humánní monoklonální protilátka denosumab rozšiřuje paletu léků ovlivňujících metabolizmus kostí. U pacientů s kostními metastázami u karcinomu prostaty statisticky signifikantně snižuje riziko vzniku SRE a oddaluje jejich vznik ve srovnání se standardem léčby představovaným kyselinou zoledronovou. Kromě vyšší účinnosti je výhodou menší nefrotoxicita, méně reakcí akutní fáze i subkutánní podání bez nutnosti monitorování renálních funkcí.
prof. MUDr. Dalibor Pacík, CSc.
Urologická klinika FN Brno
Jihlavská 20, 625 00 Brno
dpacik@fnbrno.cz
Sources
1. http://www.uroweb.cz/index.php?pg=dg--nadory-prostaty--epidemiologie-ceska-republika--vyvoj-incidence-mortalita
2. http://www.linkos.cz/informace-pro-praxi/zasady-cytostaticke-lecby.
3. Bolla M. Adjuvant hormonal treatment with radiotherapy for locally advanced prostate cancer. Eur Urol 1999; 35 (Suppl 1): S23–S26.
4. Bolla M, Collette L, Blank L et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002; 360(9327): 103–108.
5. Messing EM, Manola J, Sarosdy M et al. Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N Engl J Med 1999; 341(24): 1781–1788.
6. Maillefert JF, Sibilia J, Michel F et al. Bone mineral density in men treated with synthetic gonadotropinreleasing hormone agonists for prostatic carcinoma. J Urol 1999; 161(4): 1219–1222.
7. Shahinian VB, Kuo YF, Freeman JL et al. Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med 2005; 352(2): 154–164.
8. Sharifi N, Gulley JL, Dahut WL. Androgen deprivation therapy for prostate cancer. JAMA 2005; 294(2): 238–244.
9. Coleman RE. Metastatic bone disease: clinical features, pathophysiology and treatment strategies Cancer Treat Rev 2001; 27(3): 165–176.
10. Saad F, Lipton A, Cook R et al. Pathologic fractures correlate with reduced survival in patients with malignant bone disease. Cancer 2007; 110(8): 1860–1867.
11. Norgaard M, Jensen AO, Jacobsen JB et al. Skeletal related events, bone metastasis and survival of prostate cancer: a population based cohort study in Denmark (1999 to 2007). J Urol 2010; 184(1): 162–167.
12. Saad F, Gleason DM, Murray R et al. A randomized, placebo-controlled trial of zoledronic acid in patients with hormone-refractory metastatic prostate carcinoma. J Natl Cancer Inst 2002; 94(19): 1458–1468.
13. Kantoff PW, Higano CS, Shore ND et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 2010; 363(5): 411–422.
14. Coleman RE, Major P, Lipton A et al. Predictive value of bone resorption and formation markers in cancer patients with bone metastases receiving the bisphosphonate zoledronic acid. J Clin Oncol 2005; 23(22): 25–35.
15. Fizazi K, Carducci M, Smith M et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 2011; 377(9768): 813–822.
16. Smith MR, Egerdie B, Toriz NH et al. Denosumab in Men Receiving Androgen-Deprivation Therapy for Prostate Cancer. N Engl J Med 2009; 361(8): 745–755.
17. Matoušková M, Hanuš M. Bisfosfonáty v léčbě kostních metstáz v urologii. Urologie pro praxi 2009; 10 : 282–286.
18. Rosen LS, Gordon D, Tchekmedyian S et al. Long term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with NSCLC and other solid tumors: a randomised, phase III, double blind, placebo controlled trial. Cancer 2004; 100(12): 2613–2621.
19. Brown J, Carducci M, Fizazi K et al. CIBD 2010: abstract 9 and oral presentation.
20. Lipton A, Siena S, Rader M et al. Comparison of denosumab versus zoledronic acid for treatment of bone metastases in advanced cancer patients: An integrated analysis of 3 pivotal trials European Cancer Organisation 2010: abstract 1249P and poster presentation.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2012 Issue 2
-
All articles in this issue
- Denosumab rozšiřuje možnosti farmakoterapie kostního postižení pacientů s karcinomem prostaty
- Nejnovější informace v oblasti terapeutických cílů a preparátů pro léčbu karcinomu prostaty rezistentního na kastrační léčbu
- Etiologie a diagnostika nádorů horních močových cest
- Ureteroskopická biopsie tumorů horních cest močových: endoskopické a cytologické techniky
- Technické triky a tipy pro retroperitoneální laparoendoskopickou nefrektomii jedním portem (LESS)
- Chemoterapie karcinomů horních cest močových
- Léčba generalizovaných nádorů ledvin: systémová imunoterapie, paliativní léčba
- Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýře
- Léčba nádorů, které neprorůstají do svaloviny: transuretrální resekce, nové postupy
- Chemoterapie a radioterapie u nádorů močového měchýře
- Léčba metastatických nádorů močového měchýře, systémová chemoterapie, symptomatická léčba
- Antimuskarinika a lékové interakce
- Extrakt ze Serenoa repens při léčbě benigní hyperplazie prostaty
- EAU Guidelines pro vazektomii
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Antimuskarinika a lékové interakce
- Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýře
- Chemoterapie a radioterapie u nádorů močového měchýře
- Etiologie a diagnostika nádorů horních močových cest
