Minimálně invazivní, ablační techniky při léčbě malých renálních tumorů
Minimal invasive ablation techniques in small renal tumours treatment
The improvement in imaging methods has led to an increase in renal cancer incidence during a few last years. Most (approximately 70%) tumours localized in renal parenchym are stage T1a tumours and thus considered as small tumours (mean < 4 cm). These tumours are usually found incidentally during tests for other indication. Virtually 100% of patients are asymptomatic (considering renal cancer). Most tumours are diagnosed in lower stage – T1 without metastatic expansion or lymphatic invasion. Surgical treatment is currently recommended as the standard treatment of small renal masses (SRM). Where technically feasible nephron-sparing resection (partial nephrectomy) is also recommended. Laparoscopic resection represents an alternative to open surgery, but should only be reserved for experienced surgeons. Alternative, minimal invasive methods and conservative treatment can be indicated in selected patients, usually patients with comorbidities in whom surgical treatment would pose significant threat, or patients with short expected survival. The aim of alternative ablation techniques in patients with SRM is to decrease intraoperative morbidity. Percutaneous biopsy is performed to obtain material for histological examination and to select the most adequate treatment modality. Active surveillance should be reserved for patients with significant comorbidities and short expected survival.
Key words:
renal cancer, small renal masses, thermal ablation, cryoablation, interstitial photon radiation ablation therapy, laser ablation, irreversible electrovaporation, microwave therapy
Authors:
A. Čermák; D. Pacík
Published in:
Urol List 2012; 10(3): 16-23
Overview
Se zdokonalováním zobrazovacích metod dochází v posledních letech k nárůstu incidence tumorů ledvin. Většina (přibližně 70 %) tumorů lokalizovaných v renálním parenchymu jsou nádory T1, a tedy jsou považovány za malé nádory (velikosti prům. < 4 cm). Tyto nádory jsou nejčastěji detekovány náhodně jako vedlejší nález při vyšetřování pacienta z jiné indikace. Téměř ve 100 % případů se jedná o pacienty asymptomatické (z hlediska nádoru ledviny). Většina nádorů je také diagnostikována v nižším stadiu, tedy T1 bez metastatického postižení či lymfatické invaze. Standardem léčby malých renálních lézí (SRM – Small Renal Masses) je doporučována chirurgická léčba. V současné době je doporučována (tam, kde je to technicky možné) nefron šetřící resekční operace – parciální resekce ledviny. Laparoskopická resekce je alternativou k otevřené operaci. Je však vyhrazena do rukou velmi zkušeného operatéra. Alternativní, minimálně invazivní metody nebo konzervativní metody jsou indikovány u vybrané skupiny pacientů, obvykle s komorbiditami, které činí chirurgický výkon neúměrně rizikovým, nebo u pacientů s krátkou předpokládanou dobou přežití. Důvodem pro provádění alternativních ablačních metod je léčba SRM se snahou snížit morbiditu operačního výkonu. Perkutánní biopsie jsou prováděny s cílem získání materiálu k histologickému vyšetření SRM a rozhodnutí o možné a vhodné léčebné strategii. Aktivní sledování je vyhrazeno pro pacienty s významnými komorbiditami a krátkou předpokládanou dobou přežití. Klíčová slova: karcinom ledviny, malé nádorové ložisko ledviny, termální ablace, kryoablace, intersticiální fotonová radiační ablace, terapie, laserová ablace, ireverzibilní elektroporace, mikrovlnná terapie
I přes pokroky v diagnostice a stálé zdokonalování léčby nádorů ledvin, nevykazuje onemocnění za posledních 30 let změnu stadií a též celková úmrtnost zůstává konstantní. Při použití léčebné metody se získáním materiálu ke kompletnímu histologickému zpracování – radikální nefrektomie (RANE) nebo parciální resekce (PN) bude v 80 % detekován karcinom a přibližně ve 20 % benigní léze (angiomyolipon, renální onkocytom, krvácející cysta, metanefritický adenom). Přežití u těchto léčebných modalit (RANE, PN) dosahuje 90 %. Předoperační biopsie, kterou je možno nejlépe provést perkutánně pomocí CT zaměření, umožňuje rozlišení mezi benigní a maligní lézí a určení histologického podtypu nádoru zhruba v 70 %. Zobrazovací metody, které detekují nádor, umožňují i sledování recidivy. Slouží také ke sledování růstu nádorů u pacientů, kde byla zvolena metoda odložené intervence a aktivního sledování.
I když v současné době standardně používaná TNM klasifikace je stále nejčastěji používaná, prakticky o všech kategoriích se vedou diskuze. Poslední verze AJCC (American Joint Committee on Cancer), která přinesla rozdělení T1 stadia na T1a (< 4 cm) a T1b (4–7 cm), současně zaměřuje pozornost na indikaci léčby v závislosti na velikost tumoru. Jsou navrhovány změny klasifikačního systému ve skupině T2, kdy je dokazováno, že nádory T2a (7–10 cm) mají nižší riziko mortality než nádory větší 10 cm. Další revizi si pravděpodobně vyžádá klasifikace T3. Jako špatný prognostický faktor byla zjištěna ipsilaterální invaze do nadledviny. Tento faktor má podobnou váhu jako klasifikace nádoru T4. Stejně tak bylo prokázáno, že invaze tumoru do tuku renálního sinu má horší prognózu než invaze do perinefritické tukové tkáně. Byly sledovány rozdílné prognostické faktory u nádorového trombu v renální žíle i v dolní duté žíle (DDŽ) s přítomností, nebo nepřítomností invaze tukové tkáně. Dříve než bude možné zavést změny klasifikace do rutinní praxe, bude nutné dále zkoumat karcinomy ohraničené na ledvinu.
Pro zlepšení prognózy přežití je potřeba vytvoření integrovaných klasifikačních nomogramů, které využívají anatomické i klinické proměnné. V současné době se pro stanovení rizika progrese po resekci lokalizovaného nádoru používají UCLA integrovaný klasifikační systém (UISS), velikost nádoru podle „Mayo“, grade tumoru, klasifikační systém SSIGN, předoperační a pooperační nomogramy vytvořené v Memorial Sloan-Kettering Cancer Institute. Integrované klasifikační systémy hrají rovněž důležitou úlohu při stratifikaci onemocněni podle rizika, což může ovlivnit volbu a způsob léčby.
S narůstající incidencí tumorů ledvin se mění i způsoby léčby. Původní léčbou každého nádoru byla radikální nefrektomie. Parciální resekce ledviny se zvažovala pouze u postižení solitární nebo funkčně solitární ledviny. Trend zachování orgánu, tedy nefron šetřící operace, se vyvíjel postupně. V retrospektivním přehledu se dnes skutečně ukazuje, že radikální nefrektomie i parciální resekce mají stejnou účinnosti při léčbě malých nádorů ledvin, přičemž parciální resekce ledviny vede k nižší celkové mortalitě než radikální nefrektomie u nádorů ledvin T1a. Při elektivni parciální resekci ledviny (PN) je dosahováno výsledku bez projevů lokální recidivy a přežití bez metastáz ve stejném procentu jako u radikální nefrektomie (RANE). Tento efekt byl prokázán nejprve u nádorů o velikosti ≤ 4 cm a později též u ložisek velikosti ≤ 7 cm. Soubory pacientů s malými renálními tumory, kteří podstoupili PN nebo RANE, byly porovnány z hlediska pooperační hodnoty ledvinných funkcí. Výsledky prokázaly, že pacienti podstupující RANE měli vyšší výskyt proteinurie a vyšší hladiny kreatininu (> 2 mg/dl).
Nejnovější studie užívající výpočet odhadované rychlosti glomerulární filtrace (eGFR) na základě MDRD vzorce prokázaly negativní dopad RANE na výslednou renální funkci. Jedna z velkých studii uvádí, že pravděpodobnost eGFR < 60 ml/min se vyskytuje po PN ve 20 %, zatímco po RANE v 65 % případů. Hodnoty eGFR < 45 ml/min se u PN vyskytují v 5 %, zatímco po RANE v 36 % případů. Multivariantní analýzy předpokládají, že provedení RANE při léčbě malých nádorových lézí znamená nezávislý rizikový faktor pro vznik chronické renální insuficience (CHRI).
Řada pacientů má významné komorbidity, jako jsou např. diabetes, hypertenze nebo periferní vaskulární onemocnění, které mohou mít významný vliv na počáteční funkci ledviny. Podrobné prospektivní studie u pacientů s tumorem ledvin, kteří nepodstoupili operační léčbu, prokázaly, že roční přírůstek renálního karcinomu je velmi malý (přibližně 0,3 cm/rok). Navíc u určitého procenta (asi 20 %) operovaných malých renálních lézí odhalí histologické vyšetření benigní nebo indolentní charakter. U pacientů s konvenčním renálním karcinomem o velikosti ≤ 4 cm se pravděpodobnost metastatického rozšíření odhaduje na 5–7 %. Klinický přístup spočívající v aktivním sledování vybraných pacientů s malými renálními lézemi, zejména u starších jedinců a jedinců s dalšími komorbiditami, získává na popularitě, zvláště z důvodu, že příliš agresivní RANE může vyvolat nebo zhoršit CHRI.
Nové, méně invazivní postupy rovněž zdokonalily léčbu nádorů ledvin. Vývoj v laparoskopické a roboticky asistované laparoskopii změnil přístup k malým nádorům ledvin. Na základě dat z desetiletého sledování Gill a Berger prokázali, že onkologické výsledky laparoskopické radikální nefrektomie jsou srovnatelné s výsledky otevřené radikální nefrektomie. Laparoskopie se stala standardem pro léčbu malých nádorů ledvin radikální nefrektomií nebo parciální resekcí ledviny.
Tento trend pokračuje a v závislosti na rozvoji operačních technik i metod hemostázy se neustále mění názor na hranici velikosti nádoru vhodného k provedení laparoskopické parciální resekce ledviny.
Pečlivá volba pacientů a zvyšující se zkušenosti s laparoskopickými technikami činí z PN (v rukou zručného operatéra) přijatelnou alternativu k otevřenému přístupu. Stále však platí, že doba teplé ischemie má negativní vliv na zhoršení renální funkce. Vyšší míra výskytu intraoperačních komplikací ve srovnání s otevřenou PN na pracovištích s menší četností prováděných výkonů vede k jednoznačným závěrům, že laparoskopické resekce by měly být prováděny v centrech zabývajících se výhradně minimálně invazivními technikami.
MINIMÁLNĚ INVAZIVNÍ, ABLAČNÍ TECHNIKY PŘI LÉČBĚ MALÝCH RENÁLNÍCH TUMORŮ
Ablační terapie – metodiky
I. Termální ablace
- radiofrekevenční ablace
- mikrovlnná termoterapie
- intersticiální laserová ablace
- fokusovaný ultrazvuk
II. Intersticiální fotonová radiační ablace
III. Kryoablace
IV. Ireverzibilní elektroporace
V současné době začínají být k dispozici slibné minimálně invazivní (MI) termoablační techniky pro léčbu malých nádorů ledvin. Ačkoli je indikace těchto technik zatím omezena pouze na pečlivě vybranou populaci pacientů z důvodu výskytu vážných komorbidit a rizikovosti anestezie, zdokonalování technologií, slibné onkologické výsledky a nižší morbidita nabízejí předpoklad, že indikaci MI termoablačních technik bude možné rozšířit u mladších pacientů v celkově lepším zdravotním stavu. Pro možnost většího rozšířením ablačních technik je nutné vyřešit otázku schopnosti dosáhnout úplné patologické ablace ložiska, posoudit nejlepší metodu pro sledování po ablaci a rovněž posoudit její proveditelnost a možné komplikace při provádění záchranné operace u pacientů s recidivou nádoru tak, aby bylo možno vyhnout se nutnosti provedeni radikální nefrektomie.
I. Termální ablace
I.a Radiofrekvenční ablace (RFA)
Při radiofrekvenční ablaci dochází k přeměně elektrického napětí o vysoké frekvenci (375–480 KHz) na tepelnou energii prostřednictvím pohybu iontů v tkáni obklopující hrot elektrody. Působením vysokých teplot na tkáň při RFA dochází k poškození tumoru. Vysoká teplota způsobuje denaturaci proteinů, narušení buněčné membrány a v konečné fázi koagulační nekrózu a buněčnou smrt. Čím vyšší je teplota v cílové tkáni, tím kratší je doba nezbytná pro ablaci. Při teplotách > 50 °C trvá proces přibližně 4–6 min, při teplotě 60 °C je výsledek prakticky okamžitý.
Cílem RFA je dosažení a udržení teploty 50–100 °C v celém objemu tumoru. Teplota by neměla přesáhnout 100 °C. Teploty > 105 °C způsobují vypařování, vznik plynu a zuhelnatění tkáně, a mohou tedy zamezit účinnému provedení ablace [1]. Renální cévy mohou způsobovat tzv. „sink (snižovací) efekt“. Jedná se o efekt způsobený přítomností větších cév, které v případě, že procházejí tumorem či v jeho těsné blízkosti, mohou snižovat efekt konvenčních termoablačních metod.
„Snižovací efekt“ odebírá teplo v průběhu samotné RFA, proto exofyticky rostoucí tumory jsou lépe ošetřitelné než centrální tumory nebo léze v blízkosti větší vaskulatury. Tepelná ablace má rovněž (podobně jako u kryoablace) opožděný účinek. Při zvýšení teploty nad 60 °C dochází následkem mikrovaskularniho buněčného otoku k vaskulárnímu poškození, intravaskulární trombóze a přilnutí neutrofilů k cévnímu endotelu. To vede k poklesu perfuze (během RFA) a přerušení vaskulárního zásobení. Při RFA byl rovněž popsán mechanizmus imunologické modulace.
Technika
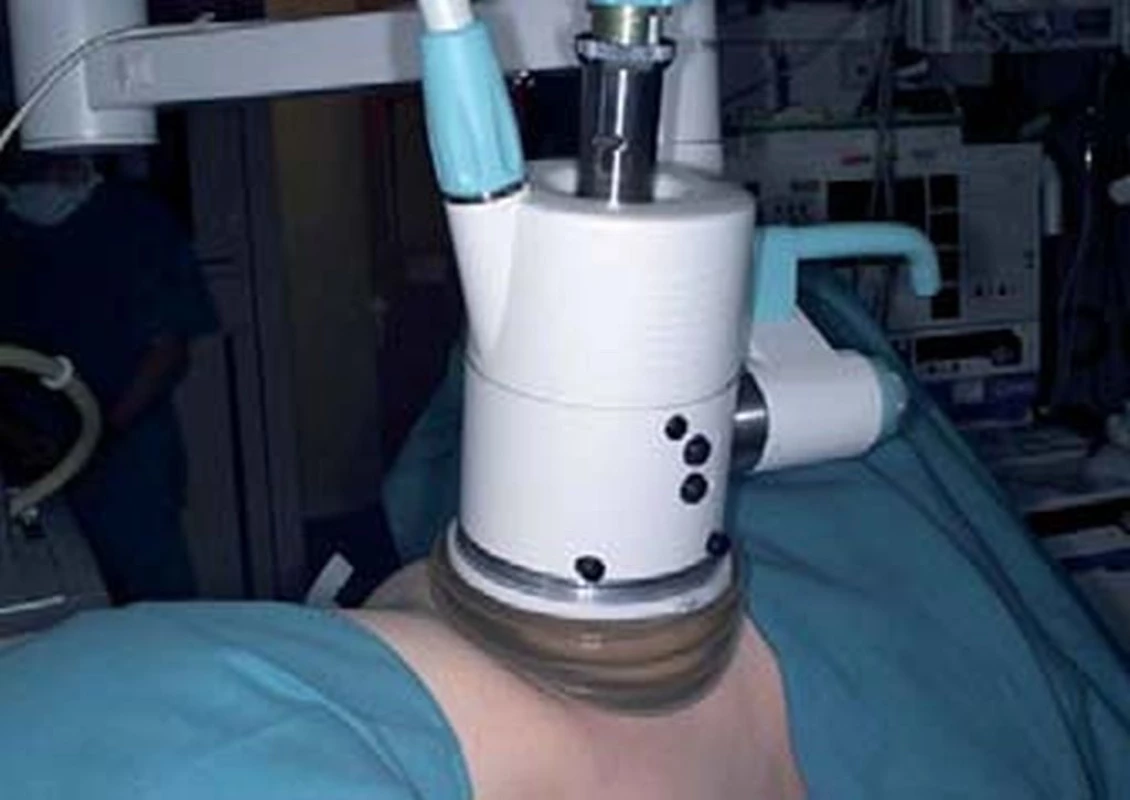
RFA lze provádět monopolární nebo bipolární koagulací. Nejčastěji se provádí perkutánně (PRFA). Výkon obvykle provádí intervenční radiolog. PRFA, stejně jako PCA, je skutečně minimálně invazivní přístup, který se provádí pouze v analgosedaci. Renální RFA lze také provádět otevřeným nebo laparoskopickým (LRFA) přístupem. Výhoda LRFA spočívá v možnosti izolovat tumor, a zabránit tak poranění okolních orgánů. Zavádění a umístění jehly je možno provádět pod ultrazvukovou (UZ) kontrolou, CT nebo MR navigací. V současné době je přibližně 94 % RFA prováděno perkutánně [2], obvykle pod CT kontrolou. I když perkutánní technika je méně invazivní, počet RFA reablací (ale také kryoablací) je vyšší. Zdá se, že výsledek vykazuje souvislost s lékařskou specializací (intervenční radiolog nebo urolog) [3].
Navigace pomocí zobrazovacích vyšetření a monitorování procesu ablace
Jako nejvýhodnější zobrazovací modalita se jeví MR, která umožňuje on-line monitorování ablačního procesu. Tkáň se po provedené ablaci zobrazí jako hypoechogenní (tmavší) oblast, reziduální tumor lze detekovat podle přetrvávajícího izoechogenního nebo hyperechogenního (světlejšího) signálu. CT bez kontrastní látky neumožní správně hodnotit změny v renální lézi po ablaci. Použitá kontrastní látka se vstřebává až několik hodin a lze ji aplikovat během výkonu pouze jednou, což znemožňuje okamžitou detekci reziduálních tumorů a rozhodnutí o opakování cyklu v rámci jediného výkonu. Použití UZ se jeví jako nejméně vhodné, protože vzduchové bubliny vznikající při odpařování významně narušují kvalitu zobrazení.
Limitace velikosti tumoru
Podobně jako tomu je u CA, velikost a lokalizace tumoru jsou významnými prediktory úspěšnosti RFA. U tumorů velikosti < 3 cm lze téměř ve všech případech dosáhnout kompletní ablace během jediného cyklu. U tumorů velikosti 3–5 cm klesá pravděpodobnost kompletní ablace na 50 % a u tumorů o velikosti > 5 cm dokonce na 25 %. Při PRFA je možné jednotlivé cykly v rámci jediného výkonu opakovat. U centrálně lokalizovaných tumorů je míra kompletní ablace v důsledku efektu „tepelného rezervoáru“ mnohem nižší.
Tab. 1 ukazuje výsledky RFA. Tracy et al v nedávné době publikovali největší soubor provedených RFA nádorů ledvin. Autoři provedli 243 RFA u 208 pacientů v obodobí 7,5 let. Průměrná velikost léze byla 2,4 cm a průměrné sledování bylo 27 měsíců (1,5–90). RCC bylo potvrzeno v 79 % případů, když byla provedena předoperační biopsie.
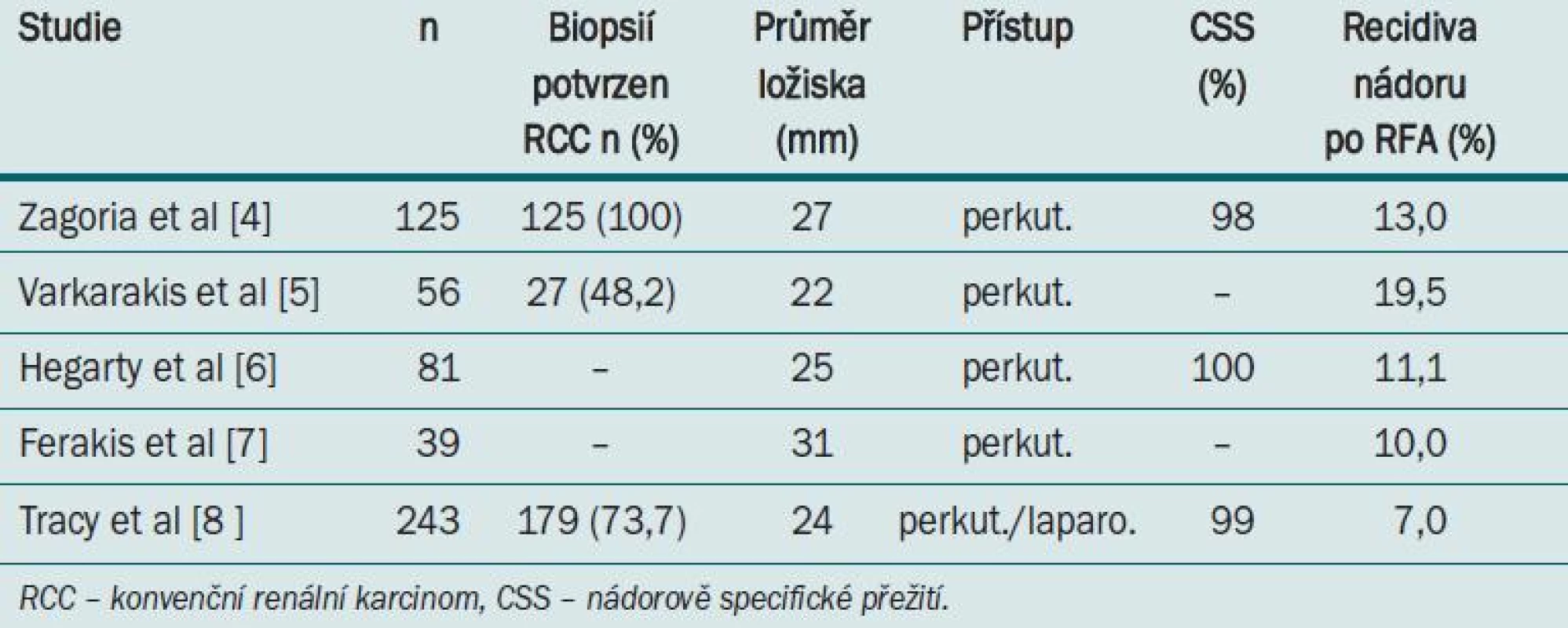
Kritéria pro výběr vhodného pacienta pro RFA
Skupina vhodná pro aplikaci RFA jsou starší, vysoce rizikoví pacienti s tumorem pod 3 cm. Větší nádory vykazují nízkou úspěšnost léčby pomocí RFA. Gervais et al provedli ošetření 100 nádorů u 85 pacientů RFA zavedenou perkutánním přístupem a prokázali, že malé tumory (3 cm) a exofyticky rostoucí tumory byly kompletně koagulovány. Všechny malé (< 3 cm), ale pouze 25 % velkých (> 5 cm) byly úspěšné léčeny pomocí RFA [9].
RFA má podle analýz malý vliv na zhoršení renální funkce. Průměrná glomerulární filtrace (GFR) před provedením RFA a po jejím provedení byla zkoumána v retrospektivním hodnocení 63 pacientů s kortikálními SRM. Předoperační a pooperační výsledky byly 76,3, resp. 74,3 ml/min na 1,73 m2 [22]. Johnson et al provedli multiinstitucionální analýzu aplikací RFA a prokázali, že metoda RFA při léčbě malých tumorů je zatížena nízkou četností komplikací [10]. Komplikace se vyskytly v 8,3 % případů (6,1 % lehké, 2,2 % závažné). Nejčastější komplikací (3 %) byla bolest nebo parestezie v místě zavedení jehly.
Biopsie
Pro sledování úspěšnosti léčby některá centra nyní doporučují provádění postablační biopsie k potvrzení destrukce nádorové tkáně. Metoda biopsie je preferována před prováděním sledování radiologickými zobrazovacími metodami [11]. Současné zobrazovací metody mají velké limitace a doporučují se pouze při dlouhodobém sledování. V případě podezření na nekompletní destrukci nádoru při RFA se doporučuje rutinně provádět kontrolní biopsii. Stejně tak při podezření z lokální recidivy na RTG obrazu by mělo být potvrzeno odběrem biopsie [12].
Stejně jako u kryoablace, ani pro RFA neexistují standardizovaná radiologická kritéria pro hodnocení úspěšné ablace. Obecně se vymizení „contrast-enhancement“ po podání kontrastní látky při CT či MR zobrazení považuje za úspěšné ošetření.
Biopsie po léčbě se obvykle neprovádí. Tři studie hodnotily výsledky termických ablací RFA provedením chirurgické excize tumoru nebo celou nefrektomií [13–15]. Tyto práce jsou zajímavé, velmi přínosné, ale na druhou stranu z etického hlediska přinejmenším sporné [16]. Podle dalších prací po perkutánně provedené RFA byla v jedné době nebo s krátkým časovým odstupem provedena operační revize a resekce nádoru. Tumor byl vyšetřen patologem na klasické barvení hematoxylin-eoxin (HE) a event. též barvení na NADH diaforázu. U velké části tumorů byla prokázána ložiska vitální nádorové tkáně. Autoři uzavírají, že metoda nevede ke kompletní destrukci, a zůstává tak výzkumnou metodou léčby [17–19]. Podle studií je barvení na NADH diaforázu výtěžnější oproti barvení HE. Navíc HE v některých případech vykazuje falešně pozitivní výsledky.
V největší a poslední studii bylo laparoskopicky odstraněno 17 tumorů o průměru 2,2 cm. Reziduální vitální nádorová tkáň byla detekována ve čtyřech případech (23 %). Dalším problémem v hodnocení výsledků RFA je nález tzv. „skipping“ tumorů [15,20]. Tyto nálezy „skip“ oblastí jsou okrsky vitální nádorové tkáně a byly popsány ve většině studií hodnotících onkologické výsledky. Znamená to, že v případě detekce ložisek inkompletní nádorové nekrózy jsou výsledky RFA významně nižší něž udávaných 90–95 %. Některé práce však sdělují, že hodnocení „skipping“ tumorů není přesné, protože byly použity různé metodiky. Barvení na NADH diaforázu je přesnější oproti barvení HE. Dalším argumentem je, že barvení bylo provedeno u odebrané tkáně ihned po provedení RFA, zatímco koagulační nekróza po termoablačních metodách se vyvíjí ještě 48–72 hod po výkonu.
Komplikace
Jednou z potenciálních komplikací RFA je tepelné poškození okolní zdravé tkáně. Při LRFA i PRFA byly zaznamenány ojediněle případy poškození močovodu.
Pravděpodobně nejzávažnější komplikací je tepelné poranění střeva. Někteří autoři doporučují oddělit struktury citlivé na aplikaci tepla pomocí paranefrické infuze elektricky inertní tekutiny (5% roztok glukózy, glycin). Dále může dojít k podráždění lumbálního plexu nebo genitofemorálního nervu. Bolestivost a znecitlivění kůže v oblasti třísla může přetrvat i několik měsíců.
Onkologické výsledky
Průměrná délka sledování pacientů po RFA obvykle nepřesahuje 2–3 roky. To prozatím neumožňuje vyvodit definitivní závěry s ohledem na onkologickou účinnost teto léčebné modality, ani srovnání RFA s nefron šetřící operací. Nejnovější publikace však uvádí výsledky RFA po minimálně 40 měsících sledování (střední doba sledováni 61 měsíců), které jsou srovnatelné s výsledky kryoablace. I když bylo nutné opakování léčby během prvního roku u 10 % pacientů, bylo dosaženo 95% míry úspěšnosti. Nutnost opakování léčby však nepředstavuje významnou nevýhodu vzhledem k tomu, že opakovanou RFA lze snadno provádět v lokální anestezii nebo analgosedaci.
V souhrnu RFA (i CA) jsou slibné alternativní techniky pro léčbu malých ložiskových lézí ledvin, ale stále chybí dlouhodobé onkologické výsledky. Chybí také standardizace přesných kritérií, která mohou definovat indikaci metody a úspěšnost léčby. V současné době u RFA zůstává rozpor mezi vymizením perfuze kontrastní látky na zobrazovacím vyšetření (CT, MR) a nálezem pozitivní biopsie. Pozitivní bioptický nález má sice výpovědní hodnotu, ale rutinní provádění postablační biopsie nejsou zatím standardně prováděny. Budou nutné další randomizované prospektivní studie porovnávající výsledky alternativních metod s klasickou chirurgickou excizí [21–23].
I.b Mikrovlnná termoterapie
První zprávy o výzkumu působení mikrovlnné energie na renální tkáň se datují do roku 1969, ale v dalším období byly pouze ojedinělé zprávy zabývající se vlivem mikrovlnného působením na ledvinnou tkáň. V roce 1995 popsali Kagebayashi et al [24] první případ klinického použití mikrovlnné terapie u RCC. Tato technika je rutinně užívána k léčbě BHP jako tzv. TUMT (Transurethral Microwave Thermotherapy). Kigure zkoumal účinnost laparoskopicky aplikované mikrovlnné termoterapie na implantovaných renálních VX-2 tumorech na modelu králíka [25].
Do tkáně se aplikují se mikrovlny 30–3 000 MHz elektromagnetického spektra. Obvykle se zavádí pod UZ kontrolou. Mikrovlnnou terapii lze aplikovat též laparoskopicky. Princip destrukce tkáně je v absorpci mikrovlnné energie a vzniklá kinetická energie se v cílové tkáni (nádor) přemění na teplo. Po destrukci je ošetřená tkáň podobně jako u kryoablace velmi křehká. Při poškození dutého systému ledviny není futura možná a hrozí riziko vzniku urinomu.
Dosavadní výsledky ukazují, že ultrazvukem navigovaná mikrovlnná termoterapie může být využita k nefron šetřící léčbě malých renálních tumorů.
I.c Intersticiální laserová ablace (LITT)
Intersticiální laserová ablace je metoda, kdy je aplikován laser s vysokou energií do nádorové léze. Metoda byla používána k léčbě BPH. Laserová energie způsobuje tepelnou nekrózu. K aplikaci laseru se používá optické vlákno. Nejčastějším způsobem navigace laseru do tumoru i monitorování laserové termokoagulace je MR. Pod MR kontrolou je nejprve zavedena do tumoru jehla, pak následuje dilatace punkčního kanálu a následně je zavedeno vlákno ND:YAG laseru, vodou chlazeným aplikačním systémem. Jedním vpichem je aplikována energie 25 W po dobu 10–30 min. Jeden vpich vytváří destrukční ložisko velikosti asi 1 cm. Podle velikosti nádoru je potřeba provádět více vpichů. Termální léze je kontrolována MR v reálném čase v několikasekundových intervalech.
I.d Fokusovaný ultrazvuk (HIFU High Intensity Focused Ultrasound)
Fokusovaný ultrazvuk vysoké intenzity vytváří teplotu 65 °C. Ultrazvuk je generován piezoelektrickými krystaly. Výhoda metodiky je, že se jedná o skutečně neinvazivní metodu, protože je aplikována extrakorporálně. Nevýhodou extrakorporální aplikace HIFU je fakt, že její efekt snižují pohyby ledviny při dechových exkurzích. Podobně jako při ESWL ultrazvukové vlny interferují s žebry zvláště u tumorů horního pólu ledviny. Výsledkem je inkompletní destrukce, kde je energie částečně absorbována kostními strukturami. V místě vstupu dochází k tepelnému poškození kůže [26].
II. Intersticiální fotonová radiační ablace (PRS)
Intersticiální fotonová radiační ablace se nejčastěji používá při operaci nádorů a metastáz v mozku. Její urologická alternativa by měla nahradit chirurgickou resekci a radiaci u tumorů ledvin. Aplikuje se 15 Gy do tumoru. Mechanizmus působení je indukukování smrti buněk v závislosti na dávce radiace a ztrátě integrity membrán následované morfologickými změnami konzistentními s buněčnou nekrózou a apoptózou. Kontrola terapeutického výsledku se provádí CT zobrazením podobně jako u ostatní oblačních metod.
III. Kryoterapie (CA, cryoabalation)
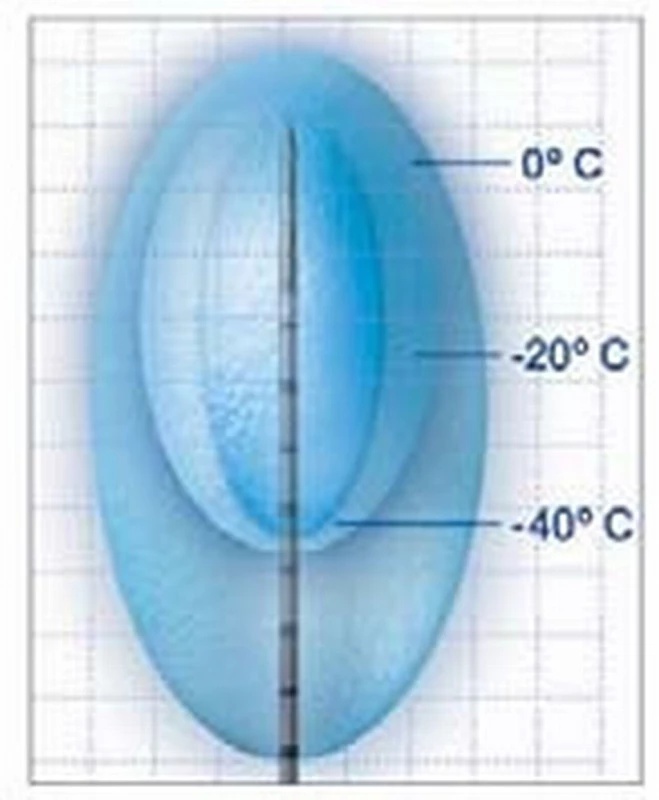
Kryoterapie způsobuje ireverzibilní poškození tkáně. Kryoablace je založena na cyklické změně rychlého zmrazení buněk nádorové tkáně a následného tání na teplotu pod –20 °C. Nejčastěji se používají tekutý Argon a tekutý dusík. Metoda funguje dvojím způsobem. Jednak bezprostředním působením a následně opožděným efektem. Okamžité poškození vzniká přímo v důsledku působení ledu na tkáň. V extracelulárním prostoru dochází ke zvyšování osmolarity a v důsledku přesunu tekutiny z intra - do extracelulárního prostoru dochází k poškození buňky. Extracelulární krystaly mohou navíc mechanicky poškozovat buněčnou membránu, a způsobovat tak vznik intracelulárních krystalů. K dalšímu poškození tkáně dochází několik hodin až dnů po kryoablaci vznikem nekrózy. V důsledku poranění endoteliálních buněk v akutní fázi s následným vznikem masivní trombózy vzniká opožděný účinek ischemického poškození nádorové tkáně a buněčné smrti [27]. Standardně se používají dva cykly zmrazení–tání, protože tato metoda dosahuje nejlepších výsledků tkáňové ablace [28]. Další opožděný mechanizmus poškození tkáně spočívá v apoptóze buněk. Antigeny uvolněné poškozenou tkání mohou senzibilizovat imunitní systém hostitele a působit imunomodulačně.
V současné době je k dispozici několik druhů kryosond, které umožňují volbu izotermické oblasti (–20 °C nebo –40 °C) podle velikosti tumoru. Při kryoablačnim protokolu se užívá zmrazení na teplotu –40 °C. Aby byla dosažena požadovaná teplota v celém ložisku, je nutné „ice-ball“ rozšířit jeden centimetr za okraj nádoru.
Nové technologie na bázi argonu však umožnily vývoj ultratenkých sond (1,47 mm) se stejnou účinností jako původní 6,8 mm. Argonové sondy rovněž umožňují zastavit růst „ice-ballu“ okamžitě po zastavení mrazicího procesu. Při použití starších sond na bázi tekutého dusíku se „ice-ball“ zvětšoval i po ukončení mrazicího cyklu, což významně omezovalo přesnost při provádění výkonu.
Technika
Nezbytným předpokladem pro interpretaci onkologického výsledku je provedení biopsie renální léze před kryoablací. Bez potvrzení tumoru pomocí histologického vyšetření je jakékoli srovnávání účinnosti MI termoablačnich metod a běžné operační ablace nemožné.
Kryoablace se zpočátku prováděla pomocí otevřeného přístupu. Nyní se kryoablace provádí více laparoskopicky (LCA). Podle současných přehledných studií se > 70 % renálních kryoablací provádí cestou otevřeného nebo laparoskopického přístupu [2]. Alternativou je perkutánní kryoablace (PCA), kterou lze provádět v celkové anestezii pod MRI navigací, nebo v analgosedaci pod CT navigací v reálném čase. Provádí se však méně často. Výhoda LCA spočívá v přesné lokalizaci tumoru a monitorováni růstu „ice-ballu“ pod přímou zrakovou kontrolou a pomocí ultrazvukové sondy (UZ). Na UZ se „ice-ball“ jeví jako hyperechogenní oblast s akustickým stínem, což umožňuje přesnou navigaci „ice-ballu“ 1 cm přes okraj tumoru, a tedy úplnou nekrózu léze. Zobrazovací vyšetření v reálném čase, které se užívá při PCA, má jistá omezení. UZ je levnější, ale na druhou stranu nabízí omezenou vizualizaci okrajů „ice-ballu“ a špatné rozlišení zvláště u obézních pacientů. Magnetická rezonance (MR) nabízí vynikající vizualizaci ložiska s jasným rozlišením. Na druhou stranu však vyžaduje celkovou anestezii a nákladný MR-kompatibilní kryosystém. Nejlepší kompromis představuje v současnosti pravděpodobně CT skiaskopie. Toto vyšetření lze provádět v analgosedaci a umožňuje kvalitní zobrazení v reálném čase zavádění sondy a rozvoj „ice-ballu“. Další potenciální nevýhodou PCA je riziko poškození kolon u ventrálně lokalizovaných tumorů. V tomto případě je možným řešením vytvoření tzv. „salinomu“ pomocí injekční aplikace fyziologického roztoku, jímž kolon mobilizujeme. Jednou z výhod PCA oproti LCA je možnost opakování výkonu v případě, že nedojde k dostatečné ablaci renální léze během prvního pokusu.
Srovnávací studie ukázaly, že perkutánní CA jsou provázeny větší četností komplikací než laparoskopické (21,1 vs 13,9 %). Komplikace u laparoskopického přístupu jsou však závažnějšího charakteru a vyžadovaly složitější léčbu [29]. PCA vykazuje nižší pooperační bolest, kratší dobu hospitalizace i rekonvalescence [30,31]. Nižší invazivita perkutánního přístupu je vykoupena vyšším procentem selhání oproti LCA (9 vs 3,1 %) [31].
Omezení z hlediska lokalizace a velikosti tumoru
Centrálně lokalizovaný tumor v blízkosti vývodného systému není kontraindikací pro CA. „Ice-ball“ zasahující až 5 mm do vývodného systému nezpůsobuje vznik urinomu, což je jednou z výhod CA oproti tepelně ablačním technikám při léčbě centrálně uložených tumorů. Za horní hranici pro bezpečnou a účinnou CA se v současnosti považuje tumor o velikosti 3 cm. Centrálně lokalizovaný tumor o velikosti ≥ 4 cm lze považovat za relativní kontraindikaci.
Monitorování po výkonu
Renální tumory reagující na léčbu pomocí MI termoablačních technik jsou obvykle spojeny s nízkým rizikem recidivy či progrese systémového onemocnění. V současné době je doporučení při běžném sledování pacientů po klasické léčbě nádoru ledviny nahradit CT scan ultrazvukovým vyšetřením. Při sledování po MI termoablačním výkonu se doporučuje CT vyšetření s kontrastní látkou, lépe MR s aplikací gadolinia. Po CA se doporučuje provádět vyšetření v krátkých intervalech. Onkologicky úspěšný výkon je definován na základě vymizení tzv. „enhancement“. V některých případech může být po jednom až třech měsících viditelný okraj „enhancement“ kolem kryoléze. Okraj postupně vymizí. Samotná léze nevymizí okamžitě po výkonu, ale postupně se zmenšuje. Teprve po 48 měsících dojde k vymizení 95 % léze.
Pro zhodnocení účinnosti CA a recidivy neexistují jednoznačná kritéria. Většina autorů jako efekt úspěchu hodnotí radiografické vymizení kontrastního sycení na CT či MR. Postablační biopsie se rutinně k důkazu efektivity neprovádí [32,33]. Weight et al sledovali na 192 pacientech korelaci mezi radiologickým nálezem a výsledkem biopsie po 6 měsících od ablace [12].
Souhrn
K ireverzibilní buněčné smrti dochází při –70 °C. K ablaci tumoru by mělo být dosaženo teploty –40 °C. Ablační protokol by měl zahrnovat dva cykly zmrazení a rozmrazení. Při kryoablaci tumoru by měl být vytvořen „ice-ball“ + 1 cm okraje tumoru.
Počet sond – jednoduchá nebo vícečetná (závisí na velikosti tumoru). Kalibr sondy 1,47 mm.
Použité médium Argon nebo tekutý N. Výhoda Argonu spočívá v možnosti okamžitého zastavení mrazicího procesu, zatímco u tekutého dusíku i po zastavení procesu dochází ještě k nárůstu „ice-ball“.
Laparoskopický přístup je vhodný pro lokalizace tumoru na předním rtu ledviny, v horním pólu ledviny a nebo mediální lokalizace v blízkosti močovodu.
Perkutánní přístup je vhodný v případě nádorů na zadním rtu ledviny, u endofytických tumorů, centrálních nebo hilárních tumorů.
IV. Ireverzibilní elektroporace (IRE)
Ireverzibilní elektroporace („studená ablace“ NanoKnife®, USA) je novinkou v boji proti rakovinovým zhoubným nádorům. Jedná se o novou technologii v oblasti miniinvazivních tkáňových ablací.
NanoKnife slouží k efektivnímu odstranění cílové měkké tkáně, aniž by poškodila okolní struktury. Při užití přístroje NanoKnife se vysílá série mikrosekundových pulzů, které způsobí buněčnou smrt zasažené tkáně, a to bez toho, aby byla vystavena tkáň extrémnímu teplu či chladu.
Během působení statické elektřiny vysokého napětí dochází v elektrickém poli k narušení buněčných membrán – vznikají nanopóry. Zvýšená permeabilita buněčných membrán pak v případě použití dostatečného počtu pulzů s potřebnou charakteristikou napětí navozuje ireverzibilní změny, které vedou k apoptóze a destrukci buněk v tumorózní tkáni. Proces se označuje jako ireverzibilní elektroporatizace. Eletroporace se aplikuje zavedenou jehlou do cílové tkáně. Vlastní zákroky jsou vedeny v celkové anestezii a pod kontrolou ultrazvuku nebo CT. Předoperační CT umožňuje přesný výpočet množství a tvaru tkáně určené k léčbě a přesné umístění elektrod NanoKnife.
Jak vyplývá z mechanizmu IRE, nedochází ke vzniku termického poškození tkání. Kolagenní struktury, které jsou základem tubulárních struktur ve tkáních, bývají poškozeny právě vysokými teplotami, které používají konvenční termoablační metody. IRE je ablační metodou, která nepoškozuje důležité struktury v blízkosti tumorózních expanzí. Metodu je tedy možné použít při léčbě nádorů v blízkosti cévních struktur (aorta, dolní dutá žíla) a rovněž nebyl u IRE zaznamenán tzv. „heat sink“ efekt. Větší cévy, v případě, že procházejí tumorem či v jeho těsné blízkosti, mohou zhoršovat efekt ostatních konvenčních termoablačních metod. Zde proudící krev v cévách snižuje teplotu v jejich bezprostředním okolí, takže v ložisku nemusí být dosaženo potřebné destrukční teploty a podél cév dochází k přežívání viabilních nádorových struktur. S časovým odstupem může dojít k recidivě tumoru. IRE nepoškozuje kolagen v důležitých tubulárních strukturách (prezervace struktur, jako jsou žlučové cesty, močovod, močová trubice, posterolaterální nervově--cévní prostaty atd.). IRE nepoškozuje kolagen v důležitých tabulárních strukturách (prezervace struktur, jako jsou žlučové cesty, močovod, močová trubice, posterolaterální nervově-cévní svazky u prostaty atd.).
Vlastní IRE procedura pěticentimetrového ložiska trvá jednu minutu. NanoKnife přitom působí buněčnou smrt pouze v cílové tkáni. Elektrody jsou umístěny v okolí vlastní léze a nepoškozují okolní důležité struktury, jako jsou nervy, krevní cévy a jiné kolagenní tkáně. Při mikroskopickém prozkoumání místa léčby lze pozorovat ostré ohraničení mezi zdravou tkání a místem působení NanoKnifu. Okamžitě po ukončení léčby je díky tomu organizmus schopný zahájit proces hojení, podobně jako při hojení hematomu. Pokud je proveden během zákroku Dopplerovský ultrazvuk, je patrné, že v místě zákroku nejsou porušeny cévy až do šíře 1 mm. Při vyšetření kontrolním CT nebo ultrazvukem 30 dnů po terapii NanoKnifem je nalezena v místě zákroku téměř výhradně zhojená tkáň [34–36].
NanoKnife se zdá být velmi perspektivní metodou v terapii solidních nádorů. Do současné chvíle jsou k dispozici pouze výsledky jeho použití na zvířatech. U člověka byly prezentovány výsledky použití pouze u několika jedinců se zanedbatelnou dobou sledování. Efekt metody na další růst nebo dokonce vymizení nádorového ložiska tedy není žádným způsobem prokázán. Rutinní použití ireverzibilní elektroporace u urologických nádorů není proto zatím podporováno doporučenými postupy Evropské urologické společnosti.
Česká urologická společnost považuje v současné době ireverzibilní elektroporaci u urologických nádorů zatím za experimentální techniku, jejíž použití je možné jen v kvalitně připravené studii schválené etickou komisí, s náležitým pojištěním a podrobným informovaným souhlasem. Její použití na českých urologických pracovištích mimo zmíněné klinické studie proto nelze považovat za postup lege artis.
ZÁVĚR
Narůstající počty detekovaných malých nádorových lézí jsou v současné době známým faktem. Stejně tak je pozorován zvyšující se trend detekce asymptomatických lézí. Signifikantní procento SRM jsou benigní nádory nebo RCC s relativně dobrou prognózou. Tato skutečnost vedla ke zvýšenému zájmu o mimiálně invazivní metody.
Standardem léčby SRM v současné době je chirurgická léčba. Nefron šetřící techniky (NSS) dosahují stejných onkologických výsledků s lepším zachování ledvinné funkce ve srovnání s klasickou radikální nefrektomií. Proto by NSS měla být provedena vždy tam, kde je to technicky možné. Laparoskopie je v rukou zkušeného chirurga alternativou otevřené operace. Roboticky asistovaná parciální nefrektomie zlepšuje technické možnosti ve srovnání s klasickou laparoskopií.
Alternativami k chirurgické léčbě malých ledvinných nádorů jsou metody, které využívají různých fyzikálních principů k destrukci nádorové tkáně. Tyto metody se aplikují laparoskopicky nebo perkutánně. Nejužívanější metodiky používané v klinické praxi jsou radiofrekvenční ablace a kryoablace. Zkouší se i fokusovaný ultrazvuk vysoké intenzity, mikrovlnná termoterapie, intersticiální fotonová iradiace nebo laserová intersticiální ablace. Tyto nové metody by současně měly být svou účinností srovnatelné s klasickou chirurgií. S postupujícím časem a zdokonalováním technik se hodnotí dlouhodobé výsledky, výhody i nevýhody a jasněji se definují důkazy, kdy a jaký postup přináší efektivitu.
Velmi potřebné (v současné době chybí) je vytvoření předoperačních algoritmů pro indikaci alternativních metod. Rovněž je potřebné vypracování pooperačních standardů a metodiky sledování po provedení ablačního výkonu. Při rozhodování o provedení ablace je nutné informovat pacienta o možnosti vyššího rizika vzniku lokální recidivy v porovnání s klasickým chirurgickým postupem. Informovaný souhlas by měl obsahovat poučení o limitacích současných zobrazovacích vyšetření pro potvrzení úspěšnosti léčby a pro dlouhodobé sledování. Pacient by měl být informován o možných komplikacích a též že v případě recidivy může být záchranná chirurgická léčba („salvage therapy“) po ablační terapii velmi obtížná pro perinefritickou fibrózu [37,38]. Větší nádory (> 3–4 cm) a nádory nepravidelného tvaru nebo infiltračně rostoucí mají po ablační terapii vyšší pravděpodobnost neúspěchu a recidivy.
V současné době neexistují data dlouhodobého sledování, která by umožnila rozhodnutí mezi jednotlivými ablačními technikami. Alternativní metody měly být vyčleněny pro přísně vybrané pacienty, vysoce rizikové pro klasickou chirurgickou léčbu, ale nevhodné pouze pro sledování. Cílem by měla být snaha o zachování ledvinné funkce a dodržení onkologické bezpečnosti. Alternativní, méně invazivní metody jsou možným řešením u vybraných skupin se záměrem snížit jejich morbiditu.
prim. MUDr. Aleš Čermák
Urologická klinika FN Brno
Jihlavská 20, 625 00 Brno
acermak@fnbrno.cz
Sources
1. Goldberg SN, Gazelle GS, Mueller PR. Thermal ablation therapy for focal malignancy: a unified approach to underlying principles, techniques, and diagnostic imaging guidance. AJR Am J Roentgenol 2000; 174(2): 323–331.
2. Kunkle DA, Uzzo RG. Cryoablation or radiofrequency ablation of the small renal mass: a meta-analysis. Cancer 2008; 113(10): 2671–2680.
3. Long L, Park S. Differences in patterns of care: reablation and nephrectomy rates after needle ablative therapy for renal masses stratified by medical specialty. J Endourol 2009; 23(3): 421–426.
4. Zagoria RJ, Traver MA, Werle DM et al. Oncologic efficacy of CT-guided percutaneous radiofrequency ablation of renal cell carcinomas. AJR Am J Roentgenol 2007; 189(2): 429–436.
5. Varkarakis IM, Allaf ME, Inagaki T et al. Percutaneous radio frequency ablation of renal masses: results at a 2-year mean followup. J Urol 2005; 174(2): 456–460.
6. Hegarty NJ, Gill IS, Desai MM et al. Probe-ablative nephron-sparing surgery: cryoablation versus radiofrequency ablation. Urology 2006; 68 (1 Suppl): 7–13.
7. Ferakis N, Bouropoulos C, Granitsas T et al. Longterm results after computed-tomography guided percutaneous radiofrequency ablation for small renal tumors. J Endourol 2010; 24(12): 1909–1913.
8. Tracy CR, Raman JD, Donnally C et al. Durable oncologic outcomes after radiofrequency ablation: experience from treating 243 small renal masses over 7.5 years. Cancer 2010; 116(13): 3135–3142.
9. Aron M, Gill IS. Minimally invasive nephron-sparing surgery (MINSS) for renal tumours. Part II: probe ablative therapy. Eur Urol 2007; 51(2): 348–357.
10. Johnson DB, Solomon SB, Su LM et al. Defining the complications of cryoablation and radiofrequency ablation of small renal tumors: a multi-institutional review. J Urol 2004; 172(3): 874–877.
11. Gill IS, Remer EM, Hasan WA et al. Renal cryoablation: outcome at 3 years. J Urol 2005; 173(6): 1903–1907.
12. Weight CJ, Kaouk JH, Hegarty NJ et al. Correlation of radiographic imaging and histopathology following cryoablation and radio frequency ablation for renal tumors. J Urol 2008; 179(4): 1277–1281.
13. Rendon RA, Kachura JR, Sweet JM et al. The uncertainty of radio frequency treatment of renal cell carcinoma: findings at immediate and delayed nephrectomy. J Urol 2002; 167(4): 1587–1592.
14. Matlaga BR, Zagoria RJ, Woodruff RD et al. Phase II trial of radio frequency ablation of renal cancer: evaluation of the kill zone. J Urol 2002; 168(6): 2401–2405.
15. Klingler HC, Marberger M, Mauermann J et al. ‘Skipping’ is still a problem with radiofrequency ablation of small renal tumours. BJU Int 2007; 99(5): 998–1001.
16. Hora M, Hes O, Klečka J. Miniinvazivní ledvinu šetřící ablační metodiky v léčbě nádorů ledvin. Urol List 2003; 1 : 26–29.
17. Michaels MJ, Rhee HK, Mourtzinos AP et al. Incomplete renal tumor destruction using radio frequency intersti-tial ablation. J Urol 2002; 168(6): 2406–2410.
18. Rendon RA, Kachura JR, Sweet JM et al. The uncertainty of radio frequency treatment of renal cell carcinoma: Findings at immediate and delayed nephrectomy. J Urol 2002; 167(4): 1587–1592.
19. Walther MM, Shawker TH, Ligutti SK et al. A phase 2 study of radio frequency interstitial tissue ablativ of localized renal tumors. J Urol 2000; 163(5): 1424–1427.
20. Volpe A, Cadeddu JA, Cestari A et al. Contemporary management of small renal masses, European Urology 2011; 60(3): 501–515.
21. Klatte T, Patard JJ, de Martino M et al. Tumor size does not predict risk of metastatic disease or prognosis of small renal cell carcinomas. J Urol 2008; 179(5): 1719–1726.
22. Barocas DA, Rohan SM, Kao J et al. Diagnosis of renal tumors on needle biopsy specimens by histological and molecular analysis. J Urol 2006; 176(5): 1957–1962.
23. O’Malley RL, Godoy G, Kanofsky JA et al. The necessity of adrenalectomy at the time of radical nephrectomy: a systematic review. J Urol 2009; 181(5): 2009–2017.
24. Kagebayashi Y, Hirao Y, Samma S et al. In situ non-ischemic enucleation of multiocular cystic renal cell carcinoma using a microwave coagulator. Int J Urol 1995; 2(5): 339–343.
25. Kigure T, Harada T, Yuri Y et al. Laparoscopic microwave thermotherapy on small renal tumors: experimental studies using implanted X - 2 tumors in rabbits. Eur Urol 1996; 30(3): 377–382.
26. Murphy DP, Gill IS. Energy-based renal tumor ablation: a review. Sem Urol Oncol 2001; 19(2): 133–140.
27. Hoffmann NE, Bischof JC. The cryobiology of cryosurgical injury. Urology 2002; 60 (2 Suppl 1): 40–49.
28. Woolley ML, Schulsinger DA, Durand DB et al. Effect of freezing parameters (freeze cycle and thaw process) on tissue destruction following renal cryoablation. J Endourol 2002; 16(7): 519–522.
29. Tsivian M, Chen VH, Kim CY et al. Complications of laparoscopic and percutaneous renal cryoablation in a single tertiary referral center. Eur Urol 2010; 58(1): 142–148.
30. Bandi G, Hedican S, Moon T et al. Comparison of postoperative pain, convalescence, and patient satisfaction after laparoscopic and percutaneous ablation of small renal masses. J Endourol 2008; 22(5): 963–967.
31. Mues AC, Okhunov Z, Haramis G et al. Comparison of percutaneous and laparoscopic renal cryoablation for small (< 3,0 cm) renal masses. J Endourol 2010; 24(7): 1097–1100.
32. Beemster P, Phoa S,Wijkstra H et al. Follow-up of renal masses after cryosurgery using computed tomography; enhancement patterns and cryolesion size. BJU Int 2008; 101(10): 1237–1242.
33. Bolte SL, Ankem MK, Moon TD et al. Magnetic resonance paging findings after laparoscopic renal cryoablation. Urology 2006; 67(3): 485–489.
34. Kolombo I. NanoKnife® (USA): chirurgie na subcelulární úrovni. Technický týdeník č. 24/2011.
35. Pech M, Janitzky A, Wendler JJ et al. “Irreversible electroporation of Renal cell carcinoma: First in Man Human Phase 1 Clinical Study”, Cardiovasc Intervent Radiol 2011; 34(1): 132–138.
36. Tracy CR, Kabbani W, Cadeddu JA. Irreversible electroporation (IRE): a novel method for renal tissue Iablation BJU Int 2011; 107(12): 1982–1987.
37. Gronka L, Poršová M, Kolombo I et al. Karcinom ledviny – současné trendy. Urol pro praxi: 9(3): 120–127.
38. Poppel H, Becker F,Cadeddu JA et al. Treatment of Localised Renal Cell Carcinoma. Eur Urol 2011; 60(4): 662–672.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2012 Issue 3
-
All articles in this issue
- Roboticky asistovaná radikální cystektomie: technika podle Mayo Clinic
- Kontinentní a inkontinentní derivace moči, měchýř šetřící postupy
- Minimálně invazivní, ablační techniky při léčbě malých renálních tumorů
- Současný pohled na léčbu malých nádorů ledvin
- Hodnota léčby, riziko a zodpovědnost v urologické praxi
- Lokalizované nádory ledvin, epidemiologie, etiologie, chirurgická léčba, operační postupy a jejich indikace, role lymfadenektomie
- Kompletní duplikace měchýře a uretry jako organická příčina dysfunkce dolních močových cest
- Raritní komplikace zavedení double J stentu – migrace do pravé síně srdeční
- EAU Guidelines pro laserové technologie
- Opakovaná hospitalizace a míra výskytu komplikací u pacientů po PCNL v závislosti na komorbidních faktorech
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Raritní komplikace zavedení double J stentu – migrace do pravé síně srdeční
- Kontinentní a inkontinentní derivace moči, měchýř šetřící postupy
- Současný pohled na léčbu malých nádorů ledvin
- Roboticky asistovaná radikální cystektomie: technika podle Mayo Clinic


