-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Regionální chlazení mimotělního okruhu – nová možnost antikoagulačního zajištění metod kontinuální náhrady funkce ledvin*
Regional cooling of blood in the extracorporeal circuit: New way of anticoagulation during CRRT
Objective:
To test the hypothesis that cooling of blood in the extracorporeal circuit of continuous veno-venous hemofiltration (CVVH) enables to realize the procedure without the need of anticoagulation.Design:
Experimental animal study.Methods:
We developed the device for selective cooling of extracorporeal circuit (20 °C) allowing blood rewarming (38 °C) just before returning into the body. 12 anesthetized and ventilated pigs were randomized to receive either 6 hrs of CVVH with application of this device (COOL; n = 6) or without it (CONTR; n = 6). Before the procedure and in 15., 60., 180., 360. minute after starting hemofiltration variables related to: 1) circuit patency (time to clotting [TC], number of alarm-triggered pump stopping [AS], venous and transmembranous circuit pressures [VP, TMP]); 2) coagulation status in the extracorporeal circuit (thrombin-antithrombin complexes [TATcirc], thromboelastography [TEG]) and 3) animal status (hemodynamics, hemolysis, biochemistry) were assessed.Results:
The patency of all circuits treated with selective cooling was well maintained within the observation period. By contrast, 5 of 6 sessions were prematurely clotted in the untreated group. As a result, the number of AS was significantly higher in the CONTR group. In-circuit thrombus generation in CONTR group was associated with a markedly increasing TATcirc. TEG performed at 180.minute of the procedure revealed a tendency to a prolonged initial clotting time and a significant decrease in clotting rate of in-circuit blood in the COOL group. No signs of repeated cooling/rewarming-induced hemolysis were observed in animals treated with “hypothermic circuit” CVVH.Conclusion:
In this porcine model, regional extracorporeal blood cooling proved effective in preventing in-circuit clotting without the need to use any other anticoagulant.Keywords:
renal replacement therapy, anticoagulation, hypothermia, hemofiltration, cooling, critically ill
Autoři: Kroužecký Aleš 1; Sýkora Roman 1; Chvojka Jiří 1; Karvunidis Thomas 1; Raděj Jaroslav 1; Novák Ivan 1; Růžička Jiří 2; Beneš Jiří 2; Petránková Zuzana 2; Bolek Lukáš 2; Matějovič Martin 1
Působiště autorů: JIP, I. interní klinika, Fakultní nemocnice Plzeň a Univerzita Karlova, Lékařská fakulta v Plzni 1; Ústav biofyziky, Univerzita Karlova, Lékařská fakulta v Plzni 2
Vyšlo v časopise: Anest. intenziv. Med., 20, 2009, č. 3, s. 143-148
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl studie:
Testovat hypotézu, že ochlazení krve v mimotělním okruhu (EC) kontinuální veno-venózní hemofiltrace (CVVH) umožní realizovat proceduru bez potřeby použití antikoagulancií.Typ studie:
Experimentální studie.Materiál a metoda:
Vyvinuli jsme zařízení umožňující jak selektivní ochlazení krve v mimotělním okruhu CVVH na 20 °C, tak její znovuohřátí těsně před návratem do těla na 38 °C. Dvanáct anestezovaných a ventilovaných selat bylo randomizováno tak, že 6 z nich podstoupilo 6hodinovou CVVH s aplikací tohoto chladicího zařízení a 6 podstoupilo CVVH bez jeho aplikace. Během procedury a v 15., 60., 180. a 360. minutě po jejím zahájení jsme sledovali proměnné vztahující se k: 1. průchodnosti mimotělního okruhu (čas do vysrážení krve v EC, počet zastavení krevní pumpy způsobených vysokým tlakem v EC, venózní a transmembránový tlak v EC); 2. aktivaci koagulace v EC (komplexy trombin-antitrombin, tromboelastografie) a 3. stavu zvířat (teplota, hemodynamika, hemolýza, biochemie).Výsledky:
Během všech procedur, které byly realizovány s aplikací chladicího zařízení, byla zachována výborná průchodnost mimotělního okruhu. Naopak v kontrolní skupině došlo k předčasnému vysrážení u 5 z 6 procedur. Počet zastavení krevní pumpy způsobených vysokým tlakem v EC byl signifikantně vyšší v kontrolní skupině. Progresivní tvorba krevních sraženin v EC kontrolní skupiny byla provázena signifikantně vyšším nárůstem koncentrace komplexů trombin-antitrombin v krvi získané z EC. Tromboelastografická vyšetření krve z okruhu prokázala, že chlazení krve vedlo k odložení zahájení tvorby trombu a signifikantnímu snížení rychlosti jeho nárůstu. Neprokázali jsme žádné známky hemolýzy způsobené opakovanými cykly ochlazení/ohřátí, stav všech zvířat byl během pokusu stabilní.Závěr:
Námi vyvinuté zařízení pro selektivní ochlazení krve v mimotělním okruhu CVVH účinně bránilo vysrážení krve, a tak umožnilo realizovat experimentální procedury bez použití antikoagulancií.Klíčová slova:
náhrada funkce ledvin – antikoagulace – hypotermie – hemofiltrace – chlazení – kriticky nemocnýÚvod
Kontakt krve se syntetickými materiály mimotělního oběhu kontinuálních metod náhrady funkce ledvin (CRRT) vede k aktivaci koagulace [1]. Použití CRRT u kriticky nemocných je proto obvykle spojené s nutností aplikace antikoagulancií. Nejobvyklejším způsobem, jak ošetřit krev proti srážení, je aplikace antikoagulancií nemocnému systémově. Nicméně u některých kriticky nemocných plnou systémovou antikoagulaci použít nelze. U těchto pacientů pak často volíme metody alternativní – regionální antikoagulaci, minimální heparinizaci, prostaglandiny či proplachy okruhu v pravidelných intervalech [2, 3]. Bohužel, žádná z těchto metod není optimální – buď je drahá, nebo je nedostatečně účinná či přináší metabolická rizika [2].
Je známo, že snížení teploty krve vede k snížení její srážlivosti [4, 5]. Tento efekt je hlavně důsledkem inhibice enzymatických reakcí koagulační kaskády a narušení funkce krevních destiček [6, 7]. Je tím výraznější, čím je snížení teploty krve intenzivnější [5]. Na druhou stranu se zdá, že opětovné znovuohřátí krve vede k úpravě koagulačního defektu [8]. Nabízí se tedy hypotéza, že pokud by se podařilo v mimotělním okruhu dosáhnout dostatečného snížení teploty krve s tím, že by před návratem do těla nemocného byla znovu adekvátně ohřáta, nebylo by třeba podávat antikoagulaci žádnou.
Cílem naší studie proto bylo zjistit, zda ochlazení krve v mimotělním okruhu CRRT na 20 °C s jejím následným ohřátím na původní teplotu před návratem do těla zvířete umožní realizovat mimotělní proceduru bez použití antikoagulancia.
Studie byla provedena po schválení univerzitní komisí pro práci s laboratorními zvířaty.
Materiál a metody
Zvířata a jejich příprava
Během studie bylo použito 12 selat o srovnatelné tělesné hmotnosti (37 kg [33;43]).
Úvod do anestezie byl navozen i. v. podáním atropinu (0,5 mg), 2% propofolu (1–2 mg . kg-1) a ketaminu (2 mg . kg-1). Následně byla zvířata intubována a napojena na umělou plicní ventilaci (FiO2 0,4; PEEP 5 cm H2O; dechový objem 10 ml . kg-1; úprava frekvence s cílem dosáhnout PCO2 ve vydechované směsi 4,0–5,0 kPa). Během instrumentace byla udržována chirurgická anestezie kontinuálním i. v. podáváním thiopentalu (10 mg . kg-1 . h-1) a opakovanými bolusy buprenorfinu (0,3 mg). Následně byla dávka thiopentalu snížena a v dávce 5 mg . kg-1 . h-1 udržována do konce pokusu; každé 3 hodiny byl podán bolus buprenorfinu (0,3 mg) k prevenci inadekvátní analgezie. Svalová relaxace byla navozena kontinuálním podáváním pancuronia (0,2 mg . kg-1 . h-1). Během instrumentace byla podávána infuze krystaloidu (Plasma Lyte) rychlostí 10 ml . kg-1 . h-1, po jejím ukončení byla její rychlost snížena na 5 ml . kg-1 . h-1 a podávána až do konce pokusu.
Během operace byl zvířatům do pravé femorální žíly zaveden 14 Fr dvouluminální dialyzační katétr o délce 15 cm. Do levé femorální tepny byl zaveden fibrooptický arteriální katétr s termistorem, který umožnil náběry krve, kontinuální registraci teploty zvířete a měření srdečního výdeje metodou diluce dvou indikátorů (COLD, Pulsion). Pod USG kontrolou byl zaveden epicystostomický katétr k derivaci moči.
Nastavení přístroje pro kontinuální náhradu funkce ledvin (CRRT)
Procedury byly realizovány v módu kontinuální hemofiltrace (CVVH, MultiFiltrate, Fresenius Medical Care AG & Co. KGaA, Bad Homburg, SRN) s použitím polysulfonové membrány (Ultraflux AV600S, Fresenius Medical Care AG & Co. KGaA, Bad Homburg, SRN). Krevní průtok byl nastaven na 150 ml . min-1. Ultrafiltrace byla nastavena na 20 ml . kg-1 . h-1, přičemž k substituci byl použit laktátem pufrovaný roztok (Medisol K4, Medites Pharma, Rožnov pod Radhoštěm) aplikovaný za membránu (tzv. postdiluce) s tím, že byla nastavena vyrovnaná tekutinová bilance.
Chladicí zařízení
Zařízení obsahuje chladicí jednotku umístěnou před přístrojem CRRT a druhou ohřívací jednotku umístěnou za ním. První výměník tepla je napojený na přívod chladicího média, zatímco druhý je napojený na přívod ohřívacího média. Požadované teploty na obou výměnících lze nastavit v širokém rozsahu, v případě našeho projektu bylo cílem při vstupu do mimotělního okruhu krev ochladit na 20 °C a k návratu do těla znovu ohřát na fyziologickou teplotu tělesného jádra zvířete (okolo 38 °C). Systém je vybaven několika teplotními čidly, která provádějí kontrolu dosažení nastavených teplot. Data z těchto čidel jsou trvale přenášena do počítačem ovládané řídicí jednotky, která zpětnou vazbou automaticky upravuje proces chlazení a ohřívání jednak změnou teploty chladicího/ohřívacího média, jednak změnou průtoku tohoto média ve výměníku tepla. Zařízení bylo patentováno (pantentový spis č. 300266), jeho schéma je vyobrazeno na obrázku 1.
Obr. 1. Technické schéma chladicího zařízení D = přístroj CRRT (v CVVH módu); V1 = chladicí jednotka; V2 = ohřívací jednotka; P1 = jednotka pro chlazení chladicího média; P2 = jednotka pro ohřev ohřívacího média; C = pumpa; T1–T5 = teplotní snímače; R = počítačová řídicí jednotka; S = místo odběru vzorků pro analýzy TEG a TAT<sub>circ</sub> 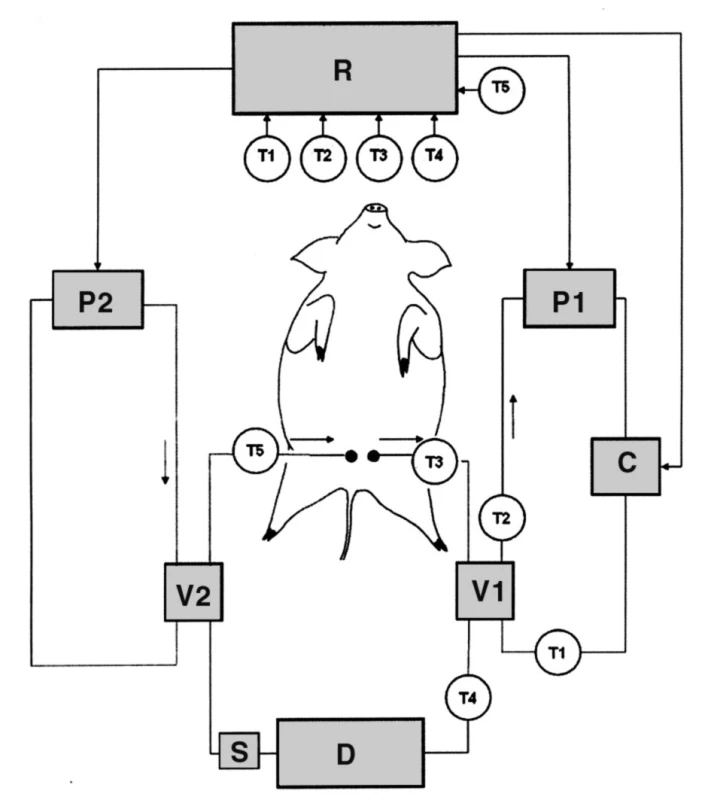
Protokol a sledované parametry
U všech zvířat bylo plánováno napojení na CVVH po dobu 6 hodin, přičemž 6 selat absolvovalo proceduru s aplikací chladicího zařízení (COOL), 6 selat sloužilo jako kontrolní skupina (CONTR) a bylo napojeno bez aplikace přístroje. Před zahájením CVVH a pak v 15., 60., 180. a 360. minutě procedury byly sledovány parametry vztahující se k průchodnosti mimotělního okruhu (čas do vysrážení krve v EC, počet zastavení krevní pumpy způsobených vysokým tlakem v EC, venózní a transmembranózní tlaky v EC). Navíc jsme sledovali: úroveň aktivace koagulace v EC (komplexy trombin-antitrombin, tromboelastografie) a stav zvířat (tělesná teplota, hemodynamika, hemolýza, vybrané biochemické parametry).
Statistická analýza
Data jsou prezentována v mediánech a interkvartilech. Rozdíly ve skupině byly analyzovány za pomoci testu ANOVA s opakovanými měřeními. Rozdíly mezi skupinami byly testovány za pomoci Mannova - -Whitneyova U-testu.
Výsledky
Obě skupiny zvířat se před napojením na CVVH nelišily v žádné ze sledovaných proměnných.
Průchodnost mimotělního okruhu
Během žádné procedury, realizované s použitím chladicího zařízení, nedošlo k předčasnému vysrážení krve v mimotělním okruhu. Tyto procedury byly ukončeny v plánovaném čase, tj. po 6 hodinách, přičemž patence takto ošetřených EC byla až do konce sledované periody výborná. Na druhou stranu se 5 ze 6 procedur v kontrolní skupině nepodařilo v plánovaném čase dokončit, protože došlo k úplnému vysrážení krve v EC. Medián trvání procedur v kontrolní skupině byl proto pouze 197 minut (180;240 min).
Jak ukazuje tabulka 1, tak progresivně probíhající obstrukce EC v kontrolní skupině byla manifestována rychle narůstajícím tlakem ve venózní části okruhu a tlakem transmembránovým. V důsledku tohoto rychlého zvyšování tlaků byl v této skupině též signifikantně vyšší počet zastavení krevní pumpy (CONTR 6 (5;7) vs COOL 1,5 (0;2), p = 0,015). Podobný nárůst tlaků nebyl ve skupině selat napojené na CVVH s chlazeným EC pozorován.
Tab. 1. Tlaky v mimotělním okruhu a hladiny komplexů trombin-antitrombinu v EC okruhu 
ap < 0,05 vs COOL; bp < 0,05 vs 15 VP = venózní tlak; TMP = transmembranózní tlak; TATcirc = komplexy trombin-antitrombin Aktivace koagulace v mimotělním okruhu
Rozvíjející se obstrukce mimotělního okruhu u kontrolní skupiny byla provázena progresivním nárůstem v koncentraci komplexů trombin-antitrombin (TATcirc) v EC okruhu, dokazujícím probíhající tvorbu trombinu. Tento nárůst TATcircbyl ve skupině napojené na CVVH se selektivním chlazením mnohem méně výrazný. Co se týká dynamiky tvorby trombu v EC okruhu, data získaná z tromboelastografie (TEG) ve 180. minutě procedury prokázala, že v chlazeném EC okruhu dochází k prodloužení periody do zahájení tvorby trombu (R) a signifikantnímu snížení rychlosti jeho nárůstu (K, α úhel) – tabulka 2. Pevnost krevní sraženiny však chlazením ovlivněna není (MA). Reprezentativní TEG křivky z obou skupin jsou ukázány na obrázku 2.
Tab. 2. Tromboelastografie krve z EC okruhu 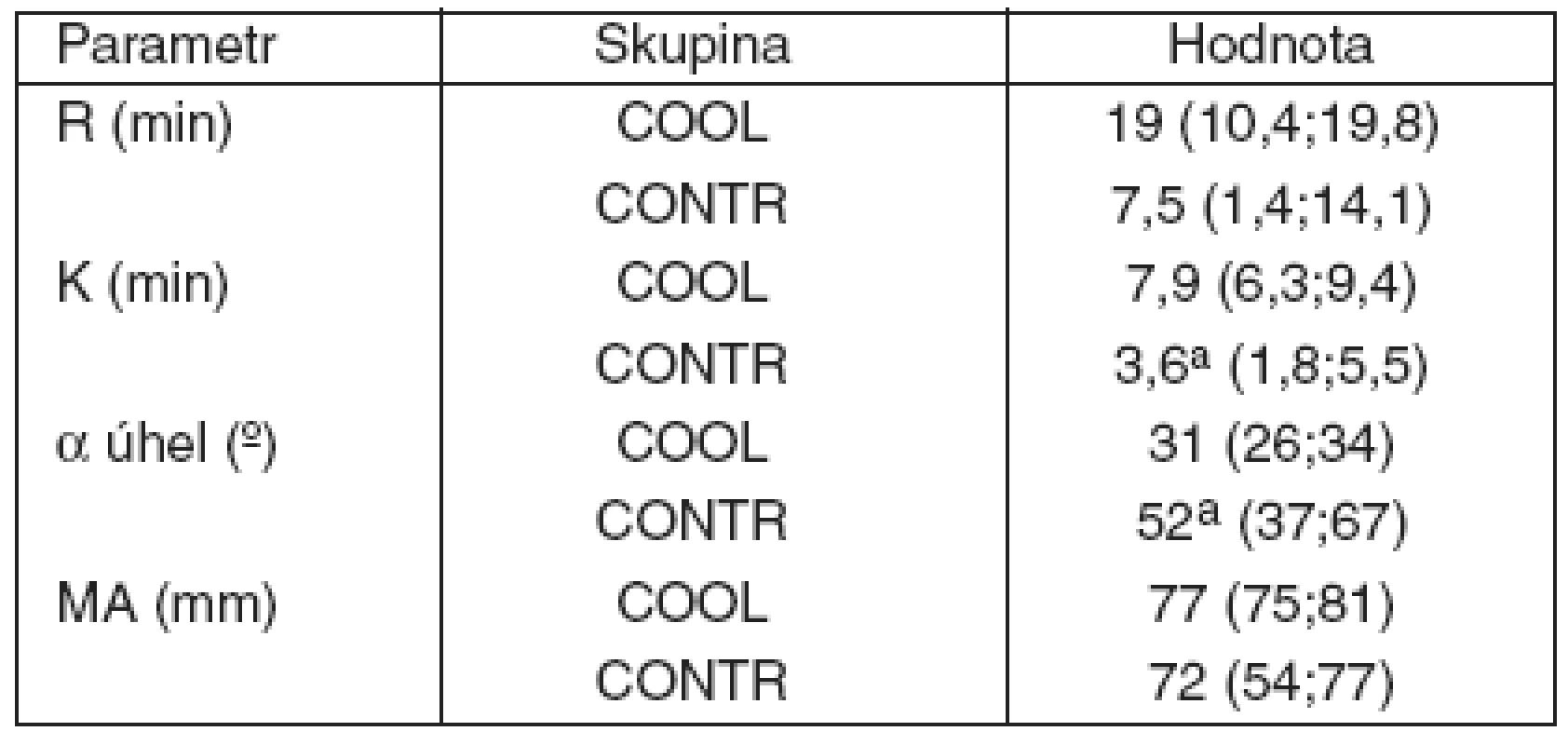
ap < 0.05 vs COOL. R = čas od zahájení testu do zahájení tvorby krevní sraženiny; K = čas reprezentující dynamiku tvorby trombu; a úhel = reprezentuje kinetiku výstavby fibrinu; MA = reprezentuje stabilitu utvořené krevní sraženiny Obr. 2. Typické křivky TEG (a) Chlazený mimotělní okruh (b) Nechlazený mimotělní okruh 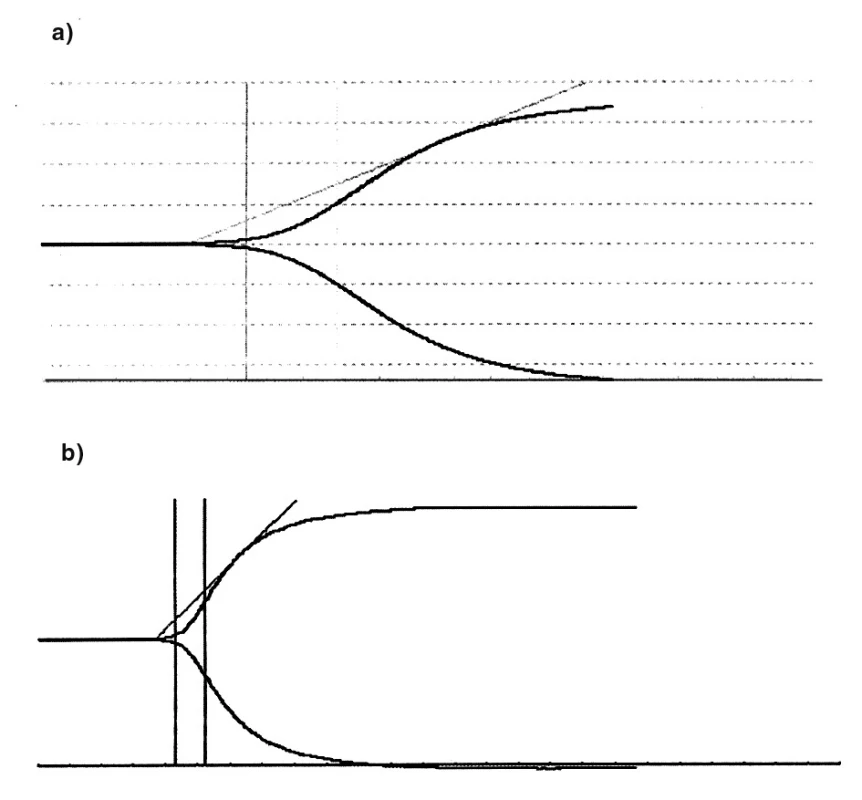
Stav zvířat a další biochemická vyšetření
V obou sledovaných skupinách byla během celého experimentu zvířata hemodynamicky zcela stabilní. Stejně tak zůstala beze změn teplota jejich tělesného jádra. U obou skupin došlo v průběh procedury k signifikantnímu poklesu krevních destiček, přičemž rozdíl mezi jednotlivými skupinami nebyl patrný (tab. 3). Nepozorovali jsme změny v aktivitě jaterních enzymů, ani změny v acidobazické rovnováze. Tyto proměnné zůstaly po celou dobu experimentu u obou skupin ve fyziologickém rozmezí (hodnoty neuvádíme). U dvou náhodně vybraných zvířat ze skupiny napojené na CVVH se selektivním chlazením jsme opakovaně měřili hladinu volného hemoglobinu v plazmě, jehož neměnící se hodnota vyloučila probíhající hemolýzu navozenou opakovanými cykly ochlazení/ohřátí krve (obr. 3).
Tab. 3. Hemodynamika, teplota tělesného jádra a počet krevních destiček 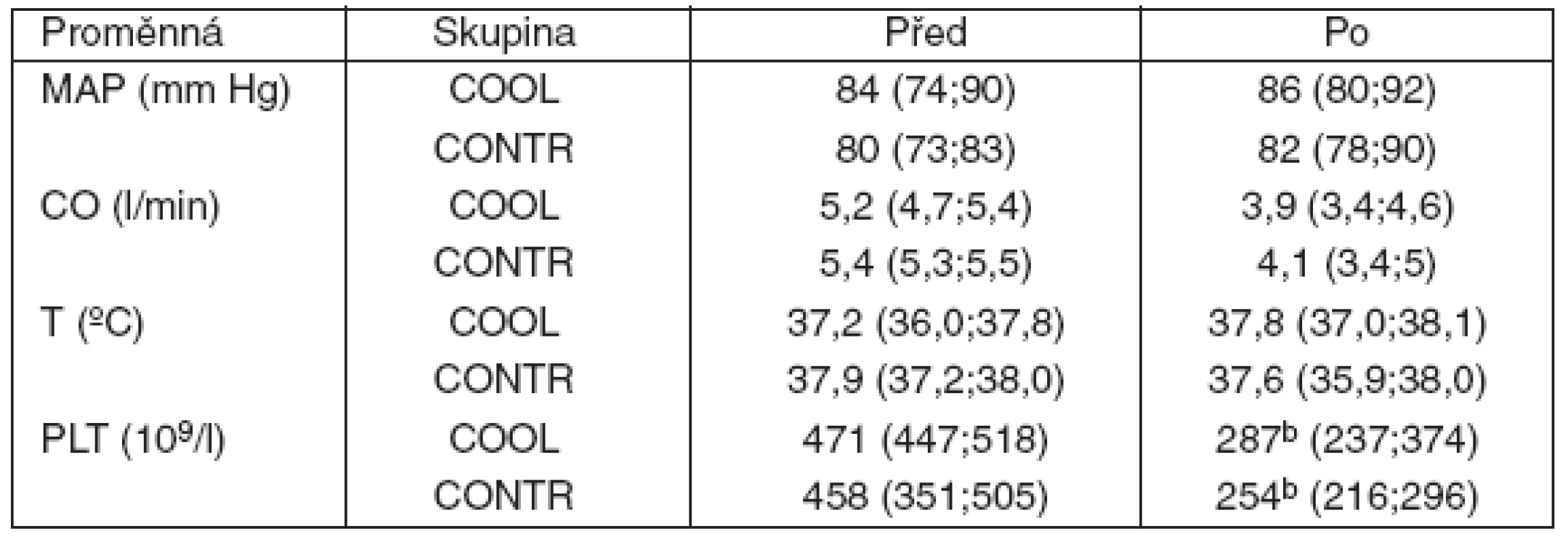
bp < 0,05 vs Před MAP = střední arteriální tlak; CO = srdeční výdej; T = teplota tělesného jádra; PLT = krevní destičky Obr. 3. Volný hemoglobin v arteriální plasmě 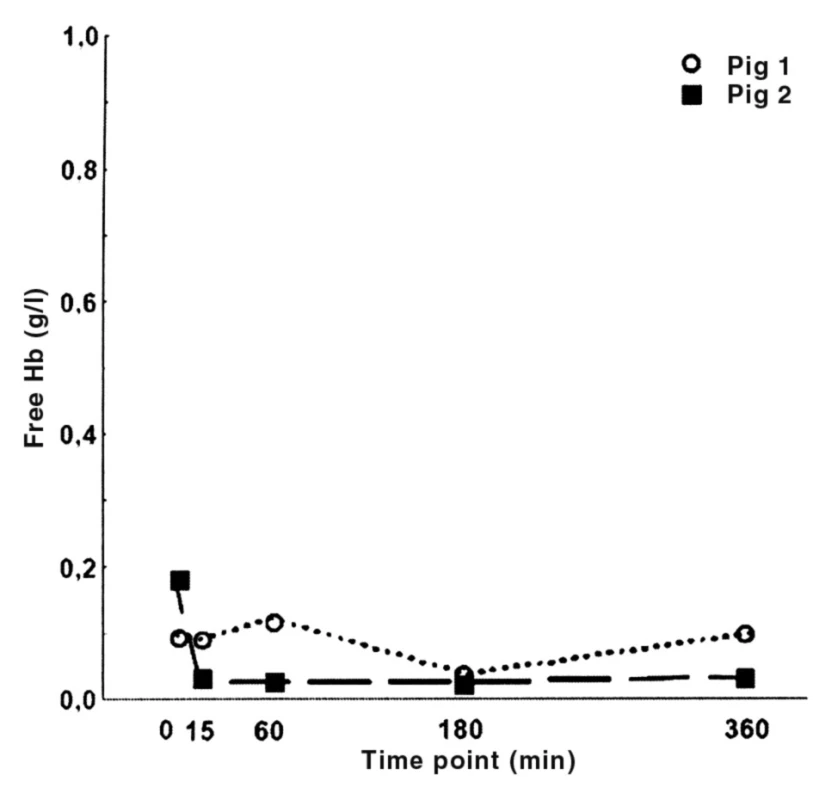
Diskuse
Hlavním výsledkem této experimentální studie je zjištění, že selektivní ochlazení krve v mimotělním okruhu CVVH na 20 °C po dobu 6 hodin umožnilo proceduru realizovat bez potřeby použití jakéhokoliv antikoagulancia, aniž by byly pozorovány známky srážení krve v EC okruhu.
Myšlenka regionálního ochlazení mimotělního okruhu u metod náhrady funkce ledvin není zcela nová. Tato metoda již byla použita v experimentálních podmínkách, kdy byla zvířata napojena na 3hodinovou intermitentní dialýzu, přičemž byla krev v EC též ochlazena na 20 °C a před návratem do těla zvířete znovu ohřáta na 37 °C v mikrovlnné troubě [9]. Nicméně tato studie byl více zaměřena na sledování parametrů biokompatibility (C5a) EC okruhu intermitentní metody, nezabývala se podrobným sledováním aktivace koagulace a ovlivnění dynamiky tvorby trombu v EC okruhu. Přesto však, stejně jako my, autoři této studie pozorovali, že je možné takto realizovat tuto relativně krátkou proceduru bez použití antikoagulancia. Námi vyvinuté zařízení se však významně liší v několika parametrech. Za prvé, jedná se o zařízení uzpůsobené pro potřeby kontinuální metody, tedy metody, která využívá nižšího průtoku krve než metody intermitentní, což může vést k vyšší tendenci aktivovat krevní srážení. Za druhé, technika znovuohřevu krve před návratem do těla je zcela jiná (nevyužívá mikrovlnou troubu, což shledáváme biologicky bezpečnějším). Za třetí, použití inkorporovaných teplotních čidel do EC okruhu i okruhu vlastního chladicího zařízení se zpětnovazebným řízením procesu chlazení/ohřev vylučovalo neadekvátní průběh procesu (a především nežádoucí změny v teplotě organismu).
Vysvětlení, proč ochlazení EC okruhu pomáhá udržet jeho průchodnost bez známek rozvoje tvorby trombu, můžeme najít v datech popisujících tvorbu trombinu a dynamiku tvorby krevní sraženiny. Tyto parametry ukázaly, že ochlazení krve vede jak ke zpomalení iniciační fáze tvorby trombinu, tak ke zpomalení celého procesu srážení. Výsledkem je pak jednak oddálení zahájení tvorby krevní sraženiny, tak její následný pomalejší nárůst. Tyto výsledky jsou v souladu s výsledky jiných studií, které se zabývaly sledováním hypotermní koagulopatie [10, 11, 12]. Je však třeba vzít v úvahu, že se na ovlivnění krevní srážlivosti nemusí podílet pouze změny v aktivitě koagulačních faktorů, ale též snížení počtu destiček a především hypotermií navozená porucha jejich funkce. My jsme během procedury pozorovali pokles v počtu krevních destiček jak u skupiny zvířat napojených na CVVH s chlazením, tak i v kontrolní skupině napojené na CVVH bez chlazení EC okruhu. Nicméně pokles počtu trombocytů, ačkoliv byl statisticky signifikantní, byl stále v rámci fyziologického rozmezí, takže by tímto mechanismem nemělo dojít k ovlivnění tvorby trombu a jeho síly. Přestože jsme se v naší studii sledováním ochlazením navozené poruchy funkce destiček nezabývali, tak na podkladě výsledků jiných studií předpokládáme, že se tato na námi sledované inhibici tvorby trombu mohla podílet [6, 13].
Zásadní skutečností, která musí být dále řešena, je otázka, zda nemůže mít proces mnohonásobně opakovaného ochlazení a následného ohřátí krve nežádoucí účinky. Je třeba zdůraznit, že naše studie byla zaměřena především na otázku funkčnosti metody. Vlastní ověření bezpečnostních parametrů bude v budoucnu vyžadovat komplexní analýzu jak na úrovni buněčných krevních elementů, tak na úrovni nebuněčných složek krve (proteiny, enzymy, imunitní systém atd.). Nicméně z dat získaných v rámci této studie můžeme v tomto okamžiku vyloučit indukci signifikantního rozpadu červených krvinek, protože nedocházelo ke změně plazmatické koncentrace volného hemoglobinu. Bylo by sice možné namítnout, že měření volného hemoglobinu proběhlo pouze u dvou zvířat ze skupiny léčené CVVH s chlazeným okruhem, nicméně se vzhledem ke konzistenci těchto dat nedomníváme, že by jejich další rozšiřování přineslo odlišné výsledky. Navíc u žádného ze zvířat z obou skupin nedošlo ke změně v hladině bilirubinu, laktátdehydrogenázy či počtu erytrocytů, což činí možnost signifikantní hemolýzy nepravděpodobnou.
Dat, která by popisovala změny ve vlastnostech krve, jež byla ochlazena a následně ohřáta, není k dispozici dostatek. Je známo, že ohřátí ochlazené krve vede k úpravě koagulační poruchy [14], a proto je znovuohřátí podchlazeného nemocného rutinním a mandatorním léčebným opatřením [15]. Podobně došlo k úpravě agregability destiček po znovuohřátí po protrahované hypotermii v experimentálním modelu [16]. Nicméně žádná z těchto situací neodpovídá průběhu našeho experimentu, kde k procesu ochlazení/ohřátí docházelo mnohokrát po řadu hodin.
Naše studie má několik limitací. Ačkoliv jsem testovali zařízení pro CVVH, tak toto nebylo použito po dobu delší než 6 hodin. Nicméně, když byla procedura ukončena a EC okruh propláchnut fyziologickým roztokem, zaznamenali jsme v chlazeném okruhu jen minimální přítomnost trombů – medián úrovně vysrážení byl 2 (byla použita škála od 1 do 5, kde 5 znamenalo úplné vysrážení a 1 zcela čistý okruh bez krevních sraženin). Předpokládáme proto, že by bylo možné v této proceduře pokračovat po řadu dalších hodin. Je třeba vzít také v úvahu, že přestože jsou selata využívána jako vhodný model pro studování koagulačních pochodů pro jejich významnou podobnost srážecích mechanismů, nelze vyloučit, že určité rozdíly mohou existovat. Navíc byla naše studie provedena na zdravých zvířatech, ale řada kriticky nemocných indikovaných k léčbě CVVH má více či méně alterovanou hemostázu. Při současném stavu znalostí proto nemůžeme experimentální data získaná v naší studii jednoduše plně extrapolovat do klinické rutiny. Výběr cílové teploty, na kterou byla krev ochlazena, byl víceméně empirický. Cílem bylo snížit teplotu krve na dostatečnou úroveň, která alespoň podle zkušenosti jiných autorů vedla k významnému snížení krevní srážlivosti [9, 13]. Podle našich výsledků se zdá, že snížení teploty krve na 20 ºC je dostatečné k dosažení žádaného efektu, ale nejsme schopni posoudit, zda by podobného efektu nebylo možné dosáhnout i s teplotou vyšší (což by zřejmě kladlo menší nároky na technickou náročnost chladicího zařízení).
Souhrnem lze tedy konstatovat, že se selektivní ochlazení krve jeví jako fungující alternativa antikoagulačního zajištění před srážením krve v mimotělním okruhu přístroje kontinuální náhradu funkce ledvin. Nezbytným krokem je však v následujících studiích prokázat, že je tato metoda pro organismus bezpečná. Pokud se tak stane, jistě by se implementace chladicího zařízení do přístrojů pro náhradu funkce ledvin stala zajímavou technickou a hlavně klinickou výzvou.
*Tento článek vychází ze studie, jejíž výsledky byly autory poprvé publikovány v časopisu Intensive Care Medicine 2009; 35(2):364-70.
Poděkování: Autoři děkují L. Trefilovi, L. Vítovi a L. Reifové za jejich technickou pomoc.
Práce byla podpořena výzkumným záměrem MSM 0021620819 Náhrada a podpora funkce některých životně důležitých orgánů.
Došlo 18. 2. 2009.
Přijato 20. 3. 2009.
Adresa pro korespondenci:
Doc. MUDr. Martin Matějovič, Ph.D.
JIP, I. interní klinika FN
Alej Svobody 80
304 Plzeň-Lochotín
e-mail: matejovic@fnplzen.cz
Zdroje
1. Joannidis, M., Oudemans-van Straaten, H. M. Clinical review: Patency of the circuit in continuous renal replacement therapy. Crit. Care, 2007, 11, p. 218–227.
2. Oudemans-van Straaten, H. M., Wester, J. P., de Pont, A. C. et al. Anticoagulation strategies in continuous renal replacement therapy: can the choice be evidence based? Intensive Care Med., 2006, 32, p. 188–202.
3. Tan, H. K., Baldwin, I., Bellomo, R. Continuous veno-venous hemofiltration without anticoagulation in high-risk patients. Intensive Care Med., 2000, 26, p. 1652–1657.
4. Simpson, S., Rasmussen, A. T. The effect of temperature on blood coagulation time. Q. J. Exp. Physiol., 1916, 10, p. 159–168.
5. Rohrer, M. J., Natale A. M. Effect of hypothermia on the coagulation cascade. Crit. Care Med., 1992, 20, p. 1402–1405.
6. Wolberg, A. S., Meng, Z. H., Monroe, D. M. et al. A systematic evaluation of the effect of temperature on coagulation enzyme activity and platelet function. J. Trauma, 2004, 56, p. 1221–1228.
7. Watts, D. D., Trask, A., Soeken, K. et al. Hypothermic coagulopathy in trauma: effect of varying levels of hypothermia on enzyme speed, platelet function, and fibrinolytic activity. J. Trauma, 1998, 44, p. 846–854.
8. Staab, D. B., Sorensen, V. J., Fath, J. J. et al. Coagulation defects resulting from ambient temperature-induced hypothermia. J. Trauma, 1994, 36, p. 634–638.
9. Otte, K. E., Jensen, P. B., Svendsen, P. et al. Heparin-free hypothermal hemodialysis at 20 degrees C improves biocompatibility. Blood Purif., 1997, 15, p. 200–207.
10. Kettner, S. C., Sitzwohl, C., Zimpfer, M. et al. The effect of graded hypothermia (36 degrees C-32 degrees C) on hemostasis in anesthetized patients without surgical trauma. Anesth. Analg., 2003, 96, p. 772–1776.
11. Martini, W. Z. The effects of hypothermia on fibrinogen metabolism and coagulation function in swine. Metabolism, 2007, 56, p. 214–221.
12. Martini, W. Z., Pusateri, A. E., Uscilowicz, J. M. et al. Independent contributions of hypothermia and acidosis to coagulopathy in swine. J. Trauma, 2005, 58, p. 1002–1009.
13. Kermode, J. C., Zheng, Q., Milner, E. P. Marked temperature dependence of the platelet calcium signal induced by human von Willebrand factor. Blood, 1999, 94, p. 199–207.
14. Valeri, C. R., Feingold, H., Cassidy, G. et al. Hypothermia--induced reversible platelet dysfunction. Ann. Surg., 1987, 205, p. 175–181.
15. DeLoughery, T. G. Coagulation defects in trauma patients: etiology, recognition, and therapy. Crit. Care Clin., 2004, 20, p. 13–24.
16. Ao, H., Moon, J. K., Tashiro, M. et al. Delayed platelet dysfunction in prolonged induced canine hypothermia. Resuscitation, 2001, 51, p. 83–90.
17. Velik-Salchner, C., Schnürer, C., Fries, D. et al. Normal values for thrombelastography (ROTEM) and selected coagulation parameters in porcine blood. Thromb. Res., 2006, 117, p. 597–602.
18. Olsen, A. K. The pig as a model in blood and coagulation and fibrinolysis research. Scand. J. Lab. Anim. Sci., 1999, 26, p. 214.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2009 Číslo 3- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Svalová relaxace v České republice v roce 2009 – pokrok nebo přešlapování na místě?
- Kontrola glykémie v intenzivní péči – ne jestli, ale jak
- Doporučené postupy ČSARIM – Zásady bezpečného a účelného používání svalových relaxancií v anesteziologii
- Analgosedace na pracovištích typu ARO/JIP v České republice – výsledky dotazníkové studie
- Dynamické parametry preloadu při ventilaci tlakovou podporou
- Regionální chlazení mimotělního okruhu – nová možnost antikoagulačního zajištění metod kontinuální náhrady funkce ledvin*
- Katétrem způsobené infekce krevního řečiště
- Hladina glukózy v krvi a ve tkáni u kriticky nemocných pacientů – srovnání odlišných metod stanovení intersticiální hladiny glukózy
- Výuka neodkladné resuscitace na internetu
- Delirium v pooperačním období a v intenzivní medicíně
- Polarografie – významný příspěvek Jaroslava Heyrovského pro intenzivní péči
- Primář MUDr. Zdeněk Křivánek – Křivánkovy pardubické anesteziologické dny
- Zápis ze zasedání Akreditační komise oboru Anesteziologie a resuscitace
- Zápis z jednání výboru č. 1/2009
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Analgosedace na pracovištích typu ARO/JIP v České republice – výsledky dotazníkové studie
- Doporučené postupy ČSARIM – Zásady bezpečného a účelného používání svalových relaxancií v anesteziologii
- Delirium v pooperačním období a v intenzivní medicíně
- Katétrem způsobené infekce krevního řečiště
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



