-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Regionální antikoagulace citrátem při eliminačních metodách u kardiochirurgického pacienta s vysokým rizikem krvácení – kazuistiky
Regional citrate anticoagulation during continuous renal replacement therapy (CRRT) in a cardiac surgery patient with a high risk of bleeding – case report
Regional citrate anticoagulation is suitable for cardiac surgery patients with clotting abnormalities who require continuous renal replacement therapy (CRRT) in the postoperative period. Case reports point to using regional citrate anticoagulation in patients with a high risk of bleeding and document the possibility of monitoring systemic haemocoagulation during renal replacement therapy using thromboelastography. This method is used as the first option in the case of significant disturbances in blood clotting.
Keywords:
regional anticoagulation – haemocoagulation – bleeding – continuous renal replacement therapy
Autoři: Zuščich Ondřej; Hájek Roman; Drobiličová Andrea
Působiště autorů: Kardiochirurgická klinika, Fakultní nemocnice Olomouc
Vyšlo v časopise: Anest. intenziv. Med., 20, 2009, č. 5, s. 262-266
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Regionální antikoagulace citrátem (RCA) je vhodná u kardiochirurgických pacientů s hemostatickým defektem v pooperačním období vyžadujících kontinuální eliminaci z renální indikace. Kazuistiky poukazují na vhodnost užití regionální antikoagulace citrátem u pacientů s vysokým rizikem krvácení a také dokumentují možnost sledování systémové hemokoagulace v průběhu eliminace pomocí tromboelastografie. Tato metoda je použita jako první volba v případech výrazné poruchy srážení krve.
Klíčová slova:
regionální antikoagulace – hemokoagulace – krvácení – kontinuální eliminační metody – tromboelastografieÚvod
Využití eliminačních technik pro podporu nebo náhradu funkce ledvin v intenzivní péči je spojené s problematikou použití antikoagulačních preparátů.
Bezpečná a účinná antikoagulace u eliminačních metod je ta, která maximalizuje dobu a účinnost eliminace, minimalizuje riziko krvácení a přispívá ke snižování finančních nákladů spojených s danou technikou eliminace.
Mechanismus aktivace koagulace v mimotělním okruhu je spojen s kontaktem krve s membránou filtru a umělým povrchem setu. Na prokoagulačním stavu se podílí také vlastní selhání ledvin a kritický stav pacienta s aktivovanou koagulací vlivem produkce prozánětlivých a prokoagulačních mediátorů, deplece přirozených antikoagulačních substancí (antitrombin, aktivovaný protein C, inhibice fibrinolýzy) [1]. Snahou je vývoj takových biokompatibilních povrchů (polysulfon, polyamid, polyakrylonitril, polymetylmetakrylát), které jsou hydrofobní a minimalizují další akceleraci výše uvedených stavů [2].
Hemostatický profil kardiochirurgického pacienta je typický příklad stavu, u kterého je problematika antikoagulace u eliminačních metod zásadní otázkou v rozhodování, zda eliminaci indikovat či vyčkat do stabilizace koagulace. V bezprostředním pooperačním období hrozí vysoké riziko krvácení při synergickém působení antikoagulancií a také u stavů s poruchou srážlivosti.
Faktory podílející se na srážení krve v mimotělním okruhu eliminačních metod:
a) Technické
- hemodialyzační kanyla: průměr, délka, geometrie;
- krevní průtok: nastavování maximálních hodnot průtoků krevní pumpou tolerované pacientem (200–250 ml . min-1), postupné navyšování průtoku při zahajování eliminace, minimalizace doby zástavy krevní pumpy;
- filtrační frakce: role zvyšování viskozity krve vlivem ultrafiltrace tekutiny na konci hemofiltru, hodnota filtrační frakce by neměla přesahovat 20–25 %;
- vlastnosti jednotlivých komponent mimotělního okruhu: biokompatibilita, minimální trombogenita, otázka heparinem potažených setů není doposud jasně vyřešená.
b) Stav pacienta
- klinický stav pacienta při zahájení a v průběhu eliminace,
- úroveň hydratace a náplně cévního řečiště, polohování, úroveň nitrohrudního tlaku.
Faktory ovlivňující krevní srážlivost u kardiochirurgického pacienta:
a) Mimotělní oběh (MTO) a jeho délka – různou měrou zasahuje do komplexu hemokoagulace [3]
- endoteliální dysfunkce – SIRS + aktivace fibrinolýzy + aktivace koagulace = abnormální endotel-celulární interakce;
- možný přetrvávající účinek heparinu;
- porucha destiček
- trombocytopenie – hemodiluce, konsumpce a sekvestrace,
- dysfunkce destiček – nejvyšší prevalence při MTO, indukce samotným MTO, léky;
- koagulopatie – hemodiluce a konsumpce koagulačních faktorů;
- fibrinolýza
- primární – uvolnění endoteliálních aktivátorů plasminogenu;
- sekundární – aktivace plazminu jako zpětná vazba na tvorbu fibrinu;
- hypotermie – inhibice destiček, inhibice enzymatické kaskády koagulace.
b) Léky aplikované předoperačně – antikoagulancia, antiagregancia a jiné léky s potenciálem ovlivnění hemostatického systému nemocného, aplikované pacientům s ICHS, chlopenními vadami, problematika akutních revaskularizací následujících po facilitované perkutánní koronární intervenci.
c) Chirurgie srdce a velkých cév – rozsáhlé trauma tkání
Antikoagulace u kontinuálních eliminačních technik
Antikoagulancia používaná při eliminačních metodách působí na různých úrovních hemokoagulace (humorální složka, trombocyty). Obecně lze diferencovat metody antikoagulace na tyto skupiny:
a) systémová antikoagulace – totální, parciální
- heparin (nefrakcionovaný, nízkomolekulární)
- heparinoidy (danaparoid)
- inhibitory faktoru Xa (fondaparinux)
- přímé inhibitory trombinu (hirudin, argatroban)
- prostaglandiny (ovlivňují trombocytární složku - nemusí být dostatečné)
b) regionální antikoagulace
- heparin – protamin
- regionální antikoagulace citrátem
c) bez antikoagulantu
- bez proplachu
- s proplachem
d) heparin-coated membrány – prozatím nedořešená otázka, protože dostupné modely nedosahují dostatečné úrovně antikoagulace ve srovnání s regionální antikoagulací citrátem [4]
Antikoagulace vhodná pro pacienty s vysokým rizikem krvácení
Vhodné antikoagulans má být efektivní v potlačení koagulace v oblasti mimotělního okruhu a maximálně šetrné k systémové cirkulaci nemocného. Mezi antikoagulancia splňující alespoň základní výše uvedená kritéria patří prostaglandiny, které ovšem nejsou vhodné v případě trombocytopenie či jiné trombocytopatie, kdy mohou vést k další progresi stavu vlivem inhibice agregace trombocytů. K dalším rizikům patří hypotenze. Jinou možností je užití konceptu bez antikoagulantu, což je bezpochyby vhodné v situacích již existujícího koagulačního deficitu či v případě kontraindikací jiných forem antikoagulace. Problém ale nastává při naší snaze o dosažení hemokoagulační stability a snížení, respektive zastavení, krevních ztrát. Regionální antikoagulace citrátem se jeví za této situace jako optimální metoda, která má minimum kontraindikací a její zásah do systémové koagulace je podle našich zkušeností minimální i v případě těžké koagulační poruchy. Mechanismus antikoagulace citrátem zasahuje humorální složku koagulace, takže trombocyty kompromitované vlivem mimotělního oběhu již nejsou déle inhibovány. Otázkou zůstává podávání citrátu u pacientů s jaterní insuficiencí. Nezanedbatelné jsou také možné negativní účinky, spojené s průnikem citrátu sodného do systémové cirkulace (metabolická alkalóza, acidóza, hypernatrémie, hypokalcémie a hypomagnezinémie).
Regionální antikoagulace citrátem
Koncept je založený na regionální aplikaci citrátu sodného, který způsobuje hlubokou hypokalcémii a navozuje inhibici koagulace. Citrát sodný je aplikován do přístupové linky mimotělního okruhu. Dochází ke vzniku citrát/kalciového chelátu, který je většinou eliminován difuzí/konvekcí v hemofiltru. Část citrátu sodného přichází do systémové cirkulace. Dochází k uvolnění citrát/kalciového chelátu a volný citrát je metabolizován v játrech na bikarbonát [5]. Vlivem cirkulace volného citrátu v systémové cirkulaci a tvorbě nových komplexů dochází k hypokalcémii, která musí být korigována infuzí kalcia do návratové linky mimotělního okruhu. Citrát sodný tedy zasahuje do komplexního metabolismu kriticky nemocného. V důsledku tohoto zásahu má i tato metoda své komplikace, způsobuje poruchy acidobazické rovnováhy a iontovou dysbalanci [4, 8]. Po zvládnutí této metody je však frekvence komplikací velice nízká a naopak životnost hemofiltru je lepší, ve srovnání se standardní metodou antikoagulace nefrakcionovaným heparinem [6, 7]. Výrazným benefitem je minimální účinek na systémovou srážlivost a z toho plynoucí minimalizace krvácivých příhod v průběhu eliminace.
Kazuistiky
Kazuistika 1
Mladá pacientka (31 let) přichází s progredujícím srdečním selháním, které vyústilo v globální srdeční selhání s protrahovanou resuscitací. Pacientka byla napojena na extrakorporální membránovou oxygenaci (Biomedicus). Dále byla zajištěna intraaortální balonkovou kontrapulzací, která byla následně extrahována vzhledem k ischémii končetiny. Od mechanické srdeční podpory byla pacientka odpojena šestý den. Od počátku zahájení mechanické srdeční podpory byla pacientka anurická a byla nutná eliminace. Vzhledem k mechanické srdeční podpoře byla pacientka zpočátku plně heparinizovaná (masivní krevní převody: 78 TU ERD, 54 TU PD, 8 TU TAD). Po odpojení od mechanické srdeční podpory bylo nutno pacientku opět eliminovat (obr. 1 a, b). Pacientka byla po dvouměsíční a problematické hospitalizaci propuštěna do domácího ošetřování.
Obr. 1a. Výchozí stav hemokoagulace monitorovaný pomocí tromboelastografie Hypokoagulační charakter křivky svědčí o poruše koagulace způsobenou inhibicí koagulačních faktorů, významný podíl reziduální heparinizace se projevuje klinicky manifestními krvácivými projevy. 
Obr. 1b. Výchozí stav hemokoagulace monitorovaný pomocí tromboelastografie Stejný vzorek jako obr. 1a s užitím heparinázy, nativní koagulace je tedy zcela v pořádku, bez zjevné poruchy. 
Parametry tromboelastografie:
- R (min) – reakční čas: doba od zahájení měření do detekce tvorby zjistitelného koagula, představuje počáteční formování fibrinu a odráží přítomnost koagulačních faktorů a jejich inhibitorů. Ke zkrácení dochází v případě hyperkoagulačních stavů, k prodloužení v případě deficitu koagulačních faktorů, hypofibrinogenémie.
- K (min) – čas tvorby koagula: doba od ukončení R do dosažení definované pevnosti koagula (amplituda velikosti 20 mm). Ke zkrácení dochází v případě hyperfibrinogenémie, trombocytémie, ke zkrácení v případě antikoagulační terapie.
- α – rychlost tvorby koagula: rychlost narůstání fibrinové sítě, vyšší vypovídací hodnota než K, protože při některých poruchách koagulace nedosáhne pevnost koagula amplitudy 20 mm; změny při trombocytopenii.
- MA (mm) – maximální amplituda: odráží absolutní pevnost koagula, která závisí na interakci destiček a fibrinu vazbou na receptory IIb/IIIa.
- LY30, 60 (%) – procentuální pokles hodnoty MA za 30, respektive 60 minut od jejího dosažení je indikátorem rozpadu koagula, tedy fibrinolýzy.
- CI – koagulační index: souhrnná charakteristika křivky.
Vzhledem k dokumentovanému narušení hemokoagulace – díky reziduální heparinizaci, manifestním známkám krvácivých projevů a nutnosti zahájení eliminace – byla eliminace vedena pomocí regionální antikoagulace citrátem (obr. 2, 3).
Obr. 1. Výsledný stav systémové hemokoagulace po 50 hodinách eliminace a antikoagulace pomocí regionální antikoagulace citrátem (nativní vzorek s hraniční křivkou) 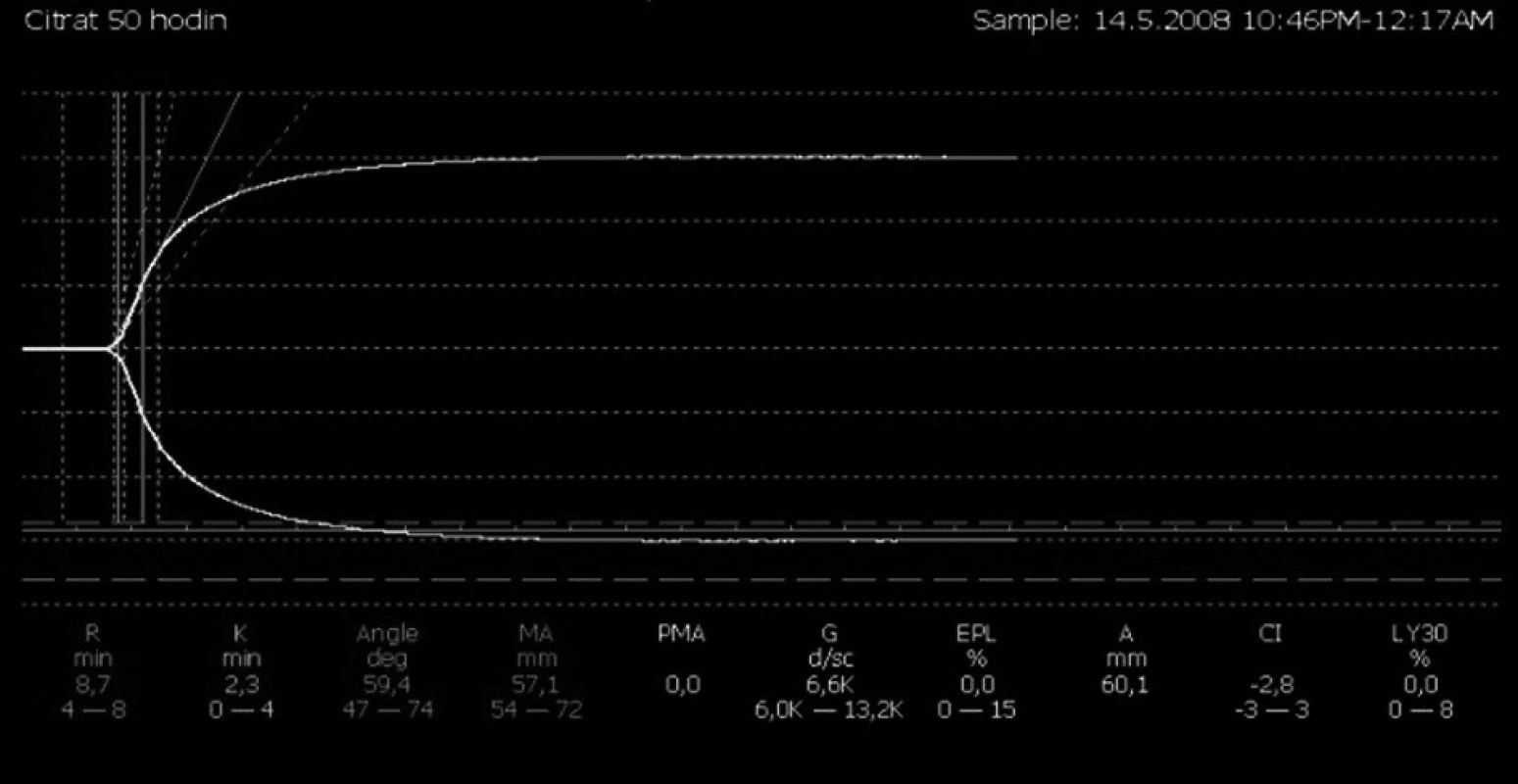
Obr. 2. Superpozice tromboelastografií 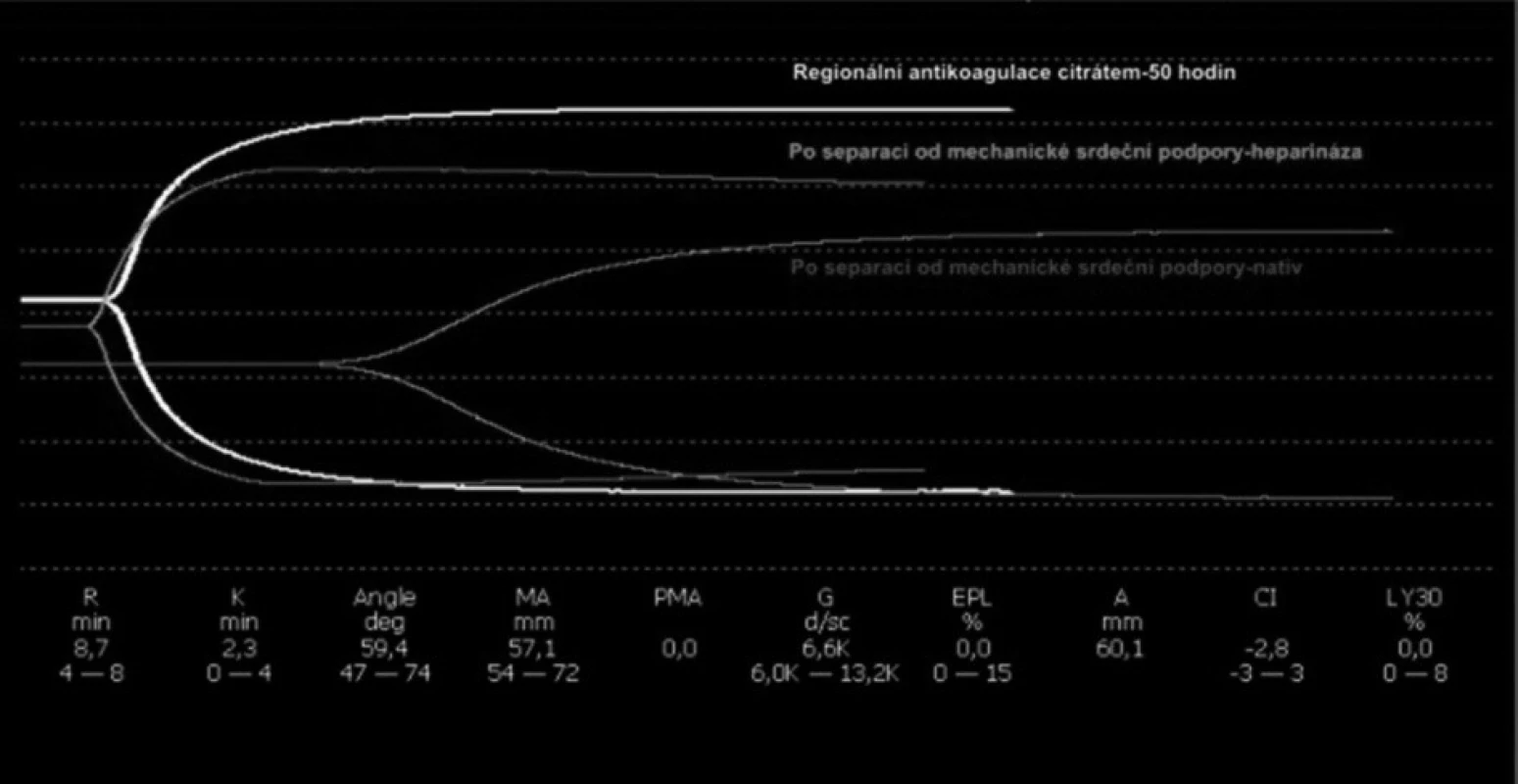
Kazuistika 2
Pacient přichází k náhradě aortální chlopně, výkon byl komplikován výraznou hemodynamickou nestabilitou po odpojení od mimotělního oběhu, kombinovanou s těžkým oxygenačním selháním (pravděpodobná anafylaktická reakce na podání protaminu). Pacient byl převezen na JIP, zde vysoké krevní ztráty, vzhledem k oběhové nestabilitě bylo nutno pacienta resuscitovat a převést zpět na operační sál k operační revizi. Po ošetření zdroje krvácení, byly provedeny opakované neúspěšné pokusy o uzavření sternotomie, pro oběhové selhávání po dotažení drátěných kliček. Pacient byl převezen zpět na JIP s odloženou suturou sternotomie. Postupná hemodynamická stabilizace. Vzhledem k opakované hypoperfuzi ledvin, plynoucí z hemodynamické nestability, opakovanému napojení na mimotělní oběh a zástavu oběhu, došlo k rozvoji akutního renálního selhání s nutností eliminace. Definitivní uzávěr sternotomie byl proveden za tři dny s opětovnou progresí krevních ztrát. Opět byla nutná operační revize s nutností reinzerce aortální chlopně. Výkon zase komplikovaly progredující krevní ztráty, proto bylo nutné ve fázi odpojování od mimotělního oběhu napojení na cell-saver. Indikace aplikace rekombinantního aktivovaného faktoru VIIa (NovoSeven®) v dávce 90 mg/kg tělesné hmotnosti (obr. 4 a, b). Na JIP postupný pokles krevních ztrát, vzhledem k nutnosti pokračování v eliminaci pokračovala regionální antikoagulace citrátem (obr. 5, 6). Pacient zemřel po deseti dnech na multiorgánové selhání.
Obr. 4a. Hemokoagulace po podání rekombinantního aktivovaného faktoru VIIa (NovoSeven) monitorovaná pomocí tromboelastografie Nativní vzorek, těžká kombinovaná hypokoagulace způsobená trombocytopenií, deficitem a inhibicí koagulačních faktorů, reziduální heparinizací. 
Obr. 4b. Hemokoagulace po podání rekombinantního aktivovaného faktoru VIIa (NovoSeven) monitorovaná pomocí trombelastografie k průkazu velikosti reziduální heparinizace Vzorek s heparinázou prokazuje podíl reziduální heparinizace, trombocytopenie. 
Obr. 3. Systémová hemokoagulace při regionální antikoagulaci citrátem (hypokoagulační charakter křivky, bez progrese stavu) 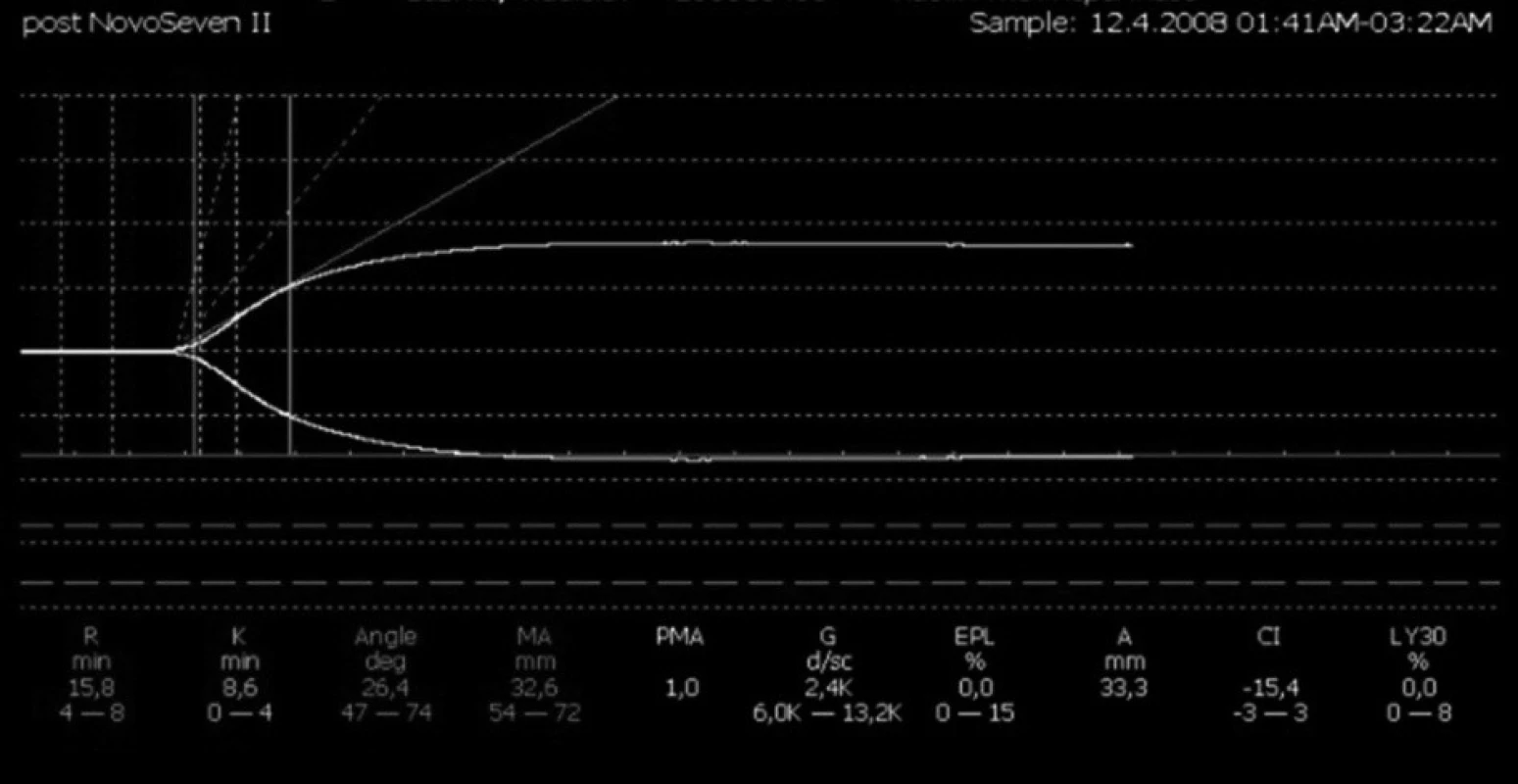
Obr. 4. Superpozice tromboelastografií 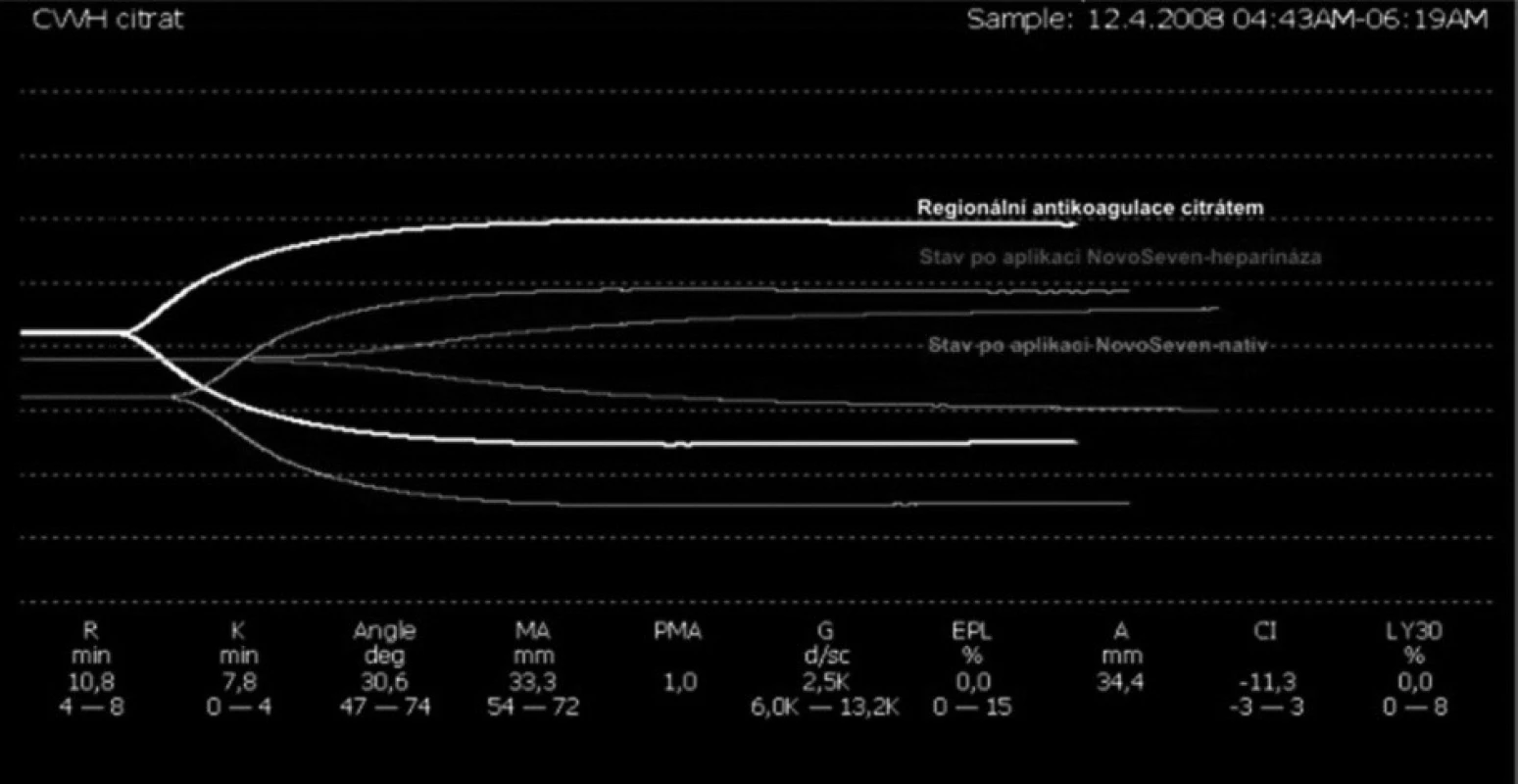
Diskuse
Regionální antikoagulace citrátem je vhodná u pacientů s vysokým rizikem krvácení, vzhledem k minimálním systémovým účinkům na hemokoagulaci [1, 5, 6]. Jednoznačnou výhodou použití regionální antikoagulace citrátem je podle Bagshawa et al. prodloužení doby životnosti hemofiltru ve srovnání s heparinem [7, 8]. V jeho souboru 87 pacientů byla průměrná životnost hemofiltru 40 hod (rozmezí 14–72 hod) ve skupině s užitím regionální antikoagulace citrátem a 20 hod (rozmezí 5–44 hod), p < 0,001) ve skupině s heparinem. Medián životnosti hemofiltru činí > 72 hod, respektive 33 hod (p < 0,001) ve prospěch regionální antikoagulace citrátem. Obdobné výsledky ve prospěch RCA uvádí také Morgera et al. ve své studii 209 pacientů (80,2 ± 60 hod, respektive 30,2 ± 32 hod; p < 0,001). Betjese et al. také prokázali, že při systémové antikoagulaci heparinem dochází k vyšší ztrátě erytrocytů, respektive k vyššímu poklesu koncentrace hemoglobinu. Pozorovali snížení počtu erytrocytů signifikantně vyšší ve skupině heparinu (0,88 jednotek, respektive 0,43 jednotek/den eliminace) ve srovnání s regionální antikoagulací citrátem, a to i u pacientů s nízkým rizikem krvácení [9]. Metoda regionální antikoagulace citrátem má srovnatelný vliv na přežití jako heparin, ovšem minimální riziko krvácení, a proto by měla být metodou volby u kriticky nemocných pacientů [9]. Její použití je vhodné zejména u pacientů, u kterých je antikoagulace heparinem kontraindikována. Použití regionální antikoagulace citrátem je podle Thoenena et al. jednoznačné vhodné u kardiochirurgických pacientů [10]. Použití heparinem potažených membrán doprovází nejednotné výsledky studií. Podle Evenepoela et al. je efektivita ve srovnání s RCA menší (procento srážlivých jevů vedoucích k předčasnému ukončení eliminace 39%, respektive 0% ve skupině RCA). Naše dosavadní zkušenosti naznačují, že je tato forma antikoagulace velmi vhodná právě u pacientů s vysokým rizikem krvácení. V jejím průběhu jsme nezaznamenali žádné krvácivé projevy nebo alteraci hemostázy, kterou jsme monitorovali pomocí trombelastografie prováděné jak v nativní, tak v heparinázové modifikaci. Tromboelastografie byly prováděny v různých časových intervalech pro zmapování posunu systémové hemostázy v průběhu RCA. Otázkou zůstává problém komplikací spojených s implementací metody do provozu jednotek intenzivní péče vzhledem k vyšší technické náročnosti. Po zvládnutí základních principů regionální antikoagulace citrátem je tato metoda jednoznačně bezpečná, vhodná a použitelná na jednotkách intenzivní péče s minimálním rizikem komplikací plynoucích z komplexního zásahu do metabolismu. Cubattoli et al. hodnotili soubor 11 pacientů s vysokým rizikem krvácení [6]. Protokol indikoval hladinu ionizovaného kalcia za filtrem 0,4 mmol . l-1 při průtoku < 250 ml . min-1 a 0,6 mmol . l-1 při průtoku > 250 ml . min-1. Hladina systémového ionizovaného kalcia byla udržována v normálním rozmezí. Výskyt asymptomatické snížené hladiny ionizovaného vápníku (< 0,9 mmol . l-1) byl zaznamenán v 6,9 % případů. Hyperkalcemie (1,39 ± 0,05 mmol . l-1) se objevila v 2,5 % případů. Hypernatremie (práh 153 mmol . l-1) a alkalóza (práh pH 7,51) se vyskytovala v 9,3 % a 9,4 % případů. Autoři nepozorovali citrátovou toxicitu.
Závěr
Forma antikoagulace u kontinuálních eliminačních metod představuje jednu z determinant podmiňujících úspěch vlastní eliminace, a proto je nutno i této oblasti věnovat patřičnou pozornost. Regionální antikoagulace citrátem patří k vhodným formám antikoagulace u pacientů s vysokým rizikem krvácení. Její indikaci je nutné dokonale zvážit s ohledem na její přínosy i nedostatky v konfrontaci s klinickým stavem pacienta. Nedílnou součástí implementace metody je vypracování a používání protokolu vedení antikoagulace. Trombelastografie je vhodným nástrojem pro sledování vývoje hemostázy u pacientů s vysokým rizikem krvácení, kteří vyžadují kontinuální eliminaci.
Použité zkratky:
TU – transfuzní jednotka
ERD – erytrocytový koncentrát resuspendovaný deleukotizovaný
PD – mražená plazma
TAD – trombocyty z aferézy
Práce byla přednesena na XV. národním kongresu ČSARIM v Brně dne 15–18. 10. 2008 a III. sjezdu společnosti kardiovaskulární chirurgie dne 6–7. 11. 2008, konaného v Brně.
Došlo 1. 4. 2009.
Přijato 31. 7. 2009.
Adresa pro korespondenci:
Mgr. Zuščich Ondřej
Trávníky 463
Kralice na Hané
e-mail: O.Zuscich@seznam.cz
Zdroje
1. Kroužecký, A. Antikoagulace u metod mimotělní náhrady funkce ledvin. In: Novák, I., Matějovič, M., Černý, V. et al. Akutní selhání ledvin. Praha : Maxdorf, 2008, p. 85–95.
2. Stašek, J. Trombocytopenie jako komplikace kontinuálních očišťovacích metod. Interní medicína pro praxi, 2005, 7, 10, p. 438–439.
3. Hájek, R., Zezula, R., Fluger, I., Růžičková, J. Význam trombelastografie pro monitorování hemostázy v kardiochirurgii. Intervenční a akutní kardiologie, 2005, 4, 4, p. 224–228.
4. Evenepoel, P., Dejagere, T., Verhamme, P., Claes, K., Kuypers, D., Bammens, B., Vanrenterghem, Y. Heparin-coated polyacrylonitrile membrane versus regional citrate anticoagulation: a prospective randomized study of 2 anticoagulation strategies in patiens at risk of bleeding. Am. J. Kidney Dis., 2007, 49, 5, p. 642–649.
5. Maňák, J., Mottl, R., Sobotka, L. Citrátová antikoagulace během kontinuální veno-venosní hemodiafiltrace – návod na provedení metody. Aktuality v nefrologii, 2006, 6, 4, p. 125–129.
6. Cubattoli, L., Teruzzi, M., Cormio, M., Lampati, L., Pesenti, A. Citrate anticoagulation during CVVH in high risk bleeding patients. Int. J. Artif. Organs, 2007, 30, 3, p. 244–252.
7. Bagshaw, S. M., Laupland, K. B., Boiteau, P. J., Godinez-Luna, T. Is regional citrate superior to systemic heparin antikoagulation for continuous renal replacement therapy? A prospective study in an adult regional critical care system. J. Crit. Care, 2005, 20, 2, p. 155–161.
8. Morgera, S., Scholle, C., Voss, G., Haase, M., Vargas-Hein, O., Krausch, D., Melzer, C., Roseau, S., Zuskermann-Becker, H., Neumayer, H. H. Metabolic complications during regional citrate anticoagulation in continuous venovenous hemodialysis: single-center experience. Nephron. Clin. Pract, 2004, 97, 4, p. 131–136.
9. Betjes, M. G., van Oosterom, D., van Agterem, M., van de Watering, J. Regional citrate versus heparin anticoagulation during venovenous hemofiltration in patients at low risk for bleeding: similar hemofilter survival but significantly less bleeding. J. Nephrol., 2007, 20, 5, p. 602–608.
10. Thoenen, M., Schmid, E. R., Binswanger, U., Schuepbach, R., Aerne, D., Schmidlin, D. Regional citrate anticoagulation using a citrate-based substitution solution for continuous venovenous hemofiltration in cardiac surgery patients. Wien Klin. Wochenschr., 2002, 114, 3, p. 108–114.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2009 Číslo 5- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Krevní transfuze – rizika versus benefit
- Stáří transfuzních jednotek – problém k zamyšlení
- Jaká je optimální intenzita mimotělních hemoeliminačních metod u akutního poškození ledvin kriticky nemocných?
- Doba úvodu a zotavení z celkové anestezie – prospektivní studie
- Odložené plánované operační výkony ve třech českých fakultních nemocnicích – prospektivní studie
- Vysokoobjemová versus standardní hemofiltrace v experimentální sepsi při peritonitidě*
- Vliv stáří transfuzních jednotek erytrocytů na koncentrace vybraných biochemických veličin
- Regionální antikoagulace citrátem při eliminačních metodách u kardiochirurgického pacienta s vysokým rizikem krvácení – kazuistiky
- XVI. NÁRODNÍ KONGRES ČSARIM
- ABSTRAKTA POSTERŮ
- Zápis z výborové schůze ČSARIM, 7. 4. 2009
- Zápis z výborové schůze ČSIM
- Recenze knihy
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Doba úvodu a zotavení z celkové anestezie – prospektivní studie
- Odložené plánované operační výkony ve třech českých fakultních nemocnicích – prospektivní studie
- Regionální antikoagulace citrátem při eliminačních metodách u kardiochirurgického pacienta s vysokým rizikem krvácení – kazuistiky
- ABSTRAKTA POSTERŮ
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



