-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
KDIGO doporučení pro akutní poškození ledvin 2012 – komentovaný výběr z doporučení
Autoři: Matějovič Martin
Vyšlo v časopise: Anest. intenziv. Med., 23, 2012, č. 5, s. 264-274
Kategorie: Intenzivní medicína - Speciální článek
Potřebujeme klinická doporučení na AKI?
Koncept akutního selhání ledvin doznal v posledních letech zásadních změn. Tradiční učebnicové texty pracují s pojmem akutní selhání ledvin, zdůrazňující nejzávažnější stupeň akutně vzniklé renální dysfunkce. Rostoucí poznatky však ukazují, že i relativně mírné akutní poškození ledvin či porucha jejich funkce jsou spojeny s vážnými klinickými důsledky a přispívají nezávisle na základním onemocnění k nemocniční mortalitě a morbiditě. I z těchto důvodů byl termín akutní selhání ledvin nahrazen pojmem akutní poškození ledvin (AKI, acute kidney injury). AKI vyjadřuje dynamický proces zahrnující široké spektrum poruch renálních funkcí či morfologického poškození, od mírného zvýšení sérových hodnot kreatininu až po anurické selhání ledvin vyžadující mimotělní očišťovací metody. Jde o závažný problém medicínský a obecně zdravotnický, jehož incidence má stále stoupající charakter. Komunitní AKI je příčinou 1 % příjmů do nemocnice. AKI získané v nemocnici (nozokomiální) postihuje 5–7 % všech hospitalizovaných pacientů a jeho prevalence má rostoucí charakter [1]. Stoupá počet AKI v důsledku sepse a nefrotoxicity (antibiotika, nesteroidní antirevmatika, chemoterapeutika, antivirotika, kontrastní látky aj.). V prostředí jednotek intenzivní péče se AKI vyvíjí typicky jako součást syndromu multiorgánové dysfunkce a sepse je zde jeho hlavní příčinou [2]. Mortalita nemocných vyžadující náhradu funkce ledvin je stále nepřijatelně vysoká: 50–60%. Nepříznivé důsledky AKI nejsou jen krátkodobé. Tito pacienti mají více než trojnásobně vyšší riziko chronického selhání ledvin v následující dekádě ve srovnání s kontrolní skupinou. Částečná reparace renálních funkcí po prodělaném AKI je stále více rozpoznávána jako významný rizikový faktor rozvoje chronického onemocnění ledvin.
Z výše uvedeného je zřejmé, že AKI je globálním problémem s enormním dopadem. Časné rozpoznání, vyhodnocení a vhodná preventivní a léčebná opatření jsou zásadními předpoklady pro příznivé ovlivnění morbidity a mortality těchto pacientů. Důvod pro formulování základních klinických doporučení je proto zcela legitimní. Jejich posláním je zlepšit kvalitu péče o nemocné s AKI, omezit nežádoucí variabilitu v léčebně-preventivních přístupech, a v konečném důsledku tak zlepšit osud nemocných a snížit náklady na jejich léčbu. Doporučení, o nichž se dále diskutuje, sice nepřinášejí žádné převratné změny do klinické praxe, ale jasně pojmenovávají klíčové proměnné, které – byť často dobře známé – jsou stále v denní praxi opomíjené.
Co jsou to KDIGO doporučení pro akutní poškození ledvin a jejich metodologie
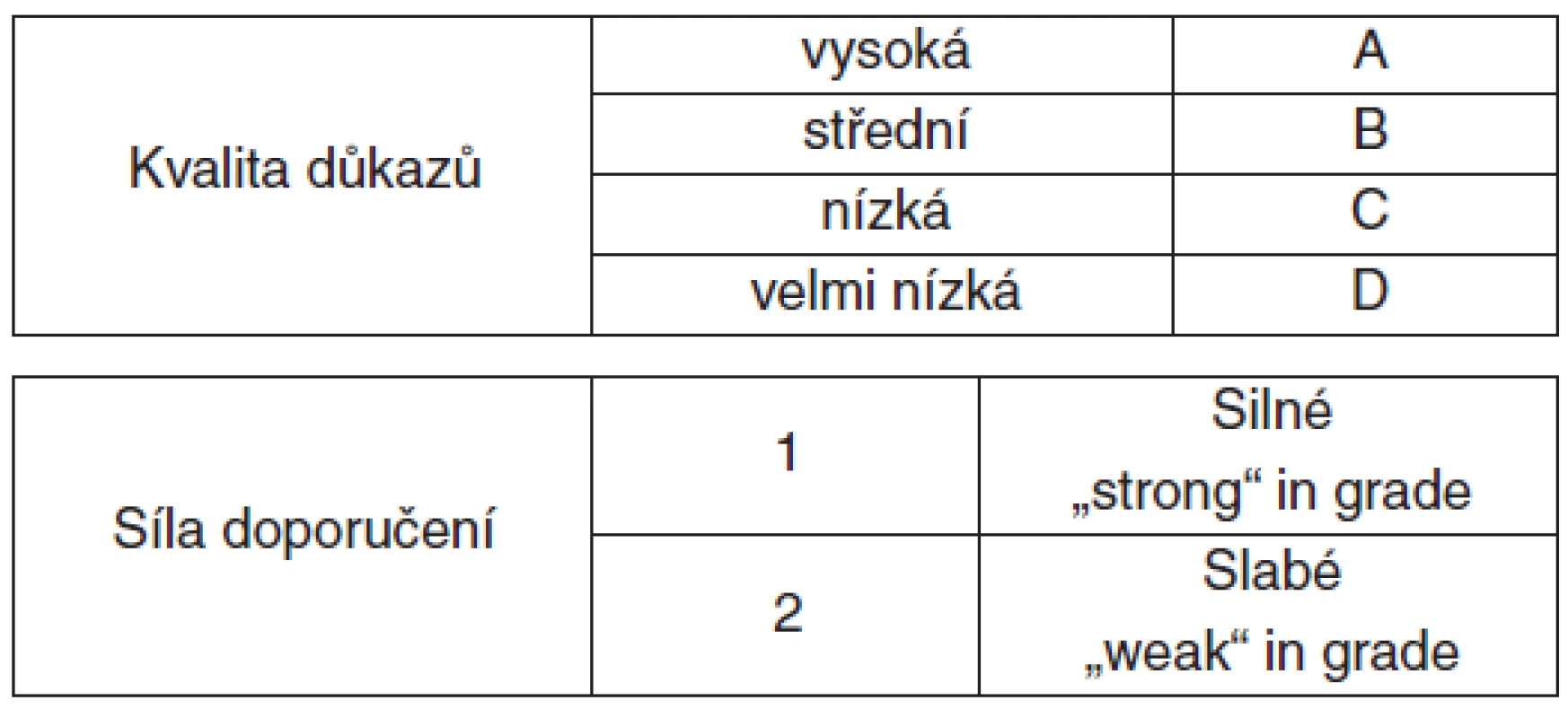
Předložená doporučení jsou vůbec prvními komplexními nadnárodními formálními „guidelines“ v problematice AKI [3]. Vypracovala je pracovní skupina expertů v rámci globální iniciativy KDIGO (Kidney Disease: Improving Global Outcome) a byla publikována na 138 stránkách letošního březnového suplementa prestižního nefrologického periodika Kidney International. KDIGO doporučení vycházejí z obecného principu medicíny založené na důkazech (EBM – Evidence Based Medicine) a jeho nástrojem je systém GRADE (Grade of Recommendation, Assessment, Development, and Evaluation, viz tab. 1).
Silné doporučení (v textu „JE DOPORUČENO“) vychází z vysoké kvality vědeckých dat a ve většině případů by se mělo podle tohoto doporučení postupovat. Slabé doporučení (v textu „JE NAVRŽENO)“ znamená, že rozdílné postupy mohou být vhodné pro různé pacienty, je důraz na individuální vyhodnocení. Jinými slovy, i když většina odborníků se rozhodne stejně, existuje nezanedbatelná skupina, která bude volit odlišný postup. Kromě uvedené síly doporučení obsahuje text i formulace, kde váha doporučení není specifikována. Jedná se obvykle o oblasti, kde není možné uplatnit princip EMB, nebo kde takové vyhodnocení chybí. Ve druhém případě se obvykle jedná o konsenzuální stanovisko odborníků. Pochopení uvedeného systému je nezbytné pro správnou interpretaci doporučených postupů v klinické praxi.
Vysokou kvalitu získalo 11 doporučení (18 %). Četnost zastoupení ostatních stupňů kvality je následující: 20 „B“ (33 %), 23 „C“ (38 %), 7 „D“ (12 %). Přibližně tomu odpovídá i rozložení síly doporučení: 22 silné doporučení (level 1) – 36 %, 39 slabé doporučení (level 2) – 64 %, 26 stanovisek nebylo váženo systémem GRADE („not graded“) – 30 %. V odborné literatuře se objevují názory, že doporučení by obecně neměla být vydávána v oblastech, kde síla důkazů je slabá, nebo úplně chybí. Autoři KDIGO doporučení přesto tento typ doporučení v textu ponechávají. Argumentují tím, že i v těchto oblastech je přínosnější dát klinikům návod jak postupovat, než nezaujmout žádné stanovisko. Současně však zdůrazňují obecnou zásadu při používání jakýchkoliv doporučujících textů – jsou pouhým návodem, nikoliv závazným textem. Míra jejich následování musí zohlednit individuální kontext aktuální situace, odbornou zkušenost lékaře s daným stavem, jeho erudici a v neposlední řadě trvalý respekt k základním etickým principům medicíny. Odpovědnost za použití jakéhokoliv postupu zůstává vždy na jeho poskytovateli [4].
Komentovaná vybraná doporučení
Uvedený text je výběrem základních a pro potřeby běžné klinické praxe nejdůležitějších doporučení z původního textu. Není diskutovaná pediatrická problematika. Jednotlivá doporučení jsou uvedena kurzivou a opatřena komentářem autora. Plná verze v původním jazyce je dostupná na adrese http:// www.kdigo.org/clinical_practice_guidelines/AKI.php
Definice a klasifikace AKI
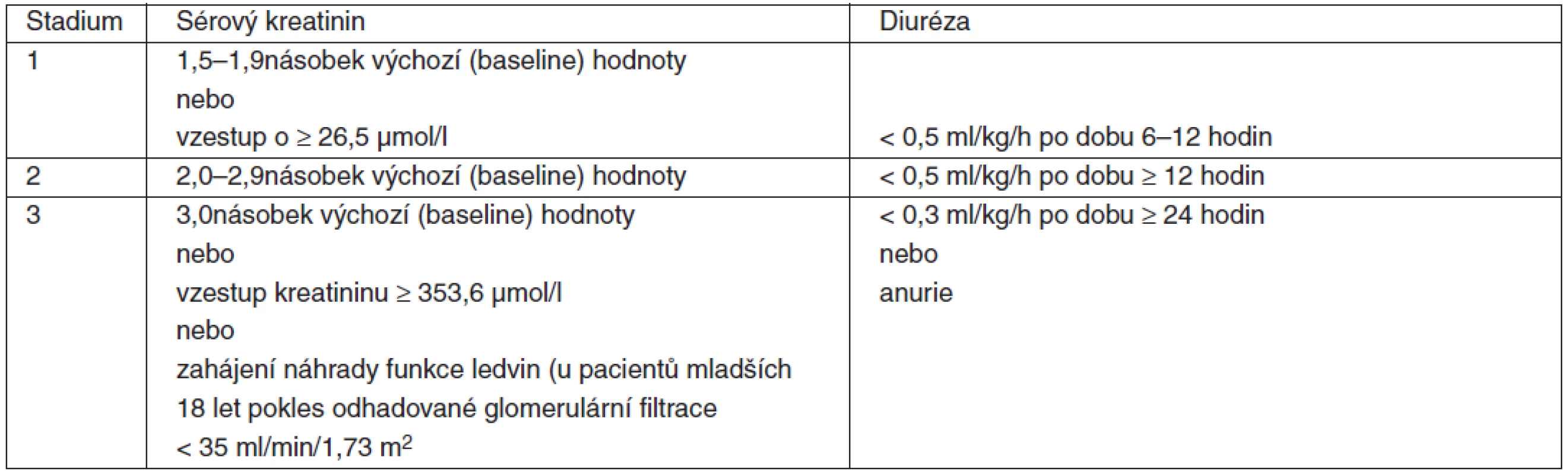
AKI je definováno splněním jedné z následujících podmínek:
- absolutní vzestup sérového kreatininu o více než 26.5 µmol/l
- ≥ 1,5násobný vzestup kreatininu oproti výchozí hodnotě, která je známá nebo předpokládaná z předchozích 7 dní
- diuréza < 0,5 ml/kg/h po dobu 6 hodin
AKI je klasifikováno podle tíže do 3 skupin, které uvádí tabulka 2.
Příčina AKI by měla být určena kdykoliv je to možné.
Definice AKI se na rozdíl od definice chronického onemocnění ledvin (CKD) stále vyvíjí a velmi bude záviset na vyhodnocení nových biomarkerů dysfunkce a poškození ledvin. I když jsou dobře známy limitace konvenčních biomarkerů (pozdní detekce, nepřesný odhad míry renálního poškození), stále tvoří změny sérového kreatininu a diurézy základ definice AKI. Klasifikace AKI do tří stupňů závažnosti vychází z kritérií RIFLE a AKIN. I když význam tohoto stagingu AKI pro klinickou praxi nemusí být na první pohled zřetelný (navíc není např. zohledněn DRG systémem), je vhodný, protože v sobě nese důležitou prognostickou informaci – riziko úmrtí a potřeby RRT narůstá úměrně s tíží AKI. Z dlouhodobého hlediska i mírné a přechodné formy AKI mají vliv na kardiovaskulární morbiditu, rozvoj CKD a mortalitu. Navržený klasifikační systém má i své nedostatky. Je založen na ukazatelích renální funkce, nikoliv na markerech renálního traumatu/poškození a nezohledňuje ani příčinu, ani dobu trvání AKI. Podmínkou je rovněž znalost hodnot kreatininu před akutním onemocněním, ta je ovšem často nedostupná. Analogicky akutnímu koronárnímu syndromu či akutnímu plicnímu poškození je důležité vnímat AKI jako široký klinický syndrom, který má řadu podjednotek (prerenální, renální a postrenální AKI) a příčin (ischemické, toxické, vaskulitické, intersticiální, glomerulární, obstrukční apod.). Přestože je léčba AKI vždy určována základní etiologií, jsou současná doporučení zaměřena především na všeobecná opatření, společná pro většinu příčin AKI.
Vyhodnocení rizika a sledování pacientů s AKI
Riziko rozvoje AKI je vždy důsledkem interakce mezi náchylností ledvin a inzultem (tab. 3). Identifikace rizika má význam zejména u hospitalizovaných pacientů, kdy jejich znalost umožňuje implementaci všech dostupných preventivních opatření směřujících k redukci rizika vzniku AKI či jeho závažnosti.
Tab. 3. Rizikové inzulty a predispozice k AKI 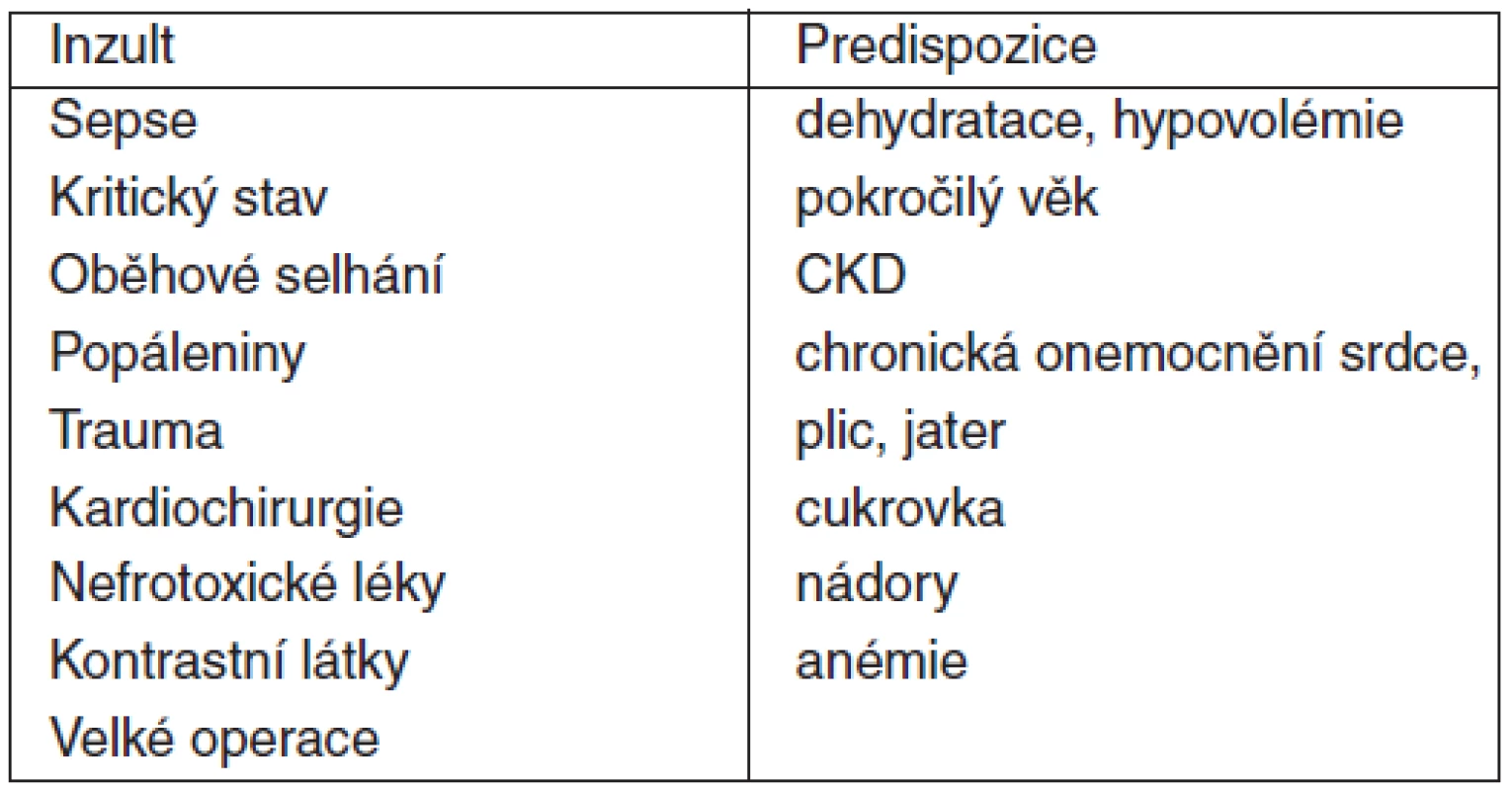
Je doporučeno stratifikovat riziko AKI podle přítomnosti predispozic a inzultů (1B).
Monitorovat pacienty v riziku AKI s individualizovanou frekvencí měření sérového kreatininu a diurézy.
Promptně vyhodnotit AKI pacienty s důrazem zejména na určení reverzibilní příčiny.
Vyhodnotit pacienty 3 měsíce po AKI s posouzením míry zotavení nebo naopak rozvoje nového či zhoršení preexistujícího CKD.
- Pokud má pacient CKD, další přístup se řídí podle KDOQI CKD doporučení.
- Pokud pacient nemá CKD, je třeba jej považovat za rizikového k CKD a další přístup se řídí podle KDOQI CKD doporučení 3 (pacient v riziku CKD).
Prevence a léčba AKI
Hemodynamická podpora v prevenci a léčbě AKI
Pokud se nejedná o hemoragický šok, je navrženo u pacientů v riziku AKI nebo s rozvinutým AKI používat k doplnění intravaskulárního objemu izotonické krystaloidy spíše než koloidy (2B).
Je doporučeno používat vazopresory společně s tekutinami u pacientů s vazomotorickým šokem a rizikem nebo přítomností AKI (1C).
Je navrženo používat protokolizovaný management hemodynamiky a parametrů oxygenace k prevenci rozvoje nebo progrese AKI u vysoce rizikových pacientů v perioperačním období (2C) a u pacientů v septickém šoku (2C).
Doporučené postupy se věnují třem velmi diskutovaným problémům: volbě tekutin, vazopresorů a fyziologických cílů v rámci resuscitace a stabilizace oběhu. Časná korekce prerenálních příčin stojí v první linii všech opatření. Hlavní prerenální faktory, které nejvíce ohrožují funkce ledvin, jsou hypovolémie a hypotenze. Tekutinová resuscitace je účinná v prevenci rozvoje/progrese AKI v situacích, kde je dominantním mechanismem renální hypoperfuze navozená hypovolémií. Zvýšený přívod tekutin může být žádoucí i u některých vybraných stavů, u kterých není primárním problémem renální hypoperfuze. Mezi ně patří stavy spojené s rabdomyolýzou, tumor lysis syndrom, podávání nefrotoxických látek (amfotericin B, platinum, kontrastní látky, acyklovir). Zásadní úlohu hraje časový faktor. Čím časnější je intervence, tím větší je naděje, že nedojde k závažnějšímu strukturálnímu poškození ledvin. Na druhou stranu, nekontrolované podávání tekutin s kumulativní pozitivní tekutinovou bilancí může být u kriticky nemocných spojeno s vyšší incidencí AKI, častější potřebou náhrady funkce ledvin, horší reparací renálních funkcí a vyšší celkovou mortalitou [5]. Izotonické krystaloidy jsou považovány za roztoky první volby. Koloidní roztoky jsou často používány s cílem rychlejšího obnovení efektivního cirkulujícího objemu. Řada recentních studií a analýz však stále intenzivněji upozorňuje na renální rizika syntetických koloidních roztoků, především u septických pacientů. Recentně uveřejněné konsenzuální stanovisko Evropské společnosti intenzivní medicíny (ESICM) doporučuje nepoužívat roztoky hydroxyetylškrobu (HES) s molekulární hmotností ≥ 200 kDa a/nebo stupněm substituce > 0,4 u pacientů s těžkou sepsí nebo s rizikem AKI a rovněž navrhuje nepoužívat ani HES roztoky nové generace (130/0,4) či roztoky na bázi želatiny u této populace nemocných [6]. Definitivní východisko pro správnou klinickou praxi se očekává od závěrů recentně ukončených velkých randomizovaných studií, srovnávajících HES 130/0,4 s krystaloidními roztoky (CHEST trial a 6S trial). O albuminu jako plazma-expandéru lze uvažovat u pacientů s jaterní cirhózou komplikovanou spontánní bakteriální peritonitidou či hepatorenálním syndromem. Základním vazopresorem, který je v klinické praxi využíván ke korekci hypotenze u stavů se sníženou systémovou cévní rezistencí (typicky sepse), je noradrenalin. Dříve rozšířený názor, že noradrenalin je lékem, který vzhledem ke své vazokonstrikční aktivitě zhoršuje funkci ledvin, je dnes definitivně vyvrácen. Naopak, u septických nemocných se systémovou vazodilatací a porušenou renální autoregulací může noradrenalin reální krevní průtok zvýšit. Neuzavřenou zůstává otázka cílového perfuzního tlaku, nezbytný je vždy individuální přístup. Použití vazopresinu či jeho analoga terlipresinu jako alternativních vazoaktivních látek zatím nelze přes některé povzbudivé výsledky studií pro prevenci či léčbu AKI doporučit. Protokolizovaný hemodynamický management (zejména titrace tekutin a vazoaktivních látek k dosažení predefinovaných parametrů hemodynamiky a tkáňové oxygenace) je kromě léčby septických stavů doporučen i v perioperační péči u vysoce rizikových skupin pacientů (věk nad 60 let, emergentní výkony, významné komorbidity). Hlavní limitací je absence standardizace fyziologických cílů.
Kontrola glykémie a nutriční podpora
U kriticky nemocných pacientů je navržena inzulinoterapie k dosažení a udržení glykémie v rozmezí 6,1–8,3 mmol/l (2C).
Je navrženo dosáhnout celkového energetického příjmu 20–30 kcal/kg/den u pacientů s jakýmkoliv stupněm AKI (2C).
Je navrženo vyvarovat se restrikce proteinů s cílem prevence nebo oddálení RRT (2D).
Je navrženo podávat 0,8–1,0 g/kg/d proteinů u nekatabolického AKI bez potřeby RRT (2D), 1,0–1,5 g/kg/d u pacientů s AKI vyžadujících RRT (2D) a až maximálně 1,7 g/kg/d u pacientů na kontinuálních metodách RRT nebo u hyperkatabolických pacientů (2D).
Je navrženo preferenční podávání výživy enterálně u pacientů s AKI (2C).
Koncept těsné kontroly glykémie se prosadil do nadnárodních doporučených postupů po uveřejnění monocentrické belgické studie, která prokázala snížení morbidity a mortality u chirurgické populace kriticky nemocných [7]. Součástí výsledků byla i statisticky významná redukce incidence AKI ve skupině těsné kontroly glykémie (4,4–6,1 mmol/l). Několik významných multicentrických studií, které následovaly, však tento prospěšný účinek nepotvrdily. Naopak, některé poukázaly na rizika a škodlivý vliv častých hypoglykémií. Analýza všech dosud provedených 7 randomizovaných kontrolovaných studií zahrnujících celkem 11 425 kriticky nemocných pacientů nepotvrdila vliv na snížení 28denní mortality, incidenci orgánové dysfunkce včetně potřeby náhrady funkce ledvin jako indikátoru výskytu závažného AKI [8]. Existuje konsenzus, že kontrola glykémie u kriticky nemocných je žádoucí. Otevřenou otázkou zůstává cílové rozmezí. Koncept těsné kontroly glykémie (tj. 4,4–6,1 mmol/l) však není z důvodů rizik plynoucích z hypoglykemických epizod doporučen. Je nutné upozornit, že pásmo glykémie navržené v KDIGO doporučeních nikdy nebylo ve vztahu k AKI rigorózně vyhodnoceno řádnými klinickými studiemi a je mnohem přísnější než nově připravovaná doporučení pro léčbu sepse (protokolizovaný přístup by měl zajistit glykémii pod 10 mmol/l spíše než pod 6,1 mmol/l – grade 1A). Všechna doporučení týkající se výživy pacientů s AKI vycházejí ze zdrojů s velmi limitovanou kvalitou. Většinou se důsledkem absence klinických studií jedná o názory expertů. Je však známo, že proteino-kalorická malnutrice je významným nezávislým prediktorem mortality nejen u pacientů s AKI. Navržená doporučení zohledňují i další důležitý fakt – významné ztráty aminokyselin (10–15 g denně) při použití kontinuálních metod náhrady funkce ledvin.
Diuretika u AKI
Je doporučeno nepoužívat diuretika k prevenci AKI (1B).
Je navrženo nepoužívat diuretika k léčbě AKI s výjimkou managementu tekutinového přetížení (2C).
Používání kličkových diuretik u AKI je velmi častou léčebnou intervencí, indikovanou z důvodu současného objemového přetížení, ve snaze zvrátit prognosticky méně příznivé oliguricko-anurické selhání do neoligurického, či podávaných s úmyslem redukce metabolicky náročné reabsorpce solutů a omezit případnou intratubulární obstrukci udržením průtoku moče. Uvedená zdůvodnění a časté rutinní používání diuretik u AKI (67 % intenzivistů a nefrologů) jsou však v protikladu k výsledkům klinických studií a jejich metaanalýz: s výjimkou kontroly tekutinového přetížení nemají kličková diuretika žádnou doloženou úlohu v prevenci, léčbě AKI či zotavení z AKI. Některé studie dokonce dokumentovaly zhoršení AKI i mortality. Diuretika rovněž nesnižují (a možná nežádoucím způsobem jen oddalují) potřebu náhrady funkce ledvin. Uvedená doporučení platí jak pro kličková diuretika, tak i pro manitol.
Vazodilatační léčba: dopamin, fenoldopam a natriuretické peptidy
Je doporučeno nepoužívat nízké dávky dopaminu k prevenci nebo léčbě AKI (1A).
Je navrženo nepoužívat fenoldopam k prevenci nebo léčbě AKI (2C).
Je navrženo nepoužívat natriuretické peptidy (ANP) k prevenci (2C) nebo k léčbě (2B) AKI.
Dříve doporučená snaha o zlepšení renálního prokrvení tzv. renálními vazodilatátory doznala jednoznačného přehodnocení. Přesto řada pracovišť „renální“ dávky dopaminu stále používá. Nízké dávky dopaminu však ledviny před rozvojem AKI nechrání a naopak mohou podle některých studií funkci ledvin zhoršit. Nezanedbatelná jsou i mimorenální rizika dopaminu (především riziko srdečních arytmií, limitace prokrvení střeva, potlačení funkce adenohypofýzy). Podobně podávání fenoldopamu (selektivní dopamin-1-receptor agonista) a natriuretických peptidů přineslo rozporuplné výsledky. Některé recentní studie sice naznačují, že by mohly existovat podskupiny nemocných, kterým tyto léky mohou přinášet prospěch (např. předléčení dárců ledvin dopaminem, fenoldopam u kardiochirurgických pacientů). Zatím je však pro rutinní praxi nelze doporučit.
Prevence nefrotoxicity aminoglykosidů a amfotericinu
Je navrženo nepoužívat aminoglykosidová antibiotika pro léčbu infekcí, pokud jsou k dispozici jiné, méně nefrotoxické alternativy (2A).
Je navrženo, aby u pacientů s normální funkcí ledvin byly aminoglykosidy podávané v jedné denní dávce spíše než v režimu častějšího dávkování (2B).
Je doporučeno monitorovat hladinu aminoglykosidů, pokud jsou podávané ve více denních dávkách déle než 24 hodin (1A).
Je doporučeno monitorovat hladinu aminoglykosidů, pokud jsou podávané v jedné denní dávce déle než 48 hodin (2C).
Je navrženo topické nebo lokální podávání aminoglykosidů (např. inhalačně) spíše než i. v. aplikace, pokud je to proveditelné a vhodné (2B).
Je navrženo používat lipidové formy amfotericinu B spíše než konveční formy amfotericinu B (2A).
V léčbě systémových mykotických nebo parazitárních infekcí je doporučeno používat azolová antimykotika a/nebo echinokandiny spíše než amfotericin B, pokud lze očekávat srovnatelnou účinnost (1A).
Časná a správně zvolená antimikrobiální léčba (ve smyslu volby a dávky) patří mezi nejdůležitější určovatele mortality a morbidity kriticky nemocných pacientů v sepsi. Nesprávné dávkování antibiotik ohrožuje pacienty dvojím způsobem. Nedostatečná dávka je spojena s rizikem selhání léčby těžké infekce a vznikem rezistence, předávkování naopak s rizikem toxicity. Pacient s AKI v rámci multiorgánového selhání se v mnoha farmakokinetických ohledech zcela zásadním způsobem odlišuje od jiných patologických stavů. Příčinou je alterace řady fyziologických dějů, zejména zvýšení distribučního objemu (narušená propustnost kapilár a intenzivní tekutinová resuscitace), snížená vazba na bílkoviny (hypoproteinémie), změny distribuce a eliminace léku v souvislosti s hyperdynamickým stavem či naopak s dysfunkcí orgánů podílejících se na vylučování léku z organismu. Situace se stává ještě komplikovanější, pokud je při volbě dávky a dávkovacího intervalu antibiotik nutné zohlednit nejen současnou sníženou renální clearance léků, ale i jejich případnou eliminaci při použití různých metod mimotělních očišťovacích metod. Do hry tak vstupují další faktory, které mohou významně ovlivnit hladiny antibiotik a tím jejich účinnost. Patří mezi ně typ RRT (intermitentní, kontinuální, hybridní), princip očišťování krve (difuze, konvekce, jejich kombinace), dávka RRT (velikost efluentu, dialyzátu), způsob zařazení substitučního roztoku (prediluce, postdiluce), typ a velikost membrány (nízkopropustné, vysokopropustné), sieving koeficient a míra reziduální funkce ledvin. Je proto zřejmé, že doporučené dávkování antibiotik pro pacienty s chronickým selháním ledvin, kteří podstupují pravidelné hemodialýzační léčení, nelze aplikovat na uvedenou skupinu kriticky nemocných. Monitorování terapeutické hladiny léku (therapeutic drug monitoring, TDM) v plazmě je v současnosti jediným spolehlivým vodítkem k dosažení optimálního dávkovaní antimikrobiální léčby. Stanovení minimální hladiny před podáním (trough level) a vrcholové koncentrace po podání (peak level) je dnes rutinně dostupné pouze v případě léčby vankomycinem či aminoglykosidy, u kterých se ve značné míře kombinuje riziko poddávkování s rizikem toxicity. Gentamicin je typickým zástupcem skupiny antibiotik, pro jehož účinnost je rozhodující poměr maximální plazmatické koncentrace k MIC (concentration dependent, tj. maximální sérová koncentrace stanovená za 1 hodinu po podání by měla dosáhnout alespoň desetinásobku hodnoty MIC příslušného patogena). Postantibiotický efekt gentamicinu umožňuje nechat klesnout jeho hladiny před podáním další dávky do velmi nízkých hodnot, a tím minimalizovat riziko toxicity. V závislosti na renálním postižení je doporučeno zejména prodloužení dávkovacího intervalu na 48–72 hodin, zpravidla je nutná i redukce udržovací dávky. U intermitentních RRT je některými autory doporučeno podávat dávku gentamicinu před procedurou k dosažení dostatečné vrcholové koncentrace a navazující hemodialýzu využít ke korekci přetrvávající vysoké hladiny. Problémem podávání antibiotik tohoto typu je variabilita zejména kontinuálních náhrad funkce ledvin, které jsou často z řady důvodů přerušovány. Je vhodné, aby hemodialýza byla každý den zahájena vždy ve stejný čas, což nemusí být vždy klinicky indikované. Nevýhodou aminoglykosidů obecně je nefrotoxicita, zejména v koincidenci s dalšími inzulty, které jsou u septických pacientů téměř pravidlem. Při volbě antibiotik u septického pacienta bychom proto měli s postižením ledvin, či dokonce s potřebou RRT upřednostnit méně toxická antibiotika, u nichž jsou dostupné informace o způsobu jejich eliminace, úvodní dávce i o „empirické“ adaptaci udržovací dávky v případě porušené funkce ledvin či potřeby její náhrady. Situaci také ulehčí skutečnost, že aminoglykosidová antibiotika zpravidla nejsou nosnou kombinací antimikrobiální léčby kriticky nemocných. Pokud už je u této rizikové populace kriticky nemocných indikujeme pro jejich synergický účinek nebo v rámci úvodní širokospektré empirické kombinované léčby, lze jejich toxicitu limitovat zkrácením jejich podávání na dobu ne delší než tři dny či léčbu včas podle mikrobiologických výsledků deeskalovat. Topické, např. inhalační, podávání aminoglykosidů nelze považovat za ekvivalentní intravenózní léčbě. Tyto formy léčby je možné zvážit jako doplňkové například u ventilátorových nozokomiálních pneumonií nebo cystické fibrózy. Je škoda, že se doporučení nevěnují i dávkování jiných, častěji používaných a zatím nemonitorovatelných antimikrobiálních léků. Situace je však komplikována nedostatkem klinických studií, které by umožnily vést strategii antibiotické léčby na principech medicíny založené na důkazech.
Kontrastem indukované AKI (CI-AKI)
Definice a vyhodnocení rizika
Kontrastem indukované akutní poškození ledvin (CI-AKI) je dle některých zdrojů třetí nejčastější příčinou AKI u hospitalizovaných pacientů [9]. Přesto, že jde ve většině případů pouze o přechodné zhoršení funkce ledvin, je jeho vznik i v těchto případech spojen s nepříznivou krátkodobou i dlouhodobou morbiditou i mortalitou. Pracovní skupina nových doporučení se shodla, že je nutné sjednotit definici AKI. V literatuře často používaný pojem kontrastem indukovaná nefropatie (CIN) by proto měl být nahrazen pojmem kontrastem indukované AKI. Podobně je navrženo vycházet ze současné definice AKI, nikoliv z původního konsenzu, který za „CIN“ považoval vzestup S-kreatininu o ≥ 44 µmol/l či o 25 % bazální hodnoty v průběhu 48–72 hod při absenci jiných možných příčin.
U všech pacientů podstupujících intravenózní nebo intraarteriální kontrastní vyšetření vyhodnotit riziko pro CI-AKI, zejména přítomnost pre-existující poruchy renálních funkcí.
CI-AKI je do určité míry iatrogenní onemocnění. Incidence CI-AKI ve všeobecné populaci je nízká (2%), ale nápadně stoupá s přítomností rizikových faktorů. Obecně mohou být rizikové ukazatele CI-AKI vztaženy k populaci pacientů (diabetes, chronické onemocnění ledvin, chronické srdeční selhání apod.) nebo k vlastní proceduře (i. a. podání je spojeno s vyšším rizikem CI-AKI, typ a objem podané kontrastní látky, intravaskulární výkony spojené s rizikem ateroembolie, opakované podání kontrastu v intervalu do 48 hodin). Mezi nejvýznamnější rizikové faktory patří chronické onemocnění ledvin. Byť neexistuje žádný práh glomerulární filtrace, pod kterým by se riziko vzniku CI-AKI jednoznačně prudce zvyšovalo, experti pracovní skupiny se shodli, že riziko rozvoje CI-AKI je klinicky významné, pokud výchozí hodnota S-kreatininu je ≥ 115 µmol/l u mužů a ≥ 88 µmol/l u žen. Panel doporučuje implementaci preventivních opatření u pacientů s výchozí hodnotou odhadnuté glomerulární filtrace (eGFR) < 60 ml/min/1,73 m2. Pokud není recentní hodnota S-kreatininu dostupná, doporučuje panel ke zhodnocení rizika jednoduché vyšetření moči testovacími proužky na přítomnost bílkoviny. Dalšími rizikovými faktory jsou diabetes, hypertenze, srdeční selhání, pokročilý věk, hypovolémie, hemodynamická nestabilita, další nefrotoxická medikace, vysokoosmolární kontrastní látky. Nedostatečné důkazy existují pro doporučení vysadit ACE-I či ARB léky před kontrastním vyšetřením. Je doporučeno odložit opakované kontrastní vyšetření o 48 hodin u nerizikových pacientů a o 72 hodin u pacientů s diabetem či preexistujícím onemocněním ledvin. Panel překvapivě nedává doporučení k dalším preventivním opatřením, která by neměla u rizikových pacientů chybět – vysazení nefrotoxických a rizikových léků alespoň 24 hodin před vyšetřením (nesteroidní antirevmatika, diuretika, metformin, aminoglykosidy).
Zvážit alternativní zobrazovací metody u pacientů, kteří jsou v riziku CI-AKI.
U pacientů s vysokým rizikem CI-AKI je nutné vždy – s ohledem na výtěžnost – zvážit možnost provedení sonografického či nekontrastního CT vyšetření. Jinou nejčastěji klinicky zvažovanou alternativou zobrazovacích metod s vysokým rozlišením je magnetická rezonance. Panel však upozorňuje na nutnost zohlednit riziko rozvoje nefrogenní systémové fibrózy (NSF) u rizikových pacientů vystavených kontrastnímu vyšetření s gadoliniem. Kontraindikací k tomuto vyšetření jsou pacienti s GFR < 30 ml/min/1,73 m2 a důkladná rozvaha je nutná při GRF mezi 30–60 ml/min/1,73 m2. Podobně jako u jodových kontrastních látek je doporučeno používat nejmenší možné množství kontrastu a vyvarovat se opakovaného podání gadolinia. U pacientů na pravidelné dialýze panel doporučuje ke zvážení provedení intermitentní hemodialýzy po expozici gadoliniem (a následující 2 dny). Nicméně připouští, že tento preventivní postup nebyl dosud ověřen a vychází z farmakokinetiky gadolinia. Peritoneální dialýza gadolinium eliminuje minimálně.
Nefarmakologická a farmakologická prevence CI-AKI
Použít co nejmenší objem kontrastní látky u rizikových pacientů.
Je doporučeno použít izoosmolární nebo nízkoosmolární jodové kontrastní látky u pacientů v riziku CI-AKI (1A).
Je doporučena i. v. objemová expanze buď izotonickým fyziologickým roztokem, nebo bikarbonátem sodným u pacientů v riziku CI-AKI (1A).
Je doporučeno nepoužívat pouze perorální tekutiny u pacientů v riziku CI-AKI (1C).
Je navrženo používat perorální N-acetylcystein společně s izotonickým roztokem krystaloidů u pacientů v riziku CI-AKI (2D).
Je navrženo nepoužívat teofylin k prevenci CI-AKI (2C).
Je doporučeno nepoužívat fenoldopam k prevenci CI-AKI (1B).
Je navrženo nepoužívat profylakticky intermitentní hemodialýzu (IHD) nebo hemofiltraci (HF) k odstranění kontrastní látky u pacientů v riziku CI-AKI (2C).
Z mnoha testovaných preventivních přístupů lze jednoznačnou preventivní hodnotu přisoudit jen několika opatřením. Mezi ně patří parenterální hydratace, maximální redukce objemu podané kontrastní látky a používání nízko - nebo izoosmolárních látek. Zatím nelze jednoznačně určit preference z hlediska konkrétní volby izo - a nízkosomolárních kontrastních látek. Podobně nedostatečná jsou vodítka pro volbu typu tekutiny pro parenterální hydrataci, optimální dávku a interval jejich podávání. Většina studií však navrhuje zahájit podávání tekutin nejméně 1 hodinu před vyšetřením a pokračovat 3–6 hodin po aplikaci kontrastní látky. K dosažení dostatečné diuretické odpovědi (> 150 ml/h) v periprocedurálním období je však obvykle nutné použít krystaloidní roztoky dříve (3–12 hodin před vyšetřením) a pokračovat 6–12 hodin po podání kontrastu. Dávka podaných tekutin nutná k dosažení uvedeného cíle je obvykle (podle oběhové tolerance) ≥ 1 ml/kg/h. Volba typu tekutiny zůstává otevřená. Bylo pouze prokázáno, že izotonický „fyziologický“ roztok (0,9%) je účinnější než hypotonický (0,45%). Lze předpokládat, že stejného protektivního účinku lze dosáhnout použitím kteréhokoliv v současnosti dostupného izotonického balancovaného krystaloidního roztoku. Data na prospěšnost bikarbonátu sodného nejsou konzistentní. Nicméně v situacích, kdy z časového hlediska není možné zahájit rehydratační léčbu v dostatečném časovém odstupu před kontrastním vyšetřením, je přijatelnou alternativou podání 8,4% NaHCO3 150 ml v 750 ml 5% glukózy v dávce 3 ml/kg během 60 min před procedurou. Panel nedoporučuje samotnou p. o. hydrataci. Nicméně recentní studie kombinující orální hydrataci vodou s bikarbonátem neprokázala inferioritu tohoto postupu ve srovnání s parenterální hydratací [10]. Větší studie musí potvrdit spolehlivost těchto výsledků. Podobně nekonzistentní výsledky se týkají prospěšnosti perorálně podávaného N-acetylcysteinu (NAC). Přesto panel p. o. podávání NAC v kombinaci s hydratací (samotný NAC nenahrazuje hydratační režim!) doporučuje ke zvážení (úroveň doporučení 2D!), ale nespecifikuje dávkovací schéma. Pokud se k podání p. o. NAC rozhodneme, je zřejmě nejúčinnější podávat 1200 mg NAC 2krát denně, den před výkonem a v den výkonu (tj. celkem 4 dávky á 1200 mg). I když se panel celkem jednoznačně vyjadřuje k nepoužívání IHD nebo HF k prevenci CI-AKI (ale váha důkazů 2C), domnívám se, že v dialyzačních centrech je v případě elektivních výkonů u vybrané populace pacientů vhodná domluva s nefrologem. Kandidáty na provedení bezprostřední postprocedurální hemodialýzy mohou být pacienti s pokročilou chronickou dysfunkcí ledvin a již založeným cévním přístupem. Analogií je kriticky nemocný pacient s AKI, který vyžaduje náhradu funkce ledvin.
Dialyzační léčba AKI
Načasování zahájení a ukončení náhrady funkce ledvin (RRT, renal replacement therapy)
RRT zahájit bezprostředně v případě život ohrožujících změn v tekutinové, elektrolytové a acidobazické rovnováze.
Při rozhodování o zahájení RRT zvážit širší klinický kontext – přítomnost stavů, které mohou být prostřednictvím RRT modifikovány, a trend laboratorních výsledků, spíše než vycházet z izolovaných jednotlivých hodnot urey a kreatininu.
RRT ukončit pokud již není dále potřeba – buď z důvodů dostatečného stupně zotavení renálních funkcí, nebo protože pokračování RRT již není v souladu s cíli léčby.
Je navrženo nepoužívat diuretika k urychlení zotavení renálních funkcí nebo ke zkrácení doby či snížení frekvence RRT (2B).
Otázka optimálního načasování RRT zůstává ve světle nedostatků dat založených na seriózních důkazech stále nejednoznačná. Většina učebních textů uvádí jako absolutní indikace k zahájení RRT některé krajní situace, jakými jsou hyperkalémie (≥ 6,5 mmol/l), pokročilá azotémie (urea ≥ 35 mmol/l), urémie (encefalopatie, perikarditida), těžká acidóza (pH < 7,1), plicní otok. Tyto indikace, zejména arbitrárně zvolené hodnoty některých laboratorních ukazatelů, však nejsou obecně aplikovatelné u většiny nemocných pacientů s AKI, zejména v prostředí intenzivní péče. Existuje však značná variabilita v názorech na optimální načasování zahájení RRT. Do rozhodování o zahájení RRT vstupuje mnoho faktorů – názor lékaře, okolnosti konkrétního pacienta a v neposlední řadě i organizačně-logistické aspekty. Podstata diskuse nad optimálním načasování RRT u pacientů s AKI vychází z otázky, zda časnější napojení pacienta na RRT a z toho plynoucí rychlejší kontrola metabolické homeostázy, efektivnější kontrola volémie a v teoretické rovině i kontrola zánětlivé odpovědi může příznivě ovlivnit léčebný výsledek a prognózu pacientů. Obhájci zdrženlivější taktiky v indikaci k RRT argumentují riziky, která jsou s metodami RRT spojena (kanylace, antikoagulace, ztráty stopových prvků, vitaminů, aminokyselin, ovlivnění hladin antibiotik, bioinkompatibilita, cena) a tím, že časným napojením můžeme léčit pacienty, u kterých by došlo ke spontánní reparaci renálních funkcí a kteří by tudíž byli RRT zbytečně vystaveni. Klinické rozhodnutí týkající se indikace a načasování RRT se tak stává velmi komplexním dějem, který je umocněný absencí důkazů, podle kterých bychom mohli postupovat. Při rozhodování o zahájení RRT má zcela zásadní význam charakter základního onemocnění, které je příčinou AKI a reakce na úvodní léčbu. Je nezbytné odlišit izolované AKI od AKI, které je součástí akutního systémového onemocnění s víceorgánovým postižením (sepse, polytrauma, pooperační komplikace, popáleniny, pankreatitida apod.). Druhým problémem, který je nezbytné zohlednit při analýze dostupných studií, je definice „časného“ versus „pozdního“ načasování RRT, které jsou velmi heterogenní a subjektivní. Některé studie rozlišují časný versus pozdní přístup podle absolutních hodnot či relativních změn konvenčních biochemických ukazatelů (urea, kreatinin), úrovně diurézy, v jiných případech je načasování definováno intervalem od přijetí na jednotku intenzivní péče do doby napojení na RRT. Tyto významné limitace dramaticky snižují výpovědní hodnotu dosud provedených studií. Velmi problematické je posuzování indikace k RRT pouze podle hodnot urey či kreatininu. Jejich absolutní hodnoty jsou u kriticky nemocných ovlivněny řadou proměnných. Hodnoty urey jsou zkresleny významnou změnou distribučního objemu, zvýšenou produkcí, katabolickým stavem, zvýšenou tubulární reabsorpcí. Podobně sérové hodnoty kreatininu jsou ovlivněny mj. jeho produkcí (snížena např. u sepse), zkresleny intenzivní tekutinovou resuscitací (diluce podhodnocující absolutní hodnoty). Ve svém důsledku absolutní hodnoty těchto biochemických ukazatelů nemusí odrážet koncentraci jiných (uremických) toxinů ani skutečný stav renálních funkcí. I z těchto důvodů nejsou vhodnými kritérii k definování časné versus pozdní RRT léčby. Zásadní úlohu při úvaze o zahájení RRT má vyhodnocení stavu pacienta, trendu vývoje onemocnění, jeho odpovědi na úvodní léčbu a zohlednění kontextu případné víceorgánové dysfunkce. Nepříznivý vývoj hemodynamické situace (šokový stav), progredující metabolická acidóza, trvající oligurie, rozvoj multiorgánové dysfunkce, k diuretikům rezistentní tekutinové přetížení, jsou okolnosti, které tvoří základní klinický argument pro zahájení RRT, zcela nezávisle na absolutních hodnotách sérové urey či kreatininu. I když načasování RRT zůstává přísně individuální, nikdy bychom neměli dopustit, aby indikací k RRT byl rozvoj uremických komplikací vzniklých odkládáním RRT. Očišťovací metodu lze (někdy přechodně) ukončit, pokud jsou známky klinického zlepšování a dochází k obnově diurézy.
Antikoagulace u RRT
U pacientů s AKI vyžadujících RRT vychází rozhodnutí o volbě antikoagulace RRT z vyhodnocení poměru rizika a přínosu plynoucích z antikoagulace.
- Je doporučeno používat antikoagulaci během RRT u AKI, pokud nemá pacient zvýšené riziko krvácení nebo porušenou koagulaci a současně nedostává systémovou antikoagulaci (1B).
Pro pacienty bez zvýšeného rizika krvácení, bez poruchy koagulace a nemocné nedostávající účinnou systémovou antikoagulaci je navrženo následující:
- K zajištění antikoagulace intermitentních procedur je doporučeno používat buď nefrakcionovaný, nebo nízkomolekulární heparin než jiné antikoagulanty (1C).
- K zajištění antikoagulace kontinuálních procedur (CRRT) je doporučeno používat citrátovou regionální antikoagulaci spíše než heparin, pokud nejsou přítomny kontraindikace pro citrát (2B).
- K zajištění antikoagulace během CRRT je navrženo v případě kontraindikace k citrátu používat buď nefrakcionovaný, nebo nízkomolekulární heparin spíše než jiné antikoagulanty (2C).
Pro pacienty se zvýšeným rizikem krvácení je navrženo následující:
- V průběhu CRRT je navrženo používat citrátovou regionální antikoagulaci spíše než žádnou antikoagulaci, pokud nejsou kontraindikace k citrátu (2C).
- V průběhu CRRT je navrženo nepoužívat regionální heparinizaci u pacientů se zvýšeným rizikem krvácení (2C).
- U pacientů s heparinem indukovanou trombocytopenií (HIT) musí být podávání všech heparinů ukončeno a je doporučeno používat během RRT přímé inhibitory trombinu (např. argatroban) nebo inhibitory faktoru Xa (např. danaparoid nebo fondaparinux) (1A).
- U pacienta s HIT, který nemá těžké jaterní selhání, je navrženo během RRT použít argatroban spíše než jiný inhibitor trombinu nebo faktoru Xa (2C).
Použití RRT je obvykle spojené s nutností použití antikoagulace, jejímž cílem je zabránit vysrážení krve v mimotělním oběhu, optimalizovat délku použitelnosti filtru a zabránit krevním ztrátám způsobeným vysrážením krve v okruhu. Neopominutelnou skutečností je též zbytečný nárůst nákladů na mimotělní eliminaci tam, kde je třeba často provádět výměny setů a filtrů. Největším rizikem použití antikoagulace se systémovým účinkem jsou krvácivé komplikace. V běžné klinické praxi máme několik možností, jak nesrážlivost v mimotělním okruhu dosáhnout. Patří k nim především systémová antikoagulace nefrakcionovaným heparinem či nízkomolekulárním heparinem, regionální citrátová antikoagulace či provedení RRT bez použití jakéhokoliv antikoagulancia. Volba konkrétního antikoagulancia je výsledkem rovnováhy mezi jeho bezpečností, efektivitou, praktičností použití a cenou. Použití jednorázové dávky nízkomolekulárního heparinu (LMWH) je již formulované pro chronicky dialyzované pacienty (European Best Practice Guidelines). I když studie u pacientů s AKI chybí, používání LMWH se postupně stává zlatým standardem pro intermitentní procedury i u této populace pacientů, pokud nejsou přítomny kontraindikace. Jejich efektivita stran udržení průchodnosti mimotělního okruhu je srovnatelná s nefrakcionovaným heparinem, podle některých autorů je dokonce lepší. U pacientů s AKI je nezbytné vždy počítat s rizikem akumulace LMWH při opakovaném podávání. V těchto případech je indikované monitorování anti-Xa aktivity.
Preferenční používání citrátové regionální antikoagulace u kontinuálních metod RRT (CRRT) je jedním ze skutečně nových a významných doporučení v předloženém textu KDIGO. Dosud bylo systémové podávání heparinu považováno za antikoagulaci volby u většiny pacientu vyžadujících CRRT. Na rozdíl od heparinu zajišťuje regionální citrátová antikoagulace signifikantně delší životnost mimotělního okruhu (a tím i nižší náklady na spotřební materiál, krevní produkty při opakovaném předčasném vysrážení okruhu, práci personálu), je spojena s významně nižším rizikem krvácivých komplikací a heparinem indukované trombopenie. Podávání citrátu ale může mít významné metabolické důsledky (metabolická alkalóza, hypernatrémie, hypokalcémie, hypomagnezémie). Všechny uvedené metabolické komplikace jsou však zcela minimalizovány, pokud je citrátová antikoagulace metodicky dobře zvládnuta a protokolována. Klinicky jednoduché použití citrátu poskytují některé komerční systémy pro metody CVVH, které umožňují flexibilní, účinné a bezpečné používání této metody. Jako hlavní kontraindikace citrátové antikoagulace uvádí doporučení pokročilé jaterní selhání a šok s hypoperfuzí. Důvodem je riziko kumulace citrátu (porucha jeho metabolizace na bikarbonát dysfunkčními játry) a výsledná metabolická acidóza a hypokalcémie. Recentní studie však ukazují, že pokud je citrátová antikoagulace prováděna erudovaným personálem, je nejen účinná, ale i dostatečně bezpečná i u nemocných s akutním selháním jater [11]. Podmínkou je pečlivé metabolické sledování. Především je doporučeno sledovat v krvi nemocného nejen hladinu ionizovaného kalcia, ale také hladinu celkového kalcia a z těchto pak vypočítávat poměr Ca celkové/Ca2+. Pokud je tento poměr vyšší než 2,5, je velmi pravděpodobná kumulace citrátu. I když je regionální citrátová antikoagulace v uvedeném textu KDIGO doporučena, zejména pro pacienty s rizikem krvácení, existuje však mnoho dobrých argumentů, pro které je citrát stále hojněji využíván i u obecné populace kriticky nemocných. Na základě více než 13letých zkušeností [12] tuto metodu využíváme velmi efektivně a bezpečně nejen k zajištění kontinuálních, ale i intermitentních hemodialyzačních metod. Je rovněž suverénní metodou k zajištění bezproblémového průběhu plazmaferéz, především u nemocných s vysokým rizikem krvácení (např. difuzní alveolární hemoragie apod.).
Cévní přístup pro RRT u AKI
Je navrženo zahájit RRT u pacienta s AKI cestou netunelizovaného dialyzačního katétru (2D).
Při volbě cévního přístupu zvážit tyto preference:
- První volba: pravá jugulární žíla
- Druhá volba: femorální žíla
- Třetí volba: levá jugulární žíla
- Poslední volba: subklaviální žíla s preferencí dominantní strany
Je doporučeno zavádět dialyzační katétry pod sonografickou kontrolou (1A).
Je doporučeno provést RTG plic ihned po kanylaci a před prvním použití katétru ve vnitřní jugulární a subklaviální žíle (1B).
Je navrženo nepoužívat topická antibiotika v místě zavedeného netunelizovaného dialyzačního katétru na jednotkách intenzivní péče (2C).
Je navrženo nepoužívat antibiotické zátky k prevenci katétrové infekce u netunelizovaného dialyzačního katétru (2C).
Funkční cévní přístup je základem pro adekvátní realizaci RRT. Na trhu je řada typů dialyzačních katétrů určených pro akutní dialýzu. Nelze učinit žádné doporučení z hlediska preference jednoho typu nad ostatními. Obecným cílem je, aby katétr umožnil dosažení dostatečného krevního průtoku (méně významné u citrátové antikoagulace) s minimální recirkulací. Konec katétru má být umístěn ve velké žíle, což vyžaduje délku 12–15 cm pro katétry zavedené do pravé vnitřní jugulární žíly a 16–24 cm pro femorální přístup. Zevní průměr používaných katétrů se pohybuje od 11 do 14 Fr. Východiskem pro doporučení vyhnout se subklaviálnímu přístupu je snaha zabránit stenózám centrální žíly a znemožnění případného následného permanentního přístupu. Vyšší riziko infekčních komplikací nebylo potvrzeno u femorálních katétrů, je zde ale vyšší frekvence malfunkcí a v případě použití krátkých katétrů i recirkulací. Femorální přístup by měl být z důvodu možného rizika vzniku stenózy ilické žíly pečlivě zvážen u kandidátů k transplantaci ledvin. Konfirmace polohy katétrů zavedených do horní duté žíly je nutné k ověření správné polohy (junkce horní duté žíly a pravé síně, ne pravá síň – riziko síňové perforace a tamponády, vyloučení postpunkčních komplikací – pneumotorax). Nepoužívat topická antibiotika v místě zavedeného dialyzačního katétru na jednotkách intenzivní péče vychází ze studií, poukazujících na vyšší incidenci mykotických infekcí a vznik antimikrobiální rezistence. Ze stejného důvodu nejsou doporučeny antibiotické zátky.
Dialyzační membrány používané pro RRT u AKI
Je navrženo používat dialyzátory s biokompatibilními membránami pro IHD i CRRT u pacientů s AKI (2C).
„Biokompatibilními“ (správněji „méně bioinkompatibilními“, protože žádný typ membrán není plně biokompatibilní) membránami jsou membrány na bázi polysulfonu, polymetylmetakrylátu, polyakrylonitrilu. Tyto membrány jsou spojeny s nižší aktivitou komplementu, menší produkcí cytokinů, produktů oxidačního stresu a aktivace destiček. Nelze určit, který typ syntetických membrán je nejvýhodnější. Za zlatý standard jsou obvykle považovány polysulfonové membrány. V případě použití membrán AN-69 je nutné upozornit na riziko syndromu uvolnění bradykininu (hypotenze, plicní kongesce), především u pacientů s výraznou acidózou a u nemocných léčených ACE-I inhibitory. Závazné stanovisko nelze rovněž zaujmout k používání vysokopropustných membrán. Metaanalýzy dostupných studií neshledaly jednoznačný přínos těchto membrán u pacientů s AKI. Použití RRT stávajícími metodami a membránami rovněž nelze doporučit, pokud by byly využívány čistě za účelem odstranění zánětlivých mediátorů.
Modalita a substituční roztoky pro RRT u AKI
Kontinuální a intermitentní metody RRT používat jako komplementární léčbu AKI.
Je navrženo používat CRRT spíše než IHD u hemodynamicky nestabilních pacientů (2B).
Je navrženo používat CRRT spíše než IHD u AKI pacientů s akutním poraněním mozku nebo s jinými příčinami zvýšeného nitrolebního tlaku či generalizovaného otoku mozku (2B).
Je navrženo používat bikarbonát spíše než laktát jako nárazník v dialyzačním či substitučním roztoku pro RTT u pacientů s AKI (2C).
Je doporučeno používat bikarbonát spíše než laktát jako nárazník v dialyzačním či substitučním roztoku pro RTT u pacientů s AKI a cirkulačním šokem (1B).
Je navrženo používat bikarbonát spíše než laktát jako nárazník v dialyzačním či substitučním roztoku pro RTT u pacientů s AKI a jaterním selháním a/nebo s laktátovou acidózou (2C).
Pro výběr způsobu náhrady funkce ledvin u kriticky nemocných opět neexistují jednoznačná doporučení. Nejsou k dispozici ani přesvědčivá data, která by ukazovala, že kontinuální procedury (CRRT) jsou jednoznačně lepší než procedury intermitentní (intermitentní dialýza, IHD). Žádná z dosud dostupných velkých studií totiž neprokázala, že by se klinický výsledek u intermitentních i kontinuálních metod jednoznačně lišil (mortalita, morbidita) – samozřejmě za podmínky, že je danou metodou zajištěna dostatečná metabolická a hemodynamická kontrola. Volba modality musí být přizpůsobena klinické situaci, dostupnosti metod a zkušenostem pracoviště. Kontinuální (CRRT) nebo hybridní metody (SLED, sustained, low-efficiency dialysis) jsou fyziologicky výhodnější, zejména v případě hemodynamické nestability, umožňují efektivní kontrolu tekutinové bilance, azotémie, acidobazické a elektrolytové rovnováhy a měly by být preferovány u pacientů s otokem mozku, těžkým dekompenzovaným srdečním selháním, u nemocných s fulminantním selháním jater a ARDS. IHD je indikována u nemocných s těžkou symptomatickou hyperkalémií a u nemocných s život ohrožujícími intoxikacemi dialyzovatelným jedem, kde je nezbytné docílit co nejrychlejší eliminace toxinu. IHD je též často používána jako náhrada funkce ledvin po ukončení CRRT po stabilizaci nemocného (tedy jakási forma odvykání z metody). Výhody a nevýhody IHD a CRRT shrnují tabulky 3 a 4. Volba jednotlivých modifikací CRRT (tj. CVVH, CVVHD, CVVHDF) pravděpodobně neovlivňuje klinický výsledek, rozhodující je adekvátnost RRT. Doporučení týkající se typu substitučního roztoku vycházejí ze studií, které demonstrovaly lepší korekci acidózy, nižší hladinu laktátu a lepší hemodynamickou toleranci roztoků na bázi bikarbonátu, zejména u nemocných s cirkulačním šokem a jaterní dysfunkcí.
Tab. 4. Výhody a nevýhody použití IHD 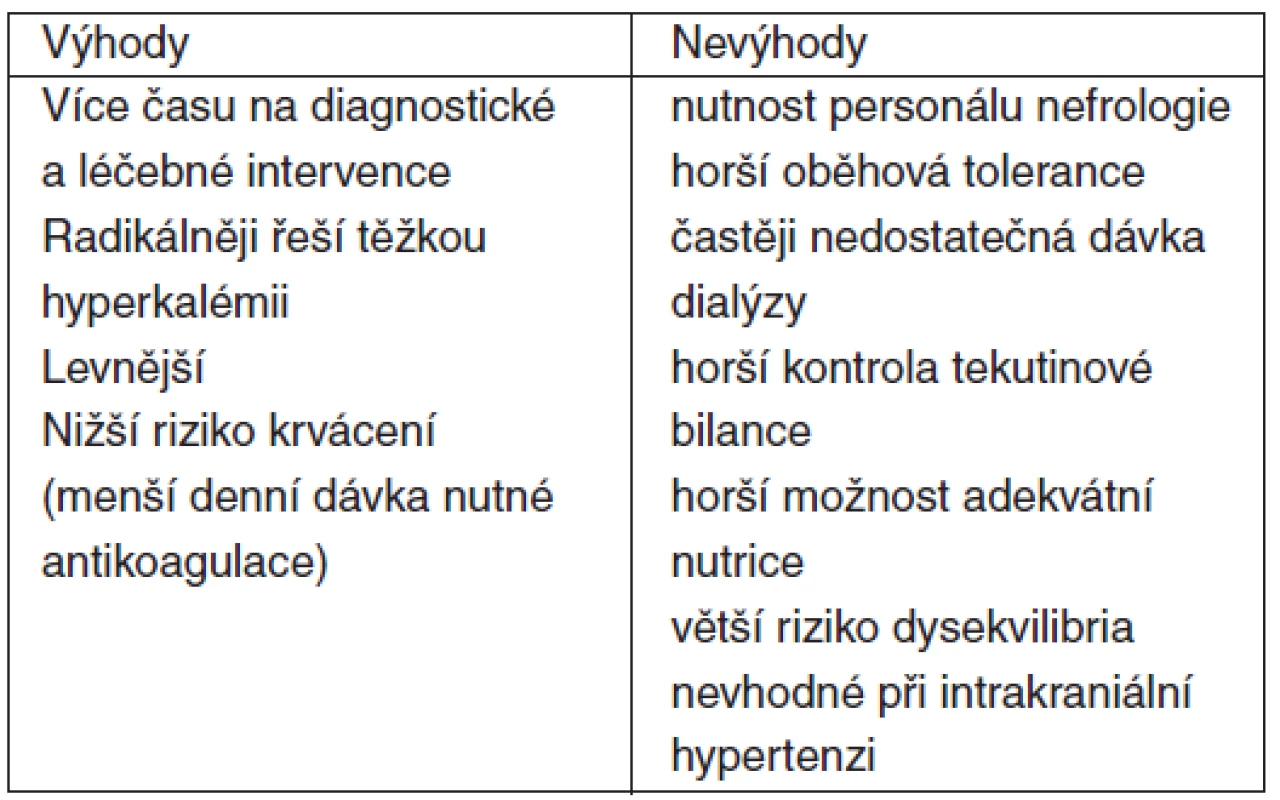
Tabulka 4. Výhody a nevýhody použití CRRT 
Dávka RRT u AKI
Dávka RRT by měla být předepsána před zahájením každé procedury RRT. Je doporučené časté vyhodnocení skutečně realizované dávky, aby mohla být preskripce dávky adekvátně upravena (1B).
Poskytovat RRT tak, aby byly dosaženy cíle pro elektrolyty, acidobázi, soluty a tekutinovou bilanci.
Při použití intermitentních a extendovaných RRT u AKI je doporučeno dosáhnout Kt/V 3,9/týden (1A).
Při použití CRRT u AKI je doporučen objem efluentu 20–25 ml/kg/h (1A). Ke skutečnému dosažení této dávky je obvykle nutná vyšší předepsaná dávka.
V současnosti již existují konzistentní data ze dvou velkých multicentrických randomizovaných studií [13, 14], které neprokázaly, že je zvyšováním intenzity CRRT nad 20–25 ml/kg/h (vyjadřuje objem efluentu) dosaženo přídatného prospěchu pro kriticky nemocné s AKI. V případě intermitentních a extendovaných dialýz studie neprokázaly lepší mortalitu či zotavení renálních funkcí zvyšováním Kt/V nad 3,9 nebo při dosažení plazmatických hladin urey pod 15 mmol/l. Hodnocení adekvátnosti dialýzy, vyjádřené poměrem Kt/V, je však na rozdíl od pacientů s CKD značné limitované u pacientů s AKI. Tito pacienti jsou metabolicky nestabilní, s velkou variabilitou produkce urey. Navíc jejich distribuční objem urey pravděpodobně překračuje objem celkové tělesné vody. Bylo by však chybnou interpretací, kdybychom z formulovaných doporučení vyvodili závěr, že pro nemocné s AKI (zejména v podmínkách intenzivní péče) není dávka RRT důležitá a kdybychom absenci pozitivního vlivu vysoce intenzivních forem RRT vnímali jako argument k toleranci „neadekvátnosti“ či poddávkování RRT. V tomto kontextu je zásadním faktorem dávka skutečně dodaná, nikoliv pouze předepsaná! Předepsaná dávka se může od reálné významně lišit, především díky častému přerušování kontinuálních metod na podkladě vysrážení okruhu, transportu pacientů na operační sál či k diagnostickým procedurám. Ve většině studií byly vždy skutečné dávky menší než předepsané (obvykle méně než 85 %). Na jednotkách intenzivní péče bychom měli strategii náhrady funkce ledvin vždy přizpůsobit individuálním potřebám kriticky nemocných. Cílem není vždy odstranění uremických toxinů, ale také kontrola acidobáze, kalémie, katabolismu či tekutinové bilance.
Závěr
Rostoucí incidence a závažné důsledky AKI jsou oprávněným důvodem k intenzivnímu hledání a uplatňování opatření, která brání jeho rozvoji, snižují míru již vzniklého poškození ledvin či urychlují jeho zotavení. Z tohoto pohledu přichází KDIGO s velmi aktuálním dokumentem, jehož cílem je kritické zhodnocení dosavadních důkazů a formulace doporučení pro klinickou praxi zaměřená na širokou problematiku AKI. Publikovaná doporučení bezesporu odhalují řadu oblastí, na které dosud neznáme odpověď. Často obecné formulace a stanoviska expertů mohou být pro informované odborníky určitým zklamáním. Naopak jiné oblasti denní praxe může klinik postrádat (specifické formy AKI jako například kardiorenální či hepatorenální syndrom, rabdomyolýza, dávkování léků u AKI, stanovisko k novým biomarkerům AKI apod.). Přesto jsem přesvědčen, že předložený dokument má významný potenciál příznivě ovlivnit kvalitu péče poskytovanou nemocným s AKI. Podpůrným dokladem jejich potřebnosti jsou studie, které ukazují, že dodržováním jednoduchých opatření lze v nemocnicích zabránit nejméně 30 % případů AKI. Jsou to především včasná a dostatečná objemová náhrada, rychlá korekce hypotenze, přerušení a/nebo vyvarování se nefrotoxických léků a včasné rozpoznání pacientů v riziku.
Poděkování: Podpořeno výzkumným záměrem MSM 0021620819 „Náhrada a podpora funkce některých životně důležitých orgánů“.
Článek byl primárně uveřejněný v časopise Aktuality v nefrologii, roč. 18, 2012, supplementum 1, s. 52–62 (otištěno v AIM se souhlasem vydavatele a autora).
Do redakce došlo dne 12. 6. 2012.
Do tisku přijato dne 25. 7. 2012.
Adresa pro korespondenci:
Prof. MUDr. Martin Matějovič, Ph.D.
I. interní klinika, UK v Praze, LF v Plzni
Fakultní nemocnice Plzeň
Husova 3
305 06 Plzeň
Zdroje
Matějovič, M. Desatero akutního selhání ledvin. Postgraduální medicína, 2011, vol. 13, příl. 3, s. 27–34.
2. Matejovic, M., Chvojka, J., Radej, J., Ledvinova, L., Karvunidis, T., Krouzecky, A., Novak. I. Sepsis and acute kidney injury are bidirectional. Contrib. Nephrol., 2011, 174, p. 78–88.
3. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney inter., Suppl. 2012, 2, p. 1–138.
4. Černý, V., Matějovič, M., Dostál, P. Vybrané doporučené postupy v intenzivní medicíně. Praha: Maxdorf, 2009, 255 s.
5. Prowle, J. R., Echeverri, J. E., Ligabo, E. V., Ronco, C., Bellomo, R. Fluid balance and acute kidney injury. Nat. Rev. Nephrol., 2010, 6, 2, p. 107–115.
6. Reinhart, K., Perner, A., Sprung, C. L., Jaeschke, R., Schortgen, F., Johan, Groeneveld, A. B., Beale, R., Hartog, C. S. Consensus statement of the ESICM task force on colloid volume therapy in critically ill patients. Intensive Care Med., 2012, 38, 3, p. 368–383.
7. van den Berghe, G., Wouters, P., Weekers, F. et al. Intensive insulin therapy in the critically ill patients. N. Engl. J. Med., 2001, 345, p. 1359–1367.
8. Griesdale, D. E., de Souza, R. J., van Dam, R. M. et al. Intensive insulin therapy and mortality among critically ill patients: a meta-analysis including NICE-SUGAR study data. CMAJ, 2009, 180, p. 821–827.
9. Goldfarb, S., McCullough, P. A., McDermott, J., Gay, S. B. Contrast-induced acute kidney injury: specialty-specific protocols for interventional radiology, diagnostic computed tomography radiology, and interventional cardiology. Mayo Clin. Proc., 2009, 84, p. 170–179.
10. Cho, R., Javed, N., Traub, D. et al. Oral hydration and alkalinization is noninferior to intravenous therapy for prevention of contrast-induced nephropathy in patients with chronic kidney disease. J. Interv. Cardiol., 2010, 23, p. 460–466.
11. Faybik, P., Hetz, H., Mitterer, G., Krenn, C. G., Schiefer, J., Funk, G. C., Bacher, A. Regional citrate anticoagulation in patients with liver failure supported by a molecular adsorbent recirculating system. Crit. Care Med., 2011, 39, 2, p. 273–279.
12. Šrámek, V., Novák, I., Matĕjovič, M., Rokyta, R., Nalos, M., Hora, P., Pittrová, H. Continuous venovenous hemodiafiltration (CVVHDF) with citrate anticoagulation in the treatment of a patient with acute renal failure, hypercalcemia, and thrombocytopenia. Intensive Care Med., 1998, 24, 3, p. 262–264.
13. RENAL Replacement Therapy Study Investigators, Bellomo, R., Cass, A., Cole, L., Finfer, S., Gallagher, M., Lo, S., McArthur, C., McGuinness, S., Myburgh, J., Norton, R., Scheinkestel, C., Su, S. Intensity of continuous renal-replacement therapy in critically ill patients. N. Engl. J. Med., 2009, 361, p. 1627–1638.
14. VA/NIH Acute Renal Failure Trial Network, Palevsky, P. M., Zhang, J. H., O’Connor, T. Z., Chertow, G. M., Crowley, S. T., Choudhury, D., Finkel, K., Kellum, J. A., Paganini, E., Schein, R. M., Smith, M. W., Swanson, K. M., Thompson, B. T., Vijayan, A., Watnick, S., Star, R. A., Peduzzi, P. Intensity of renal support in critically ill patients with acute kidney injury. N. Engl. J. Med., 2008, 359, p. 7–20.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Předoperační vyšetřeníČlánek Zemřel MUDr. Vladimír Lemon
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2012 Číslo 5- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Jak důležitá je role specifických aminokyselin ve výživě kriticky nemocných?
- Sugammadex z pohledu medicíny založené na důkazech
- Současný koncept mozkové oximetrie v kardiochirurgii dospělých
- Nová role a renesance rozvětvených aminokyselin v intenzivní péči
- Perforovaný peptický vřed – předoperační rizika, pooperační morbidita a mortalita, profylaxe v intenzivní péči a doporučení
- KDIGO doporučení pro akutní poškození ledvin 2012 – komentovaný výběr z doporučení
- Předoperační vyšetření
- Co je kalcifylaxe aneb proč nemáme suplementovat kalcium u pacientů s hyperfosfatémií a fosfáty u pacientů s hyperkalcémií?
- Difficult Airway Society Guidelines for the management of tracheal extubation
- Doporučení pro ochranu očí v průběhu celkové anestezie
- Doporučený postup před zahájením anesteziologické péče
- Zemřel MUDr. Vladimír Lemon
- Zápis z jednání výboru č. 3/2012
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Perforovaný peptický vřed – předoperační rizika, pooperační morbidita a mortalita, profylaxe v intenzivní péči a doporučení
- Doporučení pro ochranu očí v průběhu celkové anestezie
- Sugammadex z pohledu medicíny založené na důkazech
- Zemřel MUDr. Vladimír Lemon
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy