-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nová role a renesance rozvětvených aminokyselin v intenzivní péči
New role and rennaisance of branched chain aminoacids in intensive care
The branched chain amino acids valine, leucine and isoleucine are essential nutrients with more than nutritional effects. They are important mediators and structural components in proteosynthesis and they regulate hormonal functions. Leucine is a precursor in cholesterol synthesis and as such plays an important role in muscle tissue growth and in sarcopenia suppression. Older and recent data are reviewed and support wider utilization of branched chain amino acids in intensive care.
Keywords:
branched chain amino acids – valine – leucine – izoleucine – sarcopenia – catabolism – beta-hydroxy beta-methylbutyrate – critical condition
Autoři: Zadák Zdeněk; Hyšpler Radomír; Tichá Alena
Vyšlo v časopise: Anest. intenziv. Med., 23, 2012, č. 5, s. 253-258
Kategorie: Intenzivní medicína - Přehledový článek
Souhrn
Rozvětvené aminokyseliny valin, leucin, izoleucin patří mezi esenciální nutrienty, které mají větší než jen nutriční význam. Jsou důležitými mediátory a stavebními složkami v proteosyntéze, regulují hormonální funkce. Leucin je prekurzorem v syntéze cholesterolu a touto cestou hraje důležitou úlohu ve výstavbě svalové tkáně a při potlačení sarkopenie. V krátkém přehledu jsou demonstrovány starší i nová data opravňující širší využití rozvětvených aminokyselin, zejména v intenzivní péči.
Klíčová slova:
rozvětvené aminokyseliny – valin – leucin – izoleucin – sarkopenie – katabolismus – beta-hydroxy-beta-methyl-butyrát – kritické stavyÚvod
Závažný katabolismus a proteino-energetická malnutrice je velmi častým projevem kritických pacientů na jednotce intenzivní péče [1]. Diagnostická hranice mezi proteino-energetickou malnutricí a proteinovou malnutricí (kwashiorkorovým typem) je sice neostrá, ale klinicky negativní důsledky obou typů jsou nepochybné a role esenciálních aminokyselin je zřetelná.
Přes určitý kritický přístup v minulosti se jeví rozvětvené aminokyseliny valin, leucin a izoleucin (VLI) velmi důležitým faktorem nejen jako esenciální substrát pro syntézu tělesných proteinů, ale také jako farmakonutrient, který zasahuje do několika metabolických směrů jak v oblasti syntézy a katabolismu bílkovin, tak do regulace lipidomu (syntéza cholesterolu a jeho prekurzorů). V oblasti syntézy a katabolismu proteinů se uplatňují rozvětvené aminokyseliny, zejména v proteosyntéze ve svalové tkáni, kde působí při přenosu aminoskupiny, vzniku alfa-ketoglutarátu a při tvorbě glutamátu a rozvětvených ketokyselin [2]. V tomto bodě se působení rozvětvených aminokyselin cestou glutamátu podílí na syntéze glutaminu, který je významnou součástí svalové bílkoviny [3, 4]. Transaminace postupuje dále, když za přítomnosti pyruvátu je enzymaticky aminoskupina poskytnuta rozvětvenými aminokyselinami k vytváření alaninu. Metabolismus VLI a ketokyselin je uveden na obrázku 1.
Obr. 1. Metabolismus VLI (valin, leucin, izoleucin) a ketokyselin 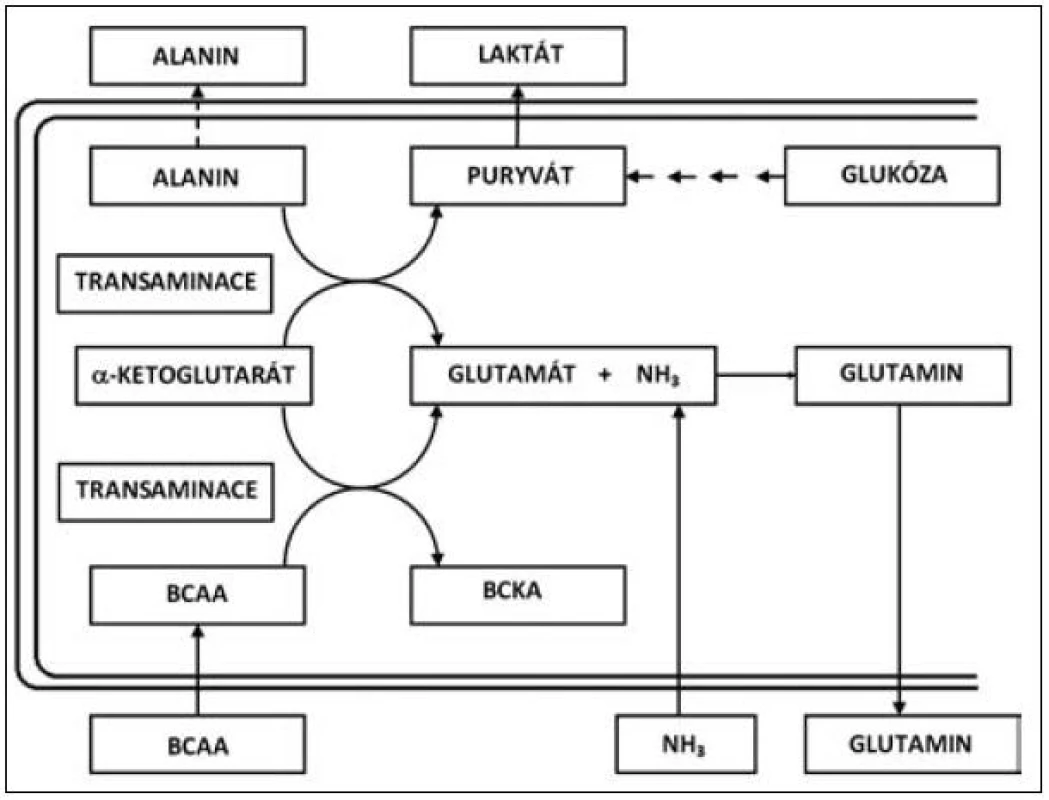
Oxidace tří rozvětvených aminokyselin (leucin, izoleucin a valin) se liší v základních energetických reakcích. Uhlíkový skelet každé z těchto aminokyselin sleduje specifickou metabolickou cestu, v níž leucin je výhradně ketogenický, izoleucin je ketogenický i glukogenický, zatímco valin směřuje pouze do glukoneogeneze. První krok oxidace rozvětvených aminokyselin VLI je vyjmutí aminoskupiny transaminací specifickými transaminázami (aminotransferázami). Leucin specifické transaminázy jsou rozdílné pro játra a mozek (izoenzym II a III), izoenzym I je obsažen ve všech tkáních. Zatímco izoenzym I a III zajišťuje transaminaci všech tří rozvětvených aminokyselin, izoenzym II je specifický pro leucin. Izoenzym II (leucin aminotransferáza) je v největší míře obsažen ve svalových buňkách a podílí se částečně na syntéze cholesterolu, který je nutný pro výstavbu membrány svalové buňky. Transaminace l-leucinu, l-izoleucinu a l-valinu vede ke vzniku kyseliny alfa-ketoizokapronové, alfa-keto-beta--metylvalerové a alfa-ketoizovalerové, jak je patrné z metabolismu těchto aminokyselin uvedených na obrázku 2. Schopnost tkání oxidovat rozvětvené aminokyseliny, zejména leucin, je v různých tkáních velmi odlišný.
Obr. 2. Metabolismus glutaminu a alaninu 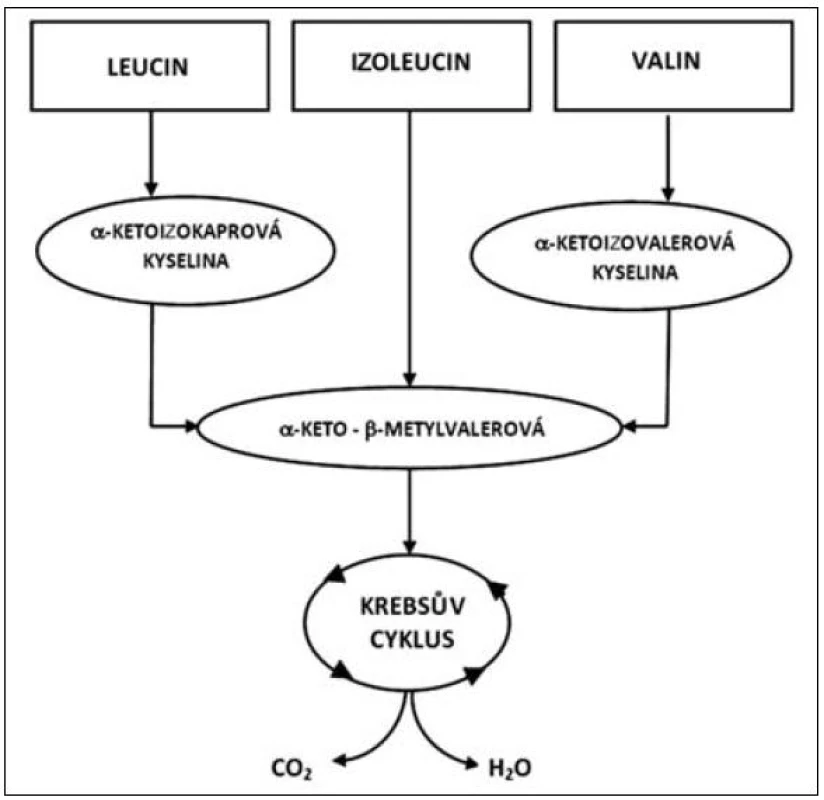
Jako hlavní místo degradace rozvětvených aminokyselin VLI jsou pokládána játra [5]. Zvláštní roli však v metabolismu VLI zaujímá svalstvo, a to jak z hlediska proteinového katabolismu, tak i z hlediska syntézy proteinů. Rozvětvené aminokyseliny slouží jako nespecifický substrát pro oxidaci a zejména jsou metabolitem určeným pro získání energie ve svalu, ale také pro svalovou proteosyntézu. Z tohoto hlediska Nieler a Holden [6] prokazují, že podstatná část aminokyselin VLI je oxidována extrahepaticky. Oxidace rozvětvených aminokyselin v bráničním svalu odpovídá pro izoleucin přibližně 60 % a valin 31 %. Svalová hmota, která zaujímá přes 40 % tělesné hmotnosti je hlavním místem pro oxidaci leucinu a z tohoto hlediska je leucin a zřejmě i ostatní rozvětvené aminokyseliny významným zdrojem energie pro svalový stah. V katabolických stavech rozvětvené aminokyseliny velmi významně redukují hypermetabolismus, tlumí katabolismus svalové tkáně a zvyšují proteosyntézu ve svalstvu. Navíc v rámci celotělové energetické rovnováhy jsou VLI konvertovány do alternativních energetických zdrojů, jako jsou ketolátky a glutamin (viz obr. 1) [7, 8].
Obecně z klinického hlediska, zejména u těžce katabolických, polytraumatizovaných a septických pacientů jsou prokázány následující příznivé účinky VLI v aminoroztocích pro parenterální výživu [4]:
- Zlepšení dusíkové rovnováhy a retence proteinového dusíku.
- Stimulace proteosyntézy.
- Zlepšení bilance viscerálního proteinu ve smyslu převažující proteosyntézy a snížení proteinového katabolismu.
- V důsledku zlepšení proteosyntézy posílení imunitních funkcí.
- Normalizace plazmatického aminogramu.
Glutamin a metabolismus rozvětvených aminokyselin
Glutamin a alanin mají velmi důležitou roli v kritických stavech, kdy syntéza těchto aminokyselin je mimořádně stimulována a hraje důležitou roli pro energetickou rovnováhu organismu [4, 9]. Navíc glutamin je naprosto nezbytný pro tvorbu bílkovin a proliferaci buněk v aktivních tkáních, jako je střevo a kostní dřeň. Glutamin je rovněž důležitým pilířem v udržení acidobazické rovnováhy a umožňuje přenos energie mezi orgány. Alanin je mimo jiné důležitým prekurzorem v procesu glukoneogeneze v katabolickém stavu a při rozvoji systémové zánětlivé reakce. Je zřejmé, že v průběhu proteinového katabolismu a především při proteolýze v kosterním svalu se uvolňuje velké množství rozvětvených aminokyselin VLI, které jsou nepostradatelné pro syntézu glutaminu a alaninu. Provázání metabolických vztahů mezi rozvětvenými aminokyselinami – valinem, leucinem a izoleucinem na jedné straně a vznikem glutaminu a alaninu je prezentováno na obrázku 1. Zmíněné schéma zároveň ukazuje mechanismus, jakým je fixován NH3 při jaterní insuficienci [10].
Metabolická odezva na stres je charakterizována významným poklesem syntézy proteinů a zvýšeným proteinovým katabolismem s celkově negativní dusíkovou bilancí.
Vliv VLI na aminogram a syntézu albuminu
Dostupnost VLI ve výživě ovlivňuje dysbalanci aminogramů a zároveň je důležitým regulátorem syntézy plazmatických proteinů, především albuminu. Aminokyseliny VLI mají schopnost spustit proteosyntézu v různých buňkách, především však v hepatocytu; klíčovou molekulou pro tento děj je mTOR (mammalian target of rapamycin). Aktivovaný mTOR spouští proteosyntézu albuminu za spoluúčasti inzulinu a stimuluje zejména proteosyntézu ve svalu a v játrech. Leucin podporuje syntézu proteinů přinejmenším dvěma signálními cestami, rapamycin senzitivní cestou a další, ne zcela objasněnou cestou stimulující proteosyntézu především ve svalové tkáni. Nejnověji bylo prokázáno, že silný vliv na syntézu nejen albuminu, ale také dalších proteinů jako transferinu, má leucin cestou stimulace a inhibice mTOR [11].
Schopnost stimulovat proteosyntézu mediátorovou cestou má z VLI v největší míře leucin, ale lehký stimulační účinek byl pozorován i u izoleucinu a valinu [12].
Potřeba aminokyselin je nejvyšší u pacientů s výrazným stresem (polytrauma, sepse, rozsáhlý chirurgický výkon, ozáření). Vzhledem k tomu, že těžký katabolismus proteinů je současně spojen s imunosupresí, je velmi důležitá syntéza glutaminu a alaninu, které jsou vytvořeny transaminací uhlíkového skeletu s aminoskupinami z rozvětvených aminokyselin valinu, leucinu a izoleucinu. Tyto rozvětvené aminokyseliny jsou při stresové zátěži ireverzibilně degradovány a v tomto procesu nemohou být znovu utilizovány pro nezbytnou proteosyntézu. Je též dobře známo, že degradace svalového proteinu je řízená prozánětlivými mediátory – cytokiny.
Vedle regulačního účinku rozvětvených aminokyselin VLI, zejména v potlačení sarkopenie a při proteosyntéze svalových bílkovin, má význam suplementace leucinu na sekreci prolaktinu a inzulinu. Rozvětvené aminokyseliny jsou zcela nepostradatelné v katabolismu a při hladovění u pacientů s diabetem, kdy oxidace glukózy je potlačena. Během hladovění mají rozvětvené aminokyseliny i mediátorový účinek na uvolnění alaninu a glutaminu jako hlavních prekurzorů pro glukogenezi v játrech a ledvinách. Předpokládá se, že pyruvát je nevhodný akceptor aminoskupiny, a proto jej zastupuje alfaketoglutarát.
Schopnost tkání oxidovat rozvětvené aminokyseliny, zejména leucin, se velmi liší. Potenciál pro oxidaci aminokyselin VLI a především leucinu postupuje v řadě: ledviny > mozek > tuková tkáň > sval > játra [4].
Význam VLI pro pozitivní proteinovou bilanci a potlačení sarkopenie
Preference mastných kyselin svalovou buňkou k získání energetické rovnováhy a významná anapleróza využívající ketolátky má za následek lepší utilizaci tuku a úsporu VLI pro syntézu bílkovin. Toto je jeden z více mechanismů, který je zaměřen na ochranu svalové hmoty v průběhu různých akutních i chronických onemocnění a v průběhu stárnutí. Schopnost leucinu stimulovat syntézu svalové bílkoviny se však s postupujícím věkem výrazně snižuje, přinejmenším klesá schopnost leucinu stimulovat mTOR metabolický mechanismus. Tento mechanismus vede k závěru, že dieta bohatá na leucin může stimulovat syntézu svalového proteinu a pomáhá zachovat svalovou hmotu v katabolismu a ve stáří. Zejména v poslední době je tento mechanismus zdůrazňován v boji proti sarkopenii ve stáří a kritických stavech [3, 13, 14].
Podávání rozvětvených aminokyselin VLI na noc má příznivý význam nejen na zlepšení poruch centrálního nervového systému, ale zároveň snížený odpad trimetylhistidinu v nočním období, jasně svědčí o potlačení katabolismu a zpomalení procesu sarkopenie. Recentní studie tak ukazují zlepšení klinické situace, zejména u malnutričních pacientů s poruchou proteosyntézy. Role rozvětvených aminokyselin VLI stoupá, zejména u osob se sníženou tolerancí proteinů při jaterním selhání v kombinaci s malnutricí a katabolickým stavem.
Metabolismus VLI a lipidů v katabolickém stavu
Sepse je dobře známá příčina katabolismu proteinů a aminogram v sepsi se pravidelně vyznačuje deplecí VLI. Podání endotoxinu v experimentu vytvoří septický obraz včetně poklesu koncentrací aminokyselin v plazmě s výraznou deplecí leucinu. V experimentu aktivace imunitního systému antigeny, které pocházejí z bakterií, virů a sójového proteinu, mají negativní vliv na proteosyntézu a růst tkání, avšak zvyšují tělesné zásoby tuku. Tento obraz se podobá situaci při nízkoproteinové dietě. Podobně je dobře známý mechanismus, kdy při nízkobílkovinné dietě dochází ke zvýšené akumulaci tělesného tuku a tato situace může být obrácena zvýšeným přívodem biologicky hodnotného proteinu. Tímto způsobem reaguje organismus také při nádorové kachexii a při urémii, kde dochází k významnému zvýšení oxidace VLI, poklesu rozvětvených aminokyselin v aminogramu a k rychlému úbytku svalové hmoty. Zvýšená stimulace tyreoidálními hormony podporuje proteosyntézu v játrech, ale potlačuje tvorbu bílkovin ve svalové tkáni. Potlačení oxidace VLI patří mezi významné faktory zlepšující proteosyntézu a regeneraci tkání. Z hlediska energetické rovnováhy hrají zvláštní a důležitou úlohu triacylglyceroly se středním řetězcem (MCT). Představují substrát, který zvyšuje oxidaci leucinu, tím jeho spotřebu, a snižuje dostupnost leucinu pro syntézu bílkovin. Z klinického hlediska proto MCT v kombinaci se sacharidy selhávají v prevenci kardiomyopatie, rabdomyolýzy, svalové slabosti a sarkopenie.
Nutriční a farmakologická role leucinu, jeho metabolitů HMB (beta-hydroxy - -beta-methyl-butyrátu) v ovlivnění lipidomu a potlačení sarkopenie
Leucin je významným prekurzorem, který zasahuje do syntézy cholesterolu. Role leucinu se uplatňuje zejména při syntéze a metabolismu beta-hydroxy-beta-methyl-butyrátu (HMB), kterému se přičítá významný imunomodulační účinek a také zásadní úloha v tvorbě svalové tkáně. U osob podrobených svalovému tréninku suplementace HMB vedla ke zvýšení svalové hmoty o 50 % s podobným zvýšením svalové síly ve srovnání s kontrolní skupinou. Vedle příznivého účinku na vzestup svalové hmoty bylo pozorováno snížení svalového poškození při spojení s intenzivním cvičením. Efekt je vysvětlován vzestupem syntézy hydroxy-metyl-butyryl-koenzymu-A vlivem HMB jako prekurzoru. Zvýšená tvorba HMB z leucinu zvyšuje syntézu cholesterolu ve svalové tkáni, která je nezbytným předpokladem pro tvorby myocytů a jejich buněčných membrán. HMB vzniká výhradně z leucinu a je nezbytným prekurzorem cholesterolu pro strukturu a správnou funkci myocytů [2]. Model účinku leucinu a jeho metabolitu hydroxy-methyl-butyrátu znázorňuje obrázek 3.
Obr. 3. Vliv leucinu na tvorbu HMB (beta-hydroxy-beta-metyl-butyrátu) a sarkopenie 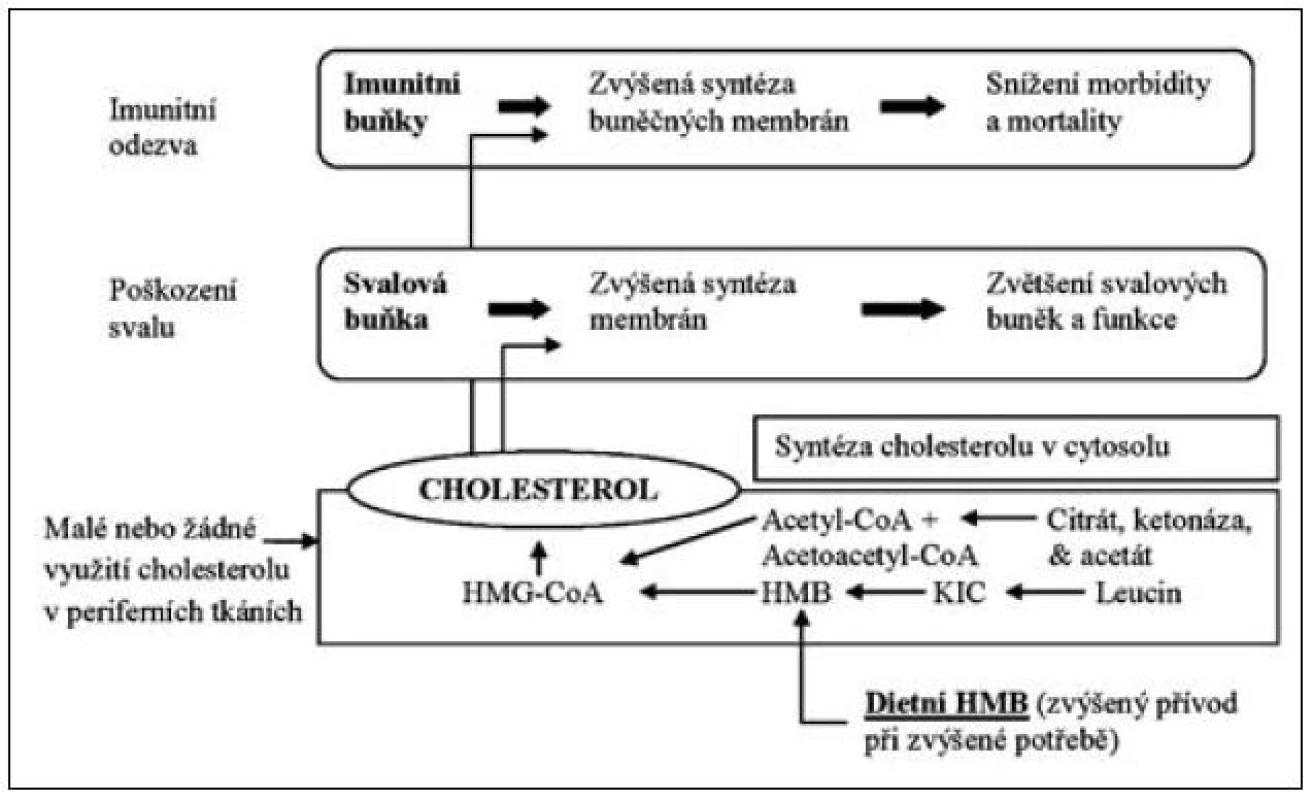
Leucin tímto způsobem významně zasahuje do struktury a funkce lipidomu, je obligatorním metabolitem lipidového metabolismu a je pravděpodobně i klíčem, jakými inhibitory syntézy cholesterolu mohou působit toxicky na příčně pruhovaný sval a být zdrojem poruch od minimální svalové léze až po rabdomyolýzu.
VLI a jaterní funkce
Použití VLI u jaterního selhání a dekompenzované jaterní cirhózy sice prodělalo několik vln kritiky, ale dnes se názor na použití VLI v parenterální i enterální výživě poměrně ustálil. Etiopatogeneze jaterního selhání je široká a složitá. Jaterní selhání zaujímá různé typy toxického poškození jater akutního charakteru, důsledky akutního i chronického postižení jaterního parenchymu v průběhu hepatitid a konečně metabolické a klinické důsledky omezení jaterních funkcí při cirhóze jater a její dekompenzaci [15].
Na celkovém obrazu jaterní cirhózy, která se klinicky manifestuje rozvojem portokavální encefalopatie, se podílí celá skupina vlivů.
Klíčovou roli v patogeneze portokavální encefalopatie sehrává hyperamonémie. Amonný iont vznikající výhradně v průběhu intracerebrální syntézy glutaminu má za následek poškození astrocytů a gangliových buněk CNS. Poškození mozkových buněk je způsobeno přímo nebo nepřímo (excitotoxicky) a energetickým deficitem [10]. Dalším mechanismem je porucha aminogramu. S tím souvisí glutamát-ergický a GABA-ergický přenos nervového vzruchu [17].
V současné době se pokládá za odůvodněné podání VLI v parenterální výživě i v enterální výživě v situacích jaterního selhání, které se vyvíjí do portokavální encefalopatie. Podobně je podání VLI indikováno jako léčba již vzniklé encefalopatie při akutním poškození jaterního parenchymu i při dekompenzaci jaterní cirhózy. Podání přípravků VLI je zdůvodněno v doporučeních Evropské společnosti parenterální a enterální výživy a je klasifikováno stupněm doporučení „A“ [17].
Použití VLI po transplantaci kostní dřeně
Částečná parenterální výživa v časném posttransplantačním období a úplná parenterální výživa neprokázala celkově při standardním použití zlepšení nutričního stavu. Výjimku tvoří speciální parenterální výživy obohacené VLI, kde byl výsledek lepší, než u standardní parenterální výživy [18].
Rozvětvené aminokyseliny VLI u operačního a popáleninového traumatu
Rozvětvené aminokyseliny jsou oxidovány převážně v periferních tkáních, zejména ve svalové tkáni, více než v játrech. Valin, leucin a izoleucin vychytaný v kosterním svalstvu představují primárně přenos dusíku cestou transaminace pro tvorbu glutaminu a alaninu. Spotřeba glutaminu hraje zásadní úlohu u stresovaných jedinců a alanin je důležitý jako zdroj energie pro glukoneogenezi v játrech, zvláště tehdy, když jsou po traumatu zásoby glykogenu v játrech vyčerpány. Oxidace ketokyselin značí, že lidský kosterní sval zásobují VLI jak energií, tak dusíkem. V reakci na těžké popáleninové trauma je transfer dusíku do glutaminu a alaninu klíčovým dějem spíše než pouhá tvorba energie. Vzhledem k tomu, že experimentální studie i klinické studie jsou v některém ohledu rozporné, je nutné doplnit tato data před definitivním závěrem o účinku VLI v léčbě popáleninového traumatu [19, 20].
Závěr
Nejnovější studie věnované roli VLI, zejména však leucinu v parenterální i enterální výživě u závažných a kritických stavů vedou evidentně k revizi přístupu v jejich použití. V metaanalýze provedené ESPEN v roce 2009 sice podávání VLI zlepšilo stav vědomí u nemocných s hepatálním selháním, avšak neovlivnilo celkovou mortalitu tohoto typu nemocných. To vedlo k dočasnému odklonu od VLI. Ani tomuto bodu však není dosud jasný závěr a je nutné jej revidovat. Podávání aminokyselin VLI při portokavální encefalopatii tak jednoznačně zůstává podle směrnic ESPEN jako doporučení stupně A [17].
Zcela nová a mimořádně důležitá situace se však objevila v poslední době, pokud jde o užitečnost aminokyselin VLI při potlačení sarkopenie v kritickém stavu, polytraumatu, při nádorové kachexii a při sepsi. Leucin jako prekurzor beta-hydroxy-beta-methyl-butyrátu se jeví významným metabolicko-nutričním faktorem nezbytným k udržení energetické rovnováhy i svalové hmoty a imunitní odpovědi (viz obr. 3), takže je důležitým faktorem při zvládnutí katabolického stavu kritického pacienta.
Jedním z důvodů pro intenzivní katabolismus proteinů ve stresovém stavu a infekci je vystupňovaná imunitní aktivita, která je závislá na dostatečném přívodu glutaminu a alaninu. Jejich produkce vyžaduje přenos aminoskupiny z aminokyselin VLI, které jsou pro tento účel nevratně katabolizovány, nemohou být reutilizovány pro výstavbu svalů a musí být nahrazeny jinou cestou.
Rozvětvené aminokyseliny VLI významným způsobem snižují riziko progrese toxické jaterní léze různé etiologie, předcházejí jaternímu selhání a snižují tím mortalitu.
Role VLI, především leucinu, se jeví jako nepostradatelná v tvorbě ketolátek (leucin, izoleucin) a glukózy v procesu glukoneogeneze (izoleucin, valin) – viz obr. 1. Vedle toho ovlivnění tryptofan-niacinové cesty a regulační efekt na působení inzulinu a prolaktinu demonstruje i metabolickou důležitost VLI, především leucinu.
Renesance použití a případně vývoj nových formulí rozvětvených aminokyselin se jeví jako nezbytné.
Práce byla podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace „00179906“ a grantem Ministerstva průmyslu a obchodu FR-TI3/496.
Do redakce došlo 4. 5. 2012.
Do tisku přijato 30. 6. 2012.
Adresa pro korespondenci:
Prof. MUDr. Zdeněk Zadák, CSc.
Centrum pro výzkum a vývoj FN
Sokolská tř. 581
500 05 Hradec Králové
e-mail: zadak@fnhk.cz
Zdroje
1. Ozgultekin, A., Turan, G., Durmus, Y., Dincer, E., Akgun, N. Comparison of the efficacy of parenteral glutamine and branched-chain amino acid solutions given as extra supplements in parallel to the enteral nutrition in head trauma. Clin. Nutr., 2008, 3, 3, p. 211–216.
2. Nissen, S., Abumrad, N. Nutritional role of the leucine metabolite beta-hydroxy beta-methylbutyrate (HMB). Nutr. Biochem., 1997, 8, 6, p. 300–311.
3. Harris, R. A., Joshi, M., Jeoung, N. H. Mechanism responsible for regulation of branched-chain amino acid catabolism. Biochem. Biophys. Res. Commun., 2004, 33, 2, p. 391–396.
4. Lal, H., Chugh, K. Metabolic and regulatory effects of branched chain amino acid supplementation. Nutr. Res., 1995, 15, 11, p. 1717–1733.
5. Holecek, M. Three targets of branched-chain amino acid supplementation in the treatment of liver disease. Nutrition, 2012, 26, 5, p. 482–490.
6. Freund, H. R., Hanani, M. The metabolic role of branched-chain amino acids. Nutrition, 2002, 18, 3, p. 287–288.
7. Marchesini, G. et al. Nutritional supplementation with branched-chain amino acids in advanced cirrhosis: A double-bind, randomized trial. Gastroenterology, 2003, 124, 7, p. 1792–1801.
8. Merli, M., Nicolini, G., Angeloni, S., Riggio, O. Malnutrition is a risk factor in cirhotic patients undergoing surgery. Nutrition, 2002, 18, 17, p. 978–986.
9. Kim, H. Glutamine as an imunonutrient. Yonsei med. J., 2011, 52, 6, p. 892–897.
10. Leweling, H. et al. Hyperamoemia-induced depletion of glutamate and branched-chain amino acids in muscle and plasma. J. Hepatol., 1996, 25, 5, p. 756–762.
11. Ijichi, Ch., Matsumura, T., Tsuji, T., Eto, Y. Branched-chain amino acids promote albumin synthesis in rat primary hepatocytes through the mTOR signal transduction system. Biochem. Biophys. Res. Commun., 2003, 303, 1, p. 59–64.
12. Yoshizawa, F. New therapeutic strategy for amino acid medicine: notable functions of branched chain amino acids as biological regulators. J. Pharmacol. Sci., 2011, 118, 2, p. 149–155.
13. Kim, J. S., Wilson, J. M., Lee S. R. Dietary implications on mechanism of sarcopenia: roles of protein, amino acids and antioxidants. J. Nurl. Biochem., 2012, 21, 1, p. 1–13.
14. Nicastro, H. et al. Does branched-chain amino acids supplementation modulate skeletal muscle remodeling through inflammation modulation? Possible mechanisms of Action. J. Nutr. Metab., 2012, 2012, 1, p. 1–10.
15. Chanda, S., Mehendale, H. Role of nutrition in the survival after hepatotoxic injury. Toxicology, 1996, 111, 1–3, p. 163–178.
16. Kondrup, J. Nutrition in end stage liver disease. Best Pract. Res. Clin. Gastroenterol., 2006, 20, 3, p. 547–560.
17. Plauth, M. et al. ESPEN guidelines on parenteral nutrition: Hepatology. Clin. Nutr., 2009, 28, 4, p. 436–444.
18. Hwang, T. L., Chiang, Ch. L., Wang, P. N. Parenteral nutrition support after bone marrow transplantation: comparison of total and partial nutrition during the early posttransplantation period. Nutrition, 2001, 17, 9, p. 773–775.
19. King, P., Power, D. Branched chain amino/keto acid supplementation following severe burn injury: a preliminary report. Clin. Nutr., 1990, 9, 4, p. 226–230.
20. De Bandt, J. P., Cynober, L. Therapeutic use of branched-chain amino acids in burn, trauma, and sepsis. J. Nutr., 2006, 136, 1 suppl, p. 308S–313S.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Předoperační vyšetřeníČlánek Zemřel MUDr. Vladimír Lemon
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2012 Číslo 5- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Jak důležitá je role specifických aminokyselin ve výživě kriticky nemocných?
- Sugammadex z pohledu medicíny založené na důkazech
- Současný koncept mozkové oximetrie v kardiochirurgii dospělých
- Nová role a renesance rozvětvených aminokyselin v intenzivní péči
- Perforovaný peptický vřed – předoperační rizika, pooperační morbidita a mortalita, profylaxe v intenzivní péči a doporučení
- KDIGO doporučení pro akutní poškození ledvin 2012 – komentovaný výběr z doporučení
- Předoperační vyšetření
- Co je kalcifylaxe aneb proč nemáme suplementovat kalcium u pacientů s hyperfosfatémií a fosfáty u pacientů s hyperkalcémií?
- Difficult Airway Society Guidelines for the management of tracheal extubation
- Doporučení pro ochranu očí v průběhu celkové anestezie
- Doporučený postup před zahájením anesteziologické péče
- Zemřel MUDr. Vladimír Lemon
- Zápis z jednání výboru č. 3/2012
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Perforovaný peptický vřed – předoperační rizika, pooperační morbidita a mortalita, profylaxe v intenzivní péči a doporučení
- Doporučení pro ochranu očí v průběhu celkové anestezie
- Sugammadex z pohledu medicíny založené na důkazech
- Zemřel MUDr. Vladimír Lemon
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



