-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Jak do praxe aplikovat výsledky klinických studií?
Practical application of the results of clinical trials
Intensive Care Medicine is a field in which the outcome depends on many factors. Clinical trials are required to assess the impact of various interventions on outcome. They form the fundamentals of evidence-based medicine but knowing their limitations is necessary for their proper application in clinical practice. Personalized medicine is defined as clinical management based on evidence-based medicine individually tailored to each patient and their response to previous interventions.
KEYWORDS:
clinical trials – evidence based medicine – personalized medicine
Autoři: P. Sklienka 1,2; J. Žvaka 1; R. Kula 1,2
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava 1; Katedra intenzivní medicíny, urgentní medicíny a forenzních oborů, Lékařská fakulta, Ostravská univerzita 2
Vyšlo v časopise: Anest. intenziv. Med., 28, 2017, č. 3, s. 168-175
Kategorie: Intenzivní medicína - Speciální článek
Souhrn
Intenzivní medicína je obor, ve kterém výsledek léčby (outcome) závisí na mnoha faktorech. Pro posouzení vlivu jednotlivých intervencí na výsledek léčby je nezbytné ověření v klinických studiích. Klinické studie jsou základem medicíny založené na důkazech, ale pro jejich správnou aplikaci v praxi je nezbytná znalost jejich limitací. Personalizovaná medicína je definovaná jako způsob péče, kdy je léčba poskytovaná na základě medicíny založené na důkazech a individuálně přizpůsobená aktuálnímu stavu pacienta a jeho odpovědi na předchozí intervence.
Klíčová slova:
klinické studie – medicína založená na důkazech – personalizovaná medicínaÚVOD
Intenzivní medicína – definovaná jako péče o pacienty s rozvinutými nebo akutně hrozícími orgánovými dysfunkcemi – je jednou z nejmladších medicínských specializací. Následkem medicínského a technického pokroku se v rozvinutých zemích od druhé poloviny 20. století zvyšuje průměrný věk obyvatelstva a stoupá počet i závažnost komorbidit v populaci. Rozvoj na poli diagnostických (laboratorních, zobrazovacích) metod v oblasti podpory a náhrady životních funkcí (umělá plicní ventilace, eliminační metody, invazivní hemodynamické monitorování, neuroinvazivní monitoring a další), pokroky v oblasti farmakologie (z nichž nejvýznamnější je zavedení antibiotické léčby do rutinní praxe) a v neposlední řadě pokroky v oblasti organizace zdravotní péče a edukace personálu jsou základními kameny dynamického rozvoje intenzivní medicíny. Tyto faktory zároveň podmiňují vzestup počtu vulnerabilních pacientů ohrožených selháváním vitálních funkcí a vyžadujících hospitalizaci v intenzivní péči. Podle dostupných demografických údajů má počet pacientů vyžadujících hospitalizaci na lůžkách intenzivní péče trvale vzestupnou tendenci [1]. Mortalita v celkové populaci kriticky nemocných pacientů dosahuje 16,2 % v průběhu léčby na jednotkách intenzivní péče, část pacientů dále umírá po propuštění z intenzivní péče na lůžkách standardních oddělení. Celková nemocniční mortalita kriticky nemocných pacientů tak dosahuje 22,4 % a je významně vyšší než mortalita pacientů, kteří hospitalizaci na ARO/JIP nevyžadují [2].
Vzhledem k relativně krátké historické zkušenosti s péčí o nemocné se selhávajícími životními funkcemi se intenzivní medicína ve svých začátcích rozvíjela na základech postupů tradičních medicínských oborů – chirurgie, interní medicíny, pediatrie a neurologie. Vzhledem k tomu, že rychlý rozvoj intenzivní medicíny přinášel nové, do té doby nepoužívané léčebné postupy, byla péče o kriticky nemocné ve svých začátcích mnohdy charakterizována postupy spíše empirickými – založenými na soudobém poznání fyziologie, farmakologie a na zkušenostech přebraných ze základních oborů – než na postupech s účinností ověřenou klinickými studiemi. Je nesporným faktem, že rozvoj intenzivní medicíny umožnil pacientům s diagnózami předtím neléčitelnými přežívání s dobrou kvalitou následného života. Entuziasmus ze zavádění nových léčebných postupů a jejich účinnosti je však pravidelně následován poznáním, že každá metoda kromě nesporného přínosu představuje pro pacienty i radikální zásah do homeostázy organismu, a může tak představovat značné riziko zpravidla závislé na intenzitě použitých intervencí. Pro optimální klinickou aplikaci nových postupů je tedy nezbytné ověřování jejich skutečné účinnosti jak ve vztahu k postupům používaným v minulosti, tak i k jejich potenciálním nežádoucím účinkům. Taktéž je nezbytné ověřování skutečné efektivity zavedených léčebných intervencí, neboť řada z nich je používána historicky spíše na základě empirické zkušenosti než na základě současných vědeckých poznatků. Klinické studie jsou v tomto kontextu nezbytným nástrojem pro každodenní rozhodování o stanovení léčebného plánu u lůžka kriticky nemocného. Na základě výsledků klinických studií jsou dále stavěny léčebné protokoly i doporučení odborných společností pro klinickou praxi. Klinické studie se tak stávají základním pilířem medicíny založené na důkazech (Evidence Based Medicine – EBM).
Zavádění výsledků klinických studií do denní praxe s sebou přináší množství otázek a není odbornou veřejností přijímáno vždy bezvýhradně. Aplikace výsledků studií bez ohledu na faktory vyplývající z individuality pacienta a na kontext probíhajícího onemocnění byla renomovanými autory identifikována jako jedna ze zásadních chyb, kterých se v intenzivní medicíně dopouštíme (tab. 1) [3].
Tab. 1. Deset chyb, kterých se dopouštíme v intenzivní medicíně. Body 1, 2 a 6 přímo souvisejí s klinickými studiemi a aplikací jejich výsledků do klinické praxe [3] ![Deset chyb, kterých se dopouštíme v intenzivní medicíně. Body 1, 2 a 6 přímo souvisejí s klinickými studiemi a aplikací jejich výsledků do klinické praxe [3]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f00882c79b198508df886a7f01d42dd5.png)
Skepse do značné míry vyplývá i ze skutečností, že v současné době je kvůli změnám v přístupu některých vydavatelství (především tzv. „predátorská periodika“ uveřejňující po zaplacení „recenzního“ poplatku de facto jakoukoliv práci bez řádného recenzního řízení) publikována řada nekontrolovatelných studií se závažnými metodologickými nedostatky. Ačkoliv základem jakéhokoliv vědeckého experimentu má být opakovatelnost postupu, kdy za stejných podmínek má být dosaženo identického výsledku, v oblasti intenzivní medicíny jsme pravidelně svědky publikování protichůdných výsledků studií zabývajících se stejnou problematikou. Ke zhodnocení skutečného efektu intervence a k dosažení závěru pro klinickou praxi je proto nezbytné provedení metaanalýz a systematických přehledů dané problematiky. Bohužel, v posledních letech není výjimečné ani publikování rozdílných výsledků metaanalýz zabývajících se danou problematikou, čímž dochází k dalšímu matení odborné veřejnosti (jako v případě užití humánního albuminu [4–7]). Všechny uvedené fakty mohou být pro kliniky značně frustrující a vést k nihilistickému postoji ve smyslu „stejně to vyjde pokaždé jinak“. I přes uvedené problémy je nutné zdůraznit, že klinické studie jsou nezbytným základem správně prováděné péče, nicméně je nutné znát limity jejich interpretace a zavádění do rutinní praxe.
LIMITY KLINICKÝCH STUDIÍ
APLIKACE VÝSLEDKŮ PREKLINICKÉHO VÝZKUMU DO KLINICKÉ PRAXE
Mnohé intervence s nadějnými výsledky ve fázi animálního modelu nejsou v humánních studiích potvrzeny. Mezi hlavní příčiny obtížné interpretace preklinických studií do humánní medicíny patří skutečnost, že zatímco na animálních modelech jsou často všechny subjekty geneticky příbuzné, v dobré zdravotní kondici a vyvolávající inzult mívá stejnou intenzitu a etiologii (např. modely sepse – ligatura a punkce céka; modely ARDS – instilace kyseliny olejové do plic; modely hemoragického šoku apod.), léčebné intervence jsou zahajovány ve stejných časových a patofyziologických konsekvencích vzhledem k inzultu. Naopak v klinických studiích (a běžné praxi) většinou ani jednu z uvedených podmínek nelze reprodukovat, neboť se setkáváme s pacienty různých ras, pohlaví, věku, komorbidit, v různé fázi průběhu onemocnění a mnohdy se značně odlišnou etiologií a patofyziologií onemocnění.
VSTUPNÍ KRITÉRIA PRO ZAŘAZENÍ PACIENTA DO STUDIE
Kritéria pro zařazování do klinických studií v intenzivní medicíně jsou nejčastěji odvozena od vstupních skórovacích škál (např. APACHE II), základního onemocnění (např. pneumonie), od symptomů společných pro řadu základních onemocnění (např. ARDS, sepse nebo akutní selhání ledvin), od definovaných klinických a laboratorních parametrů (např. střední arteriální tlak; hodnota hemoglobinu apod.) nebo kombinací výše uvedených parametrů. Pro zařazování pacientů do klinických studií na základě vstupních skórovacích škál platí, že žádná z těchto škál nepostihuje patofyziologii probíhajícího procesu a nebyla primárně určena k predikci cílů frekvenčně sledovaných ve studiích (např. 28denní mortalita) [8]. Zařazování pacientů do studií na základě společných symptomů má úskalí ve skutečnosti, že tyto symptomy jsou obvykle definovány velice široce a představují spíše pozdní orgánové změny vznikající následkem inzultů různé etiologie [9]. Zařazování pacientů do studií na základě pouhých společných symptomů bylo definováno jako další ze zásadních chyb, kterých se v intenzivní medicíně dopouštíme (tab. 1). Pro potřeby zařazování pacientů do klinických studií je proto potřebné lépe definovat (na základě dalších laboratorních nebo klinických parametrů) populace pacientů, u kterých lze předpokládat benefit zkoumané intervence (obr. 1) [10]. Tato pravidla mají platnost nejen v případě klinických studií, ale především v naší denní praxi, kdy pečlivé zhodnocení klinického průběhu, laboratorních parametrů a odpovědi na zavedené intervence umožňují přesné pochopení aktuálních problémů a následné navržení optimálního léčebného protokolu – „personalizovanou medicínu“.
Obr. 1. Stupeň individualizace léčby na základě přesného definování skupin pacientů, u kterých je předpoklad efektivity sledované intervence. Na základě ověření účinnosti a bezpečnosti postupu klinickou studií je možné aplikovat jej v klinické praxi u pacientů s přesně definovanou charakteristikou. 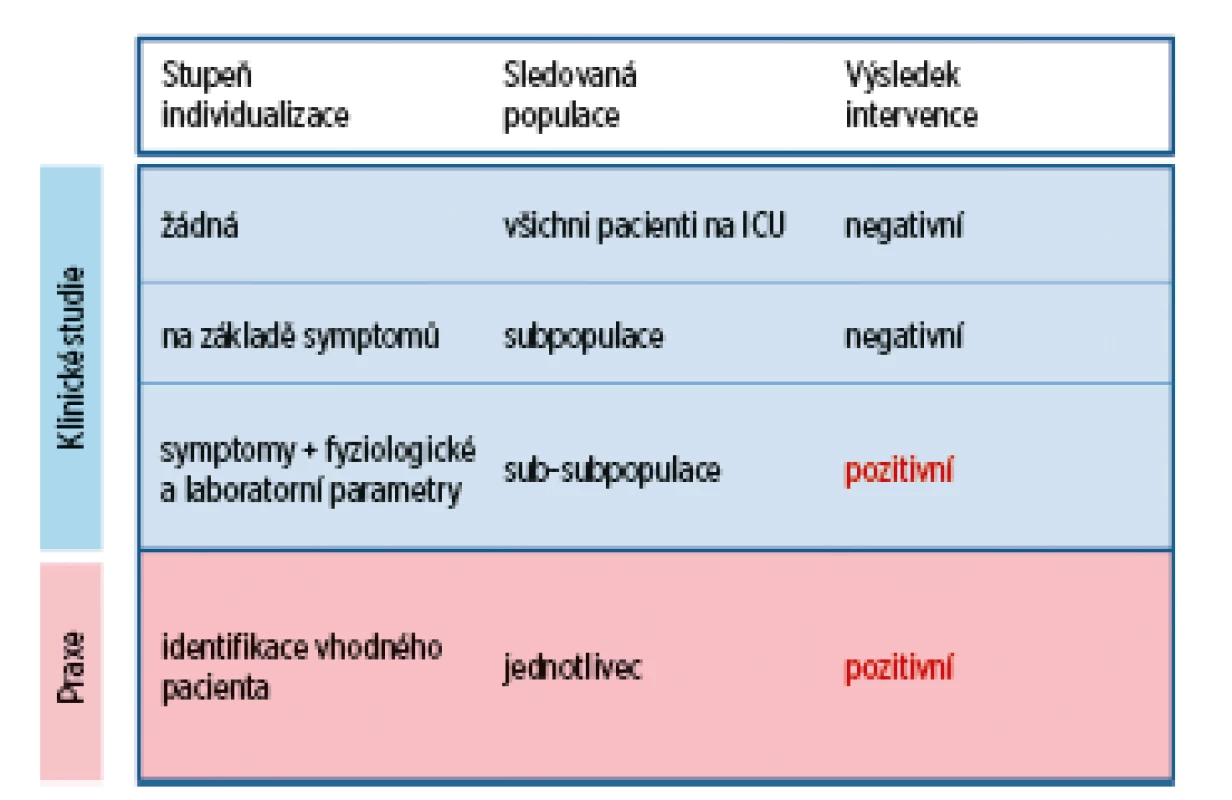
Upraveno podle [10]. PROCES ZAŘAZOVÁNÍ PACIENTŮ DO STUDIÍ
Pro možnost zařazení pacienta do klinické studie platí striktní etická a legislativní kritéria, která se mohou lišit v jednotlivých státech a institucích. To může u multicentrických studií vést k disproporcionálnímu zařazování pacientů mezi jednotlivými centry, a tím i ke zkreslení výsledků studie. Dalším významným faktorem je uplatňování vstupních a eliminačních kritérií, kdy při striktním nastavení těchto kritérií je do studie zařazeno pouze 10–15 % sledovaných pacientů; výsledky těchto studií se nicméně mohou promítat do doporučených postupů pro celou populaci kriticky nemocných [11]. Administrativní procesy spojené se zařazením pacienta do studie jsou časově náročné, proces randomizace může trvat několik hodin, v průběhu nichž je ale pacientovi podávána adekvátní léčba korigující parametry, na jejichž základě byl pacient do studie zařazen. Proces randomizace dále způsobuje, že v každém z ramen studie se mohou vyskytovat pacienti, kteří by mohli profitovat ze zařazení do opačného ramena studie (obr. 2) [12].
Obr. 2. Při definici sledované populace pacientů na základě symptomů se v obou ramenech studie vyskytují pacienti, kteří by mohli mít prospěch ze zařazení do opačného ramena studie. Přesnější charakteristika populace na základě dalších laboratorních a klinických parametrů umožňuje identifikovat skupinu pacientů, kteří by mohli mít ze sledované intervence prospěch (zelené pole), ačkoliv je intervence na základě výsledků studie vyhodnocena jako neefektivní. 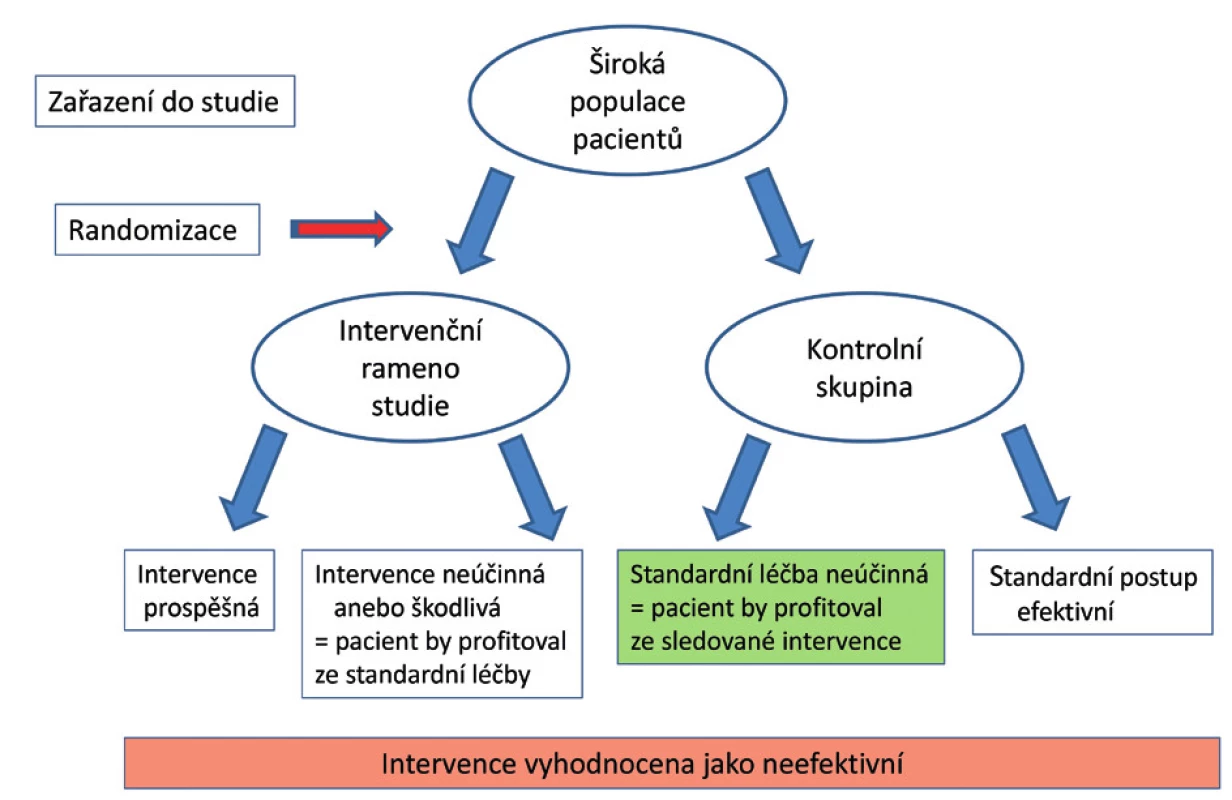
Upraveno podle [12]. POČET PACIENTŮ VE STUDII
Medicína založená na důkazech je historicky spjata s obory jako kardiologie nebo onkologie, kde výsledek klinické léčby zcela dominantně závisí na vyřešení základní diagnózy. Intenzivní medicína je výjimečná tím, že na výsledku léčby konkrétního pacienta se zásadním způsobem promítá mnoho faktorů, u kterých byla prokázána spojitost s průběhem onemocnění i klinický výsledek – od typu a hloubky sedace přes nastavení parametrů umělé plicní ventilace, množství, složení a časové konsekvence tekutinové terapie, aplikace vazoaktivních a inotropních látek, podpora a náhrada funkcí ledvin, množství, složení a způsob podávání výživy, prevence nemocničních nákaz, adekvátnost antibiotické léčby atd. (obr. 3). Účinné vyřešení základního problému u kriticky nemocného pacienta tak neznamená automaticky dosažení dobrého výsledku léčby, neboť v průběhu následné léčby je pacient přímo ohrožen na životě řadou druhotných komplikací i případných nežádoucích účinků prováděných léčebných intervencí.
Obr. 3. Přehled léčebných intervencí ovlivňujících výsledek léčby kriticky nemocných. 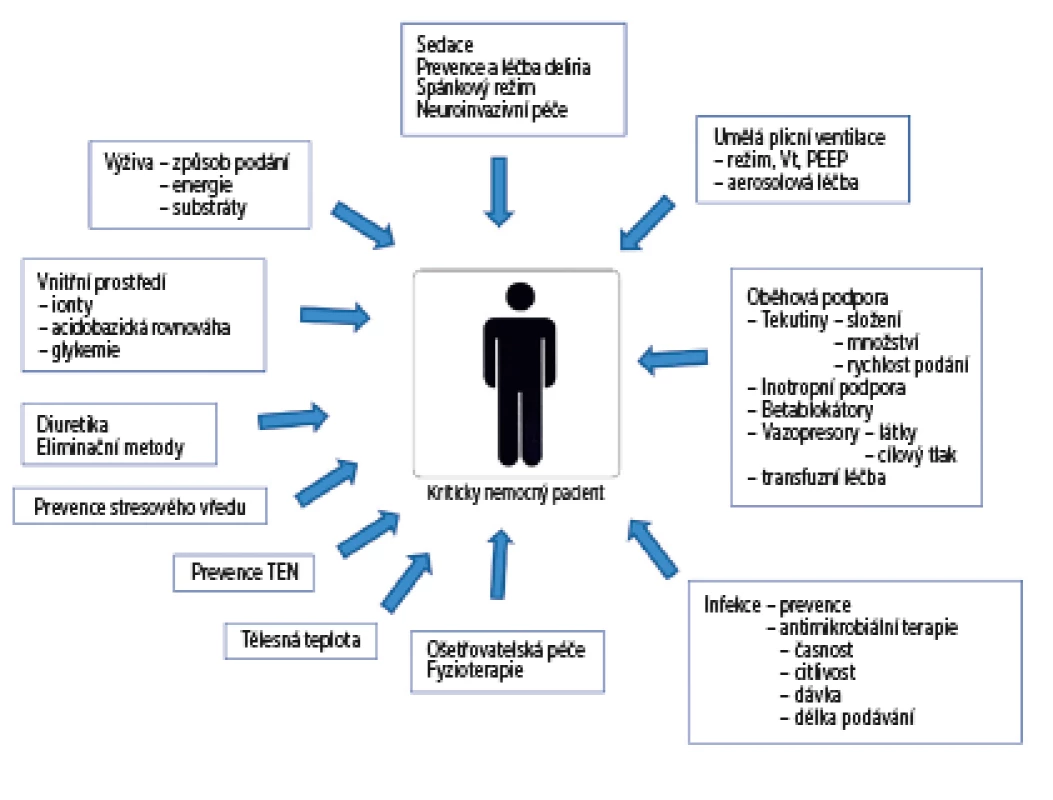
Upraveno podle [13]. Vzhledem k tomu, kolik faktorů se na výsledku léčby kriticky nemocných podílí, je nutné položit si otázku, kolik pacientů musí být zařazeno do studie, aby bylo možné odfiltrovat vliv ostatních proměnných a zhodnotit výhradně skutečný efekt sledovaného postupu (tzv. efekt motýlích křídel). U septických pacientů s vysokým rizikem mortality bylo v průběhu studie ENHANCE pozorováno značné kolísání průběžných výsledků a křivka se stabilizovala na úrovni konečných výsledků až po zařazení více než 500 pacientů [14]. V odborné literatuře frekventně citovaná publikace 6S (Scandinavian Starch for Severe Sepsis/Septic Shock), porovnávající efekt tekutinové resuscitace hydroxyetyškrobem versus ringeracetátem v septickém šoku, do studie zařadila a randomizovala 798 pacientů s těžkou sepsí a septickým šokem [15]. V následné post-hoc analýze souborů pacientů se ukázalo, že pacienti narozeni ve znamení Ryb měli významně nižší 90denní mortalitu než pacienti narození v jiných znameních (35,7 % vs. 48 %; RR 0,75 (95 % CI 0,54–1,03, p = 0,03) [16]. Je na úsudku čtenáře, zda tento pozoruhodný fakt aplikujeme do rutinní praxe a tekutinovou terapii u septických pacientů budeme provádět dle znamení zvěrokruhu (případně podrobíme septické pacienty narozené ve znamení Ryb detailní analýze v mnoha dalších studiích), nebo akceptujeme fakt, že u kriticky nemocných pacientů je pravděpodobně nutné ke skutečnému posouzení efektu sledovaného postupu mnohonásobně více pacientů, než bylo zařazeno do mnoha studií, podle kterých řídíme naši klinickou praxi v současnosti.
Klinické studie v intenzivní medicíně sledující vliv zkoumaných intervencí na mortalitu jsou často založeny na nedostatečném počtu pacientů a nedávají reálný podklad ke zhodnocení vlivu intervence na mortalitu. Pouze jedna třetina validních studií zkoumajících vliv na mortalitu zahrnuje počet pacientů dostatečný k detekci signifikantního rozdílu mortality a více než polovina nejcitovanějších studií uveřejněných v prestižních periodicích v oblasti anesteziologie a intenzivní medicíny vyvozuje závěry, pro které nemá adekvátní statistické důkazy [17]. Na základě těchto údajů by u každé publikované studie měl být uveden tzv. „fragility index“ (index určující, kolik sledovaných událostí se musí ve studii při daném počtu pacientů stát, aby se změnila statistická síla důkazů) a klinici mají tyto údaje brát v potaz při aplikaci výsledků klinických studií do klinické praxe.
TYP STUDIE
Kontrolované randomizované multicentrické dvojitě zaslepené práce jsou považovány za metodologicky nejkvalitnější typ studií [18]. Zapojení více pracovišť však může být kontraproduktivní – výsledky v centrech zařazujících menší počet pacientů se mohou lišit od těch s větší zkušeností s prováděním studií. V centrech zařazujících nižší počet pacientů je i častěji pozorováno porušení protokolu studie, což se na výsledku studie může taktéž projevit [19]. Dvojité zaslepení nelze u některých typů studií provést z logistických důvodů – např. u nastavení ventilačních parametrů, porovnání časného vs. pozdního zahájení eliminačních metod u selhání ledvin apod.
KYVADLOVÝ EFEKT
Výsledky některých studií přinesly tak zásadní důkazy o efektivitě sledovaných intervencí, že byly de facto okamžitě po publikaci široce akceptovány odbornou veřejností a následně se téměř bezprostředně promítly do doporučených postupů a především do běžné praxe. Protože naše poznání není hodnotou stacionární, ale vyvíjí se, byly i tyto studie podrobeny opětovnému přehodnocení a výsledky kontrolních studií překvapivě předchozí široce akceptované závěry zpochybnily (tab. 2) [20].
Tab. 2. Deset postupů v intenzivní medicíně, které byly na základě výsledků klinických studií široce akceptovány a používány, ale jejichž účinnost v následných studiích nebyla potvrzena (kyvadlový efekt) [20] ![Deset postupů v intenzivní medicíně, které byly na základě výsledků klinických studií široce akceptovány a používány, ale jejichž účinnost v následných studiích nebyla potvrzena (kyvadlový efekt) [20]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/eaedad2776416112c520ad12c72b6ebb.png)
Tento fenomén, kdy jsou výsledky studie popřeny následnými podobnými studiemi, je označován jako kyvadlový („pendulum“) efekt. Jedním z vysvětlení kyvadlového efektu (vedle případných metodických selhání zmíněných studií) je, že zmíněný postup po zavedení do praxe snížil mortalitu kriticky nemocných pacientů tak zásadním způsobem, že při zpětné evaluaci již nelze jeho efektivitu prokázat, neboť mortalita v kontrolní skupině (léčené právě na základě zkoumané intervence) je nízká (viz dále „Interpretace výsledků“). V těchto případech pravděpodobně nelze negativní výsledek kontrolní studie interpretovat jako selhání efektu zkoumaného postupu, ale naopak jako benefit jednoznačně prokázaný klinickou praxí.
STANOVENÉ CÍLE KLINICKÝCH STUDIÍ
Většina klinických studií si za cíl klade srovnání parametrů klinického výsledku léčby (klinický výsledek) – mortality (nejčastěji 28denní, 90denní, případně v intenzivní péči nebo po celou dobu hospitalizace), délky doby hospitalizace na ARO/JIP nebo celkovou dobu hospitalizace, dobu umělé plicní ventilace, dobu, kdy hemodynamické nebo metabolické parametry splňují parametry šoku, apod. Hodnocení mortality jako výsledku léčby je nesporně relevantním postupem, ale je nezbytné si uvědomit, že u kriticky nemocných může být způsobená řadou jiných faktorů, než je vliv zkoumané intervence. Sledování krátkodobé mortality nevypovídá nic o kvalitě života přežívajících ani o mortalitě dlouhodobé, přitom v intenzivní medicíně je dnes široce akceptované paradigma, že výsledkem léčby nemá být pouhé přežívání pacienta, ale návrat do plnohodnotného života v nejvyšší dosažitelné kvalitě.
Dalšími často sledovanými cíli je srovnání vlivu intervence na hodnoty vybraných fyziologických nebo laboratorních parametrů. Při interpretaci výsledků těchto studií je nutné zohlednit nejenom to, zda je postup efektivní ve smyslu dosažení fyziologického cíle („does it work?“), ale zda je efektivní i ve smyslu zlepšení výsledků péče („does it help?“). Typickým příkladem je aplikace inhalačního oxidu dusnatého (iNO), která je u pacientů s ARDS spojena se zlepšením parametrů výměny plynů, ale nevede ke zlepšenému přežívání [21].
INTERPRETACE VÝSLEDKŮ
Výše uvedený příklad s aplikací iNO u pacientů s ARDS je modelovou situací, kdy je možné výsledky studie interpretovat různým způsobem: jako neefektivitu iNO v klinickém použití nebo jako nedocenění benefitu intervence a její vytržení z kontextu klinické situace. Významné zlepšení parametrů výměny plynů by pro klinika mělo být podnětem k úpravě ventilačních parametrů s cílem minimalizovat rizika plynoucí z ventilací indikovaného plicního postižení (VILI). U pacientů s těžkým ARDS vyžadujícím použití mimotělní oxygenace (ECMO) se nicméně ukazuje, že u značné části pacientů je ponecháno nastavení neprotektivních parametrů ventilace i po dosažení adekvátních hodnot krevních plynů mimotělovou oxygenací [22]. Údaje o úpravě ventilačních parametrů u pacientů s aplikací iNO nejsou dostupné, ale na základě uvedených faktů lze předpokládat, že podobně jako u pacientů na ECMO i u pacientů s aplikací iNO nemuselo být zlepšení parametrů výměny plynů následováno nastavením protektivních parametrů umělé plicní ventilace. Ačkoliv je tedy intervence efektivní z hlediska dosažení fyziologického cíle (zlepšení výměny plynů), není efektivní z hlediska EBM ve smyslu zlepšení přežívání pacientů, neboť je intervence samotná vytržena z klinického kontextu.
Dalším příkladem možné nesprávné interpretace výsledků klinické studie je dnes již klasická práce E. Riverse popisující zásadní redukci mortality septických pacientů při časné cílené hemodynamické resuscitaci (studie EGDT – early goal directed therapy) [23]. Jako vodítka pro cílenou oběhovou podporu byly v této studii stanoveny hodnoty centrálního žilního tlaku, saturace krve kyslíkem v centrálním žilním řečišti a hodnota hemoglobinu. V následujících letech bylo provedeno několik studií, které nepotvrdily benefit vedení hemodynamické resuscitace podle těchto cílů [24–26]. Tyto skutečnosti jsou často interpretovány tak, že Riversem popsaná cílená hemodynamická resuscitace septických pacientů nepřináší významný klinický prospěch. Na základě výsledků Riversovy studie však došlo k zásadnímu posunu v chápání nutnosti časné identifikace a léčby septického šoku. Tento postup vedl k poklesu mortality pacientů v septickém šoku, což dokazuje významně nižší úmrtnost pacientů v kontrolních ramenech recentně publikovaných studií ve srovnání s mortalitou v EGDT studii (ARISE 18,8 %, PROCESS 18,9 %, PROMISE 29,2 % oproti mortalitě v Riversově studii – 46,5 % kontrolní rameno, 30,5 % EGTD rameno) [24–26]. Doslovná interpretace EGDT trial nekoresponduje s klinickou praxí – přínos studie spočívá v poznání nutnosti časné identifikace šoku a jeho promptní léčbě, nikoli v striktním použití identických postupů a dosažení stejných cílů, jaké použila původní Riversova studie.
METODIKA STUDIÍ
Překvapující je skutečnost, že ačkoliv lékaři mají povědomí o studiích prokazujících vliv zkoumaných intervencí na mortalitu, zavádění těchto intervencí do rutinní klinické praxe se pohybuje „pouze“ v rozmezí 55–90 % [27]. Typ studie ovlivňují lékaře při jejich běžném klinickém rozhodování – výsledky studií s větším počtem zařazených pacientů a větším počtem zapojených center jsou do klinické praxe aplikovány častěji, naopak použitá metodika na rozhodování kliniků vliv nemá [27]. Z publikovaných dat není zřejmé, zda jsou příčinou nedostatečné aplikace postupů (prokazatelně redukujících mortalitu a/anebo nepoužívání postupů spojených s vyšší mortalitou) problémy organizačního charakteru, nebo nedůvěra kliniků ve výsledky publikovaných studií. Při rozhodování o postupu léčby může hrát roli i preference dosažení rychlé úpravy závažných patologických laboratorních a klinických parametrů pacienta i přes znalost nedostatečného nebo zhoršujícího vlivu intervence na mortalitu populace. Skepse kliniků vůči klinickým studiím může pramenit i z faktu, že metodika a protokol mnohých relevantních prací (které se promítly i do doporučení pro klinickou praxi) neodpovídají reálnému klinickému scénáři – v reálné praxi se jen výjimečně setkáváme s podáváním „stresové dávky“ kortikoidů u septického šoku i po dobu mnoha dnů po odeznění šoku, nicméně klinická studie, na základě které byla změněna doporučení pro aplikaci kortikoidů v septickém šoku, podávala hydrokortizon v protokolovém ramenu více než týden po eliminaci šoku – a incidence následných sepsí byla „překvapivě“ vyšší u pacientů, kteří tuto klinicky zcela neodůvodněnou léčbu s imunosupresivním působením dostávali [28]; syntetické koloidy v praxi neaplikujeme v excesivních množstvích přesahujících doporučené lékopisné dávky [15, 29]; tekutinovou resuscitaci nezahajujeme u pacientů, kteří resuscitovat dle vstupních parametrů pravděpodobně nepotřebují [30]. Na základě stále nových studií se frekventně mění doporučení pro klinickou praxi včetně popření postupů, které v klinické praxi mají zjevný efekt a snížily mortalitu našich pacientů (tab. 2). Narážíme i na další limitaci klinických studií – v protokolovém ramenu studie se mohou vyskytovat pacienti, kteří by profitovali ze standardního postupu používaného v kontrolním ramenu, a naopak (obr. 2).
I přes velice přísné postupy při koncipování metodiky a protokolů studií, při samotném procesu péče o pacienta zařazeného do studie, při sběru dat a konečně při publikování výsledků bývá v mnohých publikovaných studiích deskripce základních parametrů nedostatečná. V retrospektivní analýze relevantních studií týkajících se septického šoku byly u pacientů v kontrolní skupině jen v 8 % hodnocených studií prezentovány adekvátní údaje [31]!
PUBLIKOVÁNÍ
Současná doba je charakterizována masivním používáním elektronických médií a intenzivní podporou vědy a výzkumu soukromými i státními institucemi. I v oblasti medicíny se nacházíme na informační superdálnici, na které je velice obtížné kontrolovat pravidla. Dle dostupných literárních údajů bylo v oblasti intenzivní medicíny identifikováno 72 relevantních studií popisujících vliv intervencí na mortalitu – 10 z těchto intervencí prokázalo pozitivní efekt intervence ve smyslu redukce mortality, 7 intervencí naopak mortalitu zvyšovalo, zbylých 55 intervencí nemělo na mortalitu vliv [32]. Studie s prokázaným pozitivním efektem mají přitom vyšší pravděpodobnost publikování v prestižním periodiku, a tedy většího vlivu na odbornou veřejnost [18].
JAK APLIKOVAT VÝSLEDKY KLINICKÝCH STUDIÍ DO BĚŽNÉ PRAXE?
I přes všechny popsané limitace je nesporné, že klinické studie jsou pro naši praxi nepostradatelným zdrojem informací a tvoří jeden ze základů správné klinické praxe. Výsledky klinických studií se promítají do výstupů medicíny založené na důkazech, která je vodítkem při stanovování léčebného plánu a vyhodnocování efektivity terapie. Je nevyhnutelné zdůraznit, že medicína založená na důkazech nám poskytuje informace o tom, který léčebný postup je nejefektivnější a nejbezpečnější v celé populaci pacientů. Každý pacient je ale samostatná entita s vlastní genetickou výbavou, fyziologickými rezervami, aktuálním průběhem nemoci a modifikujícími faktory. Proto výsledky klinických studií a medicíny založené na důkazech nesmí být aplikovány paušálně a bez rozmyslu, ale jen a výhradně v kontextu aktuálního stavu pacienta, při znalosti průběhu onemocnění (literárně označované jako vektor nebo trajektorie onemocnění) a při pečlivém sledování odpovědi organismu na zavedené intervence. Tento postup nazývaný „personalizovaná medicína“ není s medicínou založenou na důkazech v rozporu, ale naopak se s ní doplňuje a umožňuje nám poskytovat efektivní a bezpečnou péči. K nastavení nejúčinnější a nejbezpečnější individuální léčby je nutné důkladné pochopení probíhajících patofyziologických procesů. Lékař by měl důkladně znát anamnézu pacienta, průběh onemocnění a možné komplikace zvolených postupů a zasadit tyto poznatky do kontextu spolupráce se specialisty příslušných oborů a v neposlední řadě i využít získané zkušenosti.
Při aplikaci výsledků klinických studií do naší praxe je nezbytné znát jejich limitace a používat je vždy v kontextu probíhajícího onemocnění u individuálního pacienta. Zavádění postupů s prokázanou efektivitou v klinických studiích musí být vždy provázeno otázkou „komu, kdy, jaká dávka, jak dlouho, jaký cíl, jak vyhodnotit efekt“ [33]. Při stanovování individuálního léčebného plánu má být základní podmínkou nejen definice problému pacienta a návrh jeho řešení včetně monitorování účinnosti léčby, ale i otázka, zda je tato léčba kompatibilní se současnou úrovní poznání v dané problematice (obr. 4). V případě, že tento postup není efektivní ve smyslu dosažení stanovených cílů, je opodstatněné léčbu změnit.
Obr. 4. Postupy podložené výsledky klinických studií (Evidence Based Medicine – EBM) jsou základem správně vedené léčby, musí však být vždy podložené pečlivým zhodnocením stavu pacienta, pochopením patofyziologie probíhajícího postupu, odpovědí na předchozí léčbu a znalostí limitací EBM. Výsledkem je individuálně vedená léčba podle aktuálních potřeb každého pacienta („personalizovaná medicína“). 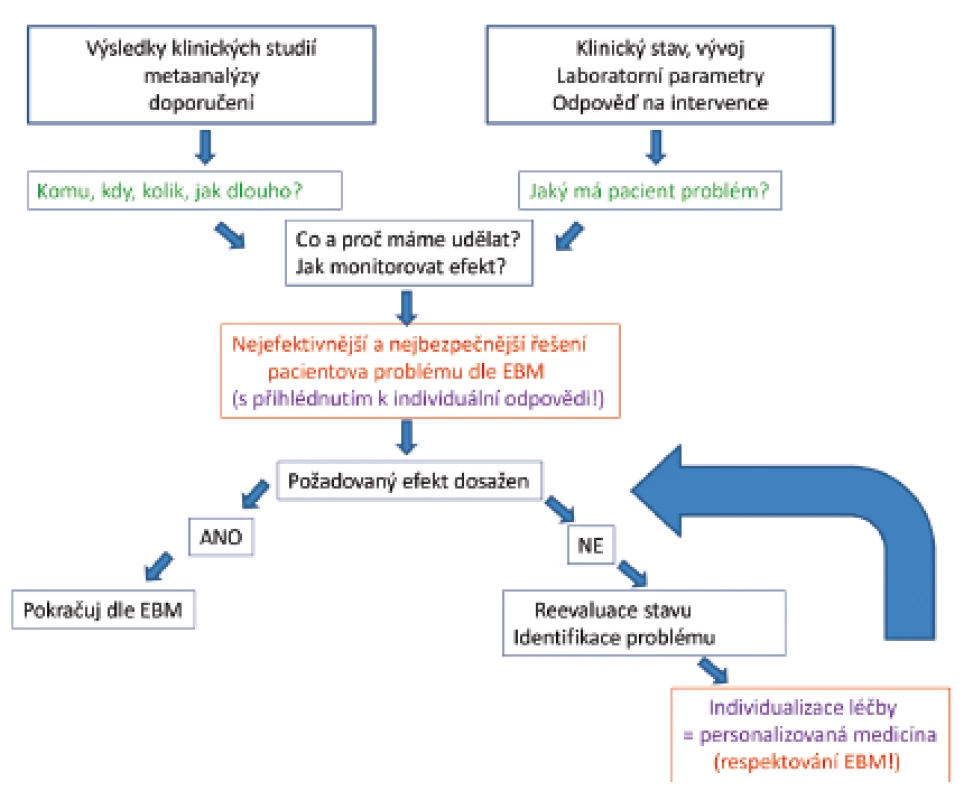
ZÁVĚR
Protokoly založené na výsledcích klinických studií mohou být v určitých situacích užitečné, ale neměly by sloužit jako „medicínská kuchařská kniha“, neměly by být slepě plněny, aniž by lékař pečlivě zhodnotil klinický stav pacienta. Léčebné postupy musí být založeny na důkladném pochopení probíhajících patofyziologických procesů a vést k „personalizované medicíně“ [3]. Výsledky klinických studií a medicína založená na důkazech tak nemají být důvodem k alibismu a nelze je chápat ani jako vrchol našeho poznání a správnou praxi, ale jako jejich základnu, na které se má dále pro každého pacienta nastavovat individualizovaná léčba.
Práce je původní a nebyla publikována v žádném jiném médiu ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli, souhlasí s jeho zněním a se zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Do redakce došlo dne 19. 1. 2017.
Do tisku přijato dne 3. 2. 2017.
Adresa pro korespondenci:
MUDr. Peter Sklienka
e-mail: peter.sklienka@fno.cz
Zdroje
1. Milbrandt EB, Kersten A, Rahim MT, et al. Growth of intensive care unit resource use and its estimated cost in Medicare. Crit Care Med 2008;36 : 2504–2510.
2. Vincent JL, Marshall JC, Namendys-Silva SA, et al. Assessment of the worldwide burden of critical illness: the intensive care over nations (ICON) audit. Lancet Respir Med 2014;2 : 380–386.
3. Vincent JL, Hall JB, Slutsky AS. Ten big mistakes in intensive care medicine. Intensive Care Med 2015;41 : 505–507.
4. Delaney AP, Dan A, McCaffrey J, et al. The role of albumin as a resuscitation fluid for patients with sepsis: a systematic review and meta-analysis. Crit Care Med 2011;39 : 386–391.
5. Xu JY, Chen QH, Xie JF, et al. Comparison of the effects of albumin and crystalloid on mortality in adult patients with severe sepsis and septic shock: a meta-analysis of randomized clinical trials. Crit Care 2014;18 : 702.
6. Jiang L, Jiang S, Zhang M, et al. Albumin versus other fluids for fluid resuscitation in patients with sepsis: a meta-analysis. nPLoS One 2014;9:e114666.
7. Patel A, Laffan MA, Waheed U, et al. Randomised trials of human albumin for adults with sepsis: systematic review and meta-analysis with trial sequential analysis of all-cause mortality. BMJ 2014;349:g4561.
8. Moreno R, Rhodes A. Evidence should not be viewed in isolation. Crit Care Med 2010;38:S528–33.
9. McAuley DF, O'kane C, Griffiths MJ. A stepwise approach to justify phase III randomized clinical trials and enhance the likelihood of a positive result. Crit Care Med 2010;38:S523–527.
10. Gattinoni L, Tonetti T, Quintel M. Improved survival in critically ill patients: are large RCTs more useful than personalized medicine? We are not sure. Intensive Care Med 2016;42 : 1781–1783.
11. Vincent JL. We should abandon randomized controlled trials in the intensive care unit. Crit Care Med 2010;38:S534–538.
12. Vincent JL, Creteur J. Paradigm shifts in critical care medicine: the progress we have made. Crit Care 2015;19:S10.
13. Vincent JL. Give your patient a fast hug (at least) once a day. Crit Care Med 2005;33 : 1225–1229.
14. Vincent JL, Bernard GR, Beale R, et al. Drotrecogin alfa (activated) treatment in severe sepsis from the global open-label trial ENHANCE: further evidence for survival and safety and implications for early treatment. Crit Care Med 2005;33 : 2266–2277.
15. Perner A, Haase N, Guttormsen AB, et al. Hydroxyethyl starch 130/0.42 versus Ringer's acetate in severe sepsis. N Engl J Med 2012;367 : 124-134.
16. Hjortrup PB, Haase N, Wetterslev J, et al. Gone fishing in a fluid trial. Crit Care Resusc 2016;18 : 55–58.
17. Ridgeon EE, Young PJ, Bellomo R, et al. The Fragility Index in Multicenter Randomized Controlled Critical Care Trials. Crit Care Med 2016;44 : 1278–1284.
18. Marik PE. Evidence-Based Critical Care. Spinger 2015.
19. Macias WL, Vallet B, Bernard GR, et al. Sources of variability on the estimate of treatment effect in the PROWESS trial: implications for the design and conduct of future studies in severe sepsis. Crit Care Med 2004;32 : 2385–2391.
20. Perner A, Myburgh J. Ten ‘short-lived‘ beliefs in intensive care medicine. Intensive Care Med 2015;41 : 1703–1706.
21. Afshari A, Brok J, Møller AM, et al. Inhaled nitric oxide for acute respiratory distress syndrome (ARDS) and acute lung injury in children and adults. Cochrane Database Syst Rev 2010; Jul 7.
22. Marhong JD, Munshi L, Detsky M, et al. Mechanical ventilation during extracorporeal life support (ECLS): a systematic review. Intensive Care Med 2015;41 : 994–1003.
23. Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001;345 : 1368–1377.
24. Peake SL, Delaney A, Bailey M, et al. Goal-directed resuscitation for patients with early septic shock. N Engl J Med 2014;371 : 1496–1506.
25. Mouncey PR, Osborn TM, Power GS, et al. Protocolised Management In Sepsis (ProMISe): a multicentre randomised controlled trial of the clinical effectiveness and cost-effectiveness of early, goal-directed, protocolised resuscitation for emerging septic shock. Health Technol Assess 2015; 19:i-xxv,1–150.
26. Yealy DM, Kellum JA, Huang DT, et al. A randomized trial of protocol-based care for early septic shock. ProCESS Investigators. N Engl J Med 2014;370 : 1683–1693.
27. Pisano A, Landoni G, Lomivorotov V, et al. Worldwide Opinion on Multicenter Randomized Interventions Showing Mortality Reduction in Critically Ill Patients: A Democracy-Based Medicine Approach. J Cardiothorac Vasc Anesth 2016;30 : 1386–1395.
28. Sprung CL, Annane D, Keh D, et al. N Engl J Med. Hydrocortisone therapy for patients with septic shock 2008;358 : 111–124.
29. Brunkhorst FM, Engel C, Bloos F, et al. Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med 2008;358 : 125–139.
30. Finfer S, Bellomo R, Boyce N, et al. A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med 2004;350 : 2247–2256.
31. Pettilä V, Hjortrup PB, Jakob SM, et al. Control groups in recent septic shock trials: a systematic review. Intensive Care Med 2016;42 : 1912–1921.
32. Ospina-Tascón GA, Büchele GL, Vincent JL. Multicenter, randomized, controlled trials evaluating mortality in intensive care: doomed to fail? Crit Care Med 2008;36 : 1311–1322.
33. Singer M. Advancing critical care: time to kiss the right frog. Crit Care 2013;17 Suppl 1:S3.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Zajímavosti, tipy a triky
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2017 Číslo 3- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Prohlášení výboru ČSIM na období 2017–2020
- Vybrané aspekty mezioborové spolupráce na porodním sále
- Pneumonie spojené se zdravotní péčí u pacientů v intenzivní péči – optimální nastavení iniciální empirické antimikrobiální terapie: výsledky multicentrické observační studie
- Energotrauma a ventilátorem indukované plicní poškození
- Jak do praxe aplikovat výsledky klinických studií?
- Epidemiologie mimonemocniční náhlé zástavy oběhu v České republice – národní výsledky studie EuReCa ONE
- Statistika v biomedicínském výzkumu II
- Alergie, anafylaxe, anafylaktický šok
- Klinická fyziologie vazopresinu
- Doporučený postup pro pooperační delirium
- Sepsis, it's been a hard year now…
- Mezinárodní doporučení pro postup u pacientů se sepsí a septickým šokem
- Stanovisko výboru České společnosti intenzivní medicíny ČLS JEP k používání nové definice sepse („Sepsis-3“)
-
Anestezie v Rakousko -Uhersku během I. světové války a po vzniku samostatného československého státu
Část I - Úvod - Zajímavosti, tipy a triky
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mezinárodní doporučení pro postup u pacientů se sepsí a septickým šokem
- Doporučený postup pro pooperační delirium
- Epidemiologie mimonemocniční náhlé zástavy oběhu v České republice – národní výsledky studie EuReCa ONE
- Alergie, anafylaxe, anafylaktický šok
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



