-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mukormykotická infekce u pacientů po transplantaci solidních orgánů
Mucormycosis in solid organ transplant recipients
Mucormycosis is a very serious, invasive fungal infection, occurring frequently in patients with a modified immune response. Mortality in cases of a generalized form of mucormycosis can reach 96 %. The principles of successful treatment of this disease are early diagnosis and aggressive antimycotic and/or surgical therapy. In this case report we point out the clinical importance of correct timing of therapy, even though even early and appropriate management does not always guarantee survival.
Keywords:
solid organ transplantation – antimycotic therapy
Autoři: S. Palásková; E. Kieslichová
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní péče, Transplantcentrum, Institut klinické a experimentální medicíny
Vyšlo v časopise: Anest. intenziv. Med., 30, 2019, č. 2, s. 86-89
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Mukormykózy jsou velmi závažné, agresivně probíhající houbové infekce vyskytující se ve vysokém procentu u pacientů s modifikovanou imunitní odpovědí. Jejich mortalita může dosahovat při generalizaci onemocnění až 96 %. Základem dosažení co nejlepšího klinického výsledku je časná diagnostika a razantní terapie (antimykotická, případně v kombinaci s chirurgickou). Prezentovaný klinický případ poukazuje na význam načasování zahájení terapie, přestože ani včasná adekvátní terapie nemusí být vždy spojena s přežitím.
Klíčová slova:
transplantace solidních orgánů – antimykotická terapie
ÚVOD
Pacienti po transplantaci solidních orgánů (SOT) s dlouhodobou imunosupresivní terapií mají zvýšené riziko vzniku infekčních komplikací, včetně infekcí mykotických. Invazivní mykotické infekce mohou být způsobeny jak endemickými houbami, tak oportunními [1, 2]. Nejčastějšími patogeny způsobujícími oportunní mykotické infekce jsou kandidy a aspergillus, méně často pak mukormycety [1, 3]. Jejich incidence je podle literárních zdrojů zatím poměrně nízká, i když v posledních letech pozvolna roste [1, 4].
Cílem práce je upozornit na klinický význam mukormykóz a diskutovat problematiku diagnosticko-léčebného postupu, zejména v otázce, kdy zahájit terapii, zda již při podezření na danou klinickou jednotku nebo zda vyčkávat na histologické potvrzení.
POPIS VLASTNÍHO PŘÍPADU
Žena s anamnézou diabetes mellitus 1. typu s mnohočetnými komplikacemi (diabetická retinopatie, neuropatie, syndrom diabetické nohy, nefropatie v terminálním stadiu s nutností pravidelné hemodialyzační léčby), ischemické choroby srdeční a hypertenze podstoupila ve věku 47 let kombinovanou transplantaci ledviny a slinivky břišní a následně dvě retransplantace ledviny (v 52 a 66 letech) pro selhání funkce štěpu. Z důvodu vysokého tzv. imunologického rizika byl při poslední transplantaci ledviny použit modifikovaný protokol imunosuprese (peroperační podání antithymocytárního globulinu, čtyři plazmaferézy a aplikace intravenózního imunoglobulinu). Samotné provedení operačního výkonu bylo bez komplikací, nicméně rozvoj funkce štěpu byl opožděný, výsledky kontrolní biopsie vylučovaly přítomnost akutní rejekce. Hodnoty kreatininu se po měsíci od transplantace pohybovaly v rozmezí 120–220 umol/l.
V prvním měsíci po poslední transplantaci ledviny si začala pacientka stěžovat na pozvolna narůstající bolesti hlavy lokalizované kolem pravé očnice propagující se ke kořeni nosu a okcipitálně, bolesti reagovaly na podávaná analgetika jen omezeně. V následujících šesti měsících pacientka absolvovala řadu vyšetření u otorinolaryngologa (vyslovení podezření na sinusitidu), stomatologa a neurologa – stav byl uzavřen jako neuralgie trigeminu. Patologem byla v bioptickém vzorku, odebraném při otorinolaryngologickém (ORL) vyšetření, vyloučena mykotická infekce. Dále pacientka opakovaně podstoupila vyšetření zobrazovacími metodami (CT a MR) vždy s nálezem slizniční hyperplazie vedlejších dutin nosních.
Pro stále neustupující bolesti hlavy nakonec podstoupila operaci na jádru trigeminu (sedm měsíců po transplantaci ledviny). Měsíc po neurochirurgickém výkonu se u pacientky rozvinula ptóza pravého víčka s oftalmoplegií a úplnou amaurózou. Neurologem byla vyloučena pooperační komplikace jako příčina vzniku potíží. Pro podezření na trombózu a. centralis retinae byla u pacientky zahájena antikoagulační terapie nízkomolekulárním heparinem následována terapií kortikosteroidy pro podezření na Tolosův-Huntův syndrom.
Veškerá dosavadní terapie se jevila jako neúčinná. Při poslední hospitalizaci (osm měsíců po transplantaci ledviny) pacientka náhle upadla do bezvědomí s nutností zajištění dýchacích cest a ventilační podpory. Podle CT vyšetření mozku bylo příčinou poruchy vědomí nově vzniklé subarachnoidální krvácení, vedlejším nálezem byla infiltrace hrotu očnice. Pacientka byla přeložena na lůžko intenzivní péče, byla zahájena antiedematózní terapie a neurochirurgem zavedena zevní komorová drenáž. S ohledem na anamnézu, klinický obraz a povahu CT nálezu infiltrace hrotu očnice podle CT bylo vysloveno podezření na mukormykotickou infekci, byl odebrán bioptický vzorek z chronického defektu na bérci levé dolní končetiny k histologickému vyšetření a následně byla zahájena antimykotická terapie liposomálním amfotericinem B v dávce 6 mg/kg/den.
O dva dny později bylo provedeno kontrolní CT vyšetření mozku s nálezem nových ischemických ložisek a subdurálního hematomu frontookcipitálně. Zároveň byl hlášen pozitivní záchyt mukormycet (rod Rhizopus) v biopsii z defektu na levé dolní končetině. Klinický stav se nadále zhoršoval, při progresi multiorgánového selhání nereagující. Vzhledem k infaustní prognóze při stále zhoršujícím se stavu v důsledku generalizace mukormykotické infekce s rozvojem multiorgánového selhání, nereagujícím na terapii, byla pacientka převedena na paliativní péči a zemřela. Exitus letalis nastal devět měsíců od prvních příznaků mukormykózy.
DISKUSE
Mukormycety jsou angioinvazivní houby. Napadají stěny cév, rychle jimi prorůstají a spolu s leukocyty a trombocyty tvoří žilní tromby. Vedou tak ke vniku rozsáhlých nekróz, do kterých pak antimykotika pronikají velmi špatně [2, 5, 6]. Může tak dojít ke generalizaci onemocnění. Mortalita u pacientů s generalizovanou formou mukormykózy dosahuje až 96 % [5, 6].
Mezi hlavní rizikové faktory vzniku mukormykotické invazivní infekce u pacientů po SOT patří renální insuficience, diabetes mellitus a předchozí podávání vorikonazolu nebo kaspofunginu [1, 4–6]. Mukormykózy disponují enzymem keton reduktáza, který jim umožňuje prosperovat v acidotickém prostředí s vysokým podílem glukózy. Ohroženým pacientem je tedy typicky dekompenzovaný diabetik s ketoacidózou [5]. V popisovaném případu byly přítomny dva významné rizikové faktory – imunosuprese a diabetes mellitus. Riziko mukormykotické infekce bylo tedy vysoké.
Bránou vstupu infekce do hostitele je nejčastěji respirační trakt. Za normálních okolností u zdravých jedinců dochází pomocí řasinek k přenosu vdechnutých spor z dýchacího ústrojí do faryngu a k jejich vyloučení gastrointestinálním traktem. U citlivých osob, jako byla právě naše pacientka, však může dojít k manifestaci onemocnění [5, 6].
Klinický obraz u naší nemocné byl typický pro rhino-orbito-cerebrální formu mukormykotické infekce, která má mortalitu v širokém rozmezí 26–62 %. Tato forma onemocnění je nejčastější a projevuje se zpočátku nespecificky jako akutní sinusitida s kongescí nosní sliznice a purulentní sekrecí. Jak onemocnění postupuje, přidávají se další příznaky, jako jsou např. bolesti hlavy, periorbitální edém, ptóza víčka, částečná nebo úplná amauróza či fokální neurologický deficit. Mukormycety dále mohou napadat plíce, kůži i gastrointestinální trakt [2, 4–6].
Vodítkem k diagnóze mukormykózy je klinický obraz u rizikových pacientů, který je však nespecifický. Stejně tak jsou nespecifické i nálezy získané zobrazovacími metodami [5, 6]. Mukormycety ve své buněčné stěně neobsahují ani ß-D-glukan, ani galaktomanan. Sérologické metody v diagnostice této infekce tedy nelze využít [5]. Zlatým standardem v diagnostice mukormykózy stále zůstává histopatologické vyšetření s identifikací organismů v bioptované tkáni, případně doplněné o kultivaci hub na běžných kultivačních médiích [2, 4, 5]. Tyto metody ale vykazují nízkou senzitivitu. Jejich hyfy jsou totiž poměrně křehké. Může tak dojít k jejich zničení při zpracovávání odebraného materiálu [5]. V posledních letech se proto klade důraz na vývoj citlivější a rychlejší metody detekce a zpřesnění identifikace jednotlivých rodů mukormycet k časnějšímu a efektivnějšímu zahájení terapie. Nadějné PCR metody užívané k identifikaci ribozomálních genů slouží zatím jako doplňující vyšetření potvrzující histologický závěr [7–10]. Diagnostika mukormykóz není jednoduchá, což potvrzuje i případ transplantované pacientky. Klinický obraz ve spojení s rizikovými faktory a nespecifickým nálezem, získaným pomocí zobrazovacích metod, budil podezření na možnou přítomnost mukormykotické infekce. Z tohoto důvodu byl při ORL vyšetření pořízen bioptický vzorek z vedlejších dutin nosních k histologickému vyšetření. Odebraný vzorek byl však patologem hodnocen jako negativní, což vedlo k prodloužení doby do zahájení účinné terapie.
Terapii mukormykózy je nutno zahájit co nejdříve. Léčba je založena na rozsáhlé chirurgické intervenci vedoucí k odstranění nekrotických hmot a na antimykotické terapii [1, 2, 5, 6]. Lékem volby je amfotericin B podávaný v dávce 5 mg/kg/den. Některá doporučení uvádějí i dávky 10–15 mg/kg/den
u pacientů s refrakterní formou mukormykózy, a to i přes toxicitu této léčby [1, 5, 6]. Spíše jako „step-down“ terapie se poté užívá triazolové antimykotikum posakonazol, a to v dávce 300 mg/den [5]. Účinnost kombinace výše uvedených antimykotik s echinokandiny nebyla zatím jednoznačně prokázána [1, 6]. Součástí terapie je dále podpůrná péče, péče o vnitřní prostředí, korekce neutropenie, případně redukce či vysazení imunosupresivní léčby [1, 4]. Avšak i včasná a adekvátní léčba mukormykózy nemusí vést k přežití pacienta.Doporučený postup léčby mukormykotické infekce byl dodržen i u naší pacientky, avšak s určitou časovou prodlevou. Terapie byla zahájena intravenózním podáním liposomálního amfotericinu B v dávce 6 mg/kg/den, následována důslednou péčí o vnitřní prostředí a vysazením imunosupresivní léčby i s možným rizikem rejekce transplantované ledviny. Chirurgická intervence vzhledem ke kritickému stavu pacientky nebyla provedena.
Nepříznivou prognózu imunokompromitovaných pacientů s mukormykózou dokazují i data z vlastního pracoviště. Na Klinice anesteziologie, resuscitace a intenzivní péče Transplantcentra IKEM byli v posledních pěti letech léčeni celkem čtyři pacienti s diagnózou mukormykózy (tab. 1). U všech byl přítomen alespoň jeden rizikový faktor (diabetes mellitus, jaterní cirhóza s hepatorenálním syndromem, transplantace solidního orgánu). Mukormykotická infekce se u pacientů po SOT rozvinula v prvním půlroce po transplantaci, což je pro mukormykózy typické, přičemž u všech pacientů probíhala infekce v rhino-orbito-cerebrální oblasti. U dvou z nich následně došlo ke generalizaci onemocnění. Léčba byla vždy zahájena intravenózním podáním liposomálního amfotericinu B v širokém rozmezí dávkování 5–10 mg/kg/den, chirurgická intervence proběhla pouze u dvou pacientů. Žádný z těchto pacientů nepřežil, a to bez ohledu na rizikový faktor, klinickou formu, dobu od počátku infekce do zahájení terapie či dávku amfotericinu B.
Tab. 1. Pacienti s prokázanou mukormykotickou infekcí hospitalizovaní na KARIP IKEM 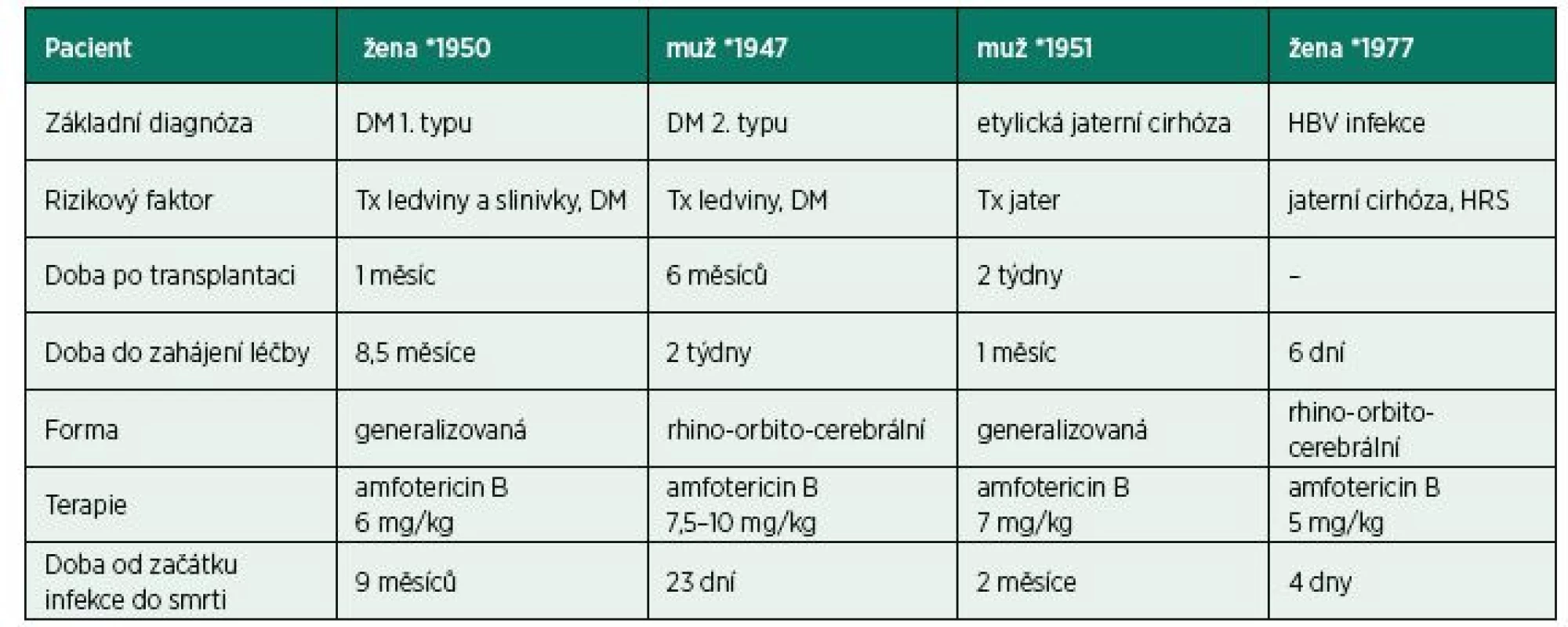
DM – diabetes mellitus, HBV – virová hepatitida B, HRS – hepatorenální syndrom, Tx – transplantace Popisovaný případ imunokompromitované pacientky s mukormykózou poukazuje na obtížnou diagnostiku mukormykotické infekce a na nutnost pomýšlet v případě rizikového pacienta s nespecifickými příznaky v diferenciální diagnostice i na toto onemocnění. Základem úspěšné léčby mukormykózy je právě časná diagnostika a následná agresivní chirurgická a antimykotická terapie, každé opožděné nasazení adekvátní léčby snižuje pravděpodobnost uzdravení. Problémem kromě diagnostiky onemocnění zůstává i otázka zahájení empirické terapie u pacientů s podezřením na mukormykózu, u nichž nebyla mukormykóza definitivně potvrzena. Na jedné straně totiž jsou rychle rostoucí angioinvazivní houby, na druhé straně toxická antimykotická a ve faciální oblasti mutilující chirurgická léčba.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autorky prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všechny autorky rukopis četly, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Financování: Podpořeno MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“).
Do redakce došlo dne 10. 9. 2019
Do tisku přijato dne 19. 4. 2019
Adresa pro korespondenci:
MUDr. Simona Palásková
Zdroje
1. Gavalda J, Meije Y, Fortún J, et al. Invasive fungal infections in solid organ transplant recipients. Clin Microbiol Infect. 2014;20 : 27–48.
2. Petrikkos G, Skiada A, Lortholary O, et al. Epidemiology and clinical manifestations of mucormycosis. Clin Infect Dis. 2012;54 : 23–34.
3. Neofytos D, Fishman JA, Horn D, et al. Epidemiology and outcome of invasive fungal infections in solid organ transplant recipients. Transpl Infect Dis. 2010;12 : 220–229.
4. Prabhu RM, Patel R. Mucormycosis and entomophthoramycosis: a review of the clinical manifestations, diagnosis and treatment. Clin Microbiol Infect. 2004;10 : 31–47.
5. Lemonovich TL. Mold infections in solid organ transplant recipients. Infect Dis Clin North Am. 2018;32 : 687–701.
6. Skiada A, Lass-Floerl C, Klimko N, et al. Challenges in the diagnosis and treatment of mucormycosis. Med Mycol. 2018;56 : 93–101.
7. Hammond PS, Bialek R, Milner DA, et al. Molecular methods to improve diagnosis and identification of mucormycosis. J Clin Microbiol. 2011;49 : 2151–2153.
8. Bialek R, Zelck UE. PCR-diagnostik von mukormykosen aus gewebeschnitten. Der Pathologe. 2013;34 : 511–518.
9. Liu M, Bruni GO, Taylor CM, et al. Comparative genome-wide analysis of extracellular small RNAs from the mucormycosis pathogen Rhizopus delemar. Sci Rep. 2018;8 : 5243.
10. Machouart M, Larché J, Burton K, et al. Genetic identification of the main opportunistic mucorales by PCR-restriction fragment length polymorphism. J Clin Microbiol. 2006;44 : 805–810.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Akutní ischemie mezenteriaČlánek Zelené vlasy po propofolu?Článek EKG lekce 4Článek Zajímavosti, tipy a triky
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2019 Číslo 2- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- EKG lekce 4
- Zajímavosti, tipy a triky
- Klinická výživa v chirurgii – doporučení ESPEN (European Society for Parenteral and Enteral Nutrition) s konsenzuálním hlasováním pracovní skupiny SKVIMP (Společnost klinické výživy a intenzivní metabolické péče)
- Významné životní jubileum doc. MUDr. Jarmily Drábkové, CSc.
- Recenze knihy Pain. Management, Issues and Controversies
- Kognitivní screening u cévních pacientů před operací
- Akutní ischemie mezenteria
- Montgomeryho T tubus při řešení inoperabilní stenózy trachey
- Pozdní probouzení po zresuscitované zástavě srdeční – jaká prognóza?
- Časná poporodní anestezie v České a Slovenské republice z pohledu studie OBAAMA-INT – prospektivní observační studie
- Nové horizonty v regionální anestezii – fascie a ultrazvuk
- Zelené vlasy po propofolu?
- Mukormykotická infekce u pacientů po transplantaci solidních orgánů
- Ošetření poranění podklíčkové tepny v souvislosti s chybným zavedením centrálního žilního katétru či hemodialyzační kanyly
- Internetové zdroje v intenzivní medicíně
- Kritéria Sepsis-3 – jsou pokrokem?
- Doporučení pro diagnostiku, prevenci a léčbu sezonní chřipky
- Vitamin C – od kurdějí k septickému šoku
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinická výživa v chirurgii – doporučení ESPEN (European Society for Parenteral and Enteral Nutrition) s konsenzuálním hlasováním pracovní skupiny SKVIMP (Společnost klinické výživy a intenzivní metabolické péče)
- Montgomeryho T tubus při řešení inoperabilní stenózy trachey
- EKG lekce 4
- Významné životní jubileum doc. MUDr. Jarmily Drábkové, CSc.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



