-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv typu růstového faktoru na fenotyp subpopulací a kinetiku CD34⁺ buněk v periferní krvi a štěpech periferních kmenových buněk pacientů s non-hodgkinskými lymfomy indikovaných k autologní transplantaci krvetvorby
Effect of Growth Factor on the Phenotype of Subpopulations and on the Kinetics of CD34⁺ Cells in the Peripheral Blood and in Grafts of Peripheral Stem Cells in Patients with Non-Hodgkin’s Lymphoma Indicated for Autologous Peripheral Blood Stem Cell Transplantation
Background.
Peripheral blood stem cells are the preferred source for transplantation of hematopoiesis in patients with non-Hodgkin’s lymphoma. Application of hematopoietic growth factors is a part of the mobilization chemotherapy regimen. Time overlap of the highest leukocyte and CD34⁺ cell count is required for optimal graft collection. Authors analyzed the effect of two growth factors (leridistim and filgrastim) on the kinetics and phenotype of CD34⁺ cells in patients with non-Hodgkin’s lymphoma indicated for autologous peripheral blood stem cell transplantation.Methods and Results.
Authors analyzed phenotype of CD34⁺ cell subpopulations and their kinetics in peripheral blood and leukapheresis products by flow cytometry during mobilization and graft collection. Statistically significant differences in expression of lineage-committed antigens between growth factors were found (CD3, CD5 – T-lineage, CD56 NK-lineage, CD20 for B-lineage, p < 0.05), as well as for lineage non–specific antigens (CD38, p < 0.05 and CD54, p < 0.01). The most significant divergence was observed between CD34⁺CD19⁺ subpopulations of leridistim and filgrastim stimulated blood and graft (p < 0.001).Conclusions.
Expression of lineage-committed antigens on CD34⁺ subpopulations between two growth factors was statistically different. Kinetics of CD34⁺ cells during mobilization regimen with leridistim was not superior to filgrastim concerning the quality of graft.Key words:
hematopoietic stem cells, transplantation, growth factors, CD34⁺ cell subpopulation, kinetics
Autoři: M. Klabusay 1; D. Lysák 2; V. Hrabčáková 1; M. Navrátil 1; P. Čoupek 3; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika FN, Brno 1; Hematoonkologické oddělení FN, Plzeň 2; Česká geologická služba 3
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 319-324
Kategorie: Původní práce
Souhrn
Východisko.
Krvetvorné buňky periferní krve jsou preferovaným zdrojem transplantátu při léčbě pacientů s non-hodgkinskými lymfomy. Součástí stimulačního chemoterapeutického režimu je aplikace růstových faktorů. Pro ideální výtěžnost sběru štěpu periferních kmenových buněk je nutný překryv časových oken dosaženého maxima leukocytů a koncentrace CD34⁺ buněk v periferní krvi. Autoři sledovali účinky dvou růstových faktorů (leridistimu a filgrastimu) u pacientů s non-hodgkinskými lymfomy indikovaných k autologní transplantaci na kinetiku a fenotyp CD34⁺ buněk.Metody a výsledky.
Autoři analyzovali fenotyp subpopulací CD34⁺buněk a kinetiku jejich mobilizace v periferní krvi a v produktech leukaferézy metodou flowcytometrie v průběhu stimulace a sběru transplantátu. Statisticky významné rozdíly byly zjištěny mezi jednotlivými stimulačními faktory v expresi antigenů: CD3, CD5 (T-linie), CD56 (NK-linie), CD20 (B-linie), CD38 (p < 0,05) a CD54 (p < 0,01). Nejvýznamnější rozdíl byl pozorován v zastoupení CD34⁺CD19⁺ subpopulace (B-linie) (p < 0,001).Závěry.
Exprese jednotlivých antigenů na CD34⁺ subpopulacích se v závislosti na stimulačním faktoru statisticky významně lišila. Kinetika vyplavování CD34⁺ buněk v průběhu stimulace vzhledem k optimalizaci sběru transplantátu nebyla výhodnější pro leridistim oproti filgrastimu.Klíčová slova:
hematopoetické kmenové buňky, transplantace krvetvorných buněk, růstové faktory, subpopulace CD34⁺ buněk.Hematopoetické kmenové buňky jsou schopny kompletní regenerace kostní dřeně po myeloablativní chemoterapii a pro klinické účely jsou často ztotožňovány s populací buněk exprimujících antigen CD34. CD34+ kompartment však nepředstavuje homogenní populaci: obsahuje hematopoetické pluripotentní kmenové buňky schopné multilineární diferenciace, progenitorové buňky a také prekurzory, které jsou již „lineage-committed“. Buňky fenotypu CD34+HLA-DR- izolované z periferní krve stimulované růstovými faktory jsou schopny indukovat hematopoézu in vitro po dobu 10 týdnů, zatímco u buněk z nestimulované krve je tato doba výrazně kratší (1). Růstové faktory indukují vyplavování frakcí CD34+CD38- buněk do periferní krve (2), obohacených o LTC-IC (long-term culture-initiating cells). Někteří autoři sledovali výskyt jednotlivých subpopulací CD34+ buněk v kostní dřeni a pupečníkové krvi i jejich možný význam pro klinické využití (3). Jednotlivé subfrakce CD34+ kompartmentu disponují také rozdílnými funkčními charakteristikami (4, 5).
Transplantace periferních kmenových buněk (PBSC – peripheral blood stem cells) se stále více upřednostňuje před kostní dření pro rychlejší přihojení štěpu, zkrácení doby hluboké neutropenie a méně invazivní odběr (6). U některých diagnóz (např. akutní myeloidní leukémie) je použití PBSC transplantátů limitováno rizikem přítomnosti buněk s maligním fenotypem (7). Růstové faktory stimulují vyplavování progenitorových a prekurzorových buněk do periferní krve a umožňují jejich sběr (8). Celkové množství T - a B-lymfocytů se po aplikaci faktoru stimulujícího vyzrávání granulocytů (G-CSF, filgrastim) rovněž zvyšuje, ale nebyla prokázána jeho klinická významnost (9). Naopak aplikace filgrastimu po převodu štěpů bohatých na hemopoetické progenitory pravděpodobně více než proliferaci potencuje jejich maturaci do granulocytární řady, a to zřejmě na úkor megakaryopoézy se zpomalením normalizace trombocytů (10).
Sledování koncentrací CD34+ buněk v periferní krvi je spolehlivým ukazatelem pro zahájení separací PBSC. Časné posttransplantační výsledky ukazují přihojení štěpu v průměru za 10 dní s nevelkou spotřebou substituční terapie transfuzními přípravky (11). Koncentrace CD34+ buněk se analyzuje standardně v transplantátu i v periferní krvi během mobilizace. Dosud je známo málo o účinku různých růstových faktorů na subpopulace CD34+ buněk. Zdá se pravděpodobné, že proporce těchto subpopulací v periferní krvi pacientů budou závislé na použitém růstovém faktoru, resp. na jejich kombinacích (G-CSF, stem cell factor, a jiné (12, 13).
Před časem získal pozornost nový chimerický hematopoetický růstový faktor z myelopoietinové rodiny leridistim, který působí jako agonista obsazující povrchové buněčné receptory pro interleukin-3 (IL-3) a pro faktor stimulující kolonie granulocytů (G-CSF), působí na buněčnou proliferaci, formování CFUs (colony forming unit) a diferenciaci CD34+ buněk (12). Tato bivalentní avidita může vysvětlovat různorodé biologické účinky jako i vliv na hemopoetické buňky v porovnání se samotným G-CSF nebo IL-3. V porovnání s lidským IL-3 (rh-IL-3) disponuje leridistim vyšší afinitou k α-řetězci receptoru pro IL-3, ale jeho vazebná kapacita k heterodimerickému IL-3ß receptoru je nižší než u rhIL-3 (13, 14). Na zvířecích modelech byl prokázán jeho pozitivní vliv na hematopoietickou aktivitu, a to i v kombinaci s jinými cytokiny (15). Studium tohoto geneticky upraveného růstového faktoru dalo příležitost srovnat jeho účinek na stimulaci hematopoetických kmenových buněk s účinkem G CSF (filgrastim), jenž je používán standardně v protokolech sběru štěpu. Znalost kinetiky subpopulací CD34+ kompartmentu se může stát přínosem pro predikci engraftmentu, překlenutí trombocytopenie a granulocytopenie či prevenci reakce štěpu proti hostiteli (GvHD – graft-versus-host disease) u transplantovaných (16, 17). Autoři předkládají výsledky analýzy CD34+ buněk a CD34+ subpopulací z periferní krve a PBSC pacientů, kteří podstoupili stimulační chemoterapeutický režim buď s G-CSF, nebo leridistimem.
SOUBOR PACIENTŮ A POUŽITÉ METODY
Pacienti
Do klinické studie srovnání preparátů leridistim (Searle, USA) a filgrastim (r-metHuG-CSF, Amgen, Inc., USA) bylo zařazeno 19 pacientů, 7 žen a 12 mužů (pro bližší charakteristiku souboru viz tab. 1). Dle protokolu popsaného níže podstoupili pacienti úspěšnou analýzu fenotypizace subpopulací CD34. Pacienti byli léčeni kombinací cyklofosfamidu a etoposidu (režim E-Cykl, Etoposid 200 mg/m2 den 1–3, Cyklofosfamid 4 g/m2 den 1) s následnou aplikací jednoho z růstových faktorů. Všechny krevní vzorky a vzorky PBSC byly odebrány v souladu s informovaným souhlasem pacienta.
Tab. 1. Bližší charakteristika souboru pacientů a srovnání skupin s aplikovaným leridistimem vs. G-CSF 
s.d. – standard deviation = směrodatná odchylka, NHL – non–hodgkinský lymfom, HD – Hodgkinova nemoc, RT – radioterapie Sběr a analýzy vzorků
Analýzy byly prováděny následovně: 1. den stimulační chemoterapie – stanovení CD34+ buněk v periferní krvi (negativní kontrola), 10. den (nebo počet leukocytů (wbc) 1, pokud dříve) až 15. den (nebo poslední separace kmenových buněk periferní krve, pokud později) – denně stanovení CD34+ buněk v periferní krvi. Pokud dosáhly hodnoty wbc 1 a CD34+ 0,1 % (absolutní počet CD34+ 5×106/1), byla provedena fenotypizace subpopulací CD34+ buněk v periferní krvi. V den separace kmenových buněk periferní krve byly stanoveny CD34+ buňky a provedena fenotypizace subpopulací CD34+ buněk v produktu leukaferézy.
Flowcytometrická analýza subpopulací CD34+
Vzorky periferní krve nebo leukaferézy byly inkubovány po dobu 30 minut s přímo označenými monoklonálními protilátkami v saturující koncentraci při 4°C. Po inkubaci byly lyzovány erytrocyty ve vzorku a vzorek analyzován po fixaci. Analýza se prováděla na flow cytometru Epics XL (Beckman-Coulter, USA) vybaveném argonovým laserem, třemi fotonásobiči pro analýzu fluorescence a softwarem XL2. Byly použity přímo označené monoklonální protilátky (Caltag, Becton-Dickinson, Immunotech, USA) a provedeny příslušné negativní kontroly. K analýze subpopulací CD34+ byla použita směs protilátek označených fluorescein isothiocyanátem (FITC), R-phycoerythrinem (PE) a peridinin chlorophyl proteinem (PerCP). Relativní exprese antigenů byla stanovena na populaci CD34+ ve speciálně navrženém tříbarevném multigatingovém protokolu. Na populacích CD34+ buněk byly analyzovány antigeny CD2, CD3, CD5, CD7, CD10, CD19, CD20, CD33, CD38, CD45, CD54, CD56, CD71, CD90 a HLA-DR. Výsledky byly vyjádřeny jako relativní hodnoty – % CD34+ buněk ze všech leukocytů a % jiných antigenů exprimovaných na CD34+ buňkách ze všech CD34+ buněk. Zastoupení CD34+ bylo kalkulováno jako vážený průměr vzhledem ke dni měření společně se směrodatnou odchylkou. Absolutní hodnoty CD34+ buněk byly kalkulovány z relativních hodnot a koncentrací leukocytů (wbc).
Statistická analýza
Pro sledování případného rozdílu mezi skupinami s leridistimem a filgrastimem byl pro každou zkoumanou koncetraci některé ze subpopulací CD34+ buněk použit smíšený lineární model:
Yij(t)=Ai + Bi + ai + cit + dit2 + εij,
kde Yij(t) je j-té pozorování zkoumané veličiny, tj. koncentrace některé ze subpopulací CD34+ buněk, v i-té skupině ve dni t. Index probíhá uvažované skupiny s různými růstovými faktory (i = 0 pro leridistim, resp. i = 1 pro filgrastim), ai, bi, a ci jsou regresní koeficienty pro polynom druhého stupně uvnitř dané skupiny pacientů, Ai je regresní koeficient v modelu třídění skupin (leridistim, resp. filgrastim), Bi je regresní koeficient v modelu třídění skupin (periferní krev, resp. PBSC). Volba polynomu vycházela z předpokladu, že zkoumaná veličina bude v průběhu času měnit svou hodnotu nejprve směrem dolů a pak opět poroste. Je to přirozená aproximace uvažovaného průběhu chování zkoumané veličiny v čase. V tomto modelu může být toto chování odlišné pro obě skupiny pacientů, např. doba minima křivky. Symboly εij jsou označeny nezávislé náhodné veličiny se shodným rozdělením N(0,σ2). Ve výše uvedeném modelu byla provedena analýza rozptylu mezi skupinami leridistimu a filgrastimu.
Výsledky
Výsledky pro každou analýzu jsou sumarizovány v tabulkách a vyjádřeny rovněž ve formě grafů pro periferní krev a pro štěpy kmenových buněk periferní krve. Průměrné hodnoty a směrodatné odchylky se používaly jako charakteristiky údajů a byla stanovena kinetika kmenových buněk CD34+ v periferní krvi a štěpu PBSC, jakož i průměrné zastoupení jejich subpopulací. Pacienti byli rozděleni do dvou skupin (leridistim a G-CSF) podle aplikovaného růstového faktoru.
Všichni pacienti byli transplantováni. Pacientům stimulovaným leridistimem bylo podáno 15,0×106Ī7,0×106 CD34+ buněk. Pacientům stimulovaným G-CSF bylo podáno 16,0×106 Ī 13,4×106 CD34+ buněk.
Analýza CD34+ buněk
Absolutní hodnoty CD34+ buněk, kalkulovány z průměru relativních hodnot zjištěných pomocí flow cytometrie a hodnot wbc, jsou uvedeny v tabulce 2. Jako negativní kontrola byly analyzovány vzorky krve v den 1 před zahájením chemoterapie. Medián koncentrace CD34+ buněk v den 1 byl roven nule, průměr Ī s.d. relativní 0,03 Ī 0,02 % a absolutní 0,0015 Ī 0,0010 × 109/l. Relativní a absolutní počty CD34+ buněk jsou analyzovány v periferní krvi nezávisle pro skupiny stimulované leridistimem a G-CSF. Kinetika vyplavování CD34+ buněk v krvi je porovnána s nárůstem leukocytů po stimulaci (obr. 1).
Tab. 2. Kinetika CD34+ buněk a leukocytů v periferní krvi po stimulaci G-CSF a leridistimem 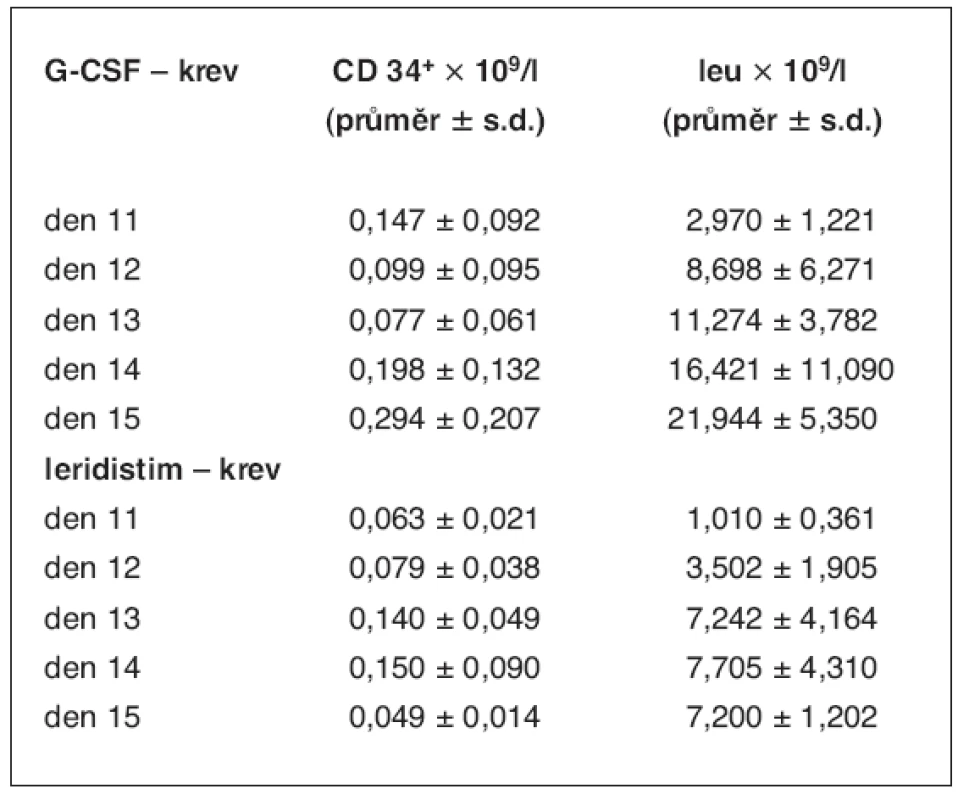
V tabulce jsou uvedeny hodnoty průměrů absolutního množství CD34+ buněk a počtu leukocytů v periferní krvi pacientů stimulovaných rozdílnými růstovými faktory. Obr. 1. Absolutní počty CD34+ buněk a leukocytů v periferní krvi jako funkce času od zahájení aplikace leridistimu a G-CSF u pacientů se stimulačním režimem chemoterapie (CD34+ × 109/l – absolutní hodnota CD34+ buněk v periferní krvi, leu – absolutní hodnota leukocytů; časová osa – den 11–16 stimulace) 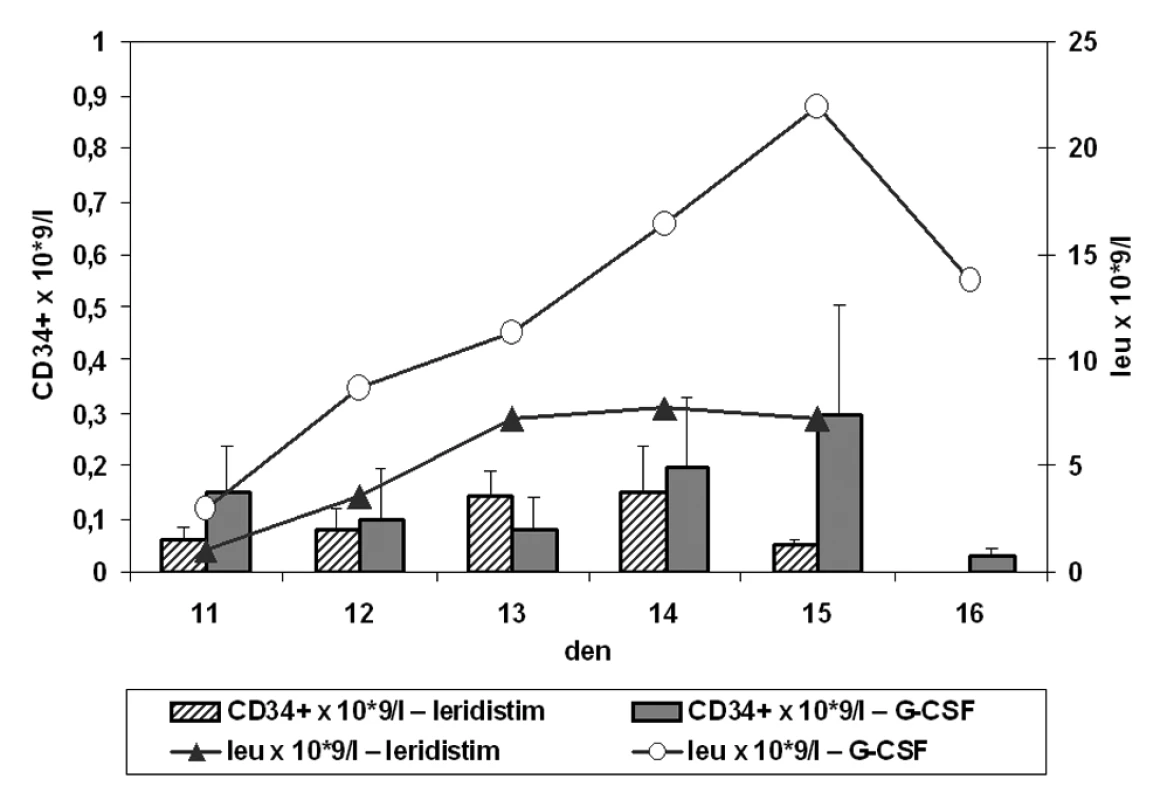
Analýza subpopulací CD34+ buněk
Relativní exprese 12 antigenů na populaci CD34+ buněk je analyzována v periferní krvi a štěpech kmenových buněk periferní krve po stimulačním režimu, zvlášť pro skupinu pacientů léčených leridistimem a pro skupinu pacientů léčených G-CSF (obr. 2, 3).
Obr. 2. V následujícím grafu jsou uvedeny vážené průměryexprese antigenů na CD34+ buňkách v periferní krvi u pacientů stimulovaných leridistimem a G-CSF včetně směrodatných odchylek 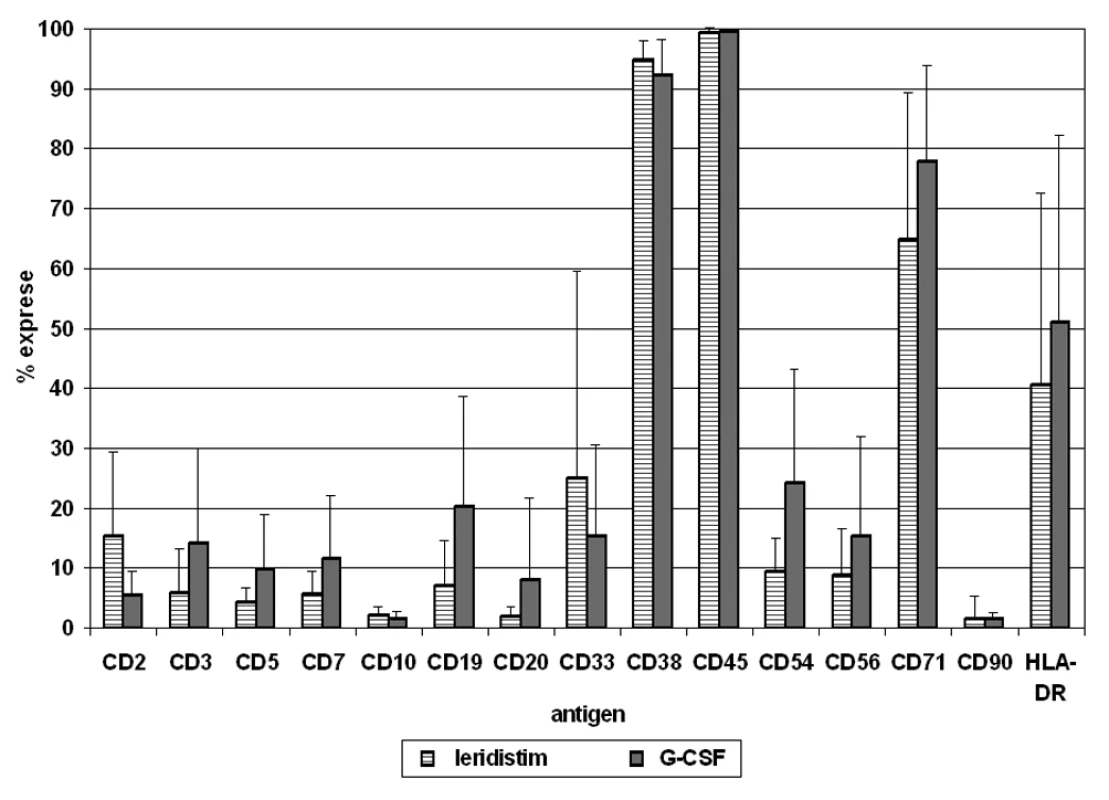
Obr. 3. V následujícím grafu jsou uvedeny vážené průměry exprese antigenů na CD34+ buňkách štěpu kmenových buněk periferní krve (PBSC) pro pacienty stimulované leridistimem a G-CSF včetně směrodatných odchylek 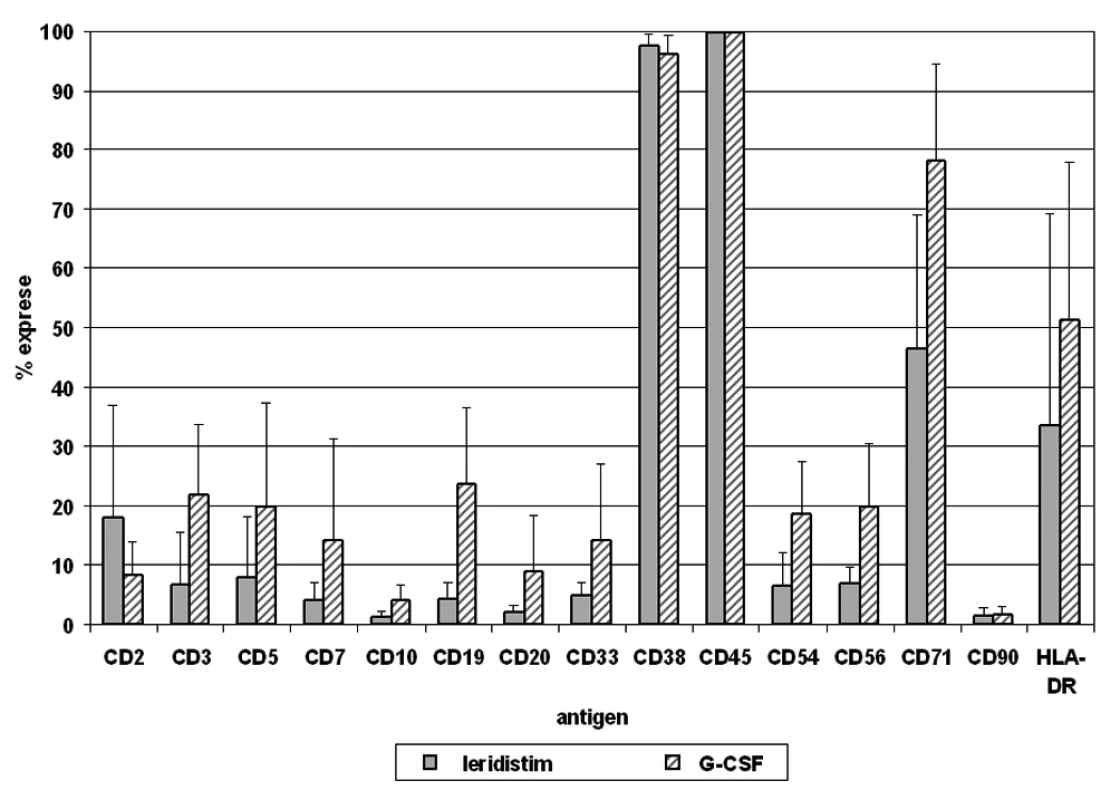
Statistická analýza
V tabulce 3 jsou zachyceny hladiny významnosti pro zamítnutí nulové hypotézy ve výše popsaném modelu (tj. H nebyl určen rozdíl hodnot mezi oběma růstovými faktory). Výsledky uvádíme pouze pro ty subpopulace, kde se vyskytl významný rozdíl mezi hodnotami. Označení hvězdičkami odpovídá dosažené hladině významnosti.
Tab. 3. Statisticky významné rozdíly v zastoupení subpopulací CD34+ buněk mezi oběma růstovými faktory 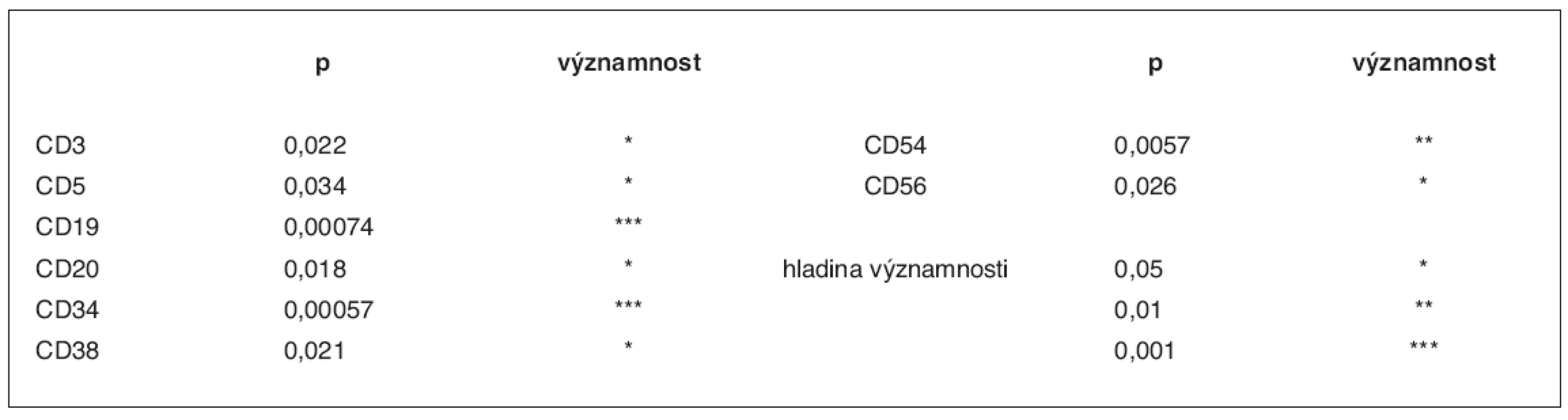
V tabulce jsou uvedeny nejvýznamnější rozdíly mezi stimulačním režimem s použitím G-CSF a režimem s leridistimem zjištěné pomocí analýzy rozptylu. p – hladiny významnosti pro zamítnutí hypotézy o shodnosti stimulačních režimů v modelu (viz text) Výzkum a analýza CD34+ buněk v periferní krvi a štěpech kmenových buněk periferní krve odhalily významné rozdíly mezi farmakologickými účinky leridistimu a filgrastimu v rámci stimulační chemoterapie. Z uvedených údajů autoři shrnují následující závěry:
Změny v leukocytech periferní krve a CD34+ buňkách po stimulaci růstovým faktorem G-CSF ukazují překryv s oknem ideální kolekce kmenových buněk periferní krve 14. a 15. den stimulační chemoterapie (obr. 1). Po stimulaci leridistimem se v krvi objeví CD34+ buňky ve vysoké relativní koncentraci, která ale klesá v době, kdy počet leukocytů narůstá. Tudíž relativní maxima CD34+ buněk a leukocytů periferní krve se v případě leridistimu míjejí, a to snižuje absolutní koncentraci CD34+ buněk v krvi (tab. 2).
Analýza antigenů na CD34+ buňkách po stimulaci oběma faktory ukazuje téměř 100% expresi antigenu CD45, vysokou úroveň exprese CD38 a CD71 a střední úroveň exprese HLA-DR. Fenotyp subpopulací CD34+ buněk v PBSC přitom reflektuje jejich relativní zastoupení v periferní krvi. CD34+ buňky stimulované leridistimem mají významně nižší expresi antigenů specifických pro jednotlivé linie. Byl zjištěn rozdíl v expresi antigenů B, T, NK i myeloidní linie. Nejvýznamnější rozdíly byly pozorovány v expresi antigenu CD19 linie B na populaci CD34+ buněk. Významné rozdíly byly také pozorovány v expresích antigenů linie T (CD3, CD5), antigenu linie NK (CD56), dalšího antigenu linie B (CD20), a v linii nespecifických antigenů (CD38, CD54) (tab. 3).
Diskuze
Většina CD34+ buněk jsou buňky více či méně předurčené k diferenciaci do jedné z linií. Tyto buňky by mohly být identifikovány jako buňky exprimující jeden nebo více antigenů specifických pro určitou linii, přičemž jsou zodpovědné za rychlou fázi přihojení štěpu. Na druhé straně jsou pluripotentní kmenové buňky zodpovědné za dlouhodobé přihojení a jsou také schopny se diferencovat do všech linií krevních buněk, ale plná obnova funkce kostní dřeně je pomalejší. Podávání růstových faktorů v procesu mobilizace před plánovanou transplantací hematopoetických buněk vede ke změnám v relativním i absolutním zastoupení většiny krevních elementů. Hassan et al. uvádí, že obnovení hematopoézy u příjemců alogenního štěpu PBSC může být způsobeno početnějším zastoupením myeloidních progenitorů CD34+CD33+ a CD34+HLA–DR – v transplantátu (18). Mayer et al. prokázal, že u autologních štěpů není počet mononukleárních buněk vhodným nástrojem na predikci engraftmentu štěpu, zatímco nejvýznamnějším parametrem je dostatečný počet CD34+ buněk a CFU-GM (colony forming unit granulocyte macrophage) (19).
V současné době je pro potřeby transplantace hematopoetických kmenových buněk (HSC, hematopoetic stem cells) standardně využíván jen preparát filgrastim (rekombinantní lidský G-CSF, r-metHu G-CSF), který potencuje nástup leukocytózy a přechodnou trombocytopenii během samotného sběru HSCs a jeho nežádoucí účinky jsou malé. Leridistim (myelopoietin) je stejně jako G-CSF schopen uvolňovat vysoké frakce CD34+ buněk v periferní cirkulaci, když je podáván jako součást stimulačního chemoterapeutického režimu. Průměrný relativní počet CD34+ buněk překračuje 6 % leukocytů, ve srovnání s pouze 1 % u G-CSF. I přes tuto jeho zjevně výhodnou vlastnost se jeho aplikace neprojevila jako optimální – vrcholu počtu CD34+ buněk v periferní krvi bylo totiž dosaženo dříve než vrcholu počtu leukocytů, čímž se promeškalo ideální časové okno pro sběr kmenových buněk periferní krve a celkový výnos CD34+ buněk byl nižší. Klabusay et al. sledoval efekt mobilizace hematopoetických kmenových buněk pomocí G-CSF v krvi a transplantátech PBSC u zdravých dárců PBSC i vliv leukaferézy na populace leukocytů a na kinetiku hematopoetických kmenových buněk. Absolutní koncentrace CD34+ buněk v periferní krvi dárců PBSCs vzrostla od začátku stimulace G-CSF do dne 4 v průměru 26×, přičemž počet CD34+ buněk v periferní krvi narůstal během mobilizace až po den 5 relativně i absolutně. V absolutních hodnotách dochází do dne 4 k současnému vzestupu T, B i NK lymfocytů (17). Okno optimálního sběru CD34+ buněk se shoduje i s výsledky jiných autorů (např. 20).
V porovnání s CD34+ buňkami, které byly stimulovány G-CSF, CD34+ buňky stimulované leridistimem exprimovaly antigeny specifické pro linii u menšího počtu buněk. Tento jev pravděpodobně koreluje se stupněm diferenciace CD34+ buněk, a tudíž vyšší procento progenitorů specifických pro linii mezi CD34+ buňkami stimulovanými G-CSF. Velká část buněk stimulovaných G-CSF exprimuje antigen CD71 (pravděpodobně tvoří progenitory erytropoetické linie) a asi 20 % buněk exprimuje antigeny CD19 (progenitory B-linie). Zbytek těchto buněk jsou progenitory zadané v myeloidních, T a NK liniích. Hematopoetické pluripotentní kmenové buňky tvoří jen malou část CD34+ buněk objevující se v periferní krvi v relativně stabilních proporcích po stimulaci. Z kompartmentu CD34+ buněk stimulovaných leridistimem méně buněk exprimuje antigen CD71 a jen 5% antigen CD19. Nižší expresi lze pozorovat také u antigenů CD3, CD5, CD7, CD20 a CD56. Tyto výsledky naznačují, že v kompartmentu CD34+ buněk existují méně diferencované progenitorové buňky. Nejvýznamnější rozdíly jsou u antigenu CD19 linie B v porovnání s CD34+ buňkami stimulovanými G-CSF. Exprese povrchového leukocytárního antigenu CD45 je vysoká při obou typech stimulačního režimu. CD34+ buňky stimulované leridistimem mají v porovnání s buňkami stimulovanými G-CSF významně nižší expresi antigenů specifických pro linii. Nabholtz et al. prokázal, že G-CSF je v porovnání s leridistimem také významějším profylaktickým faktorem při prevenci febrilní neutropenie u pacientů s pokročilým nádorem prsu (21). Vyšší proporce méně diferencovaných CD34+ buněk v transplantátu může teoreticky vést k prodloužení doby zotavení kostní dřeně a k vyššímu výskytu komplikací po chemoterapii.
Zkratky
CFU – colony forming unit
CFU-Blast – colony forming unit – blast
CFU-GM – colony forming unit granulocyte-macrophage
FITC – fluorescein isothiokyanát
G-CSF – granulocyte-colony stimulating factor
GvHD – graft versus host disease, reakce štěpu proti hostiteli
HSC – hematopoetic stem cell, hematopoetická kmenová buňka
IL-3 – interleukin-3
LTC-IC – long-term culture-initiating cells
PBSC – peripheral blood stem cells, periferní kmenové buňky
PE – R-phycoerythrin
PerCP – peridinin chlorophyl protein
rh-IL-3 – lidský IL-3
wbc – white blood cells, leukocyty
doc. MUDr. Martin Klabusay, Ph.D.
Interní hematoonkologická klinika FN
Jihlavská 20, 625 00 Brno
fax: +420 532 233 603, e-mail: mklabus@fnbrno.cz
Zdroje
1. Tong, J., Gianni, A. M., Siena, S. et al.: Primitive hematopoietic progenitor cells are present in peripheral blood autografts. Blood Cells, 1994, 20, s. 351–363.
2. Lozano, M. L., Ortuno, F., de Arriba, F. et al.: Effect of rhG-CSF on the mobilization of CD38 and HLA-DR subfractions of CD34+ peripheral blood progenitor cells. Ann. Hematol., 1995, 71, s. 105–110.
3. Novelli, E. M., Ramirez, M., Civin, C. I.: Biology of CD34+CD38 - cells in lymphohematopoiesis. Leuk. Lymphoma, 1998, 31, s. 285–293.
4. Rusten, L. S., Jacobsen, S. E. W., Kaalhus, O. et al.: Functional differences between CD38 - and DR - subfractions of CD34⁺ bone marrow cells. Blood, 1994, 5, s. 1473–1481.
5. Sakabe, H., Ohmizono, Y., Tanimukai, S. et al.: Functional differences between subpopulations of mobilized peripheral blood-derived CD34+ cells expressing different levels of HLA‑DR, CD33, CD38 and c-kit antigens. Stem Cells, 1997, 15, s. 73–81.
6. Fritsch, G., Stimpfl, M., Kurz, M. et al.: The composition of CD34 subpopulations differs between bone marrow, blood and cord blood. Bone Marrow Transplant., 1996, 17, s. 169–178.
7. Feller, N., Schuurhuis, G. J., van der Pol, M. A. et al.: High percentage of CD34-positive cells in autologous AML peripheral blood stem cell products reflects inadequate in vivo purging and low chemotherapeutic toxicity in a subgroup of patients with poor clinical outcome. Leukemia, 2003, 17, s. 68–75.
8. Pytlík, R., Trnková, M., Trněný, M.: Autologní transplantace krvetvorných buněk v České republice. Čas. Lék. čes., 2003, 142, s. 733–735.
9. Arat, M., Arslan, O., Gurman, G. et al.: The impact of granulocyte colony stimulating factor at content of donor lymphocytes collected for cellular immunotherapy. Transfus. Apheresis Sci., 2004, 30, s. 9–15.
10. Raida, L, Faber, E., Papajík, T. et al.: Ovlivňuje kvalita štěpu a aplikace filgrastimu rekonstituci krvetvorby a výsledky autologních transplantací krvetvorných kmenových buněk u nemocných s maligními lymfomy? Trans. Hemat. dnes, 2003, 9, s. 125–131.
11. Gašová, Z., Ludvíková, Z., Kučerová, I. et al.: Separace hemopoetických progenitorových buněk z periferní krve (PBPC) u pacientů s hematoonkologickými malignitami. Čas. Lék. čes., 1999, 138, s. 369–373.
12. Abegg, A. L., Vickery, L. E., Bremer, M. E. et al.: The enhanced in vitro hematopoietic activity of leridistim, a chimeric dual G-CSF and IL-3 receptor agonist. Leukemia, 2002, 16, s. 316–326.
13. Hess, D. A., Levac, K. D., Karanu, F. N. et al.: Functional analysis of human hematopoietic repopulating cells mobilized with granulocyte colony-stimulating factor alone versus granulocyte colony-stimulating factor in combination with stem cell factor. Blood, 2002, 100, s. 869–878.
14. Monahan, J. B., Hood, W. F., Welply, J. K. et al.: Bivalent binding and signaling characteristics of Leridistim, a novel chimeric dual agonist of Interleukin-3 and granulocyte colony-stimulating factor receptors. Exp. Hematol., 2001, 29, s. 416–424.
15. Farese, A. M., Casey, D. B., Smith, W. G. et al.: Leridistim, a chimeric dual G-CSF and IL-3 receptor agonist, enhances multilineage hematopoietic recovery in a nonhuman primate model of radiation induced myelosuppression: effect of schedule, dose, and route of administration. Stem Cells, 2001, 19, s. 522–533.
16. Chang, Q., Harvey, K., Akard, L. et al.: Differences in CD34+ cell subpopulations between human bone marrow and “mobilized” peripheral blood as determined with counterflow centrifugal elutriation. Exp. Hematol., 1997, 25, s. 423–431.
17. Klabusay, M., Suková, V., Kořístek, Z. et al.: Analýza fenotypu a kinetiky subpopulací CD34⁺ buněk a lymfocytů dárců periferních hematopoetických kmenových buněk pro alogenní transplantace. Čas. Lék. čes., 2003, 142, s. 410–416.
18. Hassan, H. T., Stockschlader, M., Schleimer, B. et al.: Comparison of the content and subpopulations of CD3 and CD34 positive cells in bone marrow harvests and G-CSF-mobilized peripheral blood leukapheresis products from healthy adult donors. Transpl. Immunol., 1996, 4, s. 319–323.
19. Mayer, J., Kořístek, Z., Pospíšil, Z. et al.: Kinetika obnovy krvetvorby po vysokodávkované chemoterapii a autologní transplantaci periferních kmenových buněk. Čas. Lék. čes., 1999, 138, s. 170–177.
20. Hashimoto, S., Itoh, M., Nishimura, M., Asai, T.: Effect of filgrastim administration for steady-state mobilization of peripheral blood stem cells. Ther Apher., 2002, 6, s. 431–436.
21. Nabholtz, J. M., Cantin, J., Chang, J. et al.: Phase III trial comparing granulocyte colony-stimulating factor to leridistim in the prevention of neutropenic complications in breast cancer patients treated with docetaxel/doxorubicin/cyclophosphamide: results of the BCIRG 004 trial. Clin. Breast Cancer, 2002, 3, s. 268–275.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Klinická pastorační péčeČlánek Intentio duplexČlánek Future Human EvolutionČlánek Laureáti Nobelovy ceny
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
-
Všetky články tohto čísla
- Lékařská etika a etikoterapie II
- Metabolický syndrom a kožní onemocnění
- Pošetilosti a omyly v medicíně
- Poruchy chování u sedmiletých dětí – výsledky studie ELSPAC2. část: Rizikové faktory*
- Mitochondriální membrána, Mitochondrie a jejich bakteriální původ
- Vliv typu růstového faktoru na fenotyp subpopulací a kinetiku CD34⁺ buněk v periferní krvi a štěpech periferních kmenových buněk pacientů s non-hodgkinskými lymfomy indikovaných k autologní transplantaci krvetvorby
- Změny v močovém měchýři po krátkodobém zavedení permanentního katétru
- Alkaptonurie a tvorba močových konkrementů
- Hypokalémie u suicidálního pokusu dospívající dívky
- Mechanismus biogeneze barelových proteinů
- Risk factors for clustering of tuberculosis cases: a systematic review of population-based molecular epidemiology studies
- HIV and malaria co-infection: interactions and consequences of chemotherapy
- Oseltamivir (Tamiflu(R) increases dopamine levels in the rat medial prefrontal cortex
- Výuka humanitních věd na lékařských fakultách
- Klinická pastorační péče
- Intentio duplex
- Posttraumatický rozvoj člověka – nové poznatky
- Psychofyziologické projevy doprovázející konsolidaci traumatické paměti
- Disociativní symptomy a neuroendokrinní dysregulace
- Bludný kruh psychosomatických vztahů v estetické chirurgii
- Psychodynamika a psychosomatika
- Podaří se v České republice zavést segment základní psychosomatické medicíny?
- MOPRA – modifikovaná odborná praxe
- Etika jako předmět ve zdravotnických vzdělávacích programech v České republice
- Plány a perspektivy výuky psychosomatiky a komunikace u poslouchačů LF MU v Brně
- Vztah lékaře a pacienta na počátku 21. století
- HORIZONTY PREVENTIVNÍ GERONTOLOGIE PRO LÉKAŘE V PRAXI
- Tesco a ČLS JEP podporují výzkum rakoviny
- Spolek lékařů českých v Praze
- Future Human Evolution
- Zevní dermatologická terapie a kosmetikaPohledy klinické a fyziologické
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Alkaptonurie a tvorba močových konkrementů
- Změny v močovém měchýři po krátkodobém zavedení permanentního katétru
- Metabolický syndrom a kožní onemocnění
- Psychodynamika a psychosomatika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



