-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vyšetřovací metody na pomezí biochemie a imunologie
Analytical Methods at the Boundary between Biochemistry and Immunology
The article presents assays shared by both disciplines; i.e the specialization 801 (Clinical Biochemistry) and 813 (Laboratory of Allergology and Immunology), and it covers over 60 tests. It is intended as reference information for general practitioners, as well as for laboratory workers at the beginning of their studies. Emphasis is laid on some facts which GPs ordering laboratory determinations should be familiar with; the pre-analytical stage (specimen collection, their transport and storage), the analytical reliability of particular methods, their accessibility, frequency and total costs. Analytical techniques are only mentioned marginally as their understanding is not essential for GPs. Assuming the readers’ fundamental experience of diagnostic applications of the methods discussed; we only comment some obsolete or rare tests. The shared assays cover selected analyses of proteins (incl. some enzymes and tumormarkers), ions, osmolality and quantitative microscopic urinalysis.
Key words:
shared laboratory outputs, preanalytical phase, tolerance interval.
Autoři: P. Štern 1; V. Král 2
Působiště autorů: Ústav klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN, Praha 1; Centrum imunologie a mikrobiologie, Zdravotní ústav se sídlem v Ústí nad Labem 2
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 415-420
Kategorie: Aktuální téma
Souhrn
Článek se věnuje problematice výkonů, které jsou sdíleny mezi odbornostmi 801 (Klinická biochemie) a 813 (Laboratoř alergologická a imunologická) a týká se více než 60 vyšetření. Měl by sloužit praktickým lékařům využívajícím tato vyšetření a jako doplňující informace pro laboratorní pracovníky v rámci úvodu specializačního studia (tzv. společný kmen). Důraz je kladen na informace, které by měly být známé lékařům objednávajícím uvedená vyšetření, tj. preanalytickou fázi (odběr vzorků, jejich transport a skladování), analytickou spolehlivost metod, jejich dostupnost, frekvenci požadavků a cenovou náročnost. Analytické postupy jsou zmiňovány jen okrajově, neboť jejich znalost pro ordinující lékaře není důležitá. Předpokládáme základní zkušenosti s diagnostickou aplikací diskutovaných metod a uvádíme pouze poznámky v případě obsoletních nebo raritních testů. Sdílené výkony se týkají vybraných vyšetření bílkovin (včetně některých enzymů a tumorových markerů), iontů, osmolality a kvantitativní mikroskopické analýzy moče.
Klíčová slova:
sdílené laboratorní výkony, preanalytická fáze, toleranční rozmezí.Česká společnost klinické biochemie a Česká společnost alergologie a klinické imunologie se dohodly v rámci bilaterálních jednání (mezioborová jednání v letech 1996–1997 o přípravě materiálu Sdílené výkony klinických oborů s laboratorní složkou) na vzájemném sdílení přibližně 30 výkonů od odborností 801 a recipročně zhruba 30 výkonů od odbornosti 813. Sdílené výkony jsou uvedeny v tabulce 1.
Tab. 1. Sdílené výkony zveřejněné ve Zpravodaji VZP 01/99 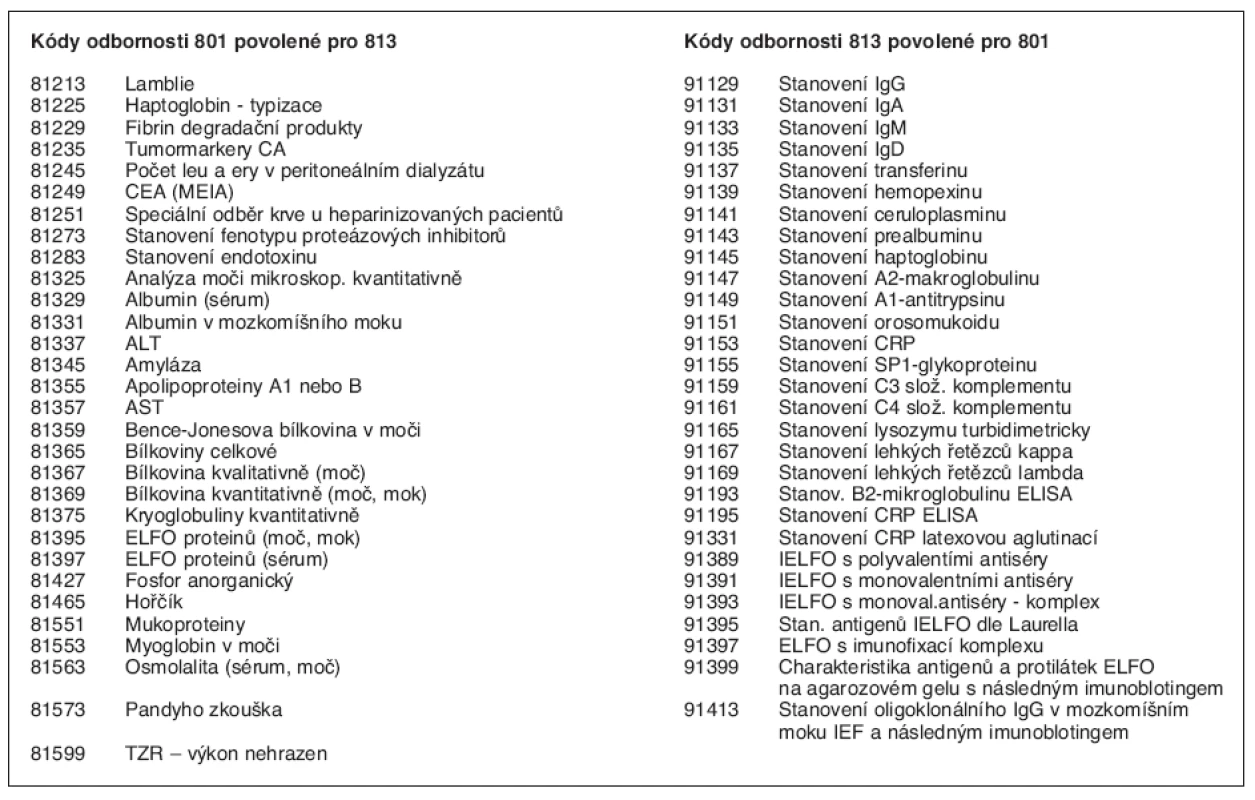
Vzhledem k tomu, že některé kódy platí pro více metod, neodpovídá počet kódů počtu sdílených metod – počet sdílených analytických metod je vyšší. Sdílené výkony jsou širokou lékařskou veřejností využívány pro diagnostické účely a pro monitorování terapie (např. stanovení imunoglobulinů při terapii intravenózními imunoglobuliny nebo monitorování monoklonálních imunoglobulinů). Lékaři běžně pracují s laboratorními výsledky a umějí je dobře interpretovat. Pokud nepracují v laboratořích, vědí už méně o tom, jakými analytickými metodami jsou tyto výsledky zjišťovány a jaká je spolehlivost našich analýz. Předpokládáme, že pro širokou lékařskou obec bude užitečné, když množinu sdílených výkonů uspořádáme do několika tematických skupin a ukážeme, jak vznikají odpovídající laboratorní výsledky. Upozorníme také na preanalytické požadavky, protože jejich splnění je předpokladem získání validních výsledků.
Nejpočetnější skupinou sdílených analytických metod je stanovení bílkovin, které se mohou stanovovat jednotlivě nebo jako suma bílkovin v biologickém materiálu (sérum, moč, likvor). K analýze mohou být využité barevné a srážecí reakce, různé typy imunochemických stanovení nebo jednoduché či důmyslné elektroforetické metody. Mezi bílkoviny patří i enzymy (ALT, AST, amyláza) a všechny uvedené tumorové markery (např. CEA, sacharidové antigeny – CA).
Další skupinu tvoří stanovení některých iontů (hořečnaté kationty a anorganické fosfáty) a s tím související osmolalita.
Kvantitativní mikroskopické vyšetření moče je prakticky jediný výkon z oblasti mikroskopie, neboť průkaz parazitického střevního prvoka lamblie (Giardia lamblia) je požadován zcela ojediněle.
Stanovení celkové bílkoviny
Nejvíce pozornosti věnujeme stanovení bílkovin, protože se jedná přibližně o 90 % metod diskutovaného souboru.
Stanovení celkové bílkoviny v séru se obvykle provádí barevnou reakcí, kdy peptidové vazby reagují s měďnatými ionty v alkalickém prostředí v přítomnosti komplexotvorného činidla za vzniku modrofialového zbarvení. Toleranční rozmezí stanovení je Ī 9 %. V jiných biologických tekutinách (moč, mozkomíšní mok) se používají srážecí, případně barevné reakce a toleranční rozmezí je u těchto stanovení podstatně vyšší, a to pro moč Ī 24 % a mok Ī 27 %. Kvalitativní stanovení bílkoviny v moči je prováděno proužkem, který obsahuje organické barvivo reagující s albuminem tak, že se původně žlutá barva reagenčního políčka mění (podle množství albuminu) přes žlutozelenou, zelenou až na modrozelenou. Citlivost metody se pohybuje mezi 0,15–0,2 g/l. Reakce může být nejasná při mezních hodnotách a také zkreslená zbarvením moče. Proto se v laboratoři provádí ještě konfirmace srážecí reakcí. Preanalytické podmínky ovlivňující výsledky jsou následující: Vstoje dochází k přesunu tekutiny z intravazálního prostoru do intersticia, což vede k zahuštění proteinů v krvi o 10–15 %. Zvýšená svalová aktivita vede také ke zvýšení koncentrace až o 12 %. Také dehydratace vede ke zvýšeným koncentracím. V horku dochází ke zvětšení plazmatického objemu a hladina celkových proteinů může poklesnout až o 10 %. Ke snížení koncentrace bílkovin dochází při lačnění a v graviditě (hemodiluce). Koncentrace celkové bílkoviny v plazmě jsou vyšší než v séru o přírůstek fibrinogenu. Kvalitativní i kvantitativní vyšetření bílkovin patří mezi levná vyšetření.
Elektroforéza proteinů
Elektroforéza bílkovin se provádí obvykle v séru, nebo méně často po zahuštění v moči, případně moku. Takto lze kvantifikovat jednotlivé frakce bílkovin (albumin, α1-, α2-, β1-, β2-, γ-globuliny) obvykle na agarózovém gelu. Je-li laboratoř vybavena automatizovaným systémem, pak lze analyzovat i více než 100 vzorků sér za hodinu. Vyšetření v séru je poměrně levné, zatímco v moči a v moku je přibližně šestkrát dražší. Požadavky na elektroforézy bílkovin v poslední době klesají a lékaři se spíše zajímají o kvantitativní hodnoty specifických proteinů.
Stanovení albuminu
Stanovení albuminu v séruse provádí barevnou reakcí v kyselém prostředí organickými barvivy. Toleranční rozmezí stanovení je Ī 9 %. Barevná reakce je rychlá a vyšetření velmi levné, ale podstatně lepší vypovídací hodnotu má koncentrační vyjádření podílu albuminu při elektroforéze sérových bílkovin. Pokud se sbírá moč pro stanovení albuminu, doporučuje se osmihodinový sběr během nočního odpočinku (od 22. do 6. hodiny) a současně stanovit látkovou koncentraci kreatininu v nasbírané moči. Sběrnou nádobu je třeba uchovávat v chladu a sběr alespoň jednou opakovat. Frekvence stanovení albuminu v moku (imunochemicky) je 150× nižší než v séru a vyšetření je 15× dražší. Při stanovení je toleranční rozmezí 27 %.
Stanovení specifických proteinů
Základními metodami pro stanovení koncentrací plazmatických (sérových) specifických proteinů jsou turbidimetrie a nefelometrie (resp. imunoturbidimetrie, imunonefelometrie). Použití uvedených metod záleží především na koncentraci bílkovin v biologickém materiálu. Pro většinu proteinů séra lze použít turbidimetrii dostupnou v biochemických analyzátorech. Pokud je ale nutné stanovit koncentrace proteinů v oblasti jednotek mg/l či dokonce μg/l, je nutné použít citlivější (cca 10×) metodu nefelometrickou. Imunologické laboratoře používají imunonefelometry zejména při průkazu defektu syntézy imunoglobulinů (např. defekt produkce IgA vyžaduje dosažení citlivosti 10–20 mg/l) nebo stanovení koncentrací specifických proteinů v likvoru. V případě velmi nízkých koncentrací analytu ve vzorku jsou pro stanovení používány další postupy zvyšující citlivost metody (např. tzv. „latexové reagens“), kdy jsou detekční protilátky navázány na velmi malých částicích latexu (polystyrénu) nebo se používají prostředky zesilující precipitaci – nejčastěji polyetylenglykol. Klasická metoda jednoduché radiální imunodifuze se dodnes používá při certifikaci kontrolních materiálů pro imunoturbidimetrii či imunonefelometrii.
Pokud jde o preanalytickou fázi laboratorního vyšetření specifických proteinů, lze konstatovat, že platí všechny obecné zásady, jak byly zmíněny výše. Základní údaje o stabilitě jsou udávány pro primární materiál (sérum/plazma), a to při laboratorní teplotě 1 den, při 4–8 °C 3–5 dnů a v mrazáku při -18 °C 2–3 měsíce. Toleranční rozpětí se pohybuje od 16 % (haptoglobin) až po 39 % (ceruloplazmin). Hladiny specifických proteinů jsou zjišťovány i v dalších materiálech jako např. moč, likvor, výpotky, sliny, slzy aj., ale počet požadavků na tato vyšetření je velmi malý. Sběr moče je bez konzervačních přísad. Během sběru uchovávat při 4–8 °C, vyšetřit do 1 týdne. Finanční hodnocení výkonů u jednotlivých metod je stejné pro všechny uvedené analyzované materiály.
Stanovení imunoglobulinů
Pro stanovení imunoglobulinů IgG, IgA, IgM lze použít jak imunoturbidimetrii, tak imunonefelometrii. Toleranční rozpětí (SEKK ) se pohybuje od 18 % (IgG) do 26 % (IgM).
Preanalytické podmínky jsou pro imunoglobuliny podobné jako u ostatních specifických proteinů a rovněž tak náklady na analýzy jsou přibližně stejné. Vyšetření imunoglobulinů patří mezi nejčastěji indikovaná vyšetření specifických proteinů, avšak diagnostická výtěžnost tohoto vyšetření je nízká. Velká imunologická laboratoř provede za rok přibližně 10 000 vyšetření základních tříd imunoglobulinů. Pracovní skupina pro klinickou imunologii při WHO již před mnoha lety (1989–1991) označila tato vyšetření za „nejvíce zneužívaná“. Odůvodněná indikace je především diagnostika primárních a sekundárních deficitů protilátek, jakož i monitorování terapie intravenózními imunoglobuliny. Naproti tomu při nádorových onemocněních mají tyto analýzy minimální přínos (s výjimkou některých hematologických malignit). Pro kvantitativní stanovení základních imunoglobulinů v likvoru (případně dalších tělních tekutinách) je vhodnější použití imunonefelometrie.
Stanovení IgD není běžně na analyzátorech dostupné. Nicméně některé laboratoře (především imunologické) mají implementovánu tuto metodu a zajišťují dostupnost vyšetření IgD. Základní indikace pro stanovení IgD jsou pouze diagnostika paraproteinu IgD a velmi vzácného onemocnění hyper IgD syndromu v rámci diferenciální diagnostiky horeček nejasného původu. Náklady na vyšetření jsou minimálně 2,5× vyšší než u IgG (malý počet vyšetření, vyšší náklady na kalibrátory a standardy); frekvence analýz je 1–5 % vzhledem k IgG (dle typu laboratoře). Frekvence vyšetření je tedy poměrně vysoká. Důvodem může být značný podíl pacientů oboru alergologie a klinická imunologie, u kterých je jedním z příznaků dlouhodobý stav zvýšených teplot. Toleranční rozmezí lze odhadnout pouze orientačně (přibližně 35 %), protože tato analýza není součástí externích kontrolních hodnocení a výzkumně zaměřené práce jsou poněkud vzdálené od běžné laboratorní praxe.
Stanovení volných lehkých řetězců
Významným vyšetřením se v poslední době stává stanovení volných lehkých řetězců kappa a lambda. Výkony jsou ohodnoceny zhruba dvojnásobkem nákladů na analýzy základních imunoglobulinů a byly původně kalkulovány pro stanovení vázaných lehkých řetězců. Příslušná změna názvu výkonu i textu k výkonu v Sazebníku je v jednání. Frekvence analýz u každé z obou metod se pohybuje mezi 3–10 % požadavků na vyšetření IgG. Toleranční rozmezí metod se pohybuje do 33 %. Přínos vyšetření volných lehkých řetězců imunoglobulinů v séru pravděpodobně povede ke změně algoritmu pro diagnostiku a monitorování paraproteinémií.
Proteiny akutní fáze zánětu
Vedle imunoglobulinů tvoří množinu specifických proteinů řada bílkovin z alfa i beta oblasti elektroforetické pohyblivosti se souhrnným označením proteiny akutní fáze zánětu (PAF). Jejich koncentrace jsou v rozsahu 0,1–4 g/l. Pro stanovení lze použít imunoturbidimetrii i imunonefelometrii. Cenově tato vyšetření příliš nepřesahují základní imunoglobuliny a frekvence jednotlivých analýz je rozdílná. Nejčastěji je žádáno stanovení hladin prealbuminu a transferinu, výrazně méně je analyzován orosomukoid. Lokální rozdíly mezi metodami a laboratořemi jsou značné a mohou se pohybovat v rozmezí 1–50 % ve srovnání s IgG. Z hlediska přínosu pro diagnostiku a monitorování zánětu nemá už jejich stanovování zásadní význam. Ještě před významnějším vyžíváním sacharidových antigenů patřily tyto proteiny mezi tzv. nespecifické markery malignity (např. Cancer Serum Index vyjadřoval poměr orosomukoidu a prealbuminu) nebo markery postižení některých orgánů (index IgA/transferin odpovídal postižení jaterního parenchymu). Některé PAF jsou bílkoviny, které vykazují antiproteázovou aktivitu (inhibitory proteáz jako α-1-antitrypsin a α-2-makroglobulin).
Systém komplementu
Samostatně zmíníme systém komplementu resp. jeho klíčové složky C3 a C4, které patří do skupiny proteinů akutní fáze zánětu. Tento systém lze také charakterizovat jako enzymovou kaskádu limitované proteolýzy. Klíčovými molekulami tzv. klasické dráhy aktivace systému jsou právě složky C3 a C4 a v nedávné minulosti byla snaha využít kvantifikaci těchto proteinů pro určení aktivity systému. Metodické a preanalytické údaje a náklady jsou shodné s ostatními PAF. Frekvence vyšetření u každé z těchto bílkovin dosahuje téměř poloviny počtu požadavků na stanovení IgG a toleranční rozpětí je 20 % (C3) resp. 28 % (C4). Důležité je upozornění, že elektroforetický obraz složek komplementu se liší mezi sérem a plazmou. Při srážení krve je komplement aktivován, a tak v séru na rozdíl od plazmy nacházíme především štěpné produkty aktivace (např. složky C3b, C4b, atd.). Od imunochemického přístupu ke studiu komplementu se v poslední době obrací zájem opět k využití klasických biologických metod stanovení lytické schopnosti komplementu (tzv. CH50). Tato metoda je považována za důležité skríninkové vyšetření biologické aktivity komplementu, především při podezření na funkční defekt. Vyšetření provádí pouze specializované imunologické laboratoře a do sdílených výkonů pochopitelně nepatří.
C-reaktivní protein
Nejdůležitějším proteinem akutní fáze zánětu z popisovaného spektra je C-reaktivní protein (CRP). Patří do skupiny fylogeneticky velmi starých obranných mechanismů přirozené imunity. Charakteristická struktura jej řadí do starobylé vysoce konzervované rodiny pentraxinů. Při bakteriálním ataku se prudce zvyšuje jeho koncentrace v tělních tekutinách, řádově až 1000× v průběhu hodin až dnů. Diagnostický přínos stanovení je nesporný a CRP se stalo součástí spektra vyšetření POCT. Imunochemická analýza umožňuje měřit ve velmi širokém rozsahu koncentrací. Stále více se používá metoda stanovení hsCRP (high sensitivity CRP), kdy nejnižší reprodukovatelně měřitelné hladiny jsou okolo 1 mg/l. Normální koncentrace u zdravých osob jsou obvykle do 5 mg/l, i když některá novější doporučení uvádějí hranici 3 mg/l. Sledování bazálních hladin CRP je dáváno do souvislosti s rizikem rozvoje aterosklerózy. Toleranční rozmezí pro stanovení CRP i hsCRP jsou nízká (do 24 %), metodu lze charakterizovat jako robustní s velmi dobrými analytickými parametry. Preanalytické podmínky vyžadují uchovávat sérum před analýzou v lednici a stanovení provést do 2 dnů. Výsledky ovlivňuje tělesná zátěž, dieta, poloha při odběru. S věkem hodnota stoupá a rovněž tak v těhotenství a u kuřáků. Počet analýz CRP odpovídá diagnostickému významu této bílkoviny a může dosahovat i několikanásobku počtu vyšetření IgG. Náklady na analýzu jsou asi o 10 % nižší než u základních imunoglobulinů.
Vedle výkonu 91153 (Stanovení CRP), k němuž lze výše uvedený text vztahovat, je sdílen také výkon 91195 (CRP ELISA), který má dvojnásobné náklady, ale žádný přínos navíc. Proto jej ČSAKI navrhla k vyřazení ze Sazebníku v roce 2006 (dosud nerealizováno).
Kvalitativní stanovení proteinů
Oblast kvalitativního stanovení proteinů séra (plazmy, jiných tělních tekutin) představuje široké spektrum elektroforetických metod s následnou specifickou detekcí elektroforetických linií pomocí precipitační reakce antigenu a specifického antiséra (imunodifuze), které jsou v Seznamu zdravotnických výkonů soustředěny do šesti položek. Čtyři výkony se používaly k charakterizaci monoklonální produkce imunoglobulinů (paraproteinů). Provázanost sdílených výkonů v oblasti kvalitativního a kvantitativního stanovení proteinů séra (plazmy) mezi odbornosti 801 a 813 je dobře patrná právě na příkladu stanovení a charakterizace paraproteinů. Výše uvedené výkony navazují na výkony odbornosti 801 sdílené pro odbornost 813 (ELFO proteinů v séru, moči a likvoru), které také slouží k průkazu monoklonální M–komponenty imunoglobulinů metodou agaroforézy, resp. agarózoforézy. Velké množství fyzikálně-chemicky stejnorodého materiálu (paraproteinu) se při elektroforéze projeví jako skvrna v gama či beta oblasti elektroforeogramu bílkovin. Tato subjektivní metoda, která vyžadovala značnou laboratorní erudici, byla postupně nahrazena metodou imunofixace. Uvedená technika spojuje elektroforetické dělení proteinů s následnou imunofixační reakcí (inkubace po převrstvení specifickým antisérem) a vizualizací vzniklého imunokomplexu. Metoda se velmi rychle rozšířila; vykazuje vyšší citlivost (cca 10× proti IELFO, tj. 0,5 g/l vs. 5g/l) a nevyžaduje takovou zkušenost hodnotícího pracovníka. Určitou daní za vyšší citlivost je otázka správné interpretace průkazu malého množství paraproteinů (do 5 g/l), spadajících pod diagnostické označení „monoklonální gamapatie neurčitého významu“ nebo transientní monoklonalita. Bohužel, na podkladě takových nálezů jsou pacienti někdy vystavováni stresu z vyšetření kostní dřeně a scintigrafie skeletu pro vyloučení malignity. Stanovení koncentrace paraproteinů v séru a moči je v současnosti podporováno řadou vyspělých firemních programů a v rámci externího hodnocení kvality je akceptováno toleranční rozmezí 33 %. Tato exaktní a přínosná vyšetření jsou poměrně velmi drahá (nejméně šestinásobek původních kvalitativních metod).
Za velmi speciální vyšetření, vyhrazené jen omezenému počtu pracovišť, lze považovat průkaz oligoklonální produkce IgG v mozkomíšním moku metodou izoelektrické fokusace (IEF) s následnou imunodetekcí (imunobloting, imunofixace). Vyšetření je nezbytné především pro diferenciální diagnostiku roztroušené sklerózy. Četnost požadavků na toto vyšetření může dosahovat v některých laboratořích i více než 1000/rok. Kodifikované požadavky na preanalytickou fázi vyšetřenílikvoru jsou: zkumavky bez protisrážlivých činidel, odstředěný likvor analyzovat do 3 hodin při skladování za laboratorní teploty nebo do 1 týdne při 4–8 °C. Charakterizace paraproteinu i průkaz oligoklonální produkce IgG v likvoru jsou pouze kvalitativní vyšetření.
Apolipoproteiny
Vyšetření apolipoproteinů AI a B v séru nebo plazmě jsou poměrně často požadovaná. Z mnoha postupů, které byly popsány, postačuje informace o turbidimetrickém stanovení, které provádí většina laboratoří; případně s využitím nefelometru v některých velkých laboratořích. Toleranční rozmezí stanovení je Ī 21 %. Před odběrem se vyžaduje 12 hodin lačnění. Cena stanovení se pohybuje v intervalu běžných analýz specifických proteinů.
Tumorové markery
Stanovení tumorových markerů CEA (karcinoembryonální antigen) a sacharidových antigenů CA 125, CA 15-3, CA 19-9 a v poslední době i CA 72-4 jsou poměrně častá a jen v největší biochemické laboratoři překročil počet analýz 32000 ročně. Ke kvantitativní analýze těchto makromolekul se používají heterogenní imunoanalytické metody, které vyžadují separaci vzniklého imunokomplexu antigenu s protilátkou od volných reaktantů. Poté následuje navázání druhé protilátky se značkou, která je schopna (přímo nebo po další úpravě) vykazovat chemiluminiscenci, fluorescenci, radioaktivitu nebo zabarvení roztoku. Jednotlivé detekční techniky se používají co do frekvence v pořadí, jak byly v předchozí větě vyjmenovány. Při stanovení tumorových markerů je významný vliv použité matrice v komerční analytické soupravě. I když je toleranční rozmezí stanovení 16–20 % (jen pro CA 72-4 zatím 33 %) – platí tyto hodnoty pro analýzy prováděné stejnou technologii a stejnými reagenciemi. Rozdíly mezi jednotlivými technologiemi mohou činit např. pro CA 15-3 i více než 100 %, a proto by onkologové při přesunech pacientů měli věnovat pozornost tomu, jakou technologií byly výsledky v jednotlivých laboratořích dosaženy. Při hodnocení analytických výsledků CEA je třeba vzít v úvahu, že asi 15 % kuřáků má zvýšenou koncentraci nad hraniční hodnotu (obvykle do 10 μg/l). V první polovině menstruačního cyklu může být vyšší arbitrární látková koncentrace CA 125, která rovněž roste v průběhu těhotenství, a ve třetím trimestru může dosahovat až dvojnásobku diskriminační hranice. Vyšetření tumorových markerů jsou ve srovnání se specifickými proteiny 2 až 3× dražší.
Enzymy
Enzymy se v laboratořích vyšetřují velmi často. Nejčastěji vyšetřované enzymy jsou aminotransferázy ALT a AST. Výsledky jsou ovlivněny svalovou hmotou. Přestože diagnostický význam AST značně poklesl, není to na frekvenci objednávek jeho stanovení téměř poznat. Počet stanovení α amylázy (AMS) je sice vysoký, ale jako druhý nejvýznamnější diagnostický enzym zdaleka nedosahuje četnosti enzymů zafixovaných u lékařů pod pojmem „jaterní testy“. Všechny tři uvedené enzymy se stanovují fotometricky v kinetickém režimu, kdy se u aminotransferáz sleduje pokles absorbance v blízké ultrafialové oblasti a u AMS naopak nárůst zbarvení roztoku. Toleranční rozmezí stanovení je Ī 21 %. Před odběrem ke stanovení ALT a AST by se měl pacient vyhnout svalové námaze. Výsledky může ovlivnit lipémie, takže odběr nalačno je s výhodou. Stanovení ruší hemolýza značně u AST a nepatrně u ALT. Stanovení se provádí v séru nebo v plazmě. Při stanovení AST v séru vadí také trombolýza. AMS se také stanovuje v séru nebo v plazmě, přičemž výsledky v plazmě jsou vyšší než v séru. Pro stanovení v plazmě nutno použít heparinové antikoagulační činidlo – použití EDTA (etylendiamintetraoctová kyselina) stanovení znehodnotí! Stanovení AMS v moči nevyžaduje žádnou preanalytickou úpravu. Kvantitativní určení katalytické aktivity ALT a AST je levné, stanovení AMS je více než 2× dražší.
Ionty
Stanovení fosfátů (v Seznamu zdravotnických výkonů je zastaralý nesprávný název anorganický fosfát) a hořčíku jsou zhruba stejně početná a s přibližně pětinovou frekvencí ve srovnání s ALT. Fosfáty se nejčastěji stanovují fotometricky jako komplexní kyseliny s molybdenem, vanadem nebo wolframem v blízké ultrafialové oblasti. Vzhledem k dennímu rytmu je vhodné provést odběr ráno. Při vyšetření v plazměje potřebné použít jako antikoagulační činidlo heparin. Vzorky je třeba urychleně centrifugovat a separovat. Toleranční rozmezí stanovení v séru a plazmě je Ī 15 %. Moč se sbírá do plastových lahví bez konzervačních přísad zpravidla 24 hodin. Laboratoř pak při příjmu provede okyselení, aby nedošlo k vysrážení fosfátových solí. Toleranční rozmezí stanovení v moči je Ī 18 %. Stanovení fosfátů patří mezi levná vyšetření podobně jako stanovení hořčíku. Při odběru krve je nutné zabránit hemolýze (hořčík z erytrocytů zcela znehodnotí analýzu), vzorek centrifugovat a separovat do 30 minut. Při stanovení z plazmy lze použít jako antikoagulační činidlo pouze heparinát sodný! Obvykle se při analýze využívá schopností hořečnatých iontů usnadnit enzymovou reakci, jejíž následné produkty se sledují fotometricky. Větší laboratoře používají kvalitní referenční metodu s detekcí na atomovém absorpčním spektrofotometru. Některá pracoviště bohužel používají málo spolehlivé reakce s organickými barvivy a následnou fotometrií. Toleranční rozmezí stanovení v séru a plazmě je Ī 15 %, při stanovení v moči Ī 20 %. Moč se sbírá a zpracovává za stejných podmínek jako při stanovení fosfátů.
Osmolalita
Osmolalita se vyšetřuje v séru, plazmě nebo moči. Frekvence vyšetření dosahuje přibližně poloviny požadavků analýz fosfátů. Jedná se o fyzikální analýzu zpravidla v kryoskopickém osmometru a vzorky se před měřením nijak neupravují, nicméně se nesmí mrazit. Pokud vzorky nejsou zasílány v chladicím boxu, je třeba provést analýzu během 4 hodin. To platí i pro vyšetření v moči, protože v tomto případě se nepoužívají žádné konzervační přísady. Toleranční rozmezí stanovení v séru, plazmě i močijsou Ī 10 %. Osmometry sice patří mezi levnější laboratorní přístroje, ale tyto výkony jsou pojišťovnami ohodnoceny tak nízko, že při frekvenci méně než 15 analýz denně se osmometr nezaplatí.
Analýzy moči mikroskopicky kvantitativně
Provádí se manuálním odečítáním mikroskopem při 400násobném zvětšení v zorném poli obvykle velikostí 0,5 mm po zahuštění (10 nebo 20×) centrifugací. Hodnocení lze také provádět průtokovým cytometrem, nebo mikroskopem vybaveným televizní kamerou a zařízením pro počítačovou analýzu obrazu. Vzorek moče se neupravuje a nutno ho vyšetřit do 2 hodin. I když v této oblasti došlo k určité standardizaci, je chybovost analýz značná a nutno počítat s tolerančním rozmezím alespoň 30 %.
Sporadická vyšetření
Frekvence analýz kryoglobulinů nepřekročí ani ve velkých laboratořích 10 týdně. Pacienti se musí odebírat při teplotě 37 °C odběrovou soupravou inkubovanou na tuto teplotu, což zajišťuje vyšetřující laboratoř. Po odstředění se v séru po ochlazení sleduje vznik precipitátu, který se při zahřátí opět rozpouští. To může indikovat diagnózu mnohočetného myelomu, revmatických chorob nebo vaskulitid. Vyšetření je levné, ale pouze orientační, následná imunochemická analýza je podstatně finančně náročnější.
Sledování fibrin degradačních produktů je v rámci hematologie jako výkon 96847 – stanovení D-dimerů a v odbornosti 801 se téměř neprovádí.
Pandyho zkouška, jako kvalitativní průkaz bílkoviny, byla nahrazena kvantitativním stanovením bílkoviny v moku. Nebyla dosud zrušena, protože je téměř zadarmo.
Z doby vzniku Sazebníku pochází stanovení SP1-glykoproteinu, lysozymu turbidimetricky, ß-2-mikroglobulinu ELISA a CRP latexovou aglutinací – rapid test, které (snad s výjimkou stanovení lysozymu) nepatří již do portfolia reálně používaných metod.
Ostatní výkony odbornosti 801 (Klinická biochemie) povolené ke sdílení pro odbornost 813 (Laboratoř alergologická a imunologická) se neprovádějí a v tabulce 1 jsou pouze pro úplnost.
V tomto mezioborovém příspěvku jsme se zaměřili na sdílené výkony našich dvou odborností z hlediska uživatelského zájmu o laboratorní služby. Uvedli jsme, jak připravit pacienta, způsob preanalytické přípravy vzorku, jaká je očekávaná analytická spolehlivost, relativní frekvence diskutovaných vyšetření a jejich ceny.
Zkratky
ALT – alaninaminotransferáza
AST – aspartátaminotransferáza
CA – sacharidové antigeny
CEA (MEIA) – karcinoembryonální antigen (enzymová imunoanalýza na mikročásticích)
CRP – C-reaktivní protein
ČSAKI – Česká společnost alergologie a klinické imunologie
EDTA – etylendiamintetraoctová kyselina
ELFO – elektroforéza
ELISA – enzyme linked immunosorbent assay (analýza s enzymem vázaným na imunosorbent)
hs – high sensitivity (vysoce citlivé)
CH50 – test biologické aktivity komplementu – titrace komplementu aktivovaného klasickou cestou
IB – imunobloting
IEF – izoelektrická fokusace
IELFO – imunoelektroforéza
Ig – imunoglobulin
PAF – proteiny akutní fáze
POCT – point of care test (test v místě péče o pacienta)
SEKK – systém externí kontroly kvality
TZR – tymolová zákalová reakce
WHO – World Health Organisation (Světová zdravotnická organizace)
doc. RNDr. Petr Štern, CSc.
ÚKBLD, Fakultní poliklinika
Karlovo náměstí 32, 121 15 Praha 2
fax: +420 224 962 848, e-mail: petr.stern@vfn.cz
Zdroje
1. Zima, T.: Laboratorní diagnostika. Druhé, doplněné a přepracované vydání, Praha, Galén, s r.o., Univerzita Karlova, nakladatelství Karolinum, 2007, 728 s.
2. Doporučení č. 6 České společnosti klinické biochemie ČLS JEP (ČSKB), Referenční laboratoře MZ pro klinickou biochemii (RL), Sekce pro neuroimunologii a likvorologii České neurologické společnosti ČLS JEP a Sekce laboratorní imunologie České společnosti pro alergologii a klinickou imunologii ČLS JEP (ČSAKI) k vyšetřování mozkomíšního moku.
3. Adam, P., Andrýs, C., Friedecký, B. et al.: Doporučení k vyšetřování mozkomíšního moku. Klin. Biochem. Metab., 2006, 14, s. 125–127.
4. Bartůňková, J., Paulík, M. et al.: Vyšetřovací metody v imunologii. Praha, Grada Publishing, a.s., 2005, 184 s.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
-
Všetky články tohto čísla
- Vyšetřovací metody na pomezí biochemie a imunologie
- Změna bazálního inzulínu z NPH na inzulínový analog detemir vede k dlouhodobému zlepšení ranní glykémie nalačno u dětí s diabetes mellitus 1. typu: výsledky roční multicentrické studie
- Principy fúze buněčných membrán a organel
- Priberanie na hmotnosti pacientov v metadónovom udržiavacom programe ako návrat k populačnej norme
- Co je sumoylace a k čemu slouží?
- Vrozený těžký deficit FVII a získaná idiopatická trombocytopenická purpura – vzácná kombinace dvou krvácivých stavů
- Lékaři a sestry – dialog o profesních rolích a kompetencích
- Informovaný souhlas v lékařské genetice
- Endothelin-1 in exhaled breath condensate of stable and unstable asthma patients
- Clinical significance of intercellular adhesion molecule-1 in ulcerative colitis
- Mesalazine interstitial nephritis presenting as colitis ulcerosa exacerbation
- Nejčastější chlopenní vady
- European human genetics Barcelona, 31. května až 3. června
- VI. kongres slovenských a českých dermatovenerológov s medzinárodnou účasťou Bratislava, 5.–7. června 2008
- Vladimír Wagner – jeden z prvních českých mikrobiologů a imunologů
- Cena J. E. Purkyně byla udělena prof. MUDr. Terezii Fučíkové, DrSc.
- Založení EURAPAG – Evropské asociace gynekologie dětí a dospívajících
- Profesor Jaroslav BLAHOŠ – důstojník Řádu čestné legie
- Škola a zdraví 21
- Cytogenetická konference s mezinárodní účastí
- Celostátní konference DNA diagnostiky
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vrozený těžký deficit FVII a získaná idiopatická trombocytopenická purpura – vzácná kombinace dvou krvácivých stavů
- Vyšetřovací metody na pomezí biochemie a imunologie
- Lékaři a sestry – dialog o profesních rolích a kompetencích
- Co je sumoylace a k čemu slouží?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



