-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ke koncepci metabolického syndromu
On the Concept of the Metabolic Syndrome
During the last twenty years, a cluster of risk factors called metabolic syndrome (MetS) attracts interest in preventive medicine. According to the prevailing notion, which evolved from clinical observations, the core of the MetS consists of visceral obesity, impaired metabolism of glucose, atherogenic dyslipidemia, and arterial hypertension. These risk factors tend to cluster and are believed to be causally associated with insulin resistance. Components of the MetS are to a various degree involved in chronic inflammation, prothrombotic state, endothelial dysfunction, and oxidative stress. Supporters of the concept of MetS as a physiological and clinical entity believe that systems approach can help in understanding pathogenesis, improve prediction of cardiovascular risk, and increase motivation for prevention and treatment. On the other hand, serious criticisms emerged, which concern insufficient experimental evidence, imprecise diagnostic criteria, and questionable justification in general practice. To clarify unresolved problems which evolved in the ongoing debate, further research is needed.
Key words:
(cardio)metabolic syndrome, risk factors, pathophysiological mechanisms, diagnostic criteria, predictive power.
Autoři: A. Žák; A. Slabý
Působiště autorů: Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 536-543
Kategorie: Přehledový článek
Souhrn
Během posledních dvaceti let se v preventivní medicíně soustředil zájem na soubor rizikových faktorů označovaný jako metabolický syndrom. Podle dnešní koncepce, která se vyvinula na podkladě klinických pozorování, patří k jeho základním komponentám viscerální obezita, porucha glycidového metabolismu, aterogenní dyslipidémie a arteriální hypertenze. Tyto rizikové faktory mají tendenci se sdružovat a předpokládá se jejich kauzální souvislost s inzulínovou rezistencí. Jednotlivé složky metabolického syndromu se různou měrou podílejí na vzniku chronického zánětu, prokoagulačního stavu, endoteliální dysfunkce a oxidačního stresu.
Zastánci koncepce metabolického syndromu jako patofyziologické a klinické jednotky očekávají, že systémový přístup umožní lépe porozumět etiologii a patogenezi, upřesní predikci kardiovaskulárního rizika a zvýší motivaci k prevenci a léčbě. Naproti tomu autoři, kteří zaujímají k syndromu kritický postoj, upozorňují na nedostatek experimentálních důkazů, nepřesnost diagnostických kritérií a především na sporný význam pro klinickou praxi. Z dosud pokračující odborné diskuze vyplynuly otázky, jejichž objasnění bude úkolem dalšího výzkumu.Klíčová slova:
(kardio)metabolický syndrom, rizikové faktory, patofyziologické mechanismy, diagnostická kritéria, predikční síla.ÚVOD
Metabolický syndrom (MetS) se stal jedním z nejčastěji diskutovaných pojmů preventivní medicíny. Často se užívá též termínu kardiometabolický syndrom – ke zdůraznění specifického zaměření na kardiovaskulární riziko. Podle původní koncepce zahrnuje MetS známé rizikové faktory, které se uplatňují v patogenezi ischemické choroby srdeční (ICHS) a diabetes mellitus (DM) 2. typu, a to viscerální obezitu, abnormality glukózové homeostázy, aterogenní dyslipidémii a arteriální hypertenzi. Tyto rizikové faktory se často vyskytují společně, významně častěji, než by odpovídalo náhodné koincidenci, a podle názoru většiny autorů mají kauzální souvislost s inzulínovou rezistencí, tj. porušenou odpovědí tkání na působení inzulínu. Postupně byly k MetS přidávány další komponenty jako mikroalbuminurie, hyperurikémie, chronický subklinický zánět, prokoagulační stav, elevace aktivit GMT či oxidační stres (1–5).
V současné době probíhají na celém světě odborné diskuze, které se týkají různých teoretických a praktických aspektů MetS. Kontroverzními otázkami je samostatnost MetS jako nozologické jednotky i otázka míry genetické a patofyziologické jedinečnosti MetS. Zastánci koncepce MetS (předně the American Heart Association (AHA) a the National Heart, Lung, and Blood Institute (NHLBI)) jako patofyziologické a klinické jednotky očekávají, že systémový přístup přispěje k hlubšímu porozumění patogenetickým mechanismům, umožní přesnější predikci kardiovaskulárního rizika a zlepší motivaci k preventivním a terapeutickým opatřením (6). Na druhé straně existují ke koncepci MetS závažné kritické připomínky i zcela odmítavé postoje, jejímiž představiteli jsou zejména odborné diabetologické společnosti (především the American Diabetes Association (ADA) a the European Association for the Study of Diabetes (EASD)). Výsledky některých epidemiologických studií bývají interpretovány v tom smyslu, že diagnóza MetS nemá pro daného jedince prakticky větší význam než průkaz aktuálně přítomných rizikových faktorů (7, 8).
Předmětem diskuze stoupenců obou stanovisek jsou tyto okruhy otázek: 1. vztahy jednotlivých komponent MetS, otázky základních patofyziologických souvislostí a jejich souvislost k rozvoji kardiovaskulárních onemocnění, 2. definiční, resp. diagnostická kritéria MetS a 3. vyjádření klinické užitečnosti koncepce MetS zvláště v jeho vztahu k predikci kardiovaskulárních onemocnění. Posledním diskutovaným bodem je 4. možnost terapeutického ovlivnění inzulínové rezistence a intraabdominální akumulace tukové tkáně jako základních patofyziologických mechanismů rozvoje MetS (9).
Cílem tohoto přehledového článku je shrnout argumenty obou stran a poukázat na otevřené otázky, které vyplynuly z jejich konfrontace.
HISTORICKÝ VÝVOJ
Dnešní koncepci MetS předcházela klinická pozorování, která svědčila o možné účasti některých metabolických poruch v patogenezi kardiovaskulárních onemocnění. Ve dvacátých letech 20. století popsal švédský lékař Eskil Kylin syndrom charakterizovaný společným výskytem hyperglykémie, arteriální hypertenze, obezity a dny (10). Francouzský badatel Jean Vague studoval distribucí tukové tkáně u lidí a zjistil, že androidní obezita zvyšuje riziko diabetu, aterosklerózy, dny a urátové litiázy (11). V souvislosti s tímto významným objevem je třeba připomenout italského anatoma Morgagniho, který o dvě století dříve zaznamenal ve svém stěžejním díle De sedibus et causis morborum per anatomen indagatis pitevní nálezy, z nichž usoudil na vztah mezi tloušťkou abdominální tukové tkáně a patologickými změnami v cévách.
Ve druhé polovině 20. století bylo publikováno několik klinických studií, které připravily půdu pro ucelenou koncepci MetS. Albrink a Meigs prokázali u zdravých mužů statisticky významné korelace mezi tloušťkou kožní řasy, glykémií a koncentrací lipidů v séru (12). Avogaro et al. popsali klinický syndrom zahrnující hypertriglyceridémii (HTG), obezitu, arteriální hypertenzi a DM (13). V Německu upozornil na sdružování kardiovaskulárních rizikových faktorů Haller (14). Modan et al. považovali hyperinzulinémii za spojovací článek mezi glukózovou intolerancí, arteriální hypertenzí a obezitou (15).
Zásadní význam pro vznik moderní koncepce MetS měly práce Geralda Reavena a jeho spolupracovníků, které se staly podkladem hypotézy, že v etiologii ICHS a DM 2. typu (DM2T) má klíčovou úlohu inzulínová rezistence. V často citované prestižní přednášce Banting Lecture 1988 označil Reaven soubor rizikových faktorů asociovaných s inzulínovou rezistencí jako syndrom X (16). V následujících několika letech byl publikován velký počet klinických a epidemiologických studií, které vesměs kardiovaskulární riziko spojené se syndromem X potvrdily. Užívalo se též jiných pojmenování, jako například dysmetabolický syndrom, plurimetabolický syndrom, syndrom inzulínové rezistence, syndrom dyslipidemické hypertenze či hypertriglyceridemický pas. Norman Kaplan zvolil emotivní označení „smrtící kvarteto“. Na doporučení Světové zdravotnické organizace byl koncem 20. století zaveden jednotný termín metabolický syndrom (MetS), který je v současné době všeobecně akceptován. Jak již bylo uvedeno, ke zdůraznění kardiovaskulárního rizika se stále častěji používá též termínu kardiometabolický syndrom.
PATOFYZIOLOGICKÉ MECHANISMY
Existuje všeobecná shoda, že MetS vzniká v interakci genetických a zevních faktorů. Genetická složka MetS je významná. K častějšímu výskytu MetS dochází v určitých rodinách pravděpodobně v důsledku sdílení vyšší míry genů, které predisponují u nositele k manifestaci onemocnění. Rovněž některá etnika (např. Pima indiáni, Hispánci, Afroameričané, Polynésané) vykazují extremně vysokou prevalenci MetS. Ta je v tomto případě vysvětlována selekcí „úsporného genotypu („thrifty genotype“), který zvýhodňuje přežívání jedinců odolných vůči střídajícím se období nedostatku a nadbytku potravy.
Prudký nárůst prevalence MetS není dán změnou genofondu, ale je zapříčiněn změnou životního stylu, která je způsobena především pozitivní energetickou bilancí při nadměrném přívodu živin, změnami složení stravy a nízkou fyzickou aktivitou. Experimentální, klinický a epidemiologický výzkum přináší stále nové poznatky o metabolických poruchách, které se v patogenezi MetS podílejí. I když znalost molekulárních mechanismů je dosud neúplná, většina autorů zastává názor, že klíčovou úlohu má jednak inzulínová rezistence, jednak viscerální obezita; oba tyto faktory se vzájemně ovlivňují a zdá se, že nemá smyslu uvažovat o tom, který z nich je v konkrétní situaci primární (17).
Inzulínová rezistence (IR), nedostatečná odpověď cílových tkání na působení inzulínu, je podmíněna převážně postreceptorovou poruchou inzulínové signalizační kaskády (18). Tato porucha se zpravidla manifestuje nejprve v tukové tkáni, později ji lze prokázat nejen v kosterním svalstvu a v játrech, ale též v centrálním nervovém systému, cévním endotelu a imunokompetentních buňkách. Morfologicky se IR projevuje v kosterním svalstvu zvýšenou intracelulární akumulací lipidů a sníženou denzitou mitochondrií (18). Samotná IR závisí zhruba z 50 % na genetických faktorech, z 25 % na adipozitě a stejnou měrou na fyzické aktivitě (8).
Inzulínová rezistence je příčinou omezené kapacity tukové tkáně skladovat lipidy (resp. triglyceridy), což má spolu s nedostatečnou supresí lipolýzy za následek trvale zvýšený tok volných (neesterifikovaných) mastných kyselin (NEFA) do jater a jiných orgánových systémů. Proto se již v časném stadiu IR – ještě před manifestací abnormalit glukózové homeostázy – rozvíjí aterogenní dyslipidémie a dochází k ektopické akumulaci triglyceridů (TG) s projevy lipotoxicity (19). Na poruše glykoregulace se významně podílí IR kosterního svalstva, spojená s kvantitativně významným poklesem inzulín-dependentního přestupu glukózy z cirkulace do buněk. Zvýšené koncentrace NEFA, významně se podílející na dysfunkci mitochondrií, a oxidačním stresu, jsou spolu s reaktivními kyslíkovými a dusíkovými sloučeninami (RONS) schopny aktivovat nukleární faktor-κB (NF-κB), který aktivuje geny spojené s IR, zánětem a poruchou působení inzulínu. Trvalá stimulace jaterní glukoneogeneze je zčásti podmíněna dysregulací metabolismu glukokortikoidů (20).
U obézních jedinců, zejména při obezitě viscerálního typu, lze v tukové tkáni prokázat kvantitativní změny v sekreci adipocytokinů, ve prospěch prozánětlivých (TNF-α, interleukiny IL-6, IL-1, IL-9, rezistin, angiotenzinogen, retinol-vázající protein-4), kdežto tvorba adiponektinu klesá. Leptin, jehož koncentrace u obézních jedinců jsou až o řád vyšší, vykazuje pleiotropní účinky. Podílí se na regulaci příjmu potravy (inhibuje orexigenní neuropeptid Y a stimuluje anorexigenní POMC (propiomelanokortin) a CART (cocaine and amphetamine transcript); aktivuje sympatický nervový systém (zvyšuje TK a srdeční frekvenci); stimuluje β-3 adrenergní receptory (se zvýšením lipolýzy a produkce thermogeninu) a aktivuje AMPkinázy se zvýšením β-oxidace FA a poklesem TG) (21). Prozánětlivé adipocytokiny, stimulují produkci RONS, potlačují expresi antioxidačních enzymů, čímž zvyšují oxidační stres a zhoršují endoteliální dysfunkci, dále působí změny hemokoagulace a fibrinolýzy (5).
Spolu se zvýšeným tonem sympatického nervového systému a zvýšenou expresí všech složek lokálního systému renin--angiotenzin v tukové tkáni se prozánětlivé adipocytokiny podílejí na vzniku arteriální hypertenze. Stimulací receptorů AT1 působením angiotenzinu II se inhibuje diferenciace preadipocytů v „malé, inzulín senzitivní“ adipocyty a zhoršuje se IR tukové tkáně (22). Bylo prokázáno, že objem viscerální tukové tkáně (stanovený výpočetní tomografií) predikuje vznik MetS lépe než kvalifikované odhady celkového množství podkožního tuku. V patogenezi MetS má nejvýznamnější vliv objem viscerální tukové tkáně, která nezávisle koreluje s hlavními komponentami MetS podle NCEP ATP3; současně je viscerální tuková tkáň nejsilnějším faktorem uplatňující se při shlukování rizikových faktorů (resp. komponent) MetS (23).
Na endokrinní funkce tukové tkáně mají vliv též psychosociální faktory, prostřednictvím hypotalamo-hypofyzo-adrenokortikální osy (24).
Dosavadní poznatky tedy jednoznačně svědčí o vzájemné funkční provázanosti jednotlivých komponent MetS. Tuto skutečnost lze považovat za silný argument ve prospěch koncepce MetS jako komplexní patofyziologické jednotky.
Tento předpoklad také podporují výsledky léčby MetS zahrnující změnu životního stylu (dietní opatření, zvýšení fyzické aktivity) a některých farmakologických přístupů (podávání thiazolidindionů, inhibitorů angiotenzin konvertujícího enzymu, blokátorů AT1 receptorů pro angiotenzin II, metforminu), které ovlivní IR a současně další komponenty MetS, zpomalí přechod MetS do DM2T a současně vykazují preventivní účinky na manifestaci kardiovaskulárních onemocnění (9, 25).
Takový přístup k MetS představuje bezpochyby významný přínos též pro výzkum patogeneze ischemické choroby srdeční, diabetes mellitus 2. typu a některých dalších závažných onemocnění.
VZTAHY MEZI KOMPONENTAMI METABOLICKÉHO SYNDROMU
Vazbou mezi rizikovými faktory sdruženými v MetS se zabývaly četné studie, v nichž bylo použito vícerozměrných statistických metod faktorové nebo shlukové analýzy. Při explorativní faktorové analýze se velký počet korelovaných proměnných redukuje na několik hlavních faktorů (zpravidla tři nebo čtyři), z nichž lze do jisté míry usuzovat na strukturu a funkční hierarchii syndromu, popřípadě též na stupeň heritability. Existence čtyř hlavních faktorů byla ověřena metodou konfirmativní faktorové analýzy. Naproti tomu se autorům nedávno publikované práce podařilo stejnou metodou prokázat, že při testování vztahů mezi základními komponentami MetS lépe vyhovuje model jediného faktoru (26–28).
Shlukování antropometrických a biochemických příznaků MS potvrzují analýzy velkých souborů dat získaných v rámci studie IRAS (Insulin Resistance Atherosclerosis Study) (29) a NHANES (National Health and Nutrition Examination Survey) (30). Zajímavé výsledky osvětlující interkorelační strukturu klíčových proměnných MetS byly získány u obézních jedinců během redukční léčby (25) a u mladých hyperandrogenních žen (31). V populačním souboru s vysokým rizikem kardiovaskulárních onemocnění bylo možné již u dětí prokázat seskupování jednotlivých komponent MetS a jejich společný nárůst (32).
Všechny uvedené studie jednoznačně dokazují, že MetS nelze považovat za soubor libovolně k sobě přiřazených rizikových faktorů. Interpretace výsledků získaných různými metodami faktorové analýzy však není snadná. Bylo by předčasné uzavírat, že průkaz několika nezávislých hlavních faktorů svědčí proti existenci jednotného patofyziologického mechanismu, který by mohl vysvětlit všechny klinické projevy MetS.
HODNOCENÍ INZULÍNOVÉ REZISTENCE
Mnoho otázek současné diskuze se týká klinické diagnostiky MetS. Autoři, kteří jsou přesvědčeni o centrální úloze inzulínové rezistence, považují její přímý průkaz za rozhodující diagnostické kritérium. K posouzení inzulínové senzitivity se zpravidla vyšetřuje inzulín-dependentní odsun glukózy z cirkulace (glucose disposal), a to metodou euglykemického hyperinzulínového clampu, která představuje zlatý standard nebo některou modifikací inzulínového supresního testu, popřípadě nitrožilním glukózovým testem vyhodnoceným podle Bergmanova minimálního modelu. Ve studiích provedených na velkých souborech zdravých osob bylo zjištěno, že hodnoty inzulín-dependentního odsunu glukózy jsou v populaci distribuovány kontinuálně, přičemž rozdíl mezi nejvíce senzitivními a nejvíce rezistentními jedinci činí více než 600 %. Podle autorů z Reavenovy skupiny se u třetiny populace vyskytují hodnoty, které jsou spojeny se zvýšeným rizikem ICHS, diabetu a některých dalších onemocnění (8).
Bylo prokázáno, že nepřímé markery intraabdominální akumulace tuku (obvod pasu, WC) a adipozity (BMI) jsou prediktory IR u obou pohlaví, avšak vztahy BMI a citlivosti na inzulín nejsou totožné. Inzulínová senzitivita (resp. IR) byla prokázána u 70 % (resp. 15 %) probandů s normální hmotností, u 25 % (resp. 48 %) jedinců s nadváhou a pouze 5 % (resp. 36 %) obézních osob (8).
Metody k přímému stanovení inzulínové senzitivity však nejsou vhodné pro klinickou praxi, a proto byla věnována velká pozornost otázce, do jaké míry mohou být nahrazeny méně náročnými testy. Relativně nejvyšší stupeň korelace s hodnotami inzulín-dependentního odsunu glukózy (r = 0,62) byl zjištěn pro plazmatické koncentrace inzulínu nalačno a při orálním glukózovém tolerančním testu (oGTT) (33). Inzulínová senzitivita klesá lineárně se vzestupem tělesné hmotnosti, ale nízké hodnoty se vyskytují pouze u 34 % osob s BMI v rozmezí 30–35 kg/m2 a u 60 % osob s BMI nad 35 kg/m2 (34). Na základě analýzy dosud největšího souboru osob vyšetřených metodou euglykemického clampu (n = 2321) byly k identifikaci inzulínové rezistence doporučeny tři kombinace běžných laboratorních a antropometrických parametrů, které vykazovaly senzitivitu a specificitu kolem 80 % (35). Aplikace uvedených doporučení v primárně preventivní studii KORA Survey 2000 však jejich diagnostickou spolehlivost zpochybnila (36). Rovněž porovnání přímo stanovené inzulínové senzitivity s různými náhradními metodami ve shora zmíněné studii IRAS nepřineslo uspokojivé výsledky (37). Do budoucna bude třeba hledat další možnosti, z hlediska kombinace klinických, laboratorních a zobrazovacích metod, jak vyšetřovat a hodnotit klinicky relevantní inzulínovou rezistenci.
DIAGNOSTICKÁ KRITÉRIA METABOLICKÉHO SYNDROMU
Klinická diagnostika vychází i v současné době z původní definice MetS jako souboru společně se vyskytujících rizikových faktorů. První diagnostická kritéria, která vypracovala skupina expertů WHO v roce 1998, měla za hlavní cíl upřesnit klasifikaci stavů predisponujích k DM (38). Proto definice MetS podle WHO vyžaduje přítomnost zvýšené glykémie nalačno nebo porušené glukózové tolerance, popřípadě průkaz inzulínové rezistence metodou euglykemického clampu. Za tohoto předpokladu stačí k diagnóze MetS další dva rizikové faktory ze skupiny čtyř, kterou tvoří dyslipidémie, arteriální hypertenze, obezita (zvýšený poměr pás/boky anebo BMI > 30) a mikroalbuminurie; v pozdějších modifikacích kritérií WHO byla mikroalbuminurie vypuštěna. Hraniční hodnoty rizikových faktorů jsou uvedeny v tabulce 1.
Tab. 1. Definice metabolického syndromu podle WHO (1998) (38) 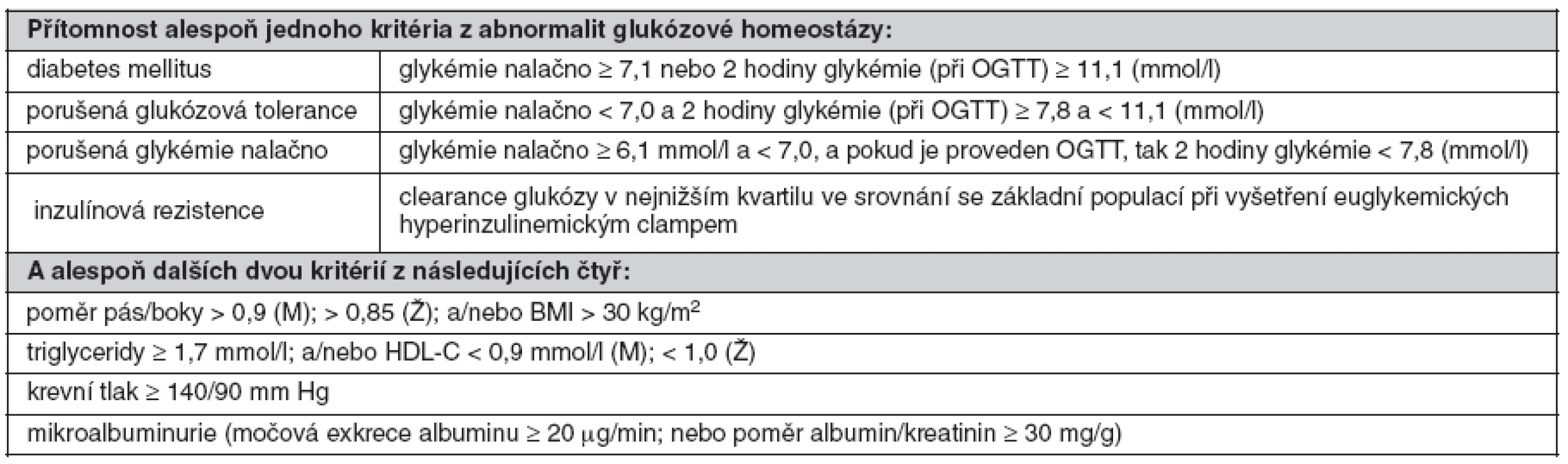
HDL-C – cholesterol lipoproteinu o vysoké hustotě, M – muži, Ž – ženy, OGTT – orální glukózový toleranční test Ve Spojených státech amerických vznikla diagnostická kritéria pro MetS v rámci programu National Cholesterol Education Program v roce 2001 a jsou označována jako NCEP ATP III (39). Odlišnost od kritérií WHO vyplývá z primárního zaměření na osoby se zvýšeným rizikem ICHS, přičemž se vychází z předpokladu, že všechny zařazené rizikové faktory jsou stejně závažné. Podle NCEP ATP III splňuje definici MetS přítomnost kterýchkoliv tří ze skupiny pěti faktorů, definovaných hraničními hodnotami obvodu pasu, plazmatické koncentrace triglyceridů (TG) a HDL-C, krevního tlaku a glykémie (tab. 2). V revidované verzi z roku 2004 byla hraniční hodnota glykémie snížena z 6,1 na 5,6 mmol/l. Diagnóza MetS podle kritérií NCEP má především sloužit k predikci rizika ICHS.
Tab. 2. Definice metabolického syndromu podle NCEP ATP III (2001) (39) 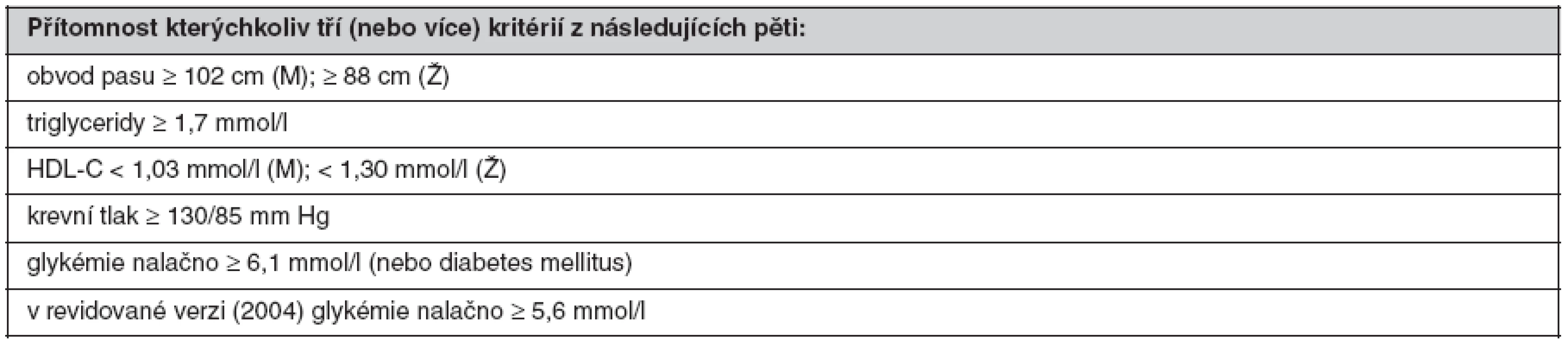
HDL-C – cholesterol lipoproteinu o vysoké hustotě, M – muži, Ž – ženy Nejnovější diagnostická kritéria MetS byla navržena a schválena v roce 2005 účastníky konference, kterou uspořádala odborná společnost International Diabetes Federation (40). Na rozdíl od obou předchozích kritérií je pro diagnózu MetS nezbytná přítomnost abdominální obezity (definované nižšími hraničními hodnotami obvodu pasu než v NCEP ATP III), spolu se dvěma rizikovými faktory ze skupiny čtyř (plazmatická koncentrace TG a HDL-C, krevní tlak a glykémie nalačno). Pro první tři faktory platí stejné hraniční hodnoty jako v NCEP, naproti tomu pro glykémii hodnota nižší (tab. 3).
Tab. 3. Definice metabolického syndromu podle IDF (2005) (40) 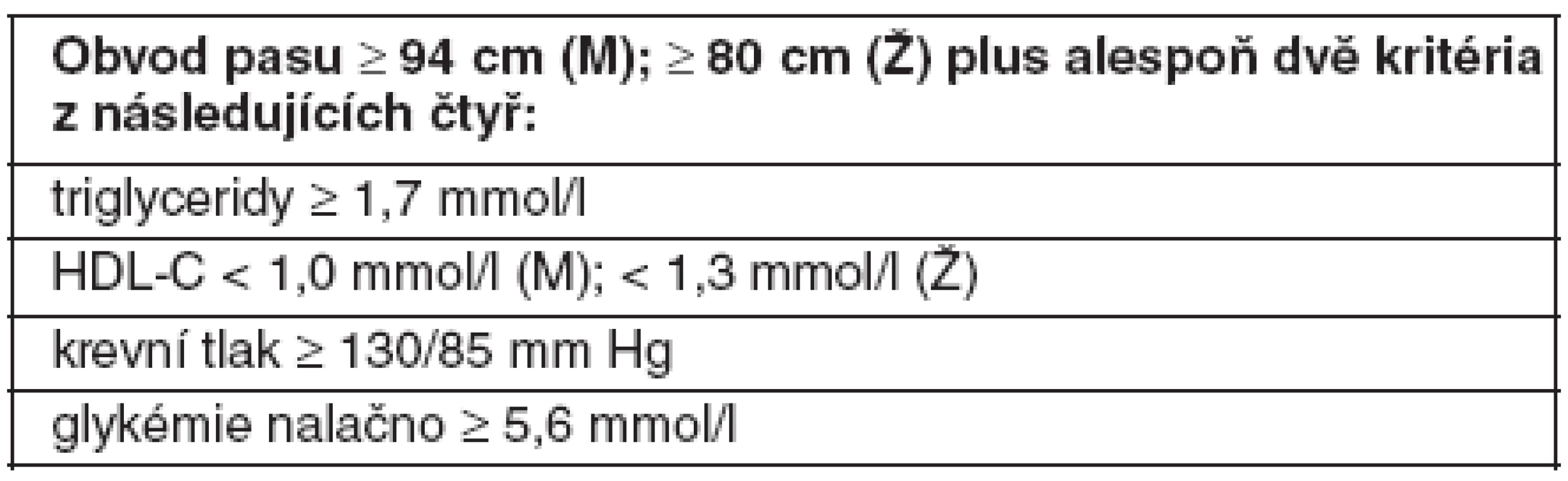
HDL-C – cholesterol lipoproteinu o vysoké hustotě, M – muži, Ž – ženy Diagnostická kritéria WHO, NCEP ATP III a IDF tedy zahrnují známé rizikové faktory pro ICHS, jejichž predikční síla byla prokázána v četných epidemiologických studiích. Zatímco definice podle WHO klade zvláštní důraz na poruchu glycidového metabolismu a definice IDF na abdominální obezitu, se zřetelem na geografická či etnická kritéria pro posuzování obvodu pasu (jako kritéria intraabdominální akumulace tuku), v kritériích ATP III mají rizikové faktory stejnou váhu a pro diagnózu MetS není nutná přítomnost všech rizikových faktorů, nýbrž pouze tří z nich. Kritéria IDF jsou nejpřísnější, takže diagnostikují MetS u relativně největšího počtu vyšetřených osob.
Kromě uvedených tří souborů diagnostických kritérií existují ještě další, různě modifikované verze, například kritéria Americké endokrinologické společnosti (AACE) z roku 2003. V těchto kritériích se používá termínu syndrom inzulínové rezistence a k jeho diagnóze je vyžadováno vyšetření glukózové tolerance, kromě plazmatické koncentrace TG, HDL cholesterolu, krevního tlaku a indexu tělesné hmotnosti nebo obvodu pasu. Podle autorů této verze by se termínu syndrom inzulínové rezistence nemělo užívat, jestliže se již manifestoval diabetes mellitus 2. typu.
Ve společném prohlášení kardiologické společnosti American Heart Association a výzkumného ústavu National Heart, Lung, and Blood Institute, které bylo publikováno v roce 2005 po uveřejnění diagnostických kritérií IDF, se doporučuje nadále používat revidovaných kritérií NCEP ATP III (s hraniční hodnotou glykémie 5,6 mmol/l), protože nekladou zvláštní důraz na jediný parametr, jsou již ověřena v četných studiích a v diagnostice MetS se plně osvědčila (6).
Součástí žádného z dosud navržených kritérií pro diagnózu MetS není zvýšená plazmatická koncentrace inzulínu. Kromě metodických důvodů totiž existují důkazy, že hyperinzulinémii nelze považovat za ekvivalent inzulínové rezistence. Například v souboru 1308 osob vyšetřených v rámci studie EGIR (European Group for the Study of Insulin Resistance) byla pouze u 60 % probandů přítomna hyperinzulinémie společně s inzulínovou rezistencí prokázanou glykemickým clampem. Hyperinzulinémie bez inzulínové rezistence byla spojena s potlačenou lipolýzou a glykogenolýzou, s vyššími hodnotami systolického tlaku a nižší plazmatickou koncentrací HDL-C. Naproti tomu jedinci s inzulínovou rezistencí a normální plazmatickou koncentrací inzulínu se vyznačovali vyšším stupněm abdominální obezity, spolu s intenzivnější lipolýzou a glykogenolýzou (41). Klást rovnítko mezi hyperinzulinémií a inzulínovou rezistencí by podle autorů této studie bylo neoprávněným zjednodušením složitých, dosud nedostatečně objasněných vztahů.
Jak již bylo uvedeno, diagnostické kritéria MetS jsou stále předmětem diskuzí. Mezi přední kritiky patří sám Gerald Reaven, který dokonce doporučuje, aby se v lékařské praxi diagnózy MetS vůbec nepoužívalo (8). Jako hlavní důvod uvádí, že žádná dosud navržená kritéria nedovedou jednoznačně identifikovat osoby se syndromem inzulínové rezistence, a tím se zvýšeným rizikem aterosklerotických komplikací. Například jedno z kritérií WHO a NCEP, totiž glykémie nalačno v rozmezí 6,1–6,9 mmol/l má velmi nízkou senzitivitu; v souboru osob vyšetřených metodou euglykemického clampu se uvedené hodnoty vyskytovaly pouze u 5,5 % osob s inzulínovou rezistencí (42). Ani hraniční hodnoty dalších diagnostických kritérií nelze považovat za spolehlivé vodítko pro odhad kardiovaskulárního rizika. V recentních Reavenových publikacích jsou uvedeny příklady, kdy ze dvou osob s obdobným metabolickým rizikem jedna splňuje kritéria pro diagnózu MetS, kdežto druhá je nesplňuje, takže diagnóze MetS unikne.
Rovněž další autoři dokazují, že kritéria pro diagnózu MetS nejsou jednoznačná (9). Navíc je třeba brát v úvahu, že jejich výběr ani jejich hraniční hodnoty nebyly systematicky ověřeny klinicky ani epidemiologicky. Jak ukázala McNeill se spolupracovníky ve studii ARIC (Atherosclerosis Risk in Communities Study), změna hraniční hodnoty pro lačnou glykémii ze 6,1 na 5,6 mmol/l sice zvýší prevalenci MetS (podle kritérií NCEP) z 23 % na 32 %, ale predikce kardiovaskulárního rizika se tím nezlepší (43). Ve finské studii byly u mužů středního věku porovnány dvě hraniční hodnoty obvodu pasu 102 cm a 94 cm a zjistilo se, že vyšší predikuje kardiovaskulární mortalitu i mortalitu ze všech příčin lépe (44). V tomto směru chybějí informace o diagnostických kritériích, jejichž hraniční hodnoty byly stanoveny odlišně pro ženy.
Problémy spojené s diagnostikou MetS dokumentuje též porovnání definic NCEP a WHO v reprezentativním populačním souboru vyšetřeném v rámci studie NHANES III. Zjistilo se, že u 15 % osob byla kritéria pro diagnózu MetS splněna pouze podle jedné z obou definic, přičemž žádná neměla převahu (45). Ve dvou velkých epidemiologických studiích, San Antonio Heart Study a Framingham Offspring Study, se prevalence MetS (podle kritérií NCEP i WHO) značně lišila v závislosti na pohlaví a etnickém původu (46). Pokud jde o kritéria IDF, nelze podcenit skutečnost, že z diagnózy MetS je vyloučen značný počet jedinců, kteří jsou nositeli tří nebo více rizikových faktorů, ale nedosahují kritické hodnoty obvodu pasu (47).
Dosavadní diagnostická kritéria MetS tedy nelze považovat za optimální. Závažný nedostatek spočívá v tom, že neumožňují kvantitativní odstupňování rizika, a to nejen se zřetelem na absolutní hodnoty jednotlivých rizikových faktorů, ale též na jejich vzájemné vztahy.
METABOLICKÝ SYNDROM A KARDIOVASKULÁRNÍ RIZIKO
Četné epidemiologické studie potvrdily, že jedinci, u nichž byl podle kterékoli definice diagnostikován MetS, mají vyšší riziko ICHS a jiných manifestací aterosklerózy, přičemž výskyt koronárních příhod i mortalita stoupají s počtem komponent (43, 44). Tato skutečnost není překvapující, uvážíme-li, že v rámci MetS je seskupeno několik rizikových faktorů, jejichž predikční schopnost byla již dříve dostatečně prokázána. Proto také riziko spojené s MetS zůstává významné i po adjustaci na tři klasické rizikové faktory, tj. zvýšenou plazmatickou koncentraci LDL–cholesterolu, hypertenzi a kouření. Toto reziduální riziko, na němž se do značné míry podílí aterogenní dyslipidémie, se v současné době dostává do centra pozornosti z hlediska nových možností intervence (48).
Při analýze velkého souboru respondentů studie NHANES III byla zjištěna významně vyšší prevalence ICHS ve skupině diabetiků, kteří splňovali kritéria MetS podle NCEP, ve srovnání s diabetiky bez takto diagnostikovaného MetS (49). Dosud však nebyl podán jednoznačný důkaz, že kardiovaskulární riziko vyplývající z diagnózy MetS je větší, než by odpovídalo aditivnímu účinku jeho komponent. Touto otázkou, která má pro koncepci MetS zvláštní význam, se zabývali autoři z několika pracovišť; zvláště fundovaná je statistická analýza dat získaných v shora zmíněné studii ARIC (50). Přítomnost jednotlivých komponent MetS a jejich seskupení v počtu dvou až šesti byla vztažena k tloušťce komplexu intimy a médie (IMT) karotické tepny, jakožto ukazateli latentní (preklinické) aterosklerózy. U poloviny z možných kombinací rizikových faktorů byl zjištěn synergický účinek, a to zvláště tehdy, byla-li současně přítomna hypertriglyceridémie a arteriální hypertenze (50).
Predikční síla diagnózy MetS vzhledem k riziku ICHS byla v několika studiích porovnána s inovovaným framinghamským skóre, které kromě původních charakteristik (věk, pohlaví, celkový cholesterol, systolický krevní tlak a kouření) zahrnuje též HDL-C a přítomnost či nepřítomnost DM.
V souboru respondentů ze studií San Antonio Heart Study a Mexico City Diabetes Study sledovaných po dobu sedmi let měla predikce výskytu ICHS podle framinghamského skóre vyšší senzitivitu při srovnatelném počtu falešně pozitivních předpovědí (51). Wilson et al. zjistili, že po přidání některých rizikových faktorů specifických pro MetS (např. hypertriglyceridémie) ke kritériím framinghamské rovnice se predikce ICHS nezlepší. Naproti tomu analýza křivek ROC (receiver operating curves) pro MetS a pro framinghamské skóre, provedená ve studii ARIC, neprokázala mezi oběma predikčními metodami významný rozdíl (43). Ve dvou epidemiologických studiích (4S a AFCAPS/TexCAPS) bylo zjištěno, že přítomnost MetS zvyšuje incidenci koronárních příhod nezávisle na kategorii desetiletého rizika vypočteného podle framinghamského skóre (52). Nelze vyloučit, že se vliv metabolických rizikových faktorů na výskyt ICHS významněji projeví až v delším časovém horizontu, který obvyklá doba sledování nepostihuje.
VÝZNAM DIAGNOSTIKY METABOLICKÉHO SYNDROMU
Jak bylo opakovaně zdůrazněno, v původním pojetí představuje MetS soubor rizikových faktorů. Proto by se tento syndrom neměl označovat jako „onemocnění“, a to ani ve sděleních určených pro laickou veřejnost. Z pragmatického hlediska spočívá hlavní význam diagnózy MetS bezpochyby v tom, že upozorňuje na hrozící nebezpečí a na nezbytnost důsledné prevence. Přesto je užitečnost diagnózy MetS v lékařské praxi dosud předmětem sporů (53, 54). V oficiálním stanovisku kardiologické společnosti American Heart Association se uvádí, že průkaz MetS může zvýšit motivaci ke změně životního způsobu, především stravovacích a pohybových zvyklostí, popřípadě též zlepšit adherenci k farmakoterapii přidružených poruch. Další kladný argument vyplynul z epidemiologické zkušenosti, podle níž časná diagnóza MetS upozorní na kardiovaskulární riziko dříve než běžně užívané predikční metody (43). Naproti tomu se dosti často vyskytuje názor, a to nejen mezi diabetology, že diagnóza MetS nepřináší pro daného jedince žádnou výhodu ve srovnání se zjištěním a cílenou intervencí jednotlivých rizikových faktorů (8). Tento skeptický závěr se opírá o shora uvedené výsledky některých epidemiologických studií, které nepotvrdily předpoklad, že diagnóza MetS má při predikci ICHS převahu nad sumou aktuálně přítomných komponent (51).
Opakovaně byla též vyslovena obava, že těm jedincům, kteří nesplňují diagnostická kritéria pro MetS, by lékaři mohli věnovat menší pozornost, než jakou by vyžadoval stupeň jejich kardiovaskulárního rizika. Taková obava nemá opodstatnění tam, kde kliničtí lékaři obeznámení s problematikou nepřistupují k diagnóze MetS dogmaticky, ale snaží se identifikovat ohrožené jedince, i když při vyšetření zjistí pouze jeden ze souboru rizikových faktorů.
Z praktického hlediska diagnostika MetS přináší výhody, ve srovnání s odhadem rizika pro kardiovaskulární choroby pomocí framinghamského skórovacího systému z hlediska dlouhodobého odhadu rizika KVO, dále u nemocných, kteří nemají klinicky vyjádřený DM2T, u osob s přítomností intraabdominální akumulace tukové tkáně a dyslipidémií (přítomností hypertriglyceridémie a/nebo poklesu koncentrace HDL C) a dále u nemocných, u kterých chybí údaje rodinné anamnézy ohledně přítomnosti kardiovaskulárních onemocnění. Konečně MetS identifikuje rizikové jedince, u kterých je potřebná změna životního stylu a dietních zvyklostí (9).
OTEVŘENÉ OTÁZKY
Z dosavadních úvah o koncepci MetS je zřejmé, že dosud existuje mnoho neobjasněných aspektů, jimž bude nutno věnovat pozornost v experimentálním a klinickém výzkumu. Jako zvláště naléhavá se jeví potřeba hlubšího porozumění etiopatogenezi MetS a podílu, jaký má MetS na vzniku diabetu, aterosklerózy a dalších onemocnění. V tomto směru se nabízí celá řada otázek. Jaký je vzájemný funkční vztah mezi jednotlivými komponentami MetS, zejména mezi IR a viscerální obezitou, mezi systémovým zánětem, oxidačním stresem a prokoagulačním stavem? Má inzulínová rezistence přímé aterogenní účinky nebo existuje dosud neznámý nadřazený patofyziologický mechanismus, který je společnou příčinou MetS a aterosklerózy? Nový vhled do složité problematiky lze očekávat od výzkumných úkolů zaměřených na funkční poruchy mitochondrií, na změny v expresi různých genů a na účinky transkripčních faktorů uvolňovaných z endoplazmatického retikula. K zajímavým otevřeným otázkám patří též vztah aldosteronu k MetS, úloha izoformy proteinu vázajícího retinol (RBP4), jehož plazmatická koncentrace koreluje se stupněm IR (21), a celá řada dalších perspektivních témat pro experimentální výzkum.
Z klinického hlediska stojí v popředí otázky, které se týkají diagnostiky MetS a možností preventivního, popřípadě léčebného ovlivnění. Bude třeba uskutečnit nové studie a na jejich podkladě revidovat dosavadní diagnostická kritéria, aby umožnila co nejpřesnější vyhodnocení rizika. Kritická analýza by se měla zaměřit na výběr rizikových faktorů, popřípadě takových kombinací rizikových faktorů, jejichž přítomnost je pro diagnózu nezbytná. Pravděpodobně bude výhodnější brát v úvahu absolutní hodnoty jednotlivých kvantitativních parametrů. Dosud chybějí spolehlivé důkazy, zda predikci rizika zlepší přidání dalších faktorů, například C-reaktivního proteinu nebo adiponektinu. Dále bude nutné získat více podkladů k definitivnímu vyřešení sporné otázky, zda se má MetS diagnostikovat také v těch případech, kdy již došlo k manifestaci DM anebo ischemické choroby srdeční. S napětím se očekávají výsledky studií, které by mohly potvrdit, že existují preventivní, popřípadě též terapeutické metody specifické pro MetS, odlišné od intervence jednotlivých rizikových faktorů.
Současná koncepce MetS zahrnuje jak noetické aspekty, tak i praktické cíle preventivní medicíny. Z obou těchto hledisek by se měl znovu promýšlet konkrétní obsah pojmu. Zůstává otevřenou otázkou, zda je správné považovat za složku MetS endoteliální dysfunkci, zvýšenou sympatoadrenergní aktivitu, esenciální hypertenzi, depresivní syndrom a další patologické stavy, i když s MetS souvisejí a prokazatelně zvyšují kardiovaskulární riziko.
ZÁVĚR
Metabolický syndrom, respektive kardiometabolický syndrom, se stal pojmem, jehož přínos pro řadu oborů medicíny je všeobecně uznáván. Lze předpokládat, že v budoucnu jeho význam nadále poroste a stále širšímu okruhu lékařů umožní, aby soustředili svou pozornost na společný výskyt rizikových faktorů a na prevenci předvídatelných důsledků. Diagnostika MetS však bude vyžadovat nový přístup, který by nebyl dogmatický, ale ani skeptický. Současná odborná debata přináší podněty k řešení sporných otázek v rámci experimentálního a klinického výzkumu. K upřesnění koncepce bude třeba nově promyslet, co do problematiky MetS skutečně patří a co je do ní zahrnováno neoprávněně.
Zkratky
AACE – American Association of Clinical Endocrinologists
ADA – American Diabetes Association
AFCAPS/TexCAPS – Air Force/Texas Coronary Atherosclerosis Prevention Study
AHA – American Heart Association
ARIC – Atherosclerosis Risk in Communities Study
BMI – hmotnostní index (Body Mass Index)
DM – diabetes mellitus
DM2T – diabetes mellitus 2. typu
EASD – European Association for the Study of Diabetes
EGIR – European Group for the Study of Insulin Resistance
GMT – gama-glutamyl transferáza
HDL-C – cholesterol v lipoproteinu o vysoké hustotě (high density lipoprotein)
HTG – hypertriglyceridémie
IDF – International Diabetes Federation
ICHS – ischemická choroba srdeční
Il-6, Il-1, Il-9 – interleukin-6, Il-1, Il-9
IMT – tloušťka komplexu intima – médie (intima media thickness)
IR – inzulínová rezistence
IRAS – Insulin Resistance Atherosclerosis Study
KORA Survey – studie KORA (Cooperative Health Research in the Region of Augsburk)
KVO – kardiovaskulární onemocnění
LDL-C – cholesterol v lipoproteinu o nízké hustotě (low density lipoprotein)
MetS – metabolický syndrom
NCEP ATP3 – National Cholesterol Education Program (Adult Treatment Panel III)
NHANES – National Health and Nutrition Examination Survey
NHLBI – National Heart, Lung, and Blood Institute
NEFA – neesterifikované mastné kyseliny
NF-κB – nukleární faktor-κB
oGTT – orální glukózový toleranční test
RBP4 – izoforma 4 retinol vázajícího proteinu
ROC křivka – receiver operating characteristic curve (křivka charakterizující vypovídající schopnost diagnostického testu v závislosti na jeho senzitivitě a specificitě)
RONS – reaktivní kyslíkové a dusíkové sloučeniny
TG – triglyceridy
TNF-α – tumorový nekrotizující faktor-α
WHO – Světová zdravotnická organizace (World Health Organisation)
Práce byla podporována Výzkumným záměrem MŠMT ČR, MSM 0021620820.
Adresa pro korespondenci:
prof. MUDr. Aleš Žák, DrSc.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: azak@vfn.cz
Zdroje
1. Haffner SM., Gonzales C., Valdez RA., et al. Is microalbuminuria part of the prediabetic state? The Mexico City Diabetes Study. Diabetologia 1993; 1002–1006.
2. Lee J, Sparrow D, Vokonas PS, et al. Uric acid and coronary heart disease risk: evidence for a role of uric acid in the obesity-insulin resistence syndrome. The Normative Aging Study. Am J Epidemiol 1995; 288–294.
3. Song Y, Liu S, Manson J-AE. High-sensitive C-reactive protein and the metabolic syndrome. In: Hansen BC, Bray GA. (ed.), Contemporary Endocrinology: The metabolic syndrome: Epidemiology, Clinical Treatment, and underlying mechanisms. New Persey: Human Press Totowa 2008; 167–188.
4. Godsland IF, Crook D, Proudler AJ, et al. Hemostatic risk factors and insulin sensitivity, regional body fat distribution, and the metabolic syndrome. J Clin Endocrinol Metab 2005; 90 : 190–197.
5. Furukawa S, Fujita T, Shimabukuro M, et al. Increased oxidative stress in obesity and its impact on metabolic syndrome. J Clin Invest 2004; 114: 1752–1761.
6. Grundy SM. Metabolic syndrome: A multiplex cardiovascular risk factor. J Clin Endocrinol Metab 2007; 92 : 399–404.
7. Kahn R, Buse J, Ferrannini E, et al. The metabolic syndrome: Time for a critical appraisal. Joint statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2005; 28 : 2289–2304.
8. Reaven GM. Metabolic syndrome. To be or not to be? In: Hansen BC, Bray GA. (ed.), Contemporary Endocrinology: The metabolic syndrome: Epidemiology, Clinical Treatment, and undrelying mechanisms. New Persey: Humnan Press Totowa 2008; 11–36.
9. Brietzke SA. Controverzy in diagnosis and management of the metabolic syndrome Med Clin N Am 2007; 91 : 1041–1061.
10. Kylin E. Studien über das Hypertonie-Hyperglykämie-Hyperurikämiesyndrom. Zentbl Inn Med 1923; 44 : 105–112.
11. Vague J. The degree of masculine differentiation of obesities: A factor determining predisposition to diabetes, atherosclerosis, gout, and uric calculous disease. Am J Clin Nutr 1956; 4 : 20–34.
12. Albrink M J, Meigs MW. Interrelationship between skinfold thickness, serum lipids, and blood sugar in normal men. Am J Clin Nutr 1964; 15 : 255–261.
13. Avogaro P, Crepaldi G, Enzi G, et al. Associazione di iperlipidemia, diabete mellito e obesita di medio grado. Acto Diabetol Lat 1967; 4: 36–41.
14. Haller H. Epidemiology and associated risk factors of hyperlipoproteinemia. Zschr Ges Inn Med 1977; 32 : 124–128.
15. Modan M, Halkin H, Almog S, et al. Hyperinsulinemia: A link between hypertension, obesity, and glucose intolerance. J Clin Invest 1985; 75 : 809–817.
16. Reaven GM. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes 1988; 37 : 1595–1607.
17. Bastard JP, Maachi M, Lagathu C, et al. Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur Cytokine Netw 2006; 17 : 4–12.
18. Lann D, Le Roith D. Insulin resistance as underlying cause for the metabolic. Med Clin N Am 2007; 91 : 1063–1077.
19. Žák A, Slabý A. Aterogenní dyslipidémie a metabolický syndrom: Patofyziologické mechanismy. Čas Lék čes 2008; 147 : 459–470.
20. Miranda PJ, DeFronzo RA, Califf RM, et al. Metabolic syndrome: Definition, pathophysiology, and mechanisms. Am Heart J 2005; 149 : 33–45.
21. Goralski KB, Sinal CJ. Type 2 diabetes and cardiovascular disease: getting to the fat of the matter. Can J Physiol Pharmacol 2007; 85 : 113–132.
22. Sharma AM. The obese patient with diabetes mellitus: From research targets to treatment options. Am J Med 2006; 119(Suppl. 5A): 17S–23S.
23. Fox CS, Massaro JM, Hoffmann U, et al. Abdominal visceral and subcutaneous adipose tissue compartments: Association with metabolic risk factors in the Framingham Heart Study. Circulation 2007; 116: 39–48.
24. Rosmond R, Bjorntorp P. Occupational status, cortisol secretory pattern, and visceral obesity in middle-aged men. Obes Res 2000; 8: 445–450.
25. Bray GA. Treatment of the metabolic syndrome with weight loss, exercise, hormones and surgery. In: Hansen BC, Bray GA. (ed.), Contemporary Endocrinology: The metabolic syndrome: Epidemiology, Clinical Treatment, and undrelying mechanisms. New Persey: Humnan Press Totowa 2008; 57–73.
26. Edwards KL, Newman B, Mayer E, et al. Heritability of factors of the insulin resistance syndrome in women twins. Genet Epidemiol 1997; 14 : 241–253.
27. Poulsen P, Vaag A, Kyvik K, et al. Genetic versus environmental aetiology of the metabolic syndrome among male and female twins. Diabetologia 2001; 44 : 537–543.
28. Pladevall M, Singal B, Williams LK, et al. A single factor underlies the metabolic syndrome: A confirmatory factor analysis. Diabetes Care 2006; 29 : 113–122.
29. Hanley AJ, Karter AJ, Festa A, et al. Factor analysis of metabolic syndrome using directly measured insulin sensitivity: The Insulin Resistance Atherosclerosis Study. Diabetes 2002; 51 : 2642–2647.
30. Ford ES. Factor analysis and defining the metabolic syndrome. Ethn Dis 2003; 13 : 429–437.
31. Zanolin ME, Tosi F, Zoppini G, et al. Clustering of cardiovascular risk factors associated with the insulin resistance syndrome: Assessment by principal component analysis in young hyperandrogenic women. Diabetes Care 2006; 29 : 372–378.
32. Retnakaran R, Zinman B, Connelly PW, et al. Nontraditional cardiovascular risk factors in pediatric metabolic syndrome. J Pediatr 2006; 148 : 176–182.
33. Yeni-Komshian H, Carantoni M, Abbasi F, et al. Relationship between several surrogate estimates of insulin resistance and quantification of insulin-mediated glucose disposal in 490 healthy nondiabetic volunteers. Diabetes Care 2000; 23 : 171–175.
34. Ferrannini E, Natali A, Bell P, et al. Insulin resistance and hypersecretion in obesity. European Group for the Study of Insulin Resistance. J Clin Invest 1997; 100 : 1166–1173.
35. Stern SE, Williams K, Ferrannini E, et al. Identification of individuals with insulin resistance using routine clinical measurements. Diabetes 2005; 34 : 333–339.
36. Rathmann W, Haastert B, Giani G, et al. Critical evaluation of models to identify individuals with insulin resistance (Letter). Diabetes Care 2005; 28 : 1833.
37. Howard G, Bergman R, Wagenknecht LE, et al. Ability of alternative indices of insulin sensitivity to predict cardiovascular risk: comparison with the “minimalmodel“. Insulin Resistence Atherosclerosis Study (IRAS) Investigators. Ann Epidemiol 1998; 8 : 358–369.
38. Definition, Diagnosis and Classification of Diabetes Mellitus and its Complications. Part 1. Diagnosis and Classification of Diabetes Mellitus. Geneva: World Health Organization 1999.
39. Executive summary of the third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel III). JAMA 2001; 285 : 2486–2497.
40. Alberti KG, Zimmet P, Shaw J. Metabolic syndrome – a new world-wide definition. A Consensus Statement from the International Diabetes Federation. Diabet Med 2006; 23 : 469–480.
41. Ferrannini E, Balkau B. Insulin: In search of a syndrome. Diabet Med 2002; 19 : 724–729.
42. Tuan C-Y, Abbasi F, Lamendola C, et al. Usefulness of plasma glucose and insulin concentrations in identifying patients with insulin resistance. Am J Cardiol 2003; 92 : 606–610.
43. McNeill AM, Rosamond WD, Girman CJ, et al. The metabolic syndrome and 11-year risk of incident cardiovascular disease in the Atherosclerosis Risk in Communities study. Diabetes Care 2005; 28: 385–390.
44. Lakka H-M, Laaksonen DE, Lakka TA, et al. The metabolic syndrome and total and cardiovascular disease mortality in middle–aged men. JAMA 2002; 288 : 2709–2716.
45. Ford ES, Giles WH. A comparison of the prevalence of the metabolic syndrome using two proposed definitions. Diabetes Care 2003; 26 : 575–581.
46. Meigs JB, Wilson PW, Nathan DM, et al. Prevalence and characteristics of the metabolic syndrome in the San Antonio Heart and Framingham Offspring Studies. Diabetes 2003; 52 : 2160–2167.
47. Khoo CM, Liew CF, Chew SK, et al. The impact of central obesity as a prerequisite for the diagnosis of metabolic syndrome. Obesity 2007; 15 : 262–269.
48. Fruchart JC, Sacks F, Hermans MP, et al. The Residual Risk Reduction Initiative: A call to action to reduce residual vascular risk in patients with dyslipidemia. Am J Cardiol 2008; 102 (Suppl 10): 1K–34K.
49. Alexander CM, Landsman PB, Teutsch SM, et al. NCEP--defined metabolic syndrome, diabetes, and prevalence of coronary heart disease among NHANES III participants age 50 years and older. Diabetes 2003; 52 : 1210–1214.
50. Golden SH, Folsom AR, Coresh J, et al. Risk factor groupings related to insulin resistance and their synergistic effect on subclinical atherosclerosis. The Atherosclerosis Risk in Communities Study. Diabetes 2002; 51 : 3069–3076.
51. Stern MP, Williams K, Gonzales-Villalpando C, et al. Does the metabolic syndrome improve identification of individuals at risk of type 2 diabetes and/or cardiovascular disease? Diabetes Care 2004; 27 : 2676–2681.
52. Girman CJ, Rhodes T, Mercuri M, et al. The metabolic syndrome and risk of major coronary events in the Scandidavian Simvastatin Survival Study (4S) and the Air Force/Texas Coronary Atherosclerosis Prevention Study (AFCAPS/ TexCAPS). Am J Cardiol 2004; 93 : 136–141.
53. Gale EAM. Should we dump the metabolic syndrome? Yes Brit Med J 2008; 336 : 640.
54. Alberti KGM, Zimmet PZ. Should we dump the metabolic syndrome? No. Brit Med J 2008; 336 : 641.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Vybrané souhrnyČlánek Ateroskleróza 2009Článek AbstraktaČlánek Genetika v psoriázeČlánek Spolek lékařů českýchČlánek KnihaČlánek Laureáti Nobelovy cenyČlánek Wilsonova choroba
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Komentář k článku „Subacute thyroiditis confused with dental problem“ autorů Tesfaye H, et al. publikovaného v Časopisu lékařů českých číslo 9/2009, s. 438–441
- Ke koncepci metabolického syndromu
- Wilsonova choroba
- Případ akutní virové hepatitidy E získané v České republice
- Posuzování zdravotního stavu a pracovní schopnosti u onkologicky nemocných
- „První pomoc“ pro lidi s návykovými nemocemi
- Kouření zvyšuje riziko aktivní tuberkulózy
- Vybrané souhrny
- Ateroskleróza 2009
- Abstrakta
- Spojení HIV S IL-10 a vývoj AIDS
- Genetika IL-6 v účinnosti terapie hepatitidy
- Genetika v psoriáze
- V. mezinárodní antropologický kongres dr. Aleše Hrdličky „Quo vadis homo … societas humana?“
- The 11th Prague-Sydney-Lublin Symposium, Topic: Orthopaedic Anthropology
- III. ostravské angiodny – komplexní problematika ischemické choroby dolních končetin
- V. kongres českých a slovenských dermatovenerologů
- BEZKREVNÍ MEDICÍNA V KLINICKÉ PRAXI
- Vinobraní klinické farmacie XI
- Spolek lékařů českých
- XI. konferenci prenatální diagnostiky
- Kniha
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Wilsonova choroba
- Posuzování zdravotního stavu a pracovní schopnosti u onkologicky nemocných
- Případ akutní virové hepatitidy E získané v České republice
- BEZKREVNÍ MEDICÍNA V KLINICKÉ PRAXI
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



