-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Alveolární echinokokóza – nově se objevující onemocnění?
Alveolar echinococcosis – a new emerging disease?
Alveolar echinococcosis is a rare zoonotic disease caused by the cestode larval stages of Echinococcus multilocularis. The Larva develops as a tumour like cyst (hydatid). Due to a slow cyst development, the early stage of the infection is always asymptomatic and the clinical symptoms develop after years later. In the Czech Republic the disease is still very rare. Only one alveolar echinococcosis case was reported 30 years ago. However, new alveolar echinococcosis cases occurred during last two years and some of them indicate autochtonic character of the transmission. With regard to the recent increasing risk of infection with E. multilocularis in Central Europe, we present two case reports of alveolar echinococcosis in a 33-year old woman and a 24-year old man. The reports show diagnostic process and therapy of the infection.
Key words:
Echinococcus multilocularis, alveolar echinococcosis, diagnosis, chemotherapy, surgery.
Autoři: L. Hozáková-Lukáčová 1; L. Kolářová 2; L. Rožnovský 1; I. Hiemer 3; L. Denemark 4; R. Čuřík 5; J. Dvořáčková 6
Působiště autorů: IPVZ Praha, NRL pro tkáňové helmintózy ; Fakultní nemocnice Ostrava, Klinika infekčního lékařství 1; Univerzita Karlova v Praze, 1. lékařská fakulta, III. klinika infekčních a tropických nemocí VFN 2; Slezská nemocnice v Opavě, Infekční oddělení 3; Univerzita Karlova v Praze, 3. lékařská fakulta, Chirurgická klinika FNKV 4; Bioptická laboratoř s. r. o., Plzeň 5; Fakultní nemocnice Ostrava, Ústav patologie 6
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 132-136
Kategorie: Kazuistika
Souhrn
Alveolární echinokokóza je vzácná zoonóza vyvolaná larválním stadiem tasemnice Echinococcus multilocularis. Larva se vyvíjí ve formě cysty (hydatidy), která imituje nádor. Díky pomalému růstu hydatid je počáteční fáze onemocnění vždy asymptomatická, klinické obtíže se objevují až po několikaleté infekci. V České republice je onemocnění zatím velmi vzácné, a tím i málo známé. Z minulosti je znám pouze jediný případ alveolární echinokokózy, který byl popsán před třiceti lety. Teprve v posledních dvou letech se objevily nové případy alveolární echinokokózy, z nichž některé mají charakter autochtonní nákazy. Vzhledem k tomu, že současné epidemiologické studie ukazují na zvýšené riziko infekce E. multilocularis ve střední Evropě, předkládáme kazuistiky alveolární echinokokózy jater u 33leté ženy a 24letého muže, které zahrnují i možnosti stanovení diagnózy a terapie onemocnění.
Klíčová slova:
Echinococcus multilocularis, alveolární echinokokóza, diagnóza, chemoterapie, chirurgická léčba.Úvod
Alveolární echinokokóza (AE) neboli hydatidóza je závažné parazitární onemocnění, které je vyvoláno larválním stadiem tasemnice Echinococcus multilocularis. Onemocnění se endemicky vyskytuje na severní polokouli, přičemž k nejvíce postiženým oblastem patří Aljaška, Čína a Japonsko (1). Ve střední Evropě patří ke vzácně se vyskytujícím onemocněním. Do konce minulého století se AE vyskytovala zejména ve Švýcarsku, v Rakousku, v jihovýchodní Francii a v jižním Německu, kde se incidence pohybovala v rozmezí kolem 0,02–1,4/100 000 obyvatel za rok (1). Od poloviny 90. let minulého století docházelo k mírnému nárůstu případů humánní AE nejen v uvedených zemích, ale i v Polsku, na Slovensku a v Maďarsku, což pravděpodobně souvisí s nárůstem počtu lišek během posledních desetiletí (2). V České republice byla AE poprvé popsána v roce 1979 u 74leté ženy z okresu Klatovy, podruhé v roce 2008 u 57letého muže z Plzeňska (3).
AE patří k alimentárním zoonózám. Dospělé tasemnice žijí v tenkém střevě masožravců, zejména u lišek (35–65 % prevalence v české populaci), ale také u psů a koček (2, 4–6). K nákaze člověka dochází po pozření vajíček tasemnic, která jsou vylučována s trusem masožravců. Z epidemiologického hlediska je významné, že bezprostředně po defekaci jsou vajíčka schopná infikovat další obratlovce (mezihostitele), v nichž probíhá larvální vývoj tasemnic. Přirozenými mezihostiteli v životním cyklu tasemnic jsou převážně hlodavci, náhodným mezihostitelem může být i člověk. V zažívacím traktu se z vajíček uvolňuje larva, která proniká střevem a krevním nebo lymfatickým řečištěm migruje prakticky vždy do jater. V játrech se parazit vyvíjí ve formě cysty (hydatida, alveokok), která difuzně prorůstá do okolní tkáně, destruuje ji, čímž imituje nádorové bujení. Zatímco hydatida periferně narůstá, ve středu léze dochází k nekróze a kalcifikaci ložiska (1, 7). U neléčených pacientů může být jedno či více ložisek, jejichž velikost kolísá od několika milimetrů až po 5–20 cm (8).
Zdrojem růstu alveokoka jsou germinativní buňky, které jsou přítomny na jeho periferii. Exogenním pučením se buňky mohou uvolňovat a krevním nebo lymfatickým řečištěm metastazovat do blízkých orgánů, např. dutiny břišní, retroperitonea, ale i do vzdálenějších orgánů, např. plic, mozku a kostí (1).
Rychlost růstu AE a následný rozvoj klinických příznaků závisí na imunitním stavu postiženého jedince. U osob bez poruchy imunity je vzhledem k pomalému růstu parazita inkubační doba velmi dlouhá. Analýzou 207 evropských případů AE bylo prokázáno, že onemocnění bylo nejčastěji diagnostikováno u osob ve věku 50–70 let (9). Počáteční fáze infekce je vždy asymptomatická a trvá 5–15 let. U třetiny pacientů je prvním příznakem ikterus, u další třetiny bolesti v epigastriu, zbývající pacienti si stěžují na únavnost a váhový úbytek. U asymptomatických pacientů může být náhodně zjištěna hepatomegalie jako první projev AE (8). Imunosuprese například u HIV pozitivních pacientů vede k relativně rychlému růstu alveokoka a fatálnímu průběhu onemocnění (9). Ani transplantace jater u osob se závažnou AE není bez rizika. Pokud nejsou z těla příjemce odstraněny všechny zárodky parazita, dochází díky imunosupresi k jeho rychlému růstu (10).
Pro diagnostiku AE mají zásadní význam zobrazovací metody, sérologická a u nejasných případů i histologická vyšetření (11, 12). Terapie spočívá v chirurgickém odstranění parazitárních ložisek v kombinaci s chemoterapií benzimidazoly. Albendazol či mebendazol se podávají už před operací a poté ještě nejméně dva roky (13). Mnohdy ale není radikální chirurgický zákrok možný; u těchto pacientů je léčba benzimidazoly dlouhodobá až celoživotní (11, 14). Přestože je AE vzácné onemocnění, zasluhuje si pozornost pro téměř 100% úmrtnost neléčených pacientů a pro vysoké náklady na léčbu. Naštěstí i při konzervativní léčbě nedochází k podstatnému zkrácení života pacientů (1, 2).
KAZUISTIKY
Kazuistika 33leté ženy
Mladá úřednice, která pochází z východního Slovenska, poslední tři roky žije na Jesenicku. Od roku 1996 opakovaně navštívila alpské země (Rakousko, Švýcarsko, Francie, Itálie) za účelem turistiky, lesní plody sbírala výjimečně. V lednu 2006 byla vyšetřena praktickým lékařem pro únavu. Pro zjištěnou anémii hematolog zahájil léčbu preparáty železa. Pro subfebrilie a únavu byla v prosinci 2006 odeslána na Infekční oddělení v Opavě. Byla zjištěna hepatomegalie, která sahala až k pupku, proto bylo provedeno ultrazvukové vyšetření (UZ) a počítačová tomografie (CT) břicha (obr. 1, 2). V pravém laloku jater byla zjištěna dvě objemná hypodenzní ložiska velikosti 9,5 × 4,5 cm a 10 × 5 cm, na rozhraní pravého a levého laloku třetí ložisko také velikosti 10 × 5 cm. Útvary měly nepravidelné okraje s menšími kalcifikacemi. Hemangiomy byly vyloučeny pomocí výpočetní tomografie s použitím značených erytrocytů (SPECT). Prvotním sérologickým vyšetřením byly prokázány protilátky proti Echinococcus sp. Onemocnění bylo hodnoceno jako suspektní cystická echinokokóza/hydatidóza (původce E. granulosus), která se vyskytuje relativně častěji, ale současně bylo doporučeno kontrolní sérologické vyšetření s detekcí specifických protilátek proti E. multilocularis.
Obr. 1. CT jater s obrazem AE jater v sagitální rovině 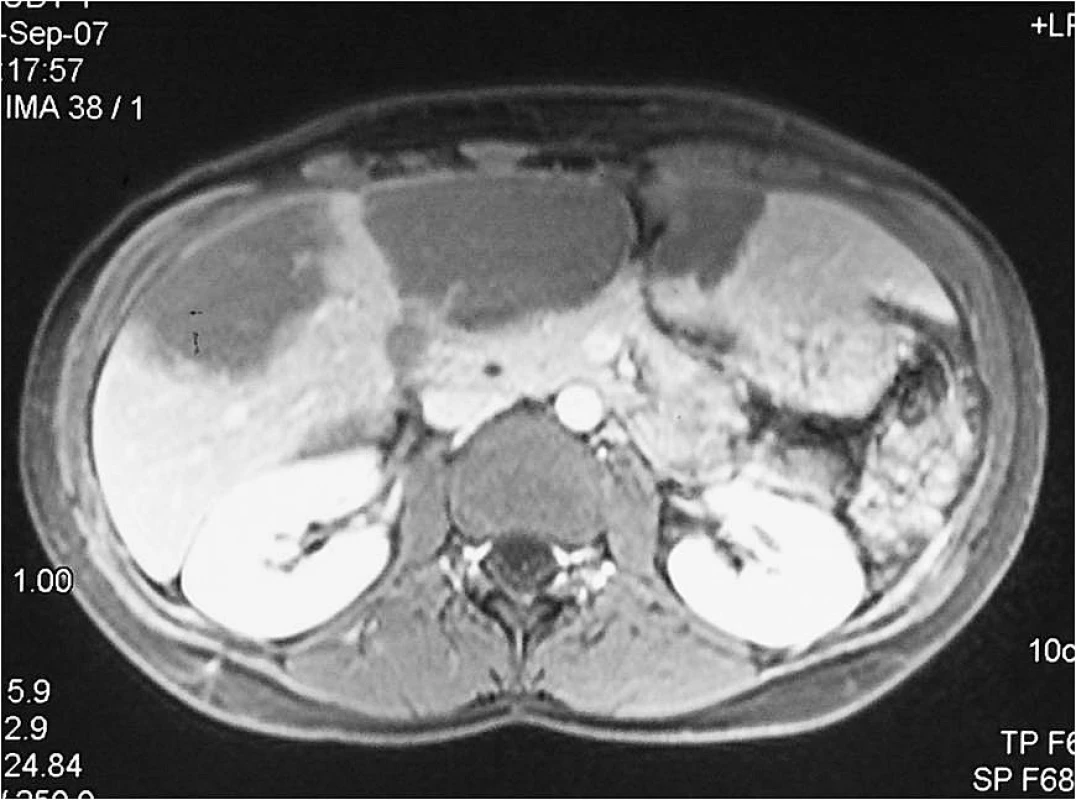
Obr. 2. CT jater – stejné ložisko ve vertikální rovině 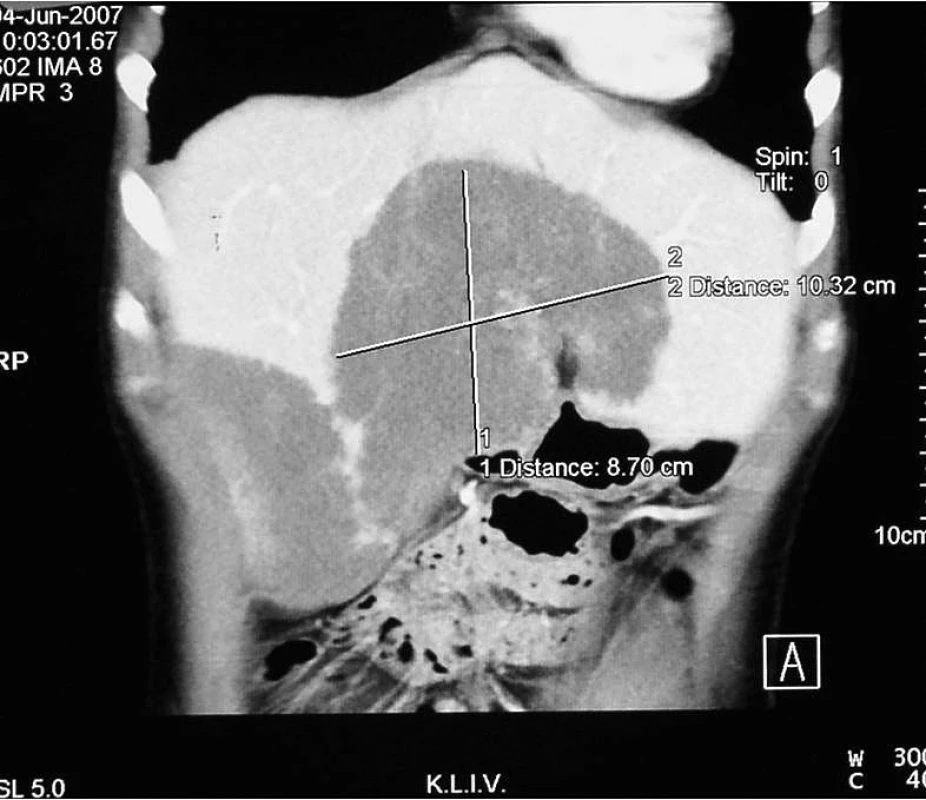
Na chirurgické klinice FN Ostrava byla v březnu 2007 provedena laparoskopická operace s biopsií ložiska. Histologickým vyšetřením byla zjištěna nekrotická masa obklopená PAS pozitivní membránou, která je typická pro larvální stadia echinokoků (obr. 3). Poté byla pacientka předána na Kliniku infekčního lékařství FN v Ostravě. Metodou ELISA IgG byly detekovány protilátky proti alveolární a cystické echinokokóze, ale i cysticerkóze způsobené larválním stadiem tasemnice Taenia solium. Diagnóza alveokokózy byla jednoznačně potvrzena konfirmačním ELISA testem s purifikovaným polysacharidovým antigenem Em2plus (ELISA test založený na kombinaci antigenu Em2 a rekombinačního antigenu II/3–10 firmy Bordier Affinity Products).
Obr. 3. Histologický obraz – PAS pozitivní membrána parazita 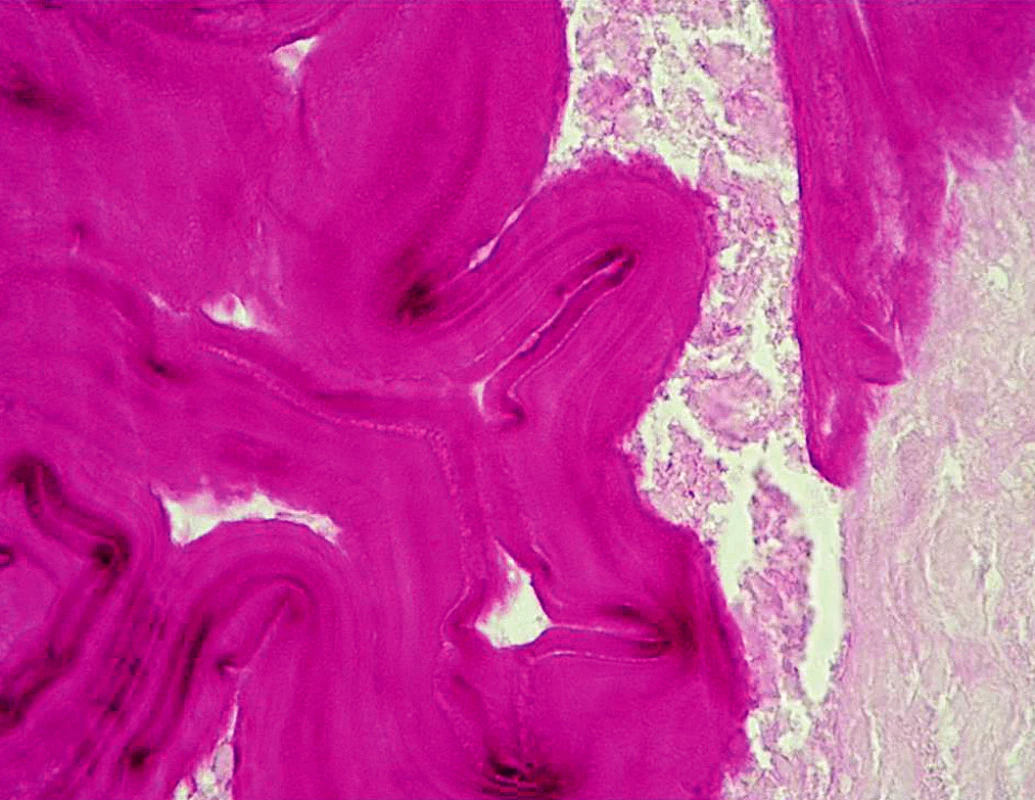
Vzhledem k inoperabilnímu jaternímu nálezu byla u pacientky zahájena kontinuální léčba albendazolem v denní dávce 700 mg (15 mg/kg/den), tj. Zentel á 200 mg 2–0–1,5 tbl.
Při pátrání po možných metastázách AE byla provedena CT plic s normálním nálezem, ale na CT mozku bylo zjištěno frontotemporálně vlevo hypodenzní ložisko 3 × 2 cm. V mozkomíšním moku byl nález v normě, nebyly v něm prokázány ani protilátky proti E. multilocularis ani nádorové buňky. Rovněž oční vyšetření a EEG záznam byly v normě. Pacientka byla asymptomatická, proto neurochirurg doporučil konzervativní postup s dalším sledováním vývoje ložiska. Nález na magnetické rezonanci (MR) mozku po měsíční léčbě byl ve srovnání s CT bez progrese. Po půlroční léčbě byla provedena pozitronová emisní tomografie (PET). Nález na játrech byl oproti původnímu CT vyšetření rozsahem beze změny, ale zvýšené vychytávání 18F-fluorodeoxyglukózy (FDG) na okraji ložisek prokazovalo trvající zánětlivý proces. V ložisku v mozku nebylo zvýšené vychytávání glukózy, ale ani PET nepřispěla k určení etiologie ložiska. Zvažován byl gliom mozku, proto neurochirurg doporučil biopsii ložiska, kterou pacientka dosud odmítá.
Pacientka dosavadní 18měsíční léčbu albendazolem toleruje dobře, přetrvává u ní jen mírné píchání v pravém podžebří a občasné bolesti hlavy. Laboratorně byla zjištěna pouze mírná anémie (hemoglobin 119 g/l), eozinofilie nepřekračující 7 %, aminotransferázy i bilirubin jsou trvale v normě, jen hodnota gama-glutamyltransferázy (GMT) je lehce nad hranicí normy. Hladina celkových IgE protilátek, která poměrně přesně a rychle signalizuje aktivitu AE, klesla z původní hodnoty 376 na 152 U/ml (norma do 87 U/ml). Hladina specifických protilátek proti alveokoku i po roce léčby zůstává stabilní.
Za 6 měsíců od stanovení AE bylo provedeno kontrolní UZ a CT vyšetření. UZ vyšetření prokazovalo regresi nálezu, ale CT tento nález nepotvrdilo. Kontrolní PET je plánována s odstupem 12 měsíců.
Pacienta je bezdětná a zvažuje graviditu, což je velký problém. Byla poučena o možném teratogenním účinku albendazolu, dokonce zvažuje přerušení léčby v graviditě i přes upozornění na vysoké riziko zhoršení AE.
Kazuistika 24letého muže
Druhým pacientem je 24letý muž ze Vsetínska, který nikdy nebyl v zahraničí. Bydlí s rodiči v rodinném domě, pracuje jako řidič, má psa a občas sbíral lesní plody. Od konce března 2008 začal pociťovat píchání a tlaky v epigastriu, sám si nahmatal tuhou rezistenci v pravém podžebří. V dubnu 2008 byl přijat na chirurgické oddělení ve Vsetíně pro výrazné bolesti břicha a hepatomegalii přesahující 10 cm pod žeberní oblouk. Pomocí UZ a CT břicha byl zjištěn nehomogenní, převážně cystický útvar postihující celý levý lalok jater v rozsahu 17,2 × 12,1 × 16,6 cm (obr 4). Ložisko s mnohočetnými drobnými kalcifikacemi odtlačovalo okolní orgány, zejména střevní kličky a hlavu pankreatu. V pravém laloku jater bylo nalezeno další ložisko velikosti 7 mm v průměru. MR prokázala výrazný útlak dolní duté žíly v úseku 5 cm. Sérologicky pomocí antigenu Em2plus byla potvrzena diagnóza AE. Na chirurgické klinice FN Praha – Vinohrady a v IKEM Praha bylo vyloučeno operační řešení včetně transplantace jater. Pacient byl přeložen na Kliniku infekčního lékařství FN Ostrava. Metodou PET byly vyloučeny metastázy AE, současně byla potvrzena vitalita alveokoka v játrech pomocí zvýšeného vychytávání FDG při ventrálním okraji ložiska.
Obr. 4. CT jater – postižení levého laloku jater 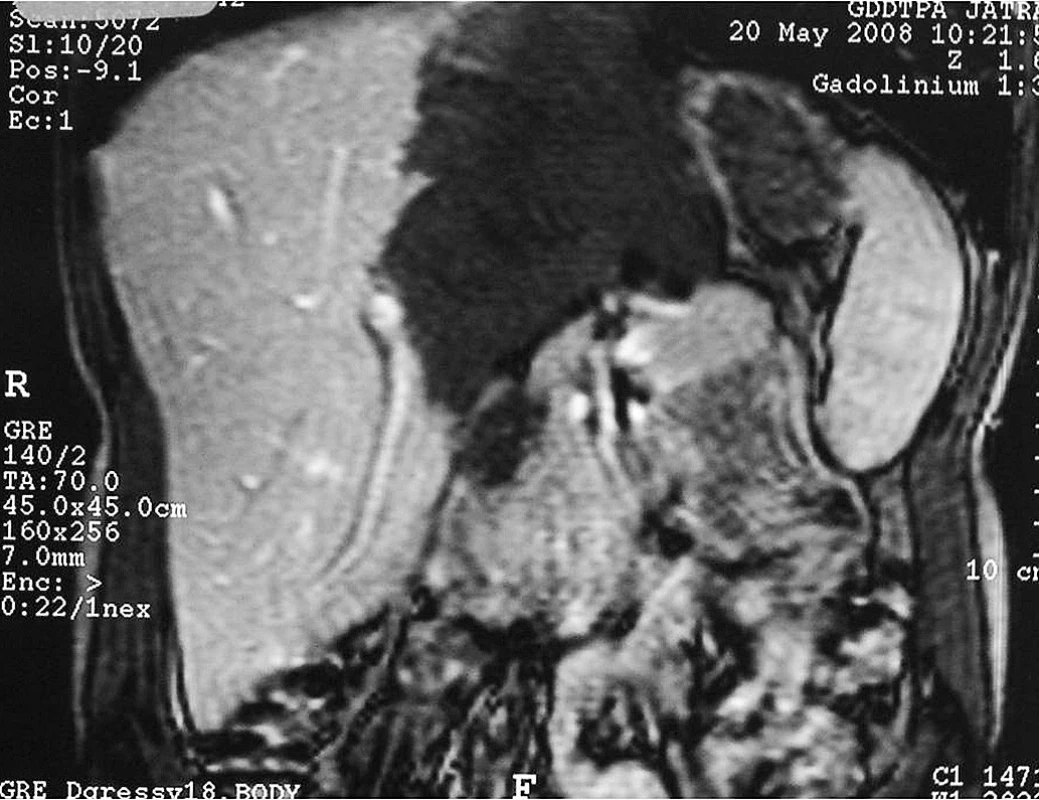
Pacient je od dubna 2008 léčen albendazolem v denní dávce 800 mg (11,5 mg/kg/den), tj. Zentel á 200 mg 2-0--2 tbl, dosavadní půlroční léčbu toleruje dobře. Laboratorní vyšetření prokázalo lehce zvýšenou hodnotu GMT, eozinofilie nebyla přítomna, dále byla zjištěna vysoká hladina celkových IgE protilátek (3500 U/ml), po 6 měsících došlo k poklesu na 2890 U/ml. Kontrolní zobrazovací metody dosud nebyly u pacienta provedeny, PET je plánována za 1 rok od úvodního vyšetření.
Diskuze
V naší republice je AE stále vzácné onemocnění, spolu s našimi dvěma kazuistikami se dosud jedná o čtyři publikované případy (3). NRL pro tkáňové helmintózy eviduje další tři případy onemocnění (nepublikováno). S ohledem na současný výskyt E. multilocularis u lišek v Evropě je možno v naší republice očekávat nárůst počtu nejen importovaných, ale zejména i autochtonních případů AE. Importovaná onemocnění mohou souviset s častým pobytem a turistikou našich občanů v endemických oblastech, např. v alpských zemích, kde se mohla infikovat pacientka uvedená v první kazuistice.
Zvýšené riziko autochtonní AE souvisí s nárůstem populace lišek v naší republice, ke kterému došlo podobně jako v jiných evropských zemích v důsledku vakcinace zvířat proti vzteklině, která je dříve decimovala (15). V řadě oblastí ČR byl E. multilocularis prokázán nejen u lišek, ale také u psa a kočky (6). V letech 1997–1998 prevalence u lišek dosahovala místy až 63,6 % (4, 6). Podobně jako v jiných evropských zemích bylo u nás zjištěno, že se nakažené lišky objevily i ve městech, kde se staly, podobně jako ve volné přírodě zdrojem infekce pro hlodavce, kteří následně mohou nakazit psy a kočky (16). K nákaze člověka by tak mohlo dojít i přímo v městských aglomeracích, pokud nejsou doma chovaná zvířata pravidelně odčervovaná. S ohledem na skutečnost, že u muže s diagnostikovanou AE nebyl zjištěn výjezd mimo republiku, dá se předpokládat, že se infikoval na našem území. Zdá se být tedy zřejmé, že AE může mít i na našem území charakter autochtonní nákazy a díky vysoké prevalenci Echinococcus multilocularis u různých druhů masožravců lze očekávat v následujících letech nárůst počtu onemocnění AE.
I když v současnosti zaznamenáváme narůstající počet případů s AE, jejich celkový počet v Evropě je dosud za posledních 50 let poměrně malý. Celkový počet případů do roku 2002 nepřesáhl 600 (9). Vzhledem k malému počtu osob s AE prokázanou navíc během dlouhého časového období je tak velmi obtížné stanovit rizika infekce. Lesní plody mohou být kontaminovány vajíčky tasemnic, přesto není doposud zřejmé, zda náhodné pozření malého počtu vajíček parazita povede k rozvoji AE. Pravděpodobně největší riziko vzniku AE je u osob, které trvale žijí a pracují v oblastech s endemickým výskytem E. multilocularis (např. lesníci, zemědělci, zahrádkáři), přičemž riziko infekce se významně zvyšuje, pokud tyto osoby zároveň chovají psy a kočky, kteří mohou být rezervoárem infekce (9). U osob v riziku AE jsou navrhována preventivní opatření, která zahrnují screeningová sérologická vyšetření, případně i vyšetření jater ultrazvukem (11).
Diagnostika AE většinou spočívá na zobrazovacích metodách a ve správné interpretaci sérologických vyšetření. Metodou volby zůstává UZ a CT, která u plně rozvinutých forem prokazují heterogenní hypoechogenní masu s nekrotickými ložisky a kalcifikacemi (11). Ložiska bez zřetelně vyvinuté parazitární stěny se vyznačují nepravidelnými okraji. Během časné AE mohou být ložiska podobná hyperechogennímu hemangiomu (13). Shodný nález při vyšetření UZ a CT je poměrně vzácný. Z literárních údajů vyplývá, že shoda může být prokázána jen v 42 % pacientů (13). I u naší pacientky kontrolní UZ vyšetření sice prokázalo regresi nálezu, ale CT vyšetřením tento výsledek potvrzen nebyl. Přesto mají zobrazovací metody význam i při hodnocení účinnosti léčby, neboť mohou poukázat na nedostatečnou léčbu, při níž parazitární útvar nadále roste, nebo na úhyn parazita, při němž dochází k vaskularizaci nebo kolikvaci nekrotického ložiska (11).
MR je přínosná pro zobrazení patologických změn v intra - a extrahepatálním cévním řečišti a v přilehlých orgánech, avšak není spolehlivá při průkazu kalcifikovaných ložisek (11). PET je významná pro sledování účinnosti léčby benzimidazoly, při úspěšné léčbě klesá vychytávání FDG, což signalizuje nižší aktivitu parazitárního ložiska (16). Kontrolní PET je vhodné provádět s odstupem 12–18 měsíců, příznivý výsledek může přispět k ukončení dlouhodobé terapie u neoperabilních ložisek (17). Ale ani negativní PET nemusí signalizovat úspěšné vyléčení, v některých případech byly prokázány rekurence onemocnění i za několik let po ukončení léčby (17). Zobrazovací metody jsou důležité i v diferenciální diagnostice, nezbytné je vyloučit například hepatocelulární karcinom (vyšší hodnota alfa-1 fetoproteinu v krvi), cystickou echinokokózu, amébový absces jater, hemangiom jater (8, 11).
Sérologická vyšetření doplňují zobrazovací metody při určení etiologie prokázaného ložiska. Nezastupitelný význam mají v počátečních fázích AE, kdy jsou ložiska malá a těžko detekovatelná zobrazovacími metodami. Používají se i pro kontrolu úspěšnosti chirurgické léčby. Pokud dojde ke kompletnímu odstranění cysty, hladiny specifických protilátek v průběhu několika měsíců postupně pomalu klesají. Pro hodnocení účinku konzervativní léčby mají sérologické testy jen omezený význam. Ve shodě s literárními zdroji zaznamenáváme dosud i u naší pacientky úspěšně léčené benzimidazoly stabilní hladinu specifických protilátek (13).
Při úvodních sérologických vyšetřeních ELISA metodou se většinou používají antigeny s menší specificitou, a proto se někdy při vyšetření sér pacientů s AE objeví zkřížená reaktivita protilátek s antigeny E. granulosus (původci cystické echinokokózy) nebo s antigeny dalších tkáňových helmintů. Pro přesné určení etiologie se v těchto případech používá více než jeden typ antigenu. K nejčastěji využívaným patří purifikované polysacharidové antigeny Em2plus a polypeptidy Em16 a Em18 (11) se specificitou pro alveokokózu přesahující 98 % (1). Všechna výše zmíněná sérologická vyšetření jsou dostupná v NRL pro tkáňové helmintózy. Výsledky sérologického vyšetření vždy interpretujeme s ohledem na anamnézu, klinický průběh a výsledky zobrazovacích metod.
Pokud trvá podezření na AE a pokud jsou sérologické metody i při použití specifických protilátek negativní či neurčité, doporučuje se vyšetření metodou polymerázové řetězové reakce (PCR), která umožňuje detekci parazitární RNA nebo DNA v biologickém materiálu. PCR diagnostiku je možné provést z materiálu získaného diagnostickou punkcí, ale spolehlivost nemusí být vysoká, pokud se nepodaří odebrat vzorek obsahující parazitární membránu (18, 19). Navíc při punkci hrozí riziko diseminace parazitárních buněk (11, 13).
Laboratorní vyšetření při AE má jen omezenou hodnotu, eozinofilie obvykle chybí, hyperimunoglobulinémie, která je přítomna u většiny pacientů, je následkem polyklonální protilátkové odpovědi. Pro kontrolu konzervativní léčby má malý význam sledování specifických protilátek, mnohem přínosnější jsou celkové IgE protilátky (1). Při úspěšné léčbě hladina celkových IgE protilátek klesá během několika měsíců.
Léčba AE spočívá v radikální resekci ložiska v játrech a dalších postižených orgánech, současně se podávají benzimidazoly po dobu minimálně dvou let (11, 13). Radikální řešení je možné jen u menších a dobře přístupných ložisek. Transplantace jater se zvažuje při biliární cirhóze s ascitem nebo při krvácení z jícnových varixů v důsledku portální hypertenze (11). Pokud jsou ložiska inoperabilní, je nutná několikaletá, někdy doživotní terapie benzimidazoly (11, 13). Albendazol (ABZ) proniká dobře hematoencefalickou bariérou, což je výhodné při cerebrální formě AE. Většinou se užívá kontinuální léčba, zejména u těžkých a progresivních forem (11, 13). U méně závažných forem a v případě toxicity je možné i cyklické podávání (28 dní léčby, 14 dní pauza, tzv. „washout phase“), ale v mezidobí bez léčby může být narušena kontrola nad růstem parazita (11). Benzimidazoly mají na E. multilocularis jen parazitostatický účinek na rozdíl od parazitocidního působení na E. granulosus (13). Doporučená denní dávka ABZ je 10 až 15 mg/kg/den (maximálně 800 mg/den) rozdělených na dvě dávky. Mebendazol (MBZ) se podává v denní dávce 40–50 mg/kg/den rozdělených na tři dávky. Oba léky se podávají s jídlem obsahujícím tuk (13). Nežádoucí účinky při léčbě benzimidazoly bývají častější při léčbě MBZ, zahrnují například zvýšení aminotransferáz, neutropenii, gastrointestinální a neurologické symptomy, reverzibilní alopecii. Léčbu je možno považovat za úspěšnou při stabilitě či regresi nálezu na zobrazovacích metodách, při poklesu hladiny celkových IgE protilátek, stabilitě či poklesu protilátek proti AE a při nepřítomnosti nežádoucích účinků léčby (13). Problémem zůstává léčba benzimidazoly v těhotenství pro jejich teratogenní účinky.
Závěr
Alveolární echinokóza je v České republice dosud vzácné, ale závažné parazitární onemocnění, jehož četnost může v následujících letech narůstat. V práci jsou uvedeny kazuistiky dvou mladých pacientů s AE, u nichž bylo ložiskové postižení jater diagnostikováno relativně pozdě bez možnosti radikálního chirurgického řešení. Pacienti jsou léčeni albendazolem, průběh onemocnění je dosud příznivý.
Zkratky
ABZ – albendazol
AE – alveolární echinokokóza
CT – počítačová tomografie
FDG – 18F-fluorodeoxyglukóza
GMT – gama-glutamyltransferáza
IgE – imunoglobulin E
MBZ – mebendazol
MR – magnetická rezonance
PET – pozitronová emisní tomografie
UZ – ultrazvukové vyšetření
Děkujeme prof. Petrovi Kernovi z Infekční kliniky v Ulmu v SRN za konzultace při léčbě a sledování našich pacientů.
Adresa pro korespondenci:
MUDr. Lubomíra Hozáková-Lukáčová
Klinika infekčního lékařství FN
17. listopadu 1790, 708 52 Ostrava
fax: +420 597 374 290, e-mail: lubomira.lukacova@email.cz
Zdroje
1. Eckert J, Deplazes P. Biological, Epidemiological, and Clinical Aspects of Echinococcosis, a Zoonosis of Increasing Concern. Clin Microb Rev 2004; 17 : 107–135.
2. Torgerson P, Schweiger A, Deplazes P, et al. Alveolar echinococcosis: From a deadly disease to a well-controlled infection. Relative survival and economic analysis in Switzerland over the last 35 years. J Hepatol 2008; 49 : 72–77.
3. Skalický T, Třeška V, Martínek K, et al. Alveolární hydatidóza – vzácný případ jaterního postižení v České republice. Čes Slov Gastroent Hepatol 2008; 62 : 30–33.
4. Kolářová L. Echinococcus multilocularis: new epidemiological insights in Central and Easter Europe. Helmintologia 1999; 36 : 193–200.
5. Kolářová L, Červený J, Martínek K. The occurence of Echinococcus multilocularis in Central and Eastern Europe. Helminthologia 1998; 35 : 165–166.
6. Martínek K, Kolářová l, Červený J. Echinococcus multilocularis in carnivores from the Klatovy district of the Czech Republic. J Helminthol 2001; 75 : 61–66.
7. Jiang C, Don M, Jones M. Liver alveolar echinococcis in China: Clinical aspect with relative basic research. World J Gastroenterol 2005; 11 : 4611–4617.
8. Amman R, Eckert J. Cestodes: Echinococcus. Gastroenterol Clin N Am 1996; 25 : 655–689.
9. Kern P, Bardonnet K, Renner E, et al. European Echinococcosis registry: human alveolar echinococcosis, Europe, 1982–2000. Emerg Infect Dis 2003; 9 : 133–139.
10. Bresson-Hadni S, Koch S, Beurton I, et al. Primary disease recurrence after liver transplantation for alveolar echinoccosis: long term evaluation in 15 patients. Hepatology 1999; 30 : 587–564.
11. Pawlowski ZS, Eckert J, Vuitton DA, et al. Echinococcosis in humans: clinical aspects, diagnosis and treatment. In: Eckert J, Gemmell MA, Meslin F-X, Pawlowski ZS. WHO/OIE Manual on echinococcosis in humans and animals: a public health problem of global concern. Paris: Office Internationales des Epizooties 2001; 20–71.
12. McManus D, Zhang W, Li J, Bartley PB. Echinococcosis. Lancet 2003; 362 : 1295–1304.
13. Reuter S, Jensen B, Buttenschoen K, Kern P. Benzimidazoles in the treatment of alveolar echonococcosis: a comparative study and review of the literature. J Antimicrob Chemotherapy 2000; 46 : 451–456.
14. Hemphill A, Spicher M, Stadelmann B, Mueller J, et al. Innovative chemotherapeutical treatment for alveolar and cystc echinococcosis. Parasitology 2007; 134 : 1657–1670.
15. Romig T, Dinkel A, Mackenstedt U. The present situation of echinococcosis in Europe. Parasitol Int 2006; 55 : 187–191.
16. Ehrhardt AR, Reuter S, Buck AK, et al. Assessment of disease activity in alveolar echinococcosis: a comparison of contrast enhanced ultrasound, three-phase helical CT and [18F] fluorodeoxyglucose positron emission tomography. Abdom Imaging 2007; 32 : 730–736.
17. Stumpe KDM, Renner-Schneiter EC, Kuenzle AK, et al. F-18-Fluorodeoxyglucose Positron-Emission Tomography of Echinococcus multilocularis. Liver Lesions: Prospective Evaluation of its Valu efor diagnosis and Follow-up during Benzimidazole Therapy. Infection 2007; 35 : 11–18.
18. Kern P, Frosch P, Helvit M, et al. Diagnosis of Echinococcus multilocularis infection by reverse-transcription polymerace Chin resction. Gastroeneterology 1995; 109 : 596–600.
19. Myjak P, Nahorski W, Pietkiewicz H, et al. Molecular confirmation of human alveolar echinococcosis in Poland. Clin Infect Dis 2003; 37 : 121–125.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Nepodceňujme důležitost dobré koncepční práce a kompetentního řízení zdravotnictví
- Mastné kyseliny 2. Fyziologický a klinický význam
- Transkripční pochody v jádře
- Šedá eminence v medicíně – štítná žláza: 2. část
- Sedmnáct kroků, jak zvítězit nad internetovou pornografií (svépomocný materiál)
- Přehled chirurgické léčby vitiliga
- mikroRNA regulující stresovou imunitní odpověď
- Alveolární echinokokóza – nově se objevující onemocnění?
- Identifikace genů, které regulují migraci
- T-buňky a jejich polibek smrti
- Zavedení DNA čipu do molekulární diagnostiky Wilsonovy choroby
- Knihy
- Trampoline-related injuries in childhood
- Suicide attempts -possibility of psychoprofilactic
- Food-dependent exercise-induced anaphylaxis
- Konference Sekce infekčních nemocí v gynekologii a porodnictví České gynekologicko-porodnické společnosti České lékařské společnosti J. E. Purkyně
- Kniha
- Založení české společnosti bezkrevní medicíny
- Spolek lékařů českých v Praze
- LAUREÁTI NOBELOVY CENY
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Alveolární echinokokóza – nově se objevující onemocnění?
- Mastné kyseliny 2. Fyziologický a klinický význam
- Šedá eminence v medicíně – štítná žláza: 2. část
- Přehled chirurgické léčby vitiliga
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



