-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
O lidském stárnutí a dlouhověkosti – 2. vnitřní podmínky
On human ageing and longevity – 2. internal determinants
Longevity as a result of prolonged or postponed ageing is substantially influenced by genetic determinants. Most of them were analyzed by studying different progeria syndromes and their genetic control. From this point of view the use of experimental animals, because it enables to identify genes involved in shortening or prolongation of life-span by changing experimental conditions, has been also very effective. Expression of ageing processes at cellular as well on organism level as a biological unit revealed sets of genetic pathways involved in longevity. Several theories which elicit different aspects have been constructed to explain the ageing process.
Key words:
cell ageing, Hayflick limit, antagonistic pleiotrophy, progeria, lamins, cell cycle, DNA repair, RecQhelicases, sirtuins, telomeres, mitochondrion, hormones, sex differences, immunity.
Autoři: R. Brdička
Působiště autorů: Ústav hematologie a krevní transfuze a Ústav experimentální medicíny AV ČR, Praha
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 330-334
Kategorie: Speciální sdělení
Souhrn
Dlouhověkost je projevem prodlouženého nebo odloženého stárnutí a tento proces má i své genetické podmínky. Syndromy předčasného stárnutí a analýzy jejich genetické determinace umožnily identifikaci řady odpovědných genů, které proces stárnutí ovlivňují. Z tohoto hlediska byly rovněž velice užitečné pokusy na zvířatech, při nichž vhodnou volbou experimentálních podmínek bylo možné délku života pokusných zvířat prodlužovat nebo zkracovat, a identifikovat tak odpovědné geny. Proces stárnutí lze sledovat jak na úrovni jednotlivých buněk, tak organismů jako celku, ačkoliv oba procesy spolu úzce souvisí.
K vysvětlení podstaty stárnutí byla vytvořena řada teorií, které zdůrazňují určité vybrané stránky tohoto jevu.Klíčová slova:
stárnutí buněk, Hayflickův limit, antagonistická pleiotropie, syndromy progerie, laminopatie, buněčný cyklus – p53, opravy DNA, RecQhelikázy, sirtuiny, telomery, mitochondrie, hormony, pohlavní rozdíly, imunita.Úvod
Rozdělení na vnější vlivy a vnitřní podmínky dlouhověkosti je veskrze tradiční a z hlediska třídění všech zmiňovaných faktorů, o nichž víme, že „jsou ve hře“, a dokážeme se v prostoru vymezeném tomuto článku o nich zmínit, je též pragmatické. Vnitřními podmínkami budou situace biologické a determinanty genetické. Z genetických determinant pak strukturní charakteristiky genomu v jeho zárodečné podobě, případně změny, které se v jeho struktuře během individuálního života odehrávají, a biologickým pohledem se pokusíme zhodnotit vývoj organismu a význam v něm fungujících systémů. V článku, který jsme věnovali vnějším okolnostem, jsme zdůraznili větší rigiditu a setrvačnost vnitřních podmínek, které se vytvářely během vývoje a z nichž ty nejzákladnější platí pro většinu současných forem života. Genetických determinant je sice „konečný“ počet a možnost je identifikovat se stále zdokonaluje, přesto však nejsme dosud schopni je kompletně individualizovat a porozumět jim.
Život každého smrtelného individua má svůj začátek a konec – a tedy i svou délku. U vícebuněčných organismů včetně člověka můžeme rozeznat několik fází individuálního vývoje – ontogenezi, a nebudeme-li zabíhat do podrobností, můžeme jako první uvést fázi prenatální, po níž následuje období završené zvládnutím schopnosti se rozmnožovat – pohlavní dospělostí. Schopnost rozmnožovat se trvá různě dlouhou dobu. U žen bývá ukončena dříve než u mužů a na rozdíl od žen u mužů slábne postupně. Pro naše účely vyhoví demografický způsob dělení, v němž obvykle ohraničujeme dospívání 12–20 lety, ranou dospělost cca 40 lety, střední dospělost 65 lety a pozdní dospělost obdobím po 65 letech. Pro vyšší věkové kategorie je uváděna ještě fáze nad 80–85 let (old oldest – vysoké stáří), po nichž případně následuje kategorie stoletých (centenarians). Odlišné třídění používají právníci, kteří začínají limitem pro právní odpovědnost, případně ukončenou ztrátou způsobilosti k právním úkonům – opírají se především o stav duševních schopností, jiné ekonomové, které zajímá schopnost aktivně se podílet na tvorbě národního produktu nebo sociologové a další společenské vědy (právo volit, a být volen). Všechna zmíněna ohraničení jsou arbitrární, založená na zkušenosti a dohodě, a i když jsou uplatňována paušálně = platí „univerzálně“ (pro všechny osoby), jsou umělá a běžně přehlížejí individuální odlišnosti.
Pro přírodu, pro vznik a vývoj druhu je zásadní otázkou schopnost rozmnožování, vytváření nových generací. U savců a zvláště u primátů je dosažení schopnosti samostatného života po narození odloženo na pozdější dobu, během tohoto období jsou zcela odkázáni na rodičovskou péči. Vznik nové generace není tedy závislý pouze na schopnosti plození, počtu narozených, ale i na schopnosti rodičovské generace udržet novou generaci při životě do doby, než se sama bude moci ujmout úkolu rozmnožování. Předpokládáme, že tyto schopnosti jsou ovládané geny, jejichž výběr byl podroben intenzivnímu selekčnímu tlaku, přičemž otázku jejich významu a vlivu na další období života nebral přirozený výběr příliš v úvahu. Takže geny vhodné pro rozmnožování a péči o potomstvo mohou být i méně vhodné pro fáze pozdější, kdy už nová generace je plně schopná samostatného života včetně rozmnožování (antagonistická pleiotropie), dokonce by se mohly uplatňovat jako regulátor hustoty populace (obyvatelstva) Do této kategorie genů spadají na prvním místě ty, které jsou hormonální regulací zapojené do reprodukce. S představou, že i makroorganismy by mohly stejně jako jejich buňky disponovat programem ukončujícím jejich život, však většina vědců nesouhlasí. Život – jeho vznik a ukončení můžeme sledovat na dvou úrovních: buněčné a organismové.
BUŇKA
Genetický aparát buňky
Základní funkcí genetického aparátu buňky je udržování genomu v bezchybném funkčním stavu, který se realizuje jednak uvolňováním genetických informací, jednak jejich kopírováním. K tomu účelu je buňka vybavena velkým množstvím mechanismů, které zajišťují replikaci, rekombinaci a opravy (úpravy) deoxyribonukleových kyselin včetně bílkovinných struktur zajišťujících jejich transport a ovládajících jejich použití (histony). Nikoliv bezvýznamnou stránkou je prostorové uspořádání. Pro správnou funkci genomu je třeba, aby vše bylo na svých místech (1).
Laminy
Laminy patří mezi „stavební“ bílkoviny vnitřní slupky jaderné membrány s řadou funkcí včetně přenosu signálů – genové regulace. Jsou důležité pro vztah mezi jadernou membránou heterochromatinem a šíři jejich uplatnění lze dokumentovat na projevech chorob, na jejichž vzniku se podílejí tzv. laminopatií. Kromě, na tomto místě samozřejmě zdůrazněné účasti na zrychleném stárnutí – progerii (Hutchinson-Gilford progeria syndrom), jsou to například muskulární dystrofie Emery-Dreyfusova typu, lipodystrofie, inzulínové resistence, poruchy kostí a kloubů, kardiomyopatie a další choroby (2). Na laminopatiích způsobených poruchami funkce laminů se vedle jejich strukturních genů podílejí i geny, které ovládají jejich přeměnu do funkceschopné podoby (ZMPSTE24) (3). Na propojení genu LMNA s ostatními geny podílejícími se na stárnutí upozornil Kudlow se spolupracovníky (4).
Buněčný cyklus a TP53
Buněčná smrt – apoptóza je navozena v případě „neopravitelného“ poškození genetického aparátu buňky, přílišného nahromadění změn, které brání jeho správné funkci.
Jestliže genetický aparát buňky, její základní informační systém a jeho správná funkce je pro život buňky zcela nezbytný, je logické, že jeho udržování v optimálním stavu věnuje buňka maximální péči. Buňka je vybavena schopností reagovat na jeho poškození – nesprávnou funkci a rozhodovat, zda jeho stav umožňuje úpravu, či nikoliv. Je-li poškození příliš veliké, spustí program autodestrukce – program buněčné smrti – apoptózu. V klíčovém místě tohoto procesu se nachází p53 protein jako produkt genu TP53, který zasahuje do buněčného dělení a z tohoto hlediska je řazen mezi tzv. nádorové supresory. Buňce s poškozeným genomem brání v dalším dělení. Jeho vyřazení z funkce může mít závažné následky, jak potvrzují časté nálezy mutací TP53 u nádorů. P53 a jeho spoluhráči – např. MDM2, MAPK a další geny mají významnou roli i v našem pohledu na délku lidského života (5–8). Řada prací ukazuje na zvláštní význam polymorfismu TP53 kodonu 72 (9) Arg/Pro, kde nositelé homozygotnho genotypu Pro/Pro jsou náchylnější k nádorovým procesům než nositelé genotypu Arg/Arg (10).
Měření genové exprese u velkého počtu genů – umožněné biočipovými technologiemi – odhalilo několik základních skupin genů, které jsou z hlediska udržování života a dosažení dlouhověkosti zvlášť důležité (11, 12). Jsou to především: geny ovládající buněčný cyklus – již zmíněné pRB/p53, geny kontrolující buněčnou stavbu – cytoskelet, geny zapojené v interferonové regulaci, geny působící v rámci růstových faktorů – insulin growth factor-related, v MAP kinázové dráze a v dráze oxidativního stresu.
Reparační systémy
V těchto odstavcích však rozhodně nejde o konečný výčet procesů, které s funkcí genetického aparátu souvisejí. Na tomto místě ho doplníme o reparační procesy, jejich kvalitu a aktivitu, jejichž účelem je udržování struktury genomu, a to vzhledem k chybám, k nimž dochází jak během jeho používání, tak vlivem zásahů z vnějšku (13). Neměli bychom zapomenout, že zde máme na mysli stav opravných systémů v jejich vrozené (zděděné) podobě!
Jde o poměrně rozsáhlou skupinu genů, k nimž svým způsobem nepochybně patří nejen geny „výlučně“ určené k opravě defektů (odchylek), ale i ty, které se podílejí na replikaci, neboť právě vysoký stupeň identity nově vzniklých molekul DNA s původními je dán schopností okamžitého odstranění odchylek, ke kterým by během replikace došlo (14). Některé syndromy spojené s projevy stárnutí souvisí s poruchami excizního systému odstraňování změněných nukleotidů (Cockaynův syndrom, Xeroderma pigmentosum E, Trichthiodystrofie, cerebrookulofacioskeletální syndrom) a odpovědné geny byly již identifikovány (15, 16) a do jisté míry sem lze zařadit i Rothmund-Thomsonův syndrom – související s oxidativním poškozením DNA.
RecQ helikázy
Helikázy jsou podstatnou součástí replikačního procesu. Jejich úkolem je rozvíjet dvoušroubovici DNA tak, aby byly oba řetězce přístupné pro činnost dalších na replikaci se podílejících enzymů. Neomezují se ovšem jen na replikaci, ale působí i při dalších procesech, k nimž je zapotřebí řetězce DNA, byť jen místně, od sebe oddělit – rekombinace, transkripce, reparace. Rodina RecQ helikáz je evolučně konzervovanou skupinou helikáz a jejich špatná funkce je činěna odpovědnou za několik syndromů – Bloomův syndrom, Wernerův syndrom a již zmíněný Rothmund-Thomson syndrom (17, 18).
Sirtuiny
K první skupině genů ovládajících buněčný cyklus můžeme připojit skupinu sirtuinů kontrolující deacetylační procesy bílkovin, a tak ovládající i aktivitu genetického aparátu buňky např. transkripci (19, 20).
Rodina sirtuinů zasahuje do celé řady buněčných procesů, počínaje stavem chromatinu (histony), ale také ovládá mitochondriální biogenezi, a tak zprostředkovává účinek CR – kalorické restrikce. O té jsme se zmínili v předcházejícím článku (21).
Telomery
Význam telomer pro integritu chromozomů, pro replikaci chromozomálních molekul DNA, a tím i pro schopnost buňky se dělit, se nám dnes zdá samozřejmý. Na to, že schopnost buněk se množit, může být nějakým způsobem omezena tak, že je pro každý typ buněk předem určeno, jak velké potomstvo může mít, upozornil již Hayflick. Schopnost dělení charakteristická pro diferencované buňky má určitou mez, kterou dnes označujeme jako Hayflickův limit a pohybuje se někde mezi 50–70 mitózami. Chromozomy eukaryotických buněk jsou zakončeny šestinukleotidovými repeticemi (5-TTAGGG-3) v počtu několika stovek, přičemž oba řetězce molekuly DNA nejsou stejně dlouhé (obr. 1). Při každé replikaci dojde ke ztrátě určitého počtu těchto repetic a poklesne-li délka telomer pod určitou mez, je to signálem bránícím vstupu buňky do dalšího dělení. U buněk, jejichž uchování dělivosti je pro organismus nezbytné, je zachován v aktivní podobě mechanismus působící převážně v embryonálním období, který je schopen telomery prodlužovat přidáním dalších repetic, a tak bránit jejich zkracování. Enzymem, který přidávání příslušných repetic zajišťuje, je tzv. telomeráza, která vedle bílkovinné části kontrolované genem TERT obsahuje i odpovídající sekvenci RNA 3-CAAUCCCAAUC-5, jež se svou komplementární částí přichytí konce telomerní repetice, a tu prodlouží reverzní transkripcí (22). Aktivita telomerázy je uchována i v dospělosti v dělivých pletivech a u nádorových buněk (23). Z počátku se zdálo, že její aktivita je pro schopnost buněk opakovaně se dělit absolutně nezbytná. Dnes víme, že buňky disponují i alternativním procesem (24). Telomery jsou složitým útvarem zakončujícím chromozomy, sestávajícím z řady bílkovin – produktů proteinotvorných genů, jejichž přítomnost a funkce není méně důležitá než samotné repetice DNA. Díky poruchám některých z nich, vedoucím k typickým onemocněním, známe např. dyskerin a odpovědný gen DKC1, jehož mutace způsobují X-vázanou Dyskeratosis congenita charakterizovanou selháváním kostní dřeně (25).
Obr. 1. Zakončení telomer hexanukleotidovými repeticemi s přesahujícím koncem 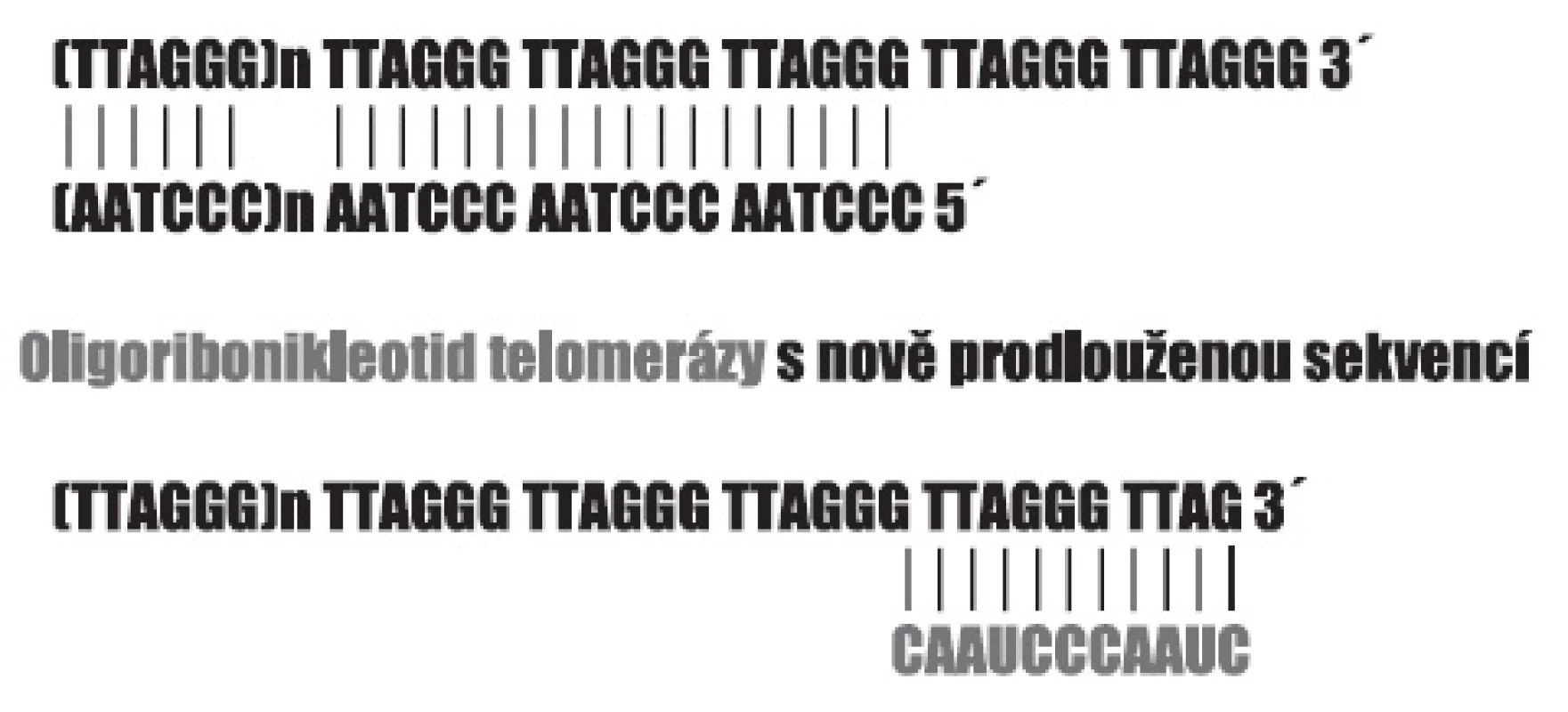
Mitochondnrie
V uvedeném výběru vnitřních podmínek stárnutí na buněčné úrovni se ještě věnujeme mitochondriím. V jejich případě bychom mohli spojit buněčnou úroveň s úrovní organismovou, neboť změny, ke kterým dochází v jednotlivých buňkách, nejsou ve svých důsledcích na tyto buňky omezeny. Tato organela a její genom se v řadě parametrů odchyluje od pravidel, které dodržuje zbytek buňky včetně jádra. Sama o sobě podléhá snáze poškození svého genomu, jehož poruchy s výjimkou odstranění nepatřičných bází nedovede opravit. Přitom svou činností, při které vznikají reaktivní radikály – jako vedlejší produkt výroby ATP, si zřejmě svůj genom sama poškozuje (26, 27). Na snížení tvorby ATP může buňka reagovat zvýšením počtu mitochondrií a molekul mitochondriální DNA, které ovšem mohou být stále defektní. Během života organismu poruch mitochondriálního genomu přibývá, zvyšuje se počet mutací, a proto se někteří autoři přiklánějí k názoru, že hlavním činitelem odpovědným za stárnutí je právě mitochondrie (28).
ORGANISMUS
Signály – Regulační systémy
Mnoho úsilí bude ještě třeba věnovat proniknutí do vzájemných vztahů nejen na úrovni jednotlivých genů, funkčních drah, ale i z hlediska jejich reakcí na podněty zvnějšku.
Některým mezigenovým vztahům jsme se věnovali v předchozích odstavcích a jejich oddělení od signálů používaných mezi buňkami v rámci makroorganismu je sice umělé, nicméně věříme, že zjednodušuje porozumění. Vedle signálů, kterými se buňky dorozumívají mezi sebou, působí na organismus, a tedy i na jeho buňky, signály přicházející z vnějšku. Pro některé vytvořil vývoj specifické receptory a vypracoval i algoritmy odpovědí, pro jiné vlivy žádné specifické způsoby příjmu lidské tělo nemá, buď proto, že je příroda nevyvinula, nebo zanikly.
Uvnitř organismu se pohybuje spousta signálních molekul jak v rámci nervové soustavy, tak v cévním řečišti. Některé působí na krátkou vzdálenost – mezi sousedními buňkami, jiné na dálku, a ačkoliv jsou k dispozici všem buňkám, mohou mít určitý konkrétní cíl, daný přítomností specifických receptorů na/v cílových buňkách. Pohlavních hormonů se to týká bez nejmenších pochyb (29), stejně tak růstových (30), ale i dalších, např. melatoninu regulujícího cirkadiální rytmus (31, 32). Odchylky postihují snad všechny hormonální regulace (33–36). Experimenty s kalorickým omezením (CR) a vyřazením receptoru růstového hormonu na myších ukázaly vzájemnou provázanost a závislost vlivu CR na prodloužení života na přítomnosti funkčního receptoru (37). Vyřazení receptoru také ovlivnilo citlivost buněk na inzulín.
Pohlavní rozdíly
Je všeobecně známo, že v populaci se vykytuje více dlouhověkých žen než mužů (38). Proč tomu tak je, se pokusilo vysvětlit velké množství prací, z nichž většina se shoduje na tom, že podstatou jsou rozdíly v hormonální regulaci a v aktivitě některých enzymů – například glutathionperoxidázy a superoxiddismutázy (39–41). Evoluční pohled na souvislost chromozomální determinace pohlaví s kratším životním cyklem mužů najdeme u Bieceka a Cebrata (42).
Imunitní systém
Na tomto místě si dovolíme drobné plagiátorství a použijeme pár vět z abstraktu článku L. Kaszubowské (43): „Imunosenescence je charakterizována zvláštní remodelací imunitního systému vyvolanou jeho vystavením antigenům a oxidativnímu stresu. Během stárnutí se adaptační imunita rozpadá v souvislosti s postupným poklesem naivních T ‑ a B‑buněk a poklesem množství T - a B-lymfocytů“. Za jednu z příčin těchto změn imunitního systému je považován pokles dělivosti buněk způsobený zkracováním telomer se specifickým průběhem v některých řadách. Stres a jeho odraz v hormonální regulaci je vůbec považován za jednu z hlavních příčin procesů imunosenescence (44).
Experimenty na izolovaných tymových T-buňkách myší, kdy u starších zvířat se na jejich povrchu nacházely IgM protilátky, naznačovaly rozvoj autoimunitní reakce (45) stejně jako pozorování o zvýšené reaktivitě dendritických buněk proti vlastním antigenům (46) a snížení exprese T-buněčných receptorů (47).
I když jsme se úmyslně nezabývali otázkami „léčení stárnutí“ jako takového, které si nepochybně zaslouží samostatnou publikaci, zdá se vhodné uvést dvě citace, v nichž je tato otázka propojena se vzájemným působením hormonů a imunitního systému (48, 49). Mezi geny, jejichž patogenní alely mají mnohostranný účinek a jejichž přítomnost v genotypu lze považovat za signum mali ominis, patří dnes již bezesporu APOE.
Apoliprotein E
Z běžných alel APOE jsou známy tři lišící se v aminokyselinovém složení příslušných proteinů – apoE2, apoE3 a apoE4. Z hlediska zdraví můžeme alelu E2 považovat za prospěšnou, E3 za neutrální a E4 za škodlivou hlavně v rámci homozygotního genotypu.
Její častější výskyt je spojován s řadou onemocnění, na prvním místě s Alzheimerovou chorobou (50). APOE je také oporou pro představu antagonistické pleiotropie (51). Ve vyšších věkových kategoriích je alela E4 nacházena mnohem méně často než alela E2, zatímco s mírou fertility je to právě naopak. Srovnání úmrtnosti podle genotypu a podle pohlaví ukazuje, že ženy jsou proti působení alely E4 zvláště ve vysokém věku odolnější (52).
Populace
Neměli bychom nechat bez povšimnutí i stránku populační, vzájemné působení organismů v rámci určitého společenství. V tomto ohledu patří otázky lidského stárnutí a dlouhověkosti do oblastí, kterými se zabývá sociologie a další obory (medicínu pochopitelně nevyjímaje), které vytvářejí podmínky urychlující, nebo zpomalující biologické procesy stárnutí, a narazili jsme na ně již v předešlém článku (21). Představují totiž i určité selekční tlaky a mohou mít dopad také na stav našeho genomu a jeho vývoj. Otázka stresu, ale i somatických mutací je právě jednou z uvažovaných příčin stárnutí.
Závěr
Význam jednotlivých složek genetického aparátu pro délku lidského života ozřejmují jejich poruchy, které jsou spojovány s „předčasným stárnutím“ s již zmíněnými Wernerovým syndromem, Bloomovým syndromem, Rothmund-Thomsonovým syndromem nebo Huthinson-Gilfordovým syndromem a dalšími. Změny (odchylky) odpovědných genů nám sice umožnily identifikovat procesy, které mohou urychlovat stárnutí, avšak o příčinách „normálního“ stárnutí mnoho nevypovídají. Definice stárnutí je obtížná, i když můžeme mít dojem, že všichni víme, oč jde. Je to proces, kterému podléhají všichni lidé (pokud nezemřou předčasně), charakterizovaný hromaděním určitých změn v čase, které se týkají fyzických, psychických a sociálních stránek lidského života.
V tomto směru vznikla řada teorií, z nichž některé vycházejí z čistě mechanických představ připodobňující lidský organismus ke stroji, který se během své činnosti opotřebovává a délka jeho použitelnosti je závislá na rezervách – náhradním řešení. V obecné poloze je tato teorie z hlediska současných možností medicíny dobře použitelná – všichni víme o náhradních částech lidského těla, které jsou nejen život usnadňující, ale často i umožňující. Jsou stále dokonalejší a neustále jich přibývá.
Jiná z teorií vychází z představ o postupném hromadění somatických mutací, které vedou ke změně, případně až ztrátě, funkce jednotlivých buněk, tkání či orgánů. Typickým příkladem může být narůstání počtu mutací tam, kde chybí nebo jsou omezené opravné procesy – např. v mitochondriích.
Další teorie zdůrazňuje nedostatečnou schopnost buněk odstraňovat některé produkty jejich metabolismu, které se hromadí jako odpad a mohou vést až k zániku buňky.
Vedlejším produktem jejich metabolismu jsou také různé volné radikály, na prvním místě v mitochondriích vznikající reaktivní kyslík, které mohou zasahovat do nejrůznějších buněčných funkcí a způsobovat jejich poruchy – oxidativní stres.
Existuje i teorie zdůrazňující poruchy imunitního systému, jehož schopnost rozlišit vlastní od cizího se může postupně vytratit a zvrátit v autoimunní reakce. Nelze ani opominout skutečnost, že „stárnutí“ jednotlivých součástí lidského těla neprobíhá stejně rychle a pro člověka je zvlášť významná činnost nervové soustavy, především mozku. Budeme-li hodnotit buněčnost mozkové tkáně (neuronů), pak je nasnadě, že lidský mozek začíná ze všech orgánů stárnout nejdříve a právě pro něj je důležité, jak velikou má rezervu – kolik funkceschopných buněk je zapotřebí k jeho správné činnosti. A opět bude záležet na tom, kterou „duševní“ činnost budeme hodnotit. Dokonce si musíme připustit otázku, zda pokles jeho buněčnosti není projevem „zrání“ a zda nejde, alespoň zpočátku, o jistou racionalizaci odvislou od užívání. Smí-li si autor dovolit připojit vlastní názor, pak nejspíše všechny vyjmenované teorie postihují některou ze složek stárnutí a jejich význam pro každého z nás bude trošku jiný. Jestliže „starší“ práce hledaly příčiny na úrovni struktury, v posledních letech se výzkum věnuje spíše funkčním změnám, zájem se přesunuje od genomu k transkriptomu (53–56). V každém případě je třeba připomenout evoluční pohled s představou o antagonistické pleiotropii. Předskutečně závěrečným slovem se musí autor omluvit těm, kteří očekávali výčet genů, které nějakým způsobem mohou být spojovány s procesem stárnutí – že se ho nedočkali. Pokud by se ke každému měla připojit jen jedna věta, měli by před sebou mnohem delší text – spíše knížku, než ten, kterým se právě prokousali. Nicméně snad vezmou zavděk alespoň dvěma odkazy (57, 58).
Podpořeno grantem IGA 9804.
Adresa pro korespondenci:
prof. MUDr. Radim Brdička, DrSc.
Ústav hematologie a krevní transfuze
U Nemocnice 1, 128 08 Praha 2
fax: +420 221 977 196, e-mail: molgen@uhkt.cz
Zdroje
1. Misteli T, Soutoglou E. The emerging role of nuclear architecture in DNA repair and genome maintenance Nature Reviews Molecular Cell Biology 2009; 10 : 243–254.
2. Vigoroux C. Laminopathies: Lipodystrophies, insulin resistance, syndromes of accelerated ageing… and others. Annales d’Endocrinologie 2005; 66 : 270–278.
3. Jacob KN, Garg A. Laminopathies: Multisystem dystrophy sydromes. Molecular Genetics and Metabolism 2006; 87 : 289–302.
4. Kudlow BA, et al. Suppresion of prpoliferative fecects associated with processing-defective Lamin A mutants by hTERT or inactivation of p53. Mol Biol Cell 2008; 19 : 38–48.
5. Salvioli S, et al. Why do centenarians escape or postpone cancer? The role of IGF-1, inflammation and p53. C 2009; PMID: 19139887.
6. Volk EL, et al. MDM2-A, a common Mdm2 splice variant, causes perinatal lethality, reduced longevity and enhanced senescence. Dis Model Mech 2009; 2 : 47–55.
7. Tavernarakis N, et al. The effects of p53 on whole organism longevity are mediated by autophagy. 2008; 4 : 870–873.
8. Cheung, CTY, et al. CARF: An emerging regulator of p53 tumor suppressor and senescence pathway. Mechanisms of Ageing and Development 2009; 130 : 18–23.
9. Den Reijer PM, et al. Influenece of the TP53 codon 72 polymorphism on the cellular responses to X-irradiation in fibroblasts from nonagenarians. Mechanisms of Ageing and Development 2008; 129 : 175–182.
10. Zhu ZZ, et al. Association of p53 codon 72 polymorphism with genetic susceptibility to hepatocellular carcinoma in Chinese population. Chinese J Med Genetics 2005; 22 : 632–635.
11. Fridman AL, et al. Expression profiling identifies three pathways altered in cellular immortalization: interferon, cell cycle, and cytoskeleton. J Gerontol A Biol Sci Med Sci 2006; 61 : 879–889.
12. Fridman AL, Tainsky MA. Critical pathways in cellular senescence and immortalization revealed by gene expression profiling. Oncogene 2008; 27 : 5975–5987.
13. Misteli T, Scaffidi P. Genome instability in progeria: when repair gets old. Nature Medicine 2005; 11 : 718-719.
14. Rossi ML et al. Lagging strand replication proteins in genome stability and DNA repair Chemical Reviews 2006; 106 : 453–447.
15. Garinis GA, et al. DNA damage and ageing: new-age ideas for an age-old problem. Nature Cell Biology 2008; 10 : 1241–1247.
16. Kyng KJ, Bohr VA. Gene expression and DNA repair in progeroid syndromes and human ageing Ageing Research Reviews 2005; 4 : 579–602.
17. Bachrati CZ, Hickson ID. RecQ helicases: suppresors of tumorigenesis and premature ageing. Biochem J 2003; 374 : 577–606.
18. Hanada K, Hickson LD. Molecular genetics of RecQ helicase disorders. Cell Mol Life Sci 2007; 64 : 2306–2322.
19. Shoba B, et al. Function of sirtuins in biological tissues. Anat Rec (Hoboken) 2009; 292 : 536–543.
20. Imai SI. From heterochromatin islands to the NAD World: A hierarchical view of aging through the Biochim Biophys Acta 2009; 13: PMID: 19289152.
21. Brdička R. O lidské dlouhověkosti – 1. vnější vlivy. Čas Lék čes 2009; 48 : 264–268??.
22. Njajou OT, et al. Telomere length is paternally inherited and is associated with parental lifespan. Proc Natl Acad Sci USA 2007; 104 : 12135–12139.
23. Jiang H, et al. Proteins induced by telomere dysfunction and DNA damage represent biomarkers of human aging and disease. Proc Natl Acad Sci USA 2008; 105 : 11299–11304.
24. Nabetani A, Ishikawa F. Unusual telomeric DNAs in human telomerase-negative immortalized cells. Molecular and Cellular Biology 2009; 29 : 703–713.
25. Gu B, Bessler M, Mason PJ. Dyskerin, telomerase and the DNA damage response. Cell Cycle 2009; 8 : 6–10.
26. Pani G, Koch OR, Galeotti T. The p53-p66shc-Manganese Superoxide Dismutase (MnSOD) network: A mitochondrial intrigue to generate reactive oxygen species International Journal of Biochemistry and Cell Biology 2009; 41 : 1002–1005.
27. Gruber J, Schaffer S, Halliwell B. The mitochondrial free radical theory of ageing – where do we stand? Frontiers in bioscience: a journal and virtual library 2008; 13 : 6554–6657.
28. Dowling DK, et al. Applying the genetic theories of ageing to the cytoplasm: Cytoplasmic genetic covariation for fitness and lifespan Journal of Evolutionary Biology 2009; 22 : 818–827.
29. Dalakishvili S, et al. Age-related changes of sex hormones-level among males in populations with high index of longevity. Georgian Med News. 2009; 168 : 2–84.
30. Giordano R, et al. Growth hormone treatment in human ageing: benefits and risks. Hormones (Athens, Greece) 2008; 7 : 133–139.
31. Wu YH, Swaab DF. The human pineal gland and melatonin in aging and Alzheimer‘s disease. J Pineal Res. 2005; 38 : 145–152.
32. Anisimov VN. Pineal gland, biorhythms and aging of an organism Usp Fiziol Nauk 2008; 39 : 40–65 (v ruštině).
33. Russo De Boland A. Age-related changes in the response of intestinal cells to parathyroid hormone. Mechanisms of Ageing and Development 2004; 125 : 877–888.
34. Hashizume K, et al. Endocrinological aspects of aging: Adaptation to and acceleration of aging by the endocrine systém. Geriatrics & Gerontology International 2006; 6 : 1–6.
35. Hashizume K. Silent endocrinological deviation in elderly: Loss and excess of endocrinological adaptation to ageing. Japanese Journal of Geriatrics 2008; 45 : 482–484.
36. Tatar M, Bartke A, Antebi, A. The endocrine regulation of aging by insulin-like signals Science, 2003; 299 : 1346–1351.
37. Bonkowski MS, et al. Disruption of growth hormone receptor prevents calorie restriction from improving insulin action and longevity. 2009; 4(2): e4567.
38. Zuk M. The sicker sex. Plos Pathos 2009; 5(1): e1000267.
39. ViĖa J, et al. Why females live longer than mkales ? importace of the upregulation of longevity-associated genes by oestrogenic compounds. FEBS Letters 2005; 579 : 2541–2545.
40. ViĖa J, et al. Modulation of longevity-associated genes by estrogenes or phytoestrogenes. Biol Chem 2008; 389 : 273–277.
41. Nakanuta E, Miyao K. Sex differences in human biological ageing. J Gerontology – Series A: Bioological Science and Medical Science 2008; 63 : 936–944.
42. Biecek P, Cebrat S.Why y chromosome is shorter and women live longer? European Physical Journal B 2008; 65 : 149–153.
43. Kaszubowska L.Telomere shortening and ageing of the immune system. J Physiol Pharmacol 2008; 59 (Suppl 9): 169–186.
44. Bauer ME, Jackel CM, Luz C. The role of stress factors dutiny ageing of the immune systém. Ann NY Acad Sci 2009; 1153 : 139–152.
45. Lustig A, et al. Transcriptome analysis of murine thymocytes reveals age-associated chnakges in thymic gene expression. Int J Med Sci 2009; 6 : 51–64
46. Agrawal A, et al. Increased reactivity of dendritic cells from aged subjects to self-antigen, the human DNA. J Immunol 2009; 182 : 1138–1145.
47. Larbi A, Fülöp T, Pawelec G. Immune receptor signaling, aging and autoimmunity. Adv Exp Med Biol 2008; 640 : 312–324.
48. Hattori N. Expression, regulation and biological actions of growth hormone (GH) and ghrelin in the immune system. Growth Hormone and IGF Research 2009; 19; 187–197.
49. Dorshkind K, Montecino-Rodriguez E, Signer RAJ. The ageing immune system: Is it ever too old to become young again? Nature Reviews Immunology 2009; 9 : 57–62.
50. Ang LS, et al. Apolipoprotein E, an important player in longevity and age-related diseases. Experimental Gerontology 2008; 43 : 615–622.
51. Corbo RM, et al. Study on a possible effect of four longevity candidate genes (ACE, PON1, PPAR- and APOE) on human fertility. Biogerontology 2008; 9 : 317–323.
52. Rosvall L, et al. APOE-related mortality: Effect of dementia, cardiovascular disease and gender Neurobiology of Aging 2008; PMID 18237822.
53. Tan Q, Kruse TA, Christensen K. Design and analysis in genetic studies of human ageing and longevity. Ageing Res Rev 2006; 5 : 371–387.
54. Baranov VS, Baranova EV. Genetic aspects of ageing. Adv Gerontol 2007; 20 : 26–34(v ruštině).
55. Glotov OS, Baranov VS. Genetic polymorphism and ageing. Adv Gerontol 2007; 20 : 35-55 (v ruštině).
56. Passtoors WM, et al. Genomic studies in ageing research:the need to integrate genetic and gene expression approaches. J Intern Med 2008; 263 : 153–166.
57. Curran SP, Ruvkun G. Lifespan regulation by evolutionarily conserved genes essential for viability. PlosGenet 2007; 3(4): e56.
58. Fallin MD, Matteini A. Genetic epidemiology in ageing research. J Gerontology A Biol Sci Med Sci 2009; 64 : 47–60.
59. Alpert JS. 12 Guides to heath, Happiness, and Longevity (with apologies to P. J. O’Rourke) Am J Med 2008; 121 : 551–552.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Využití individuálních genomických znalostí
- Sekvenování lidského genomu – technologie nové generace aneb budeme rutinně sekvenovat lidské genomy?
- Kniha
- Přehled poranění pohybového aparátu pacientů ošetřených v zimních měsících v horské nemocnici
- SCAI funguje jako potlačovač invaze nádorových buněk
- Rysy metabolického syndromu u nemocných s depresivní poruchou
- Srovnání sérových hladin vybraných biologických působků u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Oboustranný spontánní pneumotorax – chybný léčebný postup
- Studium hojení ran začíná u mezibuněčných spojů
- Glykoprotein jako transportér léků u melanomu
- Kurativní efekt karotické endarterektomie
- Nečitelný otisk prstů po cytostatiku xeloda (capecitabinum)
- O lidském stárnutí a dlouhověkosti – 2. vnitřní podmínky
- Návykové nemoci a peníze – důležité souvislosti
- Český model pro snížení mateřské úmrtnosti v Ugandě
- Doporučení k antimikrobiální léčbě u nemocných s alergií na betalaktamová antibiotika
- Eozinofily v gastrointestinálním traktu
- Mastocyty a eozinofily: dvě klíčové efektorové buňky v alergickém zánětu
- Věda a Výroční ceny Nadace český literární fond za rok 2008
- ŽIVOTNÍ JUBILEUM DOC. MUDr. DAGMARLINCOVÉ, CSc
- Docent Petr Bartůněk – 70 let
- Joshua Lederberg
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Oboustranný spontánní pneumotorax – chybný léčebný postup
- Sekvenování lidského genomu – technologie nové generace aneb budeme rutinně sekvenovat lidské genomy?
- Eozinofily v gastrointestinálním traktu
- O lidském stárnutí a dlouhověkosti – 2. vnitřní podmínky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




